Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Кишечная метаплазия слизистой оболочки желудка в практике
гастроэнтеролога: современный взгляд на проблему
И.В. Маев, О.В. Зайратьянц, Ю.А. Кучерявый.
Московский государственный медико-стоматологический университет, кафедра
пропедевтики внутренних болезней и гастроэнтерологии, кафедра патологической
анатомии.
Представления о кишечной метаплазии слизистой оболочки желудка, ее типах,
прогнозе длительного персистирования и риске развития неопластических изменений
до сих пор в среде практикующих врачей остаются неопределенными, а нередко
бывают ошибочными. В работе речь идет о нарушениях клеточного обновления,
показана взаимосвязь хронического гастрита, ассоциированного с Helicobacter
pylori, с развитием и прогрессированием атрофии и кишечной метаплазии слизистой
оболочки желудка. Представлен каскад соответствующих патологических явлений,
исходом которых может быть рак желудка кишечного типа. Приведены морфологические
особенности разных типов метаплазии с указанием риска диспластических и
неопластических изменений. Рассмотрен современный взгляд на диагностику и
лечение атрофического гастрита с кишечной метаплазией, кратко изложены положения
III Маастрихтского соглашения по инфекции Н. pylori.
Ключевые слова: кишечная метаплазия, атрофия, хронический гастрит, Helicobacter
pylori, рак желудка.
В ежедневной практической работе мы часто сталкиваемся с отсутствием понимания
врачами разных специальностей термина "кишечная метаплазия". В большей мере
удивляет то, что многие специалисты, для которых знание о значимости кишечной
метаплазии в патологии желудка чрезвычайно важно (гастроэнтерологи,
абдоминальные хирурги, онкологи и даже патологоанатомы и цитологи), не имеют
представлений о разных типах кишечной метаплазии и соответственно последствиях
ее существования. Все это порождает неквалифицированные суждения, имеющие
широчайший диапазон: от "кишечная метапалазия - она, как гастрит, у всех, ничего
страшного..." до "развилась кишечная метаплазия - непременно будет рак". При
этом в первую очередь страдают больные как ввиду отсутствия онконастороженности,
так и из-за применения пациентами с "облигатным" предраком желудка крайне
извращенных форм профилактики злокачественной трансформации (уринотерапия,
экстракты и настойки потенциально опасных для жизни растений и т. д.), поскольку
аллопатическая медицина на данном этапе чаше всего "разводит руками".
С учетом того, что проблема рака желудка на сегодняшний день чрезвычайно
актуальна, а результаты огромного количества опубликованных исследований нередко
противоречивы, практикующему врачу порой нелегко разобраться в этапах
желудочного канцерогенеза, одну из ступеней которого и занимает кишечная
метаплазия. Глубокое непонимание специалистами практического звена понятий
"атрофия" и "кишечная метаплазия", незнание отдаленных последствий этих
состояний и динамики морфологических изменений в слизистой оболочки желудка на
фоне лечения по устранению инфекции Helicobacter pylori (H. pylori), побудило
нас к написанию данной статьи.
Понятие о нарушении клеточного обновления
Как известно, эпителий желудка относится к тканям, которым свойственно
непрерывное клеточное обновление: постоянство структуры эпителия обеспечивается
только при координации фаз пролиферации, дифференцировки и апоптоза (рис.1).
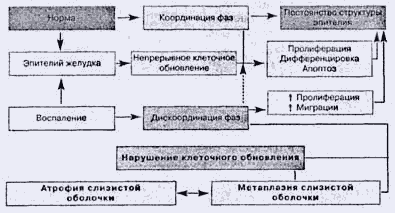
Рис. 1. Нарушения клеточного обновления
При любых повреждениях слизистой оболочки активируется пролиферация,
ускоряется миграция клеток, что ведет к восстановлению структуры и возвращению
клеточного обновления в исходное состояние. При хроническом гастрите процесс
клеточного обновления в слизистой оболочке нарушается (дисрегенерация), что
вызывает ускоренное перемещение клеток из генеративной зоны без полноценной
дифференциации в зоны расположения зрелых специализированных эпителиоцитов.
Следствием этого процесса является неспособность желудочных желез к полноценной
функции [3].
К нарушениям клеточного обновления относят кишечную метаплазию и атрофию
слизистой оболочки желудка. В настоящее время принято считать, что атрофия - это
необратимая утрата желудочных желез с замещением метаплазированным эпителием или
фиброзной тканью [61]. Однако в последние годы в научных кругах развернулась
широкая дискуссия и многие ученые стали подвергать сомнению необратимость
атрофии.
Под кишечной метаплазией в слизистой оболочке желудка принято понимать замещение
желудочного эпителия кишечным [3,7]. Исходя из вышесказанного становится понятна
взаимосвязь между атрофией и кишечной метаплазией в слизистой оболочке желудка.
При этом кишечную метаплазию и атрофию желудочного эпителия можно рассматривать
в качестве стадий эволюции хронического гастрита, поэтому представляется важным
установление связи с наиболее частым возбудителем гастрита - Н. pylori.
Хронический гастрит и Helicobacter pylori
Геликобактериоз является так называемой "медленной инфекцией", что обусловлено
длительным, практически пожизненным, персистированием возбудителя в организме
человека, его способностью взаимодействовать с иммунной системой и
адаптироваться к ее изменениям. Несмотря на многообразие клинических форм
геликобактериоза во всех случаях имеет место общий механизм - воспаление
слизистой оболочки, развивающееся вслед за адгезией микроорганизма на желудочном
эпителии. Морфологически такое воспаление характеризуется инфильтрацией
собственной пластинки слизистой нейтрофильными лейкоцитами, лимфоцитами,
макрофагами, плазматическими клетками, формированием лимфоидных фолликулов и
повреждением эпителия различной степени выраженности.
Нейтрофильная инфильтрация эпителия и собственной пластинки слизистой оболочки
индуцируется посредством реализации двух различных механизмов - непосредственно
Н. pylori (за счет выделения растворимого белка, активирующего нейтрофилы) и
опосредованно через экспрессию эпителиоцитами интерлейкина-8 (IL-8) с
последующим запуском всего провоспалительного каскада. Белок, активирующий
нейтрофилы, имеется у всех известных штаммов Н. pylori, что объясняет наличие
нейтрофильной инфильтрации у 100% инфицированных. При этом вариабельность
степени воспалительной инфильтрации, по всей видимости, вызвана различиями в
степени адгезии и обсемененности Н. pylori, где на первый план может выступать
iL-8-обусловленный механизм. Феномен хемотаксиса нейтрофилов после активации
IL-8 цитокинового сигнального каскада более выражен у CagA-, VacA-позитивных
штаммов, при этом выраженность воспалительной инфильтрации коррелирует со
степенью обсеменения.
Одним из эффектов нейтрофильной инфильтрации является увеличение проницаемости
эпителия для антигенов Н. pylori, вызывающих миграцию в собственную пластинку
лимфоцитов, плазматических клеток и макрофагов. Важная особенность состоит в
отсутствии эрадикации Н. pylori под воздействием антигеликобактерных антител,
что, вероятно, объясняется "недоступностью" бактерии для антител в слое
желудочной слизи, невозможностью выделения IgG в просвет желудка при
относительном дефиците секреторных IgA, а также "антигенной мимикрией" Н. pylori.
Таким образом, неэффективный гуморальный иммунный ответ на Н. pylori и его
антигены вместо элиминации возбудителя становится одним из факторов патогенеза,
формируя различные клинические варианты геликобактериоза. В результате
прогрессирования воспаления закономерно возникают повреждения эпителия
посредством индукции алоитоза или развития некрозов слизистой оболочки,
опосредованных активными формами кислорода и оксидом азота нейтрофилов. Следует
подчеркнуть, что для геликобактерного гастрита апоптоз является более
характерной формой гибели клеток, чем некроз.
Хронический геликобактерный гастрит развивается более чем у 70% инфицированных
Н. pylori уже в детском и подростковом возрасте; у взрослых инфицирование
наступает значительно реже - около 2% в год [6]. Подтверждение трех постулатов
Р. Коха, а также несомненная эффективность антигеликобактерной терапии у больных
хроническим гастритом свидетельствует об этиологической роли данного
микроорганизма в развитии большинства форм этого заболевания.
Н. pylori вызывает индукцию апоптоза клеток желудочного эпителия, что в
последующем приводит к компенсаторному усилению пролиферативной активности в
герминативных зонах слизистой оболочки [63]. Причем пролиферация стимулируется
главным образом CagA-позитивными штаммами, а ее темпы коррелируют с
выраженностью воспаления [48]. Это и объясняет высокую частоту нарушений
клеточного обновления - атрофии и кишечной метаплазии при геликобактерном
гастрите (рис.2). По данным Л.И. Аруина и соавт. [3], ассоциация кишечной
метаплазии и Н. pylori выявляется с частотой до 50%, атрофии Н. pylori - более
чем в 80%, атрофии и кишечной метаплазии - до 100% случаев. Таким образом, в
последние годы принято считать, что кишечная метаплазия - один из признаков
геликобактерного гастрита. Этот тезис базируется на ряде фактов - при
геликобактерном гастрите регистрируется высокая частота выявления кишечной
метаплазии [32], установлена корреляционная взаимосвязь между степенью
геликобактерного гастрита и выраженностью кишечной метаплазии [29], обратимость
кишечной метаплазии возможна после успешной эрадикационной терапии [39].
Хронический гастрит как предраковое заболевание
При многих заболеваниях, характеризующихся хроническим воспалением (язвенный
колит, болезнь Крона, хронический вирусный гепатит, хронический панкреатит и т.
д.) существует высокий риск развития злокачественных новообразований. Наиболее
вероятной причиной является клеточная пролиферация и/или повреждение генома,
вызванное воспалением [49].
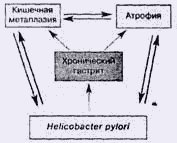
Рис. 2. Взаимосвязь кишечной метаплазии, атрофии и Н.
pylori
Как показал ряд исследований, такая взаимосвязь существует и в отношении рака
желудка, развивающегося на фоне персистирующего хронического гастрита. Начиная с
первого описания Н. pylori в слизистой оболочке желудка австралийскими учеными
J. Warren и В. Marshall [59] значение данного открытия прогрессивно
увеличивалось; в настоящее время эта инфекция признана в качестве главного
этиопатогенетического фактора развития не только хронического гастрита и
язвенной болезни, но и рака желудка.
Так как в здоровой слизистой оболочке рак практически не возникает [8], в
последние годы сформировалось представление о предраковой патологии желудка [4],
в спектре которой Н. pylori-ассоциированный хронический гастрит занимает
центральное место (табл.1).
| Предраковое состояния и заболевания
желудка |
Риск |
Величина риска, % |
Дисплазия слизистой оболочки желудка
Синдром Гарднера (семейный аденоматозный полипоз)
Аденоматозные полипы желудка
Пищевод Баррета
Синдром Линча II (наследственный неполипозный колоректальный рак)
Хронический Н. pylori-ассоциированный атрофический гастрит с кишечной
метаплазией
Резецированный желудок (по Бильрот II)
Аутоиммунный атрофический гастрит
Синдром Пейтца-Джигерса
Болезнь Менетрие
Гиперпластические полипы
Доброкачественные язвы желудка |
Абсолютный
Безусловный
Определенный
Вероятный
Возможный
|
70-90
20-70
10-20
5-10
Менее 5
|
Таблица 1. Предраковые изменения и заболевания желудка,
риск малигнизации (по Е.К. Баранской, В.Т. Ивашкину с изменениями [4])
Действительно, имеются данные, что персистенция инфекции Н. pylori
увеличивает риск развития рака желудка в 4-9 раз, особенно в случаях
инфицирования в детском возрасте [18,23,31,39]; в целом до 80% аденокарцином
желудка связаны с Н. pilori-ассоциированным хроническим атрофическим
пангастритом [4]. В 1994 г. Международное агентство по изучению рака (IARC)
классифицировало H. pylori в качестве канцерогена I класса у человека, что
свидетельствует о наличии достаточно надежных доказательств [34, 56].
Следует сказать, что вышеуказанные факты справедливы лишь в отношении
некардиального рака желудка; взаимоотношения Н. pylori и кардиальмого рака
остаются недостаточно изученными, существует даже предположение о том, что
эрадикация возбудителя способствует повышению риска развития рака данной
локализации [8]. Патогенез диффузного рака желудка, видимо, также не связан с
инфицированием Н. pylori, поскольку недавно была расшифрована генетическая
основа этого заболевания (мутация гена Е-кадхерина - CDH1 хромосомы 16q22.1)
[10]. Поэтому классификация рака желудка P. Lauren (1965 г.), включающая 3
различных варианта опухоли - карцинома кишечного типа (дистальный рак), рак
диффузного типа и неклассифицируемый рак, не потеряла своего значения и в
настоящее время. В первую очередь, это обусловлено развитием подавляющего
большинства случаев рака кишечного типа именно у Н. рудщкн-позитивных больных.
![Каскад желудочного канцерогенеза (по Р. Соrrеа, 1988, 1990) [21,25]. 1 - 3 - ступени, ведущие к раку желудка](images/art/all8/4.htm4.gif)
Рис. 3. Каскад желудочного канцерогенеза (по Р. Соrrеа,
1988, 1990) [21,25]. 1 - 3 - ступени, ведущие к раку желудка
Взаимосвязь хронического гастрита и рака желудка была доказана рядом научных
исследований как за рубежом, так и в России в 50-70-х годах прошлого века, т.е.
до открытия Н. pylori. Еще в тот период было отмечено, что необходимыми
условиями для возникновения рака являются нарушения клеточного обновления -
кишечная метаплазия и атрофия слизистой оболочки, создающие предпосылки для
дисплазии эпителия - практически облигатного предракового состояния [10]. Таким
образом, Н. pylori, хронический гастрит, кишечная метаплазия, атрофия и рак
желудка - звенья одной цепи, в которой инициирующую роль играет микроорганизм; в
ответ на инвазию у человека развивается хронический воспалительный процесс в
слизистой оболочке, сопровождающийся дисрегенеторными изменениями эпителия,
создающими, в свою очередь, фон для развития рака желудка кишечного типа.
Данный каскад патологических явлений в качестве модели развития рака желудка
предложил в 1988 г. Р. Соrrеа [21], однако в то время в этой модели не нашлось
места для H. pylori. Только двумя годами позже автор ввел H. pylori а качестве
этиологической причины гастрита [23,25] и соответственно рака желудка. Указанная
последовательность патологических явлений в последние годы стала широко известна
и получила название парадигмы желудочного канцерогенеза (рис.3). Молекулярных
изменений, которые возникают при инфекции H. pylori и способны привести к
развитию рака желудка, не установлено. Действительно, сведений, достоверно
подтверждающих синтез или секрецию Н. pylori мутагенных или канцерогенных
субстанций нет. Имеются отдельные экспериментальные исследования, показывающие
способность Н. pylori стимулировать in vitro рост культуры, опухолевых клеток
[17], не имеющих к раку желудка никакого отношения. Поэтому современные
представления состоят в том, что Н. pylori скорее действует в качестве
промотора, чем инициатора желудочного канцерогенеза. При инфицировании Н. pylori
возникает воспалительная реакция в слизистой оболочке желудка, наблюдается
продукция нейтрофильными лейкоцитами реактивных кислородных метаболитов и
происходит высвобождение цитокинов клетками воспалительного инфильтрата, что
приводит к повреждению ДНК и стимуляции рецепторов, вызывающих пролиферацию
клеток.
Развитие дистального рака желудка по времени может занять несколько десятилетий,
в течение которых у большинства пациентов последовательно сменят друг друга
указанные нами стадии желудочного канцерогенеза, включающие заражение Н. pylori,
развитие хронического активного гастрита, возникновение атрофии слизистой и
кишечной метаплазии, дисплазии эпителия с последующей трансформацией в рак
[21,35,50].
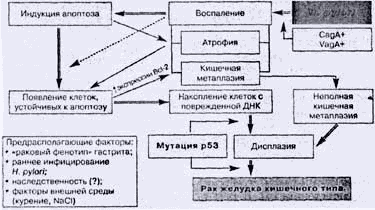
Рис. 4. Патогенез дистального рака желудка. Инициирующая
роль Н. pylori, взаимосвязь с генетическими изменениями и нарушениями клеточного
обновления
Риск развития рака значительно повышается при сочетании предраковых состояний
с предраковыми изменениями слизистой оболочки - в 26 и 132 раза при умеренной и
тяжелой дисплазии желудочного эпителия соответственно [8].
Однако приведенные выше факты не отвечают на ряд важнейших вопросов: почему Н.
pylori вызывает и другие заболевания (язвенную болезнь двенадцатиперстной кишки,
MALT-лимфому), крайне редко сочетающиеся с раком желудка [12-14,19,28,46,57],
почему только у небольшого числа больных (1-2%) с H. pilory-ассоциированным
гастритом развивается дистальный рак желудка [1,2], а также почему кишечная
метаплазия (дифференцированный эпителий, не способный к делению) является фоном
для возникновения рака желудка.
Динамическое наблюдение за больными, инфицированными Н. pylori, позволило
выделить две формы хронического гастрита - хронический поверхностный и
хронический атрофический, являющиеся, по сути, последовательными этапами
развития хронического геликобактерного гастрита. С другой стороны, большинством
специалистов, занимающихся вопросами геликобактерноза, выделяются два фенотипа
геликобактерного гастрита - классический антральный и фундальный (мультифокальный).
Именно топографические особенности гастрита, а не выраженность воспаления
определяют клинические последствия инфицирования Н. pylori [2]. Установлено,
например, что у 1% больных антральным хроническим гастритом ежегодно возникают
дуоденальные язвы, но у них не развивается рак желудка; при фундальном и
мультифокальным гастритах у 1% пациентов ежегодно развивается рак желудка и
практически не встречаются дуоденальные язвы ("язвенный" и "раковый" фенотипы
хронического гастрита по P. Sipponen). Возможное объясненне этому кроется в том,
что фенотип Н. pylori-accoцииpoванного гастрита влияет на секрецию соляной
кислоты. Если ее уровень низкий, Н. pylori может колонизировать любой отдел
желудка, при сохранной (повышенной) кислотности единственным местом, где может
выжить микроорганизм, является антральный отдел, для которого характерны более
высокие значения рН. В этом случае ведущую роль в развитии конкретного фенотипа
будет играть возраст, в котором произошло заражение, поскольку для детей более
характерно состояние гипоацидности, а для взрослых - нормацидности [12].
Вместе с тем антральный H. pylori-ассоциированный гастрит не предрасполагает к
развитию кишечной метаплазии, а соответственно к дисплазии и раку желудка.
Поверхностный гастрит с фундальной или мультифокальный локализацией приводит к
потере желудочных желез с замещением их фиброзной тканью или (что более типично)
метаплазированным эпителием. Именно этот вариант гастрита создаст фон для
карциномы кишечного типа [10].
В соответствии с изложенным неопластическая трансформация представляет собой
многоступенчатый процесс, ассоциированный с прогрессирующим накоплением
повреждений в генах-репарантах ДНК, супрессорах опухолей, онкогенах, факторах
роста, рецепторах клеточной поверхности, молекулах клеточной адгезии.
Генетическая нестабильность, инактивация генов-онкосупрессоров, гиперэкспрессия
теломеразы предрасполагают к раннему канцерогенезу, в то время как активация
онкогенов, экспрессия факторов роста, цитокинов и ангиогенных факторов - к
поздней опухолевой прогрессии и инвазии [8]. Необходимо отметить, что именно
Cag-A-позитивные штаммы Н. pylori инициируют более высокий уровень пролиферации
эпителноцито. При этом уровень апоптоза не соответствует ускоренной
пролиферативной активности эпителия, возникает дисбаланс между гибелью клеток и
их размножением, что увеличивает возможность "выживания" мутаций, имеющих
канцерогенный потенциал. Отчасти это объясняется более активной экспрессией IL-8
Cag-А-позитивными штаммами Н. pylori, а следовательно, и более выраженным
воспалением [10] (рис.4).
Целесообразно сказать об особенностях макроорганизма, определяющих риск развития
дистального рака желудка, в частности о полимофизме генов цитокинов. Как мы
отмечали ранее, экспрессия эпителиальными клетками IL-8 запускает цитокиновый
провоспалительный каскад. Мобилизованные моноциты и нейтрофилы экспрессируют, в
свою очередь, IL-1?, являющийся одним из мощнейших ингибиторов
кислотообразования. Таким образом, IL-1? потенцирует воспалительные изменения в
слизистой оболочке и вызывает достаточно выраженную гипохлоргидрию, облегчающую
колонизацию Н. pylori в желудке. После открытия полиморфизма генов цитокинов
стало ясно: чем сильнее будут выражены провоспалительные и антисекреторные
свойства IL-1?, тем больше вероятность развития фундального гастрита, атрофии,
кишечной метаплазии и дистального рака желудка. В обратной степени это относится
и к полиморфизму антагониста IL-1, однако и в том, и в другом случае без участия
Н. pylori полиморфизм генов цитокинов в плане развития рака не имеет никакого
значения.
В последнее время стало известно, что в развитии рака желудка могут играть роль
и другие генетические факторы, определяющие выраженность воспалительной реакции
(HLA, полиморфизм гена фактора некроза опухоли и IL-10) [15,41,62], а также
факторы внешней среды - избыточное употребление соли, дефицит в рационе свежих
фруктов и овощей, курение [2].
Типы кишечной метаплазии и риск развития рака желудка
Как следует из вышеизложенного, интерес к кишечной метаплазии обусловлен прежде
всего ее связью с раком желудка кишечного типа. Однако широко известно
существование разных типов и подтипов (вариантов) кишечной метаплазии в
слизистой оболочке желудка и только в отношении толстокишечного варианта
неполной кишечной метаплазии имеется взаимосвязь с раком желудка.
Метаплазия с наличием клеточных элементов тонкой или толстой кишки расценивается
соответственно как тонко- и толстокишечная (рис.5). Раньше тонкокишечную
метаплазию отождествляли с полной метаплазией (метаплазия эпителия с наличием
всех клеток, свойственных тонкой кишке), а толстокишечную - с неполной. В
последние годы появились обоснованные, на наш взгляд, суждения о том, что
тождество понятий "тонкокишечная - полная" и "толстокишечиая - неполная" не
является состоятельным [7]. Это объясняется тем, что даже при полной метаплазии
не обнаруживается весь спектр клеток, характерных для тонкой кишки, а также
нередкой встречаемостью смешанного типа кишечной метаплазии [3,44] (см.рис.5).
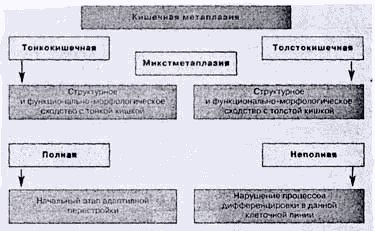
Рис. 5. Типы кишечной метаплазии
С позиций современного понимания процесса метаплазии как адаптивной
перестройки на иной клеточный фенотип - более приспособленный к изменившимся
условиям окружения, полную метаплазию можно рассматривать в качестве начального
этапа такой перестройки, а неполную - как нарушение процессов дифференцировки в
данной клеточной линии. Таким образом, понятия полная и неполная метаплазия
характеризуют полноту воспроизведения кишечного фенотипа клеток, а термины
тонко- и толстокишечная - отражают специализацию [7].
Главным диагностическим признаком кишечной метаплазии является наличие
бокаловидных клеток, встречающихся при всех подтипах кишечной метаплазии, в то
время как тип муцинов диагностического значения не имеет (табл.2). Для выявления
подтипов кишечной метаплазии имеет значение присутствие цилиндрических клеток с
различными вариантами образования муцинов. При полной кишечной метаплазии муцины
не обнаруживаются, типичным же является наличие выраженной щеточной каймы. Таким
образом, наиболее часто используемым практическим подходом к классификации
является разделение кишечной метаплазии по характеру гистохимической детекции
муцинов в цилиндрических клетках на 3 группы:
I - полная (цилиндрический клетки муцинов не содержат, выявляются щеточная
каемка и клетки Панета);
II - неполная (цилиндрические клетки содержат кислые сиаломуцины);
III - неполная толстокишечная (цилиндрические клетки содержат сульфомуцины).
| Признаки |
Кишечная метаплазия |
| Полный тип (I) |
Неполный тип (II, III) |
| тонкокишечная (IA) |
толстокишечная (IB) |
тонкокишечная (IIB) |
толстокишечная (III) |
| Бокаловидные клетки
Тип муцинов
Цилиндрические клетки
Тип муцинов
Адсорбирующие клетки
Каемчатые клетки
Клетки Панета |
+
Сиаломуцины
-
-
+
+
+ |
+
Сульфомуцины
-
-
+
-
- |
+
Сиаломуцины
+
Сиаломуцины
-
-
- |
+
Оба типа
+
Сульфомуцины
-
-
- |
Таблица 2. Основные отличия между подтипами кишечной
метаплазии
При неполной метаплазии выявляются полиморфизм ядер, увеличение
ядерно-цитоплазматических соотношений; поверхностные отделы желез практически не
отличаются от глубоких, что говорит о нарушении созревания и аберрантной
дифференциации. Все эти картины показывают сходство неполной кишечной метаплазии
с дисплазией.
Полная кишечная метаплазия не имеет морфологических сходств с дисплазией,
отчасти поэтому данный тип не относят к предраковым изменениям. Кроме того,
тонкокишечный эпителий, образующий участки метаплазии, вообще мало склонен к
малигнизацни. Так, широко известным фактом является большая редкость рака тонкой
кишки. О предраковом характере неполной кишечной метаплазии свидетельствует
наличие в ней лактоферрина, который играет важную роль в обмене железа. Как
известно, железо необходимо для синтеза ДНК и соответственно в повышенном
количестве требуется для репликации опухолевых клеток. Регуляция пролиферации и
апоптоза в эпителиоцитах при неполной кишечной метаплазии сильно нарушена, в
некоторых из них выявляется мутация гена р53, что позволяет данным клеткам
подвергнуться дальнейшему перерождению под влиянием различных мутагенов, вплоть
до злокачественного, поскольку они защищены от апоптоза. Все эти явления не
отмечаются при полной метаплазии, что позволяет утверждать - полная кишечная
метаплазия не может быть предраком биологически [3].
Выявление неполной кишечной метаплазии показало высокую специфичность этого
признака (98%) для рака желудка, однако чувствительность оказалась достаточно
низкой - всего 38% [52], что свидетельствует об, ограниченном значении неполной
кишечной метаплазии как показателя прогноза развития рака кишечного типа.
Высказывается мнение, что маркером повышенного риска возникновения последнего
является не столько тип кишечной метаплазии, сколько площадь замещения
желудочного эпителия [55]. Доказательная база для подобных высказываний
опирается на возможность абсорбации и депонирования очагами полной кишечной
метаплазии ряда потенциальных канцерогенов в желудке [3]. Поэтому важнейшими
факторами, способствующими развитию рака у больных с наличием кишечной
метаплазии, являются неполным ее тип и большая площадь замещения желудочного
эпителия.
Возможно ли обратное развитие атрофии и кишечной метаплазии?
Поскольку мы ранее отметили определенную взаимосвязь между Н. pylori,
хроническим гастритом, атрофией и кишечной метаплазией, можно предположить, что
устранение возбудителя должно привести к редукции гастрита. Происходит ли при
этом обратное развитие дисрегенераторных изменений остается предметом оживленных
дискуссий.
При успешной эрадикации Н. pylori через несколько недель в слизистой оболочке
желудка уменьшается нейтрофильная, а спустя 1-3 года - мононуклеарная
инфильтрация эпителия [33], причем в теле желудка эти процессы протекают
значительно быстрее, чем в антральном отделе, что связывают с персистированием
воспалительного инфильтрата в собственной пластинке слизистой оболочки и
продолжающейся экспрессией цитокинов [9].
Имеются данные, что ликвидация Н. pylori способна не только предотвращать
развитие и прогрессирование атрофии эпителия [51]. При успешной эрадикации
возможно обратное развитие атрофии слизистой оболочки, однако уменьшение степени
атрофии отмечается не у всех пациентов и лишь через несколько лет после
антигеликобактериой терапии [30,33,36,39].
Обратное развитие кишечной метаплазии у Н. pylori-позитивных больных после
эрадикации инфекции продемонстрировано в ряде исследований [33,38,58], в том
числе рандомизированных [24,53]. При этом существенная роль в них отводилась как
собственно антигеликобактерному лечению, так и длительному применению
антиоксидантных витаминно-минеральных комплексов [24,58]. В крупном
рандомизированном плацебо-контролируемом исследовании, включавшем 587
инфицированных Н. pylori пациентов, было показано, что отсутствие эрадикации
инфекции, особенно у мужчин старше 45 лет и лиц, злоупотребляющих алкоголем,
служило фактором, способствовавшим прогрессированию кишечной метаплазии. В то же
время успешная эрадикация снижала темпы прогрессирования кишечной метаплазии, но
не приводила к ее обратному развитию [40].
Диагностика и лечение
Как видно на рис. 6, стандартом диагностики кишечной метаплазии является
гистологическое исследование. В качестве скрининг-теста и для определения объема
поражения желудка целесообразно использовать хромоэндоскопию. При комбинации
данных методов точность диагностики значительно повышается. Высокая частота
ассоциации с инфекцией Н. pylori определяет необходимость выявления этого
микроорганизма у больных с кишечной метаплазией.
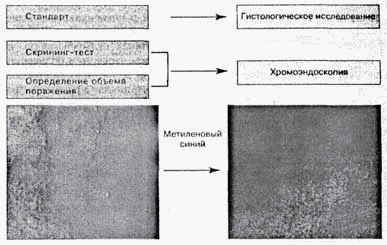
Рис. 6. Диагностика кишечной метаплазии
В соответствии с изложенным основным лечебным подходом при кишечной
метаплазии, ассоциированной с Н. pylori, является эрадикационная терапия. До
настоящего времени в России действуют рекомендации Российской
гастроэнтерологической ассоциации по диагностике и лечению инфекции Н. pylori,
разработанные на основе II Маастрихтского соглашения [42]. Диагностические
критерии широко известны и включают применение одного из доступных методов (за
исключением цитологического ввиду его низкой чувствительности) - предпочтительны
неинвазивные методы, (уреазный дыхательный тест, полимеразная цепная реакция,
иммуноферментный). Лечение начинают со схемы первой линии: ингибитор протонной
помпы (ИПП) в двойной дозе, амоксициллин 2000 мг/сут и кларитромицин 1000 мг/сут
в течение 7 дней. При ее неэффективности (отсутствие эрадикации Н. pylori через
4-6 нед после полной отмены антибиотиков и антисекреторпых препаратов) назначают
терапию второй линии: висмута трикалия дицитрат 480 мг/сут, тетрациклин 2000 мг/сут,
метронидазол 1000 мг/сут и ИПП в двойной дозе в течение 7 дней.
17-18 марта 2005 г. во Флоренции ведущими мировыми экспертами обсуждался проект
III Маастрихтского соглашения по диагностике и лечению инфекции Н. pylori.
Предпочтительными методами для скрининговой диагностики были признаны
малонивазивные тесты - иммуноферментный анализ в кале и слюне. Терапия первой
линии не претерпела существенных изменений, однако было определено, что
кларитромицин и метронидазол могут быть назначены только с учетом данных о
чувствительности инфекции к этим антибиотикам в конкретном регионе (резистентность
не более 10 и 40 соответственно). При наличии высокой устойчивости Н. pylori к
указанным антибиотикам сразу приступают к терапии второй линии, состав которой
остался прежним за исключением увеличения дозы метронидазола до 1500 мг/сут. В
схемы второй линии введена также тройная терапия, включающая ИПП в стандартной
дозе, амоксициллин 2000 мг/сут в комбинации с тетрациклином (2000 мг/сут) или
фуразолидоном (400 мг/сут). Сроки лечения рекомендовано пролонгировать до 14
дней. Контроль эрадикации целесообразно осуществлять при помощи уреазного
дыхательного теста, а в случае ограниченной его доступности - с применением
иммуноферментного анализа Н. pylori в кале. В скором времени можно ожидать, что
рекомендации по диагностике и лечению инфекции Н. pylori, действующие на
сегодняшний день в России, будут в некотором степени пересмотрены, в
соответствии с положениями III Маастрихтского соглашения.
Как следует из приведенных выше данных, схемы эрадикационной терапии являются
стандартными в отношении как комбинации и суточных доз антибактериальных
препаратов, так и двукратного применения ИПП. Однако в рекомендациях не отдается
предпочтение какому-либо конкретному препарату из имеющихся на фармакологическом
рынке, по всей видимости, этот выбор предоставляется практикующему врачу.
Необходимо отметить ряд важнейших моментов, определяющих эффективность лечения.
Так, применение ИПП повышает рН в желудке и предотвращает разрушение ряда
антителнкобактерных антибиотиков, снижает вязкость желудочной слизи, замедляет
эвакуацию пищи из желудка, в ряде случаев способствует эрадикапии Н. pylori
(даже при монотерапии). Хотя все препараты в конечном итоге обеспечивают полное
ингибирование протонной помпы, время, в течение которого оно достигается,
различно. Максимально быстро развивается эффект рабепразола (полное
ингибированне происходит через 10 мин), Медленнее и примерно с одинаковой
скоростью действуют лансопразол и омепразол (полное ингибирование через 20 мин).
Дольше всего развивается аффект пантопразола: даже через 30 мин транспорт
ингибируется лишь на 50%.
Таким образом, лимитирующей стадией в ингибировании является, вероятно, скорость
активации замещенных сульфенамидов, которая тем выше, чем больше значение рК для
атома азота пиримидинового цикла. Кроме того, различия в структуре замещенных
бензимидазалов приводят к тому, что ингибирование протонного насоса наблюдается
при различных концентрациях ингибитором. Так, полумаксимальный эффект у
омепразола обнаруживается при его концентрации 0,5 мкМ, тогда как у рабепразола
- при 0,07 мкМ [43]. По видимому, это также обусловлено различиями в скорости
активации ингибитора.
Наибольшая скорость наступления антисекреторного действия рабепразола в
сравнении с другими ИПП отмечена в многочисленных клинических исследованиях
[16,45,47,60]. По данным К. Baisley и соавт., одинаковая часть времени суток с
внутрижелудочным рН>4 достигается применением минимальной дозы рабепразола (10
мг/сут) и стандартной дозы эзомепразола (20 мг/сут) как в первые, так и на пятые
сутки приема препаратов [16]. При сравнении влияния на снижение желудочной
секреции рабепразола и эзомепразола в дозе 20 мг/сут, как наиболее эффективных в
настоящее время препаратов, было выявлено статистически достоверное отличие,
заключавшееся в более высокой эффективности рабепразола как на первый (38,5
против 19,4%), так и на пятый день применения (52,8 против 42,5%) [60]. В
результате становится понятным, почему при приеме рабепразола отмечается
максимально быстрая редукция клинической симптоматики в сравнении с другими ИПП
при лечении кислотозависимых заболеваний [11,27].
Рабепразол несколько иначе, чем другие ИПП, метаболизируется в организме. Как
омепразол и эзомепразол, он элиминируется главным образом путем окисления в
печени представителями двух изоформ цитохрома Р-450: CYP2C19 и CYP3A4. Но для
рабепразола характерно также неферментативное окисление, что снижает долю
лекарства, метаболизирующегося через названные изоформы цитохрома Р-450 [54]. В
связи с этим по сравнению с омепразолом и лансопраэолом уменьшается риск
взаимодействия рабепразола с лекарственными препаратами, метаболизируемыми
главным образом через CYP2C19, например с варфарином, диклофенаком, фенитоином и
толбутамилом. Совокупный анализ 63 контролируемых исследований, проведенных в
Японии, Северной Америке и Европе и посвященных клинической эффективности
рабепразола, показал его хорошую переносимость [37]. При различных суточных
дозах (10, 20 и 40 мг/сут) установлена сопоставимость частоты побочных эффектов
при приеме плацебо и рабепразола [20].
Список литературы
1. Аруин Л.И. Helicobacter pylori: каким образом один возбудитель вызывает
разные болезни // Эксперим. и клин. гастроэнтерол. - 2004. - № 1. - C. 36-41.
2. Аруин Л.И. Из 100 инфицированных Helicobacter pylori рак желудка возникает у
двоих. Кто они? // Эксперим. и клин. гастроэнтерол. - 2004. - № 1 (внеочередной
вып.). - С. 12-18.
3. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней
желудка и кишечника. - М.: Триада-Х. 1998. - С. 80-85, 272.
4. Баранская Е.К., Ивашкин В.Т. Клинический спектр предраковой патологии желудка
// Рос. журн. гастроэнтерол., гепатол., колопроктол. -2002. - Т. 12, № 3. - C.
7-14.
5. Денисов Л.Е., Минушкин О.Н., Бурдина Е.Г. и др. Формирование групп риска по
раку желудка // Кремлевская мед. - 1999. - № 1. - С. 13-17.
6. Исаков В.А., Дамарадский И.В. Хеликобактериоз. - М: Медирактика-М. 2003. -
412 с.
7. Мозговой С.И., Яковлева Э.В., Лининг Д.А., Кононов А.В. Кишечная метаплазия
слизистой оболочки желудка: классификация, методика детекции и сложности
гистопатологической интерпретации с позиции современной практической гистохимии
// Эксперим. и клин. гастроэнтерол. - 2004. - № 1 (внеочередной вып.). - С.
114-125.
8. Пасечников В.Д., Чуков С.З. Ранний рак верхних отделов пищеварительного
тракта // Consilium medicum. - 2002. - Прил. "Диспепсия". - С. 13-18.
9. Потрохова В.А., Кононов А.В. Эволюция воспаления слизистой оболочки желудка у
детей с Н. pylori-ассоциированным гастритом в условиях эрадицации инфекта //
Эксперим. и клин. гастроэнтерол. - 2004. - № 1 (внеочередной вып.). - С.
153-159.
10. Склянская О.Л., Лапина Т.Л. Атрофический гастрит, вызванный Helicobacter
pylori, как предраковое заболевания // Арх. патол. - 2004. - № б. - С. 57-60.
11. Adachi К., Hashimoto Т., Hanimnoto N. et al. Symptom relief in patients with
reflux esophagitis: comparative study of omeprazole, lansoprazole, and
rabeprazole // J.Gastroenterol. Hepatol. - 2003. - Vol. 18, К 12. - P.
1392-1398.
12. Alsolaiman M.M., Bakis G., Nazeer T. et. al. Five years of complete
feraission of gastric diffuse large В cell lymphoma after eradication of
Helicobacter pylori infection // Gut. - 2003. - Vol. 52. - P. 507-509.
13. Annibale В., Di Giulio E., Caruana P. et al. The long-term effects of cure
of Helicobacter pylori infection on patients with atrophic body gastritis //
Aliment. Pharmacol. Ther. - 2002. - Vol. 16. - P. 1723-1731.
14. Asaka M., Kato M., Kudo M. et al. Relationship between Helicobacter pylori
infection, atrophic gastritis and gastric carcinoma in a Japanese population //
Eur. J. Gastroentrol. Hepatol. - 1995. - Vol. 7 (suppl.). - P. 7-10.
15. Аzuma Т., Ito S., Sato F. et al. The role of the HLA-DQA1 gene in resistance
to atrophic gastritis and gastric adenocarcinoma, induced by Helicobacter pylori
infection // Cancer. - 1998. - Vol. 82. - P. 1013-1018.
16. Baisley K., Tejura В., Morocutti A. et al. Rabiprazole 10 mg is equivalent
to esomeprazole 20 mg in control of gastric pH in healthy volunteers // Am. J.
Gastroenterol. - 2001, - Vol. 96 (suppl.). - P. 148.
17. Bode C. Vergani G. Helicobacter pylori stimulates, proliferation of Morris
hepatoma (MH 1 Cl 7795) cells // Acta Gastroenterol. Belg. - 1993. - Vol. 56. -
P. 69.
18. Camargo M.C. Yepez M.C., Ceron С. et al. Age at acquisition of Helicobacter
pylori infection: Comparison of two areas with contrasting risk of gastric
cancer // Helicobacter. - 2004. - Vol. 9. - P. 262-270.
19. Caruso M.L., Fucci L. Histological identification of Helicobacter pylori in
early and advanced gastric cancer // J. Clio. Gastroenterol. - 1990.- Vol. 2. -
P. 601-602.
20. Cloud M.L., Enas N., Humphries T.J., Bassion S. and the Rabeprazole Study
Group. Results of three placebo-controlled dose-response clinical trails in
duodenal ulcer, gastric ulcer and gastroesophageal reflux disease // Dig. Dis.
Sci. - 1998. - Vol.43. -P. 99З-1000.
21. Correa P. A human model of gastric carcinogenesis // Cancer Res. - 1998. -
Vol. 48. - P. 3554-3560.
22. Correa P. Helicobacter pylori and gastric cancer: state of the art // Cancer
Epidemiol. Biomarkers Prew. - 1996. - Vol. 5. - P. 477-481.
23. Correa P. The biological model of gastric carcinogenesis // JARC Sci. Publ.
- 2004. - Vol. 157. - P. 301-310.
24. Correa P., Fontham E.T.H., Bravo J.С et al. Chemoprevention of gastric
dysplasia: randomised trail of antioxidant supplements and anti-Helicobacter
pylori therapy // J. Natl. Cancer Inst. - 2000. - Vol. 92. - P. 1881-1888.
25. Correa P., Haenszel W., Cuetlo C. et al. Gastric, precancerous process in a
high-risk, population: cohort follow-up // Cancer Res. - 1990. - Vol. 50. - P.
4737-4740.
26. Danesh J. Helicobacter pylori infection and gastric cancer; systematic
review of the epidemiological studies // Aliment Pharmacol. Ther. - 1999. - Vol.
13. - P. 851-856.
27. Dekkers C.P.M., Better J.A., Thiodleifsson B. et al. Comparison of
rabeprazole 20 mg vs. omeprazole 20 mg in treatment of active duodenal ulcer; a
European multicentre study // Aliment Pharmacol. Ther. - 1999. - Vol. 13. - P.
179-186.
28. Dixon M.F., Genta R.M., Yardley J.H., Correa P. Classification and grading
of gastritis. The updated Sydney system. International Workshop on the
Histopathology of gastritis, Houston 1994 // Am. J. Surg. Pathol. - 1996. - Vol.
20. - P. 1161-1181
29. Eidt S., Stolte M. Prevalence of intestinal metaplasia in Helicobacter
pylory gastritis // Scand. J. Gastroenterol. - 1991. - Vol. 29. - P. 607-610.
30. Fichman S., Niv Y. Histological changes in the gastric mucosa after
Helicobacter pylori eradication // Eur. J. Gastroenterol. Hepatol. - 2004. - Vol.
16. № 11. - P. 1183-1188.
31. Forman D. Newell D.G., Fullerton F. et al. Association between infection
with Helicobacter pylori and risk of gastric cancer: Evidence from a prospective
investigation // BMJ. - 1991, - Vol. 302. - P. 1302-1305.
32. Genla R.M. Can atrophic gastritis be diagnosed in the presence of
Helicobacter pylori, infection? // Helicobacter pylori. Basic Mechanisms to
Clinical Cure 2000 // Eds. R.H. Hunt, G.N.J. Tytgat. - Dordrecht, Boston, London:
Kluwer Academic Publishers, 2000. - P. 229-237.
33. Hojo M., Miwa H., Ohkusa T. et. al. Alteration of histological gastritis
after cure of Helicobacter pylori infection // Aliment. Pharmacol. Ther. - 2002.
- Vol. 16. - P. 1923-1932.
34. International Agency for Research on Cancer. Anonymous live flukes and
Helicobacter pylori. IARC Working Group oh the Evaluation of Carcinogenic Risks
to Humans. Lyon, France: IARC Monogr Eval Caciriog Risks Hum. 1994. - Vol. 61. -
P. 1—241.
35. Israel D.A., Peek R.M. Pathogenesis of Helicobacter pylori-induced gastric
inflammation // Aliment. Pharmacol. Ther. - 2001. - Vol. 15. - P. 1271-1290.
36. Ito M., Haruma K., Kamada T. et al. Helicobacter pylori eradication therapy
improves atrophic gastritis and intestinal metaplasia: a 5-year prospective
study of patients with atrophic gastritis // Aliment. Pharmacol. Ther. - 2002, -
Vol. 16. - P. 1449-1456.
37. Johnson D., Riff R., Perdomo C. et al. Rabeprazole: safety profile of a new
proton piimp inhibitor // Gastroenterology - 1999. - Vol. 16. - P. 209.
38. Kim N., Lim S.H., Lee K.H. et al. Long-term effects of Helicobacter pylori
eradication on intestinal metaplasia in patients with duodenal and benign
gastric ulcers // Dig. Dis. Sci. - 2000. - Vol . 45. - P. 1754-1762.
39. Kokkola A., Sipponen P., Pautelin. H. et al. The effect of Helicobacter
pylore eradication on the natural course of atrophic gastritis with dysplasia //
Aliment. Pharmacol. Ther. - 2002. - Vol. 16. - P. 515-520.
40. Leung W.K., Lin S.R., Clung J.Y. et al. Factors predicting progression of
gastric intestinal metaplasia: results of a randomised trial on Helicobacter
pylori eradication // Gut. - 2004. - Vol. 53. № 9. - P. 1244-1249.
41. Machado J.C., Figueiredo C., Canedo P. Proinflammatory genetic profile
increases the risk for chronic atrophic gastritis and gastric adenocarcinoma //
Gastroenterology. - 2003. - Vol. 125. - P. 364-371.
42. Malfertheiner P., Megmud F., 0'Morain C, et al. Current concepts in the
management of Helicobacter pylori infection - the Maastricht 2—2000 consensus
report // Aliment. Pharmacol. Ther. - 2002. - Vol. 16. - P. 167-180.
43. Morii M., Takata H., Fujisaki H., Takeguchi N. The potency of substituted
benzimidazoles such as E3810, omeprazole, Ro 18-5364 to inhibit gastric Н+,
К+-АТPase is in correlation with the rate of acid activation of the inhibitor //
Biochem. Pharmacol - 1990, - Vol. 39. - P. 661-667.
44. Niwa Т., Ikehara Y. Nakanishi H. et al. Mixed gastric- and intestinal-type
metaplasia is formed by cells with dual intestinal and gastric differentiation
// J. Histochem. Cytochem. - 2005. - Vol. 53. № 1. - P. 75-85.
45. Ohning G.V., Walsh J.H., Pisegna J.R, et al. Rabeprazole is superior to
omeprazole for the inhibition of peptone meal-stimulated gastric acid secretion
in Helicobacter pylori-negative subjects // Aliment. Pharmacol. Thcr. - 2003, -
Vol. 17. № 9. - P. 1109-1114.
46. Ozasa K., Kurata J.H., Higashi A. et al. Helicobacter pylori infection and
atrophic gastritis: A nested case-control study in a rural town in Japan // Dig.
Dis. Sch - 1999. - Vol. 44. - P. 253-256.
47. Pantoflickova D., Dorta G., Ravic M. et al. Acid inhibition on the first day
of dosing; comparison of four proton pump inhibitors // Aliment. Pharmacol. Ther.
- 2003. - Vol. 17. № 12. - P. 1507-1514.
48. Peek R.M. Jr., Moss S.F., Tham K.T. et al. Helicobacter pylori CagA+ strains
and dissociation of gastric epithelial cell proliferation from apoptosis // J.
Natl. Cancer Inst. - 1997. Vol. 89. № 42. - P. 863-868.
49. Preston-Martin S,. Pike M.C., Ross U.K. et al. Increased cell division as a
cause of human cancer // Cancer Res. - 1990. - Vol. 50. - P. 7415-7421.
50. Rozen P. Cancer of the gastrointestinal tract: Early detection or early
prevention? // Eur. J. Cancer Prev. - 2004. - Vol. 13. - P. 71-75.
51. Sakaki N., Kozswa H., Egaea N. et al. Ten-year prospective follow-up study
on the relationship between Helicobacter pylori infection and progression of
atrophic gastritis, particularly assessed by endoscopic findings // Aliment.
Pharmacol. Ther. - 2002. - Vol. 16. - P. 198-203.
52. Salva S., Filipe M. Intestinal metaplasia and its variants // Hum. Pathol. -
1986. - Vol. 17. - P. 988-995.
53. Satoh K. Does eradication of Helicobacter pylori reverse atrophic gastritis
and intestinal metaplasia? Data from Japan // Gastroenterol. Clin. North Am. -
2000. - Vol. 29. - P. 829-835.
54. Shirai N., Furuta Т., Miriyama Y. et al. Effects of CYP2C19 genotypic
differences in the methabolism of omeprazole on intragastral pH // Aliment.
Pharmacol. Ther. - 2001. - Vol. 15. - P. 1929-1937.
55. Stemmermann G.N. Intestinal metaplasia of the stomach. A status report //
Cancer. - 1994. - Vol. 74. - P. 556-564.
56. Testino G. Gastric preneoplastic changes // Recenti. Prog. Med. - 2004. -
Vol. 95. - P. 239-244.
57. Uemura N. The trend of the research on H. pylori eradication and gastric
cancer prevention // Nippon. Rinsho. - 2004. - Vol. 62. - P. 571-576.
58. Walker M.M. Is intestinal metaplasia of the stomach reversible? // Gut. -
2003. - Vol. 52. - P. 1-4.
59. Warren J.R., Marshall B.J. Unidentified curved bacilli on gastric epithelium
in active chronic gastritis // Lancet. - 1983. - Vol. 1. - P. 1273-1275.
60. Warrington S.J. et al. Rabeprazole is more potent than esomeprazole in
control of gastric pH in healthy volunteers // Gut. - 2001. - Vol. 49 (suppl.
3). - P. 2800.
61. Wright N.A. Mechanisms involved in gastric atrophy // Helicobacter pylori.
Basic Mechanisms to Clinical Cure 2000 // Eds. R.H. Hunts G. NJ. Tytgat. -
Dordrecht, Boston, London: Kluwer Academic Publishers. - 2000. - P. 239-247.
62. Wu M.S., Wu S.Y., Chen С.J. et al. Interleukin-10 genotypes associate with,
the risk of gastric carcinoma in Taiwanese // Intent. J. Cancer. - 2003, - Vol.
104. - P. 617-623.
63. Xia H.H., Talley N.J. Apoptosis in gastric epithelium induced by
Helicobacter pylori infection: implication in gastric carcinogenesis // Am. J.
Gastroenterol. - 2001. - Vol. 96, № 1. - P. 16-26.
Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2006, №4,
с. 38-48.
Статья опубликована на сайте
http://www.gastroscan.ru

