Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Хирургическое лечение
рефлюкс-эзофагита
Г.К Жерлов, В.Э. Гюнтер, А.П. Кошель, С.В.
Козлов, Н.С. Рудая, С.А. Соколов, Д.Г. Слугин
За период с 1985 по 2003 г. накопили опыт лечения
175 пациентов с гастроэзофагеальной рефлюксной
болезнью (ГЭРБ), 144 (82,2%) из них оперированы. У 106
(73,6%) больных использован лапаротомный способ в
модификации клиники, 38 (26,4%) пациентам выполнены
лапароскопические операции. В диагностике ГЭРБ, кроме
традиционных методов исследования, использовали
трансабдоминальное УЗИ пищевода, желудка и
двенадцатиперстной кишки, эндоскопическую
ультрасонографию пищевода (ЭУС). На основании данных
ЭУС предложена классификация тяжести рефлюкс-эзофагита.
Разработан в эксперименте и внедрен в практику новый
способ лапароскопической операции моделирования
искусственного нижнего пищеводного сфинктера (НПС)
сверхтонкими (95, 45 мкм) и сверхэластичными нитями из
сплава никелид-титана с эффектом памяти формы.
Выполнены 34 лапароскопические операции, в 26 (76,4%)
из них сформирован искусственный НПС. В этой группе у
94,4% пациентов в отдаленном периоде результат оценен
как отличный и хороший. Давление в области НПС у этих
пациентов после операции возросло в среднем на 70%.
В настоящее время общепризнанно, что
гастроэзофагеальная рефлюксная болезнь (ГЭРБ)
обусловлена повреждением пищевода и смежных органов
вследствие первичного нарушения двигательной функции
пищевода, ослабления антирефлюксного барьера нижнего
пищеводного сфинктера (НПС), снижения пищеводного
клиренса и опорожнения желудка. Достигнут консенсус в
том, что в результате действия множества ослабляющих
факторов определяющим дефектом при ГЭРБ является
патологический нейромышечный контроль НПС, приводящий
к частым длительным периодам преходящего расслабления
НПС, ‘’вялому’’, ‘’некомпетентному’’ сфинктеру [1, 3].
Недостаточность замыкательной функции НПС наблюдается
при многих заболеваниях желудочно-кишечного тракта -
грыже пищеводного отверстия диафрагмы (ГПОД),
гастродуоденальной язве, желчнокаменной болезни,
хроническом толстокишечном стазе [3, 5, 6, 12].
Хирургическая коррекция недостаточности замыкательной
функции НПС при ГПОД составляет основу лечения этого
заболевания [7].
Современным методом выбора хирургического лечения
ГЭРБ является лапароскопическая антирефлюксная
операция [3, 5-7, 9, 10]. До настоящего времени
наиболее распространенной остается операция Ниссена
[3, 5, 7, 9, 10], но она имеет ряд недостатков:
гиперфункция манжетки, гипофункция манжетки,
“соскальзывающая” манжетка, “тянущая” манжетка,
приводящая к латеральному изгибу абдоминального отдела
пищевода, деформация желудка, феномен “песочных часов”
при низком наложении манжетки, аксиальная ротация
абдоминального отдела пищевода [12, 14, 15]. Наиболее
серьезным недостатком этой операции остается дисфагия,
частота которой колеблется от 6 до 42% [12-15], что у
ряда больных требует повторной операции. Некоторые
авторы отдают предпочтение неполной фундопликации, при
которой фундопликационная манжетка окутывает пищевод
на 180-240° [6]. Однако по данным других наблюдений
[5, 13, 16], при этом типе операции достичь стойкого
антирефлюксного эффекта не удается. В связи с этим
остается актуальной проблема совершенствования методик
антирефлюксных операций с восстановлением
замыкательной функции НПС.
Цель исследования - разработать способ
антирефлюксной лапароскопической операции с
формированием в области ‘’некомпетентного’’ НПС
искусственного НПС, моделирующего строение
замыкательного механизма пищеводно-желудочного
перехода, для улучшения непосредственных и отдаленных
результатов хирургического лечения больных с ГЭРБ.
Материал и методы
С 1985 по 2003 г. в НИИ гастроэнтерологии СГМУ
находились на лечении 175 пациентов с ГЭРБ, 144
(82,2%) из них были оперированы: 106 (73,6%) -
традиционным способом, 38 (26,4%) - лапароскопическим.
Продолжительность заболевания колебалась от 2 до 35
лет. 66 (45,8%) пациентов оперированы по поводу
скользящей либо фиксированной ГПОД как
самостоятельного заболевания, 28 (19,4%) - при
сочетании ГПОД с язвой луковицы двенадцатиперстной
кишки, 21 (14,5%) - с язвенной болезнью желудка, 22
(15,2) - при сочетании с желчнокаменной болезнью.
Мужчин было 78 (54,1%), женщин - 66 (45,9%), возраст
больных от 23 до 76 лет.
У 20 (13,9%) пациентов ГПОД была осложнена
дистальным рефлюкс-эзофагитом (РЭ) I степени, у 101
(70,2%) - II степени, у 14 (9,7%) - III степени, у 9
(6,2%) - IV степени (классификация Savary-Miller).
В диагностике заболевания использовали клинические
и инструментальные методы исследования.
Кратковременную внутрижелудочную рН-метрию проводили
на аппарате ацидогастрометр АГМ-05К в модификации
“Гастроскан-5М”, продолжительную (24-часовую)
рН-метрию - с использованием суточного портативного
ацидогастромонитора АГМ-24 МП (“Гастроскан-24”). При
эндоскопической рН-метрии использовали ацидогастрометр
АГМ-01. Эндоскопическое исследование выполняли
фиброскопами фирмы “Olimpus” типа К, К-2, D-4 по
методике Ю.В. Васильева (1970 г.) . Для проведения
манометрии в институте использовали мультиканальную
(12 каналов) систему (“Рoligraf ID”). УЗИ пищевода,
желудка и двенадцатиперстной кишки проводили на
аппарате Aloka SSD-2000 конвексными датчиками 3,5 и 5
МГц.
При УЗИ пищевода определяли следующие показатели:
- длину абдоминального отдела пищевода (норма до
20 мм);
- наружный диаметр абдоминального отдела пищевода
(норма 10,5 мм);
- отношение абдоминального отдела пищевода к
диафрагме и ножкам диафрагмы;
- величину угла гастроэзофагеального перехода.
Дополнительно:
- оценивали структуру стенки абдоминального
отдела пищевода по слоям;
- визуализировали проксимальные отделы пищевода
при нарушении перистальтической активности пищевода;
- визуализировали гастроэзофагеальный рефлюкс при
заполнении желудка жидкостью.
Кроме того, УЗИ желудка выполняли для выявления
остатков жидкости и пищи в полости желудка в качестве
объективного признака замедления эвакуации содержимого
из органа и по двенадцатиперстной кишке. На втором
этапе УЗИ желудка, которое осуществляли после
заполнения последнего жидкостью, определяли:
- структуру зоны пилорического жома;
- перистальтическую активность желудка и
двенадцатиперстной кишки (частоту, скорость и
амплитуду перистальтической волны);
- период полувыведения содержимого желудка;
- степень дуоденогастрального рефлюкса при
цветном допплеровском картировании.
Наряду с традиционной ЭГДС в диагностике РЭ
использовали эндоскопическую ультрасонографию пищевода
(ЭУС) с высокочастотными датчиками 12 и 20 мГц. ЭУС
пищевода осуществляли в двух режимах: серой шкалы -
В-режим и цветного допплеровского картирования.
Длительность обследования составляла 15-20 мин.
Наша клиника располагает опытом
обследования 45 пациентов с ГЭРБ (2001-2003 г.) с
использованием ЭУС. На основании результатов
обследования пациентов с ГЭРБ разработана
классификация РЭ, согласно которой выделяют 4 степени
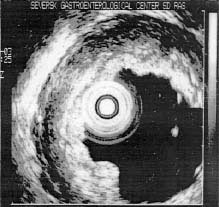
заболевания. При I степени воспалительная инфильтрация
распространялась только на слизистую с наличием
утолщения слизистого слоя и отеком базальной мембраны
- катаральная форма РЭ (рис. 1, а ).
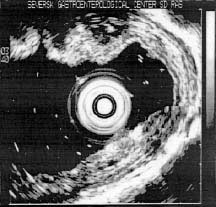
При II степени воспалительная инфильтрация
распространялась на слизистый и подслизистый слои с
образованием поверхностного дефекта не глубже
базальной мембраны слизистой, утолщением слизистого и
подслизистого слоев, наличием гиперэхогенных включений
и расширенных сосудов в подслизистом слое, нечетких
границ между этими слоями - эрозивная форма РЭ (рис.
1, б ).
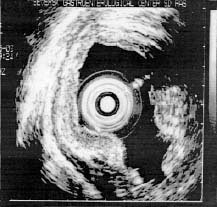
При III степени нарушается целостность
слизистого и подслизистого слоев с вовлечением
мышечной оболочки в виде гипоэхогенного участка
деструкции, в дне которого определяются гиперэхогенные
некротические массы, с распространением воспалительной
инфильтрации на слизистый, подслизистый, мышечный
слои, с нарушением архитектоники мышечного слоя и
границ между слоями - язвенная форма РЭ (рис. 1, в )
.
При IV степени гиперэхогенные фрагменты отчетливо
визуализируются в мышечном слое, нарушая архитектонику
мышечной ткани и межмышечной пластинки -
рубцово-стенотическая форма РЭ (рис. 1, г ).
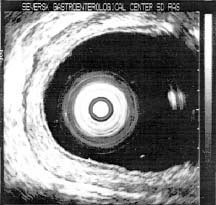
РЭ I степени диагностирован у 18 (40%) пациентов,
II - у 12 (26,6%), III - у 12 (26,6%), IV степень - у
3 (6,8%) пациентов.
ЭУС позволяет объективизировать степень и глубину
поражения стенки пищевода, объективно оценивать
динамику изменений под влиянием консервативного и
оперативного лечения, ее данные являются
дополнительным критерием при определении показаний к
хирургическому лечению, особенно в ситуациях, когда РЭ
не сопровождается ГПОД.
Всем 106 больным, оперированным из лапаротомного
доступа, производили эзофагофундопликацию в
модификации клиники. Суть способа заключается в
следующем. Выполняли селективную проксимальную
ваготомию (СПВ), при этом десерозированную малую
кривизну желудка укрывали путем наложения швов на
переднюю и заднюю стенки малой кривизны с мобилизацией
не менее 5-6 см пищевода, дна желудка. С помощью
турникета пищевод максимально низводили в брюшную
полость. Накладывали шов-держалку на переднюю
поверхность мобилизованного дна желудка и на левую
стенку пищевода, отступив 3-4 см от
эзофагокардиального перехода. Дно желудка заводили за
пищевод и аналогичный шов-держалку накладывали на
правую стенку пищевода. При этом из дна желудка
создается треугольник, острый угол которого направлен
к малой кривизне. Накладывали швы по сторонам этого
треугольника, в результате создается определенное
сдавление абдоминального отдела пищевода (рис. 2).
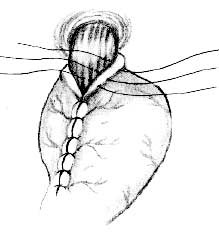
Описанный способ эзофагофундопликации мы применяем
и в настоящее время при открытых операциях, если ГПОД
сочетается с язвенной болезнью и требуется ее
коррекция тем или иным методом. В клинике не
используются дренирующие желудок операции, разработаны
методики пилороподобных антирефлюксных
гастродуоденоанастомозов с сохранением в большинстве
наблюдений пассажа по двенадцатиперстной кишке.
Лапароскопическим методом операция в такой
модификации выполнена 5 (3,5%) пациентам. Подобный
вариант антирефлюксной лапароскопической операции
сложен, так как необходима мобилизация малой кривизны
желудка на значительном протяжении, наложение
укрывающих отдельных швов на малую кривизну желудка
(непрерывный шов, на наш взгляд, приводит к деформации
малой кривизны желудка, а если швы не накладывать, не
формируется замыкательный механизм в области
абдоминального отдела пищевода). Лапароскопический
метод, по нашему мнению, показан:
1) при нефиксированной скользящей кардиальной или
кардиофундальной ГПОД, сопровождающейся РЭ (II-IV
степени по классификации Savary-Mil-ler и по данным
ЭУС пищевода) при отсутствии стриктур пищевода;
2) при резистентном к медикаментозной терапии РЭ (II-IV
степени по классификации Savary-Miller и по данным ЭУС
пищевода), подтвержденном морфологическим методом и
сопровождающимся значительным снижением качества
жизни, регистрацией по данным рН-метрии более 3-4
кислых забросов (рН<2,0) в час в пищевод днем натощак
при вертикальном положении тела больного, длительных
(более 30-40 мин) рефлюксов в пищевод ночью и снижения
давления в области НПС менее 7-9 мм рт.ст.;
3) при сочетании ГЭРБ с заболеваниями органов
брюшной полости, требующими оперативного лечения.
Формирование искусственного НПС преследует цель
восстановления и удлинения зоны повышенного давления в
области “ослабленного” НПС и желудочно-пищеводного
градиента. Анатомическим обоснованием способа являются
исследования Ф.Ф. Сакса и соавт. [8], которые
показали, что оба мышечных слоя абдоминального отдела
содержат восходящие и нисходящие мышцы спиралевидной
формы (рис. 3 ). Косые мышечные волокна циркулярного
слоя переходят с пищевода на желудок и в области малой
кривизны создают кардиальную петлю, удерживающую
кардиальную вырезку (петля Гельвеция). Эта мышца
начинается от угла кардиальной вырезки и переходит на
малую кривизну под разным углом в зависимости от формы
желудка. По данным Л.Л. Колесникова [2], эта петля
является дополнительным компонентом замыкательного
механизма, так как ее сокращение во время
перистальтики способствует сближению стенок
кардиального просвета и тем самым его смыканию.
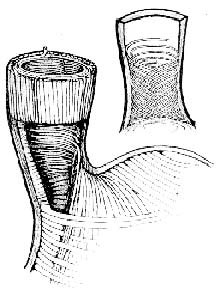
У. Кунат [4] поддерживает теорию о том, что
замыкание кардии изначально обеспечивается
физиологическим натяжением пищевода. Благодаря
винтообразному строению мышц пищевода в области кардии
формируется самозатягивающаяся петля, которая приводит
к смыканию и закрытию входа в желудок.
В эксперименте разработан способ моделирования
искусственного НПС сверхтонкими (95, 45 мкм) и
сверхэластичными нитями из сплава никелид-титана с
эффектом памяти формы. Оперированно 6 собак.
Интраоперационно измеряли ширину абдоминального отдела
пищевода. В области эзофагокардиального перехода
формировали 2-3 спирали сверхэластичной нитью из
никелид-титана общей высотой витков 15-20 мм. За
наблюдаемый период эвакуаторных расстройств в виде
рвоты, нарушения проглатывания пищи у оперированных
животных не отмечалось. В разные сроки (7, 14 сут, 1,
3, 6 мес) повторно интраоперационно производили
измерение ширины абдоминального отдела пищевода,
животных выводили из опыта, производили забор
комплекса, начиная от средней трети пищевода и включая
весь желудок. В сроки более 3 мес нити размером 45 мкм
макроскопически на препарате визуализировать на
поверхности стенки пищевода не удавалось. Измерение
показало, что во всех случаях ширина абдоминального
отдела пищевода после операции уменьшалась на 1-2 мм.
Однако дальнейшего сужения в отдаленные сроки не
происходило. Зона пищеводно-желудочного перехода в
области искусственного НПС у всех собак сохраняла
проходимость. Гистологическое исследование стенки
пищевода в области нити показало наличие
неспецифической воспалительной реакции в
непосредственной близости к нити в первые 14 сут после
операции и отсутствие выраженной рубцовой
трансформации мышечной оболочки и подслизистой основы
в отдаленный период.
Способ осуществляется следующим образом. После
введения в брюшную полость 5 троакаров производят
мобилизацию проксимальной части малой кривизны желудка
(по типу СПВ), 4-5 см дистальной части пищевода, дна
желудка. Далее формируют искусственный НПС путем
наложения непрерывного шва эластичной сверхтонкой
нитью. Начинают шов в субкардиальном отделе на малой
кривизне желудка, продолжают на правую стенку
пищеводно-желудочного перехода и далее на заднюю
стенку пищевода накладывают 2-3 спиралевидных витка по
ходу циркулярных мышечных волокон пищевода в
восходящем направлении. В общей сложности формируют
2-3 спирали общей высотой витков до 3 см. Затем шов
продолжают в обратном (нисходящем) направлении -
спиралевидно до левой стенки пищеводно-желудочного
перехода и на малую кривизну желудка к началу шва, где
узел завязывают интракорпорально (рис. 4).

При наложении непрерывного шва дозированно
натягивают нить до создания в области формируемого НПС
давления, равного 22-25 мм рт.ст. Интра-операционное
измерение давления в области искусственного НПС
производят по методу В.И. Оскреткова и В.А. Ганкова
[5]. На конце толстого желудочного зонда укрепляют
баллон, давление в котором передается на
регистрирующее устройство. После заполнения баллона
воздухом формируют искусственный НПС. Способ завершают
эзофагофундорафией путем наложения 3-4 швов по правой
и левой стенке пищевода с целью формирования угла Гиса
и клапана в области кардиальной вырезки (рис. 5).
Давление в области искусственного НПС должно превышать
давление в желудке в 2-2,5 раза.
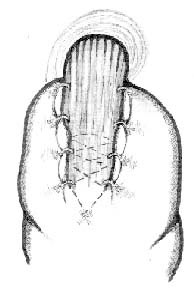
Характеристики используемой нити из сплава
никелид-титана:
1. Напряжение деформации (прочность) нити
толщиной 95 мкм до 1,5 кг.
2. Гистерезисное напряжение тканей (величина
деформации) 8%.
3. Обратимая возвратная деформация (эластичность)
10%.
За период с 2001 г. в клинике выполнены 34
лапароскопические антирефлюксные операции: 3 (8,8%)
операции Тупе, 5 (14,7%) операций в модификации
клиники, 26 (76,4%) - с формированием искусственного
НПС. У 2 больных через 6 мес после операции Тупе
выявлен рецидив симптомов (непостоянная изжога,
отрыжка), потребовавший консервативного лечения.
Давление в области НПС и протяженность нижней
пищеводной зоны высокого давления у этих пациентов
после операции изменилось незначительно: с 10, 6 и
11,7 до 13,1 и 14,2 мм рт.ст., с 1,6±0,2 до 1,8±0,1
см. После операции с формированием искусственного НПС
у 1 (3,8%) пациента отмечалась легкая дисфагия,
купировавшаяся в течение 2 мес. В отдаленном
послеоперационном периоде (от 1 года до 2,5 лет) после
операций с формированием искусственного НПС
обследованы 18 (69,2%) пациентов. Согласно результатам
опроса и анкетирования, 17 (94,4%) пациентов оценивали
свое состояние как отличное и хорошее, 1 - как
удовлетворительное. При рентгенологическом
исследовании, ЭГДС признаков недостаточности кардии не
обнаружено ни у одного пациента. По данным ЭУС
пищевода у 1 пациента выявлен РЭ I степени. Давление в
области НПС у этих пациентов увеличилось с 12,8±4,5 до
23,7±2,4 мм рт.ст., протяженность зоны высокого
давления в нижнем отделе пищевода - с 1,6±0,2 до
3,1±0,2 см. При pH-мониторинге патологического кислого
или щелочного рефлюкса не выявлено ни в одном
наблюдении.
Таким образом, разработанный способ антирефлюксной
лапароскопической операции с моделированием
искусственного НПС обеспечивает создание зоны
повышенного давления в абдоминальном отделе пищевода,
что является основой профилактики рецидива симптомов
заболевания. Сформированный искусственный НПС за счет
свойств нити не подвергается рубцеванию, остается
эластичным и позволяет сохранить проходимость кардии,
что отвечает основным требованиям, предъявляемым к
антирефлюксным операциям.
Литература
1. Билхарц Л.И. Осложнения гастроэзофагеальной
рефлюксной болезни. Рос журн гастроэнтерол гепатол
1998; 5: 69-76.
2. Колесников Л.Л. Сфинктерный аппарат человека.
Ст-Петербург: СпецЛит 2000; 183.
3. Кубышкин В.А., Корняк Б.С. Гастроэзофагеальная
рефлюксная болезнь. Диагностика, консервативное и
оперативное лечение. М 1999; 208.
4. Кунат У. Функциональная морфология пищевода и ее
значение в хирургии. Эндоскоп хир. 1995; 4: 10-13.
5. Оскретков В.И., Ганков В.А. Результаты
хирургической коррекции недостаточности замыкательной
функции кардии. Хирургия 1997; 8: 43-46.
6. Пучков К.В., Гаусман Б.Я., Мартынов М.М.
Сочетанные оперативные вмешательства при грыже
пищеводного отверстия диафрагмы. Эндоскоп хир 1996; 4:
27-28.
7. Ривкин В.Л. Лапароскопическая фундопликация.
Международный конгресс по эндоскопической хирургии,
5-й: Тезисы. Эндоскоп хир 1998; 1: 34-36.
8. Сакс Ф.Ф., Байтингер В.Ф., Медведев М.А., Рыжов
А.И. Функциональная морфология пищевода. М 1985; 192.
9. Сигал Е.И., Бурмистров М.В., Петрунин В.М.
Преимущества лапароскопической фундопликации при
грыжах пищеводного отверстия диафрагмы перед
традиционной открытой. Эндоскоп хир 1998; 1: 49.
10. Федоров В.Д., Кубышкин В.А., Корняк Б.С.
Гастроэзофагеальная рефлюксная болезнь и
миниинвазивная хирургия. Эндоскоп хир 1999; 2: 67.
11. Федоров В.Д., Кубышкин В.А., Корняк Б.С.,
Отдаленные результаты лапароскопических вмешательств у
пациентов с гастроэзофагеальной рефлюксной болезнью.
Эндоскоп хир 1999; 2: 68.
12. Черноусов А.Ф., Шестаков А.Л. Хирургическое
лечение рефлюкс-эзофагита и пептической стриктуры
пищевода. Хирургия 1998; 5: 4-8.
13. Черноусов А.Ф., Богопольский П.М., Курбанов
Ф.С. Хирургия пищевода: Руководство для врачей. М:
Медицина 2000; 320.
14. Шмакова Е.А., Мосунов А.И., Анищенко В.В.
Функциональные нарушения после фундопликации. Эндоскоп
хир. (Приложение) 2003; 157-158.
15. Anvari M., Allen С. Incidence of dysphagia
following laparoscopic Nissen fundoplication without
division of short gastric vesels. Surg Endosc 1996;
10: 199.
16. Champault G., Volter F., Rizc N. et al.
Gastroesophageal reflux: Conventional Surgical
Treatment Versus Laparosc. Eur J Coelio-Surg 1997; 2:
32-38.
Статья опубликована на сайте
http://www.gastroscan.ru

