Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Вариабельность ритма сердца: представления о механизмах
С.А. Котельников, А.Д. Ноздрачев, М.М. Одинак, Е.Б.
Шустов, И.Ю. Коваленко, В.Ю. Давыденко
Санкт-Петербург, Российская Военно-медицинская академия, кафедра
нервных болезней
У здоровых людей интервал времени от начала цикла одного
сердечного сокращения до начала другого не является одинаковым, он постоянно
меняется. Первым это обнаружил А. Галлер в 1760 г. [1]. Явление получило
название вариабельности ритма сердца (ВРС). ВРС наблюдается даже в состоянии
покоя в положении лежа. Характерно, что непостоянство интервала между
кардиоциклами находится в пределах некой средней величины, являющейся
оптимальной для определенного рассматриваемого функционального состояния
организма. Все это свидетельствует о том, что ВРС должна оцениваться только при
стационарных состояниях, так как при любом изменении статуса организма частота
сердечных сокращений (ЧСС) начинает подстраиваться под новый функциональный
уровень. Этот период «подстройки» является своеобразным переходным периодом, в
котором включаются другие, не связанные с регуляцией ВРС механизмы,
обеспечивающие достижение средней ЧСС, оптимальной уже для нового
функционального состояния.
О вариабельности ритма сердца традиционно судят по
длительности RR-интервалов ЭКГ, хотя более правильным будет рассматривание
длительности PP-интервалов, так как именно начало зубца P как раз и является
началом нового сердечного цикла, связанного с возбуждением синусового узла.
Склонность к оценке RR-интервалов связана с тем, что зубец R, особенно во втором
стандартном отведении, наиболее легко выделить из ЭКГ-сигнала при компьютерной
обработке, в силу того, что он является наибольшим по амплитуде. Для регистрации
ВРС кроме ЭКГ можно использовать и другие методы, записывающие циклы сердечных
сокращений (реографию, плетизмографию, допплерографию магистральных артерий,
эхокардиографию).
ВРС отчетливо видна при графическом представлении
последовательности длительностей RR-интервалов за определенный временной
промежуток (рис. 1). В данном случае по оси ординат откладывается длительность
RR-интервалов. Если по оси абсцисс откладывается номер кардиоинтервала, то она
называется кардиоинтервалограммой, если время – кардиоритмограммой (или просто
ритмограммой). Кардиоинтервалограмма по предложению Д. Жемайтите [2]
изображается в виде столбиковых диаграмм, а ритмограмма традиционно
представляется в виде кривой. Существуют свои особенности построения ритмограммы,
связанные с тем, что по оси абсцисс откладывается время в секундах, а
RR-интервалы имеют неодинаковые длительности, несоответствующие целой секунде.
Для решения этой проблемы дискретные значения RR-интервалов принимаются за
опорные точки. Точки последовательно откладываются по оси абсцисс, а затем
проводится переоцифровка полученной кривой с постоянным шагом времени. В итоге
этих манипуляций получается весьма наглядная и удобная для оценки ритмограмма
(рис. 1).
При визуальном рассмотрении ритмограмм легко заметить, что
изменение длительностей RR-интервалов происходит с определенной периодичностью.
Это свидетельствует о существовании волновой модуляции сердечного ритма.
Выделяется несколько типов волн в ритмограмме: короткие (s-волны) с периодом
колебаний от 2,5 до 9 с, средние (m-волны), имеющие период колебаний от 10 до 20
с, и длинные (1-волны), возникающие с периодом 30-90 с [3]. Примеры данных волн
представлены на рис. 2.
Обнаружено, что волновая модуляция сердечного ритма
соответствует колебаниям артериального давления (АД) и при обозначении
периодических составляющих ВРС можно применять названия волн АД. Исторически
сложилось так, что первоначально наиболее детально была изучена волновая
структура колебаний АД. Поэтому здесь нам представляется целесообразным привести
историю изучения волн АД.
Впервые изменения АД сопряженные с дыхательными движениями
обнаружил К. Людвиг в 1847 [4] и назвал их «волнами кровяного давления». В 1865
году Л. Траубе [5] в экспериментах на животных при выключенном дыхании обнаружил
существование других самостоятельных ритмических изменений АД с периодом
колебаний около 10 с. Эти колебания Е. Геринг (1869) назвал волнами Траубе [6].
Он же доказал прямую связь дыхательного ритма с колебаниями АД. Поэтому
колебания АД, синхронные с ритмом дыхания, были названы волнами Геринга. В 1876
г. С. Майер у экспериментальных животных обнаружил колебания АД с большим
периодом, чем дыхательные [7] . Они получили названия волн Майера. В последующем
работами других авторов было установлено, что все эти волны выявляются и при
изучении ЧСС. Впервые описание различных типов волн в последовательностях
RR-интервалов сделали А. Флейш и Р. Бекман в 1932 г [8]. Такова краткая история
вопроса.
Теперь вернемся к ВРС. Идеальные ритмограммы, типа
представленных на рис. 1, на которых можно четко различить волновые составляющие
в ритме сердца, встречаются крайне редко. Для их выделения используется
специальная процедура спектрального анализа сердечного ритма. Согласно Фурье
любую сложную кривую (какой в данном случае и является ритмограмма) можно
разложить на периодические составляющие. Для этого предложены специальные
алгоритмы, которые получили названия преобразования Фурье [9].
Кардиоинтервалограмма по принципу своего построения является дискретной и
преобразованию Фурье не подлежит.
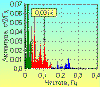
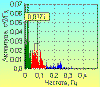
В результате преобразований Фурье получается частотный спектр
тех периодических колебаний, которые составляли исходную кривую. Представление
его в графическом виде называется спектрограммой, где по оси абсцисс
откладываются частоты, по оси ординат – их амплитуды. На рис. 3 представлен
пример разложения исходной ритмограммы на составляющие гармоники и их
спектрограмма. Таким образом, использование спектрального анализа при изучении
последовательностей RR-интервалов позволяет не только выявить периодические
составляющие ВСР, но и оценить их удельный вес в спектре частот.
На спектрограммах здоровых людей, полученных на основании
кратковременных (5 минутных) записей в состоянии покоя в положении лежа, видны
три основных волновых пика (рис. 4), из которых первый пик находится вблизи
нуля. Его амплитуда весьма вариабельна. Она зависит от ЧСС и множества других
известных и неизвестных пока факторов. Второй пик находится возле 0,1 Гц, третий
располагается в пределах 0,21 Гц. Впервые описание этих пиков было дано Б.
Сайерсом в 1973 г [10].
Частотный спектр, получаемый при анализе кратковременных
записей ЭКГ, согласно используемым сейчас "Стандартам измерения, физиологической
интерпретации и клиническому использованию вариабельности ритма сердца" [11] (в
дальнейшем "Стандартам…"), разбит на 3 диапазона: очень низкочастотный (VLF) с
границами от 0 до 0,04 Гц, низкочастотный (LF) с границами от 0,04 до 0,15 Гц и
высокочастотный (HF) с границами от 0,15 до 0,4 Гц. Таким образом, первый пик
называется очень низкочастотным, второй – низкочастотным, а третий –
высокочастотным. Наряду с оценкой амплитуды этих пиков принято анализировать
также спектральную мощность по диапазонам, которая вычисляется как площадь под
кривой, которую образуют соответствующие волновые пики.
ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ, ЛЕЖАЩИЕ В ОСНОВЕ ВРС
Хорошо известно, что интервал между циклами сердечных
сокращений зависит от ритмической активности пейсмекерных клеток синусового
узла. В свою очередь ритмическая активность находится под нервным и эндокринным
контролем, а также под влиянием ряда гуморальных факторов, изменяющих порог
спонтанной деполяризации пейсмекеров синусового узла. Последнее приводит,
соответственно, к увеличению или уменьшению интервала между циклами сердечных
сокращений и, следовательно, ЧСС. Поэтому факторы, регулирующие ЧСС, будут
определять и вариабельность сердечного ритма. Важная особенность этого процесса
заключается в том, что активность (уровень действия) названных факторов
изменяется с определенной периодичностью. Кроме периодических влияний различных
факторов в ВРС имеются также и непериодические составляющие. Они, как правило,
связаны со случайными событиями. Такими событиями могут быть глотание,
раздражения со стороны внешней (звуковое или световое воздействие) или
внутренней (внезапное усиление перистальтики кишечника) среды, изменение
положения тела. Существенно изменяют ВРС даже одиночные экстрасистолы, поэтому
при проведении анализа согласно «Стандартам…» должны использоваться только
нормальные, т.е. синусовые RR-интервалы, экстрасистолы же непременно должны
исключаться.
Теперь вначале рассмотрим механизмы формирования
периодических составляющих ВРС, а затем перейдем к непериодическим.
Механизмы образования высокочастотных волн. Как
правило, высокочастотные волны на спектрограммах здоровых людей представлены
лишь одним пиком, в большинстве случаев расположенным на 0,2-0,3 Гц. Сейчас не
вызывает сомнения, что высокочастотные колебания в ВРС связаны с актом дыхания.
Доказательством дыхательной природы высокочастотного колебания в ВРС служит
совпадение частоты дыхания (ЧД) с частотой высокочастотного пика спектрограммы.
На приводимой ранее спектрограмме (рис. 4) он располагается на 0,21 Гц, что
соответствует колебаниям с периодом в 4,8 с или 12,5 циклов в 1 мин. Такой же
являлась и частота дыхания испытуемого. Расположение данного пика меняется и при
изменении ЧД, что хорошо прослеживается в пробе с заданной частотой дыхания
(рис. 5). При ЧД 21 цикл в 1 мин пик располагается на 0,35 Гц, при ЧД 15 – на
0,25 Гц, а при ЧД 6 – на 0,1 Гц. То, что высокочастотная составляющая ВРС
связана с дыханием, подтверждается также при одновременной регистрации дыхания и
ЭКГ. С каждым вдохом длительность RR интервалов уменьшается, с каждым выдохом –
увеличивается (рис. 6).
Объяснение механизма взаимосвязи дыхательных колебаний с
изменением длительности RR-интервалов остается одной из самых сложных задач
современной физиологии. На сегодняшний день этот механизм так окончательно и не
расшифрован. Достоверно установлено лишь то, что эфферентным звеном в этом
случае является блуждающий нерв. Доказательством этого положения служит
исчезновение дыхательной модуляции сердечного ритма после назначения блокаторов
м-холинорецепторов или тотальной перерезки блуждающего нерва [12, 13, 14].
Существует несколько гипотез самого процесса образования
дыхательной модуляции сердечного ритма. Согласно первой из них изменение ЧСС
осуществляется по механизму аксон-рефлекса. В этом случае при вдохе происходит
возбуждение рецепторов растяжения легких, которое затем передается по
блуждающему нерву к сердцу. Процесс возбуждения не выходит за пределы одного и
того же аксона и, благодаря антидромному проведению, приводит к выбросу
биологически активных веществ в волокнах, вызывающих соответствующие реакции
этого же, или соседнего органа, находящегося в той же зоне иннервации [15].
По второй гипотезе, напротив, ведущим является центральный
механизм [16, 17, 18]. Возбуждение нейронов дыхательного центра, генерирующих
потенциалы в ритме дыхания, передается преганглионарным кардиомоторным вагусным
нейронам, во время вдоха тормозя, а во время выдоха – возбуждая эти структуры. В
соответствие с вагусным ритмом ЧСС на вдохе возрастает, на выдохе – уменьшается.
Гипотеза объясняет такие известные феномены, встречающиеся при анализе
высокочастотных компонентов ВРС, как несовпадение частоты высокочастотного пика
и ЧД, или происходящее во время вдоха уменьшение ЧСС, а не ожидаемое ее
увеличение. Процесс этот можно объяснить тем, что возбуждение дыхательного
центра передается сосудодвигательному через группы специальных нейронов (в
ретикулярной формации продолговатого мозга), которые могут изменить частоту
разрядов, а также вызывать фазовый сдвиг вплоть до противоположного.
Следующая гипотеза объясняет возникновение дыхательной
аритмии за счет барорецепторного механизма [19, 20, 21]. Дыхание механически
изменяет сопротивление сосудов малого круга, что сказывается на величине
ударного объема и, поэтому, на амплитудах дыхательных волн АД. Последнее
отражается на потоке импульсов артериальных барорецепторов и, следовательно,
потоке разрядов, идущих по вагусным волокнам к синусовому узлу.
Еще одна из существующих гипотез объясняет механизм
возникновения дыхательной аритмии в результате изменения газового состава крови.
В этом случае предусматривается, что увеличение концентрации углекислого газа,
приводит к активации не только дыхательного, но и сосудодвигательного центра.
Вследствие этого соответственно происходит вдох и увеличивается ЧСС. В пользу
этой гипотезы свидетельствуют данные ряда авторов, исследовавшие
кардиореспираторные взаимоотношения в зависимости от содержания в крови
кислорода и углекислого газа [22, 23]. Кроме того, во время дыхательного цикла
изменяется кровенаполнение предсердий, что также может влиять на сердечные
сокращения.
При анализе высокочастотных колебаний обращают на себя
внимание несколько феноменов, наблюдаемых у здоровых людей при соблюдении всех
условий записи. Это прежде всего: несовпадение частоты дыхательного пика и ЧД;
наличие нескольких пиков в высокочастотном диапазоне примерно одинаковой
амплитуды; наличие одного пика максимальной амплитуды, окруженного
дополнительными пиками, величина которых уменьшается по мере удаления от
основного пика; не уменьшение, а, напротив, увеличение длительности
RR-интервалов во время вдоха; отсутствие дыхательных пиков у полностью здоровых
людей (рис. 7).
Несовпадение частоты дыхательного пика и ЧД, как уже
обсуждалось ранее, можно объяснить задержкой проведения возбуждения по нейронной
цепи ретикулярной формации продолговатого мозга от дыхательного центра к
сосудодвигательному, что и влечет за собой сдвиг частот дыхательных волн в ритме
сердца в более медленную сторону. Это обстоятельство хорошо подтверждает участие
центрального механизма в образовании дыхательной аритмии.
Наличие нескольких пиков в высокочастотном диапазоне примерно
одинаковой амплитуды может быть связано с существованием других (не дыхательных)
модуляций сердечного ритма. Они могут быть обусловлены нейрорефлекторным
взаимодействием сердца с другими внутренними органами или генерацией ритмов
метасимпатической нервной системы сердца [24, 25].
Наличие одного пика максимальной амплитуды, окруженного
дополнительными пиками, амплитуда которых уменьшается по мере удаления от
основного пика, может быть связано с «плавающей» ЧД, возле некоторой средней
величины, задаваемой центральным осциллятором. Нами было также установлено, что
при оценке записей ВРС у здоровых людей в определенное время или через
определенные промежутки времени, ЧД может меняться либо в сторону увеличения,
либо уменьшения. Такая вариация ЧД, по всей видимости, и находит отражение в
формировании рассмотренной уже выше картины на спектрограмме.
Следующий феномен связан с тем, что во время вдоха происходит
не уменьшение, а, напротив увеличение длительности RR-интервалов. Эту картину
нам доводилось многократно наблюдать у испытуемых. Причем у одного из них можно
было зарегистрировать уменьшение и увеличение длительности RR-интервалов на
вдохе в разное время записи ВРС (через сутки, например). Названное явление можно
объяснить в рамках центральной гипотезы корригирующими влияниями процесса
возбуждения от дыхательного центра к сосудодвигательному.
Отсутствие дыхательных пиков в нормальных условиях, по всей
видимости, связано с повышенной ингибирующей симпатической модуляцией или
недостаточной модуляцией парасимпатической нервной системы на дыхательный и
сосудодвигательный центр.
Следовательно, в данный момент, существует много вопросов к
расшифровке механизмов образования высокочастотных колебаний в ВРС. И какой из
них является превалирующим в формировании высокочастотных колебаний - пока что
сказать трудно. Ясно лишь одно, что высокочастотные колебания сердечного ритма в
конечном итоге определяются связью блуждающего нерва с синусовым узлом и
оказываемыми при этом влияниями. Поэтому по значениям спектральной мощности в
высокочастотном диапазоне в основном судят о состоянии парасимпатической нервной
системы.
Механизмы образования низкочастотных волн. Волновые
колебания сердечного ритма в низкочастотном диапазоне спектра при записях в
состоянии покоя в положении лежа, как правило, представлены одиночным пиком с
частотой 0,1 Гц. Однако частота его может варьировать. Широко известны варианты,
характеризующиеся другими показателями – 0,05 Гц и 0,15 Гц. Кроме того, в
низкочастотном диапазоне спектра может быть не один, а несколько пиков.
Наличие волнового пика с частотой 0,1 Гц означает, что в
организме имеются и соответствующие колебания сердечного ритма с периодом 10 с.
Колебания с таким же периодом регистрируются в ритме АД. Впервые они были
описаны Л. Траубе в 1865 г [4]. При проведении кросс-спектрального анализа
ритмов АД и ЧСС удалось установить, что удлинению RR-интервалов предшествует
повышение АД. По мнению Каремакера [26] последнее служит доказательством того,
что 0,1 герцовый ритм ЧСС является следствием колебания ритма АД и этот эффект
объясняется барорефлекторным механизмом. Это означает, что в ответ на повышение
АД происходит угнетение симпатической и увеличение парасимпатической активности,
что непременно приводит к удлинению RR-интервалов. Большинство исследователей
согласны с тем, что 0,1 герцовый ритм АД является следствием генерализованных
вспышек симпатической вазомоторной активности, которые возникают с такой же
частотой [27-30]. При одновременной записи АД с симпатическими нейрональными
разрядами, выполненной посредством микроэлектродной техники, установлено, что АД
начинает повышаться примерно на 2 с позднее вспышки симпатической активности
[31, 32].
Следует иметь в виду, что до настоящего времени имеются
разногласия относительно генеза генерализованной симпатической активности.
Некоторые считают, что этот ритм навязывается барорецепторными структурами и это
осуществляется следующим образом [26, 33]. В ответ на падение АД ниже некоторого
уровня происходит активация барорецепторов, которая вызывает увеличение
симпатической вазомоторной активности и, соответственно, сужение сосудов. В
результате АД повышается, достигает некоторого максимального значения и затем
после этого начинает падать. Весь цикл многократно повторяется. В пользу
барорефлекторной гипотезы возникновения 0,1 герцового ритма свидетельствует и
то, что при растяжении каротидного синуса созданием над шейной областью
локальной зоны пониженного барометрического давления в течение 0,6 с возникают
затухающие по амплитуде колебания ЧСС с периодом 10 с.
Однако существует и иная точка зрения. Она сводится к тому,
что генерализованная симпатическая активность задается специальным осциллятором,
располагающимся в нейрональной сети ствола мозга. Он-то в основном и определяет
колебания интенсивности потока импульсов симпатических сосудодвигательных
нейронов с периодом в 10 с [17, 34]. Эти колебания по симпатическим эфферентным
нервным волокнам передаются к сердцу и сосудам, вызывая активацию кардиальных
метасимпатических структур, осуществляющих базовую иннервацию органа. Именно это
и приводит к формированию 0,1 герцовых ритмов ЧСС и АД. В данном случае
колебания ЧСС не являются следствием колебаний АД, сдвиг по времени ритмов ЧСС и
АД, возможно, связан с различной длиной эфферентного пути. Чтобы проверить это
предположение необходимо исследовать и сопоставить характер нейрональной
активности симпатических нервов сердца и вазомоторных эфферентов. Косвенным
подтверждением существования центрального механизма формирования низкочастотных
волн в ритме сердца являются исследования Р. Кули с соавт. (1998), которые
обнаружили независимость ВРС от вариабельности АД у больных с сердечной
недостаточностью, которым было имплантировано устройство вспомогательного
кровообращения (left ventricular assist device) [35].
Существует также еще гипотеза, что 0,1 герцовый ритм является
следствием ритмичности миогенных реакций артериол, которая по барорефлекторному
механизму изменяет ЧСС [36].
Рассмотрение механизмов формирования низкочастотных колебаний
в ВРС было бы не полным без отражения того, что назначение атропина не только
устраняет высокочастотный компонент спектра, но и, по данным ряда авторов,
значительно снижает мощность низкочастотной составляющей [37]. В результате
этого наблюдения делался вывод о влиянии блуждающего нерва на весь диапазон
спектра. Заметим, что в этом случае, к сожалению, не придается значения тому,
что атропин обладает не только периферическим, но и центральным действием и,
следовательно, он способен угнетать центральный механизм формирования этого
ритма в ЦНС. Для уточнения эффекта атропина будет, по видимому, необходимым
назначение холинолитических средств только с центральным или только с
периферическим механизмом действия. Если при назначении блокатора периферических
М-холинорецепторов мощность низкочастотных колебаний не будет меняться, а при
назначении центральных холинолитиков снижаться, то, на наш взгляд, это будет
служить достаточно корректным подтверждением теории центрального формирования
низкочастотных колебаний. Для полноты рассмотрения вопроса о возможном влиянии
блуждающего нерва на низкочастотную составляющую спектра необходимо также
заметить, что давно известен феномен модуляции симпатической активности
парасимпатическими влияниями. Это хорошо можно проиллюстрировать на примере
изучения колебаний электродермальной активности (ЭДА). Как известно, в основе
ЭДА лежит секреция потовых желез, которые имеют только эфферентную симпатическую
иннервацию. При одновременной записи дыхания и ЭДА в ряде случаев хорошо видны
их синхронные колебания. Поэтому нельзя исключить, что имеет место и
парасимпатическая модуляция активности симпатических эфферентов, идущих к сердцу
[38].
Возможно, что в формировании 0,1 герцового ритма ЧСС
принимают участие все три механизма (барорефлекторный, центральный и миогенный).
В конечном счете, для практического использования важным является то, что
низкочастотные колебания напрямую связаны с активностью постганглионарных
симпатических волокон, и по их спектральной мощности можно судить о состоянии
симпатической регуляции сердечного ритма.
Нельзя оставить без внимания, что в положении стоя у здоровых
молодых людей происходит значительное увеличение амплитуды 0,1 герцовых
колебаний в ритме ЧСС (рис. 9), а также появление дополнительных пиков в
низкочастотном диапазоне. При этом нейрофизиологически регистрируется выраженное
увеличение амплитуды вспышек симпатической активности и возникновение более
четкой периодичности по сравнению с положением лежа [31]. Такая же картина
наблюдается и при внутривенном введении нитропруссида натрия [39]. Эти данные
являются подтверждением барорефлекторной гипотезы формирования низкочастотных
колебаний. Однако нельзя сбрасывать со счетов и другие возможные факторы,
которые могут вносить вклад в образование этих волн. В частности, к ним можно
отнести изменение потока афферентных разрядов в нервных волокнах вен нижних
конечностей, которые, как известно, растягиваются в положении стоя, а также
сигналы от интероцепторов, реагирующих на смещение органов брюшной и грудной
полости [21]. Следует особо заметить, что амплитуда высокочастотных
(дыхательных) волн при переходе в положение стоя уменьшается или полностью
исчезает. Это указывает на существование специальных реципрокных взаимоотношений
между высокочастотными и низкочастотными колебаниями. Подобные взаимодействия
наблюдаются также между парасимпатической и симпатической отделами нервной
системы, определяющими наличие этих волновых колебаний в ВРС. Это послужило
основанием использовать отношение мощностей низкочастотного и высокочастотного
диапазонов спектра (коэффициент LF/HF) для оценки баланса между симпатической и
парасимпатической системами [11, 40].
Механизмы формирования очень низкочастотных колебаний.
Больше всего неясностей возникает при рассмотрении механизмов формирования более
медленных колебаний в сердечном ритме, то есть в очень низкочастотном диапазоне
спектра. У большинства здоровых людей в данном диапазоне имеется лишь один пик
колебаний, расположенный около 0 Гц, чаще всего на 0,003-0,007 Гц (рис. 4),
поэтому он называется околонулевым пиком [41]. Однако при этом может также
встречаться множество сопутствующих дополнительных пиков по всему
низкочастотному диапазону. Формирование рассматриваемых волновых колебаний может
быть, по-видимому, обусловлено влиянием надсегментарных отделов автономной
нервной системы, эндокринных или гуморальных факторов на синусовый узел, а также
опосредованно метасимпатической нервной системой сердца. Р. М. Баевский
предположил, что основной (околонулевой) пик данного диапазона, связан с
активностью надсегментарных, в частности, гипоталамических центров вегетативной
регуляции, которые генерируют медленные ритмы, передающиеся к сердцу через
симпатическую нервную систему [41]. Подтверждением этому являются данные Н.Б.
Хаспековой [42], которая при изучении ВРС на значительном контингенте больных с
опухолями головного мозга и невротическими расстройствами, установила наибольшую
зависимость его мощности от состояния надсегментарных вегетативных центров. Еще
одной группой авторов предполагается связь очень низкочастотных волновых
колебаний с ритмами терморегуляции, задаваемыми гипоталамусом. Предполагается
также, что некоторые периодические составляющие этого диапазона могут быть
обусловлены сугубо гормональными влияниями на сердечную мышцу, которые как раз
характеризуются медленным ритмом секреции, соответствующим рассматриваемому
частотному диапазону.
Влияния гормонов на RR-интервалы может осуществляться
благодаря их непосредственному действию на структуры синусового узла (в нем
имеются соответствующие рецепторы), через изменение метаболизма миокарда или
воздействием на мембранные рецепторы этих гормонов в центральной нервной
системе, если гормоны проникают через гематоэнцефалический барьер [43].
Необходимо заметить, что на миокардиоцитах имеются рецепторы к катехоламинам,
ацетилхолину, гистамину, ангиотензину II, натрий-уретическому фактору, окиси
азота, аденозину. Теоретически все они могут изменять ВРС. С. Аксельродом с
соавт. экспериментально доказано, что в ВРС имеется 0,04 герцовый ритм,
обусловленный секрецией ренина [13]. Он, по всей видимости, осуществляется через
изменение активности ангиотензина II. Иследованиями А.О. Навакатикян [44] в ВРС
установлено также наличие ритмов, связанных с колебаниями в крови уровня
адреналина, периодичность которых составляет 6,7 мин, норадреналина – 7,7 мин,
17 ОКС – 9 мин (0,025 Гц, 0,002 Гц, 0,0019 Гц соответственно). В ЦНС обнаружены
рецепторы к ангиотензину, глюкокортикоидам, минералокортикоидам, воздействие на
которые, как доказано в экспериментах на животных, значительно изменяет ЧСС и
АД. Высказывается также мнение, что воздействие этих веществ на рецепторы в ЦНС
может регулировать ЧСС и АД посредством изменений барорефлекторных реакций [45].
Нестационарные процессы вариабельности сердечного ритма.
Эти процессы являются случайными при записях ЭКГ, но они
значительно влияют на результаты анализа в целом. Одним из таких процессов может
быть глотание. На ритмограмме оно проявляется одиночными волнами тахикардии,
которая в ряде случаев переходит в кратковременную брадикардию (рис. 10). Это
явление известно уже более 100 лет и описано оно С. Мельцером в 1883 году [46].
Г.Я. Прийма [47] назвал такую реакцию глоточно-сердечным рефлексом. Изменения
ВРС вследствие этих реакций детально изучены В.М. Хаютиным. Они проявляются в
низкочастотном диапазоне спектра и могут завышать его мощность, что искажает
результаты исследований этих волн, а, следовательно, и оценку состояния
симпатической системы. Поэтому при анализе ВРС необходимо учитывать это явление,
регистрируя на ритмограмме момент глотательных движений и затем устраняя их из
анализа. Другие непериодические составляющие ВРС связаны с раздражениями со
стороны внешней (звуковое или световое воздействие) или внутренней (внезапное
усиление перистальтики кишечника) среды, изменением положения тела. Они также
могут влиять на результаты анализа ВРС.
Использование ВРС в клинической практике.
Сегодня исследование ВРС активно внедряется в клиническую
практику. Установлена высокая информативность ВРС при диагностике полиневропатий,
синкопальных состояний, прогнозе выживаемости при инфаркте миокарда [11, 48-56].
Имеются разработки, позволяющие определить диагностическую значимость
исследования ВРС и, в частности, спектрального анализа ритма сердца при
гипертонической болезни, патологии щитовидной железы, невротических
расстройствах, опухолях головного мозга, рассеянном склерозе, паркинсонизме и
ряде других заболеваний [55-60].
ЗАКЛЮЧЕНИЕ
Подводя итог рассмотрению физиологических механизмов
вариабельности ритма сердца необходимо отметить, что несмотря на многолетние
многочисленные работы, выполненные в этой области, механизмы вариабельности
ритма сердца не расшифрованы и до сих пор идут дискуссии в литературе о значении
тех или иных положений, объясняющих вариабельность ритма сердца. Правда надо
заметить, что на сегодняшний день бесспорными является целый ряд моментов. В ВРС
имеются периодические и непериодические составляющие. Периодические составляющие
ВРС, выделенные на основании кратковременных записей в состоянии покоя,
представлены высокочастотными, низкочастотными и очень низкочастотными
колебаниями, как правило, имеющими периодичность в 0,2-0,4 Гц, 0,04-0,15 и
0,003-0,04 Гц соответственно. Для их обнаружения наиболее оптимальной является
процедура спектрального анализа ритма сердца с использованием преобразования
Фурье. Высокочастотные колебания сопряжены с дыханием и отражают преимущественно
влияния парасимпатической системы на сердечную мышцу. Низкочастотные колебания
связаны с активностью постганглионарных симпатических волокон и отражают
модуляцию сердечного ритма симпатической нервной системой. Генез очень
низкочастотных колебаний до сих пор неясен и, вероятнее всего, связан с влиянием
надсегментарных (в первую очередь гипоталамических) центров автономной
(вегетативной) регуляции. Непериодические составляющие ВРС отражают случайные
события, связанные с рефлекторными воздействиями на ЧСС факторов внутренней или
внешней среды (экстрасистол, глотательных движений, перистальтики кишечника,
звуковых или световых раздражителей и др.). Так как они существенно изменяют
результаты анализа ВРС влияние этих факторов должно быть непременно устранено.
При невозможности устранения этих влияний связанные с ними изменения ЧСС должны
исключаться из анализа. Сейчас твердо установлены закономерные изменения ВРС при
ряде распространенных заболеваний: полиневропатиях, синкопальных состояниях,
инфаркте миокарда. Целесообразность обязательного использования результатов
исследования ВРС при других заболеваниях является пока что дискутабельной.
Таким образом, остается еще много нерешенных проблем, которые
требуют тщательной проработки и поэтому исследования в этой области обязательно
должны продолжаться.
ЛИТЕРАТУРА:
Haller A. Elementa physiologiae corporis humani: In 8 t. –
Lausanne: S. d’ Arnay, 1760. - T. 2, lib.6 - P. 330-332.
Анализ сердечного ритма / Под ред. Д. Жемайтите, Л.
Тельксниса. – Вильнюс : Мокслас, 1982. – 130 с.
Миронова Т.Ф., Миронов В.А. Клинический анализ волновой
структуры синусового ритма сердца: (Введение в ритмокардиографию и атлас
ритмокардиограмм). – Челябинск : Дом печати, 1998. – 162 с.
Ludwig C. Beitrage zur Kenntnis des Einflusses der
Respirationsbewegungen auf den Blutlauf im Aorten-systeme // Arch. Anat. Physiol.
- 1847. – S. 242-302.
Traube L. Uber periodische Tatigkeits - Aeusserungen des
vasomotorischen und Hemmungs-Nervenzentrums. Zents. - Bl. med. Wiss., 1865. - Ig.
3, N 56, - S. 881-885.
Hering E. Uber den Einfluss der Atumung auf den Kreislauf. I.
Mittheilung. Uber Athembewegungen des Gefassystems // S. - Ber. Akad. Wiss. (Wien).
Math. - naturwiss. - Kl. 2. Abt. 2. - 1869. - Bd 60. - S. 829-856.
Mayer S.S. D. Akad. Wiss. Wien, 74: 302, 1876.
Fleisen A., Beckmann R. Die raschen Schwankungen der
Pulsfrequensregistiert mit dem Pulsfettschreiber // Ztsch. Ges. exp. Med. -
1932. - Bd. 80. - S. 487-510.
Марпл С. Л. Цифровой спектральный анализ и его приложения /
Пер. с англ. О. И. Хабарова, Г.А. Сидоровой; Под ред. И. С. Рыжака. - М. : Мир,
1990. - 584 c.
Sayers B. Analysis of heart rate variability // Ergonomics. –
1973. – Vol. 16, N 1. – P. 17-32.
Heart Rate Variability. Standards of measurements,
physiological interpretation, and clinical use / Task Force of the European
Society of Cardiology and the North American Society of Pacing and
Electrophysiology // Circulation. - 1996. – Vol. 93. – P. 1043-1065.
Chess G. F., Tam R.M., Carlaresu F.R. Influence of cardiac
neural inputs on rhythmic variations of heart period in cat // Am. J. Physiol. -
1975. - Vol. 228. - N3. - P. 775 - 780.
Akselrod S.D., Gordon D., Ubel F.A. et al. Power spectrum
analysis of heart rate fluctuation: A quantitative probe of beat-to-beat
cardiovascular control // Science. – 1981. – Vol. 213, N 4503. – P. 220-222.
Rimoldi О., Pierini S., Ferrary A. et al. Analisis of shot -
term oscillations of R - R and arterial pressure in conscious dogs // Am. J.
Phisiol. - 1990. - Vol. 258, N 4 (Pt.2). - P. H967 - H976.
Ноздрачев А. Д. Аксон-рефлекс. Новые взгляды в старой области
// Физиологический журнал. - 1995. - Т. 81, N 11. - С. 136-144.
Anrep G.V., Pascual W., Rossler R. Respiratory variation of
the heart rate. II. The reflex mechanism of the respiratory arrhythmia // Proc.
Roy. Soc. B: Biol. Sci. - 1936. - Vol. 119, N 813. - P. 191-217.
Richter D. W., Spyer K. M. Cardiorespiratory control //
Central regulation of autonomic functions. – N.Y. : Oxford Univ. Press, 1990. –
P. 189-207.
Montano N., Gnecchi Ruscone T., Porta A., et al. Presence of
vasomotor and respiratory rhythms in the discharge of single medullary neurons
involved in the regulation of cardiovascular system // J. Auton. Nerv. Syst. –
1996. – Vol. 57, N 1/2. – P. 116-122.
Melcher A. Carotid baroreflex heart rate control during the
active and the assisted breathing cycle in man // Acta Physiol. Scand. - 1980. -
Vol. 108, N 2. - P. 165-171.
Akselrod S. Components of heart rate variability // Heart
rate variability. - N. Y. : Armonk., 1995. - P. 146-164.
Хаютин В.М., Лукошкова Е.В. Спектральный анализ колебаний
частоты сердцебиений: физиологические основы и осложняющие его явления // Рос.
физиол. журн. - 1999. - Т. 85, N 7. - C. 893-908.
Lucy S.D., Hughson R.L., Kowalchuk J.M., et al. Body position
and cardiac dynamic and chronotropic responses to steady-state isocapnic
hypoxaemia in humans // Exp. Physiol. - 2000. - Vol. 85, N 2. - P. 227-37.
Al-Ani M., Forkins A.S., Townend J.N., Coote J.H. Respiratory
sinus arrhythmia and central respiratory drive in humans // Clin. Sci (Colch). -
1996. - Vol. 90, N 3. - P. 235-41.
Ноздрачев А.Д., Погорелов А.П. Нейрональная активность
внутрисердечных ганглиев изолированного предсердия лягушки // Физиологический
журн. СССР. - 1981. - Т. 68, N 2. - С. 192-198.
Ноздрачев А.Д., Погорелов А.П. Особенности нейрональной
организации внутрисердечных ганглиев млекопитающих // Физиология вегетативных
ганглиев : Тез. докл. Всесоюз. симпоз. - Киев, 1981. - С. 28-29.
Karemaker J.M. Analysis of blood pressure and heart rate
variability: theoretical consideration and clinical applicability // Clinical
autonomic disorders. Evaluation and management / Ed. P. A. Low. - Boston etc.:
Little Brown and Co., 1993. - P. 315-330.
Preiss G., Polosa C. Patterns of sympathetic neuron activity
associated with Mayer waves. // Am. J. Physiol. - 1974. - Vol. 226, N 3. - P.
724-730.
Pagani M., Lombardi E., Guzzetti S. et al. Power spectral
analysis of heart rate and arterial pressure variabilities as a marker
sympatho-vagal interaction in man and conscious dog // Circ. Res. – 1986. – Vol.
59, N 2. – P. 178-193.
Lombardi F., Montano N., Fnocchiaro M.L. et al. Spectral
analysis of sympathetic discharge in decerebrate cats // J. Auton. Nerv. Syst. –
1990. – Vol. 30, Suppl. – P. S97-S100.
Saul J.P., Rea R.F., Eckberg D.L. et al. Heart rate and
muscle sympathetic nerve variability during reflex changes of autonomic activity
// Am. J. Physiol. – 1990. – Vol. 258. – P. H713-H721.
Burke D., Sundlof G., Wallin B.G. Postural effects on muscle
nerve sympathetic activity in man // J. Physiol. - 1977. - Vol. 272, N 2. - P.
399-414.
Borst C., Karemaker J.M. Time delays in the human
baroreceptor reflex // J. Auton. Nerv. Syst. – 1983. – Vol. 9, N 2/3. – P. 399 –
409.
De Boer R.W., Karemaker J.M., Strackee J. Hemodynamic
fluctuations and baroreflex sensitivity in humans: a beat-to-beat model // Am. J.
Physiol. - 1987. - Vol. 253, N 3 (Pt.2). – P. H685-H687.
Cevese A., Grasso R., Poltronieri R., Schena F. Vascular
resistance and arterial pressure low-frequency oscillations in the anesthetized
dog // Am. J. Physiol. - 1995. - Vol. 268, N 1. - P. H7-H16.
Cooley R. L., Montano N., Cogliati C. et. al. Evidence for a
central origin of the low-frequency oscillation in RR-interval variability //
Circulation. - 1998. - Vol. 98, N 6. - P. 556-561.
Janssen B.J.A., Oosting J., Slaff D.W. et al. Hemodynamic
basis of oscillations in systemic arterial pressure in conscious rats // Am. J.
Physiol. - 1995. - Vol. 269, N 1 (Pt.2). – P. H62-H71.
Pomeranz B., Macaulay R.J.B., Caudill M.A. et al. Assessment
of autonomic function in humans by heart rate spectral analysis // Am. J.
Physiol. - 1985. - Vol. 248, N 1 (Pt.2). - P. H151-H153.
Котельников С.А., Ноздрачев А.Д., Одинак М.М., Шустов Е.Б.
Вызванные кожные вегетативные потенциалы (современные представления о
механизмах) // Физиология человека. - 2000. - Т. 26, N 5. - C. 79-91.
Pagani M., Montano N., Porta A. et al. Relationship between
spectral components of cardiovascular variabilities and direct measures of
muscle sympathetic nerve activity in humans // Circulation. – 1997. – Vol. 95, N
6. – P. 1441 – 1448.
Montano N., Ruscone T.G., 1994 Porta A. et al. Power spectrum
analysis of heart rate variability to assess the changes in sympathovagal
balance during graded orthostatic tilt // Circulation. -. - Vol. 90, N 4. - P.
1826-1831.
Баевский Р.М., Кириллов О.И., Клецкин С.З. Математический
анализ изменений сердечного ритма при стрессе. - М. : Наука, 1984. - 221 с.
Хаспекова Н.Б. Регуляция вариативности ритма сердца у
здоровых и больных с психогенной и органической патологией мозга // Автореферат
дис. … д-ра мед. наук. - М., 1996. - 48 с.
Van den Berg D.T.W.M., de Rloet E.R., van Dijken H.H., de
Jong W. Brain corticosteroid receptors and regulation of arterial blood pressure
// J. Hypertens. – 1989. – Vol. 7, Suppl. 6. – P. S202 – S203.
Навакатикян А.О., Крыжановская В.В. Возрастная
работоспособность умственного труда. – Киев : Здоровья, 1979. – 207 с.
Bealer S.L. Anteroventral third ventricle periventricular
tissue contributes to cardiac baroreflex responses // Clin. Exp. Pharmacol.
Physiol. - 2000. - Vol. 27, N 5/6. - P. 460-464.
Meltzer S. Die Irradiationen des Schluckcentrums und ihre
allgemeine Bedeutung // Arch. Physiol. – 1883. – S. 209-238.
Прийяма Г.Я. О рефлекторных влияниях на сердце и сосуды при
акте глотания у здоровых и больных людей // Ученые записки сталинградского
государственного педагогического института. – 1959. – Вып. 9. – С. 230-262.
Wolf M.M., Varigos G.A., Hunt D., Sloman J.G. Sinus
arrhythmia in acute myocardial infarction // Med. J. Aust. - 1978. - Vol. 2, N
2. - P. 52-53.
Одинак М.М., Котельников С.А.,
Наумов К.М., Мантонин Е.А. Использование спектрального анализа ритма сердца в
неврологической практике // Современные подходы к диагностике и лечению нервных
и психических заболеваний. Материалы конференции. - СПб, 2000. - С. 470-471.
Одинак М.М., Дыскин Д.Е., Котельников С.А. Пароксизмальные
расстройства сознания неэпилептической природы (синкопы) // Одинак М.М., Дыскин
Д.Е. Эпилепсия: Этиология. Патогенез. Клиника. Дифференциальная диагностика.
Медикаментозное лечение. – СПб. : Политехника, 1997. - С. 128-163.
Котельников С.А., Мантонин Е.А. Дифференциальная диагностика
синкопальных состояний с помощью спектрального анализа ритма сердца //
Современные подходы к диагностике и лечению нервных и психических заболеваний.
Материалы конференции. - СПб, 2000. - С. 463-465.
Ewing D.J., Neilson J.M.M., Travis P. New method for
assessing cardiac parasympathetic activity using 24-hour electrocardiograms //
Br. Heart J. - 1984. - Vol. 52, N 4. - P. 396-402.
Pagani M., Malfatto G., Pierini S. et al. Spectral analysis
of heart rate variability in the assessment of autonomic diabetic neuropathy //
J. Auton. Nerv. Syst. - 1988. - Vol. 23, N 2. - P. 143-153.
Baharav A., Mimouni M., Lehrman-Sagie T., Izraeli S.,
Akselrod S. Spectral analysis of heart rate in vasovagal syncope: the autonomic
nervous system in vasovagal syncope // Clin. Auton. Res. – 1993. – Vol. 3, N 4.
– P. 261-269.
Flachenecker P., Hartung H.P., Reiners K. Power spectrum
analysis in heart rate variability in Guillain-Barre syndrome. A longitudinal
study // Brain. – 1997. – Vol. 120, Pt 10. – P. 1885-1894.
Spallone V., Menzinger G. Diagnosis of cardiovascular
autonomic neuropathy in diabetes // Diabetes. – 1997. – Vol. 46, Suppl 2. – P.
S67-S76.
Хаспекова Н.Б., Алиева X.К., Дюкова Г.М. Оценка симпатических
и парасимпатических механизмов регуляции при вегетативных пароксизмах //
Советская медицина. – 1989. – N 9. – С. 25-28.
Окнин В.Ю., Внотченко С.Л., Садеков Р.К. Сравнительный анализ
состояния вегетативной нервной системой у больных тиреотоксикозом и с
вегетативными кризами // Терапевтический архив – 1994. – T.66, N 10. – С. 29-32.
Frontoni M., Fiorini M., Strano S. et al. Power spectrum
analysis contribution to the detection of cardiovascular dysautonomia in
multiple sclerosis // Acta Neurol. Scand. – 1996. – Vol. 93, N 4. – P. 241-245.
Grimm D.R., De Meersman R.E., Almenoff P.L., et al.
Sympathovagal balance of the heart in subjects with spinal cord injury // Am. J.
Physiol. – 1997. – Vol. 272, N 2 (Pt 2). – P. H835-H842.
РЕЗЮМЕ
В статье рассматриваются физиологические механизмы
вариабельности ритма сердца (ВРС). Детально анализируются данные литературы,
результаты собственных исследований, а также приводится история изучения
вопроса. Особое внимание уделено спектральному анализу ритма сердца.
Рассматриваются периодические и непериодические составляющие ВРС, обсуждаются
различные точки зрения и положения, объясняющие эти процессы. Делается вывод,
что, несмотря на многолетние многочисленные работы, выполненные в этой области,
механизмы ВРС не расшифрованы. На сегодняшний день общепризнанным является целый
ряд моментов. Периодические составляющие ВРС, выделенные на основании
кратковременных записей в состоянии покоя, представлены высокочастотными,
низкочастотными и очень низкочастотными колебаниями. Для их обнаружения наиболее
оптимальной является процедура спектрального анализа ритма сердца с
использованием преобразования Фурье. Высокочастотные колебания сопряжены с
дыханием и отражают преимущественно влияния парасимпатической системы на
сердечную мышцу. Низкочастотные колебания связаны с активностью
постганглионарных симпатических волокон и отражают модуляцию сердечного ритма
симпатической нервной системой. Генез очень низкочастотных колебаний до сих пор
неясен и, вероятнее всего, связан с влиянием надсегментарных (в первую очередь
гипоталамических) центров автономной регуляции. Непериодические составляющие ВРС
отражают случайные события, связанные с рефлекторными воздействиями на ЧСС
факторов внутренней или внешней среды. Они существенно изменяют результаты
анализа ВРС, поэтому влияние этих факторов должно быть устранено. В заключение
делается вывод о том, что остается еще много нерешенных проблем, которые требуют
тщательной проработки и поэтому исследования в этой области обязательно должны
продолжаться.
АВТОРЫ:
Котельников Сергей Анатольевич - преподаватель кафедры
нервных болезней Военно-медицинской академии, кандидат медицинских наук.
Служебный адрес: 194175, Санкт-Петербург, Лесной проспект 2, клиника нервных
болезней ВМедА e-mail: sergekm@mail.ru
Ноздрачев Александр Данилович - действительный член Академии
наук Российской федерации, профессор, заведующий кафедрой общей физиологии
Санкт-Петербургского государственного университета.
Одинак Мирослав Михайлович - начальник кафедры нервных
болезней Военно-медицинской академии, Главный невропатолог МО РФ, заслуженный
врач РФ, профессор, доктор медицинских наук.
Шустов Евгений Борисович - начальник отдела № 5
психофармакологии НИЛ-7 Военно-медицинской академии, доктор медицинских наук,
профессор.
Коваленко Игорь Юрьевич – начальник лаборатории ГосНИИ
прикладных проблем, кандидат медицинских наук.
Давыденко Владислав Юрьевич – врач-интерн факультета
профессиональной переподготовки и повышения квалификации Военно-медицинской
академии.
Опубликовано: Физиология человека. – 2002. – Т 28, N 1. – С.
130-143
Рис. 1
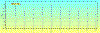

Рис. 2
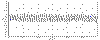


Рис. 3


Рис. 4
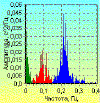
Рис. 5
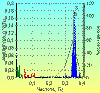
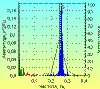
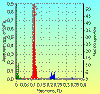
Рис. 6
Рис. 7
Рис. 8
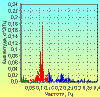
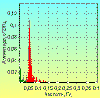
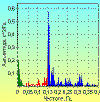
Рис. 9
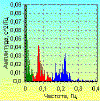
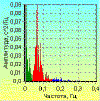
Рис. 10