Исследование моторно-эвакуаторной
функции желудочно-кишечного тракта у больных с
осложненным колоректальным раком
А.М. Беляев, В.М. Луфт, О.В. Бабков, А.А,
Захаренко, Д.А. Суров, А.А. Доманский, О.А. Тен,
А.А. Трушин, С.А.Кондрацов, Д.А. Рудаков, С.А.
Иваницкий, А.В. Лапицкий
Клиника неотложной онкологии (руководитель – проф.
А.М. Беляев) НИИ СП им. И.И. Джанелидзе, г.
Санкт-Петербург, ул. Будапештская, д. 3. Бабков Олег
Владимирович 8 (911) 281 31 97; e-mail:
oleg.babckov@yandex.ru
Резюме. В послеоперационном периоде у больных
колоректальным раком, осложненным острой кишечной
непроходимостью, возникает нарушение
моторно-эвакуаторной функции желудочно-кишечного
тракта, проявляющееся послеоперационным парезом,
который является одним из наиболее часто
встречающихся послеоперационных осложнений у данной
категории больных и ведет к возникновению
инфекционно-воспалительных осложнений в
послеоперационном периоде и высокой летальности.
Наличие послеоперационного пареза диктует
необходимость проведения мероприятий, направленных
на его коррекцию, в том числе применение в
послеоперационном периоде ранней энтеральной терапии
и нутриционной поддержки, как патогенетически
обусловленного метода профилактики данного
осложнения. Разработанная методика проведения
энтерального питания, учитывает особенности данной
категории больных, наличие у них исходной
недостаточности питания, кишечной недостаточности и
заключается в проведении ранней энтеральной терапии
и нутритивной поддержки. Объективно оценить наличие
моторно-эвакуаторных нарушений желудочно-кишечного
тракта помогает регистрация его миоэлектрической
активности путем непрямой электрогастроэнтерографии.
Проведение разработанного комплекса мероприятий
ранней энтеральной терапии и нутритивной поддержки у
больных опухолевой кишечной непроходимостью в
послеоперационном периоде позволяет более быстро
восстановить нарушенную моторно-эвакуаторную функцию
ЖКТ.
Ключевые слова: колоректальный рак, энтеральная
терапия, нутриционная поддержка, послеоперационный
парез, кишечная непроходимость,
инфекционно-воспалительный осложнения, искусственное
лечебное питание, миоэлектрическая активность,
электрогастроэнтерография.
INVESTIGATION OF THE MOTOR-EVACUATION FENCTION OF
THE GASTROINTESTINAL TRACT IN PATIENTS WITH
COMPLICATED COLORECTAL CANCER
A.M. Belayev, V.M. Luft, O.V. Babkov, A.A.
Zacharenko, D.A. Surov, A.A. Domanskii, O.A.Ten,
A.A. Trushin, S.A. Kondratsov, D.A. Rudakov, S.A.
Ivanitskii, A.V. Lapitskii
Djanelidze Research Institute of Emergency Medicine,
Saint Petersburg, Russia
Abstract. During the postoperative period in
patients with colorectal cancer complicated by acute
intestinal obstruction there is a lesion of the
motor-evacuation function of the gastrointestinal
tract manifesting with postoperative paresis, which
is one of the most common postoperative
complications in these patients and leads to a large
number of pyoinflammatory complications in the
postoperative period and high mortality. The
presence of postoperative paresis dictates the need
for measures aimed at its correction – in particular,
the use of postoperative early enteral therapy and
nutritional support as the pathogenetically
specified method of prevention of this complication.
The developed technique of enteral nutrition takes
into account the specifics of this category of
patients, their present initial malnutrition,
intestinal failure and is to hold early enteral
therapy and nutritional support. The registration of
myoelectrical activity of the gastrointestinal tract
through the indirect electrogastroenterography helps
to evaluate the degree the motor-evacuation
disorders objectively. Execution of the developed
complex of early enteral therapy and nutritional
support measures in patients with malignant
intestinal obstruction in the postoperative period
allows the faster restoration of impaired
motor-evacuation function of the gastrointestinal
tract.
Key words: colorectal cancer, enteral therapy,
nutritional support, postoperative paresis,
intestinal obstruction, pyoinflammatory
complications, artificial nutritional therapy,
myoelectrical activity, electrogastroenterography.
Введение. В структуре заболеваемости
злокачественными новообразованиями населения
различных стран мира рак ободочной кишки занимает
третье место, после рака легких и молочной железы
[1, 2]. В общей структуре смертности населения
России от злокачественных новообразований в 2007
году рак ободочной составил 5,6%, рак прямой кишки
5,4% [3, 4]. По данным литературы при данной
патологии летальность больных достигает 15-50%, а
частота послеоперационных инфекционно-воспалительных
осложнений при выполнении операций по поводу острой
кишечной непроходимости достигает 38 - 80% [2, 5, 6,
7, 8, 9, 10,]. При поступлении в стационар у 50-80%
онкологических больных наблюдаются исходные признаки
белково-энергетической недостаточности, которые, как
правило, усугубляются в послеоперационном периоде
вследствие относительно длительного вынужденного их
голодания и имеющихся явлений гиперметаболического
гиперкатаболизма [12, 13,].
Парез желудочно-кишечного тракта является одним
из наиболее часто встречающихся осложнений
послеоперационного периода [2]. Именно нарушение
автономной координационной регуляции
моторно-эвакуаторной функции желудочно-кишечного
тракта, проявляющегося блокадой генерации
мигрирующего миоэлектрического комплекса, является
одним из звеньев патогенеза синдрома кишечной
недостаточности при колоректальном раке, осложненным
острой кишечной непроходимостью.
Анализируя неудовлетворительные результаты в
разрешении послеоперационных парезов, клиницисты
связывают их с двумя основными причинами. Во-первых,
в широкой клинической практике доминирует
стандартный подход врачей к выбору лечебных
мероприятий без учета патогенеза заболевания.
Во-вторых, практический опыт лечения
послеоперационных парезов свидетельствует о том, что
борьба с ним начинается лишь тогда, когда они уже
развиваются, в то время как мероприятия по лечению
парезов должны проводиться в раннем
послеоперационном периоде до появления клинических
признаков пареза. До настоящего времени объективные
методы контроля за состоянием деятельности органов
желудочно-кишечного тракта мало внедрены в
клиническую практику.
Одним из высокоэффективных методов профилактики
послеоперационного пареза и связанных с ним
инфекционно-воспалительных осложнений является
ранняя энтеральная терапия и нутриционная поддержка
[11].
Цель исследования. Оценить динамику
изменений моторно-эвакуаторной функции
желудочно-кишечного тракта у больных колоректальным
раком, осложненным острой кишечной непроходимостью в
послеоперационном периоде и доказать эффективность
применения ранней энтеральной терапии и нутриционной
поддержки для коррекции послеоперационного пареза
желудочно-кишечного тракта у данной категории
больных.
Материалы и методы. Исследование выполнено
на основе сравнительного проспективного анализа
лечения 119 больных с диагнозом колоректальный рак,
оперированных по поводу острой кишечной
непроходимости в клинике неотложной онкологии НИИ
скорой помощи им. И.И. Джанелидзе в 2007-2008 годах
(руководитель – профессор Беляев А.М.).
Энтеральная терапия и нутриционная поддержка
осуществлялись с помощью зонда Эббота-Миллера, либо
с помощью силиконового зонда (ЗКС-15),
установленного интраоперационно на 30-40 см
дистальнее связки Трейтца. Одновременно с этим для
декомпрессии желудка устанавливался желудочный зонд.
Энтеральная терапия начиналась интраоперационно.
После установки интестинального зонда проводилась
эвакуация кишечного содержимого, затем осуществлялся
кишечный лаваж глюкозо-электролитным раствором (Регидрон),
содержащим 1г аскорбиновой кислоты и 10 мл
Цитофлавина.
Энтеральная терапия в первые сутки
послеоперационного периода включала в себя
декомпрессию желудка, кишечный лаваж и энтеросорбцию
(Смекта). Кишечный лаваж осуществлялся путем
фракционного (капельного) введения указанного ГЭР со
скоростью 90-100 мл/час в объеме 500,0 мл троекратно
в течение первых суток с последующим пассивным
оттоком кишечного содержимого.
Для обеспечения внутрипросветной регенераторной
трофики кишки и сохранения кишечного барьера,
начиная с первых суток, к ГЭР добавляли минимальное
количество (200,0 мл) 20% олигомерной питательной
смеси Нутриэн Элементаль. Инфузия осуществлялась в
назоинтестинальный зонд со скоростью 60 мл/ч, с
последующим пассивным оттоком кишечного содержимого.
Контроль усвоения питательной смеси производился по
определению остаточного объема. В случае если сброс
по кишечному зонду составлял более 50 % введенного
за 1 час объема питательной смеси, сохранялся
прежний темп интестинальных инфузий в режиме лаважа.
При усвоении питательной смеси (сброс менее 50%)
на следующие сутки количество вводимой
изокалорической олигомерной смеси увеличивали до
600-800 мл/сут (10,0 ккал/кг), с обязательным
контролем остаточного объема, что, как правило,
составляло около 40% от расчетной величины суточной
потребности больных.
При хорошей переносимости больными олигомерной
питательной смеси на третьи сутки переходили на
введение изокалорической полимерной
сбалансированной смеси в объеме 1000,0 мл (Нутризон
Стандарт - 15,0 ккал/кг) с одновременным увеличением
скорости инфузии до 90 мл/ч. При этом объём
субстратного обеспечения больных составлял 50-60% от
расчетной величины.
На четвертые сутки послеоперационного периода при
хорошей переносимости зондового питания переходили
на введение гиперкалорической гипернитрогенной
полимерной питательной смеси в объеме 1000,0 мл (Нутризон
Энергия с пищевыми волокнами 20,0 ккал/кг) с
сохранением прежней скорости инфузии. Объём
субстратного обеспечения при этом, как правило,
достигал 70-80% от расчетной величины.
На пятые сутки при осознанной возможности
больного самостоятельно питаться назоинтестинальный
зонд извлекался, назначался лечебный рацион (диета
№1 по Певзнеру) с дополнительным приемом
гиперкалорической гипернитрогенной полимерной ПС по
200,0 мл 3 раза в сутки (Нутризон Энергия с пищевыми
волокнами 10-15 ккал/кг) методом сипинга. Объём
субстратного обеспечения при этом у большинства
больных практически достигал 100% от расчетной
величины.
Для оценки эффективности разработанной методики
ранней энтеральной терапии и нутриционной поддержки
было произведено разделение больных на контрольную и
основную группы.
Контрольную группу составили 56 пациентов. В
данной группе лечение проводилось традиционным
способом, без использования методики ранней
энтеральной терапии и нутриционной поддержки. Мужчин
было 22 (39,3%), женщин - 34 (60,7%). Средний
возраст составил 70,7 ± 4,5 лет. В первые сутки
заболевания госпитализировано 19,6% больных, а в
течение трех суток – 37,5% больных. Наличие
отдаленных метастазов в контрольной группе было
выявлено у 16 пациентов (28,6%). Эйтрофичный статус
питания был выявлен у 13 больных (23,2%).
Основную группу составили 63 больных. У данной
категории больных в послеоперационном периоде помимо
стандартной инфузионной, антибактериальной терапии
проводились мероприятия ранней энтеральной терапии и
нутриционной поддержки. Мужчин было 25 (39,7%),
женщин - 38 (60,3%). Средний возраст составил 70,1 ±
4,1 лет. В первые сутки заболевания
госпитализировано 20,6% больных, а в течение трех
суток – 31,7% больных. Наличие отдаленных метастазов
в основной группе было выявлено у 17 пациентов
(27,0%). Эйтрофичный статус питания был выявлен
только у 14 больных (22,2%).
Контрольная и основная группы больных с
колоректальным раком, осложненным острой кишечной
непроходимостью, были идентичны по полу, возрасту,
длительности заболевания, распространенности
онкологического процесса, исходному трофологическому
статусу, характеру выполненных операций и сравнение
этих групп корректно.
С целью сравнительной оценки влияния ранней
энтеральной терапии и нутриционной поддержки на
моторно-эвакуаторную функцию ЖКТ нами было
произведено исследование миоэлектрической активности
различных отделов ЖКТ. Исследования проводили у всех
больных на 1, 3 и 5 сутки послеоперационного
периода. Регистрацию миоэлектрической активности
проводили с помощью гастроэнтеромонитора ГЭМ 01 “Гастроскан-ГЭМ”.
Периферическая ЭГЭГ основана на принципе
измерений электрического потенциала с поверхности
кожных покровов верхних и
нижних конечностей или передней брюшной стенки пациента.
Методика включает в себя тощаковое исследование
продолжительностью 40 минут. Для проведения
исследования электроды располагаются на обезжиренных
и покрытых электропроводной пастой участках кожи:
№ 1 (измерительный) – в нижней трети правого
предплечья по медиальной поверхности;
№ 2 (измерительный) – в нижней трети правой
голени по медиальной поверхности;
№ 3 (нейтральный) – в нижней трети левой голени
по медиальной поверхности.
Выбор данных отведений обусловлен тем, что в них
регистрируемый сигнал имеет наибольшую
интенсивность. Регистрацию начинают через 5 минут
после установки электродов.
Оцениваемый сигнал обрабатывается оригинальной
программой с использованием алгоритмов быстрого
преобразования Фурье и Вейвлет анализа. Данные
обработки сигнала представляются в виде таблиц
числовых величин и графиков, показывающих спектр
сигнала по мощности, частоте и амплитуде в периоды
пищеварительной активности и покоя. Одним из
преимуществ метода является разработка алгоритма
пользовательского и автоматического удаления
артефактов с сохранением как исходного, так и
обработанного сигнала, что позволяет более точно
оценивать получаемые результаты, особенно при
анализе длительного мониторинга моторной функции.
При анализе сигнала по мощности использовались
показатели:
- Суммарный уровень электрической активности (Ps)
– характеризующий общий суммарный уровень
электрической активности органов ЖКТ за все время
исследования.
- Электрическая активность по отделам ЖКТ (Pi) –
отражает электрическую активность отделов ЖКТ,
этот показатель рассчитывается отдельно для
каждого органа: желудок, двенадцатиперстная,
тощая, подвздошная и толстая кишка.
В результате спектрального анализа полученных
данных рассчитывалась мощность электрического
сигнала по каждому частотному отделу Pi (т.е. по
частотам, характерным для желудка,
двенадцатиперстной, тощей, подвздошной и толстой
кишки) и суммарная мощность Ps.
Суммарная мощность электрического сигнала
(суммарная электрическая активность) позволяла
оценить уровень базальной электрической активности.
Отношение абсолютных значений электрической
активности в каждом отделе ЖКТ к суммарной
активности представляет, достоверно стабильные
относительные показатели электрической активности.
Оценка указанных показателей позволяет в
достаточной мере достоверно судить о тонической и
перистальтической составляющих моторной функции
желудочно-кишечного тракта.
Прибор обеспечивает прием и регистрацию сигнала с
накожных электродов, а также хранение, обработку и
документальное представление получаемой информации.
Для отработки исходно нормативных параметров
миоэлектрической активности различных отделов ЖКТ
была отобрана группа практически здоровых
добровольцев в количестве 30 здоровых людей, возраст
которых составлял от 57 до 74 лет (средний возраст -
72,1±4,3 лет). Исследование проводилось в утренние
часы, натощак, на период исследования исключалось
курение.
Средние показатели миоэлектрической активности
различных отделов ЖКТ в контрольной приведены в
табл. 1.
Таблица 1. Средние показатели
миоэлектрической активности ЖКТ
| Отдел |
Полученная норма |
| Желудок |
9,8±1,7 мВт |
| Двенадцатиперстная кишка |
0,8±0,2 мВт |
| Тощая кишка |
2,6±0,7 мВт |
| Подвздошная кишка |
8,6±0,9 мВт |
| Толстая кишка |
16,1±1,7 мВт |
Результаты и их обсуждение.
1. Сравнительная характеристика миоэлектрической
активности желудочно-кишечного тракта на первые
сутки послеоперационного периода (рис.1).
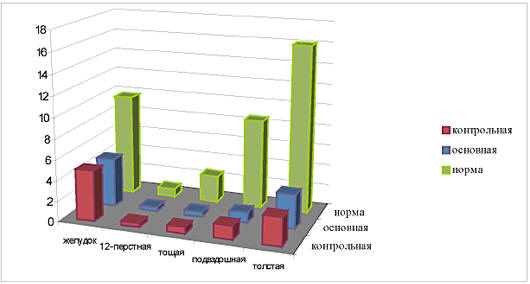
Рис. 1. Динамика изменений
миоэлектрической активности на первые сутки
послеоперационного периода
У больных основной и контрольной групп на 1 сутки
послеоперационного периода миоэлектрическая
активность различных отделов желудочно-кишечного
тракта достоверно не отличалась (соответственно Pi
желудка - 4,7±1,4 мВт и 4,9±1,2 мВт;
двенадцатиперстной кишки - 0,4±0,14 мВт и 0,4±0,11
мВт; тощей кишки - 0,5±0,15 мВт и 0,6±0,2 мВт;
подвздошной кишки - 1,0±0,17 мВт и 1,3±0,3 мВт;
толстой кишки - 3,3±0,67 мВт и 2,7±0,55 мВт; р>0,05)
и была значительно ниже нормы, что характерно для
послеоперационного периода и, в первую очередь,
связано с перенесенным оперативным вмешательством.
2. Сравнительная характеристика миоэлектрической
активности желудочно-кишечного тракта на третьи
сутки послеоперационного периода (рис. 2).
В дальнейшем наблюдалось увеличение показателей
миоэлектрической активности у больных обеих групп,
но у пациентов основной группы этот рост происходил
более быстро и практически достигал нормы к 3
суткам, достоверно отличаясь от показателей больных
контрольной группы (соответственно желудок -
9,2±1,7 мВт и 6,3±1,5 мВт; двенадцатиперстная кишка
- 0,9±0,25 мВт и 0,5±0,13 мВт; тощая кишка - 2,8±0,7
мВт и 1,5±0,4 мВт; подвздошная кишка - 7,4±1,3 мВт и
3,1±0,75 мВт; толстая кишка - 14,1±1,8 мВт и 7,9±1,2
мВт; р<0,05).
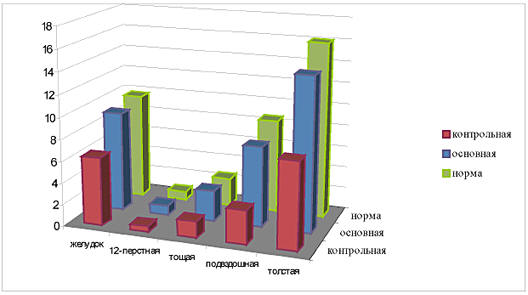
Рис. 2. Динамика изменений
миоэлектрической активности на третьи сутки
послеоперационного периода
3. Сравнительная характеристика миоэлектрической
активности желудочно-кишечного тракта на пятые сутки
послеоперационного периода (рис. 3).
К 5 суткам послеоперационного периода оба
показателя соответствовали норме и статистически
друг от друга не отличались у основной и контрольной
групп сравнения (соответственно желудок - 11,2±2,3
мВт и 8,2±1,9 мВт; двенадцатиперстная кишка
-1,2±0,35 мВт и 0,9±0,3 мВт; тощая кишка - 3,1±1,1
мВт и 2,4±0,7; подвздошная кишка -9,0±1,5 мВт и
7,2±1,1 мВт; толстая кишка - 18,6±2,1 мВт и 16,3±1,8
мВт; р>0,05).
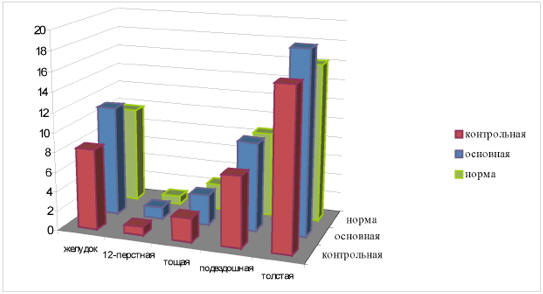
Рис. 3. Динамика изменений
миоэлектрической активности на пятые сутки
послеоперационного периода
Таким образом, полученные данные свидетельствуют,
о том, что применение ранней энтеральной терапии и
нутриционной поддержки позволяет ускорить
нормализацию миоэлектрической активности различных
отделов желудочно-кишечного тракта и, как следствие,
восстановить моторно-эвакуаторную функцию ЖКТ, что
проявляется более ранней нормализацией показателей
миоэлектрической активности у больных основной
группы по сравнению с контрольной (на 3 и 5 сутки
послеоперационного периода соответственно).
Своевременное начало энтеральной терапии
обеспечивает скорейшее восстановление структурной
целостности пищеварительной системы, оптимизируя
полифункциональную деятельность этого центрального
гомеостазирующего органа.
Выводы.
- Послеоперационный период у больных
колоректальным раком, осложненным острой кишечной
непроходимостью, характеризуется наличием пареза
кишечника, который купируется при проведении
стандартной терапии только на 5 сутки
послеоперационного периода.
- Применение ранней энтеральной терапии и
нутриционной поддержки позволяет к 3 суткам
нормализовать миоэлектрическую активность
различных отделов ЖКТ и, как следствие,
моторно-эвакуаторную функцию кишечника.
Литература.
- Белов С.Г., Бардюк А.Я. Тактика лечения
больных повышенного операционного риска при
опухолях толстой кишки, осложненных
непроходимостью // Материалы 19 съезда хирургов
Украины. – Харьков, 2000. – С. 117–118.
- Borie F., Tretarre B., Marchigano E. et al.
Management and prognosis of colon cancer in
patients with intestinal obstructions or
peritonitis: A French population-based study //
Med. Sci. Monit. – 2005. – Vol. 11, № 6. – P. CR
266 – CR 273.
- Давыдов М.И., Аксель Е.М. Смертность населения
России и стран СНГ от злокачественных
новообразований в 2007 г. // Вест. Рос. онкол.
науч. центра РАМН. – 2009. – Т. 20, №3, прилож. 1.
– С. 99–122.
- Давыдов М.И., Аксель Е.М. Заболеваемость
злокачественными новообразованиями населения
России и стран СНГ в 2007 г. // Вест. Рос. онкол.
науч. центра РАМН. – 2009. – Т. 20, №3, прилож. 1.
– С. 52–90.
- Алиев С.А. Хирургическая тактика при
осложненном раке сигмовидной кишки // Хирургия. –
1999. – №11. – C. 26–30.
- Буянов В.М., Маскин С.С. Современное состояние
вопросов диагностики, тактики и методов
хирургического лечения толстокишечной
непроходимости // Анналы хирургии. – 1999. – №2. –
C. 23–31.
- Маманов Н.А. Оптимизация хирургической тактики
при осложненных формах рака ободочной кишки:
Автореф. дис. ... канд. мед. наук. – Бишкек, 2007.
– 22 с.
- Михайлов А.П., Данилов А.М., Напалков А.Н. и
др. Острая опухолевая непроходимость ободочной
кишки у больных пожилого и старческого возраста //
Вест. хирургии. – 2003. – Т. 162, №6. – С. 25–28.
- Мохов Е.М., Мурадалиев М.А. Особенности
лечения опухолевой кишечной непроходимости у
больных пожилого и старческого возраста. //
Междунар. хирург. конгр. Актуальные проблемы
современной хирургии. – М., 2003. – С. 123.
- Тотиков В.З., Хестанов А.К., Зураев К.Э. и др.
Хирургическое лечение обтурационной непроходимости
ободочной кишки // Хирургия. – 2001. – №8. – C.
51–54.
- Юдин А.Б. Ранняя энтеральная терапия как
элемент патогенетического лечения больных
оперированных по поводу острой спаечной
тонкокишечной непроходимости: Автореф. дис. …
канд. мед. наук. – СПб., 2008. – 19 с.
- Tisdale M.J. Cachexia in cancer patients //
Nat. Rev. Cancer. – 2002. – Vol. 2, № 11. – P.
862–871.
- Луфт В.М., Костюченко А.Л., Лейдерман И.Н.
Руководство по клиническому питанию больных в
интенсивной медицине. – СПб.; – Екатеринбург
Статья опубликована на сайте
http://www.gastroscan.ru