Особенности
хирургического лечения гастроэзофагеальной
рефлюксной болезни у детей с тяжелыми
неврологическими заболеваниями
М.Г. Джилавян, И.В.
Киргизов, Л.М. Кузенкова, Л.А. Пак
ФГБУ "Научный центр здоровья детей" РАМН, 119991,
Москва Джилавян Мане Гагиковна (Dzhilavyan Mane
Gagikovna)
Многочисленные публикации последних лет
свидетельствуют о значительном увеличении частоты
гастроэзофагеальной рефлюксной болезни (ГЭРБ) во
всем мире. Ведущей причиной тяжелых вариантов ГЭРБ
является нарушение иннервации верхних отделов
желудочно-кишечного тракта. Очень часто это
патологическое состояние выявляется при различных
заболеваниях нервной системы, сопровождающихся
нарушениями глотания, таких как тяжелые
перинатальные поражения центральной нервной системы
с формированием детского церебрального паралича,
гидроцефалии, при болезни Паркинсона, рассеянном
склерозе, синдроме Гийена—Барре, объемных
образованиях головного мозга и пр. В настоящей
работе представлены результаты проведенного
оперативного лечения 35 пациентов с различными
заболеваниями нервной системы в сочетании с ГЭРБ.
Разработаны практические рекомендации по выбору
тактики хирургического лечения.
Ключевые слова : педиатрия;
детская хирургия; гастроэзофагеальная рефлюксная
болезнь; детский церебральный паралич;
псевдобульбарный синдром; бульбарный синдром;
гастростомия; фундопликация по Ниссену.
Peculiarities of
surgical treatment of gastroesophageal reflux
disease in children with severe neurological
disorders
Dzhilavyan M.G.,
Kirgizov I.V., Kuzenkova L.M., Pak L.A.
Federal state budgetary institution “Research Centre
of Children’s Health”, Russian Academy of Medical
Science, 119991, Moscow
Numerous publications of recent years give
evidence of a significant rise in the incidence of
gastroesophageal reflux disease. The main cause of
its clinical variants is disturbed innervation of
upper gastrointestinal tract. This pathology is
often diagnosed in patients with neurological
disorders associated with swallowing problems, such
as severe perinatal lesions in CNS leading to the
development of infantile paralysis, hydrocephaly,
Parkinson’s disease, disseminated sclerosis,
Guillain—Barré syndrome, brain tissue masses, etc.
This study included 35 patients with different
nervous system diseases and concomitant
gastroesophageal reflux disease. Recommendations on
the choice of surgical strategy are proposed.
Keywords : pediatrics, pediatric
surgery, gastroesophageal refl ux disease,infantile
cerebral paralysis, pseudobulbar syndrome, bulbar
syndrome, gastrostomy, Nissen fundoplication
В настоящее время истинная частота
гастроэзофагеальной рефлюксной болезни (ГЭРБ) у
детей неизвестна; колебания составляют от 8,7 до 49%
[1—3]. Частоту ГЭРБ принято демонстрировать в виде
своеобразного "айсберга" D. Castell (1992), который,
вероятно, отражает и педиатрические тенденции (рис.
1).
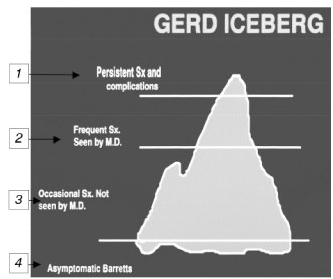
Рис. 1. "Айсберг" Д.О. Castell
(1992)
1 — длительные стойкие симптомы и осложнения;
2 — частые симптомы, с которыми пациенты обращаются
к врачам; 3 — редкие симптомы, с которыми пациенты
не обращаются к врачам; 4 — асимптоматическое
течение заболевания, наличие пищевода Барретта.
Ведущей причиной тяжелых вариантов ГЭРБ является
нарушение иннервации верхних отделов
желудочно-кишечного тракт [4—6]. Сочетанное
поражение проводящих путей и/или ядер и стволов
черепных нервов при различных неврологических
заболеваниях обусловливает формирование
соответственно псевдобульбарного или бульбарного
паралича глоточных мышц [7]. У таких пациентов
возникают затруднение проглатывания пищевого комка,
слюны, их застой и баллотирование в ротоглотке,
нарушение пассажа по пищеводу в желудок.Частичный
заброс в верхние дыхательные пути приводит к
хроническим респираторным инфекциям.
Показаниями к хирургическому лечению ГЭР являются
рецидивирующий характер заболевания, упорная рвота;
неэффективность проводимой медикаментозной терапии
(более 2 нед); невозможность кормления детей при
нарушенной иннервации нёба или верхних отделов
желудочно-кишечного тракта (наличие бульбарного/псевдобульбарного
паралича); наличие осложнений ГЭРБ (стенозирующего
рефлюкс-эзофагита, пищевода Барретта); респираторные
осложнения (рецидивирующая аспирационная пневмония,
бронхиальная астма, бронхит) [8, 9].
Целью настоящего исследования является разработка
алгоритма тактики предоперационной подготовки,
оперативного лечения детей с ГЭРБ и неврологическими
заболеваниями.
Материал и методы
В исследование было включено 55 детей в возрасте
от 2 мес до 17 лет с заболеваниями центральной
нервной системы (ЦНС) в сочетании с ГЭРБ.
Исследуемую группу составили 35 детей, у которых
выполняли операцию, группу сравнения — 20 пациентов,
родители которых по разным причинам отказались от
оперативного лечения или у которых операция не была
произведена в связи с тяжелым соматическим
состоянием. Обе группы были сопоставимы по возрасту,
полу и сопутствующим заболеваниям.
Пациенты исследуемой группы были разделены на 2
подгруппы. Критерием деления служило наличие или
отсутствие бульбарного или псевдобульбарного
паралича (рис. 2). В подгруппу 1 включено 19 детей
без нарушения акта глотания, в подгруппу 2 — 16
детей с бульбарным и псевдобульбарным параличом,
сопровождающимся нарушением глотания.
Неврологические заболевания были условно разделены
на несколько категорий: митохондриальные, обменные,
аутоиммунные нарушения; детский церебральный паралич
(ДЦП); мукополисахаридоз; гипоксически-ишемическое/
травматическое поражение ЦНС (дети до 1-го года
жизни); пациенты с задержкой психомоторного,
речевого развития. После деления пациентов на
подгруппы определяли дальнейшую тактику лечения.
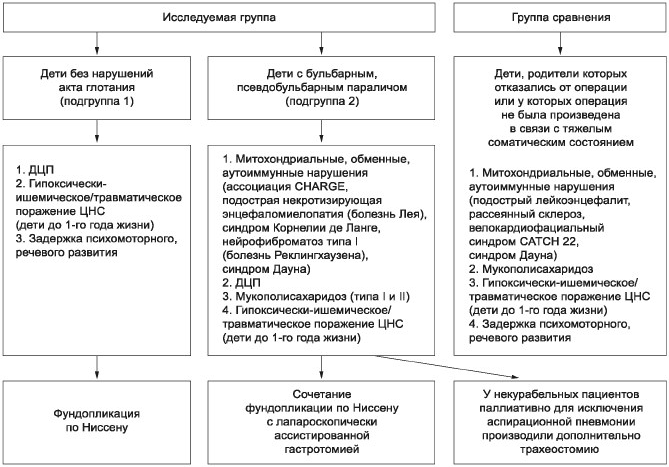
Рис. 2. Основной принцип
деления пациентов на группы
В настоящей работе у всех пациентов с
неврологическими заболеваниями была выявлена ГЭРБ,
которая классифицировалась в соответствии с
классификацией Cавари—Миллера в модификации
Кариссона (1996).
В исследуемой группе 13 (37,1%) пациентов и в
группе сравнения 11 (55%) больных находились на
зондовом кормлении. Все пациенты длительно получали
антациды (фосфалюгель, маалокс), ингибиторы
протонной помпы (нексиум, париет, омез), прокинетики
(мотилак, мотилиум). У 23 (65,7%) детей в
исследуемой группе и у 7 (35%) пациентов в группе
сравнения, несмотря на проводимое лечение, в
анамнезе были эпизоды аспирационной пневмонии (1—4
раза в год).
План обследования детей включал общеклинические
анализы, биохимический анализ крови,
рентгеноконтрастное исследование верхнего отдела
пищеварительного тракта, эзофагогастродуоденоскопию.
Детей осматривали педиатр и невролог. У детей старше
3 лет выполняли 24-часовую рН-метрию.
Статистическую обработку полученных результатов
проводили на персональном компьютере IBM-PC в
программе Statistica 6.0. Вероятность ошибки
достоверности (p) оценивали по общепринятым
критериям (значимыми считали данные, имеющие
вероятность ошибки р ≤ 0,05).
Результаты и обсуждение
Пациенты исследуемой группы были разделены на 2
подгруппы. Критерием деления служило наличие или
отсутствие бульбарного или псевдобульбарного
паралича. В подгруппу 1 включено 19 детей без
нарушения акта глотания, в подгруппу 2 — 16 детей с
бульбарным и псевдобульбарным параличом,
сопровождающимся нарушением глотания. Наиболее
частой патологией в подгруппе 1 была задержка
психомоторного, моторного развития, которая
отмечалась у 10 (28,6%) пациентов. Второй по частоте
являлось гипоксически-ишемическое/травматическое
поражение ЦНС (у детей до 1 года жизни) — у 7 (20%).
В этой подгруппе ДЦП имел место у 2 (5,7%) детей.
При обследовании пациентов из подгруппы 2 самыми
частыми патологическими состояниями являлись
обменные, митохондриальные и генетические нарушения
— у 6 (17,1%) больных. По 1 пациенту было с
диагнозами: ассоциация CHARGE, подострая
некротизирующая энцефаломиелопатия (болезнь Лея),
синдром Корнелии Де Ланге, нейрофиброматоз типа I
(болезнь Реклингхаузена). Синдром Дауна
диагностирован у 2 пациентов. В этой подгруппе было
5 (14,3%) пациентов с ДЦП, 3 (8,6%) детей с
гипоксически-ишемическим/травматическим поражением
ЦНС, 2 (5,7%) больных с мукополисахаридозом типа II
и III.
В группе сравнения превалировало
гипоксически-ишемически/травматическое поражение ЦНС
— у 6 (30%) пациентов. Задержка психомоторного,
моторного развития отмечалась у 5 (25%) больных, ДЦП
— у 4 (20%). Обменные, митохондриальные,
генетические нарушения имелись у 3 (15%) детей с
диагнозами: подострый лейкоэнцефалит, рассеянный
склероз, велокардиофациальный синдром (САТСН 22). В
группу сравнения также вошли 2 (10%) ребенка с
мукополисахаридозом типа II и III (табл. 1).
Таблица 1. Встречающаяся
неврологическая патология у обследуемых детей
| Неврологическая патология
|
Количество пациентов (n = 42) |
|
исследуемая группа (n = 35) |
группа
сравнения
(n = 20) |
| подгруппа 1
(n=19) |
подгруппа 2
(n=16) |
|
Детский
церебральный паралич |
2 (5,7) |
5 (14,3) |
4 (20) |
|
Обменные,
митохондриальные, генетические нарушения |
0 |
6 (17,1) |
3 (15) |
|
Мукополисахаридоз
|
0 |
2 (5,7) |
2 (10) |
|
Гипоксически-ишемическое/травматическое
поражение ЦНС (дети первого года жизни) |
7 (20) |
3 (8,6) |
6 (30) |
|
Задержка
психомоторного, моторного развития |
10 (28,6) |
0 |
5 (25) |
П р и м е ч а н и е . Здесь и в табл. 2—5: в
скобках — проценты.
У всех детей отмечалась рвота и/или срыгивание.
Выраженность синдрома срыгивания была различной: от
необильного срыгивания (несколько раз в день) до
упорной рвоты после каждого кормления. Дисфагия
отмечалась у 16 (45,7%) пациентов в исследуемой
группе и у 4 (20%) пациентов в группе сравнения.
Постоянная рвота приводила к уменьшению массы тела у
27 (77%) пациентов в исследуемой группе и у 8 (40%)
в группе сравнения. Заболевания респираторной
системы (бронхит, пневмония, бронхильная астма)
имели место у 30 (85,7%) детей в исследуемой группе
и у 8 (40%) в группе сравнения. По данным
клинического анализа крови, анемия отмечалась у 5
(14,3%) больных в исследуемой группе и у 2 (10%) в
группе сравнения (рис. 3).
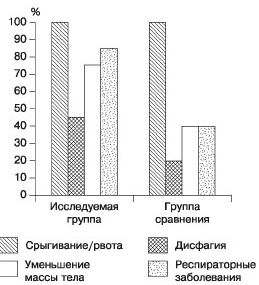
Рис. 3. Распределение симптомов
ГЭРБ и клинических проявлений у детей с
неврологическими заболеваниями
При этом у 100% пациентов в исследуемой группе и
группе сравнения отмечалось наличие заболеваний
верхних отделов желудочно-кишечного тракта, что было
подтверждено результатами ультразвукового
сканирования органов брюшной полости. Заболевания
респираторной системы (бронхит, пневмония,
бронхильная астма) имели место у 30 (85,7%) детей в
исследуемой группе и у 8 (40%) пациентов в группе
сравнения. Врожденная/приобретенная патология
сердечно-сосудистой системы (ДМПП, ООО, МАРС,
дополнительная трабекула, клапанный стеноз аорты,
вторичная кардиомиопатия, недостаточность
трикуспидального и/или митрального клапана, дефект
межжелудочковой перегородки) отмечена у 5 (14,3%)
пациентов в исследуемой группе и у 2 (10%) в группе
сравнения. Не менее часто встречались нарушения
зрения (атрофия зрительного нерва, нарушение
проведения по зрительным путям, астигматизм,
миопия): у 5 (14,3%) пациентов в исследуемой группе
и у 4 (20%) в группе сравнения. В группе сравнения у
небольшого количества пациентов отмечались
сопутствующие заболевания мочевыделительной системы
(нефротический синдром, дисметаболическая
нефропатия, инфекция мочевых путей): у 3 (15%)
больных, у 1 (5%) диагностирован врожденный порок
развития спинного мозга — cирингомиелия. Нарушения
слуха (тугоухость) имелись у 1 (2,9%) ребенка в
основной группе и 1 (5%) в группе сравнения (табл.
2).
Таблица 2. Перечень
сопутствующей патологии у пациентов
| Сопутствующие заболевания
|
Исследуемая группа (n=35)
|
Группа
сравнения
(n=20) |
| абс. |
% |
абс. |
% |
| Респираторной системы: бронхит, пневмония,
бронхиальная астма |
30 |
85,7 |
8 |
40 |
| Желудочно-кишечного тракта:
эзофагит, гастрит, дуоденит, функциональные
нарушения моторики ЖКТ, дискинезия
желчевыводящих путей |
35 |
100 |
20 |
100 |
| болезнь Крона пищевода |
1 |
2,9 |
0 |
0 |
| ПБ |
2 |
5,7 |
0 |
0 |
| Нарушения зрения (атрофия зрительного
нерва, нарушение проведения по зрительным
путям, астигматизм, миопия) |
5 |
14,3 |
4 |
20 |
| Нарушения слуха: тугоухость |
1 |
2,9 |
1 |
5 |
| Мочевыделительной системы: нефротический
синдром, дисметаболическая нефропатия,
инфекция мочевых путей |
0 |
0 |
3 |
15 |
| Врожденная/приобретенная патология
сердечно-сосудистой системы: ДМПП, ООО, МАРС,
дополнительная трабекула, клапанный стеноз
аорты, вторичная кардиомиопатия,
недостаточность трикуспидального и/ или
митрального клапана, дефект межжелудочковой
перегородки |
5 |
14,3 |
2 |
10 |
| Дисплазия/подвывих тазобедренных суставов
|
3 |
8,6 |
0 |
0 |
| Врожденный порок развития спинного мозга:
cирингомиелия |
0 |
0 |
1 |
5 |
У 19 (54%) больных, не страдающих дисфагией,
выполнена только лапароскопическая фундопликация по
Ниссену, заключающаяся в ушивании ножек диафрагмы и
формировании манжеты из передней стенки желудка
(производится обертывание стенки желудка вокруг
кардиоэзофагеального сфинктера полностью на 360°),
фиксирование к пищеводу швами, последний шов
прошивается с фиксацией стенки пищевода (рис. 4, см.
на вклейке) [10, 11]. Этот метод чаще всего
используют при ГЭР у детей с неврологическими
заболеваниями, что позволяет наиболее полно
восстановить антирефлюксный барьер для исключения
вероятности аспирационной пневмонии [12—14].
Б о л ь н а я К ., 1 год, из исследуемой группы,
с диагнозом: ГЭРБ 2 стадии. Эрозивный эзофагит.
Гастрит. Дуоденит. Хронические субдуральные гематомы
с двух сторон. Атрофия вещества головного мозга.
Фиброзные изменения оболочек головного мозга.
Симптоматическая мультифокальная эпилепсия.
Спастический тетрапарез. Грубое отставание
психопредречевого развития. Синдром дыхательных
расстройств. Вторичная микроцефалия. Частичная
атрофия зрительных нервов. Врожденная липодистрофия.
Множественные стигмы дисэмбриогенеза. Носитель
трахеостомы, гастростомы, терминальной илеостомы
(рис. 4, см. на вклейке).
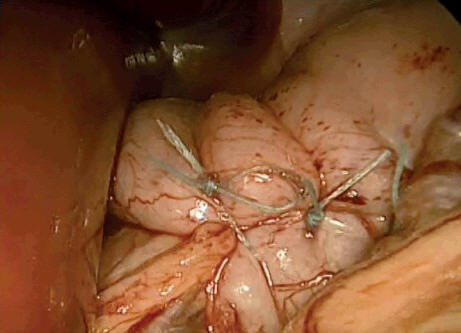
Рис. 4. Больная К., 1 год. Этап
лапароскопической фундопликации по Nissen:
сформированная манжета вокруг абдоминального отдела
пищевода
В исследуемой группе у всех 16 (45,7%) пациентов
с дисфагией проводилось комбинированное оперативное
лечение: лапароскопическая фундопликация по Ниссену,
лапароскопически ассистированное наложение
гастростомы: выполнялось подтягивание стенки
желудка, рассечение ее через все слои и введение
гастростомы в желудок через разрез в передней
брюшной стенке. Приоритет на патент РФ: "Способ
наложения гастростомы при лапароскопической
фундопликации у детей" от 13.06.12 № 2012125906
(рис. 5, см. на вклейке).
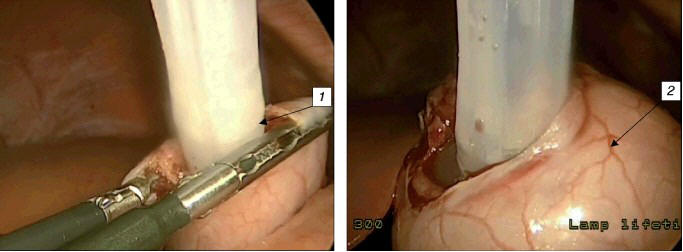
Рис. 5. Та же больная. Этап
лапароскопической гастростомии
1 — введение гастростомы в желудок через
произведенный разрез; 2 — раздувание манжеты для
последующего подтягивания к передней брюшной стенке.
Согласно полученным нами результатам, при
катамнестическом осмотре через 6—12 мес детей
исследуемой группы и группы сравнения дефицит массы
тела отмечался только у 2 (5,7%) из 19 (54,3%)
пациентов исследуемой группы (p<0,05).У детей из
группы сравнения уменьшение массы тела на фоне
проводимой диетотерапии, консервативной терапии
несколько уменьшилось — от 8 (40%) до 5 (25%). В
исследуемой группе до операции и в группе сравнения
у всех пациентов отмечались рвота или срыгивание.
Количество эпизодов срыгивания/рвоты в исследуемой
группе после операции составляло 4 (11,4%) по
сравнению с группой сравнения, в которой на фоне
получаемого консервативного лечения сохранялся
показатель 100% (р<0,05). Респираторные заболевания
(бронхиты, пневмонии, бронхиальная астма) у больных
исследуемой группы уменьшились от 30 (85,7%) до 6
(17,1%), в то время как в группе сравнения, несмотря
на проводимую консервативную терапию, респираторные
симптомы отмечались у 8 (40%) пациентов. На фоне
проводимой комплексной консервативной терапии,
улучшения соматического состояния через 6 мес после
операции у 1 ребенка дисфагия нивелировалась и
отмечалась у 15 (42,9%) пациентов из 16 (45,7%)
(табл. 3).
Таблица 3. Клинические
проявления у исследуемой группы пациентов (после
оперативного лечения) и у пациентов группы сравнения
(получающих только консервативную терапию)
| Клиническое проявление |
Исследуемая группа
(после оперативного
лечения) (n=35) |
Группа сравнения (n=20) |
| Срыгивания или рвоты |
4 (11,4) |
20 (100) |
| Дисфагия |
15 (42,9) |
4 (20) |
| Снижение массы тела |
2 (5,7) |
5 (25) |
| Анемия |
3 (8,6) |
2 (10) |
| Респираторные симптомы |
17,1 (6) |
8 (40) |
В связи с большим размером электродов применение
их в педиатрической практике ограничено. Сурьмяные
монокристаллические электроды малого размера более
гибкие, но менее чувствительные и рассчитаны на
10—12 исследований. Преимущество сурьмяных
электродов состоит в том, что из-за их
миниатюризации (1,5—2 мм) несколько pH-датчиков
может быть установлено на один электрод и возможно
использование их в педиатрической практике. По всей
видимости транзисторные электроды, появившиеся в
последние годы, станут электродами выбора, так как
они отвечают всем необходимым требованиям идеального
электрода [15].
По данным 24-часовой рН-метрии (у детей старше 3
лет) при катамнестическом осмотре отмечается
уменьшение частоты кислых рефлюксов в исследуемой
группе после проведения операции с 56,3 до 12,5%,
уменьшение количества смешанных рефлюксов с 31,3 до
6,25%. Щелочные рефлюксы у обследуемых детей в
послеоперационном периоде не наблюдались (табл. 4).
Таблица 4. Данные по
исследованию 24-часовой рH-метрии у исследуемой
группы пациентов
| Данные суточной рН-метрии
|
До операции (n =16 из 35) |
После операции (n =16 из 35) |
| абс.
|
% |
абс.
|
% |
|
Кислые ГЭР (число
рефлюксов с pH < 4 более 50 раз за сутки,
показатель DeMeester более 14,7) |
9 |
56,3 |
2 |
12,5 |
|
Щелочные ГЭР
(число рефлюксов с pH > 7,5 более 27 раз за
сутки, показатель DeMeester менее 5) |
2 |
12,5 |
0 |
0 |
|
Смешанные ГЭР
|
5 |
31,3 |
1 |
6,25 |
При эзофагогастродуоденоскопии после операции у 20
(57,1%) пациентов признаков эзофагита не отмечено.
Признаки эзофагита I степени обнаружены у 28,6%
пациентов; до операции у 25 (71,4%). Признаки
эзофагита II степени отмечались у 1 (2,9%) больного;
до операции у 4 (11,4%). Данные, свидетельствующие о
наличии эзофагита III степени, у всех пациентов
исследуемой группы отсутствовали. Признаки эзофагита
IV степени сохранялись у 4 (11,4%) детей (у 2
пациентов с пищеводом Барретта и у 2 с пептическим
стенозом пищевода), у которых в дальнейшем
производили поднаркозное бужирование пищевода. При
катамнестическом осмотре этих больных отмечалась
положительная динамика с увеличением диаметра
пищевода. У 1 пациента эндоскопические признаки
пищевода Барретта через 12 мес после операции,
проведения курса консервативной терапии не
отмечались (табл. 5).
Таблица 5. Степень эзофагита у
исследуемой группы пациентов (по классификации
рефлюкс-эзофагита Cавари—Миллера, 1978)
|
Эзофагит
|
До операции (n =35)
|
После операции (n = 35)
|
| абс.
|
% |
абс.
|
% |
| I степень |
25 |
71,4 |
10 |
28,6 |
| II степень
|
4 |
11,4 |
1 |
2,9 |
| III степень
|
2 |
5,7 |
0 |
0 |
| IV степень
|
4 |
11,4 |
4 |
11,4 |
В ходе обследования пациентов с ГЭРБ с
неврологическими заболеваниями нами разработан
алгоритм проведения оперативного лечения этой группы
пациентов. У детей с выраженным органическим
поражением ЦНС, с дисфагией, с выраженным судорожным
синдромом, с частыми осложнениями бронхолегочочной
системы производили гастростомию с лапароскопической
фундопликацией по Ниссену с формированием тугой
манжеты. У детей без выраженного поражения ЦНС, не
страдающих дисфагией (с ДЦП легкой степени, с
гипоксически-ишемическим поражением ЦНС,
перинатальным поражением ЦНС, задержкой
психомоторного развития), производили только
лапароскопическую фундопликацию по Ниссену. У 6
(14,3%) некурабельных пациентов исследуемой группы с
бульбарным и псевдобульбарным параличом для
исключения аспирационной пневмонии с паллиативной
целью производили трахеостомию.
При катамнестическом осмотре через 6—12 мес в
исследуемой группе отмечалось увеличение массы тела
детей, улучшение соматического состояния, уменьшение
жалоб со стороны детей и родителей.
Выводы
1. Детям без выраженного поражения ЦНС (с ДЦП
легкой степени, с гипоксически-ишемическим
поражением ЦНС, перинатальным поражением ЦНС,
задержкой психомоторного развития) без дисфагии
показано выполнение только лапароскопической
фундопликации по Ниссену.
2. Пациентам с дисфагией необходима гастростомия
для улучшения нутритивного статуса.
3. Некурабельным пациентам с дисфагией для
исключения аспирационной пневмонии мокротой
необходимо дополнительное наложение трахеостомы.
3. Адекватное проведение оперативного лечения в
зависимости от тяжести неврологического заболевания
значительно улучшает соматическое состояние
пациентов и облегчает родителям уход за детьми с
крайне тяжелыми неврологическими заболеваниями.
ЛИТЕРАТУРА
1. Маслова О.И., Баранов А.А., Намазова-Баранова
Л.С., Каркашадзе Г.А., Мамедьяров А.М., Лазарев М.Л.
Современные аспекты изучения когнитивной сферы в
развитии ребенка. Педиатрическая фармакология. 2012;
6: 72—8.
2. Лазебник Л.Б., Щербаков П.Л., ред.
Гастроэнтерология. Болезни детей. М.: МК; 2011.
3. Приворотский В.Ф., Луппова Н.Е., Александрова
В.А. и др. Патогенез и лечение гастроэзофагеального
рефлюкса у детей. Детская больница. 2001; 1(3):
27—34.
4. Студеникин В.М., Шелковский В.И., Балканская
С.В., Пак Л.А. Детский церебральный паралич:
современные подходы к лечению. Лечащий врач. 2007.
5. Баранов А.А., Климанская Е.В., Римарчук Г.В.,
ред. Детская гастроэнтерология (избранные главы).
М.; 2002.
6. Хавкин А.И., Приворотский В.Ф.
Гастроэзофагеальная рефлюксная болезнь. В кн.:
Кислотозависимые состояния у детей. М.; 1999: 45—57.
7. Триумфов А.В. Топическая диагностика
заболеваний нервной системы. ...: МедПресс; 2008.
8. Rowney D.A., Aldridge L.M. et al. Laparoscopic
fundoplication: Anesthesia, analgesia, and
physiologic aspects. Pediatr. Endosurg. Innovative
Tech. 2000; 4(1): 25—9.
9. Andze G.O., Brandt M.L. et al. Diagnosis and
treatment of gastro esophageal reflux in 500
children with respiratory symptoms: The value of pH
monitoring. J. Pediatr. Surg. 1991; 26(3): 295—300.
10. Rothenburg S.S. Experience with 220
consecutive laparoscopic Nissen fundoplications in
infants and children. J. Pediatr. Surg. 1998; 33(2):
274—8.
11. Collins III J.B., Georgeson K.E. et al.
Comparison of open and laparoscopic gastrostomy and
fundoplication in 120 patients. J. Pediatr. Surg.
1995; 30(7): 1065—71.
12. Dzhilavyan M.G., Kirghizov I.V. , Kuzenkova
L.M. et al. Experience of surgical treatment in
children with GERD with organic disorders of central
nervous system. In: AAPS 23 . 2012.
13. Dzhilavyan M.G., Kirghizov I.V. , Kuzenkova
L.M. et al. Surgi cal treatment of gastroesophageal
refl ux in children with chronicaspira-tion syndrome.
In: Proceedings of the XVI Congress of pediatricians
of Russia with international participation. ...:
209.
14. Dzhilavyan M.G., Kuzenkova L.M. Preventive
treatment of chronic inflammatory diseases of the
respiratory system in young children with organic
lesion of the central nervous system. In:
Proceedings of the XVII Congress of pediatricians of
Russia with international participation. ...: 181.
15. Алхасов А.В., Разумовский А.Ю., Кучеров Ю.И.,
Батаев С.Х.М. Cуточный pH-мониторинг пищевода в
диагностике гастроэзофагеального рефлюкса у детей.
Педиатрическая гастроэнтерология.
REFERENCES
1. Maslova O.I., Baranov A.A., Namazova-Baranova
L.C., Mamedyarov A.M., Lazarev M.L. et al. Modern
aspects of studying cognitive development in
children. Pediatricheskaya pharmakologiya. 2012; 6:
72—8 (in Russian).
2. Lazebnik L.B., Shcherbakov P.L.
Gastroenterology. Diseases in children. Moscow...;
2011 (in Russian).
3. Privorotsky V.F. Luppova N.E., Aleksandrov
V.A. et al. Pathogenesis and treatment of GERD in
children. Detskaya bol'nitsa. 2001; 1(3): 27—34 (in
Russian).
4. Studenikin B.M., Shelkovskiy V.I., Balkan S.V.
, Park L.A. Cerebral Palsy: modern approaches to
treatment. Lerhaschiy vrach. 2007.
5. Baranova A.A., Klimanskaya E.V., Rimarchuk
G.V. , eds. Pediatric gastroenterology (selected
chapters). Moscow; 2002 (in Russian).
6. Havkin A.I., Privorotsky V. F.
Gastroesophageal reflux disease. In: Acid reflux
conditions in children. Moscow; 1999: 45—57 (in
Russian).
7. Triumfov A.V. Topical diagnosis of diseases of
the nervous system. ...: MedPress; 2008 (in Rusian).
8. Rowney D.A., Aldridge L.M. et al. Laparoscopic
fundoplication: Anesthesia, analgesia, and
physiologic aspects. Pediatr. Endosurg. Innovative
Tech. 2000; 4(1): 25—9.
9. Andze G.O., Brandt M.L. et al. Diagnosis and
treatment of gastroesophageal reflux in 500 children
with respiratory symptoms: The value of pH
monitoring. J. Pediatr. Surg. 1991; 26(3): 295—300.
10. Rothenburg S.S. Experience with 220
consecutive laparoscopic Nissen fundoplications in
infants and children. J. Pediatr. Surg. 1998; 33(2):
274—8.
11. Collins III J.B., Georgeson K.E. et al.
Comparison of open and laparoscopic gastrostomy and
fundoplication in 120 patients. J. Pediatr. Surg.
1995; 30(7): 1065—71.
12. Dzhilavyan M.G., Kirghizov I.V., Kuzenkova
L.M. et al. Experience of surgical treatment in
children with GERD with organic disorders of central
nervous system. In: AAPS 23th. 2012: ... (in Russian).
13. Dzhilavyan M.G., Kirghizov I.V., Kuzenkova
L.M. et al. Surgical treatment of gastroesophageal
reflux in children with chronic aspiration syndrome.
In: Proceedings of the XVI Congress of pediatricians
of Russia with international participation. ...: 209
(in Russian).
14. Dzhilavyan M.G., Kuzenkova L.M. Preventive
treatment of chronic inflammatory diseases of the
respiratory system in young children with organic
lesion of the central nervous system. In:
Proceedings of the XVII Congress of pediatricians of
Russia with international participation. ...: 181 (in
Russian).
15. Alkhasov A.B., Razumovsky A.Y., Kucherov Y.,
Bataev C. Daily production of esophageal
pH-monitoring in the diagnosis of gastro-oesophageal
reflux in children. Pediatric gastroenterology.
Статья опубликована на сайте
http://www.gastroscan.ru