Нейропротекторная терапия в лечении синдрома вегетативных
дисфункций у детей и подростков
М. Ю. Галактионова*, доктор медицинских наук, профессор
Н. В. Воронина*
А. Л. Рахимова**
О. И. Миронова**
*ГБОУ ВПО Красноярский государственный медицинский университет им. проф. В. Ф.
Войно-Ясенецкого,
**МБУЗ Городская детская больница № 8, Красноярск
За последние десятилетия характер сердечно-сосудистой патологии существенно
изменился: значительно уменьшилась частота ревматических поражений сердца и
бактериальных эндокардитов и увеличился удельный вес артериальной гипертензии,
кардиомиопатий, нейроциркуляторных дистоний, нарушений ритма сердца и
проводимости [1–6].
Нейрогуморальные механизмы регуляции сердечного ритма представляют собой одну
из наиболее активно изучаемых в настоящее время проблем в кардиологии. Это
связано с тем, что сердечный ритм отражает фундаментальные соотношения в
функционировании не только сердечно-сосудистой системы, но и всего организма в
целом [7–11]. Исследования отечественных и зарубежных ученых показали, что
сердечный ритм в физиологических условиях — результат ритмической активности
пейсмекеров синусового узла и влияния, главным образом, симпатической и
парасимпатической иннервации. Одним из фундаментальных положений, необходимых
для понимания динамики нервной регуляции сердечного ритма, является концепция
баланса симпатического и парасимпатического отделов вегетативной нервной системы
(ВНС), которая соотносится с тем наблюдением, что в большинстве физиологических
условий активация любого из этих отделов сопровождается торможением другого [12,
13]. Доказано, что синхронизация симпатической и парасимпатической ВНС
обеспечивает высший уровень адаптации ритма сердца к потребностям организма и
предупреждает возникновение повреждений миокарда [14–16].
В настоящее время актуален поиск новых методов лечения синдрома вегетативных
дисфункций, функциональных аритмий в детском возрасте, когда наряду с
традиционными методами используются лекарственные препараты с эффективными
нейрометаболическими и нейропротекторными свойствами. К таким лекарственным
средствам относится отечественный препарат Кортексин, представляющий собой
комплекс сбалансированных нейропептидов, витаминов и микроэлементов [17]. Это и
определило цель и задачи настоящего исследования: оценить эффективность
препарата Кортексин в лечении детей и подростков с синдромом вегетативной
дисфункции (СВД).
Материалы и методы исследования
Проведено сравнительное открытое контролируемое исследование эффективности
препарата Кортексин при лечении синдрома вегетативных дисфункций в детском
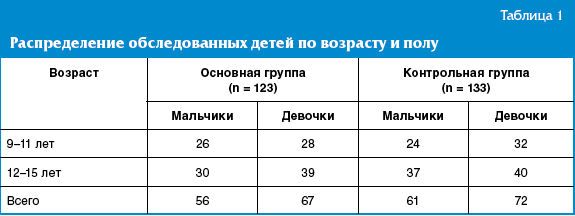
возрасте. В исследование были включены 256 детей с СВД (117 мальчиков и 139
девочек), находившихся на лечении в условиях круглосуточного и дневного
стационаров МБУЗ «Городская детская больница № 8» г. Красноярск. Критериями
включения в исследование были возраст от 9 до 15 лет, отсутствие органических и
воспалительных заболеваний сердца.
При включении в исследование все дети были рандомизированы в две группы:
основную и контрольную. Родителям и пациентам было предложено в качестве терапии
выбрать либо традиционный подход с назначением пирацетама, либо монотерапию
Кортексином. Было получено информированное согласие родителей на лечение и
комплексное обследование детей.
Пациенты основных групп получали монотерапию препаратом Кортексин. Дети и
подростки с СВД получали Кортексин в дозе 10 мг 1 раз в сутки внутримышечно,
курс лечения составил 10 дней. В контрольных группах дети получали сочетанную
терапию, включающую пирацетам. Длительность терапии составила 21 день.
Группы больных не различались по основным демографическим и клиническим
показателям; длительность заболевания до включения в исследование была
сопоставимой в обеих группах и составила в среднем 4,56 ± 0,95 года.
Распределение по возрасту и полу представлено в табл. 1.
При включении в исследование фиксировали клинические симптомы, характерные
для СВД, параметры функционального состояния вегетативной нервной и
сердечно-сосудистой систем.
Оценка эффективности и переносимости препарата Кортексин осуществлялась после
лечения и в течение трех последующих визитов через 6, 12 и 24 мес. Значительным
улучшением считали положительную динамику всех показателей, улучшением —
превышение числа показателей с положительной динамикой над числом показателей с
отрицательной динамикой на 1 и более или положительную динамику хотя бы одного
показателя при отсутствии отрицательной динамики других. Об отсутствии эффекта
свидетельствовало ухудшение — отрицательная динамика хотя бы одного показателя
при отсутствии положительной динамики других или превышение числа показателей с
положительной динамикой на 1 и более. При этом учитывалось мнение врача,
пациента и его родителей. Переносимость лечения оценивали врач и пациент по трем
градациям: хорошая, удовлетворительная и плохая. Оценка нежелательных реакций
терапии осуществлялась в соответствии с критериями Всемирной Организации
Здравоохранения (ВОЗ).
Результаты и обсуждение
Наиболее ранние энергетические и метаболические сдвиги отражаются в
изменениях нейровегетативной регуляции, которые предопределяют характер
адаптивных реакций, возможность возникновения и тяжесть течения соматических
заболеваний [5].
Исходно пациенты предъявляли жалобы преимущественно астеновегетативного и
невротического характера. Превалирующими жалобами явились головные боли
давящего, пульсирующего характера в лобно-височных областях (61,32% пациентов);
эмоциональная лабильность, нарушения сна (81,6% детей); кардиалгии и ощущения
перебоев в области сердца (41,4%). Гипергидроз ладоней, стоп, стойкий красный
дермографизм, акроцианоз отмечались у 61,3% детей. Клинические проявления
синдрома раздраженного кишечника (запоры, метеоризм, боли в животе) отмечались у
46,4% из общего числа обследованных подростков.
Кризовые состояния в анамнезе имели место у 162 (62,5%) обследованных лиц.
Вагоинсулярный криз на момент поступления диагностирован у 11 детей основной и 9
пациентов контрольной группы. Кризы смешанного характера отмечались
соответственно у 16 и 12 детей, симпатико-адреналовый криз имел место при
поступлении лишь у 3 детей основной группы. В клинической картине у всех
обследованных отмечались нестабильность пульса и артериального давления.
По окончании курса лечения у большинства обследованных детей обеих групп
отмечались уменьшение числа и интенсивности жалоб астеноневротического
характера, снижение выраженности болевого синдрома (головных болей, кардиалгий,
болей в животе) (табл. 2).
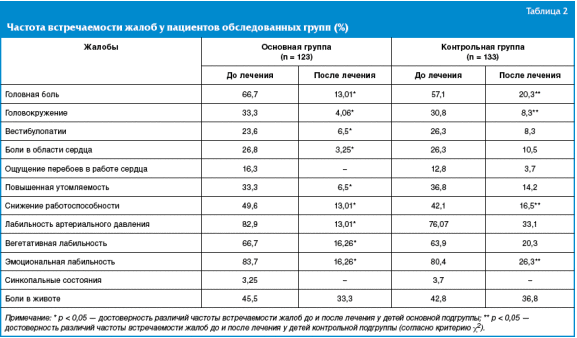
При этом у 81,3% больных основной группы положительная динамика отмечалась
уже к концу второй недели от начала лечения (на 10–14 день). Наиболее отчетливая
положительная динамика соматического и вегетативного статуса имела место у детей
с гиперсимпатико-тоническим исходным вегетативным тонусом (ИВТ), получающих
Кортексин. Улучшение психоэмоционального фона, исчезновение тревожности,
значительное повышение работоспособности, концентрации внимания и нормализация
сна отмечалась к 16-му дню у 89 (72,4%) пациентов основной группы, что указывало
на ноотропный эффект действия препарата, тогда как аналогичная динамика
вышеизложенных клинических симптомов у детей контрольной группы отмечалась на
момент выписки из стационара (на 21-й день) лишь в 65 (48,8%) случаях.
На этапе объективного осмотра у детей обследованных групп достоверных
различий по средней величине частоты сердечных сокращений (ЧСС) не выявлено. При
этом после лечения ЧСС в подгруппе детей, получивших лечение Кортексином,
достоверно уменьшилась (p < 0,05).
Достоверных различий между детьми по уровню систолического и диастолического
артериального давления на момент поступления в стационар не наблюдалось (табл.
3).
Показатели артериального давления (АД) у подавляющего числа пациентов обеих
групп к окончанию курса лечения стабилизировались и соответствовали возрастным
нормам. При этом до лечения повышенный уровень АД (больше 75 процентиля) был
зарегистрирован у 147 (57,4%) человек из общего числа детей, причем 15 (10,2%)
из них имели показатели АД больше 90 процентиля. Артериальная гипотензия (меньше
25 процентиля) регистрировалась у 23 (8,9%) детей.
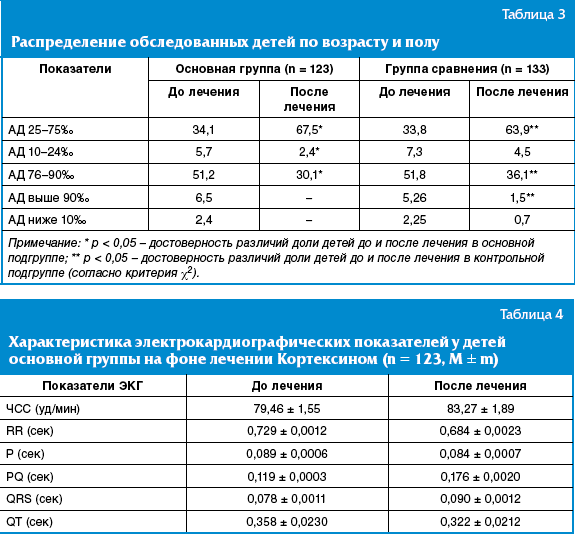
Необходимо отметить, что артериальная гипер- и гипотензия в 37,4% случаев
стабилизировалась лучше на фоне лечения Кортексином.
Комплексный подход к оценке ВНС позволил выявить более чем у половины
пациентов парасимпатическую направленность ИВТ. Изучение вегетативной
реактивности у детей с СВД показало преобладание гиперсимпатико-тонической
вегетативной регуляции (47,2% детей основной и 44,3% — контрольной группы),
свидетельствующей о напряженности адаптационных механизмов вегетативной
регуляции. У 35,2% обследованных наблюдалась асимпатико-тоническая вегетативная
регуляция, указывающая на истощение компенсаторных механизмов.
Симпатико-тоническая реактивность отмечалась у 28,1% пациентов и, как правило,
сочеталась с повышенной эмоциональной лабильностью. Показатели вегетативной
обеспеченности деятельности подростков с вегетативной дисфункцией указывали на
нарушение функционального состояния ВНС. Так, в половине всех случаев исходно
регистрировалась избыточная вегетативная обеспеченность деятельности (ВОД).
По завершении курса лечения нормализация показателей вегетативного гомеостаза
отмечалась у большинства пациентов, о чем свидетельствовало изменение
направленности ИВТ (р < 0,001) и вегетативной реактивности (р < 0,05). Число
детей с дезадаптивными вариантами клиноортостатической пробы (КОП) значительно
снизилось, что указывало на положительную динамику параметров ВОД. Так, число
детей с избыточным (42,3%) ВОД и недостаточным ВОД (25,2%) после лечения
Кортексином составило 25,2% и 8,94% соответственно. Число детей с нормальным
вегетативным обеспечением увеличилось в 2 раза (с 40 до 81 человека).
Нормализация показателей вегетативного гомеостаза отмечалась у 87,8% детей
основной и 42,8% — контрольной группы.
Положительная динамика со стороны жалоб (головная боль, вестибулопатии,
утомляемость, кардиалгии, ощущение перебоев в сердце, эмоциональная лабильность)
отмечалась у всех пациентов основной группы к 5–7-му дню от начала лечения
Кортексином. В контрольной группе положительная динамика отмечена только к концу
14-го дня. Кризовые состояния купировались в течение первых двух суток у
пациентов основной группы и на 5-й день — в контрольной (табл. 4).
Повторная госпитализация на первом году диспансерного наблюдения по поводу
кризовых состояний имела место лишь у 4 пациентов основной группы, в контрольной
группе в повторных курсах терапии нуждались 18 подростков. В течение второго
года наблюдения за медицинской помощью обратились 27 пациентов из основной и 42
пациента контрольной группы.
Средняя длительность пребывания в стационаре пациентов с СВД составила 19,1 ±
2,1 дня: при этом в основной подгруппе дети проводили достоверно меньшее число
койко-дней при стационарном лечении (16,4 ± 1,6 дня против 20,1 ± 2,3 дня в
контрольной подгруппе). В динамике установлено уменьшение среднего числа
койко-дней, проводимых пациентами, получившими курс лечения Кортексином, при
повторных госпитализациях.
Выводы
- Показана высокая эффективность Кортексина в виде монотерапии при лечении
СВД у детей и подростков.
- Кортексин положительно воздействует на вегетативные нарушения: нормализует
вегетативный гомеостаз, мозговое и системное кровообращение.
- Кортексин характеризуется хорошей переносимостью, частота развития
побочных явлений не выходит за рамки общепринятых для данной категории
препаратов и может использоваться в лечении функциональных кардиопатий.
- Положительный эффект применения Кортексина подкрепляется более коротким
курсом лечения (10 дней) по сравнению с пирацетамом (21 день), что
благоприятно сказывается на качестве жизни пациентов.
Литература
- Александров А. А., Розанов В. Б. Профилактика сердечно-сосудистых
заболеваний с детства: подходы, успехи, трудности // Кардиология. 1995. № 7.
С. 4–8.
- Антонова Л. К. Роль социальных факторов риска
в формировании синдрома вегетативной дистонии у детей пубертатного возраста //
Пробл. соц. гигиены, здравоохранения и истории медицины. 2003. № 6. С. 7–9.
- Лебедькова С. Е., Капцова Г. Б., Бобкова О. П. Распространенность
и структура артериальных гипертензий в популяции детей 6–15 лет // Педиатрия.
1990. № 1. С. 61–63.
- Ковалев И. А., Попов С. В., Антонченко И. В. и др. Нарушения
ритма сердца у детей: основные принципы диагностики и лечения. Под ред. И. А.
Ковалева, С. В. Попова. Томск: STT, 2006. 272 с.
- Луценко Я. В., Кантемирова М. Г., Цукерман В. С. и др. Частота
встречаемости различных нарушений ритма и проводимости сердца при соматической
патологии / Современные технологии в педиатрии и детской хирургии: матер. V
Рос. конгр. М., 2006. С. 174.
- Школьникова М. А., Леонтьева И. В. Современная структура
сердечно-сосудистых заболеваний у детей, лечение и профилактика // Рос. вестн.
перинатологии и педиатрии. 1997. № 6. С. 14–20.
- Ардашев В. Н., Ардашев А. В., Стеклов В. И. Лечение нарушений
сердечного ритма. 2?е изд., исправл. и доп. М.: Медпрактика, 2005. 228 с.
- Артюхов И. П., Галактионова М. Ю. Роль медико-социальных факторов
риска в формировании нарушений ритма и проводимости сердца у детей // Сиб.
мед. журн. 2006. № 2. С. 41–46.
- Леонтьева И. В. Лекции по кардиологии детского возраста. М.:
Медпрактика. М, 2005. 536 с.
- Tygesen H., Eisenhofer G., Elam М. Heart rate variability
measurements correlates with sympathetic nerve activity in congestive heart
ailure // Eur Heart J. 1997. Suppl. 18. Р. 592.
- Барышникова Г. А. Дефицит магния и его коррекция при
сердечно-сосудистых заболеваниях // Клинич. вестн. 1994. № 1. С. 28–31.
- Розенштраух Л. В., Зайцев А. В. Роль блуждающих нервов в развитии
суправентрикулярных аритмий // Кардиология. 1994. № 5. С. 47–54.
- Malliani A., Pagani M., Furlan R. Individual recognition by heart
rate variability of two different autonomic profiles related to posture //
Circulation. 1997. V. 96. Р. 4143–4145.
- Coumel P. Cardiac arrhythmias and the autonomic nervous system //
J. Cardiovasc. Electrophysiol. 1993. V. 4, № 3. P. 338–355.
- Ferrari A. U. Modulation of parasympathetic and baroreceptor
control of heart rate // Cardioscience. 1993. V. 4, № 1. P. 9–13.
- Tavernier R., Jordaens L., Haerynck F. Changes in the QT interval
and its adaptation to rate, assessed with continuous electrocardiographic
recordings in patients with ventricular fibrillation, as compared to normal
individuals without arrhythmias // Eur. Heart J. 1997. V. 18, № 6. P. 994–999.
- Платонова Т. Н., Скоромец А. П., Шабалов Н. П. Кортексин —
многолетнее применение в педиатрической практике. В кн.: Кортексин —
пятилетний опыт отечественной неврологии. Под ред. А. А. Скоромца, М. М.
Дьяконова. СПб: Наука, 2005. С. 1–9.
Статья опубликована в журнале
Лечащий Врач