Патофизиология
хронического запора
Christopher N.
Andrews MD MSc FRCPC 1, Martin Storr
1,2
1 Centre
for Digestive Motility, Division of
Gastroenterology, Department of Medicine,
University of Calgary, Alberta;
2 Lugwig
Maximilian University, Munich, Germany
Согласно широко принятому определению, запор —
это нарушение дефекации, проявляющееся снижением
частоты стула, затруднением опорожнения кишечника
или сочетанием этих симптомов. В зависимости от
патогенеза различают первичный и вторичный запор.
Первичный запор возникает в результате нарушения
функций толстой кишки и аноректальной области,
тогда как вторичный запор может быть обусловлен
органическими, системными заболеваниями или
приемом некоторых лекарственных средств. В
настоящей статье описаны механизмы транзита
содержимого по толстой кишке и процесс дефекации в
норме, представлен обзор причин запора.
Ключевые слова: диссинергия, запор,
кишечный транзит, расстройства дефекации.
Свобода кишечника — самая ценная, а возможно, и
самая важная из всех свобод, одно из тех условий,
без которых вряд ли кому-то удастся достичь
многого.
Emile Gautier, 1909 г.
Согласно широко принятому определению, запор —
это нарушение дефекации, проявляющееся снижением
частоты стула, затруднением опорожнения кишечника
или сочетанием этих симптомов [1]. Запором, как
показали многие исследования, страдает 12-19%
населения Северной Америки [2], а по данным
Канадских национальных исследований, это число
достигает 27% [3]. Патофизиология запора носит
многогранный характер, что усложняет его
классификацию. По одной из общепринятых
классификаций, запор делят на первичный и
вторичный. Причиной первичного запора служит
нарушение функции толстой кишки и аноректальной
области, тогда как причинами вторичного запора
могут быть органические и системные заболевания
или применение некоторых препаратов. Однако
установить тип запора по этой классификации бывает
сложно, поскольку при сборе анамнеза, физикальном
исследовании и проведении диагностических процедур
вторичные причины обычно исключаются.
В настоящей статье описаны механизмы транзита
содержимого по толстой кишке и процесс дефекации в
норме, представлен обзор причин запора.
ФИЗИОЛОГИЯ
ТОЛСТОЙ КИШКИ
Всасывание воды
В толстую кишку из тонкой ежедневно поступает
около 1,5 л жидкости, а с калом выводится только
200-400 мл. К функциям толстой кишки относятся
всасывание воды и транспортировка непереваренных
остатков в прямую кишку, откуда они выводятся
(сразу или спустя некоторое время) во время
дефекации. Удаление воды из каловых масс носит
время-зависимый характер, активно регулируется и
значительно увеличивается при дегидратации [4]. Из
кишечного содержимого через несколько транспортных
систем происходит активная реабсорбция ионов
натрия, за которыми по осмотическому градиенту
пассивно всасывается вода. Секреция воды в толстой
кишке осуществляется с помощью хлорных каналов,
например белка — регулятора мембранной
проводимости (трансмембранного регулятора
муковисцидоза, кодируется геном CFTR). В норме
этот канал практически бездействует, поэтому в
толстой кишке преобладают процессы реабсорбции
электролитов и воды [4]. Вследствие этого чем
дольше кишечное содержимое находится в толстой
кишке, тем меньше в нем остается воды, что
приводит к образованию фрагментированного кала
(«овечий» кал), а при значительном увеличении
объема и плотности каловых масс, затрудняющем их
транзит, — к каловому завалу. Холерный токсин,
избирательно стимулирующий белок — регулятор
мембранной проводимости, вызывает обильную
секреторную диарею. У больных муковисцидозом этот
белок не функционирует, что может проявляться
крайне низким содержанием воды в кале и запором. В
США для лечения запора широко используется
избирательный агонист белка — регулятора
мембранной проводимости любипростон, стимулирующий
кишечную секрецию, однако в Канаде данный препарат
не разрешен к применению.
Моторика толстой кишки
На макроуровне транзит содержимого по толстой
кишке и всасывание обеспечиваются двумя типами
моторной активности [5]. Ритмические
непропульсивные сокращения способствуют
оптимальной абсорбции и перемешиванию содержимого
при его продвижении по толстой кишке. Более мощные
координированные перистальтические сокращения
(высокоамплитудные распространяющиеся сокращения)
перемещают содержимое от восходящей ободочной
кишки к левой половине толстой кишки (рис. 1). Эти
сокращения обычно возникают утром, вскоре после
пробуждения и могут усиливаться под действием
других факторов, включая прием пищи или питье
(желудочно-кишечный рефлекс), что проявляется
позывами на дефекацию в это время. Известно, что в
норме моторика толстой кишки во время сна
значительно ослабевает, что предотвращает
недержание кала. Поэтому ночная перистальтика или
анальная недостаточность свидетельствуют о
выраженной патологии. Когда каловые массы попадают
в прямую кишку, ее стенки растягиваются и
возникает осознанный позыв к дефекации. Если
момент для опорожнения кишечника неподходящий,
прямая кишка адаптируется для временного хранения
каловых масс, позывы и перистальтика угасают. У
взрослых период транзита содержимого по толстой
кишке в норме составляет 20-72 ч [6, 7]. При
запоре частота высокоамплитудных
распространяющихся сокращений в толстой кишке
снижается, что, по-видимому, играет важную роль в
его развитии [7].
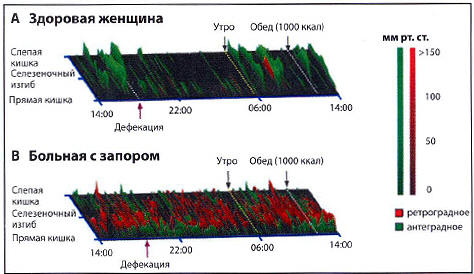
Рис. 1. Результаты 24-часовой
высокочувствительной манометрии толстой кишки (А)
у здоровой женщины из контрольной группы и (В)
женщины, с расстройством дефекации. Графики
представляют собой пространственно-временные карты
антеградно (зеленый) и ретроградно (красный)
распространяющегося сокращения толстой кишки. У
здоровой женщины (А) высокоамплитудные
распространяющиеся сокращения ясно различимы утром
после пробуждения и перед дефекацией. У больной с
расстройством дефекации (В) наблюдаются
множественные низкоамплитудные сокращения высокой
частоты, которые идут как в антеградном, так и
ретроградном направлении, и снижение частоты
высокоамплитудных распространяющихся сокращений.
Кроме того, у этой больной моторная активность
ночью не снижается, а в ответ на употребление
высококалорийной пищи, напротив, не повышается
[49]
На молекулярном уровне кишечная моторика
представляет собой сложный процесс, включающий
несколько уровней нервной и гуморальной регуляции,
начиная от толстой кишки и заканчивая ЦНС [8]. На
начальном, самом простом уровне медиатором
перистальтики как основного типа моторики служит
серотонин. При растяжении стенки кишки пищей или
каловыми массами энтерохромаффинные клетки
выделяют серотонин, который, в свою очередь,
активирует местные рефлексы опосредованные
энтеральными нейронами. Последние начинают
секретировать возбуждающие нейромедиаторы
(например, ацетилхолин), которые усиливают
моторику в области выше участка растяжения, и
тормозные медиаторы (например, оксид азота),
которые вызывают расслабление гладких мышц ниже
места растяжения. Благодаря этим процессам
содержимое продвигается по кишечнику вперед.
Повышение выработки серотонина, например, при
карциноидном синдроме вызывает выраженную диарею.
Таким образом, сложный процесс транзита
содержимого по толстой кишке требует нормального
функционирования ее эндокринных, нервных и
мышечных элементов.
В кишечнике обнаружено семь подтипов
серотониновых рецепторов, из которых наиболее
важная роль отводится 5-НТ4 и 5-НТ3. Первые из них
обеспечивают перистальтический ответ на серотонин.
Агонисты 5-НТ4, такие как цизаприд, тегасерод и
прукалоприд, использовались или используются
широко. С другой стороны, 5-НТ3-рецепторы
обеспечивают в основном чувствительное и
центральное звено регуляции. Поэтому блокаторы
5-НТ3-рецепторов, например ондансетрон, широко
применяются в качестве противорвотных средств.
Механизмы действия слабительных
С учетом нормальной физиологии толстой кишки
все слабительные можно разделить на осмотические и
стимулирующие. Осмотические слабительные, такие
как магния сульфат, лактулоза и полиэтиленгликоль
3350, способствуют поступлению воды в просвет
кишечника, что делает кал более мягким и повышает
частоту стула. Любипростон (в Канаде не разрешен к
применению) увеличивает содержание воды в просвете
кишечника за счет усиления секреции хлора.
Стимулирующие слабительные делятся на раздражающие
(например, бисакодил, сенна и кора крушины),
которые напрямую стимулируют афферентные волокна
или мышцы кишечной стенки, и энтерокинетики
(например, цизаприд, тегасерод и прукалоприд),
стимулирующие перистальтику.
Физиология
дефекации
Дефекация и удержание каловых масс — сложные,
координированные процессы, включающие наполнение
прямой кишки, формирование позыва, выведение
каловых масс и расслабление мышц тазового дна [9].
Удержание каловых масс обеспечивается
взаимодействием разных факторов. К ним относятся
анатомические структуры (включая сфинктеры заднего
прохода, лобково-прямокишечную мышцу и другие
мышцы тазового дна), изгибы прямой кишки
(например, аноректальный угол), поперечные складки
и геморроидальное сплетение в анальном канале,
образующие пассивные барьеры.
Внутренний сфинктер заднего прохода не
подчиняется сознательному контролю, состоит из
гладких мышц и на 70 % обеспечивает тонус заднего
прохода в покое. Наружный сфинктер заднего прохода
подчиняется сознательной воле, состоит из
поперечнополосатых мышц и на 30 % обеспечивает
тонус заднего прохода в покое. Сокращение
лобково-прямокишечной мышцы в покое поддерживает
аноректальный угол, а при натуживании уменьшает
его. Растяжение прямой кишки газами или каловыми
массами приводит к рефлекторному расслаблению
внутреннего сфинктера заднего прохода, что
известно как ректоанальный тормозный рефлекс (RAIR).
Этот рефлекс регулируется энтеральной нервной
системой без участия периферической и центральной
нервных систем. Выявление рефлекторного
расслабления внутреннего сфинктера с
помощью ректальной манометрии позволяет исключить
болезнь Гиршпрунга (врожденное заболевание,
проявляющееся отсутствием нейронов межмышечного
сплетения в дистальном отделе толстой кишки).
Растяжение прямой кишки каловыми массами в
норме приводит к расслаблению внутреннего и
наружного сфинктеров заднего прохода с последующим
формированием позыва на дефекацию (рис. 2).
Сенсорные механизмы, изученные пока недостаточно,
отвечают за восприятие содержимого прямой кишки,
такого как газы или стул. В отсутствие условий для
дефекации позывы на нее подавляются произвольным
сокращением наружного сфинктера. Расслабление
прямой кишки также подавляет позывы на дефекацию,
что способствует дальнейшему накоплению кала. При
наличии подходящих условий для дефекации человек
принимает положение сидя (или на корточках),
задерживает дыхание, напрягает диафрагму, мышцы
передней брюшной стенки и прямой кишки и
одновременно расслабляет наружный сфинктер и
лобково-прямокишечную мышцу [10]. Все это приводит
к открытию заднего прохода и выделению кала. Таким
образом, нормальное функционирование прямой кишки
и заднего прохода включает в себя сенсорное
восприятие и координацию физиологических
процессов.
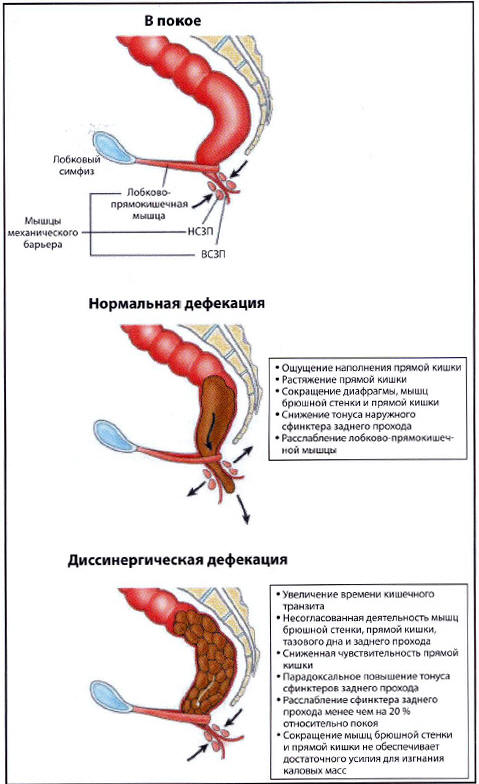
Рис. 2. Строение (в сагиттальной плоскости)
и физиология тазового дна в покое, при нормальной
и диссинергической дефекации. На верхнем рисунке
показано строение внутреннего (ВСЗП) и наружного
сфинктеров заднего прохода (НСЗП) в покое и
лобково-прямокишечной мышцы. При дефекации
сфинктеры заднего прохода и лобково прямокишечная
мышца расслабляются, а мышцы брюшной стенки и
прямой кишки сокращаются, что способствует
выталкиванию кала из прямой кишки. При
дискинетическом запоре сокращение мышц,
необходимое для продвижения кала к заднепроходному
каналу, и расслабление сфинктеров заднего прохода
и лобково-прямокишечной мышцы могут нарушаться,
что ведет к несогласованной работе мышц при
попытке дефекации (диссинергии) и задержке кала
[10]
Запор
К развитию запора могут приводить разные
причины и их сочетание. В зависимости от причин
запора его обычно подразделяют на первичный и
вторичный. Первичный запор обусловлен нарушением
функции толстой кишки и заднего прохода, а
вторичный — органическими и системными
заболеваниями или применением некоторых
лекарственных средств.
Первичный запор
Первичный запор развивается вследствие
нарушения функции прямой кишки или процесса
дефекации. Выявление этих нарушений осуществляют
только после исключения причин вторичного запора,
что часто можно сделать с помощью анамнеза (табл.
1). В отсутствие явных причин запора и
настораживающих симптомов в анамнезе назначают
эмпирическое лечение, которое часто начинается с
употребления растительной клетчатки или применения
слабительных либо того и другого одновременно.
Если такое лечение помогает, дополнительные
исследования обычно не требуются.
Таблица 1. Патофизиология
хронического запора
| Первичный запор |
Вторичный запор |
| Нормальный транзит (самый
распространенный тип) |
Лекарственные средства |
| Замедленный транзит |
Обструкция (например, опухолью,
стриктурами) |
| Расстройства дефекации |
Метаболические нарушения (например,
гипотиреоз, гиперкальциемия) Нервные
болезни (например, болезнь Паркинсона,
рассеянный склероз)
Системные заболевания (например,
системная склеродермия, амилоидоз)
Психические нарушения (например,
депрессия, расстройства пищевого поведения) |
При необходимости уточнения природы запора
проводят дальнейшие исследования, во время которых
в первую очередь устанавливают, где локализуется
поражение: в толстой кишке или аноректальной
области. Обычно для этого изучают эвакуаторную
функцию толстой кишки, чаще всего с помощью
рентгеноконтрастного исследования [11, 12]. Самый
простой из этих методов заключается в следующем:
пациента просят проглотить одну капсулу с
рентгеноконтрастными метками и через 5 дней (120
ч) после этого проводят обзорную рентгенографию
брюшной полости для оценки количества и
локализации оставшихся рентгеноконтрастных меток.
В течение этих 5 дней пациент не должен принимать
слабительные. Если через 5 дней в прямой кишке
остается более 20% рентгеноконтрастного материала,
это говорит о нарушении эвакуаторной функции. Это
исследование позволяет оценить примерную скорость
транзита содержимого по толстой кишке и может
проводиться в любом кабинете лучевой диагностики.
Существуют и другие методы диагностики этого
нарушения. Один из них основан на использовании
капсул с разным рентгеноконтрастным материалом на
протяжении нескольких последующих дней [7]. Этот
метод позволяет определить причину запора
(например, задержка меток в ректосигмоидном отделе
говорит о патологии заднего прохода, а диффузное
распределение меток в толстой кишке — о
замедленном транзите содержимого по толстой
кишке). Однако этот метод пока не стандартизован.
Хотя методы, основанные на сцинтиграфии [13] и
использовании радиокапсул [14], более стандартны и
надежны, они доступны не во всех клиниках.
Запор с нормальным транзитом
Запор с нормальным транзитом, или
функциональный запор — самый распространенный тип.
Римские критерии III для функционального запора
приведены в табл. 2. Больные с этой формой запора
жалуются на твердый кал и затруднение дефекации
[15]. Однако обследование не выявляет снижения
скорости транзита, а иногда и частоты стула [3,
16]. Вздутие живота, боль и неприятные ощущения в
животе, характерные для функционального запора,
часто вызывают психологический дискомфорт [17].
Эти симптомы, как правило, удовлетворяют критериям
синдрома раздраженного кишечника (СРК) с
преобладанием запора [16]. Назначение растительной
клетчатки, отдельно или в сочетании с
осмотическими слабительными либо
энтерокинетическими средствами, обычно помогает
уменьшить эти симптомы [18]. Поскольку в
большинстве случаев лечение носит эмпирический
характер и дает хорошие результаты, назначать
исследования для оценки скорости транзита бывает
нецелесообразно. Такой запор иногда называют
простым или алиментарным, связанным с недостатком
клетчатки в пище. Если эмпирическое лечение
оказывается неэффективным, обследование обычно
продолжают для исключения других причин первичного
запора.
Таблица 2. Римские критерии
III для функционального запора
Наличие 2 или более из следующих
симптомов:
Необходимость натуживания*
Плотный или фрагментированный кал*
Чувство неполного опорожнения прямой
кишки*
Чувство закупорки прямой кишки или
заднего прохода*
Необходимость ручного вспоможения для
опорожнения прямой кишки (например,
пальцевая эвакуация или поддержка тазового
дна)*
< 3 дефекаций в неделю
|
| В отсутствие приема слабительных
неоформленный стул — редкость |
| Отсутствие критериев СРК с преобладанием
запора |
Симптомы должны присутствовать не менее чем в
течение предшествующих 3 мес. при их начале более
6 мес. до постановки диагноза.
* Должны отмечаться не менее чем при 25 %
дефекаций [16].
Запор с замедленным транзитом
Эта форма запора чаще встречается у молодых
женщин [19] и проявляется редким стулом (обычно
реже 1 раза в неделю). Больные часто не испытывают
позывов на дефекацию и жалуются на вздутие и
неприятные ощущения в животе. Как следует из
названия этой формы запора, он характеризуется
медленным транзитом содержимого по толстой кишке и
редкими высокоамплитудными распространяющимися
сокращениями [7] (см. рис. 1).
При выраженном снижении скорости транзита по
толстой кишке, отсутствии усиления моторики
кишечника после еды или применения стимулирующих
слабительных, например бисакодила или
прокинетических средств, говорят об инертной
толстой кишке [20]. Однако это понятие не имеет
однозначного определения и никак не влияет на
выбор лечения [20].
По-видимому, в основе запора с замедленным
транзитом лежат нервно-мышечные нарушения в
толстой кишке. Так, у больных с этой формой запора
в кишечной стенке обнаружено снижение числа
интерстициальных клеток Кахаля [21] и нейронов
межмышечного сплетения, выделяющих вещество Р
[22]. В недавно разработанной Лондонской
классификации заболеваний ЖКТ с нервно-мышечными
нарушениями гипоганглиоз, воспалительная
нейропатия и дегенеративная лейомиопатия
рассматриваются как причины запора с замедленным
транзитом [23]. Поскольку эти заболевания описаны
совсем недавно, их лечение, а значит, и лечение
обусловленного ими запора пока не разработано.
Больные с этой формой запора обычно нуждаются в
частом приеме слабительных. Однако стимулирующие
слабительные при их длительном применении в
высоких дозах сами по себе могут замедлять транзит
по толстой кишке, поэтому их использование при
запоре с нормальной скоростью транзита и СРК в
конечном итоге может приводить к запору со
сниженной скоростью транзита. Некоторым пациентам
с этой формой запора без выраженного нарушения
функции тазового дна и диссинергии помогает
субтотальная колэктомия с наложением
илеоректального анастомоза [24].
Расстройства дефекации
Под расстройствами дефекации понимают запор,
обусловленный функциональными и структурными
изменениями в аноректальной области. Для
опорожнения прямой кишки пациентам с этими
расстройствами приходится сильно натуживаться и
ежедневно проводить в туалете много времени.
Зачастую им приходится удалять кал из прямой кишки
с помощью пальцев, принимать во время дефекации
специальные позы или использовать клизмы.
Дефекация у них может быть затруднена даже при
жидком стуле. Слабительные им часто не помогают.
Тонус мышц тазового дна у этих больных может быть
постоянно повышен, что создает предпосылки для
развития геморроя и образования трещин заднего
прохода, в т. ч. хронических. В свою очередь,
длительное подавление дефекации из-за боли при
трещинах заднего прохода может приводить к
расстройствам дефекации. В более редких случаях
причиной расстройства дефекации служат структурные
изменения в аноректальной области, включая
инвагинацию и выпадение прямой кишки, ректоцеле и
синдром опущения промежности.
Диссинергия (возможно, самое частое
функциональное расстройство дефекации) носит
приобретенный характер и связана с образом жизни и
привычками. В большинстве случаев причинами
диссинергии служат пренебрежение правилами
посещения туалета, боль при дефекации, повреждение
при родах, травмы спины, нарушение связи между ЦНС
и энтеральной нервной системой [25, 26]. У
некоторых пациентов в анамнезе можно найти
упоминания о половом или физическом насилии,
расстройстве пищевого поведения. У детей запор
может приводить к недержанию кала вследствие
подтекания жидкого стула вокруг плотного [27]. У
больных с диссинергией нарушается координация
тонуса мышц брюшной стенки, аноректальной области
и тазового дна во время дефекации и может
снижаться чувствительность прямой кишки [26].
Диссинергия может проявляться спазмом наружного
сфинктера заднего прохода, нарушением функции мышц
тазового дна, спазмом лобково-прямокишечной мышцы
и анальным спазмом. Хотя названия всех этих
нарушений имеют свои нюансы, отражающие разную
этиологию диссинергии, многие врачи используют их
как синонимы.
Диагностические критерии расстройств дефекации,
связанных с диссинергией, включают [26]:
- Соответствие диагностическим критериям
хронического запора (Римские критерии III).
- Выявление диссинергии при повторных попытках
дефекации с помощью ректальной манометрии,
методов визуализации или электромиографии. О
диссинергии говорит выявленное с помощью этих
исследований парадоксальное увеличение тонуса
сфинктера заднего прохода, его расслабление при
дефекации менее чем на 20 % относительно тонуса
в покое или низкий тонус мышц брюшной стенки и
прямой кишки.
- Наличие одного из следующих симптомов:
- неспособность эвакуации введенного в
прямую кишку баллона, содержащего 50 мл воды
(симуляция дефекации), в течение 1 мин;
- увеличение времени кишечного транзита;
- неспособность к эвакуации бариевой взвеси
или задержка не менее 50 % бариевой взвеси во
время дефекографии.
Необходимо отметить, что замедление транзита
содержимого по толстой кишке может наблюдаться как
при расстройствах дефекации, так и при запоре с
замедленным транзитом. Для диагностики разных форм
первичного запора приходится использовать
несколько методов исследований в связи с их низкой
специфичностью; важнейшую роль в диагностике
играет анамнез. Ректальная манометрия и
дефекография проводятся только в
специализированных центрах. Ректальная манометрия,
как следует из ее названия, заключается в оценке
давления с помощью манометра в заднепроходном
канале в покое, при сокращении сфинктера и
натуживании. Обычно во время этого исследования
определяют также порог чувствительности прямой
кишки. В завершение обследования выполняют
баллонный тест, во время которого пациент должен
эвакуировать введенный в прямую кишку баллон,
заполненный стандартным объемом воды. Этот тест
позволяет объективно оценить способность пациента
к дефекации. Ректальная манометрия и баллонный
тест считаются «золотым стандартом» диагностики
функциональных расстройств дефекации [28].
Во время дефекографии в прямую кишку вводят
бариевую взвесь для стимуляции стула. В то время
как пациент пытается опорожнить прямую кишку,
выполняют рентгеноскопию.
Этот метод исследования дает ценную информацию
о структурных и, в меньшей степени, функциональных
изменениях аноректальной области. Он позволяет
обнаружить изменения, не выявляемые при
клиническом или эндоскопическом исследовании,
включая ректоцеле, инвагинацию и выпадение прямой
кишки и опущение промежности. Функциональные
нарушения могут проявляться слабой активацией
поднимающих мышц, задержкой бариевой взвеси или
невозможностью ее эвакуации. Дефекография особенно
информативна при подозрении на структурные
изменения заднего прохода.
Если оценка функций аноректальной области
недоступна, больным с симптомами функциональных
расстройств дефекации можно назначить физиотерапию
и, по возможности, лечение методами биологической
обратной связи. Лечение нарушений функций тазового
дня с помощью физиотерапии, направленное в первую
очередь на обучение пациентов и восстановление
координированных механизмов дефекации, доступно в
большинстве медицинских центров. Оно не приводит к
осложнениям и дает хорошие результаты [26-29].
Вторичный запор
Лекарственные средства, вызывающие запор.
Поскольку побочные эффекты многих препаратов
включают запор, в начале обследования обязательно
проводят тщательный сбор анамнеза [30,31].
Гипотензивные средства, включая клонидин,
антагонисты кальция и ганглиоблокаторы, снижают
тонус гладких мышц и могут вызывать запор. Поэтому
пациентам с запором для снижения АД рекомендуется
назначать β-адреноблокаторы, ингибиторы
ангиотензинпревращающего фермента или блокаторы
ангиотензиновых рецепторов [32]. Антидепрессанты,
особенно трициклические, также вызывают запор,
поэтому вместо них этим больным назначают
селективные ингибиторы обратного захвата
серотонина и ингибиторы обратного захвата
серотонина и норадреналина, т. к. они реже
приводят к запору [33].
Поскольку препараты железа для приема внутрь
часто вызывают запор, вместо них используют
препараты железа для в/в введения или
дополнительно назначают слабительные. Средства,
содержащие алюминий, например сукральфат и
антациды, которые также вызывают запор, можно
заменить на ингибиторы Н+,К+-АТФазы [34]. Среди
всех средств, вызывающих запор, особенно хорошо
известны наркотические анальгетики, включая
опиаты, а также каннабиноиды. Вместо них можно
использовать анальгетики других групп или
назначать опиаты в сочетании с антагонистами
наркотических анальгетиков, такими как налоксон
или метилналтрексон [35].
Противопаркинсонические, противоэпилептические
средства и нейролептики также способны вызывать
запор за счет их антихолинергического и
дофаминергического действия. Поэтому при
склонности к запору эти препараты не используют
или назначают вместе с регулярным приемом
слабительных. Поскольку антигистаминные средства,
спазмолитики, винбластин и винкристин вызывают
запор, при склонности к нему их заменяют на другие
препараты [30, 31].
Запор при
неврологических нарушений
Причиной хронического запора могут быть
некоторые неврологические заболевания, например
вегетативная нейропатия, сахарный диабет и другие
эндокринные болезни, а также болезнь Шагаса и
болезнь Гиршпрунга.
Сахарный диабет вызывает множество
желудочно-кишечных осложнений, самые частые из
которых — нарушение эвакуаторной функции желудка и
энтеропатия. Диабетическая энтеропатия может
проявляться диареей, запором, недержанием кала,
которые могут сменять друг друга или возникать
одновременно. Хотя в ряде исследований показано,
что вегетативная нейропатия, лежащая в основе
диабетической энтеропатии, может быть основной
причиной запора у больных сахарным диабетом, точно
это пока не установлено. Частота запора повышена
при сахарном диабете обоих типов, хотя точных
статистических данных на этот счет пока нет [36].
Неизвестно также, почему у женщин с сахарным
диабетом запор возникает чаще, чем у мужчин.
Несмотря на многочисленные исследования по
изучению возможных механизмов развития
желудочно-кишечных расстройств при сахарном
диабете, выявить какой-либо один фактор риска пока
не удалось. Возможно, к этим нарушениям приводит
сочетание разных факторов, включая как обратимые,
так и необратимые острые и хронические процессы.
Несмотря на предположение о роли вегетативной
нейропатии, многие данные указывают на четкую
связь между желудочно-кишечными нарушениями,
включая запор, недостаточной компенсацией
сахарного диабета и, в меньшей степени,
продолжительностью заболевания [37]. Интересно,
что вегетативная нейропатия не влияет на частоту
запора у больных сахарным диабетом, что
свидетельствует не в пользу предположения о ее
ключевой роли в развитии запора.
Моделирование острых и хронических болезней и
воздействий показывает, что как гипер-, так и
гипогликемия нарушают функцию энтеральной нервной
системы и вызывают запор [38]. Это подчеркивает
первостепенную важность контроля за уровнем
глюкозы для предупреждения и лечения запора у
больных сахарным диабетом.
Точный механизм развития запора у больных
сахарным диабетом неизвестен, хотя высказываются
предположения, что одним из них может быть гибель
интерстициальных клеток Кахаля [39, 40].
Интерстициальные клетки Кахаля — водители
ритма, играют ключевую роль в активации и
координации фазных и распространяющихся
сокращений. Другой функцией этих клеток служит
контроль за передачей возбуждающих и тормозных
нервных импульсов гладкомышечным клеткам. В ряде
исследований [41] у больных сахарным диабетом было
обнаружено изменение числа клеток Кахаля,
возбуждающих и тормозных нейронов, однако
функциональные последствия этих изменений пока
неизвестны.
Еще один возможный патофизиологический механизм
запора при сахарном диабете заключается в развитии
висцеральной миопатии, нарушающей моторику и
снижающей скорость транзита кишечного содержимого.
К замедлению транзита кишечного содержимого и
запору при сахарном диабете могут также приводить
нейроэндокринные нарушения. В дальнейших
исследованиях предстоит выяснить роль других
механизмов, включая аутоиммунное поражение тканей,
нарушение трофики нервной и мышечной ткани и
апоптоз, в патогенезе запора при сахарном диабете
[42]. Все перечисленные механизмы вносят тот или
иной вклад в развитие желудочно-кишечных
осложнений сахарного диабета и приводят к
нарушению моторной функции ЖКТ, включая такие
сложные процессы, как перистальтика, изменение
тонуса сфинктеров и ритмическая сегментация [42,
43].
Нейрогенная дисфункция толстой кишки при
повреждении спинного мозга, рассеянном склерозе и
болезни Паркинсона
Травмы спинного мозга, рассеянный склероз и
болезнь Паркинсона часто приводят к запору.
Развитие запора при этих заболеваниях носит
комплексный характер и включает нарушение функций
вегетативных и тазовых нервов, обусловленное
основным заболеванием, и разнообразные системные
факторы — от изменения потребления жидкой и
твердой пищи до особенностей поведения,
ограничения двигательной активности и психических
нарушений. Кроме того, запор может быть обусловлен
препаратами, используемыми для лечения этих
заболеваний. Таким больным рекомендуется регулярно
принимать слабительные.
Нарушение функции толстой кишки, возникающее
примерно у 70 % больных рассеянным склерозом,
проявляется недержанием кала и запором, которые
часто сочетаются друг с другом [44, 45].
Патофизиологические механизмы нарушения функции
толстой кишки при рассеянном склерозе изучены
недостаточно. В небольших исследованиях выявлено
снижение активности толстой кишки, замедление
кишечного транзита у больных рассеянным склерозом.
Это говорит о том, что основной причиной запора
при этом заболевании служит нарушение моторики
толстой кишки [46]. Лечение запора у этих больных
носит симптоматический характер. Однако перед
назначением слабительных необходимо исключить
спастические расстройства мышц тазового дна,
поскольку они могут быть причиной неэффективности
данных препаратов.
Болезнь Паркинсона также сопровождается
нарушением функций ЖКТ. Это заболевание часто
приводит к желудочно-кишечным осложнениям, включая
дисфагию, нарушение моторики пищевода и запор. В
то время как дисфагия и нарушение моторики
пищевода развиваются на поздних стадиях болезни,
запор может возникать на более ранних стадиях,
иногда до появления нарушений моторики кишечника
[47]. Развитие запора при болезни Паркинсона
обусловлено центральными и периферическими
механизмами. Центральные механизмы включают
нарушение функции заднего ядра блуждающего нерва,
хотя четкой связи между числом погибших нейронов,
содержанием телец Леви в живых клетках в этом
участке мозга и тяжестью запора не обнаружено
[48]. Уменьшение количества дофаминергических
нейронов на периферии вносит свой вклад в развитие
запора, однако лечение дофамином обычно не
устраняет симптомы у этих больных.
Заключение
Запор — весьма распространенное явление.
Причины его разнообразны. Выяснение первичных
причин запора, особенно его тяжелых форм, играет
важнейшую роль в выборе лечения.
Конфликты интересов. Д-р С. Andrews выполнял
обязанности консультанта и члена наблюдательного
совета, получал гонорары от компании Janssen, Inc.
Д-р Martin Storr заявляет об отсутствии конфликтов
финансовых и других интересов.
Литературы
- Brandt LJ, Prather CM, Quigley EM, Schiller
LR, Schoenfeld P, Talley NJ. Systematic review
on the management of chronic constipation in
North America. Am J Gastroenterol 2005;100(Suppl
1):S5-S21.
- Higgins PD, Johanson JF. Epidemiology of
constipation in North America: A systematic
review. Am J Gastroenterol 2004;99:750-9.
- Pare P, Ferrazzi S, Thompson WG, Irvine EJ,
Ranee L. An epidemio-logical survey of
constipation in Canada: Definitions, rates,
demographics, and predictors of health care
seeking. Am J Gastroenterol 2001;96:3130-7.
- Sleisenger MH, Feldman M, Friedman LS,
Brandt LJ. Sleisenger & Fordtran's
Gastrointestinal and Liver Disease:
Pathophysiology, Diagnosis, Management, 8th edn.
Philadelphia: Saunders, 2006:2127-46.
- Sleisenger MH, Feldman M, Friedman LS,
Brandt LJ. Sleisenger & Fordtran's
Gastrointestinal and Liver Disease:
Pathophysiology, Diagnosis, Management. 8th ed,
Philadelphia: Saunders, 2006:2111-26.
- Southwell BR, Clarke MC, Sutcliffe J, Hutson
JM. Colonic transit studies: Normal values for
adults and children with comparison of
radiological and scintigraphic methods. Pediatr
Surg Int 2009;25:559-72.
- Dinning PG, Smith TK, Scott SM.
Pathophysiology of colonic causes of chronic
constipation. Neurogastroenterol Motil
2009;21:20-30.
- Grundy D, Al-Chaer ED, Aziz Q, et al.
Fundamentals of neurogastroenterology: Basic
science. Gastroenterology 2006;130:1391-411.
- Bharucha AE. Pelvic floor: Anatomy and
function. Neurogastroenterol Motil
2006;18:507-19.
- Rao SS. Advances in diagnostic assessment of
fecal incontinence and dyssynergic defecation.
Clin Gastroenterol Hepatol 2010;8:910-9.
- Hinton JM, Lennard-Jones JE, Young AC. A new
method for studying gut transit times using
radioopaque markers. Gut 1969;10:842-7.
- Rao SS, Camilleri M, Hasler WL, et al.
Evaluation of gastrointestinal transit in
clinical practice: Position paper of the
American and European Neurogastroenterology and
Motility Societies. Neurogastroenterol Motil
2011;23:8-23.
- Burton DD, Camilleri M, Mullan В P, Forstrom
LA, Hung JC. Colonic transit scintigraphy
labeled activated charcoal compared with ion
exchange pellets. J Nucl Med 1997;38:1807-10.
- Camilleri M, Thorne NK, Ringel Y, et al.
Wireless pH-motility capsule for colonic transit:
Prospective comparison with radiopaque markers
in chronic constipation. Neurogastroenterol
Motil 2010;22:874-82,e233.
- Cash BD, Chey WD. Review article: The role
of serotonergic agents in the treatment of
patients with primary chronic constipation.
Aliment Pharmacol Ther 2005;22:1047-60.
- Longstreth GF, Thompson WG, Chey WD,
Houghton LA, Mea-rin F, Spiller RC. Functional
bowel disorders. Gastroenterology
2006;130:1480-91.
- Ashraf W, Park F, Lof J, Quigley EM. An
examination of the reliability of reported stool
frequency in the diagnosis of idiopathic
constipation. Am J Gastroenterol 1996;91:26-32.
- Tack J, Muller-Lissner S. Treatment of
chronic constipation: Current pharmacologic
approaches and future directions. Clin
Gastroenterol Hepatol 2009;7:502-8; quiz 496.
- Preston DM, Lennard-Jones JE. Severe chronic
constipation of young women: 'Idiopathic slow
transit constipation'. Gut 1986;27:41-8.
- Bassotti G, Roberto GD, Sediari L, Morelli
A. Toward a definition of colonic inertia. World
J Gastroenterol 2004;10:2465-7.
- He CL, Burgart L, Wang L, et al. Decreased
interstitial cell of Cajal volume in patients
with slow-transit constipation. Gastroenterology
2000;118:14-21.
- Tzavella K, Riepl RL, Klauser AG,
Voderholzer WA, Schindlbeck NE, Muller-Lissner
SA. Decreased substance P levels in rectal
biopsies from patients with slow transit
constipation. Eur J Gastroenterol Hepatol
1996;8:1207-11.
- Knowles CH, De Giorgio R, Kapur RP, et al.
The London Classification of gastrointestinal
neuromuscular pathology: Report on behalf of the
Gastro 2009 International Working Group. Gut
2010;59:882-7.
- Nyam DC, Pemberton JH, Ustrup DM, Rath DM.
Long-term results of surgery for chronic
constipation. Dis Colon Rectum 1997;40:273-9.
- Remes-Troche JM, Rao SS. Neurophysiological
testing in anorectal disorders. Expert Rev
Gastroenterol Hepatol 2008;2:323-35.
- Rao SS. Dyssynergic defecation and
biofeedback therapy. Gastroenterol Clin North Am
2008;37:569-86, viii.
- Loening-Baucke V. Encopresis and soiling.
Pediatr Clin North Am 1996;43:279-98.
- Rao SS, Ozturk R, Laine L. Clinical utility
of diagnostic tests for constipation in adults:
A systematic review. Am J Gastroenterol
2005;100:1605-15.
- Rao SS. Biofeedback therapy for constipation
in adults. Best Pract Res Clin Gastroenterol
2011;25:159-66.
- Storr M, Allescher HD. [Motility-modifying
drugs]. Internist (Berl) 2000;41:1318-24, 26-30.
- Fosnes GS, Lydersen S, Farup PG.
Constipation and diarrhoea - common adverse drug
reactions? A cross sectional study in the
general population. ВМС Clin Pharmacol
2011;11:2.
- Simonson W, Han LF, Davidson HE.
Hypertension treatment and outcomes in US
nursing homes: Results from the US National
Nursing Home Survey. J Am Med Dir Assoc
2011;12:44-9.
- Dolder C, Nelson M, Stump A. Pharmacological
and clinical profile of newer antidepressants:
Implications for the treatment of elderly
patients. Drugs Aging 2010;27:625-40.
- Talley NJ, Jones M, Nuyts G, Dubois D. Risk
factors for chronic constipation based on a
general practice sample. Am J Gastroenterol
2003;98:1107-11.
- Rosti G, Gatti A, Costantini A, Sabato AF,
Zucco F. Opioid-related bowel dysfunction:
Prevalence and identification of predictive
factors in a large sample of Italian patients on
chronic treatment. Eur Rev Med Pharmacol Sci
2010;14:1045-50.
- Mjornheim AC, Finizia C, Blohme G, Attvall S,
Lundell L, Ruth M. Gastrointestinal symptoms in
type 1 diabetic patients, as compared to a
general population. A questionnaire-based study.
Digestion 2003;68:102-8.
- Clouse RE, Lustman PJ. Gastrointestinal
symptoms in diabetic patients: Lack of
association with neuropathy. Am J Gastroenterol
1989;84:868-72.
- Takahashi T, Matsuda К, Kono T, Pappas TN.
Inhibitory effects of hyperglycemia on neural
activity of the vagus in rats. Intensive Care
Med 2003;29:309-11.
- He CL, Soffer ЕЕ, Ferris CD, Walsh RM,
Szurszewski JH, Farrugia G. Loss of interstitial
cells of Cajal and inhibitory innervation in
insulin-dependent diabetes. Gastroenterology
2001;121:427-34.
- Horvath VJ, Vittal H, Lorincz A, et al.
Reduced stem cell factor links smooth myopathy
and loss of interstitial cells of Cajal in
murine diabetic gastroparesis. Gastroenterology
2006;130:759-70.
- Ordog T. Interstitial cells of Cajal in
diabetic gastroenteropathy. Neurogastroenterol
Motil 2008;20:8-18.
- Verne GN, Sninsky CA. Diabetes and the
gastrointestinal tract. Gastroenterol Clin North
Am 1998;27:861-74, vi-vii.
- Sellin JH, Chang EB. Therapy insight:
Gastrointestinal complications of diabetes -
pathophysiology and management. Nat Clin Pract
Gastroenterol Hepatol 2008;5:162-71.
- Glick ME, Meshkinpour H, Haldeman S, Bhatia
NN, Bradley WE. Colonic dysfunction in multiple
sclerosis. Gastroenterology 1982;83:1002-7.
- Hinds J P, Wald A. Colonic and anorectal
dysfunction associated with multiple sclerosis.
Am J Gastroenterol 1989;84:587-95.
- Preziosi G, Emmanuel A. Neurogenic bowel
dysfunction: Pathophysiology, clinical
manifestations and treatment. Expert Rev
Gastroenterol Hepatol 2009;3:417-23.
- Abbott RD, Petrovitch H, White LR, et al.
Frequency of bowel movements and the future risk
of Parkinson's disease. Neurology
2001;57:456-62.
- Cersosimo MG, Benarroch ЕЕ. Neural control
of the gastrointestinal tract: Implications for
Parkinson disease. Mov Disord 2008;23:1065-75.
- Dinning PG, Szczesniak MM, Cook IJ.
Twenty-four hour spatiotem-poral mapping of
colonic propagating sequences provides
patho-physiological insight into constipation.
Neurogastroenterol Motil 2008;20:1017-21.
Статья опубликована на сайте
http://www.gastroscan.ru