Цитогенетические изменения и
перекисное окисление липидов у больных
гастроэзофагеальной рефлюксной болезнью в сочетании
с метаболическим синдромом
Д.Я. Тадтаева1,2,
Л.Г. Ранюк1,2, С.К. Аликова1,2,
Н.М. Бурдули1,2
1 Институт биомедицинских исследований
Владикавказского научного центра РАН
2 ФГБОУ ВО «Северо-Осетинская
государственная медицинская академия» Минздрава
России, г. Владикавказ
Цель – изучить цитогенетические изменения
слизистой оболочки пищевода и особенности
перекисного окисления липидов у больных
гастроэзофагеальной рефлюксной болезнью (ГЭРБ) в
сочетании с метаболическим синдромом (МС).
Материал и методы. Обследованы 122 пациента
ГЭРБ в сочетании с МС, у которых в ходе обследования
оценивались цитогенетические изменения слизистой
оболочки пищевода, а также показатели перекисного
окисления липидов и антиоксидантной защиты.
Результаты. Частота встречаемости клеток с
цитогенетическими нарушениями в мукоцитах
дистального отдела слизистой оболочки пищевода в
группе больных, инфицированных Н. pylori,
превосходил почти в два раза аналогичный показатель
в группе участников без H. pylori, а уровень
продуктов окисления липидов у пациентов с эзофагитом
превышал нормальные значения.
Заключение. У больных ГЭРБ, сочетающейся с
МС, процесс воспаления неблагоприятно влияет на
дистальный отдел слизистой пищевода в отношении
генотоксичности мукоцитов, а активация процессов
перекисного окисления липидов происходит при всех
вариантах течения заболевания.
Ключевые слова: метаболический синдром,
гастроэзофагеальная рефлюксная болезнь, перекисное
окисление липидов, цитогенетическое исследование.
Авторы заявляют об отсутствии возможных
конфликтов интересов.
Для цитирования: Д.Я. Тадтаева, Л.Г. Ранюк,
С.К. Аликова, Н.М. Бурдули. Цитогенетические
изменения и перекисное окисление липидов у больных
гастроэзофагеальной рефлюксной болезнью в сочетании
с метаболическим синдромом. Doi: https: //dx.doi.org/10.18565/
Терапия. 2019; 3 [29]:32–36
В России, как и в большинстве экономически
развитых стран мира, метаболический синдром (МС)
является актуальной проблемой, чья
распространенность неуклонно растет. МС
характеризуется увеличением объема висцерального
жира и снижением чувствительности периферических
тканей к инсулину, что вызывает развитие нарушений
углеводного, липидного, пуринового обменов,
артериальной гипертензии, атеросклероза, заболеваний
печени, почек, репродуктивной системы,
онкологической патологии, а это, в свою очередь,
повышает риск сердечно-сосудистой и общей смертности
[1–3].
Органы пищеварения имеют непосредственное отношение
к развитию МС и сами при этом становятся
органами-мишенями. Нарушение пищевого поведения,
дисбаланс гормонов пищеварительного тракта,
функциональное состояние печени, поджелудочной
железы, нарушение микробной экологии толстой кишки –
ключевые патогенетические факторы развития МС [4,
5].
Избыточная активация липидной триады,
катехоламинового звена, гиперсекреция глюкагона,
кортизола и паратгормона ведут к прогрессирующим
расстройствам метаболизма, сочетающимся со снижением
резистентности слизистой оболочки желудка и
двенадцатиперстной кишки, нарушением моторной
функции пищеварительного тракта [4, 6]. При МС
мобилизация энергетических и структурных резервов
(глюкозы, жирных кислот, нуклеотидов, аминокислот) в
условиях проявления стресс-реакции имеет целью
обеспечение срочной адаптации организма к
изменившимся условиям существования с формированием
транзиторной инсулинорезистентности, направленной на
адекватное распределение энергетических субстратов
[6, 7].
Воздействие гиперинсулинемии и
инсулинорезистентности на ранних стадиях развития МС
трактуется неоднозначно, но дальнейшее
прогрессирование нарушений углеводного и липидного
обменов и сосудистые катастрофы отягощают течение
болезней желудочно-кишечного тракта (ЖКТ) [8].
Состояние органов пищеварения и их роль в развитии
МС малоизвестны клиницистам, поэтому изучение
патологии верхних отделов ЖКТ в рамках МС
представляется интересным.
В связи с этим целью исследования явилось изучение
цитогенетических изменений в слизистой оболочке
пищевода и показателей перекисного окисления липидов
у больных гастроэзофагеальной рефлюксной болезнью (ГЭРБ)
в сочетании с МС.
Материал и методы
Исследование проводили на базе клинической
больницы скорой медицинской помощи г. Владикавказа.
В исследовании приняли участие 122 пациента с МС,
сочетающимся с ГЭРБ (55 мужчин и 67 женщин, средний
возраст составил 43,2±6,6 лет). Диагноз
устанавливался в соответствии с критериями
Всероссийского научного общества кардиологов (ВНОК)
от 2009 г., данных фиброэзофагогастродуоденоскопии (ФЭГДС)
и суточной рН-метрии пищевода. МС выставлялся
больным при наличии основного признака
(абдоминальный тип ожирения – объем талии >80 см у
женщин и >94 см у мужчин) и двух дополнительных
(артериальная гипертензия ≥140/90 мм рт.ст.,
повышение уровня триглицеридов ≥1,7 ммоль/л,
снижение уровня холестерина липопротеинов высокой
плотности <1,0 ммоль/л у мужчин, <1,2 ммоль/л у
женщин; повышение уровня холестерина липопротеинов
низкой плотности >3,0 ммоль/л; гипергликемия натощак
≥6,1 ммоль/л; нарушение толерантности к глюкозе –
глюкоза в плазме крови через 2 ч после нагрузки
глюкозой в пределах ≥7,8 и ≤11,1 ммоль/л) [1, 2, 6,
9, 10].
Метод инструментальной диагностики включал
обязательное выполнение эзофагогастродуоденоскопии (ЭГДС)
с одновременной биопсией слизистой оболочки пищевода
и суточный мониторинг рН-пищевода. Эндоскопическое
исследование выполняли по общепринятой методике, в
процессе которой оценивали состояние слизистой
оболочки: степень выраженности воспаления,
гиперплазию и наличие атрофических изменений
слизистой оболочки в эзофагогастродуоденальной зоне.
Всем обследованным больным выполняли в ходе ФЭГДС
прицельную биопсию из дистального отдела пищевода и
определение инфекции Helicobacter pylori с
помощью уреазного теста.
Исследование суточной рН-метрии проводили с помощью
аппарата «Гастроскан-ГЭМ» (Россия). Цитогенетическое
исследование было проведено методом микроядерного
теста в мазках отпечатках. Мазки-отпечатки
высушивали на воздухе, фиксировали этанолом (96%) в
течение 5 мин и окрашивали азур-эозином по
Романовскому. От каждого пациента был получен один
рутинно окрашенный цитологический препарат, в
котором анализировали максимальное количество
мукоцитов покровно-ямочного эпителия. Использовались
следующие критерии: не допускалось наложения клеток
друг на друга, основное ядро и микроядро были
расположены в цитоплазме и находились в одном
оптическом поле, характер окрашивания хроматина
микроядер соответствовал или был чуть бледнее
окраски основного ядра; микроядра имели округлую или
овальную формы [8, 11].
Отдельно в мазках-отпечатках учитывались мукоциты с
морфологическими аномалиями ядра (выпячивание ядра в
цитоплазму, а также наличие двух ядер в мукоцитах и
париетальных клетках). В среднем у каждого пациента
было исследовано 1600 мукоцитов слизистой оболочки
желудка.
Определение малонового диальдегида (МДА) в
эритроцитах проводили по принципу, основанному на
образовании окрашенного комплекса при взаимодействии
МДА с тиобарбитуровой кислотой.
Определение активности каталазы в плазме крови
проводили методом, основанным на способности
перекиси водорода образовывать с солями молибдена
стойкий окрашенный комплекс.
Определение активности церулоплазмина проводили
модифицированным методом Равина. Метод основан на
ферментативном окислении n-фенилендиамина
церулоплазмином. Реакция останавливается добавлением
натрия фторида. По оптической плотности образующихся
окрашенных продуктов судят о концентрации
церулоплазмина.
Для определения средних нормальных величин изучаемых
показателей было обследовано 30 практически здоровых
лиц.
Оценку статистической значимости различий средних в
случаях двух выборок проводили с использованием
t-критерия (критерия Стьюдента) и непараметрического
U-критерия Вилкоксона–Манна–Уитни.
Результаты и обсуждение
Неэрозивная ГЭРБ выявлена у 75 пациентов (61%), у
остальных 47 (49%) обнаружились изменения слизистой
дистального отдела пищевода по данным классификации
Savary–Miller. Так, у 21 пациента выявлены признаки
I степени тяжести эзофагита, у 16 – признаки II
степени, у 8 – III степени тяжести, еще у 2
пациентов обнаружены язвы пищевода.
Инфицированными H. рylori оказались 65
пациентов метаболическим синдромом в сочетании с
ГЭРБ, а у 57 пациентов H. рylori не был
выявлен.
У пациентов с эндоскопически доказанным эзофагитом
инфицирование H. рylori встречалось чаще,
нежели в группе больных без эзофагита, причем
процент выявления инфекции был тем выше, чем была
тяжелее степень эзофагита. У больных с МС выявлена
достоверная прямая (сильная) связь между частотой
встречаемости этой инфекции и степенью выраженности
эзофагита (r=0,89; р <0,05).
Цитогенетическое изучение эпителия слизистой
оболочки дистального отдела пищевода у больных с МС
в сочетании с ГЭРБ выявило наличия мукоцитов с
микроядрами как в группе больных с наличием H.
pylori, так и в группе без H. pylori
(табл. 1).
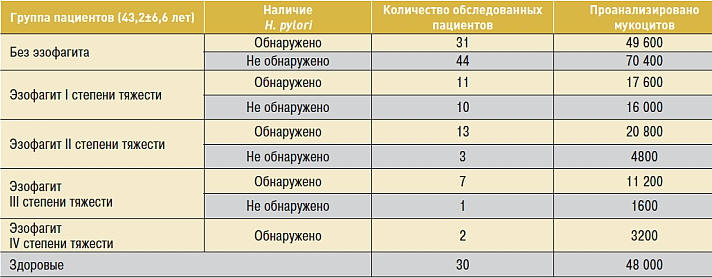
Средняя частота встречаемости мукоцитов в группе
неинфицированных больных составила 0,19‰ (р <0,05),
тогда как в группе пациентов с наличием Нр данный
показатель составил 0,35‰ (р <0,05). То есть
различия частоты клеток с цитогенетическими
нарушениями в мукоцитах дистального отдела слизистой
оболочки пищевода во второй группе больных
превосходили первую почти в 2 раза. Обнаруженные
данные, возможно, связаны с рядом причин. По данным
литературы [8, 11], образование микроядер указывает
на снижение жизнеспособности клеток, что является
показателем нестабильности их функционирования,
активизации процессов воспаления с образованием
свободных форм кислорода. Последние индуцируют
цепные реакции перекисного окисления липидов (ПОЛ),
а наличие H. pylori-инфекции усугубляет этот
процесс.
Как известно, процессы ПОЛ носят общебиологический
характер и служат необходимым метаболическим звеном
и универсальным механизмом повреждения клеток,
вызывая увеличение проницаемости клеточных мембран
и, как следствие, цитолиз. Накопление продуктов ПОЛ
тормозит клеточное деление, оказывает
вазоконстрикторное действие, ухудшает перфузию
тканей [6].
Изменения, выявленные у обследуемых больных при
исследовании ПОЛ и антиоксидантной защиты, отражены
в таблице 2. Как видно из нее, уровень МДА в обеих
группах достоверно превышал содержание его у
здоровых.
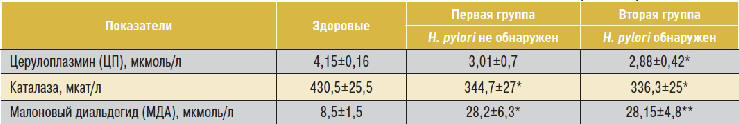
Антиоксидантная защита в этом исследовании была
представлена церулоплазмином (ЦП) и каталазой. ЦП
обладает антиоксидантными свойствами и входит как
один из основных элементов в адаптационно-защитную
систему организма [5]. Каталаза – гемосодержащий
фермент, осуществляющий защитную функцию в отношении
перекиси водорода.
Показатели каталазы в обеих группах больных были
снижены и достоверно отличались от показателей у
здоровых (р <0,05). ЦП в первой группе больных был
несколько ниже нормальных значений, но достоверно от
них не отличался, тогда как во второй группе
снижение носило достоверный характер (р <0,05).
У больных ГЭРБ активация процессов ПОЛ в слизистой
оболочке пищевода происходит при всех вариантах
течения заболевания. При эрозивном эзофагите и
осложненном течении ГЭРБ имеет место выраженный
дефицит антиоксидантов. Показано, что процессы ПОЛ в
тканях пищевода у больных с эзофагитом и его
осложнениями в условиях функциональной инертности
антиоксидантной защиты способствуют повреждению
слизистой оболочки пищевода. Активизация процессов
ПОЛ регистрируется уже при неэрозивной стадии ГЭРБ.
Заключение
Цитогенетическое исследование больных МС в
сочетании с ГЭРБ свидетельствует о неблагоприятном
влиянии процессов воспаления в дистальном отделе
слизистой пищевода на генотоксичность мукоцитов,
усугубляемого фактом присутствия H. pylori-инфекции,
что проявляется в возникновении микроядер в
слизистых клетках пищевода и повышении процессов ПОЛ
при неполноценном антиоксидантном ответе.
Литература
1. Бокарев И.Н. Метаболический синдром.
Клиническая медицина. 2014; 8: 71–75.
2. Ефремов Л.И., Комиссаренко И.А. Метаболический
континуум и полиморбидность в гериатрии.
Экспериментальная и клиническая гастроэнтерология.
2014; 6(106): 4–7.
3. Christian K. Roberts. Metabolic Syndrome and
Insulin Resistance: Underlying Causes and
Modification by Exercise Training. Christian K.
Roberts, Andrea L. Hevener, R. James Barnard. Compr.
Physiol. 2013; 3 (1): 1–58.
4. Корочина И.Э. Гастроэнтерологические аспекты
метаболического синдрома. Российский журнал
гастроэнтерологии, гепатологии, колопроктологии.
2008; 1: 26–34.
5. Харченко Н.В. Метаболический синдром в практике
гастроэнтеролога. Здоровье Украины:
гастроэнтерология, гепатология, колопроктология.
2015; 19; 42–46.
6. Чернышова Е.Н., Панова Т.Н., Донская М.Г.
Процессы перекисного окисления липидов и
преждевременное старение при метаболическом
синдроме. Кубанский научный медицинский вестник.
2013; 1(136): 181–184.
7. Christian K. Roberts, Andrea L. Hevener, R. James
Barnard. Compr. Physiol. 2013; 3(1): 1–58.
8. Калаев В.Н., Красножон К.Б., Игнатова И.В. Оценка
стабильности генома больных сахарным диабетом I типа
с использованием микроядерного теста в буккальном
эпителии. Фундаментальные исследования. 2012; 2(11):
288–295.
9. Калашникова М.Ф. Метаболический синдром:
современный взгляд на концепцию, методы профилактики
и лечения. Эффективная фармакотерапия.
Эндокринология. 2013; 6(55): 33–37.
10. Учамприна В.А., Романцова Т.И., Калашникова М.Ф.
Метаболический синдром: аргументы за и против.
Ожирение и метаболизм. 2012; 2(2): 17–27.
11. Китаева Л.В. Цитогенетические нарушения в
слизистой оболочке фундального отдела желудка у
пациентов с хроническим гастритом. Экологическая
генетика человека. 2010; 1(8): 36–41.
Статья опубликована на сайте
http://www.gastroscan.ru