
Глава IV. Диагностика, дифференциальный диагноз
4.1. Диагностические критерии
В клинических лекциях, посвященных септическому эндокардиту, W. Osler (1885)
писал: “Имеется мало болезней, которые представляли бы большие трудности на пути
диагноза, чем септический эндокардит. Многие опытные врачи указывают, что почти
у половины больных диагноз поставлен после смерти ... “. С тех пор прошло более
100 лет. Значительно возросли диагностические возможности современных
лабораторных, инструментальных методов исследования. Но и сейчас нередки случаи,
когда диагноз ИЭ устанавливают во время операции или на аутопсии.
Отсутствие патогномоничных симптомов, крайне высокий риск фатальных
осложнений, быстрое развитие полиорганной недостаточности и СН определяют
трудности своевременной диагностики. И в то же время, подчеркивают актуальность
ранней и достоверной верификации заболевания.
История диагностики ИЭ берёт свое начало с 1646 года, когда Lazare Reviere
впервые привёл его описание. С того времени и до второй половины XIX века ИЭ в
подавляющем большинстве случаев выявлялся патологоанатомами. Конец XIX и
середина следующего веков были периодом расцвета физикальной диагностики
болезни. В этот период были описаны практически все известные клинические
симптомы ИЭ, сохранившие своё значение в настоящее время. Однако полиморфизм
клинической картины и особенности современного течения ИЭ вызвали необходимость
разработки диагностических критериев, позволяющих проводить раннюю диагностику и
дифференциальный диагноз заболевания.
Диагностика ИЭ остаётся трудной задачей для практикующих врачей. Особенно
сложно установить диагноз на начальных этапах развития болезни, что во многом
обусловлено атипичным рецидивирующим течением ИЭ под различными “масками”,
снижением количества положительных результатов бактериологического исследования
крови, частым выявлением ложноположительных эхокардиографических признаков.
Переоценка классических признаков болезни (повышение температуры тела,
сердечные шумы) нередко приводит к диагностическим ошибкам в случаях ревматизма,
ревматоидного артрита, системной красной волчанки, полимиозита. Если бы врачи
ориентировались только на классические критерии ИЭ, то в 90 % случаев его было
бы невозможно распознать.
При верификации заболевания врачи испытывают большие затруднения. Только в
36-40 % случаев диагноз ИЭ устанавливается при первичном обследовании пациента.
Средний срок установления диагноза составляет 50-90 суток, а диагностика ИЭ с
преимущественным поражением правых камер сердца превышает эти сроки. В 32 %
случаев ИЭ даже не учитывается при проведении дифференциального диагноза, а
частота первичного обнаружения заболевания на операции и патологоанатомическом
вскрытии достигает 25-35 %.
Диагностические критерии ИЭ впервые представлены в иностранной литературе.
Наибольшей известностью пользуются критерии von C.F. Reyn et al. (1981) и
DUKE-критерии D.Т. Durack et al. (1994, 2001). В состав критериев достоверного
ИЭ по von C.F. Reyn вошли: гистологические признаки болезни, выявляемые на
операции или аутопсии, либо бактериологическая верификация микроорганизмов из
МВ, периферических эмболов.
Диагноз вероятного ИЭ устанавливается при определении положительной
гемокультуры и одного из признаков (новый шум регургитации, предрасполагающие
заболевания сердца или сосудистые признаки), а также при отрицательной
(периодически положительной) гемокультуре и наличии трёх признаков (лихорадка,
новый шум регургитации, сосудистые признаки). Однако при практическом применении
эти критерии оказались недостаточно чувствительными и специфичными.
Усовершенствованные “большие” и “малые” DUKE-критерии обладают большей
чувствительностью. Большими клиническими DUKE-критериями ИЭ являются:
1. Положительная гемокультура из двух раздельных проб крови типичных
микроорганизмов (streptococcus viridans, streptococcus bovis, НАСЕК-группа,
haemophillus spp., actinobacillus actinomycetemcomitans, cardiobacterium hominis,
eikenella spp., kingella kingae),
2. Внебольничные штаммы staphylococcus aureus и энтерококка (при отсутствии
гнойного очага),
3. Характерные эхокардиографические признаки поражения эндокарда (МВ на
клапанах, хордах, имплантированных материалах в отсутствии иных анатомических
изменений, абсцесс или дисфункция искусственных клапанов, появление признаков
вновь возникшей регургитации на клапанах).
В состав малых DUKE-критериям входят:
Предшествующие заболевания сердца,
Внутривенную наркоманию,
Лихорадку свыше 38°С,
Сосудистые (артериальные эмболии, инфаркты лёгких, микотические аневризмы,
внутричерепные кровоизлияния, геморрагии в конъюнктиву, симптом Лукина) и
иммунологические проявления (гломерулонефрит, узелки Ослера, пятна Рота,
положительная проба на ревматоидный фактор),
Положительный результат посева крови с выделением микрофлоры, не
соответствующей основным критериям (или серологическое подтверждение
активности инфекции в отсутствии микроорганизма, вызывающего ИЭ),
Эхокардиографические признаки поражения эндокарда, не соответствующие
основным диагностическим критериям (разрыв хорд клапанов, врождённые пороки
сердца).
Для достоверного ИЭ необходимо определение двух больших критериев, одного
большого и трёх малых, либо пяти малых критериев. Высока вероятность ИЭ при
выявлении признаков, которые не соответствуют ни наличию, ни отсутствию
заболевания. Диагноз не доказан в случае альтернативного объяснения признаков
заболевания, разрешения клинических проявлений на фоне кратковременной (менее
4-х дней) АБТ, отсутствии типичных морфологических изменений.
Исследования, проведенные с целью определения эффективности этих критериев,
позволили верифицировать ИЭ в 62-81 % случаев при наличии положительной
гемокультуры. В случае отрицательных результатов посевов крови чувствительность,
специфичность DUKE-критериев уменьшилась до 10,4 и 16,4 % соответственно. Для
верификации ИЭ с неустановленным возбудителем В.П. Тюриным (1998)
усовершенствованы DUKE-критерии. В состав усовершенствованных больших
DUKE-критериев вошли:
1. Положительная гемокультура из 2-х раздельных проб крови (не зависимо от
вида возбудителя), взятых с интервалом в 12 ч; или во всех 3-х; или в
большинстве проб из 4-х и более посевов крови, взятых с интервалом в один и
более часов;
2. Эхокардиографические признаки (МВ, абсцесс или дисфункция протеза клапана,
появление регургитации).
В состав уточнённых малых DUKE-критериев вошли:
Предшествующее поражение клапанов и (или) внутривенная наркомания,
Лихорадка свыше 38°С,
Сосудистые симптомы (артериальные эмболии, инфаркты лёгких, микотические
аневризмы, интракраниальные кровоизлияния, симптом Лукина),
Иммунологические проявления (гломерулонефрит, узелки Ослера, пятна Рота,
ревматоидный фактор),
Увеличение размеров селезёнки,
Анемия (снижение гемоглобина менее 120 г/л).
Диагноз ИЭ является достоверным при определении 2-х больших критериев, 1-го
большого и 3-х малых, либо – 5-ти малых. В усовершенствованных критериях первым
большим признаком является многократное выделение возбудителя не зависимо от его
вида (объединён первый большой с пятым малым DUKE-критерием). Ддополнительно
введен малый критерий – спленомегалия. Шестой малый диагностический признак (эхокардиографические
признаки, не соответствующие большим DUKE-критериям) заменён анемией,
встречаемость и значимость которой значительно выше. Использование этих
критериев позволяет установить достоверный диагноз у 53 % больных с
отрицательными результатами бактериологического исследования крови.
Для разработки диагностических критериев ИЭ нами проведен анализ
чувствительности более 300 признаков болезни. Анализ чувствительности,
специфичности клинических, лабораторно-инструментальных признаков позволил
отобрать из них наиболее информативные (таблица 13).
Таблица 13. Клинические признаки инфекционного эндокардита
| Признаки болезни |
Чувствительность, (%) |
Специфичность, (%) |
| Повышение температуры тела: |
98 |
88 |
| до 380С |
13 |
27 |
| свыше 380С |
64 |
100 |
| свыше 390С |
17 |
41 |
| Шумы в сердце |
100 |
98 |
| Ознобы |
89 |
91 |
| Петехии |
31 |
81 |
| Симптом Лукина |
48 |
79 |
| Артромиалгии |
68 |
73 |
| Снижение массы тела |
85 |
67 |
| Обильные поты |
54 |
64 |
| Симптом Ослера |
26 |
62 |
| Изменение границ сердца |
96 |
54 |
| Сердечная недостаточность |
100 |
51 |
| Лихорадка |
76 |
41 |
| Тахикардия |
82 |
35 |
Наиболее чувствительными, специфичными клиническими признаками ИЭ были
повышение температуры тела свыше 380С (64 % и 100 % соответственно),
динамика шумов сердца (100 %, 98 %). Несколько уступали им по показателю
специфичности: озноб (91 %), петехии (81 %), симптом Лукина (79 %), артромиалгии
(73 %), снижение массы тела (67 %), обильные поты (64 %), симптом Ослера (62 %).
Изменение границ сердца (54 %), признаки СН (51 %), лихорадка (41 %), тахикардия
(35 %), повышение температуры свыше 390С (41 %), лихорадка до 380С
(27 %) были малоспецифичны. Показатели чувствительности, специфичности
инструментально-лабораторных признаков ИЭ в таблице 14.
Таблица 14. Инструментальные, лабораторные признаки
|
Признаки болезни |
Чувствительность, (%) |
Специфичность, (%) |
| А) Инструментальные признаки: |
| Микробные вегетации |
100 |
100 |
| Выраженная регургитация на клапанах |
85 |
100 |
| Абсцессы сердца |
84 |
100 |
| Отрыв “протеза” клапана |
83 |
100 |
| Спленомегалия (по данным УЗИ) |
86 |
91 |
| Гепатомегалия (по данным УЗИ) |
82 |
88 |
| Выпот в полость перикарда |
71 |
77 |
| “Септическая” почка (по данным УЗИ) |
62 |
71 |
| Отрыв хорд, перфорации, разрыв створок клапанов |
51 |
59 |
| А) Лабораторные признаки: |
| Положительная гемокультура из 2 и более проб
крови |
88,8 |
100 |
| Анемия |
91 |
92 |
| Ускорение СОЭ: |
86 |
78 |
| до 20 мм/ч |
15 |
59 |
| 20-40 мм/ч |
65 |
78 |
| более 40 мм/ч |
6 |
27 |
| Увеличение ЛИИ: |
82 |
74 |
| до 3 усл. ед. |
6 |
37 |
| 3-6 усл. ед. |
62 |
82 |
| более 6 усл.
ед. |
14 |
23 |
| Лейкоцитоз |
89 |
66 |
| Лимфопения |
75 |
61 |
Обращает на себя внимание высокая чувствительность, специфичность
инструментальных признаков, положительной гемокультуры, представленной staph.
aureus, staph. еpidermidis, streptococcus viridans, streptococcus
betta-gemoliticuse, streptococcus piogenuse, еnteroccus faecalis, еnteroccus
faecium, сandida albicans и грибами рода Aspergillus (88,8 %, 100 %),
гипохромной анемии (91 %, 92 %), ускорения СОЭ от 20 до 40 мм/час (65 %, 78 %),
увеличения ЛИИ от 3 до 6 усл. ед. (62 %, 82 %), лейкоцитоза со сдвигом влево (89
%, 66 %), лимфопении (75 %, 61 %). По величине показателей чувствительности,
специфичности отобраны 4 главных и 11 дополнительных диагностических критериев
ИЭ (таблица 15).
Таблица 15. Диагностические критерии инфекционного эндокардита
|
Диагностические критерии |
Чувствительность, (%) |
Специфичность, (%) |
| I. Главные: |
| МD, выраженная регургитация, абсцесс сердца,
“отрыв” протеза клапана (по данным ЭхоКГ) |
98 |
100 |
| Положительная гемокультура из 2-х и более
раздельных культур крови |
88,8 |
100 |
| Повышение температуры свыше 380С |
64 |
100 |
| Шумы в сердце (при аускультации) |
100 |
98 |
| II. Дополнительные: А)
Клинические: |
| Ознобы, снижение массы тела, обильные поты,
артромиалгии, петехии, симптом Лукина, симптом Ослера |
57 |
84 |
| Б) Параклинические: |
| Анемия |
91 |
92 |
| Септическое поражение селезёнки (по данным УЗИ) |
86 |
91 |
| Септическое поражение печени (по данным УЗИ) |
82 |
88 |
| Увеличение ЛИИ от 3 до 6 единиц |
62 |
82 |
| Ускорение СОЭ от 20 до 40 мм/час |
65 |
78 |
| Выпот в полость перикарда (по данным ЭхоКГ) |
62,8 |
77 |
| Септическое поражение почек (по данным УЗИ) |
62 |
71 |
| Лейкоцитоз |
89 |
66 |
| Лимфопения |
75 |
61 |
| Отрыв хорд, перфорации, разрыв створок клапанов
|
51 |
59 |
Апробация диагностических критериев показала, что при положительной
гемокультуре выявление 2-3-х главных критериев или 2-х главных и нескольких
дополнительных критериев позволяет установить достоверный диагноз в 96 %
случаев. При отрицательной гемокультуре этот показатель не превышал 78 %.
Проведен анализ клинической картины, лабораторных исследований больных ИЭ.
Обращает на себя внимание изменение показателей функционального класса СН,
времени формирования порока, динамика шумов сердца, выраженность лихорадки,
озноба, потливости, снижения массы тела, увеличение размеров печени и селезёнки,
септического поражения почек, суставного, эмболического синдромов. Качественные
и количественные изменения признаков соответствовали трём степеням активности ИЭ
(таблица 16).
Таблица 16. Клинические критерии активности инфекционного эндокардита
| Критерии активности |
Степень активности |
| Третья |
Вторая |
Первая |
| Функциональный класс СН |
III - IV |
II |
I |
| Формирование порока |
Быстрое |
Медленное |
Медленное |
| Динамика шумов сердца |
Быстрая |
Медленная |
Медленная |
| Температура тела |
39-410 С |
38-390 С |
До 380 С |
| Озноб |
+ + |
+ |
+ - |
| Потливость |
+ + |
+ |
+ - |
| Снижение массы тела |
+ + + |
+ + |
+ |
| Увеличение печени |
+ + + |
+ + |
+ - |
| Увеличение селезёнки |
+ + + |
+ + |
+ - |
| Поражение почек |
+ + |
+ |
+ - |
| Суставной синдром |
+ + |
+ |
+ - |
| Эмболии |
+ + |
+ |
+ - |
Примечание: +++ - значительное, ++ выраженное, + - умеренное, + – -
непостоянно.
В состав основных лабораторных критериев активности ИЭ вошло 8 показателей,
отражающих выраженность воспаления, интоксикации, изменений в иммунной системе.
В состав дополнительных критериев вошло 9 признаков, характеризующих
функциональное состояние печени, почек, выраженность нарушений белкового обмена,
изменений в свёртывающей системе крови (таблица 17).
Обращает на себя внимание динамика изменений показателей гемоглобина,
эритроцитов, лейкоцитов, лимфоцитов крови, скорости оседания эритроцитов,
лейкоцитарного индекса интоксикации, ЦИК, иммуноглобулинов, вошедших в состав
основных критериев активности болезни. В состав дополнительных критериев
активности вошли показатели АЛТ, АСТ, креатинина, белков крови, фибриногена,
тромбоцитов, протромбинового индекса. В целом, изменения клинических признаков,
данных лабораторных и иммунологических исследований соответствовали трём
степеням активности.
Таблица 17. Лабораторные критерии активности
| Критерии активности |
Степень активности |
| Третья |
Вторая |
Первая |
| А) Основные: |
| Количество гемоглобина (г/л) |
> 100 |
100-80 |
< 80 |
| Количество эритроцитов (1012/л) |
> 3,7 |
3,7-3 |
< 3 |
| Количество лейкоцитов (10 9/л) |
< 9 |
9-16 |
> 16 |
| Количество лимфоцитов (%) |
> 25 |
15-25 |
< 15 |
| СОЭ (мм/час) |
< 20 |
20-40 |
> 40 |
| ЛИИ (усл. ед.) |
< 2 |
2-6 |
> 6 |
| ЦИК (опт. ед.) |
< 90 |
90-140 |
> 140 |
| Иммуноглобулины А, M, G (г/л) |
+ |
+ + |
+ + + |
| Б) Дополнительные: |
| АСТ (ммоль/мл) |
< 50 |
50-100 |
> 100 |
| АЛТ (ммоль/мл) |
< 40 |
40-100 |
> 100 |
| Креатинин (мг/%) |
< 1 |
1-2 |
> 2 |
| Общий белок крови (г/л) |
> 80 |
60-80 |
< 60 |
| Альбумин крови (%) |
> 60 |
60-40 |
< 40 |
| Глобулин крови (%) |
< 40 |
40-60 |
> 60 |
| Протромбиновый индекс (%) |
> 90 |
90-60 |
< 60 |
| Фибриноген (г/л) |
< 4 |
4-7 |
> 7 |
| Тромбоциты (10 3/л) |
> 180 |
180-100 |
< 100 |
Примечание: + + + – значительное, + + – выраженное, + – умеренное.
Высокая активность (III степень) характеризуется третьим,
четвёртым ФК сердечной недостаточности, быстрой динамикой шумов сердца и быстрым
формированием пороков сердца, повышением температуры тела до 39-410С,
обильными потами, ознобами, суставным синдромом, частыми эмболиями, значительным
уменьшением массы тела, гепатоспленомегалией и частым поражением почек.
При лабораторном исследовании крови отмечается гиперлейкоцитоз (свыше 16*109/л)
или выраженная лейкопения, тяжёлая гипохромная анемия (гемоглобин менее 80 г/л,
эритроцитов менее 3*1012/л), уменьшение количества тромбоцитов (менее
100*103/л), ускорение СЭО (свыше 40 мм/час), значительное увеличение
ЛИИ (более 6 усл. ед.), ЦИК (более 140 опт.ед.), иммуноглобулинов А, M, G.
При биохимическом исследовании крови возможно увеличение концентрации АСТ
(свыше 100 ммоль/л), АЛТ (свыше 100 ммоль/л), креатинина (более 2 мг/%),
глобулина (более 60 %), уменьшение концентрации общего белка (менее 60 г/л) и
альбумина (менее 40 %). При исследовании свёртывающей системы крови
регистрируется снижение показателя протромбинового индекса (менее 60 %),
увеличение концентрации фибриногена (свыше 7 г/л).
Для умеренной активности (II степень) свойственны второй ФК
сердечной недостаточности, медленная динамика шумов сердца, медленное
формирование пороков сердца, повышение температуры тела до 38-390С.
Потливость, озноб, суставной синдром, эмболии и поражение почек выражены не
резко. Снижение массы тела, увеличение размеров печени и селезёнки выражены.
При лабораторном исследовании крови отмечается лейкоцитоз (от 9 до 16*109/л)
или выраженная лейкопения, гипохромная анемия (гемоглобин 80-100 г/л, эритроциты
3-3,7*1012/л), уменьшение количества тромбоцитов до 100-180*103/л,
ускорение СЭО до 20-40 мм/час, выраженное увеличение ЛИИ (2-6 усл.ед.), ЦИК
(90-140 опт. ед.), иммуноглобулинов А, M, G.
При биохимическом исследовании крови регистрируется увеличение концентрации
АСТ до 50-100 ммоль/л, АЛТ до 40-100 ммоль/л, креатинина до 1-2 мг/%, глобулина
до 40-60 %, уменьшение общего белка (до 60-80 г/л), альбумина (до 40-60 %). При
исследовании свёртывающей системы крови характерно снижение протромбинового
индекса (до 60-90 %), увеличение концентрации фибриногена (до 4-7 г/л).
Минимальная активность (I степень) характеризуется субфебрильной
температурой (до 380С), первым ФК сердечной недостаточности, очень
медленной динамикой шумов сердца, медленным формированием пороков сердца.
Потливость, ознобы, суставной синдром непостоянны. Могут отсутствовать эмболии,
увеличение печени и селезёнки, признаки поражения почек. Снижение массы тела,
как правило, выражено умеренно.
При лабораторном исследовании крови отмечается лейкоцитоз (менее 9*109/л)
или умеренная лейкопения, гипохромная анемия легкой степени тяжести (гемоглобин
более 100 г/л, эритроцитов более 3,7*1012/л), незначительное
уменьшение количества тромбоцитов (не менее 180*103/л), ускорение СОЭ
(менее 20 мм/час), умеренное увеличение ЛИИ (менее 2 усл. ед.), ЦИК (менее 90
опт. ед.), иммуноглобулинов А, M, G.
При биохимическом исследовании крови регистрируется незначительное изменение
концентрации АСТ (менее 50 ммоль/л), АЛТ (менее 40 ммоль/л), креатинина (менее 1
мг/%), глобулина (менее 40 %), общего белка (более 80 г/л) и альбумина (более 60
%). При исследовании свёртывающей системы крови возможно повышение показателя
протромбинового индекса (более 90 %), снижение концентрации фибриногена (менее 4
г/л).
В настоящее время разработаны диагностические критерии подострого ИЭ. В их
состав вошли клинические (основные: лихорадка свыше 38°С, шум регургитации,
спленомегалия, васкулиты; дополнительные: гломерулонефрит, проявления
тромбоэмболического синдрома) и параклинические (эхокардиографические: МВ,
значительная деструкция клапанов, нарастающая регургитация; лабораторные:
положительная гемокультура, ускорение СОЭ свыше 30 мм/ч, нормо- или гипохромная
анемия) признаки. Выявление двух основных критериев, одним из которых является
шум регургитации над сердцем с одним дополнительным, позволяет установить
диагноз ИЭ без использования параклинических критериев. При определении двух
основных с одним дополнительным и не менее чем с двумя параклиническими
критериями, диагноз является достоверным. Возможный ИЭ - сочетание основных и
дополнительных признаков без шума регургитации, эхокардиографических признаков
болезни.
Для подтверждения ИЭ, осложнившего течение врождённого порока сердца,
учитывают лихорадку неясной этиологии, изменение аускультативной характеристики
шумов или тонов сердца в динамике, изменение окраски кожи (бледность,
иктеричность, петехии), увеличение размеров сердца, селезёнки, нарастающую
тахикардию, одышку. Немаловажное значение имеют признаки СН, не купирующиеся
приёмом сердечных гликозидов, нарушение ритма и проводимости, изменение функции
печени, почек, положительная дефиниламиновая, сулемовая, тимоловая, сиаловая
пробы, гипергаммаглобулинемия.
В последние десятилетия получили распространение особые клинические формы
заболевания: ИЭ у наркоманов, ИЭ протеза клапана, ИЭ у пациентов с
имплантированным электрокардиостимулятором, ИЭ у пациентов с программным
гемодиализом, ИЭ у реципиентов трансплантированного органа. Для ИЭ у наркоманов
характерно поражение интактного ТК с формированием его недостаточности (98,5 %)
и МВ (100 %); острое течение на фоне сепсиса (90 %), полисиндромность
клинических проявлений. Ведущими синдромами являются: инфекционно-токсический
(92 %), тромбоэмболический (76 %) с формированием ТЭЛА (72 %), абсцедирующей
инфаркт-пневмонии (65 %), ДВС-синдром (75 %), острая сердечная и полиорганная
недостаточность (45 %).
При ИЭПК характерны частое (66 %) поражение протеза АК с формированием МВ и
тромбоза (96 %), развитие парапротезных фистул (91 %), отрыв клапана (45 %). В
80-100 % случаев формируются абсцессы миокарда и (или) фиброзного кольца,
множественные эмболии, инфаркты и абсцессы органов. Для раннего ИЭПК свойственно
острое течение и яркая клиническая картина, быстрая декомпенсация СН, развитие
фатальных осложнений. Его важными диагностическими признаками являются
протодиастолический и систолический шум при формировании
парапротезных фистул, систолический шум в случае образования дефекта
межжелудочковой перегородки, аортоправосердной и аортолёгочной фистулы. Для
позднего ИЭПК свойственны подострое течение и “стёртая” клиника, длительная
компенсация СН.
Диагностика ИЭ у пациентов с имплантированным электрокардиостимулятором
весьма затруднительна, так как заболевание имеет подострое течение. Решающее
значение имеет выявление МВ (82-90 %), прикреплённых к зонду-электроду. Для ИЭ у
пациентов с программным гемодиализом (1,7-5 %) характерны “стёртая” клиническая
картина, проявления ХПН (уремический перикардит, миокардит, уремическое
поражение клапанов). Для диагностики этой формы заболевания важно определение МВ
на ТК, положительной гемокультуры, признаков септического поражения печени,
селезёнки.
При подозрении на эндокардит у больных после трансплантации органа следует
учитывать, что в первые 30 суток развивается первичный грибковый ИЭ (после
трансплантации сердца – в 8 %, почек – в 6 %, печени – в 2 %). Для него присуще
острое течение, яркая клиническая картина сепсиса, развитие острой сердечной,
полиорганной недостаточности, множественных ТЭО. Ведущее значение имеет
определение признаков поражения клапанов (МВ, регургитация, отрыв хорд,
перфорация и/или разрыв створок клапанов), септических изменений селезёнки,
печени, почек.
4.2. Лабораторная диагностика
Среди лабораторных методов диагностики ИЭ ведущее значение имеет
бактериологическое исследование венозной и артериальной крови, проводимое не
менее 3-х раз. Определение микробиологической природы ИЭ в каждом случае
необходимо для выбора АБТ. Это особенно важно при развитии грибковой,
микст-инфекции. В зависимости от используемой методики частота определения
возбудителя в крови составляет 30-75 %. При исследовании операционного материала
- 52-90 %. Однако, в последние годы в связи с неконтролируемым использованием АБ,
частота определения положительных гемокультур уменьшилась до 34-45 %.
Результаты микробиологического исследования крови крайне важны. Есть данные о
высокой частоте выделения бактерий из крови (85-95 %). Такие результаты получены
при использовании современных методов микробиологического исследования. Первым
этапом этого является забор крови с соблюдением определённых правил: забор крови
должен производиться до начала АБТ, техника забора крови проводится с
соблюдением правил асептики, антисептики путем пункции вены или артерии,
необходимо использовать специальные системы для забора крови, исключающие
содержание в них посторонних веществ (моющих, стерилизующих), способных влиять
на рост микрофлоры, быстрая транспортировка материала в лабораторию в условиях
изотермии, правильная маркировка образца, полная информация о характере
исследуемого материала.
При заборе крови на стерильность необходимо придерживаться правил асептики
для исключения контаминации кожной микрофлоры (коагулазонегативные стафилококки,
дифтероиды). Для взятия крови используется набор, состоящий из нескольких
флаконов на 50 мл с питательными средами, 2 %-го раствора йода или другого
антисептика, шариков со спиртом, салфеток, шприцев, одноразовых игл или
специальных приспособлений для забора крови. Рекомендуется проводить двукратную
обработку спиртом крышек бутылок для забора крови. В области пункции сосуда
производится двукратная обработка поля (до 10 см в диаметре) антисептиком
циркулярными движениями от центра к периферии. При непереносимости йода
обработка проводится 70 %-м раствором спирта в течение 2 минут.
Для лучшей визуализации места пункции йод смывают в проекции вены с помощью
1-2 шариков со спиртом. Движения шарика должны осуществляться в направлении “от
чистого к грязному”. Пальпировать вену в месте пункции можно только в стерильных
хирургических перчатках. Необходимо избегать повторного касания иглой кожи. Для
забора крови используют шприцы объемом 20 мл или специальные устройства
(вакуумные флаконы). После забора крови иглу удаляют из вены, избегая повторного
касания кожи.
У взрослых берут не менее 20 мл крови в каждый флакон (или объём крови,
рекомендованный производителем соответствующего оборудования). Затем образец
маркируют, указывая дату и время забора. Если посев крови производился из
сосудистого катетера, это должно быть специально отмечено для интерпретации
полученных результатов. Как правило, посев производят одновременно в два флакона
с аэробными, анаэробными средами. Инфекционный эндокардит всегда сопровождается
бактериемией, поэтому целесообразность многократных посевов крови и выбора для
посева момента наиболее высокой температуры тела у пациента сомнительна. Тем не
менее, имеются определённые принципы кратности посевов крови.
При ОИЭ, когда необходимо безотлагательно начинать эмпирическую АБТ, показан
трёхкратный посев крови, взятой путём венепункции из разных вен с интервалом в
15-30 минут. Эта методика обеспечивает 90 %-ю эффективность и позволяет
адекватно оценить результаты посева в случае контаминации материала микрофлорой.
У больных ПИЭ, когда проведение этиотропной терапии может быть отложено на
некоторое время, проводится трёхкратный посев крови в течение 24 часов. Если в
течение 48-72 часов не получен рост микрофлоры, рекомендуется произвести посев
ещё 2-3 раза. Данные о преимуществе посевов артериальной крови перед посевами
венозной крови разноречивы.
При проведении АБТ, неадекватной по спектру и дозам, посев крови может быть
положительным в течение 2-х недель. Если применение АБ прекращено, необходимо
производить посев крови через несколько дней после их отмены. В случае
отсутствия роста бактерий у пациентов с клиническими проявлениями ИЭ необходима
консультация клинического микробиолога для подбора адекватной техники
бактериологического исследования. Возбудитель может иметь биологические
особенности (очень медленный рост, отсутствие капсулы), вызывающие необходимость
использования специальных методов выделения.
Иногда для микробиологического и гистологического исследования производят
иссечение участка кожи с элементом сыпи (микробным эмболом). При ОИЭ возникают
эмболии хориоидных сплетений и сосудов головного мозга, развивается
бактериальный менингоэнцефалит. В этих случаях проводят диагностическую
люмбальную пункцию с посевом и микроскопическим исследованием ликвора. Из других
лабораторных показателей характерен лейкоцитоз более 16-18*109/л со сдвигом
влево, лимфопения и повышение ЛИИ до 2-8 условных единиц. Показатель ЛИИ
позволяет оценить степень тяжести гнойно-септических процессов. В числителе
формулы для расчёта этого показателя расположены “отрицательные” факторы,
отражающие негативные стороны патологического процесса (незрелые клетки крови),
а в знаменателе – “положительные” факторы (лимфоцитарно-макрофагальные клетки,
эозинофилы). В норме “положительные” и “отрицательные” факторы уравновешиваются
и ЛИИ равен 1.
Увеличение ЛИИ возможно за счёт сдвига лейкоцитарной формулы влево, угнетения
общей резистентности организма. Степень повышения ЛИИ хорошо коррелирует с
тяжестью септической интоксикации. Развитие тяжёлой гипохромной анемии,
ускорение СОЭ до 40-50 мм/час, увеличение концентрации ЦИК, иммуноглобулинов,
остаточного азота в крови, диспротеинемия являются характерными лабораторными
признаками болезни. Иммунновоспалительная фаза ИЭ проявляется высокой
концентрацией ЦИК и иммуноглобулинов, вызывающих поражения внутренних органов.
Динамика концентрации ЦИК, молекул средней массы характеризует направление
течения патологического процесса. Определение этих показателей необходимо для
прогноза тяжести течения болезни.
Лабораторные методы исследования позволяют определить фазу течения ИЭ
(инфекционно-токсическая, иммуновоспалительная, дистрофическая), оценить степень
нарушения функций органов, а также состояние иммунной системы организма. Из
всего многообразия лабораторных признаков бактериемия, подтвержденная не менее
2-х раз, является наиболее специфичной. Все остальные лабораторные критерии
являются малоспецифичными. Они важны для оценки тяжести течения болезни,
определения риска фатальных осложнений.
4.3. Инструментальная диагностика
Наиболее информативным и доступным методом диагностики ИЭ является ЭхоКГ.
Ультразвуковая диагностика ИЭ ведет свою историю с 1973 года, когда были впервые
выявлены МВ на МК. Появление ЭхоКГ совершило “маленькую революцию” в
инструментальной диагностике. Через несколько лет использольвания М-модальной
ЭхоКГ, представляющей собой одномерное исследование с режимом развёртки структур
сердца по времени, стала широко применяться В-модальная (двухмерная) ЭхоКГ,
позволяющая получить ультразвуковой срез сердца в реальном режиме времени.
Получение пространственно-временной картины морфологических структур сердца
позволило значительно улучшить выявление основных признаков ИЭ – МВ и
внутрисердечных абсцессов.
Если до этого абсцессы сердца обнаруживали только кардиохирург или
патологоанатом, то теперь появилась возможность визуализации полости гнойника,
оценки его размера, локализации и распространения. Стало возможным определение
характера разрушения клапанных структур, наличия, формы, подвижности, размеров и
локализации МВ. Возросла частота диагностики ИЭ. В 80-х годах 20-го столетия
чувствительность ЭхоКГ в выявлении признаков болезни достигла 60-85 % при 86-92
% специфичности.
Необходимо отметить, что за 20 лет возможности ЭхоКГ значительно возросли. В
1976 году впервые была проведена чреспищеводная ЭхоКГ с использованием
монопланового датчика и М-режима. Появление моно-, а затем би- и мультиплановых
датчиков, сразу же выявило преимущества чреспищеводного доступа в получении
более точной ультразвуковой картины сердца у больных ИЭ.
Значительный прогресс в оценке функции клапанов сердца связан с появлением
импульсного и постоянно-волнового допплеровских режимов, обеспечивающих
определение скорости и направления кровотока в реальном времени. В конце 80-х –
начале 90-х годов появились ультразвуковые аппараты IV-го поколения,
обеспечивающие высокое разрешение и качество получаемого ультразвукового
изображения. Был разработан режим цветного допплеровского картирования,
обеспечивающий наложение на двухмерное изображение закодированных различными
цветами скоростей кровотока. Существенным достоинством цветной допплерографии
явилась высокая достоверность оценки состояния внутрисердечной гемодинамики.
Наличие искусственного клапана не является помехой для проведения этого
исследования. Проводившиеся лабораторные и клинические исследования по сравнению
данных, получаемых при допплерографии и катетеризации сердца, показали высокую
степень соответствия результатов – 82-88%.
В конце 1995 года разработан тканевой допплеровский режим, основанный на
кодировании движущихся тканей в определенный цвет в зависимости от скорости,
направления движения. Tканевой допплер стал первой методикой, способной
оценивать скорость движения миокарда. Эта информация может быть также
представлена в виде импульсно-волнового режима ЭхоКГ. Данный метод используется
при обследовании пациентов с подозрением на развитие ИЭ естественных клапанов.
Режим TД позволяет выявить только подвижные, не плоскостные МВ размером более 2
мм, самостоятельная скорость движения которых отличается от скорости движения
клапана более чем на 0,1 м/с. Подвижные МВ при проведении исследования в этом
режиме выглядят в виде интенсивно окрашенных образований, образно напоминающих
сигнал “маячка”. Если у больного подозревается отрыв хорд или разрыв створки
клапана, метод не является специфичным. В такой ситуации используют стандартный
В-модальный режим с функцией масштабирования и повышения разрешающей
способности.
Цветной допплеровский режим используется в качестве скринингового метода
исследования, позволяющего быстро оценить внутрисердечную гемодинамику. Цветное
изображение внутрисердечных потоков создает подобие ангиографической картины. С
помощью ЦД можно быстро определить наличие и пространственную ориентацию
регургитации, легко отличить параклапанную регургитацию от трансклапанной,
выявить перфорацию створки поражённого клапана.
При перфорации створок клапанов направление струи регургитации в каждом
случае индивидуально и зависит от локализации, формы и размеров перфоративного
отверстия. В случае подозрения на наличие внутрисердечного абсцесса,
вскрывшегося в полость сердца, цветное картирование позволяет выявить сообщение
полости предполагаемого абсцесса с камерами сердца. С помощью ЦД, по характеру
распространения потоков крови, возможно, отличить тромб сердца от ультразвуковой
реверберации.
Цветное картирование позволяет полуколичественно оценить степень
недостаточности клапанов по соотношению площади струи регургитации к площади
предсердия (желудочка). В литературе отмечают совпадение данных ЦД с данными
зондирования сердца в 94-96 %. Если регургитирующая струя занимает менее 30 %
площади предсердия (желудочка), то клапанную недостаточность оценивают как
небольшую (I-й степени), 30-50 % – средней тяжести (II степени), более 50 % –
как тяжёлую (III-й степени). Недостаточность МК и ТК IV-й степени определяется
при выявлении заброса регургитирующей крови в лёгочные и/или полые вены
соответственно.
Режим импульсно-волновой допплерографии используется для количественной
оценки степени регургитации на клапанах сердца, определения её направления. С
его помощью подтверждают наличие внутрисердечной фистулы, оценивают направление
и скорость кровотока. Постоянно-волновая допплер-ЭхоКГ позволяет количественно
оценить высокие скорости кровотока и градиенты давления.
В настоящее время ультразвуковое исследование системы кровообращения
проводится тремя различными доступами: трансторакальным, чреспищеводным,
внутрисердечным. Наиболее распространенной и чаще применяемой для диагностики ИЭ
является ТТЭхоКГ. Однако в ряде случаев её выполнению мешают акустические
препятствия на пути ультразвукового луча: ребра, лёгкие, хорошо развитые мышцы и
подкожно-жировой слой, выраженный кальциноз и фиброз параклапанных структур,
послеоперационные сращения, акустическая тень от опорного кольца и диска
механического протеза. Эти причины приводят к сужению ультразвукового окна и
ухудшению визуализации анатомических структур сердца. Кроме того, при ТТЭхоКГ
взрослых для достижения нужной проникающей способности ультразвука приходится
применять датчики с частотой 2,5-3,5 МГц, что значительно ограничивает
разрешающую способность метода.
Тем не менее, около 75-80 % всех случаев ультразвуковой диагностики ИЭ
приходится на ТТЭхоКГ, что объясняется её большей распространённостью, простотой
и значительно возросшими возможностями. Менее эффективна ТТЭхоКГ в диагностике
ИЭПК, абсцессов сердца и мелких плоскостных МВ. Частота выявления ИЭПК при
проведении ТТЭхоКГ не превышает 27-32 %. Чувствительность ТТЭхоКГ при выявлении
параклапанных абсцессов варьирует от 18-32 % до 70-80 %, при достаточно высокой
специфичности – 88-90 %. Недостаточно эффективна ТТЭхоКГ в диагностике начальных
стадий ИЭ. Чаще всего с её помощью выявляются подвижные МВ более 10 мм,
прикреплённые к остаткам разрушенных створок клапанов.
В диагностике ранних стадий ИЭ всё большее значение приобретает ЧПЭхоКГ,
которая по сравнению с ТТЭхоКГ обладает значительным преимуществами. Во-первых,
ультразвуковой датчик прилежит к задней поверхности левого предсердия, их
разделяет лишь стенка пищевода и перикард, не ослабляющие ультразвуковой сигнал.
Отсутствие акустических препятствий позволяет оптимально визуализировать все
структуры сердца, в особенности предсердия, луковицу аорты, атриовентрикулярные
и аортальный клапаны, межпредсердную и межжелудочковую перегородки. Во-вторых,
для проведения ЧПЭхоКГ используют датчики с более высокой частотой (5-7 МГц),
что позволяет оценивать морфологические структуры размерами до 1-2 мм.
В-третьих, разработаны мультиплановые трансэзофагеальные датчики, позволяющие
изменять плоскость сканирования без изменения его положения, обеспечивать
качественное изображение интересующих структур сердца, небольших абсцессов и МВ.
В большинстве случаев (94 %) с помощью ЧПЭхоКГ можно визуализировать
ультразвуковые кардиальные признаки ИЭПК. Чувствительность, специфичность
ТТЭхоКГ в выявлении кардиальных признаков ИЭПК составили – 84 % и 90 %
соответственно, а ЧПЭхоКГ – 93,4 %, и 96,3 %. Наиболее значимыми признаками
являются: МВ (92,5 %), парапротезные фистулы (94 %), выпот в полость перикарда
(89%), тромбоз (81 %), отрыв протеза клапана (69 %), абсцессы миокарда (68 %).
При помощи ЧПЭхоКГ можно выявить признаки ИЭ естественного клапана на
начальных стадиях развития болезни. Это позволяет провести своевременную АБТ или
ограничиться клапаносохраняющей операцией. Только при помощи ЧПЭхоКГ можно
осуществлять адекватный интраоперационный мониторинг, наблюдение в раннем
послеоперационном периоде. Чреспищеводная ЭхоКГ позволяет лучше оценивать
функционирование искусственных клапанов сердца, диагностировать развитие раннего
ИЭПК. Проводимый ЧПЭхоКГ послеоперационный мониторинг играет решающую роль в
диагностике раннего ИЭПК.
Высокая эффективность метода способствовала распространению использования
ЧПЭхоКГ у больных ИЭ. Если в 1989 году соотношение трансэзофагеальных и
трансторакальных ЭхоКГ соответствовало 1/13, то в 1990 году – уже 1/8, а в 2001
году – 1/2. Именно ЧПЭхоКГ в большинстве случаев выявляет ИЭ тогда, когда другие
инструментальные исследования не могут определить его признаков. Обнаруженные с
её помощью морфологические, гемодинамические изменения помогают конкретизировать
сроки и показания к проведению операции.
В связи с разработкой принципиально новых диагностических систем, режимов
ультразвукового исследования возможности ЭхоКГ значительно расширились. Качество
визуализации внутрисердечных структур, объём получаемой информации возросли в
несколько раз. Сочетание трансторакальной и чреспищеводной ЭхоКГ с
использованием мультипланового датчика позволяет выявить признаки ИЭ в 90-100 %
случаев.
По данным исследования более 250 больных ИЭ нами разработаны ультразвуковые
диагностические критерии ИЭ естественного, искусственного клапанов, которые по
показателям чувствительности и специфичности расклассифицированы на главные,
дополнительные. Состав ультразвуковых критериев ИЭ естественных клапанов
представлен в таблице 18.
Таблица 18. Ультразвуковые диагностические критерии ИЭЕК
|
Диагностические критерии |
Чувствительность, (%) |
Специфичность, (%) |
| I. Главные: |
| Микробные вегетации |
100 |
100 |
| Выраженная регургитация |
71 |
98 |
| II. Дополнительные: |
| Абсцессы сердца |
82,5 |
88 |
| Септическое поражение органов: |
81,6 |
82 |
| селезёнки |
88 |
86 |
| печени |
82 |
81 |
| почек |
72,8 |
78 |
| Отрыв хорд, перфорации, разрыв створок |
56,4 |
75 |
| Выпот в полость перикарда |
54,9 |
63 |
К главным критериям ИЭЕК отнесены: микробные вегетации, выраженная
регургитация на поражённых клапанах. В состав дополнительных признаков вошли:
абсцессы сердца, септическое поражение внутренних органов, отрыв хорд,
перфорации, разрыв створок клапанов, выпот в полость перикарда.
Апробация критериев на больных показала, что установление достоверного
диагноза ИЭЕК возможно при выявлении не менее 1 главного и 2 дополнительных или
2 главных критериев при наличии характерной клинической картины: аускультативная
динамика шумов сердца, повышение температуры тела, ознобы, похудание, обильные
поты, артромиалгии, петехии, сопровождающиеся увеличением ЛИИ, ускорением СОЭ,
гипохромной анемией, лейкоцитозом со сдвигом влево или выраженной лимфопенией.
Чувствительность и специфичность диагностических признаков для определения ИЭЕК
составили 77 %, 93 % соотвественно.
В состав главных критериев ИЭ протеза клапана вошли: микробные вегетации,
располагающиеся на искусственном клапане или параклапанно, абсцесс сердца и
признаки “отрыва” протеза. К дополнительным критериям отнесены: парапротезная
фистула, выраженная регургитация на парапротезных фистулах, тромбоз протеза
клапана, выпот в полость перикарда, септическое поражение внутренних органов
(таблица 19).
Таблица 19. Ультразвуковые диагностические критерии ИЭПК
|
Диагностические критерии |
Чувствительность, (%) |
Специфичность, (%) |
| I. Главные: |
| Микробные вегетации |
100 |
100 |
| Признаки “отрыва” протеза клапана |
100 |
100 |
| Абсцессы сердца |
93 |
100 |
| II. Дополнительные: |
| Септическое поражение органов: |
72 |
79 |
| селезёнки |
55 |
78 |
| печени |
29 |
74 |
| почек |
46 |
85 |
| Тромбоз протеза клапана |
98 |
84 |
| Парапротезная фистула |
92 |
81 |
| Выпот в полость перикарда |
91 |
67 |
| Выраженная регургитация на парапротезных
фистулах |
84 |
91 |
Апробация критериев показала, что установление достоверного диагноза ИЭПК
возможно при выявлении не менее 1-го главного и 2-х дополнительных критериев или
2-х главных критериев при наличии характерной клинической картины. При выявлении
1-го главного или не менее 3-х дополнительных признаков для определения диагноза
осуществляли динамическое наблюдение за сердцем с использованием чреспищеводной
ЭхоКГ, анализировали клиническую картину, результаты бактериологического
исследования крови. Этот подход позволил избежать ложной диагностики ИЭПК. В
целом, чувствительность и специфичность ЭхоКГ для верификации ИЭ протеза клапана
составили 85 % и 94 %.
По результатам проведенного исследования чреспищеводная ЭхоКГ оказалась
наиболее чувствительным (95 %) и специфичным (100 %) методом ультразвуковой
диагностики кардиальных признаков болезни. УЗИ внутренних органов было
чувствительным (88 %) и специфичным (94 %) методом диагностики внекардиальных
признаков болезни. В силу этого в ранней диагностике ИЭ целесообразно применять
ЧПЭхоКГ, ультразвуковое исследование печени, почек, селезенки в динамике.
Проанализировав данные УЗИ более 250 больных ИЭ, провели расклассифицирование
кардиальных, внекардиальных ультразвуковых признаков болезни с учётом их
чувствительности, специфичности на главные и дополнительные диагностические
критерии. К главным ультразвуковым критериям ИЭ отнесены: микробные вегетации
(100 %, 100 %), абсцесс сердца (72,4 %, 100 %), выраженная регургитация на
клапанах, парапротезных фистулах (74 %, 100 %), признаки “отрыва” протеза
клапана (100 %, 100 %). В состав дополнительных ультразвуковых критериев ИЭ
вошли: выпот в полость перикарда (71 %, 77 %), отрыв хорд, перфорации и разрыв
створок клапанов (51 %, 59 %), тромбоз протеза клапана (21,6 %, 72 %),
парапротезные фистулы (20,4 %, 69 %), септическое поражение органов брюшной
полости (86 %, 91 %).
При апробации диагностических критериев их чувствительность, специфичность
составили 93 % и 98 % при выявлении не менее 1-го главного и 2-х дополнительных
ультразвуковых критериев или 2-х главных при наличии характерной клинической
картины. Диагноз ИЭ считался наиболее вероятным при обнаружении не менее 3-х
дополнительных или только 1-го главного ультразвукового критерия. В таких
случаях для подтверждения диагноза необходима положительная гемокультура из 2-х
и более проб крови.
Рентгеноскопия и рентгенография – ценные методы в выявлении признаков
развития, прогрессирования порока сердца у больных ИЭ, определения степени
декомпенсации СН. Наибольшее значение имеют при обследовании больных с ИЭ правых
камер сердца, которые часто осложняются ТЭЛА с развитием инфаркт-пневмоний,
абсцессов лёгких. При рентгеноскопии можно выявить признаки дисфункции протеза
клапана. Помимо этого, выявление рентгенологической картины пневмонии в
некоторых случаях приводит к определению ошибочного диагноза у больных ИЭ.
Только длительное прогрессирующее течение пневмонии, плохо поддающейся лечению,
с большим опозданием заставляет предположить о ИЭ.
Первое сообщение об использовании КТ в диагностике абсцесса сердца появилось
в 1984 году. Однако при дальнейшем изучении метод был признан
низкочувствительным и малоинформативным в определении признаков ИЭ. Единичные
сообщения о диагностике ИЭ с помощью КТ относятся к случаям выявления крупных
парааортальных абсцессов. Описаний случаев диагностики ИЭПК с помощью КТ в
литературе нет.
Магнитно-резонансная томография позволяет детально визуализировать
анатомические структуры сердца. В выявлении подвижных вегетаций метод
недостаточно информативен. Использование МРТ для диагностики ИЭПК неинформативно
вследствие искажения сигнала, вызванного металлическими элементами протеза
клапана. Томографические методы исследования чаще используют для диагностики
осложнений ИЭ: тромбоэмболий с формированием инфарктов, абсцессов, септических
аневризм. Компьютерная томография и МРТ головного мозга, органов брюшной полости
позволяют определить данную патологию в 72-92 % случаев. Такие методы
дорогостоящи, сложны и малоинформативны. В силу этого они довольно редко
используются в диагностике ИЭ.
Рентгенконтрастную ангио- и вентрикулографию используют для определения
поражения коронарных артерий, внутрисердечных фистул, дефектов межпредсердной и
межжелудочковой перегородок. Тем не менее, большинство исследователей считают ИЭ
абсолютным противопоказанием к проведению коронарографии или зондирования
сердца, вследствие высокого риска ТЭО.
В последнее десятилетие одним из современных методов диагностики ИЭ
становится радионуклидное исследование. Есть различные варианты радиоизотопной
диагностики ИЭ, начиная с простого внутривенного введения больному радиоактивных
111In, 67Ga, 99m Tc с последующим сканированием, до применения меченных
изотопами аутолейкоцитов или меченных моноклональных антилейкоцитарных антител.
В ранних работах использовался 67Ga-цитрат, накапливающийся в области воспаления
и деструкции в виде Ga-трансферриновых комплексов, соединяющихся с бактериями.
Однако чувствительность данного метода была крайне низкой. Из 28 обследованных
больных ИЭ, использование 67Ga-цитрата дало положительный результат у 3
пациентов (11 %). В то время как чувствительность ТТЭхоКГ в этой группе
составила 82 %.
С конца 90-х годов методы радионуклидной диагностики ИЭ получили новое
развитие. Появились сообщения о новых вариантах радиоизотопной диагностики
заболевания. Особенностью данной методики является её высокая специфичность для
выявления воспаления в искусственном и естественном клапанах сердца. Наиболее
перспективно введение меченных 99Tc антилейкоцитарных антител с однофотонной
эмиссионной КТ через 6 и 24 часа. Для “транспортировки” радионуклидов в очаг
инфекции применяются меченые in vitro или in vivo лейкоциты и тромбоциты.
Местами их скопления являются МВ, тромбы, воспалительные инфильтраты эндокарда и
миокарда, абсцессы. Использование этого метода в динамике позволяет оценить
эффективность АБТ. Чувствительность этой методики достигает 78 %, а
специфичность - 85 %.
Важными особенностями РНИ являются возможность ранней диагностики ИЭПК,
высокая специфичность в случае формирования параклапанного инфильтрата при ОИЭ.
Метод дорогостоящий и рекомендуется для обследования пациентов при подозрении на
ИЭ. При совместном использовании ЭхоКГ и РНИ чувствительность и специфичность
для определения ИЭПК составляет 100 % и 80-90 % соответственно.
Не теряет своей актуальности электрокардиография. Изменения на ЭКГ
определяются видом сформировавшегося порока, длительностью его существования,
характером и тяжестью поражения миокарда инфекционным процессом. Отмечаются
различные нарушения ритма и проводимости: синоаурикулярная,
предсердно-желудочковая блокада высокой степени, полная атриовентрикулярная
блокада; экстрасистолия (предсердная, атриовентрикулярная, желудочковая,
групповая, аллоаритмии); пароксизмальная тахикардия, мерцательная аритмия. Кроме
того, выявляются признаки перегрузки предсердий и желудочков сердца, ишемические
изменения (при коронариите), признаки миокардита – снижение вольтажа, нарушение
формы зубцов P, Q, T; смещение сегмента ST.
Для электрокардиографических изменений характерна динамика, связанная с
течением инфекционного процесса. На 3-5-й день после параклапанного
распространения инфекции развивается атриовентрикулярная блокада. Что особенно
характерно для ИЭ с поражением АК и формированием абсцесса межжелудочковой
перегородки, в меньшей степени – для ИЭ с распространением инфекции на основании
передней створки МК.
В последние десятилетия в клиническую практику внедрены новые методы
диагностики ИЭ. Вследствие относительно низкой стоимости, неинвазивного или
полуинвазивного характера исследования, появления новых технических
возможностей, эхокардиография заняла лидирующее место в диагностике заболевания.
Следует особо подчеркнуть важное значение радионуклидных методов исследования в
ранней диагностике инфекционного эндокардита протеза клапана.
4.4. Алгоритмы диагностики
В диагностике ИЭЕК целесообразно использовать полипозиционную ТТЭхоКГ в В- и
М-модальном режиме, дуплексное, триплексное сканирование с комбинацией В-режима
с DTI-исследованием, В-режима с ИВ- и ЦД-доплером. В диагностике ИЭПК
последовательно используют ТТЭхоКГ, ЧПЭхоКГ. Для выявления парапротезных фистул,
оценки регургитации информативнее триплексное сканирование: В и М-режим с
цветным доплеровским режимом, В-режим с импульсно-волновым, постоянноволновым
доплером. Алгоритм обследования больных в амбулаторных условиях, при поступлении
в стационар представлен в таблицах 20, 21.
Таблица 20. Амбулаторное обследование
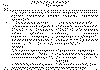
Таблица 21. При поступлении в стационар
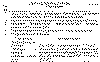
Алгоритм диагностики ИЭ при стационарном лечении представлен в таблице 22.
Таблица 22. Алгоритм диагностики в период стационарного лечения

Особенностью диагностики ИЭ протеза клапана является разделение всех
пациентов на 2 группы по наличию инфекционных осложнений в послеоперационном
периоде (таблица 23).
Таблица 23. Алгоритм диагностики после кардиохирургической операции

Во время амбулаторного обследования необходимо обращать особое внимание на
выявление характерных клинических признаков ИЭ: шумов сердца при аускультации,
немотивированного длительного повышения температуры тела, лихорадки, ознобов,
обильных потов, артромиалгий, похудания, петехий, увеличения ЛИИ, СОЭ,
гипохромной анемии, лейкоцитоза со сдвигом влево или выраженной лимфопении. По
показаниям назначать ЭхоКГ, УЗИ внутренних органов.
При стационарном обследовании следует осуществлять постоянный динамический
контроль за показателями температуры тела, артериального давления, пульса, ЧСС,
ЧДД и массы тела. При ежедневном физикальном обследовании больных производить
оценку динамики шумов сердца, признаков активности инфекционного эндокардита и
выраженности сердечной недостаточности. При эхокардиографии ИЭЕК наиболее
эффективны полипозиционная ТТЭхоКГ, дуплексное и триплексное сканирование с
использованием комбинаций В-режима с постоянноволновым, импульсно-волновым и
цветным доплером. При отрицательных результатах ТТЭхоКГ целесообразно проведение
чреспищеводной ЭхоКГ с частотой, определяемой изменением клинической картины
болезни.
Наибольших результатов в диагностике ИЭ протеза клапана можно достичь при
ЧПЭхоКГ, которую целесообразно проводить с интервалом в 1-3 дня. В ходе УЗИ
брюшной полости необходима оценка структуры и размеров селезёнки, печени, почек,
определение жидкости в брюшной полости, в малом тазу (по необходимости).
Рентгенологическое исследование органов грудной клетки, электрокардиографию
проводят по показаниям, с учётом изменений в клинической картине болезни.
При лабораторном исследовании решающее значение имеет трёхкратное
бактериологическое исследование венозной (артериальной) крови. Оценивают
результаты общеклинических анализов крови, мочи в динамике. Осуществляют
контроль за концентрацией ЦИК, иммунногобулинов, АСТ, АЛТ, креатинина, белка,
его фракций в крови. Оценку свертывающей системы крови можно проводить по
показателю протромбинового индекса, концентрации фибриногена, тромбоцитов крови.
Особенностью диагностики ИЭПК после хирургической коррекции пороков сердца
является разделение больных на 2 группы по наличию инфекционных осложнений в
послеоперационном периоде. В группе больных без инфекционных осложнений
проводится динамическое наблюдение и обследование, сходное с таковым при
стационарном лечении. Во 2 группе необходим ЭхоКГ-мониторинг с использованием
ТТЭхоКГ и ЧПЭхоКГ для раннего выявления признаков ИЭПК: микробных вегетаций,
абсцессов сердца, выраженной регургитации на клапанах и парапротезных фистулах,
признаков “отрыва” и тромбоза протеза клапана, парапротезных фистул. При
проведении ЭхоКГ производят оценку функционирования искусственного клапана,
трансклапанного кровотока, сократительной способности и насосной функции ЛЖ. В
ходе УЗИ внутренних органов регистрируют признаки септического поражения печени,
селезёнки, почек. С учётом изменений в клинической картине болезни проводят
рентгенологическое исследование органов грудной клетки и электрокардиографию.
Обязательным является бактериологическое исследование крови.
4.5. Дифференциальный диагноз
Перечень заболеваний, с которыми приходится дифференцировать ИЭ на ранних
стадиях заболевания, чрезвычайно широк. Дифференциальный диагноз проводится с
заболеваниями (синдромами), наиболее важными из которых являются: лихорадка
неясной этиологии, ревматоидный артрит с системными проявлениями, острая
ревматическая лихорадка, системная красная волчанка, узелковый полиартериит,
неспецифический аортоартериит, антифософолипидный синдром, инфекционные
заболевания, протекающие с лихорадкой, сыпью и спленомегалией (генерализованная
форма сальмонеллёза, бруцеллёз), злокачественные новообразования (неходжинские
лимфомы, лимфогранулематоз), сепсис и многие.
Инфекционный эндокардит должен быть включен в алгоритм диагностического
поиска у всех больных с ЛНЭ. Лихорадка неясной этиологии является клиническим
синдромом, основным проявлением которого является повышение температуры тела,
причину которой установить не удаётся. Для ЛНЭ характерен четырёхкратный (или
более) подъём температуры свыше 38,3°С в течение 3 недель.
Инфекционные заболевания являются наиболее частой причиной ЛНЭ (23-36 %),
вклад системных васкулитов остается прежним (20-28 %). Доля онкологических
заболеваний и системных васкулитов уменьшилась до 7-31 %. В последние
десятилетия количество ИЭ, абсцессов брюшной полости и заболеваний
гепатобилиарной зоны в структуре ЛНЭ существенно снизилось, а туберкулёза и
цитомегаловирусной инфекции увеличилось. Основными причинами ЛНЭ являются
туберкулёз, гнойный холецистохолангит, пиелонефрит, абсцессы брюшной полости,
септический тромбофлебит вен таза, инфекции вызванные вирусами (цитомегаловирусом,
вирусом Эпштейна-Барра, ВИЧ), лимфомы, лейкемия, метастазы рака яичников.
Системная красная волчанка, ревматоидный артрит, заболевания соединительной
ткани, перемежающийся артериит, ювенильный ревматоидный артрит у взрослых
(болезнь Стилла) и васкулиты могут протекать под видом ЛНЭ. Причинами ЛНЭ (17-24
%) могут быть лекарственная лихорадка, тромбоэмболия лёгочной артерии,
воспалительные заболевания тонкой кишки, саркоидоз. У взрослых в 10 % случаев
причина ЛНЭ остается невыясненной. Наиболее частыми причинами ЛНЭ у людей
пожилого возраста являются лейкемия, лимфомы, абсцессы, туберкулёз и артериит
височных артерий.
Разнообразие причин ЛНЭ приводит к необходимости детального обследования
пациентов. Для дифференциального диагноза важны подробный сбор анамнеза,
выявление лабораторных маркеров воспаления, применение ультразвукового
исследования, компьютерной и магнитно-резонансной томографии. Значение
рентгеноконтрастных и изотопных методов несколько снизилось. Серологические
лабораторные исследования позволяют диагностировать инфекционные заболевания. До
настоящего времени нет данных о применении для диагностики ЛНЭ полимеразной
цепной реакции, которая широко используется в диагностике вирусных инфекции и
туберкулёза.
Трудности в дифференциальной диагностике между ИЭ и системными заболеваниями
соединительной ткани определяются поражением сосудов и развитием панартериита.
Примером этого может служить ОРЛ, которая характеризуется поражением суставов,
формированием пороков сердца. Проблема ранней диагностики ОРЛ в последние
несколько десятилетий связана с тем, что не всегда развивается полный
симптомокомплекс заболевания. Нередко наблюдается изолированное поражение сердца
или суставов. После первых атак развиваются полиартриты, после повторных –
артралгии. Уменьшилась частота рецидивов заболевания. Тем не менее, ОРЛ чаще
развивается у подростков и молодых людей. Для неё характерны асимметричные
мигрирующие полиартриты, вальвулит, поражение миокарда, нарушение проводимости и
ритма сердца. Повышение титра антител к бетта-гемолитическому стрептококку
характерно для ОРЛ, так как возбудителем ИЭ является зеленящий стрептококк.
Однако некоторые признаки этих заболеваний в виде лихорадки, патологии суставов
и сердца, при отсутствии проявлений ТЭО и МВ на клапанах сердца, определяют
актуальность дифференциального диагноза.
Высокочувствительными признаками ОРЛ являются: молодой возраст больных,
поражение миокарда, нарушение ритма и проводимости, кольцевая эритема, повышение
титра антистрептококковых антител. Для ИЭ характерны множественные ТЭО,
гепатоспленомегалия, пневмония, плевриты, септическое и/или иммуннокомплексное
поражение печени, почек. Определяется выраженный лейкоцитоз, гипохромная анемия,
значительное увеличение концентрации иммуноглобулинов, ЦИК в крови.
Эхокардиографические признаки поражения сердца представлены МВ, регургитацией,
перфорацией и/или отрывом створок клапанов, абсцессами миокарда. В ходе УЗИ
органов брюшной полости определяются признаки инфекционно-токсического гепатита,
спленомегалии, нефрита. В состав положительной гемокультуры чаще входят
золотистый, эпидермальный стафилококк, зеленящий стрептококк, энтерококки, грибы
рода Candida, Aspergillus.
Среди заболеваний соединительной ткани, с которыми необходимо проводить
дифференциальный диагноз, важное место занимает РА с системными проявлениями.
Для этого заболевания характерно развитие эрозивно-деструктивных поражений
суставов и ревматоидного эндокардита (50-60 %). Для подострого ИЭ характерно
развитие иммуннокомплексной патологии, а также поражение опорно-двигательного
аппарата (23-60 %), проявляющееся артралгиями, артритами, тендинитами,
энтезопатиями, дисцитом поясничного отдела позвоночника. В 40-50 % случаев
клиническое течение РА проявляется гектической лихорадкой, повреждением
клапанов, нарушением ритма и проводимости сердца.
Однако у большинства больных РА с недостаточностью АК и МК заболевание имеет
бессимптомное и относительно благоприятное клиническое течение. Для системных
проявлений РА специфичны фиброзирующий альвеолит, лимфаденопатия, аутоиммунный
тиреоидит, синдром Рейно, ревматоидные узлы, синдром Шегрена, которые не
встречаются при ИЭ. Тем не менее, проведение дифференциального диагноза между РА
и ИЭ остаётся достаточно трудной задачей.
Сходство клинических и лабораторных проявлений ИЭ и СКВ значительно
затрудняет проведение дифференциальной диагностики. С одинаковой частотой
встречаются лихорадка, полисерозит, миокардит, васкулиты, гломерулонефрит. В
случае формирования (30-45 %) тромботического неинфекционного эндокардита
возникают затруднения при трактовке ультразвуковой картины поражения клапанов.
Тем не менее, при ИЭ чаще развивается деструктивная пневмония, а при СКВ –
сосудистые поражения лёгких в виде пульмонитов. Отсутствие выраженной деструкции
клапанов и регургитации, наличие отрицательной гемокультуры и положительного
эффекта от применения преднизолона и цитостатиков подтверждает СКВ.
В клинической практике могут быть полезны диагностические критерии СКВ,
разработанные Американской ревматологической ассоциацией. В состав критериев СКВ
вошли: LE-клетки, антинуклеарные антитела, эритема на лице (в виде бабочки),
дискоидная волчанка, фотосенсибилизация, язвы в полости рта, артрит, серозит,
поражение почек с протеинурией до 0,5 г/сут, неврологические нарушения (судороги
или психоз), изменения крови (гемолитическая анемия, уменьшение количества
лейкоцитов до 4*109 /л, тромбоцитов - до 100*103 /л,
лимфопения в двух и более пробах крови). Наличие любых 4-х критериев
подтверждает диагноз заболевания. Верификация затруднена в случае атипичного
течения (сочетанного или пограничного системными заболеваниями соединительной
ткани), а также на ранней стадии развития СКВ.
Определенные проблемы могут возникать при дифференциальной диагностике ИЭ и
неспецифического аортоартериита (болезни Такаясу), протекающего с формированием
недостаточности АК, обусловленной дилатацией аорты. Последнему чаще свойственны
преходящие парестезии. Выявляются перемежающаяся хромота у молодых женщин,
сосудистые шумы, асимметрия или отсутствие пульса (чаще в зоне локтевой, лучевой
и сонной артерии), различия АД на конечностях. Для верификации аортоартериита
необходимы данные ультразвукового сканирования сосудов, контрастной ангиографии.
Достаточно сложен дифференциальный диагноз ИЭ со злокачественными
новообразованиями, особенно у людей пожилого возраста. Высокая лихорадка часто
отмечается при гипернефроме, опухолях толстого кишечника, поджелудочной железы.
В то же время у пожилых людей нередко встречается грубый систолический шум
митральной регургитации как следствие хронической ишемической болезни сердца.
Нередко выслушивается протодиастолический шум аортальной регургитации
атеросклеротического генеза. У таких больных при наличии опухоли наблюдается
анемия, ускорение СОЭ.
В подобных ситуациях, прежде чем остановиться на диагнозе ИЭ, необходимо
искать опухоль, применяя все современные диагностические методы. Следует иметь в
виду, что у больных пожилого и старческого возраста возможно сочетание ИЭ и
опухоли.
Значительные трудности представляет дифференциальная диагностика ИЭ и
хронического пиелонефрита в стадии обострения, особенно у пожилых больных.
Развитие пиелонефрита с характерной клинической картиной (лихорадка с ознобом,
анемия, ускорение СОЭ, иногда - бактериемия) может наводить на мысль о наличии
ИЭ с вовлечением в процесс почек. С другой стороны, у больных пиелонефритом
возможно развитие ИЭ, вызванного микрофлорой, наиболее часто встречающейся при
инфекциях мочевыводящих путей (кишечная палочка, протей, энтерококки).
Нередко приходится проводить дифференциальный диагноз между ИЭ и НТЭ при
вторичном АФЛС, развивающемся у больных СКВ, УП, подагрой. Формирование НТЭ при
этих заболеваниях связано с образованием антител к эндотелию. Бывает трудно
отдифференцировать ИЭ от УП при наличии выраженной лихорадки, суставного
синдрома, поражения почек и кожи.
Однако для УП характерно развитие асимметричного полиневрита, поражения почек
с формированием микроаневризм и артериальной гипертензии, ишемических поражений
конечностей (сетчатое ливедо, дигитальный артериит), мозга (ишемический инсульт)
и желудочно-кишечного тракта (с развитием кишечной непроходимости).
Из группы заболеваний с НТЭ следует исключать первичный АФЛС, развивающийся в
результате аутоиммунных реакций к фосфолипидам эндотелия, мембраны эритроцитов и
нервных клеток. Характерными проявлениями АФЛС являются: сетчатое ливедо,
тромбофлебит поверхностных и (или) глубоких вен, тромбозы и тромбоэмболии
лёгочной артерии, церебральных сосудов и коронарных артерий; наличие нескольких
выкидышей в анамнезе. Лабораторные показатели АФЛС: тромбоцитопения,
Кумбс-положительная гемолитическая анемия, нарушение липидного обмена, антитела
к кардиолипину, фосфолипидам, волчаночный антикоагулянт, антинуклеарный фактор.
К критериям определённого АФЛС относят: рецидивирующие спонтанные аборты у
женщин молодого возраста, множественные и рецидивирующие венозные тромбозы,
артериальные окклюзии, язвы ног, сетчатое ливедо, гемолитическую анемию,
тромбоцитопению, увеличение концентрации антител к фосфолипидам иммуноглобулинов
G или М более чем на пять стандартных отклонений от нормы.
В практике врача необходимо проводить дифференциальный диагноз ИЭ с НТЭ при
злокачественных опухолях. Разработаны дифференциально-диагностические признаки
ИЭ и заболеваний с формированием НТЭ (таблица 24).
Таблица 24. Дифференциально-диагностические признаки ИЭ и НТЭ
| Признаки |
Инфекционный эндокардит |
Н Т Э |
| Поражение сосудов |
Артериальные
эмболии |
Венозный и артериальный тромбозы |
| Сетчатое ливедо |
Нет |
Да |
| Наличие неоплазмы |
Нет |
Да |
| Гемокультура |
Положительная |
Отрицательная |
| Тромбоцитопения |
Нет |
Да |
| Волчаночный антиген |
Нет |
Да |
| Антиядерные антитела |
Редко |
Часто |
| Антитела к кардиолипинам |
Нет |
Да |
| Данные эхокардиографического исследования |
Множественные МВ Выраженная регургитация на
поражённых клапанах
Абсцессы миокарда, фиброзного кольца
Отрывы, разрывы, перфорации створок клапанов |
Наложения на створках клапанов Незначительная
регургитация
Дополнительные Эхо-тени от створок клапанов
Уплотнение, утолщение створок клапанов |
При проведении дифференциального диагноза ИЭ с инфекционными заболеваниями,
протекающими с лихорадкой, сыпью и спленомегалией, необходимо верифицировать
сальмонеллёз и бруцеллёз. Септическая форма сальмонеллёза является наиболее
тяжёлой формой заболевания. Характеризуется острым течением, лихорадкой с
большими суточными размахами, повторными ознобами и обильным потоотделением.
Нередко образуются метастатические гнойные очаги в желчном пузыре, шейных
лимфоузлах, головном мозге, реже - в эндокарде, аорте. Диагноз устанавливают при
выделении сальмонелл из гноя вторичного очага и/или из крови в первые дни
болезни.
Бруцеллёз относится к группе зоонозов с хроническим течением. Характерно
хорошее самочувствие у больных бруцеллёзом на фоне высокой лихорадки (до 40-410С),
генерализованной лимфаденопатии, выраженной лейкопении, нормальной СОЭ. Главным
отличием заболевания является отсутствие метастатических очагов воспаления в
органах.
Злокачественные новообразования (лимфомы, лимфогранулематоз) начинаются с
гектической лихорадки, ознобов, обильного потоотделения, похудания. Для клиники
неходжинских лимфом свойственно одинаково частая лимфаденопатия как всех
лимфатических узлов, так и отдельных их групп. Первыми симптомами являются
увеличение одной (50 %) или двух (15 %) групп лимфатических узлов,
генерализованная лимфаденопатия (12%), признаки интоксикации (86-94 %). В
анализах крови – лейкоцитоз (7,5-11 %) и/или лейкопения (12-20 %), лимфоцитоз
(18-22 %), увеличение СОЭ (13,5-32 %). Диагноз верифицируется на основании
данных гистологического исследования лимфоузлов.
Диагностическими критериями лимфогранулематоза являются: наличие в
лимфатических узлах клеток Березовского-Штейнберга (100 %), первоначальное
увеличение лимфатических узлов шеи, средостения, подмышечных ямок (80-90 %),
лихорадка волнообразного характера (60-72 %), кожный зуд (33 %), нейтрофилёз с
абсолютной лимфоцитопенией (25 %), умеренная нормохромная анемия (8-15 %).
Сепсис характеризуется тяжёлым ациклическим течением, нарастающей гипохромной
анемией, неправильной лихорадкой с повторными ознобами и обильным
потоотделением, частым развитием септического шока и тромбогеморрагического
синдрома (синдрома Мачабели), формированием метастатических (вторичных) очагов
воспаления в почках, печени, селезёнки, лёгких. При проведении эхокардиографии
МВ и другие признаки поражения эндокарда не выявляются.
Общими для острой ревматической лихорадки и инфекционного эндокардита
признаками являются длительная субфебрильная температура, слабость, потливость,
увеличение СОЭ, наличие клапанного порока сердца, динамика кардиальных шумов,
свидетельствующая о формировании порока сердца. Проводя дифференциальную
диагностику ИЭ и острой ревматической лихорадки, следует использовать
диагностические критерии этих заболеваний (таблица 25).
Таблица 25. Диагностические критерии Джонса ревматической лихорадки в
модификации Ассоциации ревматологов России (2003)
|
Большие критерии |
Малые критерии |
Данные, подтверждающие
А-стрептококковую инфекцию |
| Кардит Полиартрит
Хорея
Кольцевидная эритема
Подкожные ревматические узелки |
Клинические: артралгия,
лихорадка
Лабораторные:
повышение СОЭ, С-реактивного белка
Инструментальные: удлинение интервала PR на ЭКГ, признаки митральной
и/или аортальной регургитации при допплер-ЭхоКГ |
Позитивная А-стрептококковая
культура, выделенная из зева, или положительный тест быстрого определения
А-стрептококкового антигена Повышенные или повышающиеся титры
противострептококковых антител |
Наличие двух больших критериев или одного большого и двух малых в сочетании с
данными, документированию подтверждающими предшествующую инфекцию стрептококками
группы А, свидетельствуют о высокой вероятности ОРЛ.
Острая ревматическая лихорадка - постинфекционное осложнение
А-стрептококкового тонзиллита (ангины) или фарингита в виде системного
воспалительного заболевания соединительной ткани с преимущественной локализацией
в сердечно-сосудистой системе (ревмокардит), суставах (мигрирующий полиартрит),
мозге (хорея) и коже (эритема, ревматические узелки), развивающееся у
предрасположенных лиц, главным образом, молодого возраста (7-15 лет), в связи с
аутоиммунным ответом организма на антигены стрептококка А с перекрестной
реактивностью со схожими аутоантигенами поражаемых тканей человека. Повторная
ревматическая лихорадка рассматривается как новый эпизод острой ревматической
лихорадки (но не рецидив первого эпизода), проявляется преимущественно кардитом,
реже кардитом и моноартритом, редко - хореей.
Кардит - поражение сердца по типу вальвулита (преимущественно - митрального,
реже - аортального клапана), проявляющееся органическим сердечным шумом,
возможно в сочетании с миоперикардитом. Симптомы ревматического вальвулита:
дующий, связанный с I-м тоном систолический шум апикальной локализации
(митральная регургитация); низкочастотный мезодиастолический шум в митральной
области; высокочастотный убывающий протодиастолический шум, выслушиваемый вдоль
левого края грудины (аортальная регургитация). При отсутствии вальвулита
ревматическую природу миоперикардита следует трактовать с большой осторожностью.
Ревматический полиартрит - мигрирующий полиартрит преимущественно крупных и
средних суставов (коленных, голеностопных, реже - локтевых, плечевых,
лучезапястных). Преобладающая форма поражения в современных условиях -
преходящий олигоартрит, реже - моноартрит. Отличается доброкачественным
течением, быстрой полной регрессией воспалительных изменений в суставах под
влиянием современной противовоспалительной терапии.
При стойком симметричном артрите крупных суставов, недостаточном ответе на
терапию НПВП, отсутствии четких клинико-инструментальных признаков кардита
следует иметь в виду постстрептококковый реактивный артрит.
Ревматическая хорея - поражение нервной системы, характеризующееся развитием
пяти синдромов, наблюдающихся в различных сочетаниях: хореические гиперкинезы,
мышечная гипотония, расстройства статики, координации, сосудистая дистония,
психопатологические явления.
Кольцевидная эритема - бледно-розовые кольцевидные высыпания диаметром от
нескольких миллиметров до 5-10 см с преимущественной локализацией на туловище,
нижней трети рук и ног. Имеет транзиторный мигрирующий характер без зуда, не
возвышается над уровнем кожи, бледнеет при надавливании, быстро регрессирует без
остаточных явлений (пигментации, шелушения, атрофических изменений).
Подкожные ревматические узелки - округлые, плотные, малоподвижные,
безболезненные, быстро возникающие образования различных размеров на
разгибательной поверхности суставов, в области лодыжек, ахилловых сухожилий,
остистых отростков позвонков, затылочной области gallea aponeurotica с циклом
обратного развития от 2 недель до 1 месяца. Артралгия - боль в суставе различной
интенсивности, не сопровождается болезненностью при пальпации и другими
симптомами воспаления.
Ревматическая болезнь сердца - заболевание, характеризующееся поражением
сердечных клапанов в виде поствоспалительного краевого фиброза клапанных створок
или порока сердца (недостаточность и/или стеноз), сформировавшегося после
перенесенной ОРЛ.
Проводя дифференциальную диагностику ОРЛ и ИЭ, следует обратить внимание на
наличие характерных для эндокардита признаков: указания на медицинские
манипуляции в анамнезе, сопровождающиеся бактериемией; ознобы; быстрое
прогрессирование симптоматики имеющегося порока сердца или быстрое формирование
нового порока с преобладанием недостаточности клапана; петехии на коже и
слизистых; спленомегалия; высокие лабораторные показатели воспалительной
активности; обнаружение МВ на клапанах при ЭхоКГ; отсутствие эффекта от НПВП.
Основные дифференциально-диагностические различия между острой ревматической
лихорадкой и ИЭ представлены в таблице 26.
Таблица 26. Дифференциально-диагностические различия между инфекционным
эндокардитом и острой ревматической лихорадкой
| Дифференциально-диагностические признаки |
Инфекционный эндокардит |
Острая ревматическая лихорадка |
| Возраст |
Обычно 20-50 лет |
7-14 лет |
| Пол |
Чаще мужчины |
Чаще женщины |
| Факторы, предшествующие и предрасполагающие к
развитию заболевания |
Медицинские манипуляции, сопровождающиеся
бактериемией, наркомания, иммунодефицит, наличие входных ворот инфекции,
пороки сердца, кардиомиолатии, хирургические вмешательства |
А-стрептококковая инфекция глотки (фарингит,
ангина) |
| Характер поражения клапанного аппарата |
Разрушение створок и формирование
недостаточности АК, реже МК или ТК, абсцесса фиброзного кольца клапана,
перфорация, отрыв створок |
Преимущественно стенозирование отверстий, в
основном левого атриовентрикулярного отверстия или устья аорты |
| Темпы формирования порока сердца |
При остром ИЭ порок сердца развивается через
7-14 дней, при подостром - через несколько недель |
Порок сердца формируется через месяцы и годы |
| Бактериемия |
Характерна |
Отсутствует |
| Обнаружение вегетации на клапанах сердца при
эхокардиографии |
Характерно |
Не характерно |
| Утолщение концевых фаланг пальцев кистей
(«барабанные папочки») |
Характерно |
Не характерна |
| Петехиальная сыпь на коже,
конъюнктиве (симптом Лукина-Либмана) |
Характерна |
Не характерен |
| Подногтевой капиллярит |
Характерен |
Не характерны |
| Пятна Дженеуэя и узелки Ослера |
Характерны |
Не характерны |
| Тромбоэмболический синдром |
Часто |
Редко |
| Ознобы |
Часто |
Не характерны |
| Поражение почек |
Характерен гломерулонефрит, часто инфаркты
почек |
Редко |
| Полиартрит |
Редко асимметричный артрит мелких суставов
кистей и стоп |
Мигрирующий полиартрит преимущественно крупных
и средних суставов с доброкачественным течением |
| Эффект НПВП |
Отсутствует |
Положительный |
Особенно трудно проводить дифференциальную диагностику между вторичным
ревматическим ИЭ и повторной ревматической лихорадкой на фоне порока сердца. В
этом случае ЭхоКГ недостаточно информативна в связи с фиброзом или кальцинозом
клапанов, обусловленным ревматическим пороком сердца. Выявить МВ на створках
клапанов в этой ситуации затруднительно, однако наличие абсцессов и перфораций
створок, несомненно, свидетельствует о ИЭ. Спленомегалия, тромбоэмболический
синдром, гломерулонефрит, положительная гемокультура, выраженная, стойкая
лихорадка, исчезающая только после АБТ также говорят в пользу ИЭ.
Клинико-лабораторными признаками ИЭ и СКВ являются лихорадка, снижение массы
тела, миокардит, эндокардит, формирование порока сердца, петехиальная сыпь на
коже, анемия, значительное увеличение СОЭ, ЦИК, ревматоидного фактора,
криопротеина. Дифференциально-диагностические различия между ИЭ и СКВ
представлены в таблице .
Установить диагноз системной красной волчанки помогают диагностические
критерии Американской ревматологической ассоциации: фиксированная эритема
(плоская или приподнятая) на скуловых выступах, на щеках с тенденцией к
распространению к носогубной зоне («волчаночная бабочка»); дискоидные очаги
волчанки - эритематозные приподнимающиеся бляшки с кожными чешуйками,
атрофические рубцы на старых очагах; фотосенсибилизация; язвы в полости рта или
в области носоглотки; неэрозивный артрит, поражающий два или более
периферических сустава с болезненностью, отеком, выпотом; серозит (плеврит,
перикардит); поражение почек (стойкая протеинурия > 0,5 г/сут; цилиндрурия);
поражение центральной нервной системы (судороги или психозы); гематологические
нарушения (гемолитическая анемия с ретикулоцитозом, лейкопения,
тромбоцитопения); иммунологические нарушения (антитела к двуспиральной ДНК,
увеличение IgG и IgM, антител к кардиолипину, положительный тест на волчаночный
антикоагулянт, ложноположительная реакция Вассермана); обнаружение
антинуклеарных антител. При наличии четырех из перечисленных критериев диагноз
системной красной волчанки считается достоверным. Основные
дифференциально-диагностические различия между СКВ и ИЭ представлены в таблице
27.
Таблица 27. Дифференциально-диагностические различия между ИЭ и СКВ
| Дифференциально-диагностические
признаки |
Инфекционный
эндокардит |
Системная красная волчанка |
| Пол |
Чаще мужчины |
Чаще женщины |
| Возраст |
Обычно 20-50 лет |
Молодой |
| Предрасполагающие факторы
|
Медицинские манипуляции,
сопровождающиеся бактериемией, наркомания, иммунодефицит, наличие входных
ворот инфекции, пороки сердца, кардиомиопатии, хирургические вмешательства |
Инсоляция, вакцинация, стресс
|
| Поражение кожи
|
Петехии,
геморрагически-некротическая сыпь
|
Эритематозные высыпания, «бабочка»
на лице, «люпус-хейлит», «сетчатое ливедр» |
| Утолщение концевых фаланг пальцев
(«барабанные палочки») |
Характерны при подостром ИЭ
|
Не характерны
|
| Характер порока
|
Чаще недостаточность АК
|
Чаще порок МК, но могут быть пороки
АК, ТК |
| Темп формирования порока |
При остром ИЭ порок развивается
через 7-14 дней, при подостром - через несколько недель
|
Порок сердца развивается медленно,
в течение многих месяцев, даже лет |
| Наличие МВ Абсцессы и перфорации
створок |
Характерно Характерно
|
Не наблюдается Не наблюдается
|
| Перикардит
|
Нечастый вариант поражения сердца
(13-15 %) |
Частый вариант поражения сердца |
| Полиартрит
|
Не характерен
|
Характерен, при хроническом
течении - неэрозивный ревматоидно-подобный артрит |
| Тромбоэмболический синдром |
Наблюдается часто
|
Наблюдается редко
|
| Спленомегалия
|
Характерна
|
Может наблюдаться |
| Полисерозит |
Редко |
Характерен |
| Гемокультура |
Положительная |
Отрицательная |
| Эффект АБТ |
Положительный |
Отсутствует |
| Обнаружение а крови волчаночных
клеток |
Иногда могут определяться
|
Характерно
|
| Обнаружение в крови антител к ДНК |
Могут определяться, но нет
нарастания титров в динамике |
Очень характерно, титры нарастают в
динамике |
| Обнаружение в крови антинуклеарного
фактора |
Возможно, нет нарастания титров в
динамике |
Очень
характерно, титры нарастают в динамике |
| Обнаружение в крови
антифосфолипидных антител |
Редко |
Характерно
|
Возможно развитие вторичного ИЭ у больных СКВ на фоне волчаночного
эндокардита Либмана-Сакса (5-11 %). В развитии вторичного ИЭ наряду с
предшествующим поражением клапанов принимают участие гиперкоагуляция,
антифосфолипидный синдром, тяжелое поражение почек, последствия
глюкокортикоидной и иммуно-депрессантной терапии. В литературе имеются сообщения
о стрептококковой, гонококковой, стафилококковой, энтерококковый этиологии ИЭ
при СКВ. В диагностике вторичного эндокардита следует использовать
диагностические критерии этих заболеваний. По хронологии развития инфекционный
эндокардит всегда вторичен по отношению к СКВ.
Иногда необходимо дифференцировать ИЭ с антифосфолипидным синдромом. АФС
представляет собой симптомокомплекс, в основе которого лежит развитие
аутоиммунной реакции, появление антител к широко распространенным фосфолипидным
детерминантам, присутствующим на мембранах тромбоцитов, клеток эндотелия,
нервной ткани.
К антифосфолипидным антителам относятся: волчаночный антикоагулянт, антитела
к кардиолипину, р2-глико-протеин-1-кофакторзависимые антитела,
подавляющие естественную антикоагулянтную активность р2-гликопротеина-1.
Основным патогенетическим механизмом АФС является влияние антифосфолипидных
антител на сосудистые, клеточные, гуморальные компоненты системы коагуляции, что
приводит к нарушению равновесия между анти - и прокоагулянтными процессами с
преобладанием последних, развитию тромбозов. Кроме того, антифосфолипидные
антитела связываются с мембраной активированных тромбоцитов, что вызывает более
быстрое их разрушение фагоцитирующими макрофагами, в результате чего развивается
тромбоцитопения.
Дифференцировать ИЭ и АФС необходимо потому, что при этих заболеваниях
развиваются венозные и артериальные тромбозы, а также поражение клапанов сердца
(при антифосфолипидном синдроме чаще развивается митральный порок) с появлением
тромботических наложений, неотличимых от МВ при ИЭ, резкое увеличение СОЭ.
Для АФС характерны артериальные или венозные тромбозы любой локализации;
различные формы акушерской патологии (невынашивание беременности);
тромбоцитопения; поражение нервной системы (судороги, ишемический инсульт);
пороки сердца (недостаточность МК или митральный стеноз, реже - недостаточность
АК или сужение устья аорты); нередко инфаркт миокарда (вследствие тромбоза
коронарных артерий); сетчатое ливедо, язвы голени; поражение почек (инфаркт
почек, нефрогенная артериальная гипертензия); гемолитическая анемия; высокие
титры антител к кардиолипину.
В отличие от ИЭ при АФС отсутствует бактериемия, реже наблюдается длительная
лихорадка. При верификации АФС целесообразно пользоваться международными
диагностическими критериями (таблица 28). Для постановки диагноза
антифосфолипидного синдрома необходимо выявление, по крайней мере, 1
клинического и 1 лабораторного критериев.
Таблица 28. Международные диагностические критерии АФС
| Клинические критерии |
Лабораторные критерии |
Тромбоз сосудов
Один или более эпизодов артериального, венозного тромбоза или тромбоза
мелких сосудов, кровоснабжающих любой орган и ткань. За исключением
тромбозов поверхностных вен, тромбоз должен быть подтвержден с помощью
ангиографии, доплеровского исследования сосудов или морфологически. При
морфологическом исследовании признаки тромбоза должны наблюдаться при
отсутствии выраженной воспалительной инфильтрации сосудистой стенки. |
Антитела к кардиолипину
классов IgG или IgM в сыворотке в средних или высоких титрах, обнаруженные
дважды на протяжении 6 недель с помощью стандартизованного иммуноферментного
метода, позволяющего выявить Р2-гликопротеин-1 -зависимые антитела
Волчаночный антикоагулянт, выявляемый в плазме дважды на протяжении 6
недель стандартизованным методом, включающим следующие этапы:
• удлинение фосфолипидзависимого свертывания крови при использовании
скринингового теста (АЧТВ, каолиновый тест, тест с ядом гадюки Рассела,
протромбиновое время, текстариновое время);
• отсутствие нормализации времени свертывания крови поданным скрининговых
тестов при смешивании с нормальной, лишенной тромбоцитов плазмой;•
нормализация удлиненного времени свертывания крови при добавлении избытка
фосфолипидов;
• исключение других коагулопатий (наличие в крови ингибиторов фактора VIII
или гепарина) |
Акушерская патология
•Один или более эпизодов необъяснимой гибели морфологически нормального
плода до 10 недель беременности или
• один или более эпизодов преждевременной гибели морфологически нормального
плода до 34 недель беременности в связи с выраженной преэклампсией или
эклампсией, или тяжелой плацентарной недостаточностью,
•три и более эпизодов необъяснимых, последовательно развивающихся спонтанных
абортов до 10 недель беременности при исключении анатомических и
гормональных нарушений у матери и хромосомных нарушений у матери и отца.
|
Представляют также интерес малые клинические и лабораторные критерии
антифосфолипидного синдрома, которые применяют в дополнение к большим
международным диагностическим критериям.
В состав малых диагностических критериев АФС входят: клинические (сетчатое
ливедо, поражение клапанов сердца - утолщение или вегетации клапанов сердца, не
связанные с ревматической болезнью сердца синдром, напоминающий рассеянный
склероз, хорея, судороги, тромбоцитопения, гемолитическая анемия, транзиторные
ишемические атаки, два последовательных эпизода спонтанных абортов до 10-й
недели беременности, ложноположительная реакция Вассермана; поперечный миелит;
язвы ног; двусторонние кровоизлияния в надпочечники; первичная легочная
гипертензия; АФС-нефропатия; семейный анамнез по СКВ или АФС), лабораторные
критерии (низкопозитивный уровень антител к кардиолипину IgG или IgM, антитела к
кардиолипину класса IgA, антитела к b2-гпикопротеину-1, антитела к
протромбину, аннексину, нейтральным фосфолипидам).
При ИЭ и системных васкулитах может наблюдаться сходная клиническая, и
лабораторная симптоматика: длительная лихорадка, кожные геморрагические сыпи,
гломерулонефрит, тромбоэмболический синдром, похудание, значительное увеличение
СОЭ, анемия. При дифференциальной диагностике следует пользоваться
диагностическими критериями нозологических форм системных васкулитов. Необходимо
учитывать также отсутствие бактериемии, высокую эффективность глюкокортикоидной
терапии и отсутствие эффекта антибактериальной терапии при системных васкулитах
в отличие от инфекционного эндокардита.
Большое значение в постановке диагноза системного васкулита имеет биопсия
кожно-мышечного лоскута и обнаружение в биоптатах воспалительно-инфильтративных
и некробиотических изменений в сосудах. Для некоторых вариантов системных
васкулитов, в частности, для гранулематоза Вегенера, микроскопического
полиартериита, аллергического гранулематозного ангиита характерно наличие в
крови антинейтрофильных цитоплазматических антител, реагирующих с различными
ферментами цитоплазмы нейтрофилов, в первую очередь, с протеиназой-3,
миелопероксидазой, реже - с лактоферином, катепсином G и другими антигенами.
Определенные трудности могут возникать при дифференциальной диагностике
инфекционного эндокардита и неспецифического аортоартериита (болезни Такаясу),
протекающего с формированием аортальной недостаточности, обусловленной
дилатацией аорты. Необходимо в этом случае учесть, что для болезни Такаясу
характерны выраженные парестезии, перемежающаяся хромота, отсутствие или
асимметрия пульса на лучевой, локтевой или сонной артерии, разные величины
артериального давления на правой и левой руке.
В постановке диагноза болезни Такаясу большую роль играет контрастная
ангиография, которая выявляет сужение просвета или окклюзию аорты, ее крупных
ветвей в проксимальных отделах верхних и нижних конечностей. В последние годы
для диагностики неспецифического аортоартериита используются также доплеровское
ультразвуковое исследование сосудов, компьютерная и магнитно-резонансная
томография, позволяющие установить диагноз на ранней стадии болезни, когда
наблюдается лишь утолщение сосудистой стенки. Важно и то, что при болезни
Такаясу недостаточность клапана аорты не сопровождается образованием вегетации
на аортальном клапане, что констатируется при эхокардиографии.
Лимфопролиферативные заболевания, в первую очередь лимфогранулематоз и
неходжкинские лимфомы проявляются симптоматикой, сходной с инфекционным
эндокардитом. При этих заболеваниях наблюдаются упорная лихорадка, потливость,
похудание, увеличение селезенки, анемия, увеличение СОЭ. Однако в отличие от
инфекционного эндокардита при лимфопролиферативных заболеваниях может иметь
место выраженная стойкая прогрессивно увеличивающаяся лимфаденопатия (часто с
увеличением медиастинальных и абдоминальных лимфоузлов), отсутствуют бактериемия
и вегетации на клапанах сердца, неэффективна антибактериальная терапия. Однако
окончательная верификация диагноза лимфогранулематоза и неходжкинской лимфомы
производится на основании гистологического исследования биоптата лимфатических
узлов и обнаружения характерной гистологической картины. Иногда при
лимфопролиферативных заболеваниях развивается небактериальный тромботический
эндокардит.
Злокачественные опухоли, так же как и инфекционный эндокардит, могут
проявляться упорной, не поддающейся антибактериальной терапии лихорадкой с
ознобами, потливостью, похуданием, резко выраженным увеличением СОЭ, анемией.
Высокая лихорадка особенно часто наблюдается при гипернефроме, опухолях толстого
кишечника, поджелудочной железы. Наряду с этим у пожилых людей со
злокачественными опухолями может иметь место атеросклеротическая недостаточность
клапана аорты или митральный порок, что еще больше делает актуальной проблему
дифференциальной диагностики злокачественных новообразований и инфекционного
эндокардита. К тому же у больных со злокачественными новообразованиями может
развиваться абактериальный тромботический эндокардит. В связи с вышесказанным
можно считать целесообразным, прежде чем поставить диагноз инфекционного
эндокардита, особенно у пожилых людей, исключить злокачественную опухоль той или
другой локализации, используя соответствующие современные диагностические
методы. Следует также помнить о возможности сочетания ИЭ и злокачественного
новообразования, особенно у лиц пожилого возраста.
Обострение хронического пиелонефрита может давать клиническую симптоматику,
очень сходную с ИЭ: лихорадка с ознобом, выраженная общая слабость, снижение
аппетита, анемия, увеличение СОЭ, в некоторых случаях - бактериемия. Однако, в
отличие от инфекционного эндокардита, у больных может наблюдаться учащенное,
болезненное мочеиспускание, часто обнаруживается мочекаменная болезнь, у мужчин
- доброкачественная гиперплазия предстательной железы, имеет место выраженная
лейкоцитурия, бактериурия, нередко в анамнезе имеются указания на перенесенный
ранее острый пиелонефрит. При ультразвуковом исследовании . почек у больных
хроническим пиелонефритом обнаруживается деформация чашечно-лоханочной системы,
расширение чашечек, лоханки, другие характерные признаки.
Необходимо отметить, что у больных, длительно страдающих хроническим
пиелонефритом, может развиться ИЭ, и вызывается он обычно кишечной палочкой,
протеем, энтерококком, то есть микроорганизмами, наиболее часто встречающимися
при пиелонефрите, инфекции мочевыводящих путей.
Под небактериальным тромботическим (марантическим) эндокардитом понимают
неинфицированные тромботические наложения на клапанах без воспалительных
проявлений и фиброза клапанов. Термин «небактериальный тромботический
эндокардит» предложен Cross и Freidberg в 1936 г. Патоморфологические признаки
небактериального тромботического эндокардита следующие: формирование на клапанах
сердца наложений размерами от 3-7 мм до нескольких сантиметров, состоящих из
фибрина и тромбоцитов; отсутствие в фибриновых наложениях микроорганизмов и
воспаления.
При небактериальном (марантическом, кахектическом, дегенеративном)
эндокардите чаще поражаются митральный и аортальный клапаны. Наиболее часто
небактериальный эндокардит развивается у больных злокачественными
новообразованиями, особенно протекающими с истощением (отсюда название
кахектический, марантический эндокардит). Около 4-10% больных со
злокачественными новообразованиями могут иметь небактериальный эндокардит.
Наиболее часто он развивается при раке поджелудочной железы, раке легкого, раке
желудка, лимфомах, лейкозах.
Кроме того, небактериальный эндокардит может развиваться при
гломерулонефритах, циррозах печени, психогенной анорексии, сопровождающейся
тяжелой кахексией. Описаны редкие случаи развития небактериального эндокардита и
при таких остро протекающих заболеваниях, как пневмония, тромбоэмболии легочной
артерии, что, вероятно, обусловлено развитием при этих заболеваниях синдрома
диссеминированного внутрисосудистого свертывания и нарушениями в системе
микроциркуляции.
Существует определенное сходство между инфекционным и небактериальным
эндокардитом: это частые тромбоэмболические осложнения; тромбофлебиты
периферических вен, часто рецидивирующие; эхокардиографические признаки
наложений на клапанах, очень сходные с типичными вегетациями. Приблизительно у
30% больных небактериальным эндокардитом может прослушиваться систолический шум
на верхушке сердца или в области аорты (редко определяется диастолический шум),
что еще больше подчеркивает сходство небактериального и ИЭ.
Основными признаками, отличающими небактериальный эндокардит от инфекционного
эндокардита, являются отрицательная гемокультура, нормальная температура тела,
отсутствие ознобов, «входных ворот инфекции» и других признаков инфекционного
эндокардита. Однако следует отметить возможность повышения температуры тела у
многих больных со злокачественными новообразованиями, что значительно затрудняет
дифференциальную диагностику инфекционного и небактериального эндокардитов.
Определенное значение может иметь отсутствие эффекта от антибактериальной
терапии.
Очень важны данные ЭхоКГ. При небактериальном эндокардите обычно выявляются
лишь утолщение и уплотнение створок клапана, регургитация, дополнительные
эхосигналы от створок, но в отличие от инфекционного эндокардита не бывает
отрывов, разрывов, перфорации створок, абсцессов клапанного кольца.
Заканчивая обсуждение вопросов дифференциальной диагностики инфекционного
эндокардита, необходимо указать на существование атипичных форм этого
заболевания, протекающего с преимущественным поражением какого-либо одного
органа - это так называемые «маски» инфекционного эндокардита. Различают
следующие «маски»:
• почечная (в клинической картине доминирует симптоматика поражения почек -
гломерулонефрит, пиелонефрит и даже нарастающая почечная недостаточность или
тромбоэмболия почечной артерии);
• гематологическая (на первый план выступает синдром гипохромной анемии с
дефицитом железа);
• церебральная (ведущим клиническим проявлением заболевания является
нарушение мозгового кровообращения вследствие тромбоэмболии церебральных
артерий);
• легочная (обусловлена превалированием в клинической картине синдрома
тромбоэмболии легочной артерии);
• кардиальная (ведущим в клинической картине является инфаркт миокарда,
обусловленный тромбоэмболией коронарных артерий).
При доминировании в клинической картине заболевания одной из вышеназванных
«масок» для успешной диагностики инфекционного эндокардита необходимо тщательно
анализировать анамнез и данные клинико-инструментального обследования больных с
целью выявления диагностических критериев инфекционного эндокардита. Следует
также учесть, что даже при доминировании какой-либо клинической «маски» у
больных, как правило, отмечается повышение температуры тела, сопровождающееся
ознобами, возможны кожные проявления заболевания, часто удается высеять
возбудителя из крови.
Большое значение имеет аускультация сердца в динамике (появление
диастолического шума в области аорты или новых шумов в области сердца, которых
не было прежде), эхокардиография (выявление вегетации и других
эхокардиографических признаков инфекционного эндокардита, описанных ранее).
Проводя дифференциальную диагностику лихорадок неясного генеза, всегда
следует помнить о возможности ИЭ и предпринять все усилия для ранней его
диагностики. Особенно трудна диагностика ИЭ у лиц пожилого и старческого
возраста. Особенности клиники ИЭ у лиц этой возрастной группы приведены выше.
Критериями ИЭ у лиц пожилого, старческого возраста являются: лихорадка,
сопровождающаяся необъяснимой сердечной недостаточностью, лихорадка,
сопровождающаяся цереброваскулярными расстройствами, лихорадка, сопровождающаяся
необъяснимой почечной недостаточностью, лихорадка и выраженные боли в спине,
анемия неясного генеза и прогрессирующее снижение массы тела, вновь появившийся
шум сердца, внутрибольничная инфекция с лихорадкой у больных с внутривенными
катетерами, артериальная гипотензия, спутанность сознания.
Приведенные критерии не являются специфичными, могут наблюдаться и при других
заболеваниях. Однако они подчеркивают некоторые особенности течения болезни в
указанной возрастной группе, способствуют диагностике.
* * *
Таким образом, для диагностики инфекционного эндокардита целесообразно
использовать усовершенствованные DUKE-критерии, проводить дифференциальный
диагноз с ЛНЭ, ревматизмом, неинфекционным тромбоэндокардитом, антифосфолипидным
синдромом, системными заболеваниями соединительной ткани и костно-мышечной
системы, васкулитами, злокачественными новообразованиями, инфекционными
болезнями, протекающими с лихорадкой, кожной сыпью, спленомегалией.
Использование дифференциально-диагностических признаков и диагностических
критериев, проведение лабораторных исследований, ультразвукового исследования
сердца и органов брюшной полости в динамике позволяет своевременно
верифицировать инфекционный эндокардит. |