
4.1. Морфо-функциональные особенности тимуса в
поствакцинальном периоде
Через 7 суток после проведения антирабической вакцинации консистенция тимуса
была более мягкой, а масса ее достоверно уменьшилась по
сравнению с тимусом контрольных животных. Лишь к 180-м
суткам после вакцинации относительная масса тимуса достигала контрольных
значений, а к 360-м суткам достоверно их превысила (табл.
4.1.). Процесс нормализации же клеточного состава тимуса запаздывал. Только к
360-м суткам эксперимента число клеточных элементов в тимусе соответствовало
нормальным показателям.
Одним из главных признаков реакции тимуса на антирабическую вакцинацию было
достоверное увеличение числа лимфоцитов с пикнотическими
ядрами, появление в его паренхиме крупных темно окрашенных гранул. Максимальное
увеличение числа деструктивных лимфоцитов наблюдалось на 7-е, 14-е и 21-е сутки
после вакцинации. Лимфоцитоз у контрольных животных не
превышал 1,24%, а у экспериментальных животных он достигал 4,7%, т.е.
увеличивался в 3,79 раза.
Таблица 4.1. Относительная масса (в граммах) тимуса белых
крыс после антирабической вакцинации

* - Р < 0,01 при сравнении контроля и опыта (после АРВ)
При электронной микроскопии в ретикулоэпителиальных клетках нередко
определялись структуры, аналогичные по электронной плотности цитоплазме
лимфоцитов. Наряду с этим в цитоплазме некоторых ретикулоэпителиоцитов
наблюдались лимфоциты с сохранившейся цитоплазматической мембраной
(рис. 1). Уже в ранние сроки эксперимента (7-21-е сутки) наблюдалось
увеличение относительного числа ретикулоэпителиоцитов. У контрольных животных наибольшая доля ретикулоэпителиоцитов приходилась на подкапсулярную
зону тимуса. Она составляла 15,3±1,7%. В других зонах тимуса доля ретикулоэпителиоцитов среди клеточных элементов была значительно меньшей: в глубокой зоне мозгового вещества – 10,2±1,2%; в зоне мозгового вещества на границе с корковым – 9,7±2,1%; в зоне коркового вещества, пограничного с мозговым веществом – 5,9±1,4%; в средней зоне коры – 4,9±0,9%.
На 21-е сутки количество эксперимента эпителиоретикулоцитов во всех
зонах тимуса превышало контрольные значения более, чем в 2,6 раза и на
протяжении всех сроков эксперимента оставалось значительно выше.
В поствакцинальном периоде, особенно в сроки 14-21-30-е сутки, изменяется структура эпителиоретикулоцитов.
Наибольшие признаки морфофункциональной активности обнаружены в эпителиоретикулоцитах, расположенных под базальной мембраной гемокапилляров. Эти эпителиоретикулоциты у контрольных животных характеризуются наличием большого числа
десмосомальных структур, свободно расположенных в цитоплазме микрофибрилл, митохондрий с незначительным количеством крист
и многочисленными рибосомами.
В эксперименте в эпителиоретикулоцитах этого типа обнаруживались
большое число моно- и полирибосом, равномерно распределенных в их ци-
топлазме. Количество митохондрий вытянутой формы так же увеличивалось.
Матрикс митохондрий уплотнялся, возрастало число крист (рис. 2).
Эпителиоретикулоциты коркового вещества отличаются от аналогичных
клеток других зон тимуса наличием большого и светлого ядра с четкой нуклеолемой и узкого ободка цитоплазмы с длинными отростками. Цитоплазма
отличается значительной электронной плотностью и заполнена волокнистыми структурами, рибосомами, липидными включениями. В поствакцинальном
периоде они трансформируются в клетки, вероятно, выполняющие секреторные функции. В цитоплазме этих эпителиоретикулоцитов формируются розетки полирибосом, которые в большом количестве скапливаются в вакуолях,
окруженных одинарной мембраной. Эти вакуоли свободно открываются в
межклеточные пространства. Именно туда мигрируют лимфоциты из фолликулов Кларка.
В корковом веществе поствакцинального периода увеличивается относительное число макрофагов. Они характеризуются большим объемом цитоплазмы, крупным, светлым ядром с небольшими глыбками хроматина.
Макрофагальная реакция в тимусе наблюдалась на протяжении всех сроков эксперимента. Максимум реакции отмечался на 21-е и 90-е сутки после
вакцинации (рис. 3).
Популяция лимфоцитов в тимусе контрольных животных распределена
неравномерно. В подкапсулярной зоне ярко проявляется клеточная мозаика:
зоны, богатые малодифференцированными клетками, чередуются с зонами с
высоким содержанием или плазмоцитов, или лимфоцитов.
В поствакцинальном периоде (90-е сутки) наблюдалась выраженная делимфотизация тимуса (рис. 4). При этом дольки его сохраняли крупные раз-
меры. Петли эпителиального ретикулюма и соединительнотканного остова
тимуса приобретали ячеистый вид.
У контрольных животных эти ячейки с плотно упакованными лимфоцитами образуют морфо-функциональные единицы тимуса – фолликулы Клар-
ка. В последующие сроки эксперимента (180-360-е сутки) размеры долек тимуса уменьшались, но они вновь становились заполненными лимфоцитами
(рис. 5). У контрольных животных самым высоким содержанием малодифференцированных элементов отличается подкапсулярная зона тимуса: до
15,3±2,1% и более. Значительно меньше лимфобластов и больших лимфоцитов в средней и пограничной зонах коркового вещества (до 4,2±0,7) и еще
меньше в мозговом веществе (не более 1,5-2,5%). Причем, если в подкапсулярной
зоне тимуса основную массу малодифференцированных клеток составляют лимфобласты, то в остальных зонах коркового вещества и в мозговом веществе – большие лимфоциты.
В поствакцинальном периоде, наряду с гибелью лимфоцитов, постоянно
встречались митотически делящиеся клетки. Клетки в состоянии митоза
практически всегда определялись вблизи от групп лимфоцитов, находящихся
в состоянии деструкции. В раннем поствакцинальном периоде (7–14-е сутки)
количество гибнущих клеток превышало количество делящихся клеток на 52-63%, в последующие сроки эксперимента (21-90-е сутки) ситуация изменялась и количество делящихся клеток превышало количество гибнувших на
37-45%. В дальнейшем (180-360-е сутки) соотношение делящихся и гибнущих
клеток в тимусе приблизилось к контрольным цифрам (72-78%), а затем и
превысило их на 120-180%.
Плазмобласты и плазмоциты постоянно встречались в тимусе контрольных животных. Их локализация не связана с расположением микрососудов.
Наибольшее число плазмоцитов находилось в подкапсулярной зоне тимуса
(до 7,5 %), в остальных её зонах – от 2,4 до 4,7%.
У вакцинированных животных число пиронинофильных лимфоидных
элементов значительно увеличивалось, достигая максимума к 30-м суткам
эксперимента (≈12,8%), и продолжало оставаться достаточно высоким на
протяжении всего периода наблюдений (рис. 6). Нейтрофильные и ацидофильные гранулоциты, которые у контрольных животных являлись редкими,
непостоянными клетками тимуса, в поствакцинальном периоде определялись
постоянно. В поствакцинальном периоде количество и размеры тимических
телец достоверно увеличивались по сравнению с контрольными значениями.
Наряду с эпителиальными островками и новообразованными тимическими
тельцами формировались крупные сливные тимические тельца (рис. 7).
В раннем поствакцинальном периоде тимические тельца отличались высокой
фагоцитарной активностью: в их просвете нередко определялись распадающиеся сегментноядерные нейтрофильные гранулоциты, ацидофильные гранулоциты и обломки ядер лимфоцитов. В последующие сроки эксперимента (90-180-е сутки) тимические тельца имели еще большие размеры,
часть из них сливалась друг с другом. Фагоцитарная активность их усиливалась. Через 180 и 360 суток после вакцинации в мозговом веществе тимуса
определялись только крупные, зрелые тимические тельца. Фагоцитарная активность их была значительно снижена. Эпителиальные островки и новообразованные тимические тельца наблюдались крайне редко.
В поствакцинальном периоде, начиная с 7 дня опыта и во все последующие дни эксперимента, отмечается значительное усиление функциональной активности микроциркуляторного русла тимуса: увеличение числа
функционирующих микрососудов, расширение их диаметра, увеличение размера тимических телец, повышение транспортной активности эндотелиоцитов (табл. 4.2.).
Наиболее характерным было усиление функциональной активности
эндотелия гемокапилляров, входящих в состав гематотимического барьера. В цитоплазме эндотелиоцитов увеличивалось число рибосом, зона
Гольджи гипертрофировалась, формировались лизосомальные структуры.
Нередко определялись вакуоли с фагоцитированными частицами; выраженная
функциональная активность определялась в эндотелиоцитах
лимфатических микрососудов. В паренхиме тимуса кровеносные и лимфатические
микрососуды теснейшим образом контактируют друг с другом
и междольковой соединительной тканью. Повышение
функциональной активности микрососудов ведет к увеличению индекса миграционной
активности лимфоцитов тимуса у экспериментальных животных почти в 3,5 раза по
сравнению с этим показателем у контрольных животных.
Именно увеличение индекса миграционной активности
тимуса у вакцинированных животных приводило к частичной делимфатизации тимуса.
Клеточные потери его достигали максимума к 90-м суткам эксперимента (табл.
4.3.).
Таблица 4.2. Площадь зон тимуса белых крыс после
антирабической вакцинации (%)
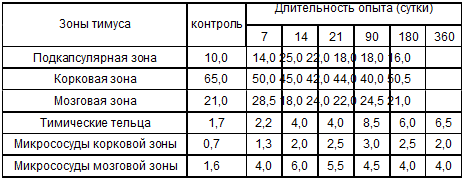
Таблица 4.3. Динамика количества клеток (106) в тимусе
белых крыс после антирабической вакцинации (M±m)
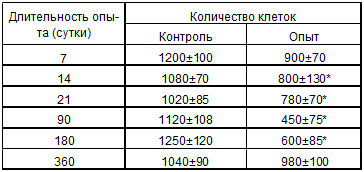
* - Р< 0,05 при сравнении контроля и опыта (после вакцинации)
|