
10.8. ЛЕЧЕНИЕ
Основными целями лечения больных хронической систолической СН являются: 1.
Устранение клинической симптоматики СН (одышки, повышенной утомляемости,
тахикардии, отечного синдрома). 2. Предотвращение поражений органов-мишеней
(сердце, почки, головной мозг, сосуды, скелетная мускулатура). 3. Улучшение
качества жизни. 4. Улучшение прогноза заболевания (продление жизни). При
разработке индивидуальной тактики лечения необходимо учитывать большую
неоднородность группы больных с признаками ХСН. Можно выделить несколько
категорий таких больных: больные с различными причинами возникновения ХСН;
больные с явными клиническими симптомами и сниженной систолической функцией ЛЖ
(снижением ФВ и СИ по данным ЭхоКГ); больные с клинической симптоматикой СН, но
без признаков систолической дисфункции (диастолическая ХСН); больные с
бессимптомной дисфункцией ЛЖ (снижение ФВ и СИ без клинических признаков СН).
Лечение этих категорий больных ХСН требует индивидуального подхода, учитывающего
многие аспекты этиологии, патогенеза и клинической картины заболевания.
ЭТИОЛОГИЧЕСКОЕ ЛЕЧЕНИЕ
Правильно подобранное лечение основного заболевания, которое привело к
развитию ХСН, во многих случаях может значительно уменьшить выраженность
проявлений сердечной декомпенсации. К числу таких потенциально обратимых причин
ХСН относятся: артериальная гипертензия (нормализация АД); бради- и тахиаритмии
(коррекция нарушений сердечного ритма и проводимости); злоупотребление алкоголем
(прекращение приема алкоголя); ожирение (снижение массы тела); пороки сердца
(хирургическая коррекция порока); тиреотоксикоз или микседема (адекватная
коррекция гормональных нарушений); экссудативный или констриктивный перикардит
(адекватная терапия или хирургическое лечение); ИБС (адекватно подобранная
антиангинальная терапия или внутрикоронарная ангиопластика аортокоронарное
шунтирование); анемии (восстановление содержания эритроцитов и гемоглобина);
хронические обструктивные заболевания легких (противовоспалительная терапия,
лечение обструктивного синдрома). Без воздействия на основную причину ХСН во
многих случаях трудно рассчитывать на положительные результаты лечения СН.
Радикальное лечение основного заболевания у части больных ХСН не всегда
возможно в связи с наличием тяжелой недостаточности кровообращения. В этих
случаях лечение должно быть направлено на уменьшение клинических проявлений
сердечной декомпенсации и создание условий, которые бы позволили вновь вернуться
к вопросу о целесообразности радикального лечения основного заболевания. Не
меньшее значение имеет выявление и устранение некоторых провоцирующих факторов -
непосредственных причин ухудшения состояния больных ХСН.
К числу наиболее частых из них относятся: несоблюдение врачебных рекомендаций
(избыточное потребление соли, жидкости, нарушение схемы приема лекарственных
средств); нарушение индивидуального режима физической активности; инфекции;
употребление алкоголя; острый ИМ, нестабильная стенокардия; ТЭЛА; преходящие
расстройства электролитного обмена (гипокалиемия, гипофосфатемия, гипокальциемия);
беременность и роды; возникновение пароксизмов или постоянной формы мерцательной
аритмии; дисфункция щитовидной железы.
Большое значение имеют ятрогенные факторы, прием лекарственных средств (ЛС),
вызывающих задержку натрия и воды (эстрогены, андрогены, хлорпропамид,
глюкокортикоиды, миноксидил, НПВС), обладающих отрицательным инотропным
действием (верапамил, дилтиазем, некоторые антиаритмические ЛС I класса,
b-адреноблокаторы в неадекватно больших дозах), ингибирующих образование
сосудорасширяющих простагландинов и эндотелиальных факторов (НПВС,
глюкокортикоиды), чрезмерное уменьшение преднагрузки (большие дозы диуретиков,
ингибиторов АПФ).
Рациональный лечебный режим. Больной ХСН нуждается в создании спокойной
благожелательной обстановки дома и на работе. По возможности его следует
оберегать от чрезмерного психоэмоционального напряжения и стрессовых ситуаций. В
течение дня больной с СН должен иметь возможность отдохнуть, лежа в постели и
придав ногам возвышенное положение. Очень важно обеспечить нормальную
продолжительность сна - не менее 8-9 часов в сутки.
Пересмотрено отношение к ограничению физической нагрузки у больных ХСН.
Дозированная физическая активность больного с сердечной декомпенсацией,
адекватная его функциональным возможностям, не только не приводит к
прогрессированию СН, но и способствует снижению уровня нейрогормонов, повышению
переносимости нагрузок и чувствительности к медикаментозному лечению. В
результате повышается “эмоциональный тонус” больных и качество жизни. Резкое
ограничение физической активности показано лишь в период нарастания признаков
левожелудочковой недостаточности или при выраженном отечном синдроме больных ФК
III-IV по NYHA. Физическая реабилитация должна учитывать степень функциональных
нарушений.
Наиболее эффективны физические тренировки, организуемые для больных ХСН в
специальных кардиологических и реабилитационных центрах, которые осуществляются
под постоянным врачебным контролем за гемодинамикой и другими показателями.
Более доступны самостоятельные физические упражнения, объем и интенсивность
которых индивидуально определяются лечащим врачом.
У больных с IV ФК по NYHA, которые при проведении 6-минутного теста-ходьбы
могут пройти в умеренном темпе не более 150 м, показаны регулярные дыхательные
упражнения или физические упражнения в положении сидя. Больным можно
рекомендовать редкое, медленное и глубокое дыхание с пролонгированным вдохом или
выдохом (4-5 дыхательных циклов за 1 мин).
У больных III ФК (дистанция 6-минутной ходьбы до 300 м), находящихся в
стабильном состоянии, наиболее простым и доступным методом физической тренировки
является дозированная ходьба. В течение первых 5 недель рекомендуется ежедневно
проходить 1 км за 13-15 мин (всего около 8-10 км в неделю). В зависимости от
индивидуальной переносимости, начиная с 6-й недели, увеличивают расстояние,
пройденное за неделю до 10-20 км; скорость ходьбы увеличивается до 11 минут на 1
км. Больным ФК I-II по NYHA (дистанция 6-минутной ходьбы до 500 м и 400 м)
рекомендуют сочетание нескольких видов нагрузки ходьбы и плавания.
В зависимости от функционального состояния больных и индивидуальной
тренированности величина и мощность дозируемой физической нагрузки могут быть
пересмотрены. Диета больных ХСН должна быть калорийной, легкоусвояемой,
скорректированной в отношении соли и жидкости. Целесообразно дробное питание 5-6
раз в сутки. Общая калорийность питания рассчитывается с учетом массы тела (МТ)
и ФК больных ХСН. Для характеристики МТ в настоящее время используют расчет так
называемого индекса массы тела (ИМТ) по формуле:
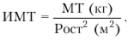
В таблице 56 предсталены значения ИМТ у пациентов с избыточным
весом, ожирением, дефицитом МТ.
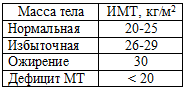
Таблица 56. Характеристика массы тела в зависимости от ИМТ
Для больных ХСН с нормальной МТ (ИМТ: 20-25 кг/м2), ведущих
малоподвижный образ жизни или выполняющих легкую физическую нагрузку, общая
калорийность суточного рациона составляет 1900-2500 ккал. Если у больных имеется
избыточная МТ или ожирение, следует предусмотреть уменьшение пищевого рациона на
20-30% за счет содержания животных жиров. При дефиците МТ (ИМТ меньше 20 кг/м2)
у больных с сердечной кахексией суточная калорийность диеты должна быть на
20-30% больше. Из рациона питания больных ХСН целесообразно исключить шоколад,
крепкий чай и кофе, острые блюда, копчености, продукты, богатые холестерином
(животный жир, икра, мозги), мучные изделия, жирные сорта мяса, сало.
Резко ограничивают или исключают прием алкоголя и запрещают курение. Потребление
поваренной соли обычно ограничивают до 5-6 г в сутки. Более значительное
ограничение в пище натрия хлорида (до 1,5-3,0 г в сутки) показано в периоды
дестабилизации состояния больных, при быстром прогрессировании симптомов
левожелудочковой недостаточности или отечного синдрома. В этих случаях больным
предлагается не подсаливать пищу и не употреблять продукты, содержащие
повышенное количество NаCl (соленые огурцы, рыба, копчености). Даже такое
ограничение обычно обеспечивает потребление соли не более 3 г в сутки. Если
необходимо еще больше ограничить поступление NаСl (до 1-1,5 г в сутки) при
выраженном отечном синдроме, пациентам ХСН дополнительно рекомендуют
приготовление пищи без соли.
Ограничение потребляемой жидкости должно быть достаточно разумным. При любой
стадии ХСН не следует уменьшать количество вводимой жидкости меньше 0,8 л.
Обычно оно составляет 1,2-1,5 л в сутки, включая все жидкие блюда (супы, чай,
соки). Даже на фоне отечного синдрома резкое ограничение вводимой жидкости в
ряде случаев может сопровождаться повышением осмолярности плазмы, что приводит к
избыточной продукции антидиуретического гормона (АДГ) и способствует еще большей
задержке жидкости в организме и усилению отеков. В этих случаях ограничение
приема натрия хлорида оказывается более эффективным, чем уменьшение количества
вводимой жидкости. Больным ХСН необходимо употреблять в пищу продукты,
содержащие калий (курагу, изюм, печеный картофель, орехи, брюссельскую капусту,
бананы, персики, гречневую и овсяную крупу, телятину). Калиевая диета особенно
показана при лечении мочегонными средствами и сердечными гликозидами.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИЕ
Представления о наиболее рациональных способах медикаментозной
терапии больных ХСН претерпели существенные изменения. До 50-х годов прошлого
века основным средством лечения считались сердечные гликозиды, обладающие
положительным инотропным действием на сердце. В 50-60-е годы, когда
разрабатывалась кардиоренальная модель ХСН, согласно которой ведущая роль в
прогрессировании ХСН и избыточной задержке Nа+ и воды отводилась почкам, наряду
с сердечными гликозидами стали активно внедряться разнообразные мочегонные
средства. В 70-е годы была продемонстрирована роль нарушений периферического
кровообращения в патогенезе ХСН, в клиническую практику стали широко внедряться
периферические вазодилататоры, снижающие нагрузку на сердце.
В 80-90-е годы сформировалась нейрогуморальная концепция
патогенеза ХСН, связывающая изменения, происходящие в органах с активацией не
только циркулирющих, но и тканевых нейрогормонов, в первую очередь
катехоламинов, ангиотензина II, альдостерона, эндотелиальных факторов. Это
привело к представлению о необходимости блокирования активности нейрогормонов с
помощью ингибиторов АПФ и b-адреноблокаторов, несмотря на отрицательное
инотропное действие последних на сердце. Продемонстрирована ведущая роль
гемодинамических расстройств, связанных с изменением систолической и
диастолической функции миокарда, происходящих под влиянием нейрогормонов.
В соответствии с этой концепцией все ЛС, применяемые при ХСН, можно разделить на
3 группы: 1.Основные (базисные) ЛС, эффективность и безопасность применения
которых доказана (ингибиторы АПФ; диуретики; сердечные гликозиды;
b-адреноблокаторы). 2. Дополнительные ЛС, эффективность которых достаточно
высока, но требуют уточнения некоторые вопросы показаний и противопоказаний, их
влияния на отдаленный прогноз больных ХСН (антагонисты рецепторов ангиотензина
II - лозартан; антагонисты рецепторов альдостерона - альдактон; блокаторы
медленных кальциевых каналов, амиодарон). 3. Вспомогательные ЛС, применение
которых необходимо в определенных клинических ситуациях: периферические
вазодилататоры (ИБС, АГ); антиаритмические ЛС (при наджелудочковых и
желудочковых аритмиях); ацетилсалициловая кислота (у больных, перенесших ИМ);
непрямые антикоагулянты (при выраженной дилатации сердца, внутрисердечных
тромбах, мерцательной аритмии); статины (при гиперлипидемиях, атеросклерозе).
Ингибиторы АПФ
Ингибиторы АПФ являются “золотым стандартом” терапии больных ХСН.
В последние годы доказана способность ингибиторов АПФ замедлять прогрессирование
ХСН, снижать летальность, улучшать прогноз и качество жизни больных ХСН.
Механизм действия ЛС, относящихся к классу ингибиторов АПФ, связан с их
способностью блокировать эффекты ключевого фермента РААС, запускающего каскад
изменений, которые закономерно приводят к развитию и прогрессированию СН. Речь
идет о действии ингибиторов АПФ на ренально-надпочечниковую (гуморальную) РААС,
тканевые РАС. Активация тканевых нейрогормонов лежит в основе ремоделирования
сердца, формирования систолической и диастолической дисфункции миокарда.
Повышение в миокарде тканевого АII сопровождается
вазоконстрикцией коронарных сосудов, развитием гипертрофии миокарда, быстрым
прогрессированием интерстициального фиброза, нарушением кальциевого обмена в
кардиомиоцитах. Это приводит к развитию диастолической ригидности миокарда и
повышению риска развития аритмий. Активация тканевых РАС в сосудистой стенке
различных органов ведет к пролиферации гладкомышечных клеток, гипертрофии и
утолщению стенки сосудов, а также уменьшает высвобождение эндотелиальных
факторов релаксации. Повышается также агрегация тромбоцитов и риск
тромбообразования, что еще больше усугубляет нарушения перфузии жизненно важных
органов (сердце, головной мозг, почки).
Воздействие ингибиторов АПФ на эндокринную РААС и уменьшение
образования циркулирующего АII имеют несколько важных следствий. 1. Расширение
сосудов (артериол и вен) обусловлено, прежде всего, уменьшением сосудосуживающих
влияний самого АII. АПФ не только катализирует превращение АI в АII, но
одновременно регулирует функциональное состояние калликреин-кининовой системы,
являясь ферментом (кининаза II), инактивирующим один из наиболее мощных
вазодилататоров организма - брадикинин. В результате подавления активности АПФ
лекарственными препаратами, относящимися к его ингибиторам, увеличивается
концентрация в крови брадикинина и развивается вазодилатация. Брадикинин, в свою
очередь, стимулирует секрецию эндотелиальных факторов расслабления (PGI2, NO,
ЭГПФ), также обладающих выраженным вазодилатирующим и антиагрегантным эффектами.
В результате происходит системная артериальная вазодилатация,
сопровождающаяся снижением ОПСС, системного АД и величины постнагрузки на ЛЖ.
Венозная дилатация, развивающаяся под действием ингибиторов АПФ, способствует
уменьшению притока крови к сердцу, снижению давления наполнения и величины
преднагрузки. 2. Под действием ингибиторов АПФ уменьшается синтез альдостерона в
надпочечниках, что сопровождается снижением альдостеронзависимой реабсорбции Nа+
и воды в дистальных канальцах почек. Одновременно уменьшается секреция ионов К+.
3. Снижая содержание циркулирующего АII, ингибиторы АПФ уменьшают
ангиотензинзависимую реабсорбцию Nа+ и воды в проксимальных канальцах.
Происходящее под действием ингибиторов АПФ уменьшение задержки Nа+ и воды ведет
к уменьшению ОЦК и величины преднагрузки. 4. Ингибиторы АПФ подавляют
стимулированное АII образование норадреналина и снижают активность САС.
Лечение ингибиторами АПФ показано большинству больных ХСН,
независимо от генеза, стадии сердечной недостаточности и функционального класса
ХСН. Целесообразно назначение ингибиторов АПФ (монотерапия или в комбинации с
диуретиками, сердечными гликозидами, b-адреноблокаторами): бессимптомная
систолическая дисфункция ЛЖ (ФВ менее 40%), не сопровождающаяся явными
клиническими симптомами недостаточности (больные, перенесшие ИМ); начальные
стадии ХСН (ФК I-II NYHA) с минимальными клиническими проявлениями; ХСН ФК
III-IV как на фоне синусового ритма, фибрилляции и трепетания предсердий или
желудочковых нарушений сердечного ритма; ХСН на фоне АВ-блокады или синдрома
слабости синусового узла (СССУ); ХСН на фоне артериальной гипертензии (АГ); ХСН
на фоне сахарного диабета. Доказана эффективность ингибиторов АПФ практически у
всех больных с СН, в том числе при высокоренинной и низкоренинной формах ХСН.
Ппобочные эффекты развиваются у 7-9% больных ХСН. К числу
наиболее клинически значимых относятся: артериальная гипотензия, в том числе
ортостатическая (4-5%); гиперкалиемия (1,5%); ангионевротический отек гортани
(1%); ухудшение функции почек при исходной ХПН; сухой кашель (2-6%).
Артериальная гипотензия встречается у 4-5% больных ХСН, даже при правильном
назначении ингибиторов АПФ.
Наиболее часто артериальная гипотензия развивается в первые 1-3
дня от начала лечения. Риск АГ увеличивается: при исходно низких цифрах
систолического АД (100-120 мм рт. ст.); при одновременном назначении больным ХСН
диуретиков, особенно в больших дозах, поскольку венозная дилатация и снижение
ОЦК при применении ингибиторов АПФ могут усугублять признаки гиповолемии и
снижения давления наполнения ЛЖ, свойственные мочегонным средствам; при
аортальном стенозе, митральном стенозе или обструктивном варианте ГКМП, так как
венозная и артериальная вазодилатация при фиксированном сердечном выбросе может
привести к еще большему падению СИ критическому снижению АД; при одновременном
приеме ЛС, способствующих дополнительному снижению АД (нитратов, ингибиторов
медленных кальциевых каналов, b-адреноблокаторов); при назначении сравнительно
высоких начальных доз ингибиторов АПФ; при гипонатриемии (меньше 130 ммоль/л).
Особенно тяжелая АГ наблюдается у больных с высокоренинной
формой ХСН с высоким содержанием циркулирующего ангиотензина II. Для этой формы
заболевания характерны низкое пульсовое АД (меньше 20 мм рт. ст.), высокое ЦВД
(шейные вены набухают в вертикальном положении пациента), признаки гипоперфузии
периферических органов (холодные на ощупь, бледно-цианотические конечности) и
гипонатриемия (меньше 130 ммоль/л), развивающаяся при длительном употреблении
мочегонных средств. Единственным эффективным средством лечения высокоренинной
формы ХСН являются ингибиторы АПФ. Однако быстрая гемодинамическая разгрузка
сердца, наступающая после назначения ингибиторов АПФ в первые 1-2 дня лечения,
может сопровождаться временным снижением СИ и выраженной АГ.
Особенно значительные нарушения функции почек возможны при
выраженных стенозах почечных артерий, у которых по понятным причинам уровень
исходного фильтрационного давления и скорость фильтрации очень низкие. Риск
ухудшения функции почек возрастает также у лиц старше 70 лет, у пациентов с
низкими значениями ФВ и СИ и при одновременном приеме диуретиков. Нчальные
стадии ХПН с уровнем креатинина не выше 265 мкмоль/л и систолическим давлением
больше 90 мм. рт. ст. не являются абсолютным противопоказанием для лечения
ингибиторами АПФ.
Ангионевротический отек является редким, но наиболее грозным
осложнением лечения ингибиторами АПФ. Он возникает в результате аллергической
реакции, в основе которой лежит высокая концентрация брадикинина, сопровождающая
лечение данными препаратами. При развитии отека языка, гортани, глотки следует
немедленно ввести адреналин и прекратить прием ингибиторов АПФ.
Гиперкалиемия может развиться при применении любых ингибиторов
АПФ, вызывающихзадержку ионов К+ в организме. Это следует учитывать при выборе
диуретической терапии, если она применяется в комбинации с ингибиторами АПФ.
Прием ингибиторов АПФ нельзя сочетать с применением калийсберегающих диуретиков
(триампур, верошпирон) или препаратов калия. Риск развития гиперкалиемии
возрастает у больных ХСН старческого возраста в связи со снижением у них функции
почек, а также при сахарном диабете, гиперальдостеронизме и применении НПВС.
Сухой кашель является самым частым побочным эффектом лечения ингибиторами АПФ.
Он появляется обычно через несколько недель от начала лечения. Кашель при приеме
этих препаратов обусловлен высоким уровнем брадикинина, субстанции Р и
простагландинов, которые, воздействуя на кининовые рецепторы, вызывают кашлевой
рефлекс. Нередко упорный сухой кашель является причиной отмены ингибиторов АПФ.
Следует придерживаться общих принципов, рекомендованных
Европейским ассоциацией кардиологов (2004): 1. Отменить диуретики за 24 ч до
применения ингибитора АПФ. 2. В течение 2-3-х часов после первого приема
ингибиторов АПФ необходимо врачебное наблюдение (контроль АД, риск возникновения
ангионевротического отека гортани). 3. Лечение следует начинать с минимальной
дозы препарата. 4. На начальном этапе лечения или при увеличении дозы препарата
через 3-5 дней следует контролировать функцию почек (креатинин сыворотки крови,
относительная плотность мочи, диурез) и содержание электролитов крови (К+, Nа+).
5. Прием ингибиторов АПФ нельзя сочетать с применением калийсберегающих
диуретиков, препаратов калия, НПВС. В таблице 57 представлены ориентировочные
начальные и поддерживающие дозы часто используемых ингибиторов АПФ.
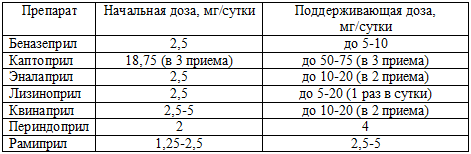
Таблица 57. Дозы ингибиторов АПФ в лечении больных ХСН
Применение ингибиторов АПФ противопоказано при следующих
состояниях: 1. Беременность. 2. Индивидуальная непереносимость препарата. 3.
Двусторонний или выраженный односторонний стеноз почечных артерий. 4. Выраженная
исходная артериальная гипотензия (СрАД ниже 85-90 мм рт. ст.). 5. Выраженное
снижение функции почек с азотемией. 6. Аортальный стеноз, митральный стеноз,
ГКМП (обструктивный вариант).
Диуретики
Диуретики - это ЛС, которые оказывают избирательное действие на
почки, вследствие чего угнетается реабсорбция Nа+ и/или воды в канальцах и
усиливается диурез. Их эффективность при сердечной декомпенсации обусловдена
уменьшением ОЦК, снижением ОПСС, притока крови к сердцу и величины пред- и
постнагрузки. Под влиянием диуретиков происходит преимущественно
гемодинамическая разгрузка сердца. Диуретики следует рассматривать как
симптоматическое средство, которое целесообразно использовать при наличии
клинических признаков избыточной задержки жидкости в организме или для
профилактики отечного синдрома после его устранения. Большинство мочегонных
препаратов у многих больных ХСН с застоем крови в легких, отечным синдромом
оказывают значительное влияние на активность нейрогуморальных систем,
ответственных за прогрессирование ХСН. Речь идет о рефлекторном увеличении под
действием диуретиков активности ренина, повышении уровня ангиотензина II,
концентрации альдостерона и катехоламинов. Такая рефлекторная реакция связана со
снижением под влиянием диуретиков ОЦК. Поэтому диуретические ЛС не следует
применять у больных ХСН в качестве монотерапии. Их целесообразно сочетать с
ингибиторами АПФ, b-адреноблокаторами или сердечными гликозидами.
В зависимости от локализации и механизма действия различают 4
группы диуретиков. 1. Диуретики, действующие на проксимальные извитые канальцы
нефрона (ингибиторы карбоангидразы и осмотические диуретики). 2. Петлевые
диуретики (фуросемид, буметанид, этакриновая кислота). 3. Диуретики, действующие
преимущественно в области дистальных извитых канальцев (тиазидные и нетиазидные
производные сульфаниламидов). 4. Диуретики, действующие в области собирательных
трубок: прямые калийсберегающие антагонисты альдостерона (спиронолактон);
непрямые калийсберегающие антагонисты альдостерона (триамтерен, амилорид).
Действие осмотических диуретиков (маннитола, мочевины, 40%
раствора глюкозы, альбумина) основано на повышении концентрации осмотически
активных веществ в плазме крови и в канальцевой жидкости. В результате снижается
интенсивность обязательной реабсорбции осмотически активных веществ в
проксимальных отделах канальцев, увеличивается количество и скорость движения
канальцевой жидкости в петле Генле, в дистальных отделах канальцев. Это, в свою
очередь, препятствует образованию осмотического градиента и ведет к снижению
факультативной реабсорбции воды в дистальных канальцах и собирательных трубках.
Такое состояние называется осмотическим диурезом. Ингибиторы карбоангидразы.
Диакарб, относящийся к этой группе диуретиков, угнетает действие фермента
карбоангидразы. Последняя обеспечивает в проксимальных извитых канальцах почек
реабсорбцию натрия бикарбоната (NаHСО3) в обмен на выделение в просвет канальца
ионов Н+.
В основе этого процесса лежит активируемая карбоангидразой
реакция: СО2 + Н2О = Н2СО3; образующаяся углекислота (Н2СО3) диссоциирует на
ионы Н+ и HСО3-. Ионы Н+ выделяются в просвет канальцев, а на их место из
канальцевой жидкости поступает эквивалентное количество ионов натрия (Nа+). В
результате организм освобождается от водородных ионов и восполняет запасы натрия
бикарбоната (NaHCO3), который реабсорбируется в интерстициальную ткань почки и
попадает в кровь. Аналогичным образом происходит обмен ионов Н+ на ионы Nа+ с
участием двухосновного фосфата и аммиака. Прием диакарба угнетает эту реакцию:
ионы Nа+ выводятся из организма, а ионы Н+ накапливаются в интерстициальной
ткани, что, кстати, может способствовать возникновению метаболического ацидоза.
Диакарб относится к слабым диуретикам. Его действие усиливается при
метаболическом алкалозе, но значительно снижается при его отсутствии. Поэтому
диакарб редко применяют при ХСН и только с целью быстрой коррекции
метаболического алкалоза, вызванного избыточным назначением петлевых или
тиазидных мочегонных.
К группе петлевых диуретиков относятся: фуросемид (лазикс); этакриновая кислота
(урегит); буметанид. Петлевые диуретики - это наиболее эффективные мочегонные
средства, которые подавляют активную реабсорбцию Сl- и Nа+ в толстом восходящем
сегменте петли Генле. Именно здесь реабсорбируется около 25-30%
профильтровавшихся ионов Nа+. Одновременно происходит значительная потеря ионов
К+ с мочой. Петлевые диуретики широко используют в лечении острой и хронической
СН. Они эффективны даже при значительном снижении скорости клубочковой
фильтрации (менее 30 мл/минуту).
При внутривенном введении оказывают отчетливый и быстрый
венодилатирующий эффект и снижают преднагрузку еще до наступления диуретического
действия. Это свойство ипользуется при лечении больных с отеком легких. В этих
случаях фуросемид вводят внутривенно медленно (со скоростью не более 4-6 мг в
минуту). Начальная доза составляет от 20 мг до 60 мг; при необходимости доза
может быть увеличена до 160-500 мг в сутки. Повторные внутривенные инъекции
возможны каждые 4-6 часов. При ХСН фуросемид, этакриновую кислоты (урегит) или
буметанид обычно применяют внутрь один раз в сутки (утром). Натрийуретическое и
диуретическое действие обычно начинается через 30-60 минут после приема
препарата и достигает максимума через 1-2 часа. Длительность действия составляет
около 6 часов. В зависимости от тяжести отечного синдрома и выраженности
диуретического эффекта суточные дозы петлевых диуретиков могут колебаться в
широких пределах. Обычно фуросемид используют в дозе 40-80 мг в сутки,
этакриновую кислоту - 50-100 мг в сутки и буметанид - 0,5-2 мг в сутки.
Тиазиды и тиазидоподобные диуретики этой группы являются
производными сульфаниламидов и воздействуют на дистальные отделы канальцев,
ингибируя фосфодиэстеразу и усиливая выделение с мочой Nа+, К+, Сl-,
гидрокарбонатов, фосфатов и магния. Наиболее распространенными представителями
этой группы мочегонных средств являются гидрохлортиазид, индапамид и клопамид.
Эффективность тиазидовых и тиазидоподобных диуретиков существенно меньше, чем
петлевых диуретиков. Эффект мочегонных препаратов этой группы значительно
уменьшается при снижении скорости клубочковой фильтрации меньше 40 мл/минуту и
прекращается при значениях меньше 30 мл/минуту.
Большинство диуретиков этой группы обладают гипотензивным
эффектом. Лечение больных с начальной и умеренной ХСН, невыраженным отечным
синдромом начинают с назначения гидрохлортиазида в дозе 25-100 мг в сутки один
раз (утром натощак). Максимальный эффект достигается через 1 ч после приема,
длительность действия - 12 часов. При необходимости суточная доза может быть
увеличена до 200 мг в сутки и распределена на 1-2 приема. Значительно возрастает
риск возникновения побочных эффектов (гипокалиемии, артериальной гипотензии).
Противопоказания: рефрактерная гипокалиемия; гипонатриемия; гиперкальциемия;
тяжелая почечная и печеночная недостаточность; подагра.
Калийсберегающие диуретики (спиронолактон, амилорид и триамтерен) угнетают
реабсорбцию Nа+ и секрецию К+ в собирательных трубках, в связи с чем на фоне
увеличения диуреза не развивается гипокалиемии. Спиронолактон (верошпирон)
обладает уникальной способностью ингибировать альдостерон. Калийсберегающие
диуретики обладают слабым мочегонным действием.
Их назначают в сочетании с петлевыми и тиазидовыми диуретиками с
целью снижения риска возникновения гипокалиемии. Спиронолактон (верошпирон)
применяют для профилактики и лечения гипокалиемии, развившейся при лечении
петлевыми и тиазидовыми диуретиками, а также в комплексной терапии
гиперальдостеронизма, в том числе у больных ХСН. Спиронолактон назначают в дозе
75-100 мг в сутки в течение 2-8 недель. Слабо выраженный мочегонный эффект
начинает проявляться только через 48-72 часов после приема препарата, хотя уже
через сутки уровень калия сыворотки начинает возрастать.
В последние годы спиронолактон используют в качестве средства,
предупреждающего развитие интерстициального фиброза миокарда и ремоделирования
сосудов, обусловленного повышенным содержанием альдостерона у больных ХСН.
Используют длительный прием сравнительно низких доз препарата (75 мг/сутки).
Триамтерен применяют в дозе 50-100 мг (в 2 приема) в качестве калийсберегающего
средства и 200-300 мг в сутки - с целью получить слабый мочегонный эффект.
При приеме триамтерена диуретический эффект начинается через 2-4
часов и продолжается 7-12 часов. В клинической практике нередко используют
комбинированный препарат - триампур композитум, в состав которого входят 25 мг
триамтерена и 12,5 мг гидрохлортиазида. Амилорид применяют в суточной дозе 5-20
мг/сутки, начало действия - через 2-3 часов после приема. Его длительность
достигает 12-24 часов. Калийсберегающие диуретики противопоказаны при: тяжелых
поражениях почек (олигурия); гиперкалиемии любого генеза; беременности и
лактации; мочекаменной болезни и других причинах затрудненного оттока мочи.
Выбор диуретиков при ХСН определяется многими факторами: стадией
ХСН и выраженностью отечного синдрома; наличием фоновых и сопутствующих
заболеваний (болезней почек, ХПН, артериальной гипертензии или гипотензии,
сахарного диабета, подагры, СКВ); наличием противопоказаний для применения тех
или иных диуретиков; состоянием электролитного обмена и кислотно-основного
состояния; особенностью гемодинамических расстройств; возникновением в процессе
лечения мочегонными средствами тех или иных побочных эффектов (таблица 58).
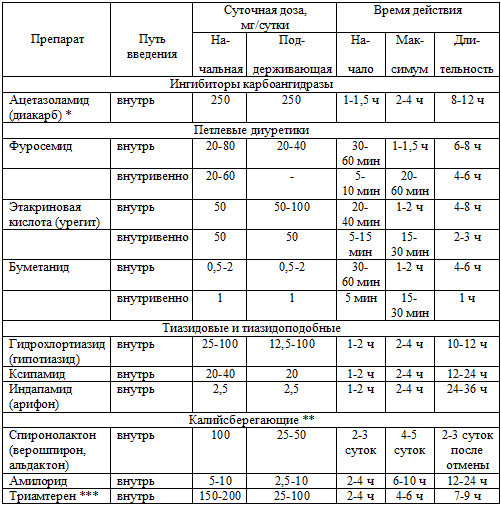
Таблица 58. Суточные дозы, время действия диуретиков при
ХСН
Примечания: * - диакарб принимают по 250 мг 1 раз в сутки в
течение 2-5 дней, затем - перерыв 2-3 дня; ** - при сочетании с другими
диуретиками дозу уменьшают в 2 раза; *** - начальную дозу триамтерена (150-200
мг/сутки) принимают за 2 приема в течение первой половины дня.
Начальные стадии ХСН (ФК I) не требуют лечения диуретиками. При
умеренной ХСН (ФК II, иногда - ФК III) и сохраненной функции почек (скорость
фильтрации более 30 мл/мин) целесообразно назначать тиазидовые или
тиазидоподобные диуретики, особенно при сочетании ХСН и АГ. Прогрессирование ХСН
(ФК III-IV) и отечного синдрома требует применения более мощных петлевых
диуретиков (фуросемида, этакриновой кислоты, буметанида). При назначении
диуретиков больным с выраженным отечным синдромом нередко вначале необходимо
создать так называемый форсированный диурез, когда количество выделяемой мочи
существенно (на 600-800 мл в сутки) превышает объем потребляемой жидкости.
Некоторые диуретики целесообразно вводить внутривенно. Лечение требует
ежедневного измерения диуреза, исследования электролитов крови, а также
определения массы тела (МТ). Последняя на фоне оптимально подобранных доз
диуретиков должна снижаться на 500-700 г в сутки. После достижения желаемого
эффекта переходят на поддерживающую терапию. В этот период следует подобрать
такую дозу диуретика, чтобы количество выделенной за сутки мочи было по крайней
мере не меньше количества выпитой жидкости, а МТ оставалась стабильной.
При лечении мочегонными средствами всегда эффективна комбинация
диуретиков с различным механизмом и локализацией действия. Это позволяет
расширить зону блокады реабсорбции Nа+ в канальцах почек и одновременно повысить
эффективность каждого из диуретиков. Назначение петлевых диуретиков, блокирующих
реабсорбцию натрия в восходящем толстом сегменте петли Генле, приводит к
увеличению концентрации ионов Nа+ в содержимом дистальных извитых канальцев.
Такая “загрузка” ионами Nа+ сопровождается повышением эффективности тиазидовых
мочегонных, блокирующих реабсорбцию на уровне дистальных извитых канальцев.
Применение петлевых и тиазидовых мочегонных сопровождается “загрузкой” ионами
Nа+ собирательных трубочек, где действуют антагонисты альдостерона. В результате
повышается эффективность и этих диуретиков.
Назначение любого мочегонного препарата, действующего на более
проксимальные участки нефрона, усиливает эффективность диуретиков, “работающих”
на более дистальных его участках. Это позволяет существенно уменьшить суточные
дозы каждого из мочегонных и снизить риск возникновения побочных эффектов. В
клинике наиболее часто используют комбинацию фуросемида с гидрохлортиазидом или
фуросемида, гидрохлортиазида и спиронолактона (верошпирона). При применении
петлевых, тиазидовых и калийсберегающих диуретиков достаточно быстро (через
1,5-2 недели лечения) развивается более или менее выраженный метаболический
алкалоз, что снижает действие тиазидовых и петлевых диуретиков.
В этих случаях целесообразно один раз в 2 недели на 3-4 дня
дополнительно назначать прием ингибитора карбоангидразы - ацетазоламида (диакарба),
который “подкисляет” мочу и восстанавливает эффективность действия петлевых и
тиазидовых диуретиков. Длительное лечение мочегонными средствами должно
сочетаться с назначением ингибиторов АПФ, которые нивелируют побочные эффекты
диуретиков, потенцируют и усиливают эффекты друг друга. Во многих случаях
назначение ингибиторов АПФ быстро приводит к уменьшению или исчезновению
клинических проявлений отечного синдрома.
Основными побочными эффектами являются: 1. Артериальная (в том
числе ортостатическая) гипотензия. 2. Электролитные нарушения: гипокалиемия;
гипонатриемия; гипомагниемия; гипокальциемия; гиперкалиемия (калийсберегающие
диуретики). 3. Нарушения кислотно-щелочного состояния (равновесия):
метаболический алкалоз; метаболический ацидоз. 4. Снижение функции почек. 5.
Метаболические нарушения: гиперурикемия; гипергликемия; гиперлипидемия .
Гипокалиемия - это снижение содержания калия в плазме крови ниже 3,4 ммоль/л.
Гипокалиемия чаще развивается при применении тиазидовых и петлевых диуретиков.
Может появляться мышечная слабость, апатия, одышка, склонность к брадикардии или
тахикардии, нарушениям сердечного ритма На ЭКГ выявляются характерные изменения
конечной части желудочкового комплекса: горизонтальное смещение сегмента RS-T
ниже изолинии, уменьшение амплитуды зубца Т или формирование двухфазного (-+)
или отрицательного зубца Т, а также удлинение электрической систолы желудочков -
интервала Q-T.
Лечение гипокалиемии: 1. Временная отмена петлевых и тиазидовых
диуретиков и препаратов, способствующих развитию гипокалиемии (сердечные
гликозиды). 2. Назначение калиевой диеты в большинстве случаев позволяет
скорректировать нарушения при концентрации К+ в 3,2-3,4 ммоль/л. 3. Назначение
препаратов калия, которые следует использовать при исходной концентрации К+ ниже
3,2 ммоль/л: внутрь - 10% раствор калия хлорида по 1 стол. ложке 5-6 раз в день;
внутривенно капельно (медленно в течение 2-3 ч) - 3 г калия хлорида в 5%
растворе глюкозы (около 1 л). 4. Дополнительное назначение калийсберегающих
диуретиков. Гипомагниемия диагностируется при снижении содержания магния в
сыворотке крови ниже 0,7 ммоль/л.
Гипомагниемия чаще развивается при лечении петлевыми и
тиазидовыми мочегонными. В клинической картине преобладают судороги отдельных
мышц, ларингоспазм, бронхоспазм, тахикардия, экстрасистолия, парестезии,
заторможенность, галлюцинации. Гипомагниемия обычно сочетается с гипокалиемией.
Лечение гипомагниемии включает следующие мероприятия: 1. Отмена (временная)
петлевых и тиазидовых диуретиков, сердечных гликозидов. 2. Назначение магниевой
диеты. 3. Назначение панангина или аспаркама 4 раза в день. 4. В тяжелых случаях
- внутривенное капельное введение (медленно в течение 3 ч) 6 г магния сульфата в
1 л 5% раствора глюкозы (контроль АД и ЧДД). 5. Внутримышечное введение 10 мл
25% раствора магния сульфата 2-4 раза в сутки (контроль уровня АД). 6.
Дополнительное назначение калийсберегающих диуретиков.
Гипокальциемия диагностируется при снижении концентрации кальция
в сыворотке крови ниже 2,1 ммоль/л. Чаще она развивается при применении петлевых
диуретиков. Ярким клиническим проявлением гипокальциемии являются спонтанные
сокращения мышц - судороги, возникающие вследствие резкого повышения
возбудимости мышечных и нервных клеток. При тяжелой гипокальциемии может
наступить смерть от остановки дыхания. На ЭКГ при гипокальциемии обнаруживают
удлинение электрической систолы желудочков (интервала Q-T), а также снижение
амплитуды зубца Т и некоторое укорочение интервала P-Q(R). Лечение: 1. Отмена
петлевых диуретиков. 2. Назначение кальциевой диеты: молочные продукты, салаты,
капуста . 3. Назначение внутрь препаратов кальция. 4. В тяжелых случаях
внутривенное введение препаратов кальция. Гиперкалиемия развивается при
применении калийсберегающих диуретиков, особенно на фоне заболеваний,
сопровождающихся склонностью к гиперкалиемии (ХПН). Гиперкалиемия
диагностируется при повышении содержания К+ в сыворотке крови выше 5,3 ммоль/л.
Повышение содержания калия в плазме крови до 6 ммоль/л обычно не
сопровождается клиническими симптомами. На ЭКГ при умеренной гиперкалиемии можно
обнаружить высокие, узкие заостренные положительные зубцы Т и укорочение
электрической систолы желудочков - интервала Q-T. Более выраженная гиперкалиемия
(6-7,3 ммоль/л) сопровождается повышением возбудимости клеток: развиваются
парестезии, парезы, мышечные параличи, нарушения сердечного ритма (брадикардия
или тахикардия), замедление атриовентрикулярной и внутрижелудочковой
проводимости. При повышении концентрации калия в плазме до 7,5 ммоль/л и выше
клеточный потенциал покоя становится равным потенциалу действия, вследствие чего
клетки полностью теряют возбудимость. В этих условиях может развиться остановка
сердца. Лечение гиперкалиемии включает следующие мероприятия. 1. Отмена
калийсберегающих диуретиков, а также ингибиторов АПФ или уменьшение их
дозировок. 2. Внутривенное введение 20 мл 10% раствора натрия хлорида или 40 мл
40% раствора глюкозы. 3. Лечение заболеваний, сопровождающихся задержкой К+ в
организме (ХПН).
Гипонатриемия - это снижение уровня Nа+ в плазме крови ниже 135
ммоль/л. Абсолютная гипонатриемия (гипонатриемия “истощения”) развивается при
применении больших доз мочегонных препаратов, особенно петлевых диуретиков. В
результате происходит уменьшение ОЦК и притока крови к сердцу. Развивающаяся
гиповолемия сопровождается чрезмерным снижением давления наполнения, сердечного
выброса (СИ) и клубочковой фильтрации. У больных с гипонатриемией появляется
выраженная общая слабость, сонливость, мышечные судороги, олигурия. При
физикальном исследовании определяется снижение тургора кожи, артериальная
гипотензия, тахикардия, артериальный пульс малого наполнения и напряжения.
Вследствие уменьшения притока крови к сердцу и величины ЦВД исчезает имевшееся
ранее набухание шейных вен. Содержание Nа+ в плазме - на уровне нижней границы
нормы или меньше 135 ммоль/л. Отмечается повышение гематокрита, азотемия, хотя
относительная плотность мочи повышена.
Лечение: 1. Временно отменить диуретики. 2. Временно увеличить
поступление соли с пищей. 3. В тяжелых случаях - внутривенные капельные инфузии
10% раствора натрия хлорида. Абсолютную гипонатриемию (“истощения”) следует
отличать от относительной гипонатриемии (гипонатриемии “разведения”). В этих
случаях избыточный диурез отсутствует, сохраняются все признаки задержки воды в
организме, что объясняется характерной для многих больных ХСН гиперсекрецией АДГ,
а также высоким содержанием ангиотензина II. Больные жалуются на общую слабость,
жажду. Сохраняются массивные отеки, набухание шейных вен, снижается содержание
Nа+ в плазме крови и уменьшается относительная плотность мочи. Лечение: 1.
Ограничение приема жидкости (750-800 мл). 2. Применение петлевых диуретиков,
желательно в сочетании с приемом ингибиторов АПФ. Клиническая картина и методы
коррекции метаболического алкалоза и ацидоза, развивающихся при длительном
приеме диуретиков или сердечных гликозидов. В таблице 59 представлены побочные
эффекты, развивающиеся при лечении диуретиками.
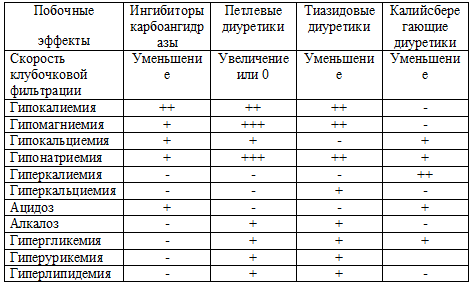
Таблица 59. Побочные эффекты диуретиков
Примечание: + наличие побочного эффекта; - его отсутствие.
Сердечные гликозиды
Сердечные гликозиды - это лекарственные средства, получаемые из
растений (наперстянка, ландыш) и обладающие сходной химической структурой, они
увеличивают сократимость миокарда. В большинстве случаев сердечные гликозиды
существенно улучшают качество жизни больных ХСН: уменьшают выраженность
клинических проявлений сердечной декомпенсации, снижают число госпитализаций в
связи с обострениями ХСН, повышают толерантность больных к физической нагрузке.
В отличие от ингибиторов АПФ и b-адреноблокаторов, они практически не влияют на
летальность и выживаемость больных. В настоящее время отношение к использованию
сердечных гликозидов при ХСН стало более дифференцированным. Основные
противопоказания к использованию диуретиков различных классов представлены в
таблице 60.
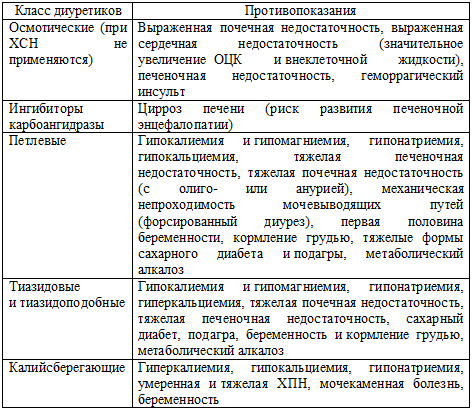
Таблица 60. Основные противопоказания к назначению
диуретиков
У больных ХСН с мерцательной аритмией сердечные гликозиды
продолжают оставаться средством первого выбора, тогда как у пациентов с ИБС,
постинфарктным кардиосклерозом и сохраненным синусовым ритмом следует особо
учитывать возможные отрицательные эффекты сердечных гликозидов: увеличение
потребности миокарда в кислороде и гипоксию сердечной мышцы, возникновение
серьезных нарушений ритма и проводимости, гликозидную интоксикацию. Существует
значительная группа больных ХСН с преимущественно диастолической дисфункцией ЛЖ,
у которых применение сердечных гликозидов противопоказано.
Эффективность сердечных гликозидов при ХСН объясняется наличием
нескольких различных механизмов действия: положительный инотропный эффект
(увеличение сократимости миокарда); отрицательный хронотропный эффект
(уменьшение ЧСС); отрицательный дромотропный эффект (замедление проведения
электрического импульса в АВ-соединении при сохранении проводимости в ножках и
ветвях пучка Гиса); нейромодуляторное действие сердечных гликозидов (снижение
повышенной активности САС и РААС).
Положительное инотропное действие сердечных гликозидов связано с
угнетением К+-Nа+-зависимой АТФ-азы кардиомиоцитов. Как известно, К+-Nа+-насос
обеспечивает высокие градиенты концентрации ионов Nа+ и К+ по обе стороны
клеточной мембраны (сарколеммы): внутри клетки создается высокая концентрация
ионов К+, а вне клетки - ионов Nа+. Низкое содержание внутриклеточного Nа+,
создаваемое К+-Nа+-насосом, приводит к перемещению в клетку по
электрохимическому градиенту ионов Nа+, обменивающихся на ионы Са2+, которые
выходят из клетки против градиента концентрации. Источником энергии для
выведения Са2+ из кардиомиоцита является электрохимический градиент Nа+,
создаваемый работой К+-Nа+-насоса.
Чем эффективнее “работает” К+-Nа+-насос, тем больше ионов Са2+
удаляется из клетки согласно Nа+-Са2+-обменному механизму. Сердечные гликозиды
угнетают деятельность К+-Nа+-насоса, в связи с чем внутри клетки возрастает
концентрация Nа+. В результате снижается интенсивность Nа+-Са2+-обменного
механизма, и часть ионов Са2+ остается в цитоплазме кардиомиоцита. Поскольку
уровень инотропизма определяется внутриклеточной концентрацией ионов Са2+,
сократимость миокарда при воздействии сердечных гликозидов возрастает.
Отрицательное хронотропное действие сердечных гликозидов
характеризуется уменьшением ЧСС за счет снижения автоматизма СА-узла. Этот
эффект связывают с прямыми нейромодуляторными свойствами сердечных гликозидов,
способных блокировать образование периферических симпатических импульсов и
усиливать вагусные влияния. Отрицательное дромотропное действие сердечных
гликозидов заключается в замедлении проведения электрических импульсов в
АВ-соединении при сохранении проводимости в ножках и ветвях пучка Гиса. Этот
эффект связывают с увеличением продолжительности эффективного рефрактерного
периода АВ-узла, возникающим в результате уменьшения активности САС и повышения
тонуса парасимпатической нервной системы.
Отрицательный дромотропный эффект лучше всего проявляется у
больных с тахисистолической формой фибрилляции предсердий, а также при
пароксизмах наджелудочковой тахикардии или тахиаритмии. В этих случаях
увеличение длительности эффективного рефрактерного периода АВ-узла способствует
тому, что далеко не все суправентрикулярные импульсы проводятся к желудочкам. В
результате уменьшается ЧСС, удлиняется диастола, снижается внутримиокардиальное
напряжение и улучшается внутрисердечная и системная гемодинамика. У больных с
исходным нарушением АВ-проводимости сердечные гликозиды могут вызывать
возникновение или усугубление АВ-блокад, вплоть до развития полной АВ-блокады.
При синдроме WPW сердечные гликозиды, замедляя АВ-проводимость, могут
способствовать проведению импульсов из предсердия в желудочки по дополнительным
аномальным проводящим путям и провоцируют возникновение пароксизмальной
тахикардии.
Применение сердечных гликозидов показано в следующих клинических
ситуациях (абсолютные показания): 1. У больных ХСН ФК II-IV (по NYHA) с
тахисистолической формой фибрилляции предсердий и признаками систолической
дисфункции ЛЖ (ФВ менее 40%). В этих случаях клинические эффекты сердечных
гликозидов обусловлены преимущественно отрицательным дромотропным и хронотропным
действием гликозидов, замедлением АВ-проводимости и уменьшением ЧСС за счет
усиления тонуса парасимпатической нервной системы, тогда как положительное
инотропное действие выражено в слабой степени. 2. У больных ХСН ФК II-IV (по
NYHA) с сохраненным синусовым ритмом, признаками систолической дисфункции ЛЖ (ФВ
менее 40%) и наличием протодиастолического ритма галопа и/или дилатации левого
желудочка.
Преобладает их положительное инотропное действие, которое
сопровождается повышением сократимости миокарда и ФВ ЛЖ, значительным
увеличением потребности миокарда в кислороде, что следует учитывать при
назначении сердечных гликозидов больным ИБС на фоне синусового ритма. 3. У
больных с пароксизмальной наджелудочковой тахиаритмией (фибрилляция и трепетание
предсердий, пароксизмальная наджелудочковая тахикардия), независимо от наличия
или отсутствия у них признаков ХСН (внутривенные инъекции или инфузии сердечных
гликозидов).
Применение сердечных гликозидов абсолютно противопоказано в нескольких
клинических ситуациях: интоксикация сердечными гликозидами; выраженная
брадикардия (ЧСС меньше 50); пароксизм желудочковой тахикардии (ЖТ) или частой
желудочковой экстрасистолии (ЖЭ); наличие аллергических реакций на сердечные
гликозиды в анамнезе. Существует ряд клинических ситуаций, при которых прием
сердечных гликозидов требует особой осторожности в связи с высоким риском
развития побочных реакций (таблица 61). У больных с сопутствующей почечной
недостаточностью применение препаратов возможно, но требует снижения дозы
препарата в связи с нарушением экскреции гликозидов и повышением риска
гликозидной интоксикации. У больных с гипотиреозом возрастает чувствительность
миокарда к действию сердечных гликозидов, быстрее происходит насыщение
препаратами и в связи с этим повышен риск возникновения гликозидной
интоксикации.
Основной принцип длительного лечения больных ХСН сердечными
гликозидами - это применение малых доз препарата (дигоксина в дозе до 0,25 мг в
сутки). Более высокие дозировки сердечных гликозидов (СГ) увеличивают риск
наджелудочковых и желудочковых аритмий, гликозидной интоксикации. То же
относится к тактике подбора доз на начальном этапе лечения.
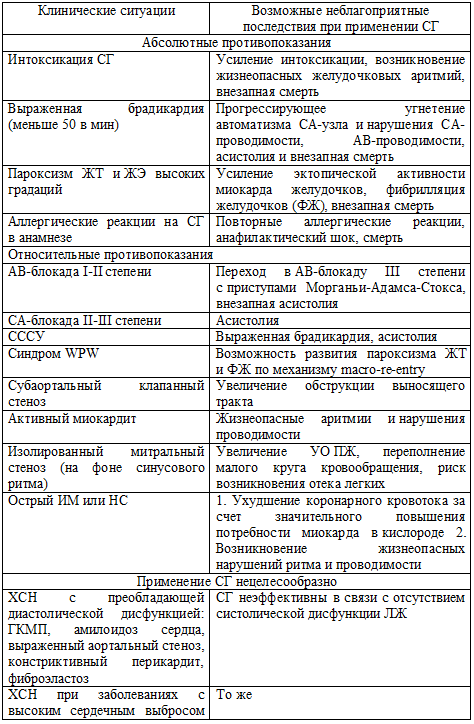
Таблица 61. Противопоказания к применению сердечных
гликозидов
В настоящее время в клинике практически не применяется методика быстрого
насыщения сердечными гликозидами, когда средняя насыщающая доза препарата (для
внутривенно вводимого дигоксина - 1,4 мг) вводится в течение первых суток
лечения. Эта методика опасна из-за частого развития гликозидной интоксикации,
нарушений ритма и проводимости. Методика умеренно быстрого насыщения также
используется при тяжелой систолической ХСН: средняя насыщающая доза дигоксина
вводится в течение 3-х суток, к концу которых обычно наступает терапевтический
эффект.
В первые сутки препарат вводят внутривенно в дозе 0,75 мг, разделенной на 2
приема (0,5 мг и 0,25 мг). Количество препарата, оставшегося в организме к концу
первых суток, составит: 0,75 мг - 0,67 = 0,5 мг. На вторые сутки внутривенно
вновь вводят 0,75 мг дигоксина. Тогда количество препарата в организме больного
достигнет: 0,5 мг + 0,75 мг = 1,25 мг. К концу 2-х суток количество дигоксина в
организме составит 1,25 ґ 0,67 = 0,84 мг. На 3-й день внутривенно вводят 0,55 мг
дигоксина, что вместе с оставшимися после 2-х суток 0,84 мг препарата составит
1,4 мг дигоксина.
Это количество соответствует средней насыщающей дозе дигоксина для внутривенного
введения. Чтобы поддерживать такое содержание гликозида в крови, требуется
ежедневное введение поддерживающей дозы не более 0,46 мг дигоксина в сутки.
При достижении оптимальной насыщающей концентрации гликозидов в крови (около
2 мг/мл) и сохранении ее в течение длительного времени с помощью приема
поддерживающих доз препарата, смертность больных ХСН возрастает примерно в 2
раза. Поэтому в настоящее время не стремятся достичь рекомендуемых в справочной
литературе средних насыщающих доз сердечных гликозидов, а с первого дня лечения
назначают поддерживающие дозы препарата, ориентируясь на минимальные их значения
по методике медленного насыщения.
Для дигоксина, назначаемого внутрь, поддерживающая доза составляет 0,25 мг (1
таблетка) или (редко) - 0,5 мг (2 таблетки). При ежедневном приеме 0,25 мг
дигоксина насыщающая доза (0,75 мг) достигается на 11-е сутки лечения. Этого
обычно бывает вполне достаточно для получения удовлетворительного
терапевтического эффекта.
При необходимости внутривенного введения сердечных гликозидов у больных с
тяжелой сердечной декомпенсацией и выраженным снижением систолической функции ЛЖ
или у пациентов с наджелудочковыми нарушениями ритма (фибрилляция предсердий,
пароксизмальная наджелудочковая тахикардия) назначают: дигоксин - не более
0,25-0,5 мг в сутки или строфантин - не более 0,25-0,5 мг (0,5-1 мл 0,05%
раствора) 2 раза в сутки или коргликон - не более 0,6 мг (1 мл 0,06% раствора) 2
раза в сутки. Внутривенно сердечные гликозиды вводят очень медленно (в течение
7-10 мин) из-за возможного внезапного спазма коронарных сосудов.
Использование минимальных доз сердечных гликозидов требует соблюдения второго
принципа лечения больных ХСН - обязательного сочетания инотропных препаратов с
лечением ингибиторами АПФ, диуретиками, b-адреноблокаторами. Комплексное лечение
позволяет снизить дозы каждого из препаратов, значительно уменьшить побочные
эффекты. Третий принцип лечения сердечными гликозидами - это тщательный анализ
клинической картины заболевания и данных лабораторно-инструментальных
исследований для определения всех показаний и противопоказаний к назначению этих
препаратов.
Токсическое действие сердечных гликозидов наблюдается у 4-23% больных ХСН и
зависит от концентрации сердечных гликозидов в крови. Токсичность препарата
резко возрастает при концентрациях дигоксина в крови выше 2 нг/мл. Оптимальной
концентрацией препарата, при которой клинический эффект достаточно выражен, а
токсическое действие почти не проявляется, следует считать 1-1,2 нг/мл, что
ориентировочно соответствует приему дигоксина в дозе 0,25 мг в сутки.
Признаки гликозидной интоксикации могут появиться при терапевтических
концентрациях препарата в крови и приеме низких суточных доз препарата. Это
связано с повышенной индивидуальной чувствительностью к сердечным гликозидам,
наиболее частой причиной является гипокалиемия.
Клинические проявления гликозидной интоксикации: 1. Диспептические
расстройства. Снижение аппетита (анорексия), тошнота, рвота, изредка диарея -
относятся к числу наиболее ранних проявлений интоксикации гликозидами. 2.
Неврологические расстройства характеризуются появлением быстрой утомляемости,
головокружений, выраженной сонливости; бессонницы, ночных кошмаров, беспокойства
и, спутанного сознания, психоза и делирия. Характерно появление вокруг предметов
ореолов желтого или желто-зеленоватого цветов (ксантоксия). 3. Кардиальные
расстройства - это наиболее тяжелые и опасные проявления гликозидной
интоксикации. Чаще встречаются желудочковая экстрасистолия (ЖЭ) по типу
бигеминии и тригеминии; желудочковая тахикардия (ЖТ) по типу “пируэт”;
фибрилляция желудочков (ФЖ); пароксизмальная наджелудочковая тахикардия в
сочетании с АВ-блокадой I и II степени; непароксизмальные наджелудочковые
тахикардии; АВ-блокада I-III степени; выраженная брадикардия, в том числе
синусовая брадикардия, СА-блокады, остановка СА-узла с замещающими ритмами из
АВ-соединения или желудочка; фибрилляция или трепетание предсердий (редко).
Чаще встречаются непароксизмальная наджелудочковая тахикардия и желудочковые
аритмии (70%). Изменения ЭКГ при лечении сердечными гликозидами достаточно
характерны. Помимо перечисленных нарушений ритма и проводимости нередко можно
обнаружить корытообразное смещение сегмента RS-Т ниже изолинии с формированием
сглаженного, двухфазного (-+) или отрицательного зубца Т, укорочение Q-Т.
Лечение гликозидной интоксикации всегда начинается с отмены сердечных
гликозидов. В легких случаях иногда этого бывает достаточно для купирования
минимальных клинических проявлений интоксикации: единичных ЖЭ, АВ-блокады I
степени, легких диспептических расстройств При наличии гипокалиемии назначаются
препараты калия: внутривенно капельно: 200 мл 2% раствора калия хлорида + 200 мл
5% раствора глюкозы + 1-4 ЕД инсулина; внутрь: 10% раствор калия хлорида по 1
столовой ложке 3-4 раза в день. При наличии АВ-блокады II степени препараты
калия не применяются.
После купирования аритмии внутрь назначают поддерживающие дозы дифенина
(400-600 мг в сутки). Лидокаин - внутривенно болюсом (100 мг) каждые 3-5 мин
вплоть до купирования аритмии с последующим внутривенным капельным введением
препарата со скоростью 1-2 мг/мин. Лидокаин эффективен при желудочковых
аритмиях. b-адреноблокаторы применяют при наджелудочковой экстрасистолии, а
также при наджелудочковой пароксизмальной тахикардии. Анаприлин (обзидан,
индерал) вводят внутривенно струйно медленно в дозе от 1,0 до 5,0 мг (1-5 мл 10%
раствора) или внутрь по 10-20 мг 4 раза в сутки.
При наличии АВ-блокады b-адреноблокаторы не применяют. Для лечения АВ-блокад
используют: атропин (1 мл 0,1% раствора внутривенно или подкожно); при
отсутствии эффекта производят временную электрокардиостимуляцию сердца. В
тяжелых случаях гликозидной интоксикации применяют специфические фрагменты
антител к дигоксину - Fab fragments. Через 20-40 мин после внутривенного
введения препарата у половины больных удается полностью купировать проявления
гликозидной интоксикации.
b-адреноблокаторы
b-адреноблокаторы - это ЛС, обладающие свойствами конкурентно связываться с
b1- и b2-адренорецепторами и блокировать их взаимодействие с норадреналином и
адреналином, а также с другими стимуляторами b-рецепторов. Блокаторы
b-адренорецепторов препятствуют взаимодействию катехоламинов с соответствующими
рецепторами клеток, устраняя активацию мембранной аденилатциклазы и
внутриклеточного цАМФ. Это сопровождается отрицательным инотропным, хронотропным,
дромотропным и батмотропным действием.
Происходит угнетение автоматизма СА-узла, уменьшение ЧСС и замедление
проведения электрического импульса по проводящей системе сердца. Одновременно
уменьшается вероятность возникновения эктопических очагов в предсердиях,
АВ-соединении и в меньшей степени в желудочках. Под действием b-адреноблокаторов
происходит снижение уровня АД у пациентов с АГ.
Все b-адреноблокаторы могут быть разделены на несколько подгрупп в
зависимости от наличия или отсутствия у них 4-х основных свойств
b-адреноблокаторов: b1-кардиоселективности; внутренней симпатомиметической
активности (ВСА); продолжительности b-адреноблокирующего действия; наличия
дополнительных вазодилатирующих свойств. b1-кардиоселективность - это
способность избирательно блокировать b1-адренорецепторы, не оказывая влияния на
функцию b2-адренорецепторов.
Неселективные b-адреноблокаторы (пропранолол, надолол) препятствуют
взаимодействию с адреналином и норадреналином как b1-, так и
b2-адренорецепторов. Нередко они обладают высокой клинической эффективностью при
лечении больных АГ или ИБС.
При лечении неселективными b-адреноблокаторами могут выявляться нежелательные
побочные эффекты: бронхоспазм (отсутствие расслабления гладкой мускулатуры
бронхов), ухудшение периферического кровообращения, в том числе синдром Рейно,
похолодание конечностей (отсутствие расширения периферических сосудов), быстрая
утомляемость и слабость в скелетных мышцах, коронароспазм, нарушения углеводного
обмена (недостаточная секреция инсулина, угнетение гликогенолиза в печени и
скелетных мышцах), спастические сокращения матки во время беременности. Эти и
некоторые другие нежелательные реакции возникают в результате блокирования
b2-адренорецепторов и преобладания эффектов a-рецепторов.
Кардиоселективные b1-адреноблокаторы лишены описанных побочных эффектов. Эти
препараты можно применять у больных с сопутствующими обструктивными
заболеваниями легких, сахарным диабетом, нарушениями периферического
кровообращения, а также во время беременности. Кардиоселективные
b1-адреноблокаторы, в отличие от неселективных, не вызывают сужения сосудов
скелетных мышц и реже вызывают мышечную слабость и повышенную утомляемость.
b1-кардиоселективность - это свойство относительное. При применении малых доз
b-адреноблокаторов относительная b1-кардиоселективность сохраняется, при
использовании высоких доз этих препаратов их селективность может уменьшаться или
исчезать совсем.
Внутренняя симпатомиметическая активность (ВСА) - это способность
b-адреноблокаторов блокировать взаимодействие b-адренорецепторов с
норадреналином и адреналином, частично стимулировать b-адренорецепторы.
b-адреноблокаторы с ВСА реже, чем препараты без ВСА, влияют на липидный и
углеводный обмен. Общее количество побочных реакций при применении
b-адреноблокаторов с ВСА меньше. В-адреноблокаторы с ВСА целесообразно
использовать в тех случаях, когда не требуется значительного снижения ЧСС, АД и
сократительной способности миокарда (таблица 62).
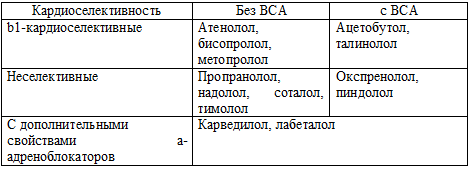
Таблица 62. Классификация b-адреноблокаторов
Современные b-адреноблокаторы обладают вазодилатирующими
свойствами. Этот эффект достигается за счет наличия внутренней
симпатомиметической активности в отношении b2-адренорецепторов (пиндолол);
дополнительной блокады a-адренорецепторов (лабеталол, карведилол ); прямого
сосудорасширяющего эффекта препаратов. В-адреноблокаторы с вазодилатирующими
свойствами целесообразно использовать у больных АГ с высоким уровнем АД и у
пациентов с исходно высоким тонусом гладкой мускулатуры.
Различают липофильные и гидрофильные b-адреноблокаторы.
Липофильные (жирорастворимые) b-адреноблокаторы (пропранолол, метопролол,
окспренолол, тимолол, карведилол) полностью всасываются в желудочно-кишечном
тракте, хорошо проникают через гематоэнцефалический барьер (развивается
слабость, сонливость, депрессия, кошмарные сновидения, галлюцинации).
Липофильные b-адреноблокаторы хорошо метаболизируются в печени и выделяются с
желчью. Имеют короткий период полувыведения (3-5 ч) и назначаются в связи с этим
не реже 2-3 раз в сутки.
Гидрофильные (водорастворимые) b-адреноблокаторы (атенолол,
надолол, соталол) хуже всасываются в желудочно-кишечном. Они экскретируются
почками и выделяются с мочой в виде метаболитов или в неизмененном виде. При
снижении функции почек нарушается экскреция b-адреноблокаторов с мочой, что
также требует снижения суточной дозы препарата. Гидрофильные b-адреноблокаторы
не проникают через гематоэнцефалический барьер и поэтому реже, чем липофильные
препараты, вызывают побочные реакции со стороны ЦНС. Период полувыведения
гидрофильных b-адреноблокаторов чаще всего достигает 6-12 ч или больше, что дает
возможность принимать препараты 1-2 раза в сутки. Гидрофильные b-адреноблокаторы
целесообразно назначать больным с поражением печени, пациентам с психическими
нарушениями.
Применение b-адреноблокаторов при ХСН
В последние годы большое значение в комплексной терапии ХСН
придают рациональному применению b-адреноблокаторов. Длительное применение
кардиоселективных b-адреноблокаторов метопролола и бисопролола снижает число
обострений ХСН, общую смертность, частоту внезапной сердечной смерти на 34-49%.
Особенно хорошо зарекомендовали себя b-адреноблокаторы при ХСН, развившейся на
фоне ИБС, АГ, ГКМП. Отрицательный инотропный эффект b-адреноблокаторов у больных
ХСН выражен в малой степени и лишь на начальном этапе лечения. Длительное
применение подобранных доз b-адреноблокаторов сопровождается возрастанием
насосной функции сердца, увеличением сердечного выброса, что является следствием
широкого спектра положительных влияний b-адреноблокаторов на сердце.
Согласно рекомендациям Американской ассоциации кардиологов
(2004), использование b-адреноблокаторов показано всем больным ХСН с
систолической дисфункцией (ФВ меньше 40%), относящимся к ФК II-III по NYHA, при
отсутствии у них противопоказаний к приему препаратов и при условии стабилизации
клинических симптомов ХСН. Особенно эффективны b-адреноблокаторы у больных ХСН,
развившейся на фоне АГ, ГКМП и ИБС, что связано с влиянием препаратов на уровень
системного АД, замедлением сердечного ритма, улучшением диастолической функции
ЛЖ, а также с антиангинальным действием b-адреноблокаторов.
Применение противопоказано при обструктивных заболеваниях легких
(бронхиальная астма, хронический обструктивный бронхит в стадии обострения); ХСН
ФК IV по NYHA; обострении ХСН и дестабилизации клинической картины СН (отек
легких, кардиогенный шок, нарастание отечного синдрома); выраженной брадикардии
(ЧСС меньше 60 в мин); артериальной гипотензии (СрАД меньше 100 мм рт. ст.);
АВ-блокаде и СА-блокаде; СССУ; беременности. Осторожно используют
b-адреноблокаторы у больных с сахарным диабетом, ХПН, при нарушении функции
печени и портальной гипертензии, у пациентов с перемежающейся хромотой,
синдромом Рейно.
Рекомендован длительный прием одного из трех блокаторов
b-адренорецепторов (метопролол, бисопролол и карведилол), для которых на большом
клиническом материале доказан отчетливый положительный эффект терапии.
Метопролол и бисопролол являются кардиоселективными b1-блокаторами без
внутренней симпатомиметической активности, а карведилол - неселективным
b1,2-адреноблокатором, обладающим к тому же свойствами вазодилататоров. Выбор
одного из этих b-адреноблокаторов определяется в основном конкретной клинической
ситуацией. Могут быть использованы и другие препараты данного класса,
преимущественно не обладающие внутренней симпатомиметической активностью:
соталол, пропранолол.
Лечение больных ХСН b-адреноблокаторами представляет достаточно
сложную проблему из-за риска возникновения различных побочных эффектов. К числу
наиболее значимых из них относятся: артериальная гипотензия; синусовая
брадикардия; АВ-блокады; ухудшение периферического кровообращения на фоне
облитерирующего атеросклероза артерий нижних конечностей или васкулита,
протекающего с синдромом Рейно; усугубление бронхиальной обструкции (у больных с
заболеваниями легких); снижение толерантности к глюкозе (особенно неселективные
b-адреноблокаторы); повышение уровня триглицеридов и ЛОНП.
Избежать этих побочных эффектов позволяет строгое соблюдение
следующих принципов: 1. В-адреноблокаторы назначаются в соответствии с
показаниями и противопоказаниями, описанными выше. 2. У больных ХСН
b-адреноблокаторы назначаются только дополнительно к ингибиторам АПФ и
диуретикам, больные должны находиться на подобранной дозе этих препаратов при
уровне АД не ниже 100 мм рт. ст. 3. Стартовая доза не выше 20% от средней
терапевтической: карведилол - 3,125 мг/сутки; бисопролол - 1,25 мг/сутки;
метопролол - 12,5 мг/сутки. 4. Увеличение дозы b-адреноблокаторов в 2 раза
осуществляется 1 раз в 2 недели доза. 5. Период “титрования” дозы
b-адреноблокаторов в течение 6-8 недель для карведилола - 50 мг/сутки; для
бисопролола - 10 мг/сутки; для метопролола - до 150 мг/сутки. 6. В первые 2-3
недели лечения возможно ухудшение самочувствия, даже прогрессирование симптомов
ХСН, небольшая задержка жидкости.
Другие лекарственные средства
При необходимости ипользуют периферические вазодилататоры,
антиагреганты и антикоагулянты, антиаритмические препараты, препараты,
оказывающие влияние на метаболизм миокарда. Оптимальный выбор ЛС и их комбинаций
для лечения систолической ХСН определяется тяжестью СН, наличием или отсутствием
синусового ритма или мерцательной аритмии; тахикардии; отечного синдрома и
признаков застоя крови в легких; артериальной гипотензии. Большое значение имеет
характер и тяжесть основного заболевания, а также осложнений основного
заболевания и ХСН (аритмий, склонности к гиперкоагуляции, внутрисердечных
тромбов, электролитных нарушений).
У больных I-II ФК (по NYHA) и сохраненным синусовым ритмом на
первом этапе назначается один из ингибиторов АПФ. На втором этапе к ингибитору
АПФ может добавляться диуретик (при наличии отечного синдрома) или
b-адреноблокатор (при синусовой тахикардии). Если у больного ФВ менее 30% или
выявляется артериальная гипотензия, на третьем этапе лечения назначают сердечные
гликозиды. По показаниям могут добавляться альдактон (верошпирон),
антиаритмические препараты и антикоагулянты, нитраты, аспирин. Сходные подходы к
лечению существует для больных с начальными стадиями ХСН (ФК I-II по NYHA), но
наличием постоянной мерцательной аритмии. На первом этапе целесообразно
назначить ингибиторв АПФ и дигоксин. На втором и третьем этапах лечения могут
добавляться диуретики, b-адреноблокаторы, антиаритмические препараты, альдактон,
нитраты. Особое значение у больных ХСН с мерцательной аритмией приобретает
применение антикоагулянтов в связи с повышенным риском тромбоэмболических
осложнений.
У больных с III-IV ФК ХСН, сохраненным синусовым ритмом на
первом этапе назначают ингибитор АПФ и диуретик. На втором обычно добавляется
альдактон, b-адреноблокатор или сердечный гликозид. У пациентов с выраженной ХСН
и постоянной мерцательной аритмией на первом этапе целесообразно назначать три
базисных препарата: ингибитор АПФ, диуретик, сердечный гликозид, а в дальнейшем
- b-адреноблокаторы, антикоагулянты, антиаритмические.
|