
13.3. ХИРУРГИЧЕСКАЯ РЕВАСКУЛЯРИЗАЦИЯ МИОКАРДА
Благодаря усилиям многих исследователей, в хирургической реваскуляризации
миокарда к настоящему времени получили распространение и продолжают развиваться
следующие методики:
1. Коронарное шунтирование в условиях искусственного кровообращения (coronary
artery bypass grafting – CABG). Суть заключается в шунтировании венечных
артерий, выполняемом в условиях ИК и кардиоплегической остановки сердца.
Вмешательство выполняется через срединную стернотомию (являющуюся универсальным
доступом к сердцу). Одним из преимуществ операции является возможность
обеспечения сухого неподвижного поля при формировании анастомозов, недостатком –
неблагоприятное воздействие аппарата ИК и посткардиоплегическая депрессия
миокарда.
Операцию осуществляют в несколько этапов:
- доступ к сердцу путем срединной стернотомии, выделение (по показаниям)
внутренней грудной артерии «на ножке» (рисунок );
Рисунок 38. Этап коронарного шунтирования: левая внутренняя грудная артерия
выделена «на ножке» с сопровождающими венами и внутригрудной фасцией (Хубулава
Г.Г., Пайвин А.А., Юрченко Д.Л.)
- подготовка аутотрансплантантов (аутовены, аутоартерии), выполняемая другой
бригадой хирургов одновременно с производством доступа к сердцу (рисунок );
- наложение проксимальных анастомозов между аутотрансплантатами и восходящей
аортой (рисунок );
- канюляция восходящей аорты и полых вен, подключение АИК;
- пережатие аорты с кардиоплегической остановкой сердца;
- наложение дистальных анастомозов с коронарными артериями (рисунок);
- снятие зажима с восходящей части аорты;
- профилактика воздушной эмболии;
- восстановление сердечной деятельности;
- отключение АИК;
- деканюляция;
- ушивание стернотомического разреза с дренированием полости перикарда, при
необходимости – плевральных полостей.
Рисунок 39. Этап коронарного шунтирования: выделена и подготовлена к
аутотрансплантации левая лучевая артерия (Хубулава Г.Г., Пайвин А.А., Юрченко
Д.Л.)
Рисунок 40. Этап коронарного шунтирования: формирование проксимального
анастомоза с аутовенозным шунтом в условиях бокового отжатия аорты (Хубулава
Г.Г., Пайвин А.А., Юрченко Д.Л.)
Рисунок 41. Этап коронарного шунтирования: формирование дистального анастомоза с
аутовенозным трансплантатом на остановленном сердце (Хубулава Г.Г., Пайвин А.А.,
Юрченко Д.Л.)
Рисунок 42. Вид сердца после выполненного шунтирования ПМЖВ (маммарнокоронарный
анастомоз), ОВ и ПКА (аутовенозными трансплантатами) (Хубулава Г.Г., Пайвин
А.А., Юрченко Д.Л.)
Представленная методика не является общепринятой, поскольку, в зависимости от
хирургической школы, последовательность отдельных этапов может меняться. К
примеру, наиболее часто (примерно в 90% случаев) кардиохирургами проксимальные
анастомозы шунтов с аортой формируются после дистальных.
2. Коронарное шунтирование на работающем сердце (off-pump coronary artery
bypass – OPCAB). Характеризующими чертами методики является отказ от проведения
кардиоплегии и применения ИК, при этом задача обездвиживания операционного поля
ложится на специально разработанные устройства – стабилизаторы миокарда (рисунок
-).
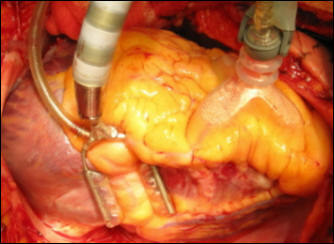
Рисунок 43. Этап коронарного шунтирования на работающем
сердце: экспозиция правой коронарной артерии при помощи вакуумных стабилизаторов
миокарда (Хубулава Г.Г., Пайвин А.А., Юрченко Д.Л.)
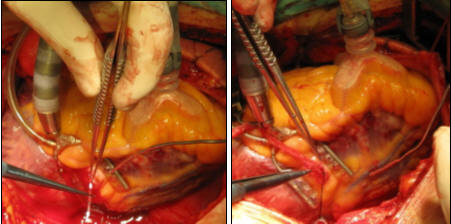
Рисунок 44. Этапы коронарного шунтирования на работающем
сердце: введение временного интракоронарного шунта (слева) и формирование
дистального анастомоза аутовены с ПКА (справа) (Хубулава Г.Г., Пайвин А.А.,
Юрченко Д.Л.)
Рисунок 45. Результат аутовенозного аортокоронарного шунтирования ПКА на
работающем сердце (Хубулава Г.Г., Пайвин А.А., Юрченко Д.Л.)
Несомненными преимуществами метода являются исключение отрицательного системного
воздействия ИК и посткардиоплегической депрессии миокарда. Необходимыми
условиями применения данной технологии являются: - отсутствие показаний к
реконструктивным вмешательствам на клапанах сердца, - отсутствие эмболоопасных
тромботических масс в камерах сердца,- отсутствие показаний к устранению
постинфарктной аневризмы левого желудочка, - диаметр коронарных артерий 1,5 мм и
более в отсутствие выраженного кальциноза, - обеспечение стабильной системной
гемодинамики, - субъективный фактор – уверенность хирурга в возможности
адекватной реваскуляризации при использовании методики у конкретного пациента.
3. Минимально инвазивная реваскуляризация миокарда (МИРМ, англ. MIDCAB – «minimally
invasive direct coronary artery bypass»). В эту группу операций входит группа
ряд вмешательств, не использующих для доступа к сердцу срединную стернотомию,
вне зависимости от использования ИК. Могут применяться следующие доступы: право-
и левосторонняя миниторакотомия, субксифоидальный доступ, парастернальная
миниторакотомия, министернотомические доступы. К этой группе относятся и
операции с видеоэндоскопической поддержкой на различных этапах. Данная методика
пока имеет ограниченное распространение.
4. Трансмиокардиальная лазерная реваскуляризация (ТМЛР) подразумевает
создание многочисленных искусственных трансмиокардиальных каналов от эпикарда до
эндокарда левого желудочка с помощью высокомощного СО2 лазера. Данный метод
предложен M. Mirhoseini и соавторами в 1982 году. В связи с созданием
высокомощного СО2 лазера, который позволяет пробить всю толщу миокарда в течение
одного сокращения сердца, не нарушая его электрической активности, стало
возможным проведение ТМЛР на «работающем» сердце.
Рисунок 46. Пример использования технологии MIDCAB при повторной операции:
шунтирование правой коронарной артерии на работающем сердце из правосторонней
переднебоковой миниторакотомии (Хубулава Г.Г., Пайвин А.А., Юрченко Д.Л.)
В настоящее время метод используется преимущественно у больных с
терминальными проявлениями ИБС, когда лекарственная терапия неэффективна и
отсутствует возможность прямой реваскуляризации миокарда. Другими словами, ТМЛР
используется как «шаг отчаяния» при неудовлетворительном прогнозе заболевания и
неэффективности других методов лечения ИБС
В качестве аутотрансплантатов для осуществления операций прямой
реваскуляризации миокарда (пп. 1-3) могут быть использованы:
1. Аутовенозные шунты: - ствол большой подкожной вены (значительно реже –
малой подкожной вены) нижней конечности в реверсированной позиции; - головная
вена верхней конечности
2. Аутоартериальные кондуиты: - внутренняя грудная артерия на «ножке» – как
«золотой стандарт», применяется для реваскуляризации ПМЖВ. Возможно ее
использование с обеих сторон, либо свободным трансплантатом; - лучевая
(локтевая) артерия в виде свободного трансплантата; - желудочно-сальниковая
артерия; - верхняя надчревная артерия.
Попытки применения искусственных эксплантатов (дакроновых,
политетрафторэтиленовых, гомо- и ксенографтов), способных выполнять функцию
венечной артерии, к настоящему времени не увенчались успехом (их проходимость в
течение 1 года не превышает 50%).
Предложенные операции имеют свои особенности, которые необходимо учитывать
при выборе вида хирургического лечения. Накопленный опыт выполнения операций
реваскуляризации миокарда, отработанная десятилетиями хирургическая техника
вмешательства, создали все необходимые предпосылки для появления новых
технологий и методик в хирургическом лечении ИБС. Стало возможным выполнение
вмешательств у пациентов пожилого и старческого возраста, с исходно сниженными
ресурсами сердечно-сосудистой системы и тяжелой сопутствующей патологией
(почечная и печеночная недостаточность, хронические неспецифические заболевания
легких, диабет, выраженный атеросклероз брахиоцефальных и периферических
артерий, злокачественные новообразования и т.д.). Улучшились результаты
повторных операций хирургической реваскуляризации миокарда. Следует отметить,
что потребность в коронарном шунтировании в популяции, по оценкам экспертов,
может достигать 1000 вмешательств на 1 млн. населения в год.
Послеоперационная летальность при коронарном шунтировании в большинстве
специализированных клиник варьирует от 0,7 до 4% и ее увеличение зависит от
контингента больных и тяжести проявлений ИБС (аневризма сердца, митральная
недостаточность, снижение сократительной способности левого желудочка, острые
нарушения коронарного кровотока, повторные вмешательства) и сопутстсвующей
патологии (сахарный диабет, почечная недостаточность и др.).
Благодаря хирургическому лечению, удается достичь улучшения прогноза и
качества жизни больных ИБС. Необходимо отметить, что при своевременном
выполнении оперативного вмешательства, у 70-80% больных отмечается значительное
урежение или полное прекращение приступов стенокардии в условиях обычной
активности в среднем на 3-5 лет. Вероятность рецидива стенокардии через 5 лет
после операции, по разным данным, составляет около 30-35%.
Необходимо отметить, что оперативное лечение ИБС не является в полном смысле
радикальным, поскольку атеросклероз коронарных артерий, лежащий в основе
патологического процесса, продолжает прогрессировать, вовлекая новые участки
сосудистого русла и увеличивая стенозирование ранее пораженных сосудов и
сформированных шунтов. В связи с этим, вопрос – увеличивает ли операция
коронарного шунтирования продолжительность жизни больного – остается
дискутабельным. Однако среди оперированных больных намного больше лиц, полностью
избавившихся от ангинального синдрома, что существенно увеличивает качество
жизни.
|