
4.2. Механизмы развития резистентности к АМП у
микроорганизмов
Несмотря на значительные успехи клинической микробиологии, этиотропная
терапия, по крайней мере, на начальном этапе остается эмпирической и, вероятно,
будет таковой в обозримом будущем. Основой режимов эмпирической терапии являются
данные о природной чувствительности к АМП наиболее вероятных возбудителей.
Однако проблема значительно осложняется распространением, как во внебольничных,
так и особенно в госпитальных условиях приобретенной резистентности.
Под резистентностью (устойчивостью) понимают способность микроорганизма
переносить значительно большие концентрации препарата, чем остальные
микроорганизмы данного штамма (вида), или развиваться при таких концентрациях,
которые превышают достигаемые в макроорганизме при введении антибиотиков,
сульфаниламидов и нитрофуранов в терапевтических дозах.
Резистентность это естественный процесс селекции под воздействием АМП среди
микроорганизмов, циркулирующих в человеческой популяции. Последующее широкое
распространения резистентных штаммов проходит ряд хорошо известных этапов.
Все начинается с выделения отдельными группами микробиологов единичных
устойчивых к какому-либо АМП микроорганизмов. Такие сообщения привлекают на
первом этапе внимание только специалистов узкого профиля, которые начинают
целенаправленно искать подобные штаммы и изучать биохимические, а также
генетические механизмы их устойчивости. Как правило, в это же время к процессу
подключается фармацевтическая индустрия, которая начинает поиск соединений,
способных преодолевать устойчивость.
Следующий этап условно можно назвать инкубационным периодом. В это время
выделение устойчивых микроорганизмов перестает быть редкостью, появляются
публикации о частоте распространения резистентности. Однако широкую аудиторию
практических врачей это, как правило, не интересует, поскольку общее впечатление
о высокой эффективности АМП сохраняется.
На неудачи лечения внимание обращают в тех случаях, когда они связаны с
летальными исходами или тяжелыми осложнениями. Если же АМП применяют при легких
и среднетяжелых инфекциях, когда выздоровление без лечения является скорее
правилом, чем исключением, то зафиксировать снижение эффективности гораздо
сложнее, даже при проведении специальных исследований. Длительность этого
периода зависит от многих факторов и, в общем, мало предсказуема. Лишь тогда,
когда частота распространения резистентности превосходит некий критический
уровень, вдруг становится очевидным, что АМП неэффективен, и возникает
необходимость в пересмотре устоявшихся схем лечения. Общей закономерностью
является также тот факт, что вначале антибиотикорезистентность появляется в
госпитальных условиях, а затем распространяется на микроорганизмы, циркулирующие
вне стен стационаров.
Мировое научное сообщество осознало бесперспективность пассивного отношения к
процессам возникновения и распространения резистентности, поскольку оно
неизбежно приводит к проигрышу человека в борьбе с микроорганизмами на
популяционном уровне. Подобно тому, как в подавляющем большинстве областей
внутренней медицины приоритет отдается выявлению и коррекции ранних стадий
патологических процессов у отдельных пациентов, так и в отношении всей популяции
человека необходимо выявлять ранние стадии распространения резистентных
микроорганизмов и предпринимать адекватные меры. При этом речь идет не столько о
пропаганде и быстрейшем внедрении в практику новых АМП, к чему непроизвольно
подталкивает фармацевтическая индустрия, сколько о раннем выявлении
неблагоприятных тенденций и разработке мер, направленных на "продление жизни"
известных препаратов. Работы в этом направлении находятся в центре внимания ряда
международных и национальных организаций (Всемирной Организации Здравоохранения,
Международного и Европейского обществ химиотерапии, Альянса за разумное
использование антибиотиков и др.), однако в Российской Федерации уровень
осознания проблем антибиотикорезистентности все еще можно относить к
рудиментарному.
Вполне естественно, что для профессионалов в большинстве областей медицины
сегодня уже недостаточно банального общего представления о возможности
формирования у микроорганизмов устойчивости к АМП. Необходимо владение
информацией о тех микроорганизмах и АМП, для которых наиболее характерно
формирование устойчивости, а также об основных закономерностях и механизмах
этого процесса, что в дальнейшем при интерпретации бактериологических анализов
позволит выявить ошибки в полученных результатах, а также повысить качество
проводимой антибактериальной терапии.
Резистентность микроорганизмов к АБП может быть природной и приобретенной.
Природная, или собственная, резистентность является характеристикой
данного вида бактерий (т. е. служит видовым признаком) и связана с генетическими
особенностями вида (например, устойчивость вирусов к антибиотикам, анаэробных
бактерий к цефалоспоринам I поколения). Такое нормальное поведение бактерий в
присутствии антибиотиков называется «диким фенотипом». Природная устойчивость
генетически поддерживается бактериальной хромосомой. Истинная природная
устойчивость характеризуется отсутствием у микроорганизмов мишени действия
антибиотика или недоступности мишени вследствие первично низкой проницаемости
или ферментативной инактивации.
Природная резистентность является постоянным видовым признаком
микроорганизмов и легко прогнозируется.
Под приобретенной устойчивостью понимают свойство отдельных штаммов
бактерий сохранять жизнеспособность при тех концентрациях антибиотиков, которые
подавляют основную часть микробной популяции.
Выделяют два типа приобретенной резистентности бактерий: первичная и
вторичная. Оба типа резистентности основаны на изменении генома
бактериальной клетки в результате мутации, при этом не существует строгих
различий между первичной и вторичной резистентностью.
Первичная резистентность бактерий имеет место до начала лечения
антибактериальными средствами (например, устойчивость некоторых штаммов
пневмококка или золотистого стафилококка к бензилпенициллину).
Вторичная резистентность бактерий возникает или возрастает в процессе лечения
антибактериальными препаратами.
Приобретенная устойчивость возникает в результате мутации отдельных
штаммов бактерий и селекции устойчивых клонов микроорганизмов или в результате
внехромосомного (плазмидного) обмена генетической информацией между отдельными
бактериальными клетками.
Знание варианта формирования приобретенной резистентности является очень
важным в прогнозировании сроков возникновения резистентности к АМП.
В настоящее время выделяют два варианта по скорости формирования
приобретенной резистентности: хромосомной (медленный тип) и плазмидный или
транспозонный (быстрый тип).
Плазмидный или транспозонный вариант передачи резистентности (быстрый тип).
Наиболее частой генетической основой резистентности служит наличие в
бактериях внехромосомных факторов устойчивости к лекарственным веществам -
плазмид и транспозонов.
Плазмиды - это стабильно существующие внехромосомные элементы, представляющие
собой ковалентнозамкнутые кольца ДНК, способные автономно реплицироваться в
бактериальной клетке. В одной клетке может одновременно находиться несколько
плазмид, отвечающих за различные свойства микроорганизма, например
резистентность, колициногенность, токсичность.
Бактериальные плазмиды, связанные с переносом маркеров лекарственной
устойчивости в процессе конъюгации клеток, получили название R-факторов.
Плазмиды резистентности R (конъюгирующие) состоят из двух компонентов — фактора
переноса устойчивости RTF, обеспечивающего передачу генетической информации, и
r-фактора, отвечающего за резистентность к антибиотикам. В отдельных случаях
r-факторы (неконъюгирующие плазмиды) существуют в бактериальных клетках
самостоятельно. Межбактериальный перенос таких r-факторов может осуществляться
посредством их мобилизации и коинтеграции с конъюгирующими плазмидами. R-фактор
одновременно может содержать 1—10 и более детерминант устойчивости к различным
антибактериальным соединениям.
Транспозонные элементы — это фрагменты ДНК, которые свободно перемещаются от
одного репликона к другому. Транспозоны определяют различные фенотипические
признаки бактериальной клетки, в частности антибиотикорезистентность, и
способствуют переносу детерминант устойчивости к антибиотикам между хромосомой,
плазмидами и фагами. Они не подчиняются rec-системам клетки, которые
ограничивают передачу хромосомных маркеров между неродственными видами. Гены,
входящие в состав транспозонов, окружены особыми нуклеотидными
последовательностями (IS-элементами), которые и обеспечивают их включение в
негомологичный геном. Вхождение детерминант устойчивости в состав транспозонов
при постоянно действующем в условиях производства селективном давлении
антимикробных препаратов на бактериальные популяции может привести к образованию
гибридных плазмид, обусловливающих новые комбинации устойчивости к
химиотерапевтическим веществам.
Транспозоны могут перемещаться в пределах одного вида, а также попадать в
новые виды и роды микроорганизмов. Установлено, что транспозоны Т1699 и Т1700,
присутствующие в неконъюгативных плазмидах S. marcescens, первоначально
проникают в конъюгативную плазмиду этого вида, вместе с которой перемещаются в
другие роды семейства Enterobacteriaceae (рис. 4.8).
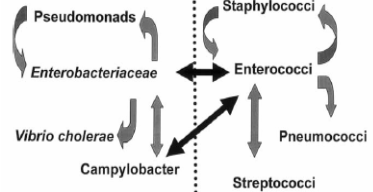
Рис. 4.8 Структура передачи плазмид и транспозонов среди
различных видов микроорганизмов (Страчунский Л.С. 2003)
В пищеварительном тракте в огромных количествах содержатся энтеробактерий,
что создает условия для трансмиссивной передачи плазмид резистентности. С
эпидемической точки зрения наиболее опасна передача детерминант устойчивости от
одного вида микроорганизмов к другому.
Циркуляция плазмид от животных к животным, от животных к человеку и от
человека к животным способствует быстрому распространению лекарственной
резистентности во всем мире.
Применение антибиотиков, предназначенных для этиотропной терапии, с целью
повышения продуктивности животных привело к селекции микрофлоры, резистентной к
лечебным препаратам. В результате широкого употребления в животноводстве
тетрациклиновых антибиотиков в качестве кормовой добавки большинство штаммов
сальмонелл и эшерихии приобрело резистентность к препаратам этой группы. В
странах, где в последние годы было запрещено использование лечебных антибиотиков
для стимуляции роста животных, наблюдается снижение частоты выделения
резистентных штаммов энтеробактерий как у животных, так и у людей. В Голландии
после запрещения применения тетрациклина в качестве кормовой добавки частота
выделения от свиней резистентных штаммов сальмонелл снизилась с 90% в 1974 г. до
34% в 1980 г.
Таким образом, плазмидный или транспозонный вариант передачи резистентности
(передачи наследственной информации окружающим клеткам), характеризуется быстрым
типом и в проблемных отделениях (ОРИТ, ожоговых и акушерских отделениях)
осуществляется в течении 1-2 лет.
Хромосомный тип передачи резистентности (медленный тип).
Спонтанные мутации происходят с низкой частотой, примерно одна мутация на 108
- 109 микробных клеток в течение одной клеточной генерации. Однако
при огромном числе клеток в бактериальной популяции вероятность возникновения в
каком-либо гене мутации, приводящей к превращению чувствительных к данному
лекарственному препарату клеток в резистентные, достаточно велика. Однако для
закрепления данной мутации в популяции микроорганизмов необходимо чтобы
произошла передача дочерним клеткам данной мутации в хромосоме. В этой связи
формирование хромосомного типа передачи резистентности у микроорганизмов
осуществляется в ЛПУ в течении 5-10 лет.
Устойчивость микроорганизмов к антимикробным препаратам в случае как
плазмидной, так и хромосомной локализации детерминант резистентности может быть
обусловлена несколькими основными механизмами.
- Инактивация антибиотика.
- Модификация мишени действия.
- Активное выведение антибиотика из микробной клетки (эффлюкс).
- Нарушение проницаемости внешних структур микробной клетки.
- Формирование метаболического "шунта".
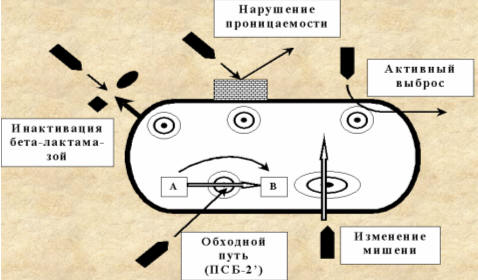
Рис. 4.9 Основные механизмы резистентности микроорганизмов
к АМП (Козлов Р.С., 2007)
1. Инактивация АМП.
Существуют две основные теории происхождения антибиотиков как биологически
активных веществ. Согласно одной из них АМП изначально выполняли функцию
эффекторных молекул в конкурентной борьбе микроорганизмов за питательный
субстрат. По другой – на ранних этапах эволюции антибиотики выполняли
регуляторные функции, которые затем были полностью или частично утрачены. Однако
обе теории предполагают, что одновременно с появлением антибиотиков должны были
появиться и механизмы их инактивации. Если микроорганизм продуцирует антибиотик
для конкурентной борьбы, то должен быть механизм защиты продуцента от действия
собственного антибиотика, после выполнения своей функции инактивироваться должна
и каждая регуляторная молекула. С практической точки зрения важно то, что
механизмы инактивации антибиотиков существовали задолго до начала их
использования человеком в сугубо утилитарных целях. В отличие от антибиотиков
(веществ природного происхождения) химиотерапевтические препараты микробной
клеткой, как правило, не инактивируются.
Данный тип резистентности наиболее часто встречается на антимикробные
препараты группы β-лактамных АМП, которые разрушают β-лактамное кольцо
антибиотиков (рис. 4.10).
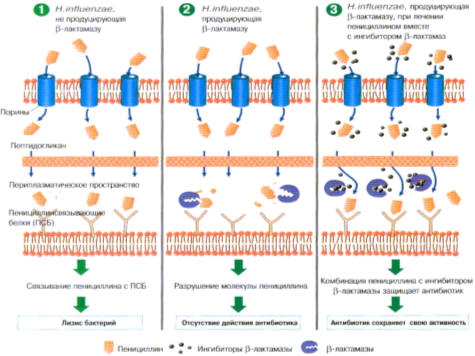
Рис. 4.10 Ферментная инактивация антимикробных препаратов.
β-лактамазы, продуцируемые грам «положительными» микробами выделяются из
клетки в межклеточное пространство, а продуцируемые грам «отрицательными»
бактериями не покидают клетку и циркулируют между наружной и внутренней
мембранами.
Все известные в настоящее время β-лактамазы делят на 4 молекулярных класса, в
пределах которых ферменты характеризуются общностью свойств и выраженной
гомологией. Предполагается, что β-лактамазы классов А, С и D эволюционировали из
бактериальных пенициллиносвязывающих белков в почвенных экосистемах в результате
селективного прессинга β - лактамных антибиотиков, продуцируемых некоторыми
микроорганизмами. β - лактамазы перечисленных классов относятся к ферментам "серинового"
типа (по аминокислоте, находящейся в активном центре фермента). Ферменты класса
В относятся к металлоэнзимам, поскольку в качестве кофермента в них присутствует
атом цинка, их происхождение менее ясно (рис. 4.11).
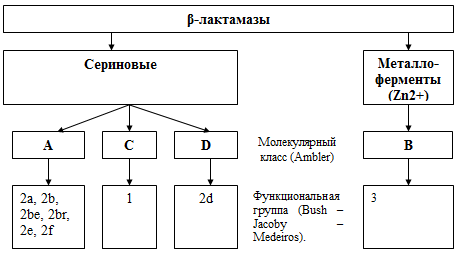
Рис. 4.11 Структура и функциональная классификация
β-лактамаз (Яковлев С.В., 2008).
К наиболее распространенным ферментам относятся стафилококковые
β-лактамазы (встречаются у 60-80% штаммов) и
β- лактамазы широкого спектра грамотрицательных бактерий
(среди штаммов E.coli встречаются в 30-40% случаев). Несмотря на широкое
распространение перечисленных ферментов, они не представляют серьезной проблемы
для терапии, поскольку многие современные β- лактамы (цефалоспорины
II-IV поколений, ингибиторозащищенные пенициллины, карбапенемы) не чувствительны
к гидролизу.
В настоящее время наибольшее значение для клинической практики имеют
плазмидные β - лактамазы расширенного спектра
грамотрицательных бактерий (БЛРС), поскольку они способны разрушать
цефалоспорины III и, в меньшей степени, IV поколения. Рутинные методы оценки
антибиотикочувствительности очень часто не выявляют этот механизм устойчивости.
Чаще всего БЛРС встречаются у микроорганизмов рода Klebsiella, достаточно часто
у E.coli и Proteus spp., реже у других грамотрицательных бактерий. В России в
отдельных учреждениях частота распространенности этих ферментов среди клебсиелл
достигает 90%.
При тяжелых нозокомиальных инфекциях, вызванных Enterobacter spp.,
Citrobacter spp. и некоторыми другими микроорганизмами, в процессе лечения
цефалоспоринами III поколения примерно в 20% случаев формируется резистентность
к этим антибиотикам, обусловленная гиперпродукцией хромосомных β
- лактамаз класса С. В таких ситуациях эффективность сохраняют цефалоспорины IV
поколения и карбапенемы. К неблагоприятным тенденциям, наблюдаемым в последнее
время, следует отнести мобилизацию ферментов класса С на плазмиды, что создает
реальные предпосылки для их широкого распространения.
Хромосомные β - лактамазы класса В, разрушающие
карбапенемы, распространены среди редких видов микроорганизмов, например,
S.maltophilia (таб. 4.3).
Таблица 4.3. Наиболее распространенные β-лактамазы
и их свойства.
| Ферменты |
Характеристика |
|
Плазмидные β - лактамазы класса А стафилококков
|
Гидролизуют природные и полусинтетические пенициллины кроме
метициллина и оксациллина. Чувствительны к ингибиторам.
|
|
Плазмидные β - лактамазы широкого спектра
класса А грамотрицательных бактерий
|
Гидролизуют природные и полусинтетические пенициллины, цефалоспорины
I поколения. Чувствительны к ингибиторам.
|
|
Хромосомные β - лактамазы класса А
грамотрицательных бактерий
|
Гидролизуют природные и полусинтетические пенициллины цефалоспорины
I-II поколения.
Чувствительны к ингибиторам.
|
|
Плазмидные β - лактамазы расширенного спектра
класса А грамотрицательных бактерий
|
Гидролизуют природные и полусинтетические пенициллины цефалоспорины
I-IV поколения.
Чувствительны к ингибиторам.
|
|
Хромосомные β - лактамазы класса С
грамотрицательных бактерий
|
Гидролизуют природные и полусинтетические пенициллины цефалоспорины
I-III поколения. Не
чувствительны к ингибиторам.
|
|
Хромосомные β - лактамазы класса В
грамотрицательных бактерий
|
Эффективно гидролизуют практически все b-лактамы, включая карбапенемы.
Не чувствительны к ингибиторам.
|
Для практической деятельности врача, крайне важно ориентироваться в
выявленных β - лактамазах, так как бактериологическая
лаборатория не всегда производит определение резистентности ко всем
рекомендованным для данного
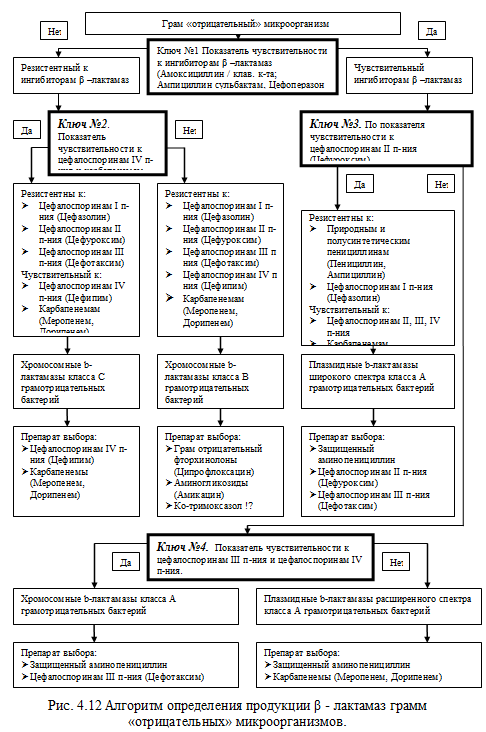
Рис. 4.12 Алгоритм определения продукции β - лактамаз грамм
«отрицательных» микроорганизмов.
микроорганизма АМП. В этой связи, предлагается алгоритм позволяющий проводить
дифференциальную диагностику между различными видами β-лактамаз,
соответственно осуществлять выбор АМП для терапии (рис.4.12).
2. Нарушение проницаемости внешних структур микробной клетки.
Практически все мишени действия антибиотиков локализованы либо в
цитоплазматической мембране микробной клетки, либо в более глубоких
цитоплазматических структурах. Для того, чтобы достичь чувствительной мишени,
АМП должен преодолеть внешние структуры микробной клетки. Основным препятствием
для АМП является липополисахаридный слой грамотрицательных микроорганизмов,
пассивно диффундировать через который, в силу своей гидрофильности молекулы,
большинства АМП не способны. Транспорт АМП внутрь микробной клетки
осуществляется через пориновые каналы белковой природы, которые являются
естественным путем для поступления питательных веществ внутрь микроорганизма и
выведения продуктов метаболизма. Структура пориновых каналов подвержена
естественной изменчивости, и в некоторых ситуациях они становятся менее
проницаемыми для крупных молекул. Описанный механизм резистентности не
специфичен и, как правило, затрагивает АМП различных классов. Указанный механизм
устойчивости встречается практически среди всех грамотрицательных бактерий,
обычно в сочетании с другими механизмами.
3. Активное выведение АМП из микробной клетки (эффлюкс).
Этот механизм в отношении тетрациклиновых антибиотиков был известен
достаточно давно, однако в последнее время интенсивно накапливаются данные о
роли этого механизма в устойчивости микроорганизмов к АМП других групп.
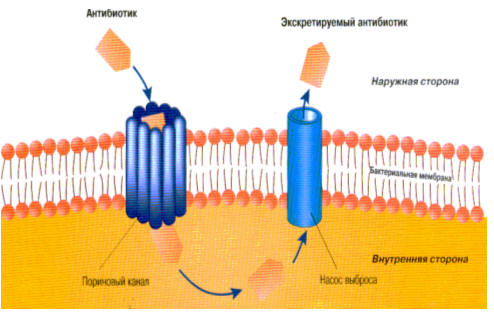
Рис. 4.13 Феномен эффлюкса.
У микроорганизмов обнаружены сложные транспортные системы белковой природы,
осуществляющие выведение из внутренней среды микробной клетки целых классов
химических веществ, первичная функция этих транспортных систем (как и их
специфичность) полностью не ясна (рис. 4.13).
4. Модификация чувствительной мишени..
Структура любого компонента живой клетки подвержена изменчивости в результате
естественных мутаций в кодирующих его генах, что является фундаментальной
основой эволюционного процесса. Часть таких мутаций не оказывает влияния на
функции (немые), другие приводят к утрате функциональной активности (летальные),
но некоторые проявляются в снижении (или утрате) способности к связыванию с АМП
при сохранении функциональной активности.
Поскольку каждому из известных механизмов резистентности соответствует один
или несколько генов, то для практики крайне важно знать их локализацию (на
бактериальной хромосоме или на подвижных генетических элементах – плазмидах).
В том случае, когда генетические детерминанты резистентности локализованы на
плазмидах, возможно их быстрое внутривидовое и межвидовое распространение.
Поскольку во многих случаях обмен генетической информацией между
микроорганизмами происходит весьма интенсивно, бороться с таким распространением
устойчивости крайне трудно, если вообще возможно. Для широкого распространения
устойчивости достаточно даже незначительного селективного прессинга АМП. Если же
детерминанты резистентности локализованы на хромосоме, то распространение
резистентности происходит преимущественно по клональному типу, на фоне мощного
селективного прессинга АМП. В отсутствие селективного прессинга резистентные
клоны, как правило, бывают вытеснены чувствительными. При клональном типе
распространения устойчивости значительно легче выявить источник резистентных
штаммов, конкретные механизмы их передачи и, соответственно, спланировать и
осуществить противоэпидемические мероприятия.
|