
8.3. Судебно-медицинская экспертиза случаев ятрогений, связанных с
фармакотерапией
Увеличение объема профессиональных знаний и совершенствование
медицинских технологий позволяет предпринимать такие медицинские вмешательства,
какие были невозможны в прошлом, что привело к повышению степени риска
неблагоприятных исходов и развитию ятрогений в виде синдрома диссеминированного
внутрисосудистого свертывания, полиорганной недостаточности и др. Эта группа
пациентов госпитализируется в отделения или палаты интенсивной терапии. Рост
лекарственных ятрогений и неблагоприятные исходы заболеваний связанных с ними
стимулируют судебные иски к производителям медицинских услуг и поиск технологий
для объективной оценки деятельности медицинских работников с помощью
судебно-медицинской экспертизы.
К особенностям таких экспертиз относится установление дефектов
применения лекарственных средств и установление причинно-следственных связей
ятрогений с наступлением неблагоприятных исходов. В случаях смерти больных в
медицинских учреждениях судебно-медицинские эксперты устанавливают причины
смерти, оценивают признаки действия повреждающего фактора лекарств на организм
пациента, признаки прижизненности этого действия, устанавливают танатогенез и
исключают другие повреждающие факторы, тяжесть вреда причиненному здоровью,
алкогольное, наркотическое опьянение и оценивает качество медицинской
деятельности. В настоящее время продолжается дискуссия об обязательном участии
судебно-медицинской службы в контроле качества фармакотерапии.
Всемирная организация здравоохранения в течение многих лет собирает
и анализирует информацию по уровню расходов на приобретение ЛС. Одним из
результатов этой работы была первая публикация книги «Лекарства и деньги» в 1983
г. В настоящее время до массового её читателя доступно её седьмое издание, в
котором отражена текущая ситуация с ценами и стоимостью лекарственных препаратов
в мире. Параллельно разрабатываются пути сбора информации о реальных ценах в
разных странах и проведение международного сравнительного анализа. Процесс
контроля над ценами на лекарства и проведение международного сравнительного
мониторинга необходимы для обеспечения доступности основных лекарственных
препаратов для всех слоев населения, особенно в бедных странах. Кроме того,
разработана и предложена к реализации программа по предотвращению и пресечению
экспорта, импорта и контрабанды поддельных фармацевтических средств, а так же
пути развития национальных стратегий и специальные меры для предотвращения
поступления в продажу поддельных лекарств. К сожалению, до сих пор отсутствует
анализ расходов систем здравоохранения различных стран, связанных с ятрогенными
осложнениями фармакотерапии.
В реальной ситуации, при недостаточной жесткости механизмов
контроля и надзора отечественный фармацевтический рынок продолжает пополняться
фальсификатами, что увеличивает риск развития лекарственных ятрогений.
Сохраняется тенденция закупки медицинских препаратов россиянами при заграничных
поездках. При появлении минимальной материальной возможности потенциальные
пациенты отечественных медицинских учреждений стремятся лечиться за рубежом.
Значительный отток финансов дополнительно усугубляет проблемы капиталоемкой
сферы медицинских услуг. Больницы становятся «центрами оценки жизнеспособности»
завуалировано предлагая лекарственную помощь дженериками или неэффективными ЛС
малообеспеченным слоям населения. Печальные последствия комплекса нарушений
принципов лекарственной безопасности дополняются врачебными ошибками,
проявлениями халатности, безграмотности и преступными преднамеренными действиями
медицинского персонала.
Заслон нарушению принципов лекарственной безопасности могла бы дать
действенная система клинических исследований в этом направлении и разработка и
внедрение лекарственного страхования. Однако реалии сегодняшнего дня таковы, что
от 30% до 80% ЛС, потребляемых пациентами в России, не обладают приемлемым
уровнем эффективности и безопасности. Следует отметить, что это не только
российская проблема, проблема безопасности ЛС существует во всем мире многие
годы. В силу биологических особенностей организма действие лекарств отнюдь не
обязательно будет одинаковым во всей популяции. Даже у однояйцевых близнецов,
живущих в разных социальных и географических условиях, реакция на одни и те же
лекарственные препараты бывает разной. Поэтому и развивается персонифицированная
фармакотерапия, цель которой сформировать близкий к реальности прогноз
эффективного и безопасного применения лекарственного препарата в условиях
конкретного организма пациента. Именно в этих условиях очень важно участие
государственных структур в солидарных расходах на приобретение эффективных и
безопасных лекарственных средств. В современной России уровень расходов на
приобретение ЛС относительно уровня ВВП неоправданно низок (рис. 8.1), что
стимулирует потребление населением дженериков и неэффективных препаратов.
Например, препарат «арбидол», клиническое действие которого
сомнительно, но серьезная маркетинговая политика привела к росту его продаж. В
то же время число клинических эффектов его применения сравнимо с применением
плацебо. По данным «Кохрановского сотрудничества» (Cochrane Collaboration),
около 30-40% популярных у населения медикаментов имеют аналогично низкий уровень
клинических эффектов. Однако низкий уровень клинической эффективности совсем не
препятствует развитию ятрогенных осложнений от применения этих «безобидных» ЛС
типа валокордина, валидола и др. Однако по многолетним статистическим данным,
чаще всего в клинической практике приходится встречаться с осложнениями,
вызванными противомикробными и противопаразитарными препаратами. Треть
осложнений данной группы вызвана антибиотиками, поскольку они наиболее часто
применяются в фармакотерапии воспалительных заболеваний, как в амбулаторной, так
и в стационарной практике. Все виды ятрогенных осложнений фармакотерапии
встречаются в среднем у 2 человек на 1000 населения.
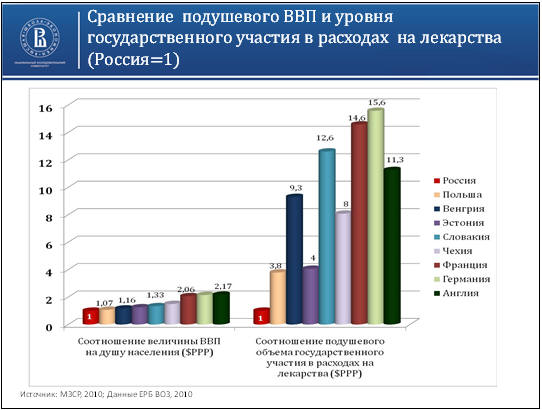
Рис. 8.1. Сравнение подушевого внутреннего валового продукта и
уровня государственных расходов на лекарственные средства (Попович Л.Д. К
вопросу о Национальной лекарственной политике в России. Институт экономики
здравоохранения. Национальный исследовательский Университет Высшая Школа
экономики. Москва, 2012).
В последние годы наблюдается рост числа лекарственных ятрогений в
динамике. Основные причины роста: недооценка аллергологического анамнеза,
необоснованное назначение большого количества препаратов – полипрагмазия,
назначение родственных препаратов, недооценка врачами нарушений функций печени и
почек, неправильное проведение диагностических кожных проб с ЛС. Попытка
подвергнуть анализу распространение полипрагмазии в различных стационарах ДФО
показала, что только 1/4 больных назначается менее пяти лекарственных
препаратов, а более 12% пациентов получали во время лечения более 15-19
препаратов различных наименований.
При ятрогениях медикаментозного генеза различные органы и системы
поражаются не с одинаковой частотой. Хотя у каждого ЛС имеется определенная
органотропность. По различным данным, из числа нежелательных лекарственных
реакций среди ятрогений чаще регистрируются поражения кожи, печени,
тромбоэмболические и гематологические побочные эффекты. В 3,2 % случаев
медикаментозные ятрогении заканчивались летальным исходом. Причем почти в
половине случаев причиной летального исхода является тромбоэмболии, около 10% -
анафилактический шок и около 7% - смерть наступает от печеночных осложнений
(Астахова А.В., Лепахин В.К., 2008; de Vries, T.P.G.M. et al., 1995).
«Фармацевтический бум» последних десятилетий определил не только синтез новых,
существенно влияющих на функцию важнейших органов и систем лекарственных
средств, но и чрезмерное злоупотребление ими. Вместе с тем лекарственный
прессинг на организм пациента далеко не всегда достигает нужного эффекта,
подчас, наоборот, усугубляет течение болезни, удлиняет сроки лечения ( Fletcher
A.P.,
1991; Meyboom
R.,
Lindquist M.,
Egberts
A., 2001).
Большинство данных о нежелательных событиях и исходах в настоящее
время поступает из круглосуточных стационаров, поскольку стационарное лечение
сопряжено с большим риском, стратегии повышения качества стационарной помощи
лучше документируются, а доверие пациентов в условиях стационара играет ключевую
роль. Однако, по мнению экспертов, на уровне первичной медико-санитарной помощи
так же следует уделять внимание обеспечению безопасности пациентов, особенно при
использовании лекарственных препаратов.
В этой связи следует отметить, что правосудие в последние годы
подходит к привлечению врачей к уголовной ответственности не предвзято,
осторожно и с достаточным вниманием. Об этом свидетельствует значительное число
прекращённых «врачебных дел», где имеются претензии к медицинскому персоналу по
поводу правильности применения лекарственных средств. Судебно-медицинские
экспертные комиссии, накапливая материалы по анализу «врачебных дел», к
сожалению, неохотно расстаются с аналитическими данными выявленных отклонений от
стандартных технологий фармакотерапии по каждому конкретному разделу медицины.
Такой подход стимулирует число повторяющихся ошибок, что неминуемо влечёт за
собой увеличение объема судебных исков по случаям ненадлежащей фармакотерапии.
Судебно-медицинская экспертиза лекарственных ятрогений. В
рамках правового регулирования производства медицинских услуг врачи
судебно-медицинские эксперты проводят оценку дефектов лечебной помощи у больных
умерших в лечебных учреждениях от насильственной причины и при неблагоприятных
исходах медицинской деятельности (Сергеев Ю.Д., Ерофеев С.В., 2001; Ураков А.Л.
с соавт., 2004; Ромодановский П.О. с соавт., 2007). Известно, что наиболее
качественное изучение госпитальной смерти осуществляется судебно-медицинскими
экспертами, которые выявляют больше дефектов лечебной помощи, чем
патологоанатомы, соответственно, 86,8 % и 18 % (Акопов В.И., 2001)..
Неблагоприятные исходы медицинской помощи, обусловленные дефектами
применения лекарственных средств, в судебно-медицинской практике чаще возникают
в премортальном периоде у пациентов в отделениях реанимации и интенсивной
терапии. Это обусловлено развитием критических состояний, основным методом
лечения которых является «бескровная хирургия» или проведение
инфузионно-трансфузионной терапии. Именно интенсивная инфузионно-трансфузионная
терапия сопряжена с высокой степенью опасности возникновения дефектов
производства медицинских услуг и развития ятрогений.
В таких случаях перед экспертом стоит непростая задача, поскольку
как лечащий врач, так и пациент нерационально относятся к риску. Так,
врач-терапевт настороженно относится к оперативным методам лечения, а пациент,
ознакомленный с даже минимальной вероятностью смерти на операционном столе,
выберет консервативные методы лечения. Подход, основанный на том, что
хирургические методы лечения «опаснее» терапевтических может стать источником
тактических ошибок применения значительного числа лекарственных препаратов в
виде полипрагмазии и инициировать нежелательный исход. Приводим пример СМЭ по
случаю смерти ребенка 4-х лет в детском хирургическом отделении больницы г.
Комсомольска-на-Амуре связанного с тактическими ошибками выбора и реализации
лечебных мероприятий.
Комиссии специалистов поставлены следующие подлинные медицинские
документы:
- Медицинская карта №Б ребенка 22.11.02 г.р.
- Медицинская карта «Д»- спецгруппы (патология зрения).
- История развития ребенка
- Медицинская карта №А стационарного больного.
- Протокол патологоанатомического исследования №А от 23 октября 2007 г.
Ребенок Д. 4 лет поступил в детское хирургическое отделение МУЗ
«Городская больница №А» г. К. 15.10.07. в 13час. 45 мин. с жалобами на боли в
животе возникшие в детском саду. После осмотра врача СМП был доставлен в
приёмное отделение больницы в состоянии средней тяжести с диагнозом: «Кишечная
колика. Подозрение на кишечную непроходимость».
Из анамнеза: ребёнок от первых срочных нормальных родов с весом
3050 г. Находился на диспансерном учёте в поликлинике у педиатра и кардиолога
(Врождённый порок сердца. Стеноз легочной артерии.), невропатолога (Резидуальная
энцефалопатия. Задержка психомоторного и речевого развития) и окулиста
(Гиперметропия средней степени, содружественное сходящееся косоглазие).
При поступлении в хирургическое отделение проводилось лечение:
декомпрессия желудка назогастральным зондом, инфузионная терапия через венозный
катетер: глюкозо-солевые растворы, анальгетики и спазмолитики. По желудочному
зонду через 2 часа появился сброс содержимого окрашенного желчью. В 19 часов
была выполнена повторная рентгенограмма органов брюшной полости, на которой
выявлены явления кишечной непроходимости - неравномерное скопления газа в
кишечнике и уровни жидкости. В этот же день была выполнена операция лапаротомия,
ревизия органов брюшной полости.
Установлена причина непроходимости - ущемление петли подвздошной
кишки в пространстве образованном брыжейкой дивертикула Меккеля и брыжейкой
тонкой кишки. Проведено устранение кишечной непроходимости путём пересечением
брыжейки дивертикула. Затем выполнена дивертикулэктомия, блокада корня брыжейки
тонкого кишечника, программная лапаростома с целью контроля состояния кишечника
через 12-14 часов. После операции ребёнок переведен в отделение реанимации, где
проводилась продлённая ИВЛ.
В раннем послеоперационном периоде у ребенка Д. отмечался
гипокоагуляционный синдром. 16.10.07 в 14 час. выполнена операция: ревизия
программной лапаростомы брюшной полости - кишечник жизнеспособен. Произведено
дренирование брюшной полости, лапаростома устранена, на послеоперационную рану
наложен глухой шов. 16.10.07.
Послеоперационный период протекал тяжело. Проводилась инфузионная
терапия (плазма А2 Rh положит
№9, гемотрансфузия №10, реополиглюкин), коррекция водно - электролитных
нарушений, парэнтеральное питание с пятых суток после операции (инфезол,
липофундин). Антибактериальная терапия (цефобид, метронидазол) и
симптоматическая терапия. Дренаж из брюшной полости удален на 4 сутки после
операции. Перистальтика кишечника восстановилась на 2-3 сутки - стул
самостоятельный и после клизмы.
На фоне стабильно-тяжелого состояния 22.10.07 в 5 часов 20мин.
развилась клиника острой сердечно-сосудистой недостаточности и отёка легких.
Проводимые реанимационные мероприятии оказались неэффективными. 22.10.07 в 6
часов 15 мин. констатирована смерть.
Клинический диагноз: Странгуляционная непроходимость тонкого
кишечника. Ущемлением петли подвздошной кишки брыжейкой дивертикула Меккеля.
Вторичный дивертикулит. Вялотекущий перитонит. Фоновое: Врождённый порок сердца
Стеноз легочной артерии. Осложнение: гипокоагуляционный синдром .Перикардит.?
Острая сердечная левожелудочковая недостаточность. Отёк легких. Сопутствующее:
Резидуальная энцефалопатия атонический- астатический синдром. Задержка
психомоторного и речевого развития.
Из Протокол патологоанатомического исследования № 66 от 23 октября
2007 г. ребенка Д. 4 лет. Патологоанатомический диагноз:
Основное заболевание: ( Q43.0)
Порок развития кишечника - дивертикул Меккеля.
Осложнения: Странгуляционная кишечная непроходимость. Ущемление
петли подвздошной кишки брыжейкой дивертикула Меккеля. Вторичный дивертикулит
(Гистологическое исследование №А). Серозно-фибринозный перитонит.
ДВС-синдром: гипокоагуляционный синдром; множественные
субплевральные и единичные субэпикардиальные кровоизлияния; фибриновые тромбы в
просвете мелких сосудов головного мозга, легких, сердца, поджелудочной железы,
печени. Легочно-сердечная недостаточность: альвеолярный и интерстициальный отек
легких; двусторонний гидроторакс (по 50мл); гидроперикард (30мл); отек и
разволокнение миокарда; гипертрофия миокарда правого желудочка до 0,4см;
дилятация левых отделов сердца; острое общее венозное полнокровие. Отек
головного мозга.
Сопутствующая патология: Иммунодефицитное состояние неуточненное:
преждевременный жировой метаморфоз тимуса; гипоплазия долек; отсутствие
дифференцировки слоев; множественные кистозно измененные т. Гассаля с
кальцинатами; гиперплазия селезенки и брыжеечных лимфоузлов. Множественные
аденомы надпочечников. Резидуальная энцефалопатия; задержка речевого и
психомоторного развития. Гиперметропия. Содружественное сходящееся косоглазие
(по клиническим данным).
Операции: 15.10.07 лапаротомия, дивертикулэктомия, устранение
непроходимости ущемления петли тонкого кишечника, лапаростомия. 16.10.07 ревизия
тонкого кишечника, закрытие лапаростомы. 16.10.07 катетеризация подключичной
вены справа и слева.
Заключение комиссионной СМЭ по факту смерти ребенка Д. 4 лет в
детском хирургическом отделении МУЗ «городская больница №А». Изучив
представленные на комиссии специалистов документы комиссия пришла к
следующим выводам:
1. Хирургическое оперативное лечение (лапаротомия с устранением
непроходимости ущемления петли тонкого кишечники), оказанное ребенку Д.,
22.11.02 г.р., было выполнено правильно. По дневниковым записям во время
пребывания в стационаре после операции у ребенка были стабильные показания АД,
пульса, дыхания. Позднее в послеоперационном периоде назначенное лечение
ухудшило состояние ребенка из-за развития перикардита (диагностирован
рентгенологически в последние сутки до смерти). Неправильно без учета состояния
ребенка были назначены:
- завышенный на 20% объем вводимых жидкостей при наличии тахикардии и
тахипноэ;
- соотношение вводимых лекарственных средств в 4 раза больше, чем положено
(соотношение натрий содержащих препаратов и глюкозы, кристаллоидов и
коллоидов);
- противопоказано назначение реополиглюкина;
- запоздалое (на 5 суток) назначение парантерального питания;
- при диагностике перикардита следовало резко на 50-70% снизить объем
инфузионной терапии;
- при наличии перикардита и недостаточности кровообращения 2А степени
отсутствовали в назначении стандартная патогенетическая терапия: не назначены
сердечные гликозиды, кардиотопная, кардиотрофная терапия;
- отсутствуют показания для назначения эуфиллина;
- при наличии показаний не были назначены консультации кардиолога,
невропатолога.
Выбранная тактика ведения больного ребенка Д. привела к ускоренному
отеку головного мозга, легких и развитию острой сердечно-сосудистой
недостаточности на фоне выявленного перикардита и косвенно состоит в причинной
связи со смертью.
2. Причиной смерти явилась остро развившаяся тотальная
сердечно-легочная недостаточность на фоне перикардита, диагностированного
предсмертно, подтвержденного рентгенологическими данными в представленной
Медицинской карте №А стационарного больного, в исследовательской части
патологоанатомического исследования .
Сложность проведения СМЭ случаев гибели пациентов в
послеоперационном периоде заключается в том, что экспертам и консультантам
приходится подвергать анализу не только патологические синдромы, связанные с
основным заболеванием и проведенным оперативным пособием, но и сопровождающую
медикаментозную терапию. Кроме того приходится учитывать уровень мониторинга
реакции организма больного на скорость введения жидкостей для регулирования ОЦК,
уровень оптимальности сочетания лекарственных средств и многое другое. Ранние
стадии развития ятрогенного синдрома, который зачастую приводит к смерти, как
правило, лечащим врачом устанавливаются с определенной временной задержкой.
Изучение причинно-следственных связей гибели пациентов во время операции или в
послеоперационном периоде, проведение «разбора полётов» на конкретных примерах
позволяют избежать подобных инциндентов в будущем.
В 1990-х годах получила распространение практика назначения СМЭ в
рамках доследственных (прокурорских) проверок, проводящихся «в форме
судебно-медицинского исследования по медицинским документам» для выявления того
«какие недостатки и упущения были допущены в лечебно-диагностическом процессе».
Хотелось бы отметить, что хотя качеству судебно-медицинских и медицинских
документов уделяется пристальное внимание со стороны исследователей, однако
ощущается недостаток изученности дефектов фармакотерапии, характеризующих
премортальный период (Пашинян Г.А. с соавт., 2005). Это указывает на то, что при
производстве СМЭ пока ещё не сформировано должного комплексного подхода к оценке
дефектов интенсивной помощи в критических ситуациях.
В случаях, когда имеется подозрение на наличие дефектов
фармакотерапии, необходимо привлечение консультантов-специалистов. Нужно только
иметь в виду, что участие консультантов должно быть оформлено постановлением
следователя или определением суда о назначении СМЭ. Их участие в проведении
экспертизы может быть непосредственным, т.е. эксперт производит исследование
совместно с консультантом. В этом случае заключение эксперта составляется и
подписывается судебно-медицинским экспертом и консультантом-специалистом. В
других случаях судебно-медицинский эксперт, направляя субъекта к
консультанту-специалисту, получает от него письменное заключение.
В целом, на пути формирования СМЭ алгоритма взвешенного участия в
«медицинских» делах в судебном процессе немало сложностей. Эти сложности
преодолимы, если СМЭ будет следовать потребностям правовой процедуры с
дифференциацией подходов в зависимости от различий правонарушений, в связи с
совершением которых она и проводится (Пашинян Г.А., Родин О.В., Тихомиров А.В.,
2009).
Структура лекарственных поражений органов и систем. При
проведении СМЭ при подозрении на тактические ошибки применения лекарственных
препаратов в виде полипрагмазии, отклонения от принятых стандартов лечения,
сопровождающимися нежелательными реакциями, необходимо разрешить вопросы,
требующие знаний по клинической фармакологии, терапии, неврологии, педиатрии и
т.п. При проведении СМЭ, судмедэксперту важно учитывать особенности
лекарственных поражений органов и систем организма пациента. К ним следует
отнести поражения печени, почек, легких, сердца и сосудов, кожи, костей,
соединительной ткани, мышц, системы кроветворения и др.
- Лекарственные поражения печени. Среди побочных
эффектов фармакотерапии лекарственные поражения печени составляют небольшую
долю, но отличаются большой вероятностью неблагоприятных исходов. Механизмы
лекарственного повреждения гепатоцитов различны, однако в большинстве случаев
это острые поражения с цитолизом и (или) холестазом. В то же время существует
большая группа хронических форм поражения печени лекарственного происхождения. В
таких случаях патологический синдром (цирроз печени) является результатом
жировой дистрофии и хронического гепатита, который могут вызвать метилдопа,
нитрофураны, тетрациклины, амиодарон, вальпроат и многие другие лекарства.
Количество препаратов, вызывающих поражение печени, насчитывает почти тысячу
наименований.
- Лекарственные поражения почек. Почки, являясь системой
связанной с выведением лекарственных средств из организма также подвержены их
побочным воздействиям. Интенсивное кровообращение и участие почек в
биотрансформации ЛС создают условия для их продолжительного контакта с тканями
почек. Нередко причиной поражения почек может быть иммунная реакция, приводящая
к денатурации белковых структур базальной мембраны. Некоторые лекарства (аминогликозиды,
цефалоспорины, цитостатики) являются активными ингибиторами сложных ферментных
систем в почках, способные вызвать тяжелые расстройства их функций. В ряде
случаев имеет место отложение лекарственных веществ и их метаболитов в
структурах нефрона — базальной мембране, мезангии, интерстиции, вокруг сосудов.
Отложения лекарств в лоханках могут привести к лекарственной нефропатии, что
наиболее часто бывает на фоне лечения сульфаниламидами, препаратами золота,
нестероидными противовоспалительными препаратами.
- Лекарственные поражения легких. Как правило,
дыхательная система устойчива к неблагоприятным действиям ЛС, однако поражения
легких встречаются не так редко, как принято считать. Варианты лекарственных
поражений легких многообразны: бронхиальная астма, альвеолит, легочная
эозинофилия, респираторный дистресс-синдром и др.
Бронхоспазм — одна из наиболее распространенных аллергических
реакций на лекарства. Бронхоспастическое действие оказывают
бета-адрено-блокаторы, холиномиметики, симпатолитики.
Причиной альвеолита могут быть как повышенная чувствительность к
лекарственным веществам, так и их токсическое действие на легочную ткань.
Препараты, оказывающие цитотоксическое действие (метотрексат, азатиоприн,
блеомицин), чаще вызывают фиброзирующий альвеолит. Патогенетически он не
отличается от идиопатического фиброзирующего альвеолита.
В основе патогенеза фосфолипидоза легких, вызываемого амиодароном,
лежит способность амиодарона связывать липиды лизосом альвеолярных макрофагов,
что нарушает катаболизм их фосфолипидов, которые затем откладываются в
альвеолах. На этом фоне может развиться фиброз легких. Эозинофильные инфильтраты
в легких могут образоваться при приеме антибиотиков, сульфаниламидов и др.
Крайне редким поражением легких является респираторный
дистресс-синдром, который могут вызвать ацетилсалициловая кислота, нитрофураны.
- Лекарственные поражения сердечно-сосудистой системы.
Многие лекарства взаимодействуя с сердечно-сосудистой системой, вызывают
нарушения ритма или (и) проводимости, нарушение сократимости миокарда, повышение
или снижение артериального давления и др. Неблагоприятные побочные реакции на ЛС
при наличии сердечно-сосудистых заболеваний и комбинации лекарств встречают
довольно часто. Некоторые лекарства (как, например, алкалоид спорыньи эрготамин)
могут вызывать фиброзное утолщение створок клапанов сердца. Лекарственные
поражения сосудов часто проявляются флебитами, васкулитами, флебосклерозом как
следствие гиперреактивности соединительной ткани на вводимый препарат.
- Лекарственные поражения кожи. Поражения кожи могут
развиться как при прямом контакте с лекарственным веществом, так и при системном
применении ЛС. Проявляются они в виде высыпаний различного характера:
эритематозного, везикулезного, буллезного, пустулезного, в виде крапивницы,
пурпуры, узловатой эритемы. Большинство из них имеет аллергический.
Пустулезные высыпания представляют собой следствие инфицирования
фолликулов потовых желез. Везикулезные высыпания при значительном
распространении проявляются эритродермией. Распространенные буллезные высыпания
могут привести к расстройствам гемодинамики и гипотонии. Тяжелая форма
мультиформной экссудативной эритемы (синдром Стивенса-Джонсона) в отдельных
случаях может приводить к летальному исходу.
- Лекарственные поражения соединительной, костной и мышечной
тканей. Описаны атрофические изменения соединительной ткани при применении
глюкокортикостероидов, при этом на туловище образуются стрии, ухудшается
заживление ран. Напротив, в результате пролиферации соединительной ткани в
различных органах и частях тела — средостении, легких, эндо- и перикарде — может
развиваться фиброз. Развитие фиброза описано при лечении ганглиоблокаторами,
бета-адреноблокаторами.
Лекарственная системная красная волчанка может быть спровоцирована
новокаинамидом, хлорпромазином, D-пенициламином,
метилдопой, противосудорожными средствами. Артралгии и артриты, как проявление
лекарственной аллергии описаны достаточно давно. Лекарственные поражения костей
наблюдаются чаще всего в виде остеопороза, остеомаляции и рахита. Остеопороз
развивается при длительном лечении глюкокортикостероидами, редко - гепарином.
Остеомаляция и рахит - это результат уменьшения минерализации костей вследствие
недостатка витамина D. Распад витамина
D могут вызывать фенобарбитал, фенитоин.
Глюкокортикостероиды тормозят всасывание витамина D.
Рабдомиолиз - это крайне редкое, но часто смертельное осложнение
лекарственной терапии цитостатиками, статинами. Помимо этого, некротизирующая
миопатия может быть спровоцирована винкристином, клофибратом,
бета-адреноблокаторами.
К поражениям, затрагивающим соединительную ткань, мышцы, кожу и
кости, относится альгодистрофия - трофические изменения костей, мышц, суставов и
кожи, сопровождающиеся выраженной болезненностью. Клинически альгодистрофия
может проявляться плече-лопаточным синдромом вследствие фиброзирования тканей
капсул верхних конечностей. Данное осложнение может иногда наблюдаться при
лечении фенобарбиталом.
- Лекарственные поражения гемопоэза. Изменения со
стороны крови относятся к числу наиболее распространенных неблагоприятных
побочных реакций. Их развитие описано при применении более тысячи препаратов.
Наибольшее клиническое значение имеют тромбоцитопения, гранулоцитопения,
апластическая и гемолитическая анемии.
Тромбоцитопения чаще всего вызывается цитостатиками,
препаратами золота, пенициллинами, цефалоспоринами, тетрациклинами, фуросемидом,
хинидином. Ее развитие является следствием токсического угнетения мегакариоцитов
в костном мозге.
Гранулоцитопения - редкое, но очень опасное осложнение
фармакотерапии анальгином, фенацетином, реже фенилбутазоном, индометацином и
другими нестероидными противовоспалительными препаратами.
Апластическую анемию может вызвать хлорамфеникол, сульфаниламидные
препараты, препараты золота, бутадион.
Гемолитическю анемию могут вызвать пенициллины, цефалоспорины,
инсулин, леводопа, хинидин. Кроме того, она может быть спровоцирована
применением сульфаниламидов, нитрофуранов, хлорохина, примахина, фенацетина,
ацетилсалициловой кислоты и др.
Обеспечение качества при проведении СМЭ по поводу медикаментозных
ятрогений. В практике судебно-медицинской экспертизы особое внимание
должно обращаться на вопросы, касающиеся противоправных и общественно-опасных
действий медицинского работника при проведении фармакотерапии. По мнению многих
специалистов причины развития лекарственных ятрогений чаще всего имеют
субъективный характер и обусловлены ненадлежащим исполнением практикующими
врачами своих профессиональных обязанностей в процессе производства медицинских
услуг.
Судмедэксперты, при проведении экспертизы случаев ненадлежащего
оказания медицинской помощи должны понимать, что избежать возникновения побочных
эффектов при применении современных лекарственных средств практически
невозможно. Тем не менее, неблагоприятные побочные реакции при применении ЛС с
летальными исходами лечащие врачи должны предупреждать, или, во всяком случае,
значительно уменьшить их число. Однако для движения по этому пути необходимо
придерживаться подходов жесткой стандартизации производства медицинских услуг в
сочетании с соблюдением принципов доказательной медицины и надлежащей
клинической практики ( Meyboom
R.,
Lindquist M.,
Egberts
A., 2001; Steers William., 2007; Shea
BJ, Grimshaw JM, Wells GA, et al., 2013).
Поскольку реального мониторинга частоты летальных исходов при
развитии побочных реакций на ЛС в России нет, то судмедэкспертам следует
ориентироваться на данные зарубежных экспертов. Лекарственные осложнения
занимают 4-е место в США по частоте летальных исходов после смертности от
сердечно-сосудистых заболеваний, злокачественных опухолей и инсультов и уносят
более 100 000 жизней ежегодно (Fletcher
A.P.,
1991; Shear N.H. et
al., 2000).
Данные мета анализа, проведенного в США по литературным сведениям (Kvasz
M.,
Allen I.E.,
Gordon
M.J.
et al.,
2000), указывали на то, что побочные эффекты занимают от
четвертого до шестого места по летальности среди госпитализированных пациентов (Lazarou
J., Pomeranz B.H., Corey P.N., 1998). В США до 140
тыс. человек погибают ежегодно в результате осложнений лекарственной терапии.
Создание сети Региональных центров по изучению безопасности
лекарств является весьма актуальной задачей для России. Эта работа ведется
достаточно интенсивно, что вероятно позволяет надеяться на повышение
результативности выявления, прежде всего, неожиданных и тяжелых побочных
реакций, которые приводят к летальным исходам (Овчинникова Е.А., 2003).
Проведение этой работы невозможно без тесного сотрудничества врачей клиницистов
с судебно-медицинскими экспертами, использующих научно-методические подходы к
организации судебно-химических и химико-токсикологических исследований с
точки зрения достижения наиболее высокой степени доказательности. В этой связи
важным аспектом является формирование научно-практической обеспеченности
судебно-химических экспертных подразделений моделями, принципами, формами
и методами обеспечения качества и достоверности получаемых результатов (Малкова
Т.Л., 2012). При оценке роли судебно-медицинских учреждений в современных
условиях на первый план выходят такие показатели, как качество и эффективность
процесса проведения экспертизы и сроки ее производства, особенно в случаях
ятрогений связанных с проведением фармакотерапии.
Вопросы обеспечения качества судебно-химических экспертных
исследований являются актуальными в связи с возросшими требованиями правовой
практики и постановкой новых задач, направленных на реализацию конституционных
прав человека и обеспечение связанных с этими правами государственных гарантий.
Федеральный закон «Об обеспечении единства измерений» декларирует в качестве
одной из своих целей обеспечение потребности граждан, общества и государства в
получении объективных, достоверных и сопоставимых результатов измерений,
используемых в целях защиты жизни и здоровья.
В контексте исследуемого вопроса о проведении СМЭ в связи с
ненадлежащим оказанием медицинской помощи при проведении лекарственной терапии,
необходимо решить вопросы системного характера. В частности, необходимо
методологическое обоснование системы обеспечения качества судебно-химических
экспертных исследований лекарственных средств в биологических средах. Эта
система должна включать положения системы менеджмента качества экспертного
учреждения, включая создание современной информационной и
материально-технической базы, подготовку квалифицированных экспертных кадров,
разработку и внедрение новых экспертных приемов и методов, реализацию требований
к эффективному функционированию лабораторной службы и достоверность получаемой в
ходе производства экспертиз информации.
Изучение международной практики деятельности по аккредитации,
которая основывается на принципах, изложенных в руководствах ИСО/МЭК,
европейских стандартах EN и
гармонизированных с ними национальных стандартах, а также в документах
Международной конференции по аккредитациям испытательных лабораторий (ИЛАК),
позволяет использовать национальные стандарты ГОСТ ИСО/МЭК 17025-2009 и ГОСТ Р
52960-2008 (Аккредитация СЭЛ, 2012). в качестве основополагающих при
формировании критериев работы лаборатории, выполняющей судебно-химические
экспертные исследования.
При проведении комиссионной СМЭ в связи с летальными исходами, где
в качестве причины имеются обоснованные подозрения на нарушение федеральных
технологических стандартов (протоколов) оказания медицинской помощи, в том числе
и стандартов фармакотерапии, необходимо изучать соблюдение лечащими врачами
рекомендаций общего плана:
исключить применение лекарственных препаратов при отсутствии четких
показаний к их назначению; применение ЛС у беременных женщин целесообразно
только тогда, когда в их назначении имеется настоятельная необходимость;
назначая конкретный препарат, следует уточнить, какие другие ЛС, включая и
препараты для самолечения, травы, пищевые добавки, принимает пациент,
поскольку возможно их взаимодействие и формирование нежелательных последствий
(ятрогений);
необходимо уточнять у пациентов наличие аллергических реакций в прошлом,
поскольку они довольно часто провоцируются применением ЛС,
назначая фармакотерапию следует обращать внимание на возраст пациента, на
наличие заболеваний печени и почек, поскольку при этих состояниях могут
изменяться метаболизм и сроки выведения ЛС из организма, что, в свою очередь,
ведет к необходимости подбора индивидуальной дозы препарата; следует
подвергать анализу генетические факторы ответственные за биотрансформацию ЛС;
по возможности следует избегать одновременного назначения нескольких
лекарственных средств; при необходимости число используемых препаратов
ограничить до минимально необходимого (не более 3-х в амбулаторных условиях);
следует четко инструктировать больных, особенно пожилого возраста о
правилах прима препаратов.
С внедрением в клиническую практику таких высокоэффективных
лекарственных средств, как антибиотики, гормоны, противовирусные препараты,
нейролептиков, иммуномодуляторов, цитокинов и многих других существенно
расширяются возможности лечения различных заболевании. Однако, с ростом
эффективности лекарственных средств сужается спектр их терапевтического действия
и увеличивается риск формирования ятрогенных осложнений, зачастую приводящих к
летальных исходам.
Принципиальным отличием СМЭ, проводимой по поводу летального
исхода, связанного с проводимой в условиях медицинского учреждения
фармакотерапией и СМЭ, проводимой по поводу отравления различными ядами является
то, СМЭ по поводу отравлений ядами проводится не только в рамках исследования
трупа, но и в рамках анализа всех обстоятельств дела. Такой подход
регламентируется выполнением нескольких специфических этапов
доказательства отравления.
- Ознакомление эксперта с материалами следствия, имеющими значение для
установления отравления.
- Участие эксперта в следственных действиях, прежде всего в осмотре места
происшествия, а также в обысках, допросах потерпевших, медработников и других
свидетелей.
- Изучение и оценка клинической картины отравлений по истории болезни и
другим медицинским документам.
- Исследование трупа.
- Дополнительные лабораторные исследования. В первую очередь,
судебно-химические исследования тканей и органов трупа, рвотных масс,
промывных вод желудка, остатков отравляющих веществ; гистологическое
исследование внутренних органов; обсуждение полученных при лабораторных
исследованиях результатов.
- Формулировка экспертных выводов (заключения).
Что же относительно летального исхода при проведении
фармакотерапии, то, как правило, на начальной стадии осуществляется
административное расследование медицинского происшествия в рамках регламента
деятельности организации-производителя медицинской услуги. Анализ реальной
практики показывает, что ни следователь, ни судмедэксперт на место происшествия
(в медицинское учреждение) не выезжают, труп и медицинскую документацию не
осматривают, не принимают мер по собиранию и закреплению доказательств (Флоря
В.Н., 2013).
Причиной этого является то, что управляющие структуры системы
здравоохранения и экспертные службы страховых медицинских организаций не
уведомляет следственные органы о медицинских происшествиях сопровождающихся
гибелью пациентов (застрахованных в системе ОМС) и не несут никакой
ответственности за сокрытие этих происшествий. Как правило, руководители
медицинских учреждений в день гибели пациента в результате медицинского
происшествия или в течение относительно ограниченного временного промежутка
предпринимают все меры к тому, чтобы провести патологоанатомическое исследование
или выдать тело без вскрытия. Поэтому СМЭ медицинского происшествия, чаще всего,
проводится по жалобе родственников или иных заинтересованных лиц.
|