Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Роль магния и калия в комплексной терапии коморбидного
больного
А. Л. Вёрткин*, доктор медицинских наук, профессор
О. Б. Талибов*, кандидат медицинских наук
А. С. Скотников*, кандидат медицинских наук
А. М. Грицанчук**
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
** ГБУЗ ГКБ № 50 ДЗМ, Москва
Магниевая терапия в кардиологии сегодня имеет надежную теоретическую основу и
убедительное практическое подтверждение. Магний, впервые выделенный английским
химиком Гемфри Дэви в 1808 г., — двухвалентный металл с массой 24,301, в
ионизированной форме он представляет собой положительный ион — катион — с
зарядом 2+ (Mg++) [1].
Вместе с еще 11 основными структурными химическими элементами человеческого
организма (углерод, водород, кислород, азот, натрий, калий, кальций, хлор,
фосфор, сера и фтор) магний определяет 99% элементарного состава тела. По
содержанию в организме он занимает четвертое место среди других катионов (после
натрия, калия и кальция), а по содержанию в клетке — второе (после калия). Mg++
необходим для нормального протекания множества биохимических реакций и
физиологических процессов. Ионы Mg++ способны образовывать обратимые
соединения с органическими веществами, обеспечивая возможность их участия в
разнообразных биохимических реакциях и активируя более чем 300 ферментов. В роли
кофактора он принимает участие во многих ферментативных процессах, в частности в
гликолизе, и гидролитическом расщеплении АТФ.
Находясь в комплексах с АТФ, Mg++ обеспечивает высвобождение
энергии через активность Mg++-зависимых АТФаз. В качестве кофактора
пируватдегидрогеназного комплекса Mg++ регулирует поступление
продуктов гликолиза в цикл Кребса и этим препятствует накоплению лактата. Он
участвует в синтезе и распаде нуклеиновых кислот, синтезе белков, жирных кислот
и липидов, в частности, фосфолипидов, а также контролирует синтез ц-АМФ —
универсального регулятора клеточного метаболизма и множества физиологических
функций. Mg++ является естественным физиологическим антагонистом
ионов кальция (Ca++).
В отличие от блокаторов медленных кальциевых каналов, Mg++
конкурирует с Ca++ не только в структуре мембранных каналов, но и на
всех уровнях клеточной системы. На этой конкуренции основано подавление
инициированных Ca++ реакций. При изменении внутриклеточного
соотношения основных катионов и преобладании Ca++ происходит
активация Ca++-чувствительных протеаз и липаз, приводящая к
повреждению мембран. Благодаря антагонизму с Ca++, Mg++
выступает как мембрано- и цитопротектор. Аналогичным механизмом обусловлена и
способность Mg++ уменьшать разобщение дыхания и окислительного
фосфорилирования в митохондриях, вследствие чего уменьшаются непроизводительные
потери энергии в виде тепла, увеличивается КПД синтеза АТФ и уменьшается
потребность клетки в кислороде. Антагонизмом с Ca++ объясняют также
снижение под действием ионов Mg++ АДФ-индуцированной агрегации
тромбоцитов и подавление других кальцийзависимых реакций в каскадах коагуляции
крови.
Ионы Mg++ играют важнейшую роль в электролитном балансе и
процессах мембранного транспорта, требующего больших энергозатрат. Связываясь с
клеточными, митохондриальными и другими мембранами, они регулируют их
проницаемость для прочих ионов. Особое значение ионы Mg++ имеют в
поддержании трансмембранного потенциала. Активируя Mg++-зависимую Na+-K+-АТФазу,
они определяют работу K+/Na+-насоса, осуществляющего
накопление калия внутри клетки и выведение натрия в межклеточное пространство,
обеспечивая таким образом поляризацию мембраны и способствуя ее стабильности.
Регуляцией электролитного баланса в клетке объясняется способность Mg++
подавлять автоматизм, проводимость и возбудимость, увеличивать абсолютную и
укорачивать относительную рефрактерность миокарда. Принимая участие в
высвобождении требующейся для функционирования мышечной клетки энергии и играя
одну из главных ролей в расслаблении миоцита, Mg++ контролирует цикл
«систола/диастола». Взаимодействие между четырьмя белками сократительного
аппарата кардиомиоцита начинается после поступления в клетку кальция, играющего
роль инициатора в образовании из актина и миозина актомиозина. Последний,
обладая АТФазной активностью, в присутствии Ca++ и Mg++
гидролизует АТФ и обеспечивает энергией сокращение мышцы, то есть систолу
сердца. Высвобождаясь из комплекса с АТФ по мере потребления последней, Mg++
вытесняет Ca++ из связи с тропонином С, в результате чего
прекращается взаимодействие актина и миозина и наступает диастола. АТФазная
активность актомиозина исчезает, а Ca++ с использованием энергии,
высвобождающейся под влиянием Ca++-Mg++-зависимой АТФазы
саркоплазматического ретикулума, реабсорбируется против градиента концентрации в
полость его продольных канальцев, а оттуда по градиенту концентрации — в
цистерны.
Таким образом, регуляция цикла «систола/диастола» осуществляется Mg++
как за счет его участия в энергетическом обмене, так и вследствие прямого
антагонизма с Са++.
Описанные механизмы играют важную роль в вазодилатирующей активности Mg++,
которая, возможно, опосредуется также через синтез ц-АМФ — мощного
вазодилатирующего фактора, через подавляющее влияние на
ренин-ангиотензин-альдостероновую систему и симпатическую иннервацию, а также
через усиление натрийуреза вследствие повышения почечного кровотока посредством
активации простациклина. В эксперименте было показано ингибирующее влияние Mg++
на выброс эндотелина, повышение которого, сопровождающее тромбоз коронарной
артерии при инфаркте миокарда, приводит к выраженной локальной вазоконстрикции в
зоне ишемического риска.
Кроме того, в эксперименте продемонстрировано, что Mg++ ингибирует
протромбин, тромбин, фактор Кристмаса, проконвертин и плазменный компонент
тромбопластина, а также его антиагрегантное действие. Среди метаболических
функций, проявляющихся на уровне целого организма, необходимо подчеркнуть роль
Mg++ в поддержании нормального липидного спектра, его участие в
обеспечении тканевого ответа на инсулин в ингибировании гормона паращитовидной
железы. Несмотря на то, что магний широко распространен в природе, его дефицит в
человеческой популяции встречается чрезвычайно часто. Так, гипомагнезиемия
определяется у 7–11% госпитализированных кардиологических больных, причем в 2
раза чаще у пациентов отделений интенсивной терапии [2]. Тому имеется множество
причин. Однако достоверное выявление недостатка магния представляет определенные
технические трудности, в связи с чем его диагностика на практике обычно
проводится на основании клинических признаков. Так, если в одном из скрининговых
исследований, проведенных в США, было показано, что гипомагнезиемия (уровень
сывороточного Mg++ ниже 0,74 ммоль/л) встречалась в 47,1% случаев
[3], то клинические признаки магниевого дефицита выявляются более чем у 72%
взрослых американцев. По этиологии магниевый дефицит можно подразделить на
первичный и вторичный.
Первичный (конституциональный, латентный) дефицит магния — в типичной, «эссенциальной»,
форме проявляется судорожным синдромом, называемым «спазмофилией»,
«конституциональной тетанией» или «нормокальциевой тетанией». У большей части
больных явные клинические симптомы наблюдаются при нормальном содержании Mg++
в крови и связаны с нарушениями трансмембранного обмена Mg++,
обусловленными, по-видимому, генетически. Вторичный дефицит магния — явление,
присущее практически всем обществам современного мира. Причин тому множество, и
они с известным допущением могут быть разделены на две большие группы: факторы,
зависящие от условий жизни и связанные с различными заболеваниями.
Пищевой стандарт, принятый в России, странах Европы и Америки, не
обеспечивает достаточного поступления Mg++ в организм человека. Это
не связано с недоеданием, как в слаборазвитых странах, а обусловлено
качественным составом пищи. Как уже указывалось, многие основные пищевые
продукты (различные виды мяса и птицы, картофель и другие овощи, молоко и
молочные продукты) содержат ограниченные количества Mg++. В
большинстве продуктов с высоким содержанием Mg++ имеется либо много
кальция или фосфора, либо белков или жиров, либо всех этих ингредиентов, что
препятствует абсорбции Mg++. Многие богатые Mg++ продукты
высококалорийны, поэтому могут употребляться в пищу лишь в ограниченном
количестве, не покрывая потребность в Mg++. Всеми этими
отрицательными свойствами не обладают шпинат и морская капуста, однако для
обеспечения физиологической суточной потребности в Mg++ ежедневно
нужно съедать 400–450 г первого или 200 г второй. Казалось бы, как источник Mg++
идеальным продуктом оказывается арбуз, но и здесь можно возразить, что
диуретическое свойство арбуза приведет к повышенным потерям электролитов и
возрастанию суточной потребности Mg++.
В связи с вышесказанным, современная популяция характеризуется пограничным
количеством Mg++ в организме, поэтому, кроме непосредственно
алиментарного дефицита, любая дополнительная нагрузка, способствующая
затруднению всасывания Mg++, возрастанию его потерь или увеличению
суточной потребности в нем, может спровоцировать развитие магниевого дефицита.
Среди таких факторов можно назвать гипокалорийные диеты при борьбе с лишним
весом; стресс (как острый, так и, особенно, хронический); напряженную физическую
работу и физическое перенапряжение; гиподинамию; воздействие высоких температур
(жаркий климат, горячие цеха, регулярное посещение парной бани); злоупотребление
алкоголем (злоупотребление алкоголем столь широко распространено в современном
мире, что, являясь по сути болезнью, в данном контексте должно рассматриваться
вместе с другими условиями жизни, а не с патологическими процессами);
беременность и лактацию; гормональную контрацепцию.
Причины магниевого дефицита, связанные с патологическими процессами, — это
нарушение абсорбции Mg++ в связи с возрастными изменениями или
заболеваниями ЖКТ (от синдрома малой абсорбции при, например, болезни Крона, до
относительно незначительных нарушений функции кишечника при хроническом
дуодените или субклиническом течении дисбактериоза); проявления сахарного
диабета и его осложнения (гипергликемия, полиурия, применение сахароснижающих
средств, диабетическая нефропатия с нарушением реабсорбции); гипергликемия
любого происхождения (в том числе и ятрогенная); почечный ацидоз, нефротический
синдром; гиперкортицизм; гиперкатехоламинемия; гиперальдостеронизм; гипертиреоз;
гиперпаратиреоз; гиперкальциемия; артериальная гипертензия; инфаркт миокарда;
застойная сердечная недостаточность; факторы риска ИБС, в частности ожирение;
передозировка сердечных гликозидов; диуретическая, глюкокортикоидная,
цитостатическая терапия.
Поскольку неоднородность распределения Mg++ в тканях организма
делает малоинформативным определение его содержания в сыворотке или эритроцитах,
заподозрить магниевый дефицит можно на основании сочетания отдельных клинических
признаков магниевого дефицита, особенно если они затрагивают различные системы и
наблюдаются на фоне значимого провоцирующего фактора, например злоупотребления
алкоголем. Разнообразные клинические симптомы и синдромы, связанные с дефицитом
ионизированного магния, представлены в таблице.
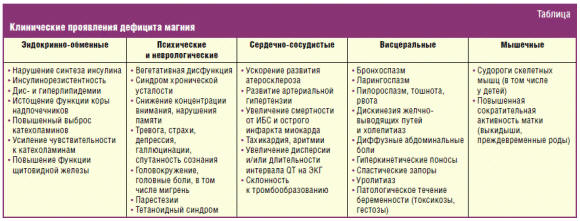
Из множества патологических состояний, возникающих при магниевом дефиците,
наиболее полно изучены сердечно-сосудистые заболевания. Инсулинорезистентность,
дис- и гиперлипидемии, развивающиеся при дефиците Mg++, должны
способствовать ускорению развития атеросклероза, что прогностически особенно
неблагоприятно при возникающих при этом повышении активности плазменного ренина
и продемонстрированного снижения выделения эндотелием вазодилатирующего фактора
— окиси азота [4]. Имеются экспериментальные данные о роли дефицита Mg++
в развитии атеросклероза [5]. Эти факты хорошо объясняют, почему у жителей
областей с повышенным уровнем Mg++ в воде отмечается замедление
развития атеросклероза и меньшая смертность от этого заболевания. Понятна и
известная связь между дефицитом Mg++ в воде и летальностью от острого
инфаркта миокарда [6]. Необходимо подчеркнуть, что важен не только абсолютный
уровень Mg++, но и уровень Ca++: величина отношения Ca++/Mg++
коррелирует со смертностью от проявлений ИБС [7].
Недостаток Mg++ в воде и пище служит и серьезным фактором риска
развития артериальной гипертензии. Кроме самостоятельного вазодилатирущего
эффекта ионов Mg++, опосредующегося многими вышеописанными
механизмами, в условиях магниевого дефицита отмечена повышенная чувствительность
артерий к воздействию прессорных аминов.
Весьма существенна роль магния при остром инфаркте миокарда. Потеря ионов Mg++
кардиомиоцитом является его ранней реакцией на ишемию, что приводит к истощению
запасов АТФ, угнетению АТФ-зависимых реакций, в том числе угнетению
функционирования K+/Na+-помпы и изменению внутриклеточного
соотношения основных катионов. Повышение концентрации Ca++ в цитозоле
вызывает активацию Ca++-зависимых протеаз и липаз, приводящую к
повреждению клетки. До 95% больных в остром периоде инфаркта миокарда имеют
сниженное содержание сывороточного магния (Святов, 1999). Одним из механизмов
развития этого феномена можно считать повышенный выброс катехоламинов, который
приводит к увеличению содержания свободных жирных кислот, связывающих Mg++
(что наблюдается при любом стрессе).
Дефицит Mg++ с преобладанием Са++ и неконтролируемое
поступление последнего в кардиомиоцит лежит в основе реперфузионного синдрома,
развивающегося после медикаментозной, инструментальной или спонтанной
реваскуляризации миокарда при остром инфаркте и проявляющегося, прежде всего,
нарушениями сердечного ритма.
Как при инфаркте миокарда, так и в других ситуациях внутриклеточный дефицит
Mg++ может служить причиной развития синусовой тахикардии и других
различных аритмий вплоть до фатальных. Выраженный магниевый дефицит
сопровождается удлинением интервала QT (что, как известно, ассоциируется с
развитием желудочковых нарушений ритма и внезапной смерти) и увеличением
«дисперсии» QT (разницы между QTMAX и QTMIN), считающимся
еще более надежным признаком высокой вероятности развития нарушений ритма, в том
числе и фатальных. Наиболее характерным для дефицита Mg++ вариантом
аритмии является желудочковая тахикардия типа «пируэт» (torsade de pointes), а
также индуцированные дигиталисом нарушения ритма, пароксизмальная
суправентрикулярная тахикардия, мономорфная желудочковая тахикардия.
У пациентов с инфарктом миокарда выявлена корреляция между дефицитом магния и
разнообразными желудочковыми нарушениями ритма. При застойной сердечной
недостаточности магниевый дефицит возникает как результат нейрогуморальных
сдвигов (сипатоадреналовой гиперфункции, активации
ренин-ангиотензин-альдостероновой системы), застоя в желудочно-кишечном тракте (ЖКТ),
препятствующего абсорбции Mg++, и усугубляется вследствие
диуретической и гликозидной терапии. У больных со сниженным уровнем Mg++
отмечается двукратное увеличение смертности от сердечной недостаточности.
Гипомагнезиемия ассоциируется с повышенной агрегацией тромбоцитов и
возрастанием риска тромбозов и эмболий. При недостатке Mg++
ослабляется антиоксидантная защита. Магниевый дефицит (уменьшение его содержания
в мышцах и эритроцитах) обнаружен у больных с пролапсом митрального клапана, для
которых также характерны нарушения ритма [8].
Развивающийся при злоупотреблении алкоголем дефицит Mg++ играет
определенную роль в формировании многих осложнений хронической интоксикации
этанолом (от поведенческих реакций до миопатии) и существенную роль в развитии
абстинентного синдрома [9].
В обычных физиологических условиях кинетический цикл Mg++
складывается из абсорбции в ЖКТ, распределения в средах организма и элиминации,
осуществляемой в основном путем экскреции с мочой. Всасывание Mg++
может осуществляться во всем кишечнике вплоть до сигмовидной кишки. Его
усвояемость из пищевых продуктов составляет 30–35% (то есть из 300–350 мг
суточной потребности усваивается около 100 мг). Она может увеличиваться под
влиянием витамина В6 и ряда органических кислот (молочной,
аспарагиновой, оротовой). Молоко и некоторые молочные продукты, содержащие
казеин, также способствуют увеличению абсорбции Mg++ (возможно, в
связи с большим содержанием оротовой кислоты). Абсорбции Mg++ в ЖКТ
препятствует большое содержание в пище веществ, с которыми он образует трудно-
или нерастворимые соединения — белки, жиры. Всасывание уменьшается также при
избытке ионов Ca++, конкурирующих с Mg++ на слизистой
кишки, и фосфатов [10].
Общее количество магния в организме взрослого человека составляет 24–25 г или
примерно 1000 ммоль. Наибольшая его часть — 60% — содержится в костях, формируя
в содружестве с кальцием их структуру; в случае необходимости отсюда может быть
мобилизовано не более 20–30%. Mg++ является типичным интрацеллюлярным
элементом — его внутриклеточная фракция составляет 39% всего его запаса (до
80–90% внутриклеточного магния находится в виде комплекса с АТФ, в связи с чем
уровень АТФ является одним из основных факторов, лимитирующих накопление этого
элемента в клетке). Оставшийся 1% распределяется во внеклеточном пространстве,
включая и сыворотку крови, на долю которой приходится лишь 0,3% [11].
Наибольшее количество магния содержится в тканях с высокоинтенсивными
обменными процессами. Основная часть его внутриклеточной фракции практически
поровну поделена между мозговой и мышечной тканями. При этом наивысшее
относительное содержание Mg++ отмечается в миокарде. Концентрация
магния в сыворотке крови составляет в норме 0,75–0,95 ммоль/л, а в клетках может
достигать 5–10 ммоль/л. Однако в связи с неоднородностью его распределения в
различных тканях внутриклеточная его концентрация варьирует в широких пределах,
составляя, например, в эритроцитах лишь 2–2,6 ммоль/л. Содержание магния в
сыворотке крови не отражает его запасы в организме, а зависит лишь от
интенсивности его движения из депо к почкам. Также малоинформативно и его
содержание в клеточных элементах крови из-за неоднородности распределения.
Поэтому лабораторная оценка магниевого обмена наиболее достоверна, если
анализируется экскреция Mg++ с мочой.
Обычно выведение Mg++ из организма осуществляется почками, через
которые теряется примерно 100 мг/сут, то есть все всосавшееся из пищи
количество. При его дефиците почечная экскреция снижается или прекращается
вовсе; при увеличении поступления Mg++ увеличивается и экскреция.
Его потери с мочой возрастают под влиянием катехоламинов и глюкокортикоидных
гормонов, чем объясняется возможность возникновения магниевого дефицита при
стрессе. Существенные количества Mg++ могут теряться и в случае
усиленного потоотделения при напряженной физической работе или тепловой
нагрузке; при этом его потери с потом могут достигать 15%, в то время как в
обычных условиях они не превышают 1,5 мг/сут (последним фактом при анализе
магниевого гомеостаза часто пренебрегают).
Mg++ как фармакологическое средство обладает множеством
разнообразных клинических эффектов, в частности антигипертензивным,
антиишемическим, диуретическим и др., а также обилием показаний к применению. В
большинстве случаев фармакологическое действие Mg++ проявляется и при
отсутствии явных признаков его дефицита [12].
Возможно, это объясняется тем, что при многих патологических процессах
развивается вторичный (общий или местный) магниевый дефицит, выступающий одним
из патогенетических механизмов, способствуя прогрессированию заболевания и
усугублению клинического состояния больного. Получение фармакологических
эффектов Mg++ во многих случаях с недоказанным его дефицитом можно
связать и с антикальциевым действием.
Положительный эффект препаратов Mg++ наблюдается как при лечении
хронических заболеваний (когда Mg++ предупреждает обострения и
улучшает качество жизни), так и в ургентных ситуациях (для восстановления
нормального осуществления жизненно важных функций). При разных путях введения,
обеспечивающих различные концентрации Mg++, на первый план выступают
его разные эффекты. Например, если седативное, спазмолитическое и некоторое
антигипертензивное действие при приеме внутрь проявляется довольно рано, то для
заметного влияния на сердце (за исключением частоты сердечных сокращений) в этом
случае требуется срок, измеряемый неделями [13].
Другим жизненно важным элементом является калий (К+), который
служит основным внутриклеточным катионом и в норме концентрация которого в
плазме составляет 3,5–5 ммоль/л, а в клетках — 150 ммоль/л. Обмен калия
обусловлен его поступлением извне и выведением почками с мочой. Этот объем
составляет 1,9–5,9 г калия в сутки. Содержание калия во внеклеточной жидкости
составляет менее 2% от общего его содержания в организме. Высокое
внутриклеточное содержание калия обеспечивается работой так называемого «натрий-калиевого
насоса» — особой белковой структуры, расположенной в клеточной мембране, для
работы которой требуются энергия молекул аденозинтрифосфата (АТФ) и присутствие
ионов магния.
Натрий-калиевый насос начинает усиленно работать при повышении уровня калия в
крови под действием альдостерона, «гормонов стресса» катехоламинов (адреналина и
норадреналина) и инсулина [14]. Так создается трансмембранный потенциал покоя,
наличие которого чрезвычайно важно для нормального функционирования нервной и
мышечной ткани. Поскольку потери калия из внеклеточной жидкости быстро
компенсируются за счет его притока из клеток, концентрация этого иона во
внеклеточном пространстве на протяжении достаточно длительного времени
изменяется очень мало. В результате критический дефицит калия, который может
привести к сердечно-сосудистым и нервно-мышечным нарушениям, часто остается
незамеченным при стандартных исследованиях [15].
На распределение калия в организме влияет ряд гормонов, кислотно-щелочное
равновесие, скорость обновления клеток. Так, на активность Na+, K+-АТФазы
опосредованно действует инсулин (способствует перемещению калия в мышечные
клетки и клетки печени), повышая эту активность, поэтому больные сахарным
диабетом находятся в группе риска по развитию гипокалиемии. Другими причинами
гипокалиемии являются: недостаточное поступление его с пищей (голодание, диеты),
интенсивная потеря жидкости (диарея, потоотделение, прием тиазидных диуретиков
или слабительных), гипергликемия, гиперальдостеронизм, гипомагниемия и др. [16].
Наиболее частая причина гипокалиемии — повышенное выделение калия через
желудочно-кишечный тракт (с рвотой, при поносе, при злоупотреблении
слабительными) или с мочой (при длительном приеме диуретиков, а также при таких
состояниях, как первичный или вторичный гиперальдостеронизм, классический
дистальный ренальный канальцевый ацидоз, синдром Барттера). Кроме диуретиков, к
гипокалиемии могут приводить и другие лекарственные препараты: ампициллин,
пенициллин, карбенициллин, гентамицин, амфотерицин В, салицилаты. Снижение
поступления калия с пищей очень редко приводит к гипокалиемии. Переход калия из
внеклеточной жидкости в клетки может наблюдаться при избыточной активности
минералкортикоидов, введении инсулина, при алкалозе. Периодический внезапный
переход калия из внеклеточной жидкости в клетки наблюдается при периодическом
гипокалиемическом параличе [17].
Возможности назначения внутрь неорганических солей магния (Mg++) и
калия (К+) в терапевтических дозах ограничены, в связи со
способностью таких доз вызывать нежелательные явления. Учитывая это, некоторые
органические кислоты, витамины, повышая абсорбцию К+ и Mg++
в кишечнике и сокращая их потери с мочой, позволяют использовать меньшие дозы
для получения отчетливых резорбтивных фармакологических эффектов. Среди таких
факторов особое место занимает аспарагиновая кислота, которая, включаясь в цикл
Кребса, нормализует нарушенные соотношения трикарбоновых кислот, активно
участвует в синтезе АТФ, способствует поступлению калия и магния внутрь клетки и
восстанавливает адекватную работу ионных насосов в условиях гипоксии.
Аспарагиновая кислота представляет собой алифатическую аминокислоту,
присутствующую в организме в составе белков, и в свободном виде играет важную
роль в обмене азотистых веществ, участвует в образовании пиримидиновых
оснований, а также мочевины. Уменьшая содержание аммиака, аспарагинат защищает
ЦНС, нормализует процессы возбуждения и торможения в ней, стимулирует иммунную
систему. Аспарагиновая кислота способствует увеличению запасов гликогена, что
важно для нутритивной поддержки в целях обеспечения белково-энергетического
гомеостаза. Соли аспарагиновой кислоты повышают выносливость, сопротивляемость
организма к различным воздействиям, т. е. обладают адаптационным эффектом [18].
Таким образом, калия и магния аспарагинат (КМА) обладает следующими
достоинствами: обеспечивает высокую абсорбцию К+ и Mg++ в
ЖКТ при минимальных гастроинтестинальных побочных эффектах; не допускает
существенного увеличения экскреции К+ и Mg++; обеспечивает
накопление К+ и Mg++ в клетке; повышает клиническую
эффективность ионов К+ и Mg++, что делает данное лекарство
препаратом выбора при дефиците электролитов и позволяет использовать его в
рутинной практике, в том числе в условиях отделений интенсивной терапии.
Литература
- Golf S. W., Bender S., Gruttner J. On the significance of
magnesium in extreme physical stress // Cardiovasc Drugs Ther. 1998, Sep; 12
Suppl. 2: 197–202.
- Weiss M. J., Orkin S. H. Transcription factor GATA-1 permits
survival and maturation of erythroid precursors by preventing apoptosis //
Proc Natl Acad Sci USA. 1995, Oct 10; 92 (21): 9623–9627.
- Wang N. P., Chen P.-L., Huang S., Donoso L. A., Lee W.-H., Lee E. Y.-H.
P. DNA-binding activity of retinoblastoma protein is intrinsic to its
carboxil-terminal region // Cell Growth Diff. 1990. 1, 233–239.
- Pearson P. S., Evora P. R., Seccombe S. F., Schaff H. V.
Hypomagnesaemia Nitric Oxide Release from Coronary Endothelium: Protective
Role of Magnesium Infusion After Cardiac Operation // Ann.Thorac.Surg. 1998;
65: 967–972.
- Jellinek H., Takacs E. Morphological aspects of the effects of
orotic acid and magnesium orotate on hypercholesterolemia in rabbits //
Arzneimittelforschung. 1995 Aug; 45 (8): 836–842.
- Rubenowitz E. Magnesium in drinking water in relation to
morbidity and mortality from acute myocardial infarction // Epidemiology.
2000. Vol. 11 (4). P. 416–421
- Taylor-Robinson D., Davies H. A., Sarathchandra P., Furr P. M.
1991. Intracellular location of mycoplasmas in cultured cells demonstrated by
immunocytochemistry and electron microscopy // Int. J. Exp. Pathol. Vol. 72.
P. 705–714.
- Cohen L., Laor A., Kitzes R. Magnesium malabsorption in
postmenopausal osteoporosis // Magnesium. 1983. Vol. 2. P. 139–143.
- Durlach J. Magnesium chloride or magnesium sulfate: a genuine
question // Magnes. Res. 2005. Vol. 18, № 3. P. 187–192.
- Косарев В. В., Бабанов С. А. Клиническая фармакология
лекарственных средств, применяемых при сердечно-сосудистых заболеваниях.
Самара, 2010, с. 140.
- Мартынов А. И., Степура О. Б., Пак Л. С., Мельник О. О. Магний и
сердечно-сосудистая система // Клин. медицина. 1998. № 8. С. 63–65.
- Мартынов А. И., Остроумова О. Д., Маев И. В. Роль магния в
патогенезе и лечении артериальной гипертонии // Тер. архив. 1999. № 12. С.
67–69.
- Мартынов А. И., Остроумова О. Д., Маев И. В. К вопросу о
состоянии системы гомеостаза при эссенциальной гипертензии // Российские
медицинские вести. 1999. № 3. С. 19–20.
- Clausen T., Everts M. E. Regulation of the Na, K–pump in skeletal
muscle // Kidney Int. 1989. Vol. 35. P. 1–13.
- Вёрткин А. Л., Талибов О. Б. Обмен магния и терапия препаратами
магния при гестозе // Фарматека. 2005, № 2, 13–17.
- Физиология человека: в 3-х томах; пер. с англ. / Под ред. Р. Шмидта и Г
Тевса. 3-е изд. М.: Мир, 2004.
- Котова О. В., Рябоконь И. В. Патогенетическая роль дефицита калия
и магния в развитии неврологических заболеваний // РМЖ. 2012. T. 29. P. 1493.
- Shechter M. Oral magnesium therapy improves endothelial function
in patients with coronary artery disease // Circulation. 2000. Vol. 102. 1. P.
2353.
Статья опубликована в журнале
Лечащий Врач

