Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Внебольничная пневмония
В. И. Симаненков, доктор медицинских наук, профессор
Е. А. Лутаенко, кандидат медицинских наук
ГБОУ ВПО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
Внебольничная пневмония (ВП) относится к наиболее частым заболеваниям у
человека и является одной из ведущих причин смерти от инфекционных болезней (А.
Г. Чучалин). Заболеваемость ВП в Европе колеблется от 2 до 15 случаев на 1000
человек в год, в России — 3,9 случая на 1000 человек в год среди лиц старше 18
лет. Этот показатель значительно выше у пожилых больных — 25–44 случая на 1000
человек в год у больных старше 70 лет и до 68–114 случаев на 1000 человек в год
у пожилых больных, находящихся в домах инвалидов, домах ухода (С. Н. Авдеев).
Согласно расчетным данным ежегодно в РФ возникает не менее 1,5 млн случаев ВП.
Смертность у больных с нетяжелой ВП обычно не превышает 5%, однако при тяжелом
течении заболевания она может достигать 25–50%. Несмотря на успехи химиотерапии,
смертность при ВП растет. За последние 30 лет она увеличилась с 1% до 9%.
Современные классификации, в зависимости от условий возникновения
заболевания, подразделяют пневмонии на две большие группы: внебольничные
пневмонии (первичные), приобретенные вне больничного учреждения, и
нозокомиальные (госпитальные) пневмонии, возникшие через 48–72 часа после
госпитализации. Отдельно выделяют пневмонии у больных с тяжелыми дефектами
иммунитета (врожденный иммунодефицит, ВИЧ-инфекция, ятрогенная иммуносупрессия)
и аспирационные пневмонии. Такой подход обоснован различными причинными
факторами пневмоний и различными подходами к выбору антибактериальной терапии.
ВП условно можно разделить на три группы.
- Пневмонии, не требующие госпитализации. Данная группа больных — самая
многочисленная, на ее долю приходится до 80% всех больных с пневмонией; эти
больные имеют легкую пневмонию и могут получать терапию в амбулаторных
условиях, летальность не превышает 1–5%.
- Пневмонии, требующие госпитализации больных в стационар. Эта группа
составляет около 20% всех пневмоний, больные пневмонией имеют фоновые
хронические заболевания и выраженные клинические симптомы, риск летальности
госпитализированных больных достигает 12%.
- Пневмонии, требующие госпитализации больных в отделения интенсивной
терапии. Такие пациенты определяются как больные с тяжелой ВП. Летальность при
тяжелой пневмонии составляет около 40%.
Этиология внебольничной пневмонии связана главным образом с нормальной
микрофлорой «нестерильных» отделов верхних дыхательных путей, микроаспирацией
содержимого ротоглотки — основной путь инфицирования респираторных отделов
легких, а значит, основной патогенетический механизм развития пневмонии, как
внебольничной, так и госпитальной. Другие патогенетические механизмы развития
пневмонии — гематогенное распространение возбудителя, непосредственное
распространение инфекции из соседних пораженных тканей — менее актуальны. Из
множества видов микроорганизмов, колонизирующих верхние дыхательные пути, лишь
некоторые, обладающие повышенной вирулентностью, способны при проникновении в
респираторные отделы легких вызывать воспалительную реакцию даже при минимальных
нарушениях защитных механизмов. Перечень типичных бактериальных возбудителей ВП
представлен в табл.

Streptococcus pneumoniae является ведущей причиной ВП как среди
больных с легкой, так и тяжелой пневмонией (около 20%). Среди больных пневмонией
с бактериемией, на долю S. pneumoniae приходится до двух третей всех
причин заболевания. Второе место по значению среди причин ВП занимают «атипичные»
микроорганизмы — Mycoplasma pneumoniae и Chlamydophila pneumoniae (до
10–20%), распространенность данных возбудителей зависит от сезона, возраста
больных, географического региона. Staphylococcus aureus, Legionella
pneumophila и грамотрицательные бактерии (Klebsiella pneumoniae,
Pseudomonas aeruginosa и др.) играют более скромную роль в генезе ВП,
однако их роль возрастает по мере нарастания тяжести заболевания. Инфекции
Legionella spp. встречаются в основном в регионах с теплым
климатом (страны Средиземноморья) и довольно редко — в странах Северной Европы
[23]. Роль анаэробных микроорганизмов в генезе ВП небольшая, но значительно
возрастает при аспирационных пневмониях — до 50% всех причин. Вирусные инфекции
являются причиной 5–15% всех ВП, при этом основное значение имеет вирус гриппа,
меньшее — вирусы парагриппа, аденовирусы, респираторно-синтициальный вирус.
Вирусные пневмонии имеют сезонное преобладание, преимущественно в осенне-зимнее
время.
Чрезвычайно важным является разделение ВП по степени тяжести — на нетяжелую и
тяжелую. Критерии тяжелого течения пневмонии: общее тяжелое состояние больного
(цианоз, спутанность сознания, бред, температура тела > 39 °C); острая
дыхательная недостаточность (одышка — число дыханий > 30/мин, при спонтанном
дыхании — рO2 < 60 мм рт. ст., SaO2 < 90%); тахикардия, не
соответствующая степени выраженности лихорадки, систолическое АД < 90 мм рт. ст.
и/или диастолическое АД < 60 мм рт. ст.); дополнительные критерии (гиперлейкоцитоз
> 20 × 109/л или лейкопения < 4 × 109/л, двусторонняя или
многодолевая инфильтрация легких, массивный плевральный выпот, азот мочевины >
10,7 ммоль/л)). Среди возбудителей нетяжелой ВП доминируют S. pneumoniae, М.
pneumoniae, C. pneumoniae и H. influenzae, тогда как актуальными
возбудителями тяжелой пневмонии наряду с пневмококком являются L.
pneumophila, бактерии семейства Enterobacteriaceae, S. aureus.
На протяжении последних лет во всем мире наблюдается стремительный рост
резистентности возбудителей пневмоний к антибактериальным препаратам, а также
возникновение нежелательных лекарственных реакций в виде
антибиотикоассоциированной диареи (ААД) и псевдомембранозного колита. ААД
называют три и более эпизода неоформленного стула в течение двух или более
последовательных дней, развившихся на фоне применения антибактериальных средств.
В большинстве случаев симптомы диареи развиваются на 4–10 день после начала
терапии, однако у трети пациентов могут появляться и спустя 4 недели после
отмены антибиотиков. Причина этого кроется, по-видимому, в том, что после
подавления антибиотиком эубиотной микрофлоры толстой кишки требуется
определенное время для роста и размножения условно-патогенной флоры,
ответственной за развитие диареи. Отмечена отчетливая зависимость частоты
развития ААД от принятой дозы антибиотика и продолжительности его приема (меньше
3 дней, больше 7 дней). В 80–90% случаев развитие ААД не связано с определенным
(конкретным) возбудителем
Внедрение новых классов антибактериальных препаратов не уменьшает число
нежелательных лекарственных реакций, продолжаются поиски способов повышения
эффективности и безопасности антибактериальной терапии.
В этой связи делались попытки подключить пробиотики в терапию внебольничных и
внутрибольничных пневмоний. Коллектив нашей кафедры проводил исследование: к
стандартной терапии внутрибольничной пневмонии был добавлен пробиотик. Данное
исследование показало, что число нежелательных лекарственных реакций
незначительно уменьшилось: у пациентов реже возникали явления дисбиоза, и при
этом эффективность терапии не улучшилась. Кроме того, было проведено изучение
аутопробиотической терапии в лечении ВП. Было показано, что добавление
аутопробиотика в стандартную терапию ускоряет редукцию инфильтративных изменений
в легких, однако сложность технологического процесса и высокая себестоимость
методики не позволяют широко использовать ее в повседневной практике.
В связи с этим актуальным представляется изучение эффективности применения
совместно с антибиотиком и пребиотика. Пребиотики — вещества немикробного
происхождения, способные оказывать регулирующее влияние на кишечную микрофлору
через селективную стимуляцию роста или активности представителей нормальной
микрофлоры. К пребиотикам относятся: фруктоолигосахариды (инулин),
ксилоолигосахариды, арабиногалактоолигосахариды, изомальтоолигосахариды,
изомальтулоза, лактулоза, галактоолигосахариды, раффиноза, стахиоза,
гентиоолигосахариды, циклодекстрины, палатиноза, ксилоглюкоолигосахариды,
устойчивые крахмалы, пищевые волокна, лектинаны, гетероглюканы, гликопентиды,
лактоглобулины, пантотеновая кислота, пантотенаты, инозит.
Среди представленных на фармацевтическом рынке пребиотиков особый интерес
представляет лактулоза, обладающая комплексом позитивных характеристик.
Лактулоза является синтетическим дисахаридом, в котором каждая молекула
галактозы связана β-1–4-связью с молекулой фруктозы. Эта связь и является той
причиной, по которой лактулоза не разрушается пищеварительными ферментами
человека, проходит через желудочно-кишечный тракт и достигает толстой кишки в
неизмененном виде. В толстой кишке лактулоза является идеальным питательным
субстратом для бифидобактерий и других лактатпродуцирующих микроорганизмов,
поэтому избирательно способствует росту этих бактерий. В результате гидролиза
лактулозы в толстой кишке образуются органические короткоцепочные жирные кислоты
(КЦЖК) — молочная, уксусная, масляная и пропионовая, подавляющие рост патогенных
микроорганизмов и уменьшающие вследствие этого продукцию азотсодержащих
токсических веществ. КЦЖК утилизируются макроорганизмом, что сопровождается
абсорбцией воды из просвета кишки и уменьшением толстокишечного содержимого.
Скорость бактериальной ферментации лактулозы, то есть ее усвояемость
кисломолочными бактериями, и минимальная энергозатратность этой ферментации
обеспечивают быстрый рост нормофлоры кишечника (бифидогенный эффект).
При проведении терапии ВП, особенно в амбулаторных условиях, высоко значение
приверженности больных к лечению. В ряде исследований показано, что одним из
способов повышения приверженности является использование фиксированных
комбинаций лекарственных средств. В России примером такой фиксированной
комбинации антибиотика и пребиотика является экоантибиотик Эколевид®, каждая
капсула которого содержит 500 мг левофлоксацина гемигидрат (в пересчете на
левофлоксацин) и 600 мг лактулозы соответственно. Лактулоза в форме ангидро
принципиально отличается от обычной лактулозы, входящей в состав других
лекарственных препаратов, высочайшей степенью очистки, ее состав на 97–99%
представлен исключительно дисахаридом лактулозой. Обычная лактулоза применяется
в фармацевтике в форме 66% сиропа и содержит значительное (до 30%) количество
остаточных сахаров в виде примесей: галактозы, лактозы, тагатозы, эпилактозы,
фруктозы. Кроме того, в экоантибиотиках лактулоза содержится в пребиотических
дозах, что не вызывает метеоризма и не ускоряет моторику кишечника.
Все вышесказанное побудило кафедру терапии и клинической фармакологии СЗГМУ
им. И. И. Мечникова провести «Сравнительное, рандомизированное, открытое,
контролируемое, многоцентровое исследование эффективности и безопасности
препарата Эколевид® (500 мг, производства ОАО «АВВА РУС», Россия) в сравнении с
препаратом Леволет (500 мг, производства компании Dr.Reddy’s) в комплексной
терапии внебольничной пневмонии».
В задачи исследования входило: оценить клиническую эффективность препарата
Эколевид® в сравнении с препаратом Леволет при лечении ВП (улучшение клинической
симптоматики и положительной рентгенологической динамики) в течение 7-дневного
курса антибактериальной терапии, оценить изменение состава микрофлоры кишечника
до начала лечения антибактериальным препаратом и после завершения курса
антибиотикотерапии, изучить безопасность и переносимость исследуемого препарата,
на основании учета всех выявленных нежелательных лекарственных реакций.
В исследование включались пациенты с ВП, соответствующие критериям включения
и несоответствующие критериям исключения.
Критерии включения:
- Мужчины и женщины в возрасте от 20 до 65 лет включительно.
- Установленный диагноз ВП.
- Способность к регулярному приему исследуемых препаратов и выполнению
процедур исследования.
- Отрицательный тест на беременность на момент включения в исследование и
подтверждение возможности использования адекватного метода контрацепции на
всем протяжении исследования для женщин детородного возраста.
Критерии исключения:
- Повышенная чувствительность к производным фторхинолонов и другим
компонентам препаратов исследования.
- Наличие у пациента диареи (согласно определению Всемирной организации
здравоохранения (World Health Organization, WHO) в течение последних 3 месяцев
до настоящего заболевания и визита скрининга.
- Прием в течение 30 дней, предшествующих скринингу, сорбентов, пребиотиков
и пробиотиков, антибиотиков.
- Любые имеющиеся или подозреваемые злокачественные заболевания на момент
скрининга.
- Установленная (по данным медицинской документации) почечная
недостаточность с расчетным клиренсом креатинина менее 50 мл/мин.
- Тяжелое нарушение функции печени (уровень аланинаминотрансферазы (АЛТ),
аспартатаминотрасферазы (АСТ), в 3 раза и более превышающий верхнюю границу
нормы, а также уровень общего билирубина в 1,5 раза и более превышающий
верхнюю границу нормы).
- Наличие коло- либо илеостомы.
- Психические и неврологические заболевания с частичной или полной утратой
дееспособности.
- Злоупотребление алкоголем либо сильнодействующими веществами на момент
включения и в течение года до включения в исследование.
- Участие в другом клиническом исследовании в течение 30 дней до скрининга.
- Беременность или кормление грудью.
- Неспособность пациента следовать процедурам протокола, по мнению
исследователя.
Дизайн исследования
В исследование были включены 40 пациентов с ВП в возрасте от 20 до 65 лет
включительно, наблюдавшиеся в стационаре. Пациенты были распределены методом
рандомизации на 2 группы в соотношении 1:1 по 20 пациентов в каждой, все
рандомизированные пациенты получали стандартную комплексную терапию: одна группа
получала Эколевид® (500 мг, производства ОАО «АВВА РУС»), по 1 таблетке 2 раза в
сутки, другая — препарат Леволет (500 мг, производства Dr.Reddy’s), по 1
таблетке 2 раза в сутки. Во время исследования пациенты не получали никакие
другие антимикробные средства, помимо исследуемых препаратов, а также сорбенты,
про- и пребиотики.
Для оценки эффективности и безопасности терапии использовались клинический,
лабораторный и инструментальные методы исследования. Клинический метод включал:
жалобы на головную боль, повышение температуры, кашель с мокротой или без,
одышку, потоотделение, слабость, также общий осмотр по органам и системам с
оценкой витальных показателей. Лабораторный: клинический анализ крови,
биохимический анализ крови, общий анализ мочи, микробиологическое исследование
мокроты, микроскопическое исследование мокроты, кал на дисбиоз (полимеразная
цепная реакция (ПЦР) в режиме «реального времени»). Проводилось также
инструментальное обследование: электрокардиография, рентгенологическое
исследование легких, функция внешнего дыхания. ПЦР в режиме «реального времени»
(Real-Time PCR, ПЦР-РВ) — используется для одновременной амплификации и
измерения количества искомой молекулы ДНК. Преимуществом данного подхода
является возможность совмещения детекции и количественного определения
специфической последовательности ДНК в образце в реальном времени после каждого
цикла амплификации. Отличительными чертами ПЦР-РВ являются не только возможность
количественного определения ДНК/РНК в исследуемом материале, но и отсутствие
стадии электрофореза, что позволяет минимизировать риск контаминации продуктами
ПЦР и таким образом резко уменьшить число ложноположительных результатов.
Результаты исследования
В ходе исследования оценивались такие клинические симптомы, как кашель с
отделением мокроты, одышка, температура тела, слабость, потоотделение. Все эти
симптомы оценивались в баллах. До начала терапии в группе пациентов, получавших
Эколевид®, на сильный кашель жаловались 35% пациентов, на умеренный 55%, после
лечения препаратом Эколевид® у 70% пациентов кашель исчез, у 30% — сохранялся
слабый. Пациенты, получавшие Леволет, жаловались на сильный кашель — 15%,
умеренный — 80%, после лечения только у 35% пациентов ушел кашель, у 65%
сохранялся слабый. Такие жалобы, как слабость и потоотделение, меньше перестали
беспокоить пациентов или совсем исчезли после терапии препаратом Эколевид®, а у
пациентов, принимавших Леволет, потоотделение сохранялось у 3 пациентов,
умеренная слабость — у 9 пациентов, что отражено на рис. 1–2.

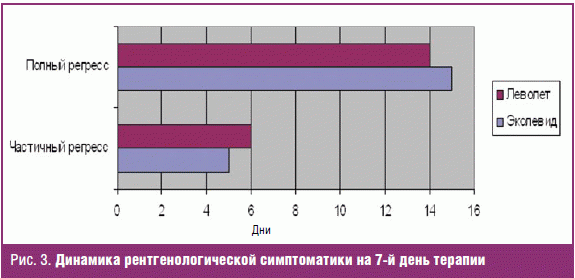
После курса 7-дневной антибактериальной терапии пациентам было проведено
контрольное рентгенологическое исследование, у пациентов, получавших Эколевид®,
отмечался регресс пневмонии через 7 дней, у 3 пациентов, получавших Леволет,
сохранялась инфильтрация через 7 дней, этим пациентам пришлось добавить второй
антибактериальный препарат (рис. 3).
Клинические симптомы дисбиоза кишечника, такие как тошнота, метеоризм,
вздутие, боль в животе, частота стула, консистенция стула оценивались по
4-балльной системе. Чаще всего пациенты предъявляли жалобы на вздутие живота и
метеоризм. Рис. 4 иллюстрирует динамику гастроинтестинальной симптоматики на
фоне терапии.

Дисбиоз — это клинико-микробиологический синдром, характеризующийся
количественными, качественными и топографическими изменениями нормальной
кишечной микрофлоры, являющийся выражением адаптационных реакций системы
«организм человека — нормальная микрофлора», проявляющийся прогредиентным
нарастанием клинических проявлений основного заболевания. Существует следующая
классификация дисбиозов:
- I степень — анаэробная микрофлора преобладает над аэробной, при сохранном
уровне бифидо- и лактофлоры; уменьшается количество кишечных палочек с
нормальной ферментативной активностью на фоне снижения общего количества
бактерий этого вида;
- II степень — угнетение роста анаэробов, полноценные кишечные палочки
заменяются атипичными формами, обогащение микробного пейзажа за счет
увеличения количества хотя бы одного из представителей условно-патогенной
микрофлоры (УПМ) до 103–104 КОЕ/мл;
- III степень — резкое угнетение анаэробной микрофлоры, увеличение
количества одного из представителей УПМ до 105–106
КОЕ/мл и более;
- IV степень — обильный рост ассоциаций УПМ в количестве 106–107
КОЕ/мл и более.
В нашем исследовании состав микрофлоры кишечника оценивался также в обеих
группах до начала антимикробной терапии и после (рис. 5–8). До начала терапии в
группе пациентов, получавших Леволет, нормальная микрофлора кишечника была у 65%
пациентов, дисбиоз I степени выявлялся у 35% пациентов. После курса
антибактериальной терапии препаратом Леволет дисбиоз I степени сохранился у 20%
пациентов, но у 10% пациентов появился дисбиоз II степени. У пациентов,
получавших препарат Эколевид®, явления дисбиоза II степени отсутствовали.

До начала терапии уже отмечались признаки кишечного дисбиоза у пациентов в
обеих группах, и в первую очередь снижение числа бифидобактерий и уменьшение
количества лактобактерий. Однако по завершению лечения у пациентов, принимавших
Эколевид®, выявлено достоверное увеличение количества бифидобактерий и
нормализация уровня лактобактерий. Благодаря наличию в составе антибиотика
Эколевид® лактулозы, в процессе терапии поддерживался нормальный кишечный
микробиоценоз, тогда как применение традиционных антибиотиков вызвало дисбаланс
кишечного микробиоценоза и значительно повысило риск развития дисбиоза (рис. 9).

Таким образом, результаты проведенного исследования свидетельствуют о высокой
клинической эффективности экоантибиотика Эколевид® в лечении ВП. Лечение
препаратом Эколевид® существенно снижает частоту характерных для
антибиотикотерапии нежелательных лекарственных реакций, связанных с их
неблагоприятным воздействием на состояние микробиоценоза кишечника. Терапия
препаратом Эколевид® ассоциирована с высокой приверженностью пациентов к
лечению. Экоантибиотики соответствуют аналогичным препаратам по эффективности и
имеют ряд преимуществ по безопасности, а именно сохраняют баланс кишечной
микрофлоры в процессе антибиотикотерапии, препятствуют развитию ААД,
поддерживают иммунный статус, обладают лучшей терапевтической переносимостью,
чем однокомпонентные антибиотики.
Литература
- Буторова Л. И., Плавник Т. Э. Экоантибиотики: новая стратегия
повышения эффективности антихеликобактерной терапии и профилактики
антибиотикоассоцированной диареи // Лечащий Врач. 2013. № 5. С. 1–8.
- Циммерман Я. С. Гастроэнтерология: руководство. М.: ГЕОТАР-Медия,
2012. 800 с.
- Иванчик Н. В., Козлов С. Н., Рачина С. А. и соавт. Этиология
фатальных внебольничных пневмоний у взрослых // Пульмонология. 2008. № 6. С.
53–56.
- Максимов В. И. Родоман В. Е., Бондаренко В. М. Лактулоза и
микроэкология толстой кишки // Журн. микробиол. 1998. № 5. С. 101–107.
- Рачина С. А., Козлов Р. С., Шаль Е. П. Анализ практики лечения
амбулаторных пациентов с внебольничной пневмонией: какие факторы определяют
предпочтения врачей? // Российские медицинские вести. 2010. № 2.
- Синопальников А. И., Чикина С. Ю., Чучалин А. Г. Внебольничная
пневмония у взрослых: современные подходы к диагностике, антибактериальной
терапии и профилактике // Пульмонология. 2008. № 5. С. 15–50.
- Современные аспекты фармакотерапии гастроэнтерологических заболеваний
Сборник избранных научно-медицинских статей журнала «Фарматека» / Под
редакцией И. В. Маева. М.: Издательский дом «Бионика», 2012. 264 с.
- Стецюк О. У., Козлов Р. С. Безопасность и переносимость
антибиотиков в амбулаторной практике // Клин микробиология и антимикробная
химиотерапия. 2011. Т. 13. № 1.
- Черников В. В., Сурков А. Н. Антибиотик-ассоциированная диарея у
детей: принципы профилактики и лечения // Вопросы современной педиатрии. 2012.
№ 12. С. 48–55.
- Чучалин А. Г. и др. Внебольничная пневмония у взрослых:
практические рекомендации по диагностике, лечению и профилактике //
Клиническая микробиология и антимикробная химиотерапия. 2010. Т. 12. № 3. С.
186–226.
Статья опубликована в журнале
Лечащий Врач

