Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Паллиативное лечение неоперабельных стенозов пищевода с
использованием стентов
M. Kocher, M. Diouhy, С. Neoral, A. Gryga, M. Duda, E. Buriankova, R.
AujeskyРезюме
Авторы исследования оценивали эффективность паллиативного лечения
неоперабельного стеноза пищевода с помощью самораскрывающихся стентов в
группе из 102 пациентов и возможные осложнения. У всех пациентов, которым
был имплантирован стент, способность глотать улучшилась как минимум на 2
пункта. 89 пациентов из исследуемой группы умерли, средняя продолжительность
периода выживаемости составила 107 дней. На момент проведения оценки в живых
осталось 13 пациентов, для них средняя продолжительность периода
выживаемости составила 175 дней. Что касается осложнений, авторы
исследования отметили неполное раскрытие стента (n=l), трещина опухоли (n=l),
смещение стента (n=8), декубитальный пищеводно-респираторный свищ (n=4),
прорастание опухоли в стент (n=4), обструкция стента едой (n=7) и
артериальное кровотечение (n=l).
Эффективность паллиативного лечения неоперабельного рака пищевода при
помощи самораскрывающихся стентов высока и улучшение наступает быстро. Общее
количество осложнений - 22%, смертность после операции равна нулю.
Большинство осложнений можно быстро исправить рентгенохирургическими
методами.
ВВЕДЕНИЕ
Нарушение прохождения пищи через пищевод в результате воздействия
злокачественных или доброкачественных новообразований - это состояние,
которое значительно ухудшает субъективные ощущения пациента, а также
является причиной недостаточного питания таких больных. Радикальное
хирургическое вмешательство является основополагающим для долгосрочных
перспектив для больных, особенно для больных со злокачественными
заболеваниями. Большую группу неоперабельных больных, состояние которых
ухудшалось, лечили паллиативно. Паллиативное лечение больных с
неоперабельным стенозом пищевода с помощью стентов очень распространено на
сегодняшний день (9,11,15,17,19,20), т.к. ранее проводимые виды
паллиативного лечения сопровождались высокой болезненностью и смертностью.
Целью нашего исследования было оценить группу из 102 больных, которым были
имплантированы пищеводные стенты в качестве паллиативной меры. Мы бы хотели
заострить внимание на осложнениях и путях их разрешения.
МАТЕРИАЛЫ И МЕТОДЫ
В Olomouc с 1993 проводились имплантации пищеводных стентов (5).
Показаниями к имплантации стента были: неоперабельные карциномы пищевода и
кардии, исключая терминальные состояния заболевания, пищеводно-респираторные
свищи, некоторые стенозы доброкачественной природы, постоперативные стенозы
не поддающиеся расширению с помощью баллонного катетера, реканализация
опухоли перед радиотерапией и окончательная экстирпация.
Стадия опухоли и операбельность определялась с помощью эндосонографии, КТ
или МРТ. Оценивалась величина опухоли, положение относительно окружающих
тканей и органов и их поражение опухолью, вовлечение в процесс регионарных и
дистантных лимфатических узлов и наличие отдалённых метастазов.
Стенты вводились под скиаскопическим контролем под местной анестезией
(3,17,12). Для успешной имплантации стента необходимо было предварительно
расширить просвет пищевода как минимум до ширины проводника (для наших
стентов это 8-10 мм). Это необходимо для успешного удаления проводника после
окончания имплантации. Длина стента выбиралась таким образом, чтобы
каудальный и краниальный концы выступали как минимум на 3 см за края
стеноза. Когда введение проводника закончено, в область стеноза вводится
стент с установочной системой. После раскрытия стента и удаления проводника,
стеноз ещё раз расширяется стентом (11). Полное раскрытие стента
непосредственно после его ведения вовсе не обязательно. Стент будет
постепенно раскрываться в течение последующих 48 часов. При контрольном
обследовании сразу после имплантации, мы проверяли проходимость стента и
выявляли возможные осложнения, такие как трещины пищевода.
1/3 стентов, имплантированных в нашем отделении (n=37) были стенты
Nitinol Strecker диаметром 18 мм. Верхний край длиной 5 мм расширялся до 20
мм. У этих стентов отличная продольная гибкость, они устойчивы к образованию
петель и, не смотря на то, что они кажутся хрупкими, могут расширить даже
очень плотные стенозы. Более старые, непокрытые модели этих стентов не могут
быть использованы при свищевых карциномах. С начала этого года в продаже
появились стенты Strecker, с лавсановым покрытием, которые можно
использовать и при эзофагореспираторных свищах.
Мы используем стенты Ella из стального сплава для паллиативного лечения
неоперабельных опухолей пищевода и кардии с марта 1995 года. Эти стенты
покрыты лавсаном или полиуретаном. Ширина стентов 20 мм, а верхние 2 см
расширяются до 30 мм в виде воронки. Широкая воронка предотвращает смещение
стента и застой пищи в престенотическом расширенном участке прищевода выше
стента. С 1995 года мы имплантировали 81 стент 72 пациентам.
РЕЗУЛЬТАТЫ
С августа 1993 до августа 1997 у нас проходили лечение 102 пациента,
которым мы в общей сложности имплантировали 118 стентов, 37 стентов Strecker
35 пациентам и 81 стент Ella 72 пациентам.
Имплантация стента была неудачной у одного из 102 пациентов из-за того,
что верхняя часть стента не расширилась по причине промышленного дефекта. У
всех остальных пациентов глотательный тест и с использованием контрастного
вещества, выполненный сразу же после имплантации показал удовлетворительную
проходимость пищевода в месте обструкции или стеноза. У этих пациентов мы
наблюдали существенное улучшение симптоматики. У всех больных с 3 или 4
стадией дисфагии после имплантации этот показатель улучшился минимум на 2
пункта.
89 пациентов на момент оценки умерли. Средняя выживаемость составила 107
дней. На момент обработки данных для этого доклада, были живы 13 пациентов,
у них средняя длительность выживаемости составила 175 дней после имплантации
стента (максимум 285 дней).
Количество осложнений крайне невелико. В одном случае стент не полностью
раскрылся в своей верхней части (0,8%) (Рис. 1), что было вызвано
промышленным браком.
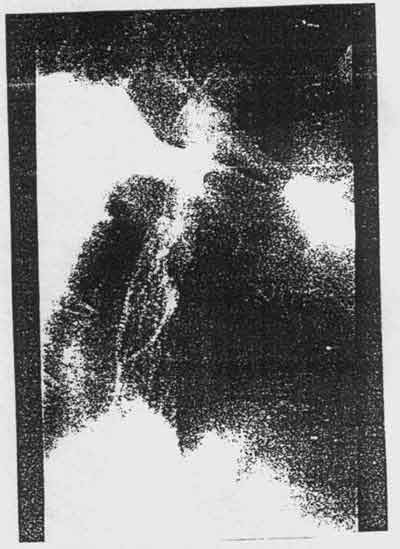
Рис. 1 Неполное раскрытие верхней части стента.
После неудачных попыток рентгенологическими или эндоскопическими
способами раскрыть стент, пришлось провести хирургическое вмешательство и
посредством гастротомии извлечь нераскрытый стент при помощи бужа. У другого
пациента (0,8%) (Рис. 2) появился свищ, связанный с имплантацией стента.
Наблюдалось выхождение небольшого количества контрастного вещества их
просвета анастомоза. За образованием свища не последовало никаких
клинических проявлений, и при последующих исследованиях свищ обнаружен не
был. Не было летальных случаев, связанных с имплантацией стентов. В течение
последующего периода у 8 пациентов наблюдалось аборальное смещение стента
(6,4%) (Рис. 3).

Рис. 2 Контрастное исследование пищевода сразу после имплантации стента
показывает локальную утечку контрастного вещества в месте
пищеводнотощекишечного анастомоза, подвергшегося воздействию
рецидивировавшей карциномы.
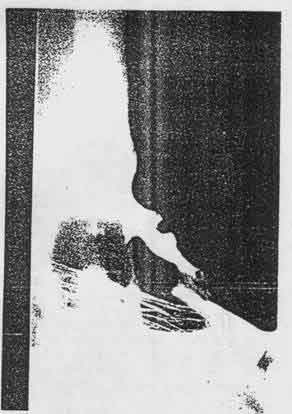
Рис. 3 Стент, лежащий в желудке.
В семи случаях произошло смещение спирального стента Ella Z, покрытого
полиуретаном и в одном случае произошло смещение спирального стента Ella Z,
покрытого лавсаном. У четырёх пациентов (3,2 %) (Рис. 4) мы выявили позднее
образование эзофаготрахеальных или эзофагобронхиальных декубитальных свищей,
которые были закрыты при имплантации покрытых полиуретаном стентов.
Клинические симптомы быстро уменьшились, и пациенты смогли проглотывать
жидкости и жидкую пищу (Рис. 5).
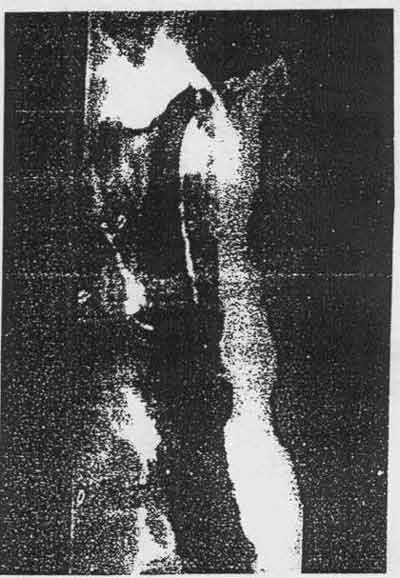
Рис. 4 48-летний пациент с эзофаготрахеальным свищом, образовавшимся при
воздействии верхней части стента через 2 месяца после имплантации по поводу
неоперабельной карциномы.

Рис. 5 Тот же пациент, что и не Рис.4. Эзофагограмма, сделанная сразу же
после имплантации стента с полиуретановым покрытием. Свищ закрыт,
контрастное вещество не просачивается в дыхательные пути.
Кроме того, мы выявили у 11 пациентов эзофагореспираторные свищи,
образовавшиеся в связи с прогрессированием заболевания и распада карциномы.
Но эти случаю не были напрямую связаны с лечением и поэтому мы не включили
это в список осложнений.
Обструкция стента пищей имела место в 7 случаях (5,6%). Проходимость
стента была во всех случаях восстановлена при помощи дилатационным баллонным
катетером под скаскопическим контролем или эндоскопически.
Обструкция вследствие прорастания опухоли было выявлено у 4 пациентов
(3,2%). У 3 больных стоял непокрытый нитиноловый стент Strecker (Рис. 6) и у
одного пациента стент Ella с лавсановым покрытием.
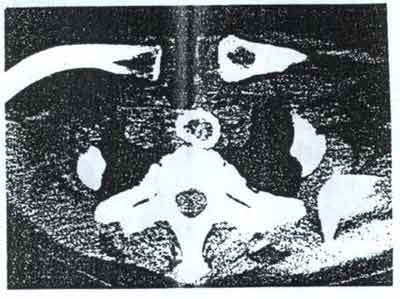
Рис. 6. Прорастание карциномы через ячейки непокрытого стента хорошо
видно на КТ.
ОБСУЖДЕНИЕ
Паллиативное лечение дисфагии при неоперабельной карциноме пищевода или
рецидиве карциноме на месте анастомоза - важная проблема, требующая решения.
Таким пациентам обычно назначают актинотерапию, расширение баллонным
катетером или бужем или различные паллиативные хирургические операции.
Отдельная актинотерапия или расширение дают довольно краткосрочный и слабый
эффект (1,2). При использовании пластиковых эндопротезов процент осложнений
доходил до 36%, включая до 20% смещений и 16% смертельных исходов (8,10).
Выполнение анастомоза - слишком сложная и тяжёлая операция, смертность после
которой составляет 30% (14,16). С 1993 года мы направляем пациентов с
неоперабельными процессами пищевода и кардии на стентирование. До
наступления эры самораскрывающихся стентов, мы боялись расширять стенозы
злокачественной природы (4,6,12,18). С начала выпуска стентов был только 1
случай образования свища карциномы. Свищ был закрыт и не требовал дальнейших
вмешательств. В сравнении с простым расширением, при имплантации стента
существенно снижается количество образующихся пищеводных свищей, т.к. стент
расширяется постепенно. При расширении баллонным катетером, баллон
необходимо надувать быстро, стент же совсем не обязательно быстро расширять.
Достаточно расширить стент до диаметра проводника. Постепенное раскрытие
стента - его большое преимущество. Мы полагаем, что это снижает риск
возникновения свищей. Стенты Ella (спиральные стенты Z) покрыты либо
лавсаном, либо полиуретаном. Наше следующее исследование покажет, какой из
этих материалов больше подходит для использования при неосложнённых
злокачественных стенозах. Преимуществом полупроницаемого лавсана мы считаем
то, что он сохраняет жизнеспособность тканям, повергающимся давлению стентом
и обеспечивает их связь с просветом пищевода. Плотность этого синтетического
материала не позволяет карциноме прорасти в просвет стента. Стенты с
полиуретановым покрытием однозначно показаны к применению при
эзофаготрахеальных или эзофагобронхиальных свищах (9,13). Смещение стента мы
выявили при использовании непокрытых стентов Strecker. Смещение стентов Ella
имело место у 8 больных. В 7 случаях это были стенты с полиуретановым
покрытием и в одном случае с лавсановым. Таким образом, можно сделать вывод,
что полупроницаемый лавсан не только предотвращает прорастание карциномы в
просвет пищевода, но также обеспечивает лучшую удержание и фиксацию стента к
стенке пищевода, что предотвращает смещение. В литературе мы нашли данные о
более частых смещениях покрытых стентов (15). У четырёх пациентов после
имплантации стентов мы обнаружили появление эзофагореспираторных
декубитальных свищей. Свищ появлялся у верхнего края стента, при этом не
наблюдалось прогрессирования в развитии карциномы. Эндоскопическое
исследование показало декубитальную природу свища в части пищевода, не
поражённой карциномой. Возможно, некроз и последующее образование свища было
спровоцировано увеличившимся давлением верхней части стента на стенку
пищевода. По той же причине у одного пациента началось массивное
кровотечение (из сонной артерии), которое закончилось летально. Прорастание
карциномы в просвет стента - сравнительно частое явление для непокрытых
стентов, что подтверждено как литературными данными, так и результатами
нашего исследования (15). Обструкция стента пищей имела место у
недисциплинированных пациентов, которые не соблюдали правила приёма пищи.
ВЫВОДЫ
В сравнении с другими паллиативными мерами, имплантация стента является
простой и быстрой, кроме того, она даёт хорошие результаты по восстановлению
глотания. Нет необходимости выполнять операцию и вводить пациента в общий
наркоз. Количество осложнений очень мало, по нашим данным из 118 пациентов,
которым были имплантированы стенты, осложнения развились у 22%, а смертность
равнялась нулю. При использовании рентгенохирургических методов эти
осложнения могут быть легко разрешимы.
Литература:
1. Albertsson, M., Ewerst, S. В., Widmark, H.: Evaluation of the
palliative effect of radiotherapy for esophageal carcinoma.
Acta0ncol.,28,1989,s. 267-270.
2. Barr, H., Krassner, N.. Raouf, A., Walker, R. J.: Prospective randomised
trial of laser therapy only and laser therapy followed by endoscopic
intubation for the palliation of malignant dysphagia. Gut, 31, 1990, s.
252-258.
3. Cwikiel, W. Stridbeck, H" Tranberg, K. G. et al.: Malignant esophageal
strictures: treatment with a selfexpanding nitinol stent. Radiology, 187,
1993, s. 661-665.
4. Dawson, L. S., Mueller, p. R., Ferrucci, J. T. et al.: Severe esophageal
strictures: indications for balloon catheter dilatation. Radiology, 153,
1994, s. 631-635.
5. DIouhy, M" Кбспег, M., Duda, M., Gryga, A.: New possibilities of
miniinvasive treatment of esophageal stenoses. Acta Univ. Palacki Olomouc,
Fac Med., 138, 1994,s. 69-72.
6. DIouhy, M., Кбспег, M., Herman, J. et al.: Dilatacnf lecba onemocneni
jicnu. 6s. Gastroenterol. Vyz., 47, 1993,s. 213-217.
7. Ell, C., May, A., Hahn, G.: Gianturco-Z stent in the palliative treatment
of malignant esophageal obstruction and esophagotracheal fistulas. Endoscopy,
27, 1995, s. 495-500.
8. Fugger, R., Niederle, В., Jantsch, H., Schiessel, R.,Schultz, F.:
Endoscopic tube implantation for the palliation of malignant esophageal
stenosis. Endoscopy, 22,1990, s. 101-104.
9. Han, Y. M., Song, H. Y., Lee, J. M. et al.: Esophagorespiratory fistulae
due to esophageal carcinoma: Palliation with covered Gianturco stent
Radiology, 199, 1996, s. 65-70.
10. Chisholm, R. J., Stoller, J. L., Carpenter, C. M.: Radiologic dilatation
preceding surgical tube placement for esophageal cancer. Am. J. Surg., 151,
1986, s. 397-:->99.
11. Keener, M. DIouhy, M.: L6cna sten6z jicnu nitinolovymi stenty. Ces.
Radiol., 49, 1995 s. 219-224.
12. La Berge, J. M" Kerlan, R. K., jr., Pogany, A. C., Ring, E. J.:
Esophageal rupture: complications of balloon dilatation. Radiology, 157,
1985, s. 56.
13. Mucci, В.: Oesophageal ruptures complicating balloon dilatation of
strictures: a report of two cases. Br. J. Radiol., 64, 1991, s. 1060.
14. MOIIer, J., Erasmi, H., Steizner, M., Zieren, U" Pichlmeier, H.:
Surgical therapy of esophageal carcinoma. Br. J. Surg., 77, 1990, s.
845-857.
15. Saxon, R. R., Barton, R. E" Rosch, J.:Complication of esophageal
stenting and balloon dilatation. Semin. Intervent. Radiol., 11, 1994, s.
276-282.
16. Sawant, D., Moghishi, K.: Management of unresectable esophageal cancer:
A review of 537 patients. Eur. J. Cardiothorac. Surg., 8, 1994, s. 113-117.
17. Song, H. Y., Choi, K. Ch., Cho, B. H., Ahn, D. S.,Kirn, K. S.:
Esophagogastric neoplasmus: palliation with a modified Gianturco stent.
Radiology, 80, 1991, s. 349-354.
18. Starck, E., Paolucci, V" Herzer, M., Crummy, A.В.: Esophageal stenosis:
tratment with baloon catheters. Radiology, 153, 1984, s. 637-640.
19. Vaiek, V" Vomela, J., Benda, K. et al.: Lecbanemocnych s inoperabiini
maligni sten6zou jicnu zavedenim expandibilnfho kovoveho stentu. Ces. Radiol.,
50, 1996, s. 241-247.
20. Watkinson, A. F., Ellul, J., Entwisle, K., Mason, R. C., Adam, A.:
Esophageal carcinoma: initial results of palliative treatment with covered
self-expanding endoprotheses. Radiology, 195, 1995, s. 821-827.

