Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Helicobacter pylori – друг или враг?
M.J. Blaser, Yu Chen, J. Reibman, Нью-Йорк, США
Науке известно множество примеров, когда какая-либо бактерия на протяжении
тысячелетий обитает в организме определенного вида позвоночных.
Род Helicobacter включает спиралевидных, очень подвижных, уреазоположительных
грамотрицательных бактерий, колонизирующих желудок многих млекопитающих. Каждое
млекопитающее имеет один или больше доминантных видов Helicobacter, которые, в
свою очередь, являются высокоспецифичными для вида хозяина или даже могут
колонизировать исключительно один вид. Это согласуется с гипотезой о том, что
когда около 150 млн лет назад из рептилий произошли первые млекопитающие, они
содержали в себе древние хеликобактерии, которые эволюционировали вместе со
своими хозяевами. Согласно этой гипотезе хеликобактерии являются потомками
древних бактерий, колонизировавших желудок млекопитающих. H. pylori – штамм
хеликобактерий, адаптировавшихся к человеку, который ни в природных, ни в
лабораторных условиях не может существовать в организме других животных, включая
приматов.
Мы не можем точно знать, как долго H. pylori присутствовала в желудке
человека. Предположительно, предшественники этого микроорганизма возникли в то
время, когда от приматов произошли предки современного человека – то есть около
4 млн лет назад. В пользу этого предположения служат результаты
филогеографических исследований; все они единогласно указывают на то, что наши
предки уже имели желудочную H. pylori, когда группа людей, в конечном итоге
населившая большую часть мира, покинула Африку (более 58 тыс. лет назад). Во
всяком случае, точно известно, что H. pylori колонизировала желудок человека уже
во времена Палеолита.
В этой статье мы предлагаем читателям ознакомиться с доказательствами наличия
связи между этим древним членом микробиоты человека (и в особенности его
отсутствием) и недавно начавшейся и продолжающейся эпидемией астмы и других
аллергических заболеваний. Мы также обсудим предположение о том, что
исчезновение H. pylori стимулирует распространенность аллергических заболеваний,
а колонизация желудка H. pylori – защищает человека от них.
Приобретение и персистенция H. pylori
Человек приобретает H. pylori в раннем детстве, обычно после первого года
жизни. Путь передачи – фекально-оральный, орально-оральный и рвотно-оральный.
После попадания в желудок, в отсутствие приема антибиотиков, H. pylori
персистирует на протяжении десятилетий, а в большинстве случаев – в течение всей
жизни хозяина. Штаммы H. pylori обладают значительной вариабельностью, при этом
на взаимодействие макроорганизма и бактерий влияют различные участки генов H.
pylori. Например, штаммы с интактным участком cag вставляют белок CagA в
эпителиальные клетки желудка хозяина.
На протяжении большей части своей истории человек жил в небольших родственных
группах, при этом микробиота свободно смешивалась между отдельными членами
группы. В условиях отсутствия какой-либо гигиены, которые также преобладали в
истории существования человека, передача желудочно-кишечных микробов
осуществлялась очень легко. Сегодня в развивающихся странах, где санитария не
достигла уровня стран Запада, H. pylori является убиквитарной:
распространенность у взрослого населения составляет около 80%, при использовании
нескольких методов диагностики – до 100%. В популяциях с высокой
распространенностью H. pylori часто наблюдается колонизация желудка несколькими
штаммами этого микроорганизма.
H. pylori исчезает
Несмотря на неопровержимые доказательства древности и убиквитарности
колонизации H. pylori у людей, сегодня можно говорить о том, что
распространенность H. pylori быстро снижается. Это следствие так называемого
эффекта поколения, начавшегося в начале ХХ века во многих развитых странах и
усилившегося после Второй мировой войны. Этот эффект настолько выраженный, что
сегодня в США и других индустриализованных странах положительны по H. pylori
менее 10% детей в возрасте до 10 лет по сравнению с историческим уровнем 70-90%.
В результате такого изменения, наблюдаемого в разных странах в различной
степени, стало возможным определить факторы риска приобретения H. pylori. К ним
относятся большая семья (количественно); родители (особенно мать) – носители H.
pylori; брат или сестра, положительные по H. pylori; тесные условия проживания в
детстве.
Таким образом, после того как исчезновение H. pylori началось, его следствия
будут ощущать на себе все последующие поколения людей, особенно если вода будет
становится чище, семья – меньше, а питание – лучше.
К еще одному явлению, несомненно, вносящему вклад в исчезновение H. pylori,
можно отнести широкое использование антибиотиков, особенно в раннем детском
возрасте. Чтобы надежно искоренить H. pylori – а именно это означает английское
слово eradicate, – сегодня необходима комбинация двух-четырех антибактериальных
препаратов, однако в ранних исследованиях с применением монотерапии, в том числе
b-лактамными антибиотиками и макролидами, частота
успешной эрадикации составляла 10-50%. С учетом того, что такой эффект
происходит каждый раз, когда ребенок получает лечение антибиотиками по поводу
инфекции верхних дыхательных путей, инфекции кожи или среднего отита, снижение в
развитых странах распространенности H. pylori у детей объяснить не трудно.
Следствия наличия и отсутствия H. pylori
Сравнивая людей с этим микроорганизмом и без него, ученые изучали пользу
и вред от носительства H. pylori. Первым наблюдением было то, что обитание H.
pylori в желудке связано с присутствием в собственной пластинке фагоцитирующих и
иммунных клеток. Ассоциацию H. pylori с данными гистологическими наблюдениями,
описанную Уорреном и Маршаллом, патологи назвали «хроническим гастритом».
Наличие клеток воспаления привело к использованию терминов, подразумевающих
патологический процесс. Однако, по мнению авторов данной статьи – биологов по
образованию, скопление иммунных и воспалительных клеток в ткани следует
расценивать как физиологический ответ на индигенную микробиоту (ФОИМ). Таким же
образом собственные пластинки рта, влагалища и толстой кишки млекопитающих
населены фагоцитирующими и иммунологическими клетками, реагирующими на местную
микрофлору. Безмикробные животные, напротив, вообще не имеют фагоцитирующих и
иммунных клеток в собственных пластинках слизистых; восстановление нормальной
микрофлоры у таких животных возвращает и эти клетки, что в комплексе
расценивается как нормальная гистопатологическая картина.
Проблема с обозначением ответа макроорганизма на H. pylori как «хронический
гастрит» заключается не в самом термине, который является правильным, а в
интерпретации указанных наблюдений как патологических. Но, по меньшей мере, одна
составляющая ФОИМ – патологическая, так как связана с увеличенным риском
развития пептической язвы, аденокарциномы и лимфомы желудка. CagA положительные
штаммы, в значительной степени взаимодействующие с макроорганизмом, вызывают
наибольший ФОИМ и больше всего увеличивают риск формирования язвы и карциномы.
Таким образом, хеликобактерии и ответ, который они вызывают, связаны с риском
заболеваний и даже смерти. Снижение распространенности новообразований желудка,
язвы желудка и двенадцатиперстной кишки, наблюдаемое в ХХ веке, согласуется со
снижением распространенности H. pylori.
В то же время становится все более очевидной обратная связь между H. pylori и
гастроэзофагеальной рефлюксной болезнью (ГЭРБ) и ее осложнениями, в том числе
пищеводом Барретта и раком пищевода. Хотя ФОИМ является фактором риска развития
пептической язвы и рака желудка, он защищает от ГЭРБ и рака пищевода, причем
CagA положительные штаммы, активно взаимодействующие с человеком, проявляют
наиболее выраженный протективный эффект. Здесь имеет место пример взаимодействия
макро- и микроорганизма, которое в одних случаях может способствовать развитию
патологии, а в других – защищает от нее. Легче всего эту концепцию объясняет
понятие, введенное Розбери, – «амфибионт», то есть микроорганизм, который в
зависимости от определенных условий может быть как патогеном, так и симбионтом.
Явление «амфибиоза» можно использовать и для описания нашей индигенной
микробиоты; например, b-гемолитические стрептококки,
обитающие в ротовой полости, защищают человека от патогенных бактерий, однако
также могут вызывать эндокардит.
Влияние H. pylori на физиологию человека
Желудок – орган, выполняющий множество функций; H. pylori и
физиологический ответ на H. pylori влияют, по меньшей мере, на три из них.
Во-первых, желудок секретирует кислоту. Этот процесс находится под сложным
регулирующим контролем, который осуществляется при помощи автономной иннервации,
нейроэндокринных пептидов, гастрина и соматостатина. Доказано, что H.
pylori-статус влияет на этот гомеостаз.
Во-вторых, желудок обладает адаптивной иммунологической активностью, которая
выражается в функциях Т- и В-клеток. H. pylori-положительные и H.
pylori-отрицательные желудки иммуннологически разные, и в отношении не только
связанных с H. pylori, но и системных эффектов. В частности, персистенция H.
pylori сопровождается намного большей концентрацией регуляторных Т-клеток.
В-третьих, желудок продуцирует лептин и является основным местом образования
грелина. Эти нейроэндокринные пептиды играют важную роль в энергетическом
гомеостазе млекопитающих, и появляется все больше данных в пользу того, что H.
pylori-статус влияет на их регуляцию.
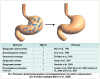
Таким образом, становится очевидно, что в развитых странах вырастают
поколения детей, не имеющих H. pylori, которая регулирует эти и другие
физиологические функции. Естественно предположить, что изменение секреции
кислоты, иммунологической активации и нейроэндокринной регуляции будет иметь
различные последствия.
Связь с астмой и аллергическими состояниями
В последние годы в развитых странах отмечается стабильный рост
заболеваемости бронхиальной астмой (БА), аллергическим ринитом и атопическим
дерматитом. Разительное увеличение распространенности атопических состояний во
всех возрастных категориях должно быть связано с факторами окружающей среды, в
том числе такими, как курение, загрязнение воздуха, аллергены, экзогенные
инфекции, ожирение.
Однако, кроме экзогенных причин, существуют и эндогенные, связанные с
изменением нашей индигенной микробиоты. И в этом контексте логично вспомнить про
H. pylori, так как ее исчезновение хорошо доказано документально и происходит в
мировом масштабе. Более того, исчезновение H. pylori предшествовало росту
заболеваемости бронхиальной астмой. Однако связаны ли эти события?
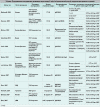
В таблице приведены результаты 12 недавно завершившихся популяционных
исследований, в которых изучали взаимосвязь между H. pylori и бронхиальной
астмой, атопией, аллергическим ринитом и/или дерматитом. Все авторы выявили
значительную обратную связь между этими состояниями и H. pylori. Опубликованные
исследования «случай-контроль», как правило, намного меньшие по масштабу, не
показали какой-либо значимой прямой или обратной связи. Однако в одном
исследовании «случай-контроль», проведенном нами в Нью-Йорке, обнаружена
обратная связь между H. pylori, особенно cagA+ штаммами, и астмой и атопией.
Чтобы подтвердить или опровергнуть результаты указанных популяционных
исследований, мы ретроспективно проанализировали два других проведенных нами
исследований.
Масштабное исследование National Health and Nutrition Survey (NHANES) III
проводилось между 1988 и 1994 годами. В середине 1990-х были выполнены
серологические исследования материала, полученного от более 10 тыс. участников
исследования, причем лаборанты и статисты не знали, была ли у пациента астма или
атопия. В 2006 г. было доступно 7663 записей, содержащих информацию об астме и
H. pylori-статусе. Отмечена обратная связь между наличием бронхиальной астмы и
cagA+ штамма H. pylori (снижение риска БА на 21%) с наиболее выраженной
корреляцией у участников в возрасте ниже среднего в популяции исследования (43
года; снижение риска БА на 37%) и ее отсутствием у пожилых пациентов. Подобным
же образом наиболее мощная обратная связь отмечена у пациентов, у которых БА
началась в возрасте до 15 лет (снижение риска на 37%); при более позднем начале
БА связь отсутствовала.
Подводя итоги анализа исследования NHANES III, можно увидеть обратную связь
между H. pylori, особенно cagA+ штаммами, и бронхиальной астмой и связанными с
ней аллергическими расстройствами, особенно у молодых пациентов с ранним началом
заболевания.
Основываясь на полученных результатах, мы провели независимую оценку этой
связи, используя данные следующего исследования NHANES (1999-2000). В этом
исследовании принимали участие 7412 пациентов, для которых был известен
аллергологический анамнез и H. pylori-статус (тестирование по cagА не
проводили). Средний возраст пациентов был 25 лет. С учетом полученных раннее
результатов относительно раннего начала БА особое внимание мы уделили пациентам
в возрасте 20 лет и младше. В результате была обнаружена значительная обратная
связь между H. pylori-положительным статусом и ранним началом астмы и
аллергического ринита у детей и подростков в возрасте до 20 лет, а также
наличием астмы на момент исследования у детей в возрасте от 3 до 13 лет. Также
H. pylori обратно коррелировала с наличием свистящего дыхания, аллергического
ринита, дерматита и сыпи.
Таким образом, эти два независимые масштабные популяционные исследования
показали высоко последовательные результаты, дополняющие полученные ранее данные
относительно протективной роли H. pylori.
Биологические предпосылки протективной роли H. pylori в отношении
бронхиальной астмы
H. pylori-статус может быть причинно связан с БА и другими аллергическими
состояниями таким образом, что лица, колонизированные H. pylori, имеют
определенную защиту от БА. В пользу этого предположения можно привести ряд
известных фактов.
На протяжении многих лет наблюдается одна и та же тенденция: H. pylori
исчезает, заболеваемость БА растет; противоположный эффект H. pylori
маловероятен.
Важным является тот момент, что снижение распространенности H. pylori,
которое началось в начале ХХ века, предшествовало увеличению заболеваемости БА.
Ни одно из эпидемиологических исследований, позволяющих оценить данную связь, не
было проспективным. Несмотря на это, вероятность того что БА и другие
аллергические состояния могут сами приводить к исчезновению H. pylori, очень
мала. После колонизации в раннем детском возрасте, в отсутствие лечения
антибиотиками, H. pylori персистирует в течение десятилетий, а то и всей жизни
человека.
Существует «дозозависимая» связь между воздействием H. pylori и
аллергическими заболеваниями.
Исследования различных штаммов H. pylori выявили наиболее сильное влияние
cagА+ штаммов в отношении как риска заболевания (пептическая язва, рак желудка),
так и защиты от заболевания (ГЭРБ, рак пищевода). Такой же «дозозависимый»
ответ, как при ГЭРБ, наблюдается и при БА: cagA+ штаммы показывают наиболее
сильную обратную связь.
H. pylori в большей мере связана с манифестацией атопии в детском
возрасте, когда происходит формирование иммунитета.
Мощная обратная связь с H. pylori имеет место для астмы и других
состояний аллергического (атопического) спектра. Обратная связь с H. pylori
сильнее выражена для бронхиальной астмы с началом в детском возрасте, этиология
которой отличается от таковой при БА с манифестацией во взрослом возрасте.
Детская астма часто проходит в подростковом возрасте, хотя часть пациентов,
вошедших в ремиссию, в дальнейшем могут иметь рецидивы. Эффект H. pylori может
быть меньше выражен в отношении БА с поздним началом, так как факторы риска в
этом случае более неоднородны, чем при детской астме; заболевание имеет более
сложный патогенез, который может отягощаться воздействием факторов внешней среды
(курение, профессиональные вредности). Наконец, у взрослых чаще имеет место
ошибочная диагностика БА-статуса и H. pylori-статуса. Так как эта диагностика
проводится независимо друг от друга, она не является дифференциальной, что при
статистической оценке сводит вероятность смещения к нулю.
Обратная связь между H. pylori и БА согласуется с результатами,
полученными в двух масштабных исследованиях NHANES; каких-либо других гипотез,
которые бы объясняли наблюдаемую корреляцию, нет.
Одно из возможных объяснений состоит в том, что H. pylori-статус, хотя и
связанный с БА, на самом деле является лишь маркером какого-то другого явления.
Например, антибиотикотерапия в раннем детском возрасте приводит к эрадикации не
только H. pylori, но и других микроорганизмов, которые являются истинными
факторами защиты. В настоящее время каких-либо данных в пользу этого
предположения не получено.
В ряде исследований, в которых изучали несколько инфекций, был установлен их
аддитивный эффект в этиологии БА. Кроме того, обратная связь между H. pylori и
БА не зависит от социально-экономического положения, возраста, пола, этнического
происхождения, курения и вирусного гепатита А.
Существуют механизмы, которые объясняют протективный эффект H. pylori.
В настоящее время накоплено достаточно данных о защитной роли H. pylori
(особенно cagA+ штаммов) в отношении астмы и других атопических состояний (см.
ниже).
Механизмы, благодаря которым колонизация H. pylori желудка может влиять на
риск бронхиальной астмы
На сегодня уже доказано, что физиология желудка у H. pylori-положительных
и отрицательных лиц значительно различается. При этом значение имеют несколько
взаимосвязанных механизмов.
Во-первых, H. pylori, фактически защищая от ГЭРБ, может защищать и от
бронхиальной астмы, так как у части пациентов БА развивается вследствие ГЭРБ.
Однако этого механизма недостаточно, чтобы объяснить протективную роль H. pylori
в отношении аллергического ринита и атопического дерматита.
В-вторых, сочетание БА, атопии, аллергического ринита и сенситизации кожи
предполагает иммунологическую медиацию. H. pylori-положительные лица имеют
популяцию иммуноцитов, включая регуляторные Т-клетки, которая в большой мере или
вообще отсутствует у H. pylori-отрицательных лиц. Эти клетки могут проявлять
системную иммуномодулирующую активность. Недавние исследования выявили
взаимосвязь между колонизацией H. pylori и инфекцией Mycobacterium tuberculosis
– колонизация сопровождалась длительным поддержанием туберкулезной инфекции в
латентном состоянии, что является еще одним подтверждением системной
иммуномодулирующей роли H. pylori.
Третий механизм может быть связан с эффектами H. pylori-индуцированного
воспаления на уровень гастральных гормонов. Лептин и грелин не только регулируют
энергетический гомеостаз, но и проявляют иммуномодулирующую активность.
Появляется все больше данных в пользу того, что колонизация желудка H. pylori
влияет на продукцию обоих гормонов.
Наконец, определенную роль может играть воздействие H. pylori на автономную
нервную систему, при этом индивидуальные различия могут обусловливать и
различный риск БА.
Выводы
Возможно, впервые за всю историю человечества растет поколение детей, не
имеющих в своих желудках H. pylori – бактерии, которая способствует развитию
иммунной системы, гормональной регуляции энергетического гомеостаза и регуляции
кислотности желудка. Утрата этого древнего, доминантного и неизменного члена
нормальной микробиоты человека, несомненно, будет иметь последствия.
К настоящему времени уже накоплено достаточно данных относительно
положительных и отрицательных эффектов этого явления на состояние
желудочно-кишечного тракта. Основное же внимание ученых направлено на
внекишечные проявления исчезновения H. pylori, включая нарушения энергетического
гомеостаза (ожирение) и бронхиальную астму. Обратная связь между H. pylori и
детской астмой, аллергическим ринитом и атопией становится все более очевидной.
И хотя это может быть лишь вторичным патологическим явлением как часть более
глобального изменения микроэкологии человека, существуют четкие доказательства
биологической роли исчезновения H. pylori в увеличении аллергической
заболеваемости детей. Если H. pylori и, особенно, cagA-статус являются
единственными маркерами риска БА, это можно использовать в клинических и
эпидемиологических исследованиях.
На сегодня понятно, что взаимодействие H. pylori с человеком сложное, в
некоторой степени индивидуальное и до конца не изученное. Врач должен знать, что
колонизация H. pylori снижает риск заболеваний пищевода (в том числе
злокачественных), бронхиальной астмы и атопии, а также, возможно, ожирения и
сахарного диабета, и учитывать это при назначении лечения. Вполне вероятно, что
уже в ближайшие годы после проведения соответствующего фенотипирования и
генотипирования ребенку можно будет выписать рецепт на получение в аптеке
препарата, содержащего один или несколько штаммов H. pylori, колонизация
которыми позволит улучшить его здоровье в течение всей последующей жизни.
Gut 2008;57:561-567
Перевел с англ. Алексей Гладкий
Медицинская газета «Здоровье Украины». 2008. № 6/1 с. 70-71.
Статья опубликована на сайте
http://www.gastroscan.ru

