
Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Лечение печеночной энцефалопатии у онкогематологических больных
В. Б. Ларионова, доктор медицинских наук, профессор
О. А. Коломейцев
ГУ РОНЦ им. Н. Н. Блохина РАМНБлагодаря современной полихимиотерапии (ПХТ), возможность излечения
от гемобластозов (ГБ) сегодня считается доказанной. В настоящее время при
лимфогранулематозе частота достижения полных ремиссий превышает 90%, а при
остром лейкозе составляет 60-70% [2, 8]. Однако негативной стороной полихимиотерапии является то, что большинство цитостатиков обладает низкой
селективностью действия, чем и обусловлено возникновение побочных эффектов
[1, 2, 5, 23, 27]. Побочное действие противоопухолевых препаратов
представляет собой серьезное ограничение, когда речь идет о достижении
максимального лечебного действия у большинства цитостатиков. В полной мере
это утверждение относится и к гепатотоксичности, которая приводит к
печеночной недостаточности (ПН). Клинические наблюдения показывают, что
гепатоэнцефалопатия - весьма распространенное осложнение течения ПН, а при
ее выраженных формах - просто неизбежное. Ухудшение состояния
онкогематологического больного с печеночной недостаточностью может
объясняется рядом причин.
Известно, что основным органом, метаболизирующим большинство цитостатиков,
является печень [24, 30]. Поэтому, когда сам опухолевый процесс негативно
влияет на ее функциональное состояние, введение противоопухолевых препаратов
может оказать кумулятивное токсическое действие [17, 27, 28, 35]. Поскольку
выведение вредных для печени веществ в этих условиях представляется
достаточно проблематичным, остается необходимость стимуляции печеночного
метаболизма. Показано, что развитие опухолевого процесса в организме
сопровождается нарушением всех видов метаболизма [9]. Одной из основных
причин структурно-функциональных нарушений гепатоцитов при гемобластозах
является синдром эндотоксикоза, развивающийся в результате опухолевой
интоксикации, присоединяющихся бактериальных и вирусных инфекций, а также
массивного лизиса опухолевой ткани в ответ на введение противоопухолевых
препаратов [3, 10, 18, 21, 25, 27]. Следует отметить, что цитостатики могут
во много раз усиливать чувствительность к эндотоксину [5].
Важное место в развитии поражения клеточных мембран принадлежит активации
процессов свободного перекисного окисления липидов (СПОЛ), снижению
антиоксидантной защиты и повышению активности лизосомальных ферментов [4, 9,
10].
При печеночной недостаточности все функции печени в той или иной степени
оказываются угнетенными, но, как показывают клинические наблюдения, самое
серьезное - это нарушение ее детоксикационной способности [3, 9, 22]. Это
имеет большое значение для переносимости ПХТ [15]. Центральным участком
собственной системы детоксикации является цитохром Р450, с помощью которого
осуществляется окисление большого числа лекарственных соединений, в том
числе и цитостатиков [30, 37]. Система цитохрома Р450 представлена
семейством гемопротеинов, которые расположены в эндоплазматической сети
гепатоцитов. В настоящее время идентифицированы как минимум 55 изоферментов
системы Р450, каждый из которых кодируется отдельным геном. Превращение
лекарств в печени у человека обеспечивают цитохромы, относящиеся к трем
семействам: Р450 I, II, III. Каждый цитохром способен метаболизировать
несколько лекарств.
Значительная роль в развитии патологических изменений печени принадлежит
также вирусной инфекции, высокий риск развития которой обусловлен частыми
переливаниями компонентов крови [25]. Наличие вирусной инфекции может
существенно затруднять проведение ПХТ и приводит к развитию тяжелых
осложнений, вплоть до летального исхода [11, 25, 27]. Частота встречаемости
вирусных гепатитов В и С до начала лечения гемобластоза составляет 5,9%, в
период ремиссии, после проведения ПХТ - 18,5%, а в отдаленном периоде
лечения - 72%, причем в 38% случаев для последней группы пациентов - в фазе
репликации вируса [7].
Своевременное распознавание и устранение провоцирующих факторов
печеночно-клеточной недостаточности уменьшают риск развития печеночной
энцефалопатии (ПЭ) и имеют большое терапевтическое значение [13]. ПЭ
определяется в качестве потенциально обратимого нарушения функции головного
мозга, возникающего как у больных с хроническими заболеваниями печени, так и
у пациентов с фульминантным острым гепатитом. Имеются многочисленные
гипотезы, объясняющие патогенез печеночной энцефалопатии. Так, в числе
факторов, способствующих ее развитию, называют:
- эндогенные нейротоксины (аммиак, жирные кислоты, фенол, меркаптан);
- «неправильные нейротрансмиттеры» (октопамин);
- изменение нормальных «нейротрансмиттеров» и их рецепторов (GABA,
серотонин).
Повышенная чувствительность рецепторов GABA-бензодиазепина
Аммониегенная теория возникновения ПЭ в настоящее время может считаться
наиболее обоснованной [6]. Диагноз ПЭ устанавливают на основании клинических
симптомов и клинико-лабораторных нарушений функции печени. Степень
выраженности нейропсихических симптомов ПЭ колеблется от I - легкая, до IV -
глубокая кома. Эти симптомы определяются клинически и включают изменения
сознания, интеллекта, поведения и нейромышечные нарушения.
Необходимо подчеркнуть особую важность своевременного распознавания и
лечения латентной печеночной энцефалопатии (ЛПЭ). Клиническая значимость ЛПЭ
объясняется двумя причинами. Во-первых, ЛПЭ может представлять собой стадию,
которая является предвестником последующего развития клинически выраженной
печеночной энцефалопатии [2]. Во-вторых, психомоторные нарушения,
развивающиеся при ЛПЭ, оказывают отрицательное влияние на качество жизни
пациентов [16, 26, 31, 33]. Согласно результатам последних исследований,
распространенность ЛПЭ варьирует от 30 до 84% [22, 32, 38].
Метаболические функции печени в конечном итоге чрезвычайно сложны, и
медикаментозное лечение с применением только одного лекарственного препарата
не представляется возможным. Поэтому разработка и внедрение методов
коррекции нарушений гомеостаза у пациентов с печеночной недостаточностью
представляют важную медико-социальную проблему онкогематологии, решение
которой позволит не только улучшить переносимость ПХТ, но и повысить
качество жизни пациентов в период лечения и реабилитации.
Лечение ПЭ осуществляется по ступенчатой схеме:
- установление и устранение факторов, способствующих развитию печеночной
энцефалопатии;
- диетические мероприятия;
- медикаментозная терапия.
Кроме того, проводят общие мероприятия, к которым относится назначение
постельного режима, что способствует уменьшению образования аммиака в
мышцах.
Диетические мероприятия у больных с ПЭ направлены, с одной стороны, на
ограничение поступления с пищей белка с целью уменьшения образования аммиака
в толстой кишке и снизить степень выраженности гипераммониемии, а с другой -
на обеспечение достаточной калорийности пищи - не менее 1500 ккал/день, что
приводит к снижению интенсивности процессов катаболизма и соответственно к
снижению выраженности гипераммониемии.
В зависимости от направленности специфической медикаментозной терапии,
проводимой при ПЭ, все применяемые лекарственные средства можно разделить на
несколько групп.
- Препараты, уменьшающие образование и абсорбцию аммиака и других
токсинов, образующихся в толстой кишке:
- лактулоза (дюфалак) - 10-30 мл три раза в сутки или лактитол 0,3-0,5
г/кг в сутки. Дозу подбирают индивидуально. Оптимальной считают дозу, при
назначении которой достигается мягкий стул два-три раза в сутки [14].
- антибиотики (рифаксимин, ципрофлоксацин, метронидазол). Эффективность
антибиотиков и лактулозы практически одинакова. Кроме того, антибиотики
быстрее купируют симптомы ПЭ и переносятся лучше лактулозы. Существенным
недостатком лечения антибиотиками является ограниченная продолжительность
их применения (пять-семь дней) [14].
- Препараты, уменьшающие образование аммиака в печени (см. таблицу).
Гранулят растворяют в 200 мл жидкости и принимают после еды. Концентрат для
инфузионного введения растворяют в 500 мл инфузионного раствора.
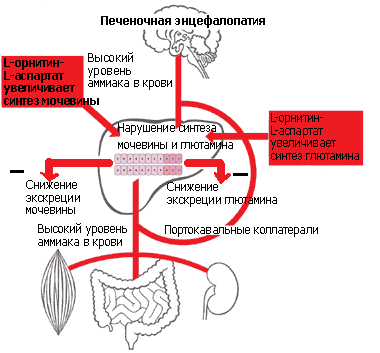
Установлены несколько механизмов гипоаммониемического действия ОА (см.
рисунок 1): орнитин стимулирует в перипортальных гепатоцитах
карбамилфосфатсинтетазу - основной фермент синтеза мочевины; аспартат - в
перивенозных гепатоцитах, мышцах и головном мозге глутаминсинтетазу; орнитин и
аспартат сами являются субстратами цикла синтеза мочевины [12, 24, 29, 34,
36].
- Препараты, связывающие аммиак в крови (натрия бензоат и натрия
фенилацетат). Эти препараты связывают аммиак с образованием гиппуровой
кислоты. Другим механизмом действия, по-видимому, является активирование ими
обмена глутамат/бензоат в перивенозных гепатоцитах.
- Препараты, действие которых направлено на уменьшение тормозных процессов
в ЦНС. К этой группе относится антагонист бензодиазепиновых рецепторов
флумазенил [19].
В отделении химиотерапии гемобластозов РОНЦ им. Н. Н. Блохина РАМН в схемы
интенсивной терапии при печеночно-клеточной недостаточности, развившейся при
полихимиотерапии, были включены препараты, направленные на улучшение
метаболических процессов в печени; в частности, целью настоящей работы явилось
изучение эффективности действия препарата гепа-мерц при лечении больных
гемобластозами с печеночной недостаточностью.
Группу обследуемых составили 24 больных гемобластозами с
печеночно-клеточной недостаточностью. Лечение печеночной недостаточности
включало диетические мероприятия и медикаментозную терапию. Препарат гепа-мерц
назначался в дозе 10-20 г в сутки внутривенно, капельно, в течение 8-14 дней
(в дни кондиционирования и в период после химиотерапии). Гепа-мерц применялся
по следующей схеме.
При ПЭ первой и второй стадий: первый этап - семь внутривенных вливаний по
20 г в день; второй этап - семь внутривенных вливаний по 10 г в день.
При ПЭ третьей стадии - 14 внутривенных вливаний по 20 г в день.
При ЛПЭ - семь внутривенных вливаний по 10 г в день.
Проводился мониторинг уровня трансаминаз, ГГТП, ЩФ, содержания билирубина в
сыворотке крови. Детоксикационная способность печени оценивалась по содержанию
глутатиона (Г) и активности глутатион-S-трансферазы (ГТ) в эритроцитах. Для
объективизации психоневрологических изменений ПЭ применялся тест связи чисел.
В результате проведенных исследований, у 75% больных определена клинически
выраженная ПЭ (I-III ст.), у 25% по выполнению теста связи чисел (>30 с.) -
латентная ПЭ (ЛПЭ). Выявлена прямая корреляционная зависимость между степенью
тяжести проявлений печеночной недостаточности и глубиной нарушений системы
глутатиона (снижением содержания Г и возрастанием активности ГТ).
Эффективность лечения зависела от исходной степени тяжести ПЭ. Нормализация
показателей психометрических тестов отмечена у 50% больных. У остальных
пациентов время выполнения психометрических тестов сократилось на 50-80% по
сравнению с исходными параметрами.
Клиническое состояние начинало улучшаться к 8-14-му дню лечения и
характеризовалось: нормализацией ритма сна или значительным уменьшением
дневной сонливости, улучшением памяти, общего самочувствия, уменьшением
астенического синдрома. Одновременно отмечалась тенденция к снижению
биохимических показателей, характеризующих синдром холестаза и цитолиза
(положительная динамика показателей АЛТ, АСТ, ЩФ, ГГТП, билирубина и
протромбинового времени).
Коррекция состояния печени позволила провести у всех больных
запланированное противоопухолевое лекарственное лечение. По завершении курса
химиотерапии ни у одного пациента не было отмечено ухудшения функции печени.
Полученные результаты свидетельствуют о том, что препарат гепа-мерц
обладает высокой лечебной эффективностью и может быть использован у
онкогематологических больных с печеночной недостаточностью при проведении
цитостатической терапии. Побочные эффекты развиваются редко и не приводят к
необходимости отмены препарата. Эффективность лечения ПЭ зависит от исходной
степени тяжести заболевания. Больным с хронической печеночной недостаточностью
в период клинико-гематологической ремиссии необходимо принимать курсовые дозы
ОА (9–18 г/сут) для профилактики латентных и субклинических стадий ПЭ.
Таблица. Схема применения гепа-мерц (L-орнитин- L-аспартат) (ОА)
| Гранулят |
Концентрат для инфузий |
| Хронические гепатиты различного генеза (в том числе вирусные,
алкогольные, токсические), жировая дистрофия |
Хронические гепатиты различного генеза (в том числе вирусные,
алкогольные, токсические), жировая дистрофия |
| При выраженной симптоматике: три раза по два пакетика гранулята в
день |
При выраженной неврологической симптоматике ("высокая" дозировка):
до четыре ампулы в день |
| При средневыраженных симптомах: два-три раза по одному пакетику
гранулята в день |
Цирроз печени с выраженной симптоматикой печеночной энцефалопатии:
три раза по одному-двум пакетикам гранулята в день, в зависимости от
тяжести.
Цирроз печени со средневыраженной симптоматикой: одна-четыре ампулы в
день.
Цирроз печени с выраженной симптоматикой печеночной энцефалопатии с
расстройствами сознания (прекома) или коматозное состояние: до восьми
ампул в день |
Статья опубликована в журнале
Лечащий Врач
Если вы заметили орфографическую, стилистическую или другую ошибку на этой странице, просто выделите ошибку мышью и нажмите Ctrl+Enter. Выделенный текст будет немедленно отослан редактору
|
|
|

