Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Прогноз результатов анализа на папилломавирус человека с
высокой степенью риска + на выявление ранних диспластических патологических
изменений плоского эпителия при помощи вакцины белка L1 папилломавируса человека
Херник Гриссер, доктор медицины1, Хайнц Зандер, доктор медицины2,
Синди Вальчак2 и Ральф А. Хильфрих, доктор наук3.
Ключевые слова:
внутриэпителиальная неоплазия
шейки матки (CIN), мазок Папаниколау, папилломавирус человека (HPV), капсидный
белок L1, цитология, биопсия, прогностический биологический маркер.
Прогнозирование клинических результатов ранних стадий диспластических
патологических изменений является одной из неразрешенных проблем в программах по
обследованию на выявление онкологических заболеваний шейки матки. Мы
анализировали воздействие обнаружения капсидного белка L1 в папилломавирусе
человека в ходе перспективного исследования методом случайной выборки 187
тестовых образцов папилломавируса человека с высокой степенью риска на ранней
стадии диспластических патологических изменений в течение 36-46 месяцев.
Различия в клинических результатах анализа образцов на наличие белка L1
имеют большое статистическое значение (Р<.0001) и не зависят от классификации
слабовыраженных внутриэпителиальных изменений (умеренная дисплазия) и
сильновыраженных внутриэпителиальных изменений умеренного диспластического типа.
Умеренные и слабые дисплазии с наличием белка L1, отражающие продуктивную
инфекцию папилломавируса человека, выявили низкие риски возникновения
злокачественной опухоли, что оправдывает выжидательную стратегию с целью
избежания передозировок, в особенности у молодых женщин. Ранние диспластические
изменения без белка L1, будучи непродуктивными инфекциями или предопухолевыми
состояниями, несут в себе большой риск возникновения злокачественной опухоли,
для которых рекомендуется тщательный мониторинг наряду с кольпоскопией и
гистологическим анализом.
Даже на заре эры вакцинации папилломавирус человека (HPV) остается глобальной
проблемой человечества, отвечающей за многие злокачественные и доброкачественные
новообразования. Женщины в особенности страдают от последствий инфицирования
папилломавирусом человека, что приводит к возникновению примерно полумиллиона
новых случаев инвазивного рака шейки матки ежегодно1.
Программы по обследованию на выявление рака шейки матки с целью обнаружения
преинвазивных новообразований в шейке матки высокоэффективны и привели к спаду
количества случаев инвазивного рака шейки матки2,3. В результате
этого, предопухолевые состояния шейки матки диагностируются часто, а стоимость
лечения слабовыраженных внутриэпителиальных поражений существенно выросла за
последние годы4. У молодых женщин частая конизация шейки матки на
выявление сильновыраженных поражений может негативно сказаться на их
репродуктивной способности.
Для улучшения качества жизни женщин и здравоохранительных ресурсов было бы
крайне полезно иметь прогностические маркеры, разделяющие пациентов на тех, у
кого ранние предшествующие поражения разовьются в раковую опухоль, и на
пациентов, у которых этого не произойдет5. Подобная оценка рисков
одинаково важна для пограничных нарушений, таких как атипичная плоская клетка
неустановленного значения (ASC-US) и сквамозное внутриэпителиальное поражение (SIL)
неопределенной выраженности. Данные, полученные в ходе сортировочного
исследования ASCUS-LSIL (ALTS), подтвердили, что анализ ДНК папилломавируса
человека не является полезной сортировочной стратегией в слабовыраженных случаях
сквамозного внутриэпителиального поражения (LSIL)6, и что до сих пор
не установлено, является ли внутриэпителиальная неоплазия шейки матки второй
категории (CIN 2) сильно- или слабовыраженное заболевание в отдельных
поражениях. Таким образом, необходимы более специализированные инструменты для
выявления женщин, подверженных риску прогрессирующих поражений, другими словами,
необходимо отделить инфекцию папилломавирусом человека (HPV) от реальных
предраковых состояний. 7
Для диагностирования мазков Папаниколау используются различные системы
отчетности. Наряду с традиционной классификацией Всемирной Организации
Здравоохранения8 всемирно признанной является классификация Бетезда (TBS)9.
В Германии применяется Номенклатура 10, в соответствии с которой
слабая и умеренная дисплазия относится к группе IIID, для которой рекомендуется
проведение цитологического мониторинга и кольпоскопия. Немецкая стратегия
выжидания предлагает возможности расследования клинических результатов
цитилогически выявленной умеренной дисплазии, поскольку независимо от системы
отчетности 10% умеренных и 20% слабых диспластических поражений развиваются в
поражения CIN 3+, но большинство из них спонтанно регрессирует. 11,12
Многие аногенитальные онкологические заболевания, в частности плоскоклеточный
рак шейки матки, вызваны эпителиальными опухолевидными ДНК-вирусами, в
особенности папилломавирусами человека13. Известно, что многие типы
папилломавирусов человека поражают аногенитальный тракт, но в злокачественных
образованиях часто обнаруживают только подгруппу вирусов с высокой степенью
риска14.
Основной капсидный белок L1 является одним из восьми известных белков,
специфичных для папилломавируса человека (E1, E2, E3, E4, E5, E6, E7, L1 и L2).
Во время продуктивной фазы жизненного цикла вируса в цитоплазме производится
белок L1 (наряду с минорным белком L2), после чего он перемещается в ядро
клетки, иммунохимически видимой в ходе сильной реакции окрашивания ядра в
промежуточных и поверхностных клетках плоского эпителия. 360 капсидных белков L1
инкапсулируют вирусную ДНК для создания новых инфекционных вирусных частиц,
выводимых в верхний эпителиальный слой13.
Наличие белка L1 в диспластических клетках является подтверждением
завершенного жизненного цикла папилломавируса человека, о чем свидетельствуют
положительные анализы на наличие белка L1. В свою очередь отрицательные анализы
на наличие белка L1 свидетельствуют о том, что белок L1 утратил возможность
производить вирионы в зависимости от клеточной дифференцировки клеток плоского
эпителия.
В 2003 году Мельзхаймер и другие15 обнаружили, что в большинстве
слабовыраженных случаев сквамозного внутриэпителиального поражения (LSIL) с
высокой степенью риска обнаруживается капсидный белок L1, но в большинстве
сильновыраженных случаев сквамозного внутриэпителиального поражения с высокой
степенью риска, вызванного папилломавирусом человека, капсидный белок L1 не
синтезируется. Предполагается, что потеря вирусного капсидного белка L1,
являющегося основной целью иммунного ответа сквамозного внутриэпителиального
поражения, вызванного папилломавирусом человека, может играть роль
прогностического маркера для развития поражений внутриэпителиальной неоплазии
шейки матки15,16.
Впоследствии мы подтвердили это в ходе ретроспективного исследования с
серединным мониторингом в течение 22.8 месяцев на 84 мазках Папаниколау, взятых
в рутинном порядке. Мы продемонстрировали, что слабые и умеренные
диспластические сквамозные поражения с высокой степенью риска, вызванные
папилломавирусом человека, без иммунохимически обнаруживаемого капсидного белка
L1 папилломавируса человека демонстрируют значительно более высокую вероятность
прогрессировать (76.4%), чем в случае наличия белка L1 (23.6%)17.
Схожие результаты в отношении прогностической актуальности капсидного белка L1
папилломавируса человека были получены в ходе различных ретроспективных
исследований с использованием образчиков цитологии и биопсии18-20.
Материалы и методы
Пациенты и расчет
В 2005 году мы начали рандомизированное перспективное исследование на
основании результатов цитологического диагностирования в соответствии с TBS и
Мюнхенской номенклатурой, поскольку две критические рецензии нашей предыдущей
работы17 основывались на том, что наше исследование проводилось на
основании ретроспективного подхода и исключительно на применении Мюнхенской
номенклатуры. В каждый рабочий день мы выбирали первый случай слабой или
умеренной дисплазии с высокой степенью риска HPV+ (в соответствии с
классификацией Всемирной Организации Здравоохранения) из общей скрининговой
популяции. На основании исследований методом гибридной ловушки II (Hybrid
Capture II test) была подтверждена высокая степень риска папилломавируса
человека. (Диген/Киаген, Хильден, Германия).
В ходе исследования было независимо друг от друга классифицировано 211
обычных мазков Папаниколау и слайдов ThinPrep (классификацию выполняли Х.Г и
Х.С.) в соответствии с Второй Мюнхенской Цитологической Номенклатурой (для
слабой и умеренной дисплазии группы IIID) и диагностировались в соответствии с
TBS и LSIL (слабая дисплазия) и HSIL (умеренная дисплазия). Итоговые
цитологические критерии использовались для установления слабой и умеренной
дисплазии21.
Информированное согласие пациентов не требовалось, поскольку получение и
анализ образцов осуществлялись анонимно, а уход за пациентами осуществлялся в
соответствии с Мюнхенской номенклатурой на основании цитологического мониторинга
и кольпоскопии для поражений слабой и умеренной дисплазии.
Мазки для последующего мониторинга предоставлялись с интервалом от 3 до 6
месяцев или ежегодно после первого отрицательного мазка на наличие
внутриэпителиальных поражений. Конизация для терапии и/или гистологическая
проверка осуществлялись на основании клинических рекомендаций и согласия
пациента. Последующий мониторинг завершился в декабре 2008 года, в результате
чего период последующего мониторинга длился от 36 до 46 месяцев.
Клинические результаты были интерпретированы как возможная ремиссия,
персистенция или прогрессия поражения. Мы пришли к выводу, что женщины, у
которых как минимум 2 мазка подряд не выявили внутриэпителиальных поражений,
находятся в состоянии полной ремиссии.
Персистенция была определена как состояние, в ходе которого слабая и
умеренная дисплазии сохранялись цитологически в течение всего периода
последующего мониторинга или в качестве гистологических CIN 1 или CIN2.
Прогрессия была определена как гистологически подтвержденное поражение CIN 3+,
поскольку межэкспертная и нитраэкспертная воспроизводимость для гистологии CIN 3
высока и существенно выше, чем для гистоморфологии CIN 27. Весь гистологический
диагноз осуществлялся на основании образцов конизации.
Для анализа данных использовался двусторонний точный критерий Фишера.
Иммунохимические исследования
В ходе презентирования традиционные мазки Папаниколау, обработанные обычными
методами, и слайды ThinPrep (Холоджик, Бедфорд, штат Массачусетс) были помечены
иммунохимическим методом при помощи диагностического набора Cytoactiv Screening
Set для обследования на выявление онкологических заболеваний производства
компании Цитоиммун Диагностикс, Пирмасенс, Германия (Cytoimmun Disgnostics,
Pirmasens, Germany), который выявляет наличие капсидного белка L1 всех известных
типов папилломавируса человека. Окрашивание производилось в соответствии с
требованиями производителя.
Вкратце, антиген на сладах был выявлен при помощи микроволновой обработки
после их снятия без предварительного обесцвечивания. К слайдам применили
диагностическое антитело Цитоактив (Cytoactiv), которое было инкубировано в
течение 30 минут при комнатной температуре, за этим последовала инкубация с
реагентами выявления в течение 10 минут и с хромогеном АЕС в течение 5 минут.
После контрастной окраски гематоксилином слайды устанавливались под покровное
стекло при помощи Aquatex (Мерк, Дармштадт, Германия). Окрашенные слайды
независимо исследовались при помощи световой микроскопии (выполняли Х.Г и Х.С.).
Слайды с одной или более эпителиальной клеткой с явно выраженной позитивной
окраской отмечались как позитивные [рисунок 1]. Этот метод рекомендован для
исследований, выполняемых при помощи Цитоактива, и применялся нами во всех
исследованиях, опубликованных на данный момент, и основанных на наших ранних
работах17, и демонстрирует, что только присутствие, а не интенсивность
окрашивания позитивного ядра соотносится с течением болезни.
Результаты
Средний возраст 211 пациентов составил 33.6 лет (возрастной предел от 16 до
83 лет). Для группы LSIL средний возраст составил 34.8 лет (возрастной предел от
16 до 83 лет) (n = 78 [37.0%]), а для группы HSIL он составил 32.9 лет
(возрастной предел от 18 до 83 лет) (n = 133[63.0%]).
Из 211 ранних диспластических поражений с высокой степенью риска, вызванных
папилломавирусом человека, 119 (56.4%) составили дисплазии L1- и 92 (43.6%)
дисплазии L1+, при этом между результатами, полученными в двух группах,
наблюдалось существенное различие, независимо от классификации в качестве LSIL
или HSIL. Средний возраст в группе L1 составил 33.7 лет (возрастной предел от 18
до 67 лет) и 33.4 года (возрастной предел от 16 до 83 лет) для группы L1+.
Из 119 случаев L1- 36 (30.3%) изначально были диагностированы как LSIL
(средний возраст 34.3 года) и 83 (69.7%) как HSIL (средний возраст 33.4 года).
Изначально 42 (46%) из 92 случаев L1+ были диагностированы как LSIL (средний
возраст 35 лет) и 50 (54%) как HSIL (средний возраст 32 года) [Таблица 1].
Таблица 1. Результаты 211 изначально привлеченных случаев с разбивкой по
результатам окрашивания на выявление белка L1, группам LSIL/HSIL, и по возрасту*
|
LSIL |
HSIL |
Итого |
| L1- |
36 (30.3) |
83 (69.7) |
119 (56.4) |
| Средний возраст (г) |
34.3 |
33.4 |
33.7 |
| L1+ |
42 (46) |
50 (54) |
92 (43.6) |
| Средний возраст (г) |
35 |
32 |
33.4 |
| Итого |
78 (37.0) |
133 (63.0) |
211 |
| Средний возраст (г) |
34.8 |
32.9 |
33.6 |
HSIL – сильновыраженные случаи сквамозного внутриэпителиального поражения
LSIL - слабовыраженные случаи сквамозного внутриэпителиального состояния.
* - Данные указываются в качестве числа (процент), если не указано иное.
Для анализа данных было задействовано 187 случаев с полной историей болезни
[Таблица 2]. Из 211 случаев 22 (5 HSIL и 17 LSIL) были потеряны во время
последующего мониторинга и 2 случая HSIL L1- были исключены по причине
несоответствий в истории болезни.
Независимо от принадлежности к группе LSIL или HSIL, в 43 (61%) из 71 случаев
L1+ и только в 6 (5.2%) из 116 L1- случаев была обнаружена спонтанная ремиссия.
Для сравнения, только 18 (25%) из 71 случаев L1+, но 84 (72.4%) из 116 случаев
L1- прогрессировали до CIN 3+, включая 4 инвазивные карциномы только среди
случаев L1- HSIL.
Самый высокий уровень ремиссии зарегистрирован среди групп L1+ LSIL (66%
[21/32]) и случаев HSIL (56% [22/39], а самый низкий – среди групп L1-LSIL (11%
[4/36]) и HSIL (3% [2/80]). Для сравнения, самая высокая скорость прогрессии
была зарегистрирована в группе L1-HSIL (79% [63/80]), затем в группе L1-LSIL
(58% [21/36]), L1 +HSIL (28% [11/39]), и в группе L1+LSIL (22%[7/32]).
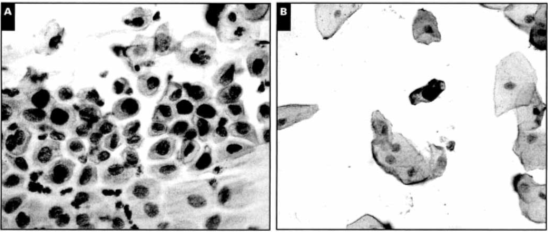
Рисунок 1
.
Позитивные случаи
капсидного белка L1 с сильным окрашиванием ядра клетки. А, сильновыраженное
сквамозное внутриэпителиальное поражение (умеренная дисплазия) в рутинно
выполняемом мазке Папаниколау, окрашенному поверх при помощи Цитоактива (x400).
В, слабовыраженные случаи сквамозного внутриэпителиального поражения на слайде
ThinPrep (x400).
Таблица 2. Клинические результаты 187 случаев заболевания папилломавирусом
человека с высокой степенью риска + ранние диспластические поражения с разбивкой
по статусам белка L1 и LSIL/HSIL*
|
L1+ |
L1- |
|
Итого |
LSIL |
HSIL |
Итого |
LSIL |
HSIL |
| Ремиссия |
43 (61) |
21 (66) |
22 (56) |
6 (5.2) |
4 (11) |
2 (3) |
| Персистенция |
10 (14) |
4 (13) |
6 (15) |
26 (22.4) |
11 (31) |
15 (19) |
| Прогрессия |
18 (25) |
7 (22) |
11 (28) |
84 (72.4) |
21 (58) |
63 (79) |
| Общее количество |
71 |
32 |
39 |
116 |
36 |
80 |
HPV – папилломавирус человека. HSIL – сильновыраженные случаи сквамозного
внутриэпителиального поражения LSIL - слабовыраженные случаи сквамозного
внутриэпителиального поражения.
* - Данные указываются в качестве числа (процент), если не указано иное
В случаях L1- HSIL риск прогрессии был в 2.8 раза выше, чем у случаев
L1+HSIL, а у случаев L1-LSIL риск прогрессии был в 2.6 раза выше, чем у случаев
L1+LSIL.
Среди 71 случая L1+ только 18 (25%) прогрессировали до CIN 3, а 10 поражений
(14%; 2 CIN1, 6 CIN 2 и 2 c цитологически умеренной персистентной дисплазией)
были классифицированы как стабильное заболевание. В частности, 22% случаев
L1+LSIL (7/32) и 28% случаев L1+HSIL (11/39) прогрессировали. Из 32 случаев
L1+LSIL 4 (13%; 2 CIN 1 и 2 CIN 2) были стабильным заболеванием. Из 39 случаев
L1+HSIL 6 (15%; 4 CIN 2 и 2 цитологически с персистентной дисплазией) были
стабильным заболеванием.
Из 116 случаев L1- 84 гистологически были случаями CIN 3+ (72.4%),
претендующими на прогрессию, а 26 (22.4; 10 CIN 1, 14 CIN2 и 2 цитологически)
были классифицированы как стабильное заболевание. Из 36 случаев L1-LSIL 21 (58%)
прогрессировали до CIN 3 наряду с 63 (79%) 80 случаев L1-HSIL.
Из 36 случаев L1-LSIL 11 (31%; 5 CIN 1, 5 CIN 2 и 1 цитологически LSIL) были
подтверждены как стабильное заболевание. Из 80 случаев L1-HSIL 15 (19%) были
подтверждены как стабильное поражение (5 CIN 1, 9 CIN 2 и 1 цитологически как
умеренная дисплазия).
Разница в клинических результатах для случаев L1- и L1+ была статистически
существенной (p<.0001) и независимо от классификации LSIL (слабая дисплазия)
HSIL (умеренная дисплазия). Анализ возрастных клинических результатов женщин не
продемонстрировал статистически существенной разницы у женщин до 30 или старше.
Средняя продолжительность от исходного мазка, выявившего наличие капсидного
белка L1, до признания прогрессии болезни и ремиссии составила 8.5 месяцев (в
диапазоне 1-13 месяцев) и 7 месяцев (в диапазоне 3-35 месяцев), соответственно.
[Таблица 3]. Для случаев L1- интервал до начала прогрессии составил 6 месяцев (в
диапазоне 1-29 месяцев) и 6.4 месяца (в диапазоне (2-12 месяцев) для ремиссии.
Обсуждение
Профилактические вакцины папилломавируса человека, использующие
вирусоподобные частицы капсидного белка L1 в качестве антигена, высокоэффективны
для предотвращения болезней, вызванных папилломавирусом человека.
Среди невакцинированных и, возможно, вакцинированных женщин (за исключением
16 и 18 типов папилломавируса человека) достаточно часто, но не систематично и
не всегда встречаются патогенные типы папилломавируса человека с высокой
степенью риска. Но по причине низких возможностей перерождения прогрессирование
болезни до рака шейки матки происходит лишь у небольшого количества зараженных
людей. Это, возможно, и является причиной того, что другие маркеры, направленные
на поиск событий по клеточному перерождению, до сих пор не смогли
спрогнозировать результаты диспластических поражений на ранних стадиях.
С другой стороны, присутствие инфильтрирующих Т-лимфоцитов и макрофагов в
спонтанно регрессирующих папилломах22 и повышенная вероятность
возникновения и прогрессии инфекций, вызванных папилломавирусом человека у
пациентов с ослабленным иммунитетом, подчеркивают крайнюю важность иммунного
клеточного ответа для разрешения и контроля инфекций, вызванных папилломавирусом
человека16, 23. Таким образом, мы сконцентрировались на капсидном
белке L1 - одном из ключевых стимулов иммунной системы, связанных с
папилломавирусом человека.
Таблица 3. Время до ремиссии или прогрессии*
|
L1- |
L1+ |
|
Итого |
LSIL |
HSIL |
Итого |
LSIL |
HSIL |
| Ремиссия |
6.4 (2-12) |
7.5 (3-12) |
2 |
7 (3-35) |
6.5 (3-18) |
9 (3-35) |
| Прогрессия |
6 (1-29) |
6 (1-29) |
6 (1-20) |
8.5 (1-13) |
9 (6-13) |
8 (1-13) |
HSIL – сильновыраженные случаи сквамозного внутриэпителиального поражения
LSIL - слабовыраженные случаи сквамозного внутриэпителиального поражения.
* - Данные указываются в качестве числа (процент), если не указано иное
Ранние исследования17,19 продемонстрировали, что в ходе
презентирования иммунохимическая оценка статуса L1 папилломавируса человека
важна для прогнозирования ранних диспластических поражений.
Папилломавирус человека выработал несколько механизмов для того, чтобы
уклоняться от естественного иммунного ответа и замедлять активирование
адаптивного иммунного ответа. Несмотря на эту возможность замедлять
иммунологические защитные механизмы, практически во всех случаях зафиксирован
успешный иммунный ответ на половую инфекцию папилломавирусом человека. Но
механизм элиминации вируса может быть существенно замедлен по причине того, что
жизненный цикл папилломавируса человека не вызывает смерти кератиноцитов, и, в
особенности в случаях инфицирования папилломавирусом человека с высокой степенью
риска, не приводит к провоспалительным сигналам. Таким образом, время,
необходимое для элиминации типов вируса с высокой степенью риска, в особенности
HPV-16, в среднем занимает от 8 до 14 месяцев, что существенно дольше, чем 5-6
месяцев, необходимые для элиминации вирусов с низкой степенью риска24.
Следовательно, можно предположить, что в данной ситуации эффективная передача
антигена в антиген-представляющие клетки из кератиноцитов, зараженных
папилломавирусом человека, не инициируется.
Единственными полностью доступными источниками антигена на ранней стадии
вирусных SIL являются свободные вирусные частицы, состоящие из 360 капсидных
белков L1, выделяемых из позитивных апикальных слоев кератиноцитов, содержащих
капсидный белок L1, в течение продуктивной фазы в конце естественного жизненного
цикла инфекции папилломавируса человека. Для создания эффективного
вирусоспецифического иммунного ответа вирусные частицы должны быть обнаружены
антигенпредставляющими клетками сквамозного эпителия, клетками Лангерганса или
дендритными клетками, что может быть ускорено микросостояниями в области
трансформации эпителия. После этого активированные антигенпредставляющие клетки
мигрируют в дренирующие лимфатические узлы, по ходу перерабатывая антигены
папилломавируса человека, и презентируют их нативным Т-клеткам в лимфатической
ткани. После этого Т-клетки видоизменяются в армированные клетки-эффекторы,
мигрируют обратно к месту инфицирования и уничтожают инфицированные кератиноциты,
что ведет к (спонтанной) ремиссии поражения16.
Когда такие механизмы иммунологической стимуляции функционируют, они могут
быть достаточно эффективными, поскольку мы обнаружили ремиссию поражения в
примерно 61% случаев в течение 7-9 месяцев независимо от того, является ли
дисплазия цитологически слабой или умеренной. Мы выяснили, что данный процесс
ненадежен на основании того, что 25% случаев L1+ в нашем исследовании
продемонстрировали раннюю прогрессию до CIN 3 в течение 8.5 месяцев в сравнении
с 6 месяцами для случаев L1-.
Блокирование на любом этапе в последовательности активации, к примеру,
пониженное выделение антигенов или их отсутствие, снижение количества
антигенпредставляющих клеток, несовместимость или нехватка в главном комплексе
гитосовместимости, может привести к неэффективному иммунному ответу и
невозможности элиминирования папилломавируса человека, что, в свою очередь,
приводит к прогрессии внутриэпителиального поражения.
Короткий промежуток времени между обнаружением LSIL и диагнозом поражения CIN
3 может также указывать на то, что в трансформационной зоне сосуществуют
множественные диспластические поражения и дисплазии различной степени тяжести,
возможно отражая смесь поражений L1+ и L1- с различным потенциалом
прогрессирования. В поиске сосуществующих поражений CIN 1/CIN 3, Негри и
другие20 сообщили, что в примерно 70% случаев (68.4%) подобные поражения CIN 1
были уже L1-. По-видимому, эта потеря синтеза капсидного белка L1 является
ранним предопухолевым состоянием, и поражения CIN 3 могут развиться из таких
поражений L1-CIN 1.
Поскольку не содержащие капсидный белок РНК-позитивные мышиные клетки С3
могут быть уничтожены иммунным ответом Т-клеток, специфичным для L1,
положительный эффект присутствия капсидного белка L1 для иммунного ответа может
быть постулирован даже в сосуществующих диспластических областях, не содержащих
капсидный белок L1. Среди случаев L1- в нашем исследовании это встречалось
крайне редко, при этом 5.2 % случаев продемонстрировали ремиссию поражения.
Вероятно, что причиной ремиссии таких случаев L1- является то, что уровень их
экспрессии находится ниже уровня обнаружения при помощи иммунохимического
анализа, или же ошибка выборочного исследования по причине отсутствия выраженных
клеток L1 в образце.
Персистенция или прогрессия дисплазии наблюдались в 94.8% случаев L1-, что
еще раз подчеркивает важность капсидного белка L1 папилломавируса человека как
основного стимула для активирования иммунной системы и элиминации дисплазии. По
всей вероятности быстрая прогрессия слабых и умеренных дисплазий до поражений
CIN 3 в течение 6 месяцев подтверждает точку зрения о том, что прогрессия
заболевания может быть связана с локальными сбоями иммунной системы. L1-, будучи
непродуктивной инфекцией папилломавируса человека и предопухолевым состоянием,
может со временем привести к нарушению вирусно-клеточного взаимодействия, что в
свою очередь приводит к нарушению регулирования клеточного цикла на
транскрипционном, трансляционном и геномном уровне25-27.
В своей совокупности данные наших перспективных исследований подтвердили
результаты наших предыдущих исследований, проводимых с использованием
ретроспективного подхода, и являются дополнительным подтверждением того, что в
реальных условиях иммунохимическое выявление капсидного белка L1 является
высокоэффективным инструментом прогнозирования результатов ранних
диспластических поражений, в особенности LSIL и умеренных диспластических
поражений, что делает оценку рисков более эффективной, чем выявление ДНК
папилломавируса человека с высокой степенью риска. Хотелось бы подчеркнуть, что
в ходе исследования не было выявлено существенных прогностических различий между
цитологически слабыми (LSIL) и умеренными диспластическими поражениями (входит в
категорию HSIL) в связи с профилем экспрессии L1. Таким образом, прогностическая
ценность иммунохимического выявления L1 может также быть постулировано для
пограничных поражений, таких как HPV+ ASC-US и SIL с высокой степенью риска
неустановленной степени выражения, и даже для умеренных дисплазий, входящих в
категорию HSIL, и для эквивалента поражений CIN 2 после биопсии.
Слабые и умеренные диспластические поражения L1+, отражающие продуктивную
инфекцию папилломавируса человека, обладают низкой степенью риска прогрессии.
Слабые и умеренные диспластические поражения L1-, будучи непродуктивными
инфекциями или предопухолевыми поражениями, обладают высоким потенциалом
прогрессировать, настолько же высоким, как и риск сильных дисплазий и сквамозных
карцином в реальных условиях. Поэтому для случаев HPV+ и L1- с высокой степенью
риска рекомендуется тщательный мониторинг с кольпоскопией и гистологическим
контролем.
Независимо от цитологических классификаций, используемых до настоящего
времени, мы предлагаем определять потенциал диспластических поражений
прогрессировать при помощи антитела для обследования на выявление капсидного
белка L1 папилломавируса человека и классифицировать наличие капсидного белка L1
как поражения с низким потенциалом развития в злокачественную опухоль, а
отсутствие капсидного белка L1 при инфицировании папилломавирусом человека с
высокой степенью риска как поражения с высоким потенциалом развития в
злокачественную опухоль.
Литература
1. Ферлэй Дж. Брей Ф, Писани П и другие ГЛОБОКАН 2002 год: частота
возникновения злокачественных новообразований и опухолей, смертность и частота
заболеваний во всем мире. МАИР (Международное агентство по изучению рака),
CancerBase № 5, версия 2.0 Лион, Франция. Пресс служба МАИР, 2004 год.
2. Паркин Д.М. Брей ФЛ, Девеса СС. Онкологическая нагрузка в 2000 году:
глобальная перспектива. Eur J Cancer 2001 год; 37:4-66.
3. Бекер Н. Эпидемиологические аспекты обследования на выявление
онкологических заболеваний в Германии. J Cancer Res Clin Oncol. 2003 год
129:691-702.
4. Курман РДЖ. Хенсон ДЕ, Хербста АЛ и другие. Промежуточные директивы для
контроля анормальной цитологии шейки матки. Журнал Американской медицинской
ассоциации. 1994 год; 271:1866-1869.
5. Нукки МР. Кастрильон ДХ, Бай Х и другие. Биологические маркеры в
диагностическом акушерстве и гинекологической патологии: обзор. Adv Anat Patol.
2003 год; 10:55-68.
6. Атипичные сквамозные клетки неустановленного значения / сортировочное
исследование слабовыраженных сквамозных внутриэпителиальных поражений. Группа (ALTS).
Испытание папилломавируса человека для сортировки женщин с цитологическим
подтверждением слабовыраженных сквамозных внутриэпителиальных поражений:
исходные данные из рандомизированного исследования. J Natl Cancer Inst. 200 год;
92:397-402.
7. Кастл ПЕ, Штолер МХ, Соломон Д и другие; для группы ALTS. Отношение
сообщества диагностированной при помощи биопсии внутриэпителиальной неоплазии 2
категории к качественному контролируемому диагнозу: отчет ALTS. Am J Clin Pathol.
2007 год; 127: 805-815.
8. Риоттон Г. Кристоферсон ВМ, Лунт Р, Цитология женских половых путей.
Женева, Швейцария: Всемирная Организация Здравоохранения; 1973 год.
Международная Гистологическая Классификация Опухолей. № 8
9. Соломон Д. Найяр Р. Классификация Бетезды для отчетности в области
цитологии шейки матки. Определения, критерии и пояснительные примечания.
Нью-Йорк, штат Нью-Йорк Springer Verlag, 2004 год.
10. Вагнер Д. Вторая Мюнхенская номенклатура для гинекологического
цитодиагноза. Acta Cytol. 1990; 34:900-901.
11. Кантор СБ. Аткинсон ЕН, Карденас-Туранзас М и другие. Естественная
история внутриэпителиальная неоплазия шейки матки. Acta Cytol. 2005 год;
49:405-415.
12. Остер А. Естественная история внутриэпителиальная неоплазия шейки матки –
критическая рецензия. Int J Cynecol Pathol. 1993 год; 12: 186-192.
13. Цур Хаузен Х. Папилломавирус и рак: от базовых исследований до
клинического приложения. Nat Rev Cancer. 2002; 2:342-350.
14. Муньоз Н. Бош ФХ де Саньоз С и другое. Эпидемиологическая классификация
различных типов папилломавируса, вызывающих рак шейки матки. N Engl Med. 2003
год. 348: 518-527.
15. Мельзхаймер П, Каул С, Добек С и другие. Иммунноцитохимичекое выявление
капсидных белков типа L1 папилломавируса человека с высокой степенью риска в
LSIL и HSIL в сравнении с выявлением ДНК капсидного белка L1 папилломавируса
человека. Acta Cytol. 2003 год; 47: 124-128.
16. Стэнли М. Иммунный ответ на папилломавирус человека. Вакцина. 2006 год.
24 (дополнение 1): S16:S22.
17. Гриссер Х. Сандер Х, Хильфрих Р и другие. Корреляция иммунохимического
выявления капсидного белка L1 папилломавируса человека в мазках Папаниколау с
регрессией слабых/умеренных дисплазий с папилломавирусом человека с высокой
степенью риска. Anal Quant Cytol Histol. 2004 год; 26: 241-245.
18. Раубер Д, Мельхорн Г, Фашинг ПА и другие. Прогностическое значение
обнаружения белка L1 папилломавируса человека в мазках слабых и умеренных
внутриэпителиальных поражений. Eur J Obstet Cynecol Reprod Biol. 2008 год. 140:
258-262.
19. Хильфрих Р, Харири Дж. Прогностическое значение обнаружения белка L1
папилломавируса человека в мазках слабых и умеренных диспластических поражений
шейки матки в сочетании с вторым биологическим маркером p16. Anal Quant Cytol
Histol. 2008 год; 30:78-82.
20. Негри Г, Беллисано Г, Заннони ДЖФ и другие. р16 ink4а и иммуногистохимия
капсидного белка L1 папилломавируса человека целесообразны в оценке поведения
слабовыраженных диспластических поражений шейки матки. Am J Sung Pathol. 2008
год; 32: 1715-1720.
21. Вужис ПГ, ван Асперт ван Эрп АЖМ, Бультен Дж. Доброкачественные
пролиферативные реакции, внутриэпителиальные необплазии и инвазивный рак шейки
матки. В: Биббо М, Вильбур ВС, eds. Полная клеточная патология. 3 издание
Филадельфия, штат Пенсильвания: Сандерс; 2008 год: 131-213.
22. Колеман Н, Бирли ХД, Рентон АМ и другие. Иммунологические события в
регрессирующих остроконечных кондиломах. Am J Sung Pathol. 1994 год; 102:
768-774.
23. Бентон С. Шахидулла Х, Хантер ДЖА, папилломавирус человека при
иммунодепрессии. Papillomavirus Rep. 1992 год; 3: 23-26.
24. Франко ЕЛ, Вилла ЛЛ, Собриньо ДЖП и другие. Эпидемиология восприимчивости
и элиминации инфекции папилломавируса человека у женщин из зон с высокой
степенью риска для возникновения рака шейки матки. J Infect Dis. 1999 год.
180:1415-1423.
25. Чу КБ, Ли ХХ, Пан СС и другие. Дублирование последовательности и
внутреннее удаление в интегрированном геноме 16 типа папилломавируса человека из
рака шейки матки. J Virol. 1998 год; 62: 1659-1666.
26. Айсеногль ДЖП, Кленси КА, Лиин СУ. Изменение последовательности в генах
капсидного белка папилломавируса человека 16 типа и 31 типа. Вирусология. 1995
год; 214:664-669.
27. Янг Р, Вилер СМ, Чен КС и другие. Мутация капсидного белка
папилломавируса человека для избежания дендритного клеточно-зависимого
естественного иммунитета при раке шейки матки. J Virol. 2005 год; 79:6741-6750.
http://www.cytoactiv.ru

