Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Роль современных сахароснижающих и антиоксидантных препаратов
в фармакотерапии сахарного диабета 2-го типа и его осложнений
А. Л. Верткин, доктор медицинских наук, профессор
О. Ю. Аристархова
А. С. Скотников
МГМСУ, кафедра клинической фармакологии, фармакотерапии и СМП, Москва
Согласно данным Всемирной организации здравоохранения, более 154 миллионов
людей во всем мире страдают сахарным диабетом, а к 2025 году их количество
возрастет до 380 миллионов, что составит 7,1% от всего взрослого населения
планеты [1].
Желая подтвердить или опровергнуть данные прогнозы, канадские ученые
предприняли попытку оценить распространенность и заболеваемость сахарным
диабетом в самой большой провинции Канады Онтарио и сравнить полученные данные с
прогнозами ВОЗ. Используя популяционные данные, в том числе базу данных
сахарного диабета, куда заносятся все живущие в провинции больные, исследователи
определили, что в 1995 г. распространенность сахарного диабета в регионе
составляла 5,2%, а к 2005 г. повысилась до 8,8%.
Это уже превышает прогнозы ВОЗ относительно роста распространенности диабета
в первые 30 лет XXI века. Таким образом, в то время как эксперты ВОЗ
предсказывают, что с 2000 по 2030 гг. распространенность сахарным диабетом в
мире возрастет на 39%, в Онтарио зафиксирован 27% рост распространенности
заболевания только за 5 лет. При этом особенно резко распространенность диабета
выросла среди женщин в возрасте 20–49 лет. Исследователи отмечают, что
распространенность диабетом выросла как за счет того, что больше людей
заболевают, так и за счет того, что растет выживаемость больных диабетом.
Исследователи отмечают, что полученные ими данные позволяют лучше приготовиться
к тому, каким бременем станет сахарный диабет для здравоохранения стран мира в
ближайшем будущем. Они полагают, что необходимы новые исследования, направленные
на определение групп риска сахарного диабета и разработку возможных
вмешательств, направленных на профилактику новых случаев заболеваний и
эффективное лечение уже заболевших [2].
Однако в связи с тем, что сахарный диабет 2-го типа часто не диагностируется
в течение длительного времени, предполагается, что его фактическая
распространенность в 2–3 раза превышает регистрируемую [3].
Так, например, в исследовании Australian Diabetes, Obesity and Lifestyle
Study (AusDiab) показано, что частота диагностированных случаев сахарного
диабета 2-го типа равна частоте недиагностированных случаев [4].
Между тем сахарный диабет 2-го типа характеризуется развитием тяжелых
инвалидизирующих осложнений, приводящих к полной потере трудоспособности и
преждевременной смертности.
По данным исследования Cost of Diabetes in Europe — Type 2 (CODE-2),
изучавшего распространенность различных диабетических осложнений у больных
сахарным диабетом, различные осложнения имели 59% больных, причем у 23%
обследованных было два, а у 3% — три осложнения и более.
Сердечно-сосудистая патология была обнаружена у 43%, а цереброваскулярная — у
12% больных [5].
С целью определения частоты встречаемости сахарного диабета и его роли в
прогнозе пациентов с соматической патологией, в одном из крупных стационаров г.
Москвы были проанализированы протоколы патолого-анатомических вскрытий за
2006–2008 гг. При этом было выявлено, что из 3239 умерших дестабилизация кардио-
и цереброваскулярной патологии стала причиной смерти 1510 больных. Таким
образом, удельный вес кардиоваскулярной патологии в структуре общей смертности
составил 46,6% (Верткин А. Л., Скотников А. С., 2008)
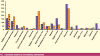
У 287 этих же пациентов, что составило 19%, при жизни был выявлен сахарный
диабет, причем у основной массы (97,1%) — сахарный диабет 2-го типа и лишь у
2,9% больных — сахарный диабет 1-го типа (Верткин А. Л., Аристархова О. В.,
2008).
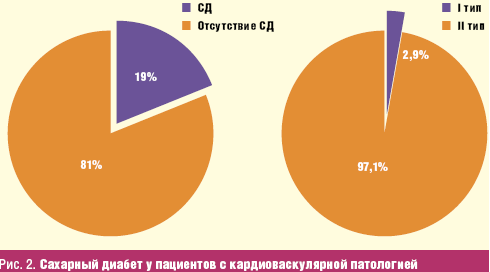
В течение нескольких последних лет у пациентов довольно часто встречается
комбинация двух сосудистых катастроф: инфаркта миокарда и инфаркта головного
мозга. При этом установить главенствующую роль того или иного заболевания подчас
не представляется возможным.
Так, проведя анализ 78 протоколов патолого-анатомических заключений пациентов
с инфарктом миокарда (ИМ) и острым нарушением мозгового кровообращения (ОНМК)
или инфарктом головного мозга, было выявлено, что сахарный диабет их них имели
17% мужчин и 32% женщин (Верткин А. Л., Аристахова О. В., 2008).
Установлено, что при имеющемся сахарном диабете 2-го типа риск развития
сердечно-сосудистой патологии в 3–4 раза выше, чем при его отсутствии. Больные с
сахарным диабетом 2-го типа имеют такую же степень риска преждевременной смерти,
как и больные, перенесшие инфаркт миокарда без сахарного диабета [6].
При этом в структуре расходов на лечение пациентов с данной патологией более
90% приходится на профилактику и терапию его осложнений и только около 10% —
собственно на сахароснижающие препараты.
Какие же осложнения сахарного диабета встречаются наиболее часто? Безусловно,
это диабетическая микро- и макроангиопатия, диабетическая полинейропатия,
диабетическая артропатия, диабетическая офтальмопатия и ретинопатия,
диабетическая нефропатия, диабетическая энцефалопатия.
Основной причиной летальности пациентов с сахарным диабетом 2-го типа
является прежде всего развитие макрососудистых осложнений (поражение коронарных,
церебральных и периферических артерий) [7].
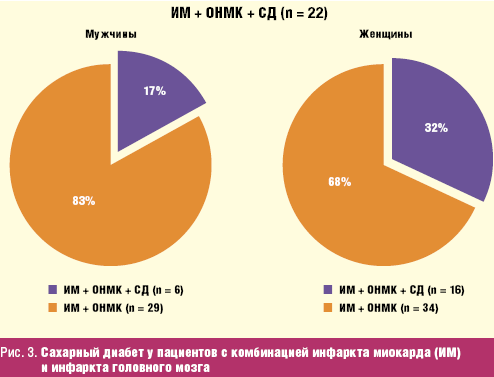
Более того, у 84% умерших больных с сахарным диабетом имеется его осложненное
течение, и лишь у 16% пациентов на секции не было обнаружено проявлений
осложненного течения данного заболевания (Верткин А. Л., Скотников А. С., 2008).
Структура осложнений сахарного диабета представлена на рис. 4.
Наиболее раннее и частое осложнение сахарного диабета — диабетическая
нейропатия [8].
По данным разных авторов, она встречается у 90–100% больных сахарным
диабетом. Частота поражений нервной системы при сахарном диабете прямо
пропорционально зависит от длительности заболевания, причем в некоторых случаях
она предшествует появлению основных клинических признаков диабета.
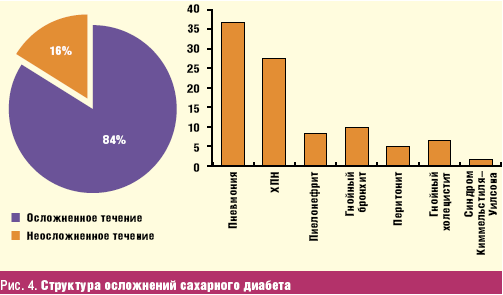
Так, у 5% пациентов с манифестацией сахарного диабета уже имеются симптомы
поражения нервной системы, которые с увеличением длительности заболевания
возрастают, составляя 60% при сроке диабета более 25 лет (рис.
5).
Частота поражений нервной системы при сахарном диабете коррелирует с
длительностью заболевания, степенью тяжести и возрастом больных, хотя у 20%
детей и 70% подростков также определяются проявления диабетической нейропатии
[9].
При сахарном диабете поражаются все отделы нервной системы: центральная
нервная система (энцефалопатия, миелопатия), периферическая нервная система
(поли- и мононейропатии) и периферическая вегетативная нервная система
(автономная нейропатия).
Наиболее часто встречаемые формы диабетической автономной нейропатии (ДАН)
представлены в таблице.
Кроме того, диабетическая нейропатия значительно снижает качество жизни
больных и является одним из основных факторов риска развития язвенных дефектов
стоп, ожогов, обморожений и гангрены [10].
Терапия осложнений сахарного диабета представляет собой большую
медико-социальную проблему как из-за высокой степени инвалидизации больных, так
и высоких показателей смертности. В настоящее время клиническая медицина
располагает целым арсеналом лекарственных средств как для коррекции
гипергликемии — главного виновника сосудистых осложнений, так и для лечения этих
и других осложнений сахарного диабета. Однако долгосрочный прогноз при сахарном
диабете и его осложнениях до сегодняшнего дня остается неутешительным. Связано
это с развитием хронических осложнений (микро-, макроангиопатии и нейропатии),
влиять на развитие которых крайне сложно [11].
Одним из самых сильных антиоксидантов, используемых в лечении нейропатии,
является альфа-липоевая (тиоктовая) кислота [12].
Ее высокая эффективность и патогенетическое действие доказаны многочисленными
экспериментальными и клиническими исследованиями (ALADIN, DECAN, ORPIL, SYDNEY,
NATHAN).
В исследовании ALADIN-I было показано, что внутривенное введение 600 мг
тиоктовой кислоты в течение 3 недель привело к уменьшению клинических проявлений
полинейропатии на 65% по сравнению с плацебо.
В исследовании ALADIN-II, продолжавшемся в течение 2 лет, при применении
тиоктовой кислоты в дозе 600 или 1200 мг выявлено существенное улучшение
проведения возбуждения по двигательным и чувствительным нервам по сравнению с
плацебо, а также отмечена хорошая переносимость препарата при долговременной
пероральной терапии.
В исследовании ALADIN-III после 3 недель внутривенного лечения тиоктовой
кислотой наблюдалось значительное уменьшение неврологического дефицита,
улучшение чувствительности и рефлексов. После последующего перорального лечения
тиоктовой кислотой в дозе 600 мг 3 раза в сутки отмечалась тенденция к такому же
улучшению по сравнению с плацебо [13].
Результаты исследования ORPIL показали, что у 24 пациентов, участвующих в
исследовании, при использовании тиоктовой кислоты в дозе 1800 мг в сутки в
течение 3 недель уменьшались нейропатические симптомы и неврологический дефицит,
в то время как частота развития побочных эффектов была сопоставима с плацебо.
В исследовании DECAN лечение в течение 4 месяцев пациентов с сахарным
диабетом, страдающих кардиоваскулярной формой автономной нейропатии, хорошо
переносимой дозой альфа-липоевой кислоты 800 мг в сутки привело к значительному
улучшению функции нервных волокон вегетативной нервной системы, что проявилось
увеличением вариабельности сердечного ритма [14].
Исследование SYDNEY-I показало, что внутривенное введение тиоктовой кислоты в
дозе 600 мг в сутки в течение 3 недель приводит к клинически значимому снижению
позитивной нейропатической симптоматики [15].
При проведении метаанализа исследований ALADIN, ALADIN-III, SYDNEY-I,
NATHAN-II (неопубликованное), включающего 1258 пациентов, показано, что
внутривенное введение тиоктовой кислоты в дозе 600 мг в течение 3 недель
значительно уменьшает позитивную нейропатическую симптоматику [16].
Однако необходимо помнить, что основной причиной неэффективности назначаемых
патогенетических средств в лечении осложнений сахарного диабета является его
декомпенсация!
Главной задачей врача является правильный выбор сахароснижающего препарата и
подбор адекватной его дозировки, с учетом индивидуальных особенностей пациента и
его сопутствующей патологии.
Принимая во внимание сложные патофизиологические связи между
инсулинорезистентностью, нарушениями гликемического контроля, ожирением,
дислипидемией, артериальной гипертензией и атеросклерозом, особое значение для
всех имеющихся в практике и появляющихся на рынке новых сахароснижающих
препаратов приобретает не только их способность обеспечивать контроль гликемии,
но и их влияние на прогрессирование макрососудистых осложнений и частоту
возникновения инфаркта миокарда и инсульта у пациентов с сахарным диабетом 2-го
типа [17].
Широко известно, что современные лекарственные средства, применяемые для
лечения сахарного диабета 2-го типа, несмотря на свою высокую сахароснижающую
активность, достаточно часто вызывают увеличение массы тела пациентов, что
является нежелательным побочным эффектом при использовании данных лекарственных
средств у больных с ожирением.
В ряде исследований показано, что прогрессирование ожирения характерно для
лечения многими препаратами сульфонилмочевины, тиазолидиндионами, инсулином. Из
антидиабетических средств только бигуаниды (метформин) и в меньшей степени
акарбоза обладают анорексигенным и антиадипогенным эффектами. Таким образом,
возникла необходимость в создании новых сахароснижающих препаратов, не только
обладающих выраженным гипогликемическим действием, но и способствующих снижению
массы тела больных.
Миметики инкретина — это принципиально новый класс препаратов для лечения
сахарного диабета 2-го типа. Их действие основано на замещении нарушенных при
данном заболевании эффектов гормона инкретина глюкагоноподобного пептида-1
(ГПП-1).
У здоровых людей ГПП-1 вырабатывается в стенке кишечника, стимулирует первую
фазу секреции инсулина и увеличивает глюкозозависимую секрецию инсулина [18].
Клинически важным следствием зависимости эффектов ГПП-1 от уровня глюкозы крови
является то, что ГПП-1 не может вызывать развития выраженной гипогликемии. ГПП-1
регулирует концентрацию глюкозы плазмы, модулируя секрецию как инсулина, так и
глюкагона. Он является необходимым компонентом для обеспечения нормальной
толерантности к глюкозе и адекватной постпрандиальной секреции инсулина.
ГПП-1 замедляет опорожнение желудка [19], снижает желудочную и
панкреатическую секрецию. Действие ГПП-1 на замедление опорожнения желудка
представляет интерес в плане влияния на снижение прандиальной гипергликемии
[20]. Постпрандиальный рост гликемии четко зависит от скорости опорожнения
желудка. Таким образом, ГПП-1, замедляя скорость опорожнения желудка, тормозит
поступление компонентов пищи из желудка в тонкую кишку, что оказывает влияние на
прандиальный подъем глюкозы.
Кроме того, ГПП-1 участвует в процессах регуляции пищевого поведения,
действуя через центральные механизмы, и способствует развитию чувства насыщения,
а также трансформации неинсулинпродуцирующих клеток в инсулинсекреторные [21].
ГПП-1 обладает рядом важных метаболических эффектов [19]. Он улучшает
периферическую чувствительность к инсулину, способствует активному поглощению
глюкозы печенью, мышечной и жировой тканями, влияет на различные системы
организма: сердечно-сосудистую, дыхательную и центральную нервную систему [21].
В результате ГПП-1 оказывает кардио- и нейропротективное действие, что приводит
к улучшению памяти, стимуляции диуреза [20].
Аминокислотная последовательность инкретинов на 50% совпадает с ГПП-1
человека. Исследования in vitro показали, что препарат связывается с рецепторами
к ГПП-1 и устойчив к инактивации. Кроме того, при его подкожном введении
пациентам с сахарным диабетом 2-го типа пик концентрации в плазме отмечался
через два-три часа, а период полужизни составлял два-шесть часов. Эти
фармакологические свойства инкретинов позволяют использовать их для лечения в
виде двух подкожных инъекций в сутки (перед завтраком и ужином), что достаточно
эффективно снижает уровень гликемии на протяжении всех суток.
Данные клинических исследований свидетельствуют о том, что терапия
инкретинами обеспечивает достоверное улучшение контроля гликемии у этой
категории больных. Нужно знать, что миметики инкретина разрешены к применению в
качестве дополнительной терапии у пациентов с неудовлетворительным контролем
гликемии на фоне лечения метформином, производными сульфонилмочевины,
тиазолидиндионами, комбинацией метформина и производных сульфонилмочевины или
метформина и тиазолидиндиона [22].
Избыточная масса тела или ожирение отмечается у 85–90% пациентов с сахарным
диабетом. Поэтому одним из безусловных мероприятий при лечении этих пациентов
является снижение веса за счет изменения образа жизни и характера питания, что
приводит к повышению чувствительности к инсулину. К сожалению, применение
данного подхода позволяет добиться нормализации показателей гликемии менее чем у
30% пациентов с впервые выявленным заболеванием [23].
С другой стороны, назначение большинства пероральных сахароснижающих
препаратов (за исключением метформина) и инсулинотерапии больным сахарным
диабетом 2-го типа обеспечивает улучшение контроля гликемии, однако во многих
случаях приводит к дальнейшему увеличению массы тела пациентов.
Снижение массы тела было отмечено у 81% больных сахарным диабетом 2-го типа,
получавших инкретины в течение 2 лет, несмотря на то, что в протоколе
исследования отсутствовали особые требования по соблюдению диеты и программы
физических упражнений [24].
Преимущества инкретинов в отношении снижения массы тела особенно очевидны при
анализе результатов сравнительных исследований с препаратами инсулина. В то
время как терапия инкретинами в дозе 10 мкг 2 раза в сутки приводила к
прогрессирующему снижению массы тела, инсулинотерапия (инсулином гларгином или
двухфазным инсулином аспарт) вызывала увеличение массы тела пациентов [25].
При анализе результатов длительного лечения инкретинами было отмечено
статистически достоверное улучшение показателей липидного спектра крови,
заключающееся в снижении уровней триглицеридов, общего холестерина и
липопротеидов низкой плотности (ЛПНП) и повышении уровня липопротеидов высокой
плотности (ЛПВП).
Так, по завершении 82 недель терапии инкретинами изменения перечисленных
показателей составили –38,6 мг/дл; –2,4 мг/дл; –1,6 мг/дл и +4,6 мг/дл (от
исходных 243,1 мг/дл; 188,2 мг/дл; 116,7 мг/дл и 38,6 мг/дл) соответственно,
причем изменения ЛПВП и триглицеридов были статистически значимыми [26].
В длительных исследованиях применения миметиков инкретина у пациентов с
сахарным диабетом 2-го типа было отмечено благоприятное влияние препарата на
показатели систолического и диастолического артериального давления. Так, в
сравнительном исследовании применения инкретинов и двухфазного инсулина аспарт в
течение 52 недель было отмечено статистически достоверное снижение показателей
систолического (в среднем на –5 ± 15 мм рт. ст., p < 0,001) и диастолического (в
среднем на –2 ± 10 мм рт. ст., p = 0,03) артериального давления у больных,
получавших терапию инкретинами. Назначение 2-фазного инсулина аспарт не вызывало
изменений артериального давления [27].
Таким образом, терапия миметиками инкретина, приводящая к нормализации
углеводного обмена и уровня гликемии в сочетании с уменьшением массы тела и
низким риском гипогликемии, является патогенетической и направлена на
восстановление естественных физиологических механизмов регуляции уровня глюкозы.
Перечисленные особенности тиоктовой кислоты и миметиков инкретина позволяют
использовать их для лечения больных сахарным диабетом 2-го типа с
неудовлетворительным контролем гликемии при использовании пероральной
сахароснижающей терапии на этапе, предшествующем назначению инсулина, а также
фармакотерапии его осложнений.
Статья опубликована в журнале
Лечащий Врач

