
Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Результаты
хирургического лечения больных с
рефлюкс-ассоциированной бронхиальной астмой
В.М. Дурлештер1,2, Н.В.
Корочанская1,2, И.Ю. Свечкарь1,2,
Р.Ш. Сиюхов2, Р.Б. Беретарь1,2,
Н.Г. Мирцхулава2, Н.Е. Шабанова2
1 Кафедра хирургии № 1 ФПК и ППС ГОУ ВПО
Кубанского государственного медицинского
университета, Россия, 350063, г. Краснодар, ул.
Седина, 4;
2 ГБУЗ Краевая клиническая больница № 2
МЗ Краснодарского края, Россия, 350012, г.
Краснодар, ул. Красных партизан, 6/2;
В статье приведены данные обследования и лечения
пациентов с рефлюкс-эзофагитом и бронхиальной
астмой. Всем пациентам была выполнена
лапароскопическая антирефлюксная операция.
Результаты хирургического лечения оценивали через 1,
6, 12, 24 и более месяцев. В ходе обследования
выявлены отсутствие рефлюкс-эзофагита и существенное
уменьшение явлений астмы после проведенного
оперативного лечения у всех больных.
Ключевые слова: рефлюкс-эзофагит,
внепищеводные проявления, бронхиальная астма,
антирефлюксные операции.
Results of surgical
treatment for patients with reflux-associated
bronchial asthma
V.M. Durleshter1,2,
N.V. Korochanskaya1,2, I.U. Svechkar1,2,
R.S. Siuhov2, R.B. Beretar1,2,
N.G. Mirtzhulava2, N. E. Shabanova2
1 Department of surgery № 1 Kuban
state medical university, Russia, 350063, Krasnodar,
Sedina street, 4;
2 Regional hospital № 2, Russia, 350012,
Krasnodar, Krasnih partizan street, 6/2; tel.
8-928-4119057. E-mail: barracuda00(а)yandex.ru
The article presented the results of the
examination of patients with reflux-esophagitis and
bronchial asthma. All patients underwent the
laparoscopic antireflux procedure. The results of
surgery were assessed in 1, 6, 12, 24 and more
months. The check-up has revealed the absence of
reflux-esophagitis and significant decreasing of
asthma manifestations in all of patients after
surgery.
Key words: reflux- esophagitis,
supraoesophageal manifestations, bronchial asthma,
antireflux procedure.
Проблема гастроэзофагеальной рефлюксной болезни (ГЭРБ)
и рефлюкс- эзофагита (РЭ) в настоящее время является
очень актуальной. Данное заболевание принято считать
гастроэнтерологической патологией XXI века, так как
прослеживается заметная тенденция к уменьшению
заболеваемости превалировавшей ранее язвенной
болезнью и увеличению заболеваемости ГЭРБ. Симптомы
этого заболевания (чаще всего изжога) при тщательном
опросе выявляются у 30–40% взрослого населения
развитых стран, а воспалительные изменения слизистой
оболочки пищевода, то есть рефлюкс-эзофагит,
диагностируют у 30–45% лиц с характерной
симптоматикой, подвергшихся эндоскопическому
обследованию [4].
В последние годы появилось много клинических
исследований, подтверждающих взаимосвязь между ГЭРБ
и патологией других органов и систем, единым
патогенетически связывающим звеном которой является
гастроэзофагеальный рефлюкс (ГЭР) [4, 6, 12, 14].
Определена большая группа так называемых атипичных,
или внепищеводных, проявлений рефлюкс-эзофагита,
среди которых выделяют бронхопульмональные,
оториноларингологические, кардиальные и
стоматологические.
Среди возможных бронхолегочных проявлений
(аспирационная пневмония, фиброзирующий альвеолит,
хронический персистирующий кашель) особое место
занимает бронхиальная астма (БА). Имеется ряд работ,
в которых исследована взаимосвязь между патогенезом
ГЭРБ и БА, а также влияние кислотосупрессивной
терапии на течение астмы [2, 3, 6, 7, 9, 13, 15].
В настоящее время большинство пациентов с ГЭРБ, в
том числе с внепищеводной бронхопульмональной
патологией, лечатся медикаментозно, что обеспечивает
хороший непосредственный эффект у 90–95% больных,
однако после его отмены в течение года отмечается
рецидив симптомов у 80–100% человек [10].
Антирефлюксное хирургическое вмешательство является
единственным методом, позволяющим восстановить
функцию нижнего пищеводного сфинктера (НПС) и
устранить гастроэзофагеальный рефлюкс (ГЭР) и его
последствия [8, 11].
В настоящее время существует большое число
оперативных методик, применяемых при лечении ГЭРБ.
Тем не менее данные литературы свидетельствуют о
неудовлетворенности хирургов и пациентов их
результатами [1, 5, 8].
Целью работы явилось повышение эффективности
комплексного хирургического и медикаментозного
лечения больных с сочетанием ГЭРБ и бронхиальной
астмы.
Материалы и методы
Работа основана на результатах клинического,
морфологического и функционального обследования 160
пациентов с ГЭРБ в хирургических отделениях МБУЗ
«Городская больница № 2 «КМЛДО» г. Краснодара (с
2013 г. – ГБУЗ ККБ № 2) за период 2008–2012 годов.
У 11 (6,9%) из общего числа больных имелась
неаллергическая астма, из них мужчин – 3, женщин –
8.
Диагноз астмы устанавливался по критериям GIN A
(2006) на основании характерных жалоб, анамнеза,
наличия обратимой бронхиальной обструкции по данным
ФВД (увеличение ОФВ1 на 15% и более после приема
бронходилататора – 200 мкг сальбутамола).
У 2 пациентов наблюдалась астма с тяжелым течением,
у 6 – средней степени тяжести, у 3 – астма с легким
персистирующим течением. Продолжительность
заболевания астмой колебалась от 5 до 37 лет, в
среднем 16,5±3,7 года. Все пациенты находились на
постоянной медикаментозной противоастматической
терапии. Не включены в исследование больные с
доказанным аллергическим генезом астмы.
Все больные данной группы в предоперационном периоде
были обследованы с помощью следующих методов:
эзофагогастродуоденоскопия, рентгенологическое
исследование ЖКТ с барием, суточная рН-метрия
пищевода и желудка, а также рентгенография легких,
спирометрия, фаринго- и ларингоскопия, консультация
пульмонолога. Проводилась оценка клинической картины
астмы (количество дневных и ночных симптомов) и
потребности в противоастматических медикаментах. В
качестве как начального, так и контрольного
диагностического метода использовалось измерение
параметров функции внешнего дыхания (ФВД):
определение жизненной емкости легких (ЖЕЛ),
функциональной жизненной емкости легких (ФЖЕЛ),
объема форсированного выдоха за первую секунду
(ОФВ1), вычисление индекса Тиффно (ОФВ1/ФЖЕЛ).
С целью оценки контролирования астмы использовался
международный тест по контролю над астмой (АСТ –
asthma control test).
Всем пациентам после соответствующего дообследования
и предоперационной подготовки в плановом порядке
выполнено лапароскопическое антирефлюксное
вмешательство по разработанной и используемой в
клинике методике (приоритетная справка на
изобретение № 2013122121 от 14.05.2013). Показанием
для оперативного лечения всех больных являлся
рефлюкс-эзофагит, осложненный внепищеводными
проявлениями и резистентный к консервативной
терапии.
Контрольные осмотры после антирефлюксной операции
проводились в сроки через 1 месяц, 6 месяцев, 1 год,
затем с интервалом в 1 год. Результаты лечения
условно разделили на: хороший, удовлетворительный и
неудовлетворительный. Хорошим результат считали в
том случае, если после антирефлюксной операции
удалось достигнуть снижения количества симптомов и
доз потребляемых медикаментов; хороший уровень
контроля над астмой – 22 и более баллов по АСТ;
удовлетворительным – уменьшение симптомов и
стабилизация течения астмы; удовлетворительный
уровень контроля – 20–21 балл по АСТ;
неудовлетворительным – при сохранении или
усугублении симптомов, факте возникновения хотя бы
одного астматического статуса, повышения потребности
в препаратах, усиления степени тяжести астмы;
результат теста АСТ менее 20 баллов.
Статистическая обработка данных проводилась с
помощью программы «Statistica 6». Достоверность
отличий сравниваемых признаков оценивалась критерием
Вилкоксона. Полученные различия считались
достоверными при значениях р<0,05.
Результаты исследования
При исследовании морфофункционального статуса
гастроэзофагеального перехода у всех 11 больных
выявлена аксиальная ГПОД. При эндоскопии у больных с
легкой персистирующей формой астмы выявлен
катаральный неэрозивный эзофагит, а у всех пациентов
с тяжелым и среднетяжелым течением астмы установлена
эрозивная форма рефлюкс-эзофагита.
У всех 11 пациентов с ГЭРБ-ассоциированной астмой
выявлены патологические показатели суточной
рН-метрии пищевода.
При анализе клинической картины установлено, что
частота дневных симптомов астмы (приступы
затрудненного дыхания, кашля, одышки, тяжести в
грудной клетке) составляет 1,6 (ДИ: Q25–0,8;
Q75–2,2) и превалирует над частотой ночных
симптомов, медиана которых составила 0,2 (ДИ: 0,1;
0,2). Частота возникновения как дневных, так и
ночных симптомов была выше у пациентов с тяжелой
астмой.
Все пациенты находились на базисной медикаментозной
противоастматической терапии. Больные с легкой
персистирующей формой астмы в качестве базисной
терапии получали ингаляционные глюкокортикостериоды
(ИГКС) – будесонид или беклометазон в дозе 200–500
мкг/сутки на 1–2 приема. С целью купирования либо
предупреждения приступа астмы использовались
ингаляционные β2-агонисты короткого
действия (сальбутамол ил фенотерол), медиана
среднесуточного количества доз потребляемых коротких
бронходилататоров составила 1 (0,8; 1,2).
Больные со среднетяжелой персистирующей формой астмы
в качестве базисной терапии получали комбинированную
форму препарата ИГКС – будесонид (500 мкг/сут.) и
ингаляционный β2-агонист длительного
действия – формотерол, на 2 приема в сутки. С целью
купирования симптомов также использовались
ингаляционные β2-агонисты короткого
действия, медиана количества доз которых в сутки
составила 2 (1,9; 2,5). Пациенты с тяжелой астмой в
качестве базисной терапии получали комбинированную
форму препарата ИГКС – будесонид (1000 мкг/сут.) и
ингаляционный β2-агонист длительного
действия – формотерол, на 2 приема в сутки.
С целью купирования приступа астмы также
использовались ингаляционные β2-агонисты
короткого действия, медиана среднесуточного
количества доз коротких бронходилататоров – 3,75
(2,6; 3). В среднем по группе потребность в
бронходилататорах короткого действия составила 2
(1,2; 3) дозы в сутки.
При анализе показателей ФВД выявлено, что медиана
значения ОФВ1 в целом по группе составила
72% (70; 75), ЖЕЛ – 80% (74; 82), ФЖЕЛ – 76% (73;
81) от должных величин. Медиана индекса Тиффно
составила 96%. Снижение показателей было более
выражено у пациентов с тяжелой формой астмы.
Указанные результаты свидетельствуют о существенном
снижении показателей спирометрии у исследуемых
пациентов, несмотря на проводимую медикаментозную
терапию.
При оценке теста АСТ из 11 пациентов с астмой только
3 человека (2 – с легкой, 1 – со средней степенью
тяжести) продемонстрировали хороший контроль над
течением заболевания, у них количество баллов
составило 20. У всех остальных больных астма была
неконтролируемой, наименьший результат отмечен у
больных с тяжелой формой – по 15 баллов. Медиана
показателя АСТ по всей группе до операции составила
17 (15; 20).
После проведенного оперативного антирефлюксного
лечения летальных исходов не было. У 2 (18%) человек
отмечена умеренно выраженная дисфагия, наблюдаемая в
течение первых 15–20 суток после операции, которая
купировалась самостоятельно, без специального
лечения. Интраоперационных осложнений, конверсий в
лапаротомию не было. Отдаленные результаты
прослежены у всех 11 пациентов.
Через 1 месяц типичной симптоматики ГЭРБ не
наблюдалось ни у одного пациента, при дальнейшем
наблюдении картина не изменялась. При выполнении
эндоскопии уже через 1 месяц после антирефлюксной
операции отмечалась выраженная положительная
динамика со стороны слизистой оболочки пищевода:
эзофагит отсутствовал у всех обследованных. При
рентгенологическом исследовании на 4–5-е сутки после
операции восстанавливались плотное смыкание и
абдоминальная позиция кардии, ГЭР отсутствовал. При
выполнении контрольного суточного рН-мониторирования
через 6 месяцев после выполнения антирефлюксной
операции у всех 11 пациентов в нижней трети пищевода
зафиксировано от 2 до 7 непродолжительных
слабокислых рефлюксов в сутки, не достигающих
средней трети пищевода, что позволило расценить их
как физиологические. Среднее значение рН увеличилось
с 5 (4,5; 6,2) до 6,7 (6,2; 6,9) (р>0,05).
Достоверно (р<0,05) снизились: % времени с рН менее
4, число рефлюксов в целом и продолжительных
рефлюксов; индекс DeMeester уменьшился в 11 раз – до
значений, соответствующих норме. Подобная
трансформация морфологических и функциональных
показателей сохранялась и в более отдаленные сроки
после операции.
Анализ отдаленных результатов продемонстрировал
положительную динамику дневных и ночных симптомов
астмы после операции. Уже через 1 месяц медиана
суточного количества дневных симптомов по группе
статистически значимо снизилась – с 1,6 (0,8; 2,2)
до 0,9 (0,5; 1,5); ночных – с 0,2 (0,1; 0,2) до 0,1
(0,05; 0,15). В дальнейшем положительная тенденция к
уменьшению симптомов астмы сохранялась. Так, при
проведении контрольной рН-метрии через 6 месяцев
после фундопликации ни в одном случае не было
отмечено связи симптомов астмы с фиксируемыми
короткими слабокислыми рефлюксами.
Через 2 года контроля частота дневных приступов
статистически значимо снизилась – до 0,3 (0,2; 0,4),
р=0,03; ночных симптомов – до 0,05 (0,03; 0,05), р=0,04.
За все время диспансерного наблюдения не отмечено ни
одного случая развития астматического статуса.
Трансформация клинической симптоматики астмы в
различные сроки наблюдения отражена в таблицах 1 и
2.
Таблица 1. Динамика дневных
симптомов у пациентов с бронхиальной астмой в
различные сроки послеоперационного периода
Степень тяжести астмы
|
Количество дневных симптомов астмы, Ме (ДИ:
Q25; Q75)
|
До операции
|
Через 1
мес.
|
Через 6
мес.
|
Через 1 год
|
Через 2
года
|
Легкая персистирующая
|
0,6 (0,5; 0,8)
|
0,4 (0,3;
0,5)* |
0,3 (0,3;
0,4)* |
0,2 (0,1;
0,2)*
|
0,1 (0,1;0,2)*
|
Средней тяжести
|
1,8 (1,3;
2,3)
|
0,9 (0,6;
0,4)* |
0,55 (0,5;
0,75)* |
0,5 (0,4;
0,65)* |
0,35 (0,2;
0,5)* |
Тяжелая
|
2,7 (1,6;
2,4)
|
1,5 (1,1;
1,1)* |
1 (0,7;
0,8)* |
0,9 (0,6;
0,8)* |
0,8 (0,5;
0,7)* |
Всего
|
1,6 (0,8;
2,2)
|
0,9 (0,5;
1,5)* |
0,5 (0,4;1)*
|
0,5 (0,2;
0,8)* |
0,3
(0,2;0,4)* |
Примечание: * – р<0,05 по сравнению с
соответствующей группой до операции
Таблица 2. Динамика ночных
симптомов у пациентов с астмой в различные сроки
послеоперационного периода
Степень тяжести астмы
|
Количество ночных симптомов астмы, Ме (ДИ:
Q25; Q75)
|
До операции
|
Через 1
мес.
|
Через 6
мес.
|
Через 1
год
|
Через 2
года
|
Легкая персистирующая
|
0,07 (0,05;
0,07)
|
0,05 (0,03;
0,05) |
0,03 (0,02;
0,04) |
0,03 (0,02;
0,03) |
0,03 (0,02;0,03) |
Средней тяжести
|
0,2 (0,1;
0,2)
|
0,1 (0,08;
0,15)* |
0,06 (0,04;
0,1)* |
0,05 (0,05;
0,06)* |
0,05 (0,04;
0,05)* |
| Тяжелая |
0,65 (0,37;
0,6)
|
0,4 (0,2;
0,4) |
0,3 (0,15;
0,3)* |
0,25 (0,15;
0,25)* |
0,25 (0,15;
0,25)* |
Всего
|
0,2 (0,1;
0,2)
|
0,1 (0,05;
0,15)* |
0,06
(0,03;0,1)* |
0,05 (0,03;
0,06)* |
0,05 (0,03;
0,05)* |
Примечание: * – р<0,05 по сравнению с
соответствующей группой до операции
В ходе послеоперационного наблюдения отмечены
положительные изменения в приеме
противоастматических медикаментов.
3 пациентов с легкой персистирующей формой астмы в
течение первого года после операции оставались на
базисной терапии препаратами ИГКС – будесонид в дозе
200–500 мкг/сутки на 1–2 приема, «по требованию»
использовались ингаляционные β2-агонисты короткого
действия (сальбутамола сульфат или фенотерола
гидробромид), причем необходимость в их
использовании после операции уменьшалась с течением
времени (табл. 3). Через 2 года наблюдения медиана
суточного количества доз коротких β2-агонистов
в сутки составила 0,2 (0; 0,2) – статистически
значимое различие по сравнению с предоперационным
показателем, р<0,05.
Положительная динамика клинических симптомов и
контролируемое течение астмы позволили 2 пациентам в
сроки более года после операции вначале уменьшить, а
затем и полностью отменить препарат ИГКС и перейти в
режим применения коротких β2-агонистов
«по требованию». Вышеуказанные условия позволили
курирующему пульмонологу снизить этим пациентам
степень тяжести астмы до легкой интермиттирующей.
Один пациент остается на базисной терапии ИГКС 500
мг/сут., режим приема коротких бронходилататоров
уменьшился и составляет через 2 года наблюдения 0,2
дозы в сутки (1 раз в 5–6 дней).
В группе пациентов со среднетяжелой персистирующей
формой астмы (n=6) также отмечены положительные
изменения. Одному больному в течение первого года
последовательно снижена доза ИГКС с 500 до 200 мкг в
сутки, затем снижен до 1 приема и далее отменен
ингаляционный β2-агонист длительного
действия; к концу 2-го года наблюдения проведена
отмена ИГКС, пациент перешел в режим применения
коротких β2-агонистов «по требованию»,
при этом медиана количества доз последних снизилась
до 0,3 в сутки. Степень тяжести астмы у этого
больного ступенчато через легкую персистирующую к
концу 2-го года наблюдения была снижена до легкой
интермиттирующей.
Еще 1 пациенту со среднетяжелой формой астмы в
течение 2 лет наблюдения снижена степень тяжести до
легкой персистирующей после соответствующего
ступенчатого снижения медикаментозной терапии; через
2 года терапия в объеме: прием ИГКС до 500 мкг/сут.,
потребляемые короткие бронходилататоры – 0,6 доз/сут.
Остальные 4 пациента со среднетяжелой формой астмы
остаются на прежнем уровне базисной медикаментозной
терапии: прием комбинированной формы препарата ИГКС
и ингаляционного β2-агониста
пролонгированного действия; у 2 пациентов его
потребление снижено до 1 приема в сутки; у 2 –
прежние 2 приема в сутки. Число доз потребляемых
коротких бронходилататоров в сутки у 3 больных
снизилось; у 1 пациента потребление коротких β2-агонистов
осталось на дооперационном уровне – 1,5 доз/сут.
В данной подгруппе отмечена статистически значимая
динамика потребления коротких бронходилататоров:
через 6 месяцев после операции – 0,75 (0,5; 1) дозы
в сутки, р<0,05; через 2 года – 0,5 (0,3; 0,85), р<0,05.
У 2 больных с исходно тяжелой астмой также отмечены
положительные изменения в послеоперационном периоде.
Базисная терапия у одного пациента осталась на
прежнем уровне, у другого доза иГКС снижена с 1000
до 500 мкг в сутки. Медиана суточного количества доз
коротких β2-агонистов статистически
достоверно снизилась у обоих пациентов – до 1,25
дозы (табл. 3).
Трансформация показателей ФВД в различные сроки
послеоперационного периода отражена в таблице 3.
Таблица 3. Результаты
динамического исследования показателей спирометрии у
пациентов с астмой в зависимости от сроков
послеоперационного периода
Параметры ФВД
|
Показатели (в % от должных величин) Ме
(Q25; Q75)
|
До операции
|
Через 1
мес.
|
Через 6
мес. |
Через 1 год
|
Через 2
года
|
| ОФВ1 |
72 (70; 75)
|
79 (77; 84)*
|
82 (79; 89)*
|
86 (89; 92)*
|
90 (89; 95)
* |
| ЖЕЛ |
80 (74; 82)
|
82 (75; 85)
|
84 (77; 87)
|
89 (82; 90)*
|
91 (85; 93)
* |
| ФЖЕЛ |
76 (73; 81)
|
81 (78; 84)
|
83 (80; 86)
|
87 (85; 89)*
|
90 (89; 93)*
|
| Индекс Тиффно |
95 (91; 97)
|
97 (94; 98)
|
98 (95; 99)
|
99 (95; 99)
|
100 |
Примечание: * - р<0,05 по сравнению с группой до
операции
Через 1 месяц после оперативного лечения отмечено
повышение уровня всех наблюдаемых показателей,
однако различия были статистически незначимы.
Статистически достоверные различия по всем
параметрам спирометрии отмечены в срок наблюдения 1
год после антирефлюксной операции. Так, в указанный
срок наблюдения уровень ОФВ1 составил 82%
(79; 89) по сравнению с предоперационным показателем
– 72% (70; 75), р<0,05.
Тенденция к повышению уровня ОФВ1
сохранялась с увеличением срока послеоперационного
периода и через 2 года наблюдения составила 90% (89;
95). Повышение уровней ЖЕЛ и ФЖЕЛ происходило
соответственно повышению ОФВ1,
достоверные различия были зафиксированы через 1 год
наблюдения.
Через 2 года уровень ЖЕЛ в среднем составил 91% (85;
93), ФЖЕЛ – 90% (89; 93) против дооперационных
показателей в 80% (74; 82) и 76% (73; 81)
соответственно (р<0,05).
Проведена оценка изменения показателей
международного теста по контролю над астмой АСТ в
различные сроки послеоперационного периода.
Результаты представлены на рисунке.
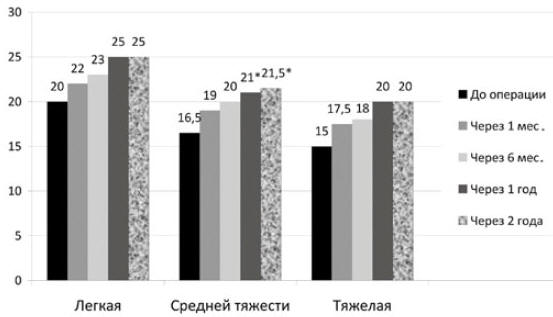
Рис. Трансформация показателей
теста АСТ в различные сроки послеоперационного
периода, * – р<0,05 по сравнению со значениями до
операции
Хотя различия при сравнении подгрупп в разные сроки
в большинстве своем не достигли статистически
значимого уровня, отмечено постепенное повышение
количества баллов в зависимости от увеличения сроков
послеоперационного периода у всех наблюдаемых
больных. Так, у 2 пациентов с легкой персистирующей
астмой в сроки 1 год и более выявлены показатели
полного контроля над астмой – 25 баллов. Среди
больных со средней тяжестью астмы в сроки наблюдения
1 и 2 года отмечено статистически достоверное
повышение (р<0,05) среднего уровня баллов, при этом
у 5 человек зафиксирован хороший уровень контроля
над астмой – от 20 до 22 баллов, а у 1 пациента
через 2 года отмечен полный контроль над астмой – 25
баллов. У больных с тяжелой астмой также отмечено
увеличение среднего балла, хотя и не достигшее
статистической достоверности: по 20 баллов через 1
год и более по сравнению с 15 баллами до операции.
Средний показатель теста АСТ по всей группе также
увеличивался, различия достигли статистической
значимости (р<0,05) через 6 месяцев – 20 (18; 22)
баллов; медиана показателя через 2 года составила 22
(20; 25) балла, р= 0,03.
Обсуждение результатов
Положительная клиническая динамика, уменьшение
потребности в медикаментах, улучшение показателей
спирометрии и полностью контролируемое течение астмы
(25 баллов по вопроснику АСТ) позволили курирующему
пульмонологу снизить 2 пациентам с легкой
персистирующей астмой степень тяжести заболевания на
легкую интермиттирующую. Один пациент из этой
подгруппы остается на прежней степени астмы, у него
отмечается улучшение по всем наблюдаемым
показателям.
Среди 6 пациентов со среднетяжелой персистирующей
формой астмы также отмечены положительные изменения.
Одному больному, достигшему полного контроля над
астмой (25 баллов по АСТ), в течение срока
наблюдения степень тяжести астмы ступенчато через
легкую персистирующую к концу 2-го года была снижена
до легкой интермиттирующей. Еще 1 пациенту со
среднетяжелой формой астмы в течение 2 лет
наблюдения уменьшена степень тяжести до легкой
персистирующей после соответствующего ступенчатого
снижения медикаментозной терапии. Остальные 4
пациента со среднетяжелой формой астмы,
продемонстрировавшие улучшение результатов, но в
меньшей степени, остаются на прежней степени
заболевания.
У 2 больных с исходно тяжелой астмой в
послеоперационном периоде также отмечены
положительные изменения приведенных выше клинических
и инструментальных показателей; снижения степени
тяжести астмы этим пациентам не проводилось.
Литература
- Богданов Д. Ю., Матвеев Н. Л., Мацак В. А.
Исследование эффективности лапароскопических
фундопликаций при хирургическом лечении ГЭРБ //
Эндоскопич. хирургия. – 2008. – Т. 14. № 3. – С.
27–34.
- Бурков С. Г., Арутюнов Т. А. Бронхолегочная и
орофарингеальная патология и ГЭРБ // Клинич.
перспективы гастроэнтерологии, гепатологии. –
2007. – № 1. – С. 35–41.
- Иванова О. В., Исаков В. А., Морозов С. В.,
Федулов Д. С., Цодикова О. М. Внепищеводные
проявления гастроэзофагеальной рефлюксной болезни
// Русский медицинский журнал. Бол. органов
пищевар. – 2004. – № 2. – С. 15–21.
- Ивашкин В. Т., Шептулин А. А. Диагностика и
лечение гастроэзофагеальной рефлюксной болезни:
Пособие для врачей. – М., 2005. – 30 с.
- Луцевич О. Э., Галлямов Э. А., Преснов К. С.,
Гвоздик В. В., Макушин А. А. Выбор способа
эндохирургических антирефлюксных вмешательств при
гастроэзофагеальной рефлюксной болезни // Альманах
Института хирургии им. А. В. Вишневского. – 2012.
– Т. 7. № 1. – С. 117–118.
- Маев И. В., Юренев Г. Л., Бурков С. Г.
Внепищеводные проявления ГЭРБ // Терапевт. архив.
– 2007. – Т. 79. № 3. – С. 57–66.
- Палеев Н. Р., Исаков В. А. и соавт. ГЭРБ и
патология органов дыхания: доказательства
взаимосвязи и нерешенные проблемы // Вестн. Рос.
академии мед. наук. – 2005. – № 6. – С. 3–7.
- Пучков К. В., Филимонов В. Б. Грыжи
пищеводного отверстия диафрагмы. – М.: «Медпрактика-М»,
2003. – 171 с.
- Рощина Т. В. Супраэзофагеальные проявления
ГЭРБ // Клинич. перспективы гастроэнтерологии,
гепатологии. – 2003. – № 1. – С. 27–30.
- Циммерман Я. С., Вологжанина Л. Г.
Гастроэзофагеальная рефлюксная болезнь: патогенез,
клиника, диагностика и лечение // Клиническая
медицина. – 2005. – № 9. – С. 16–24.
- Черноусов А. Ф., Шестаков A. Л., Тамазян Г. С.
Рефлюкс-эзофагит. – М.: ИЗДАТ, 1999.
- Fass R., Achem S. R., Harding S., Mittal R. K.
Reviewarticle: supra-oesophageal manifestations of
gastro-oesophageal reflux disease and the role of
night-time gastro-oesophageal reflux // Aliment
pharmacol ther. – 2004. – № 20 (suppl. 9). – Р.
26–38.
- Gislason T., Janson C., Vermeire P.
Respiratory symptoms and nocturnal
gastroesophageal reflux: a population-based study
of young adults in three European countries //
Chest. – 2002. – № 121 (1). – Р. 158–163. doi:10.
1378/chest. 121.1.158.
- Malagelada J. R. Review article:
supraoesophageal manifestations of
gastroesophageal reflux disease // Aliment.
pharmacol. ther. – 2004. – Vol. 19, suppl. 1 – P.
43–48.
- Parsons J. P., Mastronade J. G.
Gastroesophageal reflux disease and asthma // Cur.
opin. pulm. med. – 2010. – № 16. – Р. 60–63.
Статья опубликована на сайте
http://www.gastroscan.ru
Если вы заметили орфографическую, стилистическую или другую ошибку на этой странице, просто выделите ошибку мышью и нажмите Ctrl+Enter. Выделенный текст будет немедленно отослан редактору
|
|
|
|

