Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Причины и патогенез резистентности к эритропоэз-стимулирующим
препаратам при нефрогенной анемии
Г. В. Волгина*, доктор медицинских наук, профессор
Е. В. Ловчинский**
*МГМСУ, **ГВВ № 2, Москва
Анемия является широко распространенным осложнением хронической болезни почек
(ХБП), и ее частота прямо коррелирует со степенью нарушения их функции. По
данным эпидемиологических исследований анемия регистрируется у 5% пациентов с
ХБП 1–2 стадий, у 15–20% с 3-й стадией, у 50–55% пациентов с 4-й стадией и в 80%
случаев в группе пациентов с ХБП 5-й стадии [1, 2]. Успешную коррекцию анемии
следует рассматривать как важную часть лечения пациентов с ХБП.
Анемия при ХБП имеет многофакторный генез, но основная роль в ее развитии
принадлежит дефициту продукции перитубулярными клетками проксимальной части
нефрона гликопротеидного гормона роста эритроцитов — эритропоэтина (ЕРО) в
количествах, адекватных для поддержания гемопоэза; истощению доступного для
эритропоэза пула железа. Следует подчеркнуть тот факт, что при развитии почечной
недостаточности уровни ЕРО в сыворотке не увеличиваются пропорционально тяжести
анемии, как это происходит при анемиях непочечного генеза. В 1979 г. Caro J. и
соавт. измерили и сопоставили уровни эндогенного ЕРО у здоровых людей, пациентов
с анемией непочечного и почечного генеза. Оказалось, что уровни ЕРО были выше у
пациентов с ХБП, чем с непочечной анемией, но необоснованно ниже ожидаемых при
такой степени анемии. Анемия сохранялась у пациентов с ХБП, несмотря на то, что
средний уровень ЕРО был примерно в пять раз выше, чем у здоровых людей. Это
несоответствие указывает на то, что, в дополнение к относительной
недостаточности ЕРО у пациентов с ХБП, подавляется ответ костного мозга на
эндогенный ЕРО.
ЕРО является ключевым фактором, который обеспечивает контроль дифференцировки
клеток эритроидного ряда. Необходимость увеличения продукции ЕРО улавливается
специальным сенсором, расположенным в области проксимальных канальцев почек, его
выработка регулируется на уровне транскрипции гена. Впоследствии была
идентифицирована молекула, названная гипоксия-индуцированным фактором альфа 1,
который связывается с гипоксия-чувствительным элементом на участке гена ЕРО.
Стимулами увеличения продукции этого фактора являются относительное уменьшение
парциального давления кислорода в тканях и усиление противодействующих
регулирующих механизмов, которые обеспечивают общее потребление кислорода и, в
свою очередь, продукцию ЕРО.
Внедрение в клиническую практику препаратов рекомбинантного человеческого
эритропоэтина с целью преодоления относительного дефицита ЕРО коренным образом
изменило стратегию лечения и исходы анемии у пациентов с ХБП. Однако, несмотря
на новые терапевтические возможности лечения анемии эритропоэз-стимулирующими
препаратами (ЭСП), достижение целевого уровня Нb (10–12 г/дл) не всегда возможно
[1, 3]. Согласно данным литературы, у 80–90% пациентов назначение ЭСП вызывает
адекватный эритропоэтический ответ, тогда как у оставшихся 10–20% наблюдается
замедленная или отсутствующая реакция, несмотря на применение высоких доз [4].
Истинная частота резистентности к терапии ЭСП неизвестна, так как в ряде
исследований, посвященных изучению эффективности различных доз препаратов, у
значительной части пациентов уровень Hb был ниже пороговых значений.
Имеются убедительные доказательства взаимосвязи низкого гемопоэтического
ответа или его отсутствия на ЭСП с неблагоприятными исходами. Высокие дозы ЭСП и
резистентность к ним, более длительный период времени до достижения целевого
диапазона Hb значительно увеличивают риск фатальных/нефатальных
кардиоваскулярных осложнений (инфаркт миокарда, сердечная недостаточность,
инсульт, тромбозы). Резистентность к ЭСП является предиктором увеличения
смертности любой этиологии, независимо от других факторов риска и предшествующей
патологии сердечно-сосудистой системы [5, 6].
Критерии и диагноз резистентной анемии
Резистентность к ЭСП значительно чаще бывает относительной, нежели
абсолютной, поэтому для определения клинической ситуации, при которой необходимо
применение доз ЭСП, значительно превышающих традиционные, часто используются
термины «недостаточная эффективность», «недостаточный ответ», «низкая
чувствительность» и другие.
В рекомендациях, предложенных экспертами Национального почечного фонда США
NKF K/DOQI (Kidney Disease Outcome Quality Initiative) [7], резистентность
анемии к ЭСП определяется как наличие, по крайней мере, одного из следующих
условий:
- значительное уменьшение уровня Hb при постоянной дозе ЭСП;
- значительное увеличение дозы ЭСП для поддержания целевого уровня Hb или
- невозможность повышения уровня Hb ≥ 11 г/дл, несмотря на дозу эпоэтина
более 500 МЕ/кг/нед или эквивалентную дозу других ЭСП.
В Европейских рекомендациях определение резистентности имеет некоторые
отличия. Резистентность рассматривают как невозможность достижения целевой
концентрации Hb при назначении эпоэтина в дозах 300 МЕ/кг/нед п/к или 400–450 МЕ/кг/нед
в/в и более (~20 000 МЕ/нед) или > 1,5 мкг/кг/нед дарбэпоэтина альфа (~100 мкг/нед)
в течение 4–6 месяцев [3]. Указанные дозы более чем в 2,5 раза превышают среднюю
эффективную дозу ЭСП.
Альтернативным методом измерения степени резистентности к ЕРО и оценки
эффективности ЭСП в динамике является Индекс резистентности к эритропоэтину (ИРЭ),
который равен отношению еженедельной дозы эпоэтина в МЕ на кг массы тела к
концентрации Нb в г/дл. Значения ИРЭ ≤ 10 МЕ/кг/нед/г для эпоэтинов и ≤ 0,02
мкг/кг/нед/г для дарбэпоэтина считают нормальными или желательными [8].
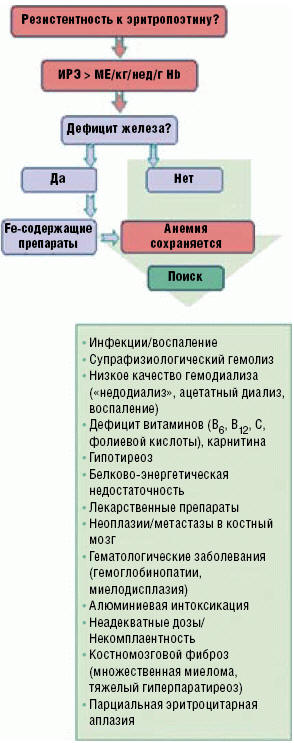
Рис. 1. Причины резистентности анемии к
эритропоэз-стимулирующим препаратам у пациентов с хронической болезнью почек
Причины резистентности
Причины резистентности анемии к ЭСП многочисленны и обусловлены эндогенными и
экзогенными факторами, основной перечень которых представлен на рис. 1.
Среди факторов недостаточного ответа на ЭСП основными являются: дефицит
железа, острые и хронические инфекции, сопутствующее воспаление и другие
состояния, сопровождающиеся избыточной продукцией провоспалительных цитокинов.
Другие причины относительной ЕРО-резистентности у пациентов с адекватным депо
железа включают: неадекватный диализ, хронический гемолиз, дефициты витамина В12
или фолиевой кислоты, L-карнитина, дисфункцию щитовидной железы (как
гипертиреоз, так и гипотиреоз), злокачественные новообразования, заболевания
крови и интоксикацию алюминием. Резистентность к ЭСП может развиться и при
применении лекарственных препаратов — ингибиторов ангиотензин-превращающего
фермента (иАПФ), блокаторов рецепторов ангиотензина (БРА) и Н2-рецепторов,
теофиллина, витамина А, миелосупрессантов, аллопуринола.
Абсолютная резистентность анемии к ЭСП диагностируется значительно реже и
обусловлена уменьшением костномозгового плацдарма кроветворения (костномозговой
фиброз при вторичном и третичном гиперпаратиреозе (ГПТ), злокачественные
процессы с поражением костного мозга, множественная миелома). В литературе были
опубликованы редкие сообщения о развитии парциальной эритроцитарной аплазии при
лечении эпоэтином альфа и еще более редкие — эпоэтином бета.
Патогенез резистентности
Наиболее частой и изученной причиной недостаточного ответа на ЭСП является
функциональный (концентрация ферритина > 100 мкг/л, насыщение трансферрина <
20%, количество гипохромных эритроцитов > 6%) или абсолютный (уровень ферритина
сыворотки крови < 100 мкг/л) дефицит железа (Fe). Функциональный дефицит Fe
характеризуется недостаточным его поступлением в костный мозг и эритробласты.
Лечение большими дозами ЭСП может приводить к снижению насыщения трансферрина
даже при достаточных запасах Fe, что расценивается как функциональный дефицит Fe.
У пациентов с резистентной анемией необходимо мониторировать показатели
баланса Fe и установить причину его дефицита (например, скрытое
желудочно-кишечное кровотечение, потери крови в диализаторе, рутинные потери
небольших объемов (5–10 мл) крови у пациентов с постоянным катетером и частом
заборе для исследований, случайные потери из артериовенозных фистул и др.).
Соответствующая терапия внутривенными препаратами железа (для поддержания депо
Fe — основного компонента формирования гема) является важной стратегией.
Показателем повышения эритропоэтической активности под влиянием ЭСП является
увеличение поглощения эритроном трансферрина, которое зависит от биодоступности
Fe и коррелирует с повышением в циркуляции растворимых рецепторов трансферрина.
В течение последних лет широко обсуждается роль гепсидина как ключевого
регулятора гомеостаза Fe. Гепсидин, богатый цистеином малый полипептид,
синтезируется, главным образом, гепатоцитами и экскретируется почками. Гепсидин
связывается с трансмембранным белком ферропортином, единственным известным
клеточным экспортером Fe, подавляет выход Fe из клеток. Увеличение синтеза
гепсидина при нагрузке Fe приводит к торможению его абсорбции в тонкой кишке,
освобождению из гепатоцитов и ретикулоэндотелиальной системы. Инфекция и
низкоградуированное воспаление увеличивают синтез гепсидина, ограничивая участие
Fe в эритропоэзе (независимо от статуса Fe в организме или эритропоэтической
активности) и обеспечивая, таким образом, прямую связь между воспалением и
метаболизмом Fe при анемии [9–12]. В недавно проведенном исследовании [13] было
показано, что прогепсидин и растворимые рецепторы трансферрина в сыворотке
крови, совместно с CPБ, являются маркерами устойчивости анемии к терапии ЭСП.
У некоторых пациентов, получающих лечение методом гемодиализа (ГД), даже
после достаточного назначения препаратов Fe сохраняется ЕРО-резистентная анемия,
что является основанием для исключения других причин резистентности:
воспалительных инфекционных процессов (например, инфекционные осложнения со
стороны сосудистого доступа, хирургическое воспаление и др.) и системной
воспалительной реакции, основными проявлениями которой являются острофазовый
ответ, гиперцитокинемия, появление в системном кровотоке продуктов активации
лейкоцитов и системы комплемента.
Сильная ассоциация между высокими уровнями маркеров воспаления (ферритин,
IL-1, IL-6, фактор некроза опухоли, интерферон гамма, CРБ) и ИРЭ была
подтверждена на большом контингенте ГД-пациентов с ЕРО-резистентной анемией.
Установлено, что цитокин-индуцированное воспаление непосредственно ингибирует
действие эндогенного и экзогенного ЕРО на эритроидные предшественники и частично
блокирует мобилизацию и транспорт железа. Определенную роль в данном процессе
может иметь взаимодействие между ЕРО и его рецепторами, уменьшение числа
рецепторов ЕРО. Кроме того, цитокины сдерживают рост эритроидных
предшественников in vitro — эффект, который, вероятно, реализуется через
цитокин-опосредованную индукцию апоптоза, — и оказывают прямой токсический
эффект на эритроидные предшественники, который генерируется, по крайней мере
отчасти, свободными радикалами окиси азота.
Недавно были идентифицированы генетические полиморфизмы, которые играют
важную роль в патогенезе «воспалительной» анемии. В клиническом исследовании,
включавшем 167 пациентов, получавших лечение ГД, было установлено, что,
независимо от других традиционных факторов риска анемии, пациенты с ACE DD
генотипом имели значительно более низкие значения ИРЭ по сравнению с пациентами
с генотипом ACE II или ACE ID [14–18].
В рандомизированном исследовании Costa E. и соавт. [14] было установлено, что
пациенты, получавшие лечение ГД и не отвечавшие на терапию ЭСП, имели более
низкий уровень сывороточного альбумина, лимфоцитов и CD4+ клеток по сравнению с
пациентами с адекватным эритропоэтическим ответом. Полученные результаты
позволили предположить взаимосвязь между ЕРО-резистентностью и величиной
воспалительной реакции.
Подавление активности воспалительного процесса (когда это возможно)
восстанавливает чувствительность к ЭСП. Понимание сложных взаимодействий между
воспалительными цитокинами и синтезом ЕРО позволит разработать новые стратегии
преодоления резистентности анемии, включающие антицитокиновую и антиоксидантную
терапию.
Основными доказанными диализными факторами эффективности лечения анемии
являются вид диализной терапии, доза диализа, длительность и частота сеансов,
использование высокопроницаемых гемодиализных мембран, чистота воды для диализа.
Установлено, что гемодиафильтрация, адекватность диализа могут оптимизировать
ЕРО-реактивность и уменьшить потребность в ЭСП. Однако в исследовании,
проведенном Movilli E. и соавт., не удалось преодолеть резистентность к ЭСП у
пациентов без дефицита Fe при увеличении Kt/V > 1,33 и использовании
биологически совместимых синтетических мембран. Позже эти же авторы в
проспективном исследовании 107 пациентов, получавших лечение методом ГД,
подтвердили гипотезу, что использование ультрачистого диализата значительно
уменьшает ИРЭ, усиливает чувствительность к дарбэпоэтину (сокращение
еженедельной дозы на 34%) и значительно уменьшает уровни маркеров воспаления
[19, 20].
Лечение ЭСП не влияет на уровень витаминов в плазме крови, но у диализных
пациентов в редких случаях может развиться дефицит таких водорастворимых
витаминов, связанных с кроветворением, как фолиевая кислота и витамин В12. В
литературе описаны случаи преодоления резистентности к ЭСП назначением B12 и
больших доз фолиевой кислоты.
Другим потенциально важным, но оспариваемым фактором, вовлеченным в
резистентность к ЭСП, является дефицит L-карнитина — сложного эфира
пальмитиновой кислоты. В эксперименте карнитин увеличивает колоний-формирующие
единицы эритроида в костном мозге мыши, что позволило предположить его роль в
стимуляции эритропоэза [21]. Оксидантный стресс у пациентов с конечной стадией
ХБП приводит к перекисному окислению липидов мембраны эритроцитов и их
деструкции, усиливая, таким образом, анемию. Дефицит L-карнитина дестабилизирует
мембрану эритроцитов и сокращает их выживание. В недавнем исследовании Reuter S.
E. и соавт. [22] установили достоверную отрицательную корреляцию между уровнями
L-карнитина и ИРЭ, что позволило подтвердить его роль в развитии резистентности.
Резистентность к ЭСП может быть обусловлена уменьшением плацдарма
кроветворения из-за замещения эритроидного ростка костного мозга плазматическими
клетками или фиброзом у пациентов с ГПТ. Паратгормон (PTH) потенциально влияет
на секрецию ЕРО почечными перитубулярными фибробластами посредством косвенных
механизмов, оказывающих влияние на чувствительность эритроидных предшественников
к ЕРО. Al-Hilali N. и соавт. [23] оценили чувствительность анемии к ЭСП у 118
пациентов (ГД — 70,3% и постоянный амбулаторный перитонеальный диализ (ПАПД) —
29,7%) с ГПТ и установили сильную связь между ЕРО-гипореактивностью и высокими
уровнями PTH. Результаты проспективного клинического исследования,
проводившегося среди пациентов, получавших лечение ГД, подтвердили связь ГПТ с
более тяжелой анемией и устойчивостью к ЭСП. Терапия кальцитриолом или
паратиреоидэктомия позволили преодолеть резистентность анемии к ЭСП у ряда
пациентов.
Несмотря на использование современных методов очистки воды, используемой для
приготовления диализирующего раствора, у длительно находящихся на ГД пациентов
происходит медленное накопление в организме алюминия (Al). Наряду с
диализирующим раствором, источником его поступления в организм пациентов
является применение Al-содержащих фосфат-связывающих препаратов и антацидов.
Полагают, что абсорбцию Al в желудочно-кишечном тракте повышает дефицит Fe, и
Al поступает в клетку при взаимодействии комплекса трансферрин-Al со
специфическим рецептором, вытесняет Fe из цитоплазмы в ядро и митохондрии.
Проникая в эритроидные предшественники, Al нарушает образование гема, ингибируя
активность гемсинтезирующих ферментов. Вмешиваясь в синтез гема и влияя на
метаболизм Fe, Al усугубляет анемию и способствует ее резистентности к ЭСП.
У некоторых пациентов ЕРО резистентность может развиться при злокачественных
новообразованиях и гематологических заболеваниях. Резистентность к ЭСП обычно
наблюдается при миелопролиферативных заболеваниях, миелодиспластических
синдромах, гемоглобинопатиях, реже при множественной миеломе и хроническом
лимфоцитарном лейкозе.
Резистентность анемии к ЭСП может быть связана с белково-энергетической
недостаточностью — сложным синдромом, при котором наблюдается ассоциация между
недостаточным питанием и воспалительной реакцией. Феномен значительного
уменьшения выживаемости ГД-пациентов с низкой массой тела в сравнении с
пациентами с повышенным индексом массы тела (ИМТ) был назван обратной
эпидемиологией [24].
Жировая ткань оказывает двойной эффект на эритропоэз. Как IL-6, так и лептин
секвестрированы в жировой ткани, но IL-6 связан со снижением чувствительности к
ЕРО, в то время как лептин стимулирует развитие эритроида in vitro. При изучении
воздействия жировой массы и уровней лептина на чувствительность к ЕРО у 166
пациентов с конечной стадией ХБП было установлено, что при высоких уровнях
лептина отсутствуют любые ингибирующие эффекты высокой туловищной жировой массы
на чувствительность к ЭСП [25]. Интересное исследование, проведенное в 2008 г.
среди афроамериканского контингента ГД-пациентов (n = 479), показало, что
потребность в ЭСП и ЕРО-резистентность снижаются у пациентов с избыточной массой
тела [26]. Между индексом массы тела (ИМТ) и контролем анемии наблюдается
обратная корреляция.
Резистентность к ЭСП может возникать вследствие применения лекарственных
средств и чаще всего на фоне широко назначаемых антигипертензивных препаратов,
влияющих на ренин-ангиотензиновую систему (РАС). Среди антигипертензивных
препаратов только иАПФ и БРА индуцируют анемию посредством нескольких
механизмов, включающих ингибирующий эффект на образование ЕРО (вероятно
посредством вазодилятации и уменьшения гипоксической ЕРО-активности) и
увеличение плазменного уровня N-acetyl-serylaspartyl-lysyl-proline тетрапептида
(AcSDKP), продуцируемого стромальными клетками костного мозга. AcSDKP ингибирует
пролиферацию гемопоэтических предшественников, а его деградация осуществляется
АПФ. Полагают, что иАПФ блокируют компоненты локальной РАС в костном мозге,
которые участвуют в регуляции гемопоэза. Рецепторы ангиотензина (AT) 1
экспрессированы на эритроидных предшественниках; и АТ II, связываясь с этими
рецепторами, регулирует эритропоэз независимо от циркулирующего ЕРО и фенотипа
АПФ. Реагируя со специфическими рецепторами, АТ II активирует JAK 2-киназу —
переносчик гемопоэтического стимула, который образуется после взаимодействия ЕРО
со своим рецептором. БРА блокируют этот механизм активации [27, 28].
Парциальная эритроцитарная аплазия (PRCA) — синдром, который характеризуется
тяжелой нормоцитарной анемией, ретикулоцитопенией и отсутствием эритробластов в
костном мозге. PRCA, зарегистрированная при лечении эпоэтинами альфа и,
исключительно редко, бета является очень редкой причиной ЕРО-резистентности. В
подобной ситуации следует определить наличие АТ к ЕРО и прекратить лечение не
только эпоэтинами, но и другими ЭСП.
Приводим собственное клиническое наблюдение одной из редких причин
резистентности анемии к эпоэтинам короткого действия, которая была преодолена
назначением дарбэпоэтина альфа.
Пациент А., 69 лет, поступил в отделение ГД в апреле 2003 г. с терминальной
стадией хронической почечной недостаточности (ХПН) в исходе диабетической
нефропатии. Сахарный диабет (СД) 2-го типа диагностирован в 1986 г., и в течение
14 лет уровень гликемии контролировался пероральными гипогликемическими
препаратами (метформин). С середины 90-х гг. зафиксировано повышение АД до
220/110 мм рт. ст., принимал ингибиторы АПФ (эналаприл) в сочетании с
недигидропиридиновыми антагонистами Са (верапамил). Уровень АД на фоне
гипотензивной терапии — 140/90 мм рт. ст. с транзиторным повышением до
160–180/90–100 мм рт. ст. В марте 2000 г. развился геморрагический инсульт в
области варолиева моста с левосторонним гемипарезом, вестибулоатаксическим
синдромом. В это же время впервые выявлено повышение уровней креатинина и
мочевины в сыворотке крови. Из-за тяжелого течения и отсутствия компенсации СД
переведен на инсулинотерапию. В начале 2003 г. развилась терминальная стадия ХБП
(скорость клубочковой фильтрации (СКФ) 5 мл/мин), и в апреле месяце
госпитализирован с нарастающими симптомами уремии.
При поступлении: креатинин — 1214 мкмоль/л, мочевина — 56,8 ммоль/л, альбумин
сыворотки — 32 г/л, Hb — 43 г/л, Ht — 14%. Масса тела 68 кг. Уровень ферритина
составил 126 мкг/л, насыщение трансферрина (TSAT) — 8,6%, что позволило
диагностировать у пациента наличие функционального дефицита железа. Начата
заместительная почечная терапия ГД через двухходовой катетер, сформирован
постоянный сосудистый доступ — нативная фистула на левом предплечье. Проводился
бикарбонатный ГД на АИП Fresenius 4008 по 4 часа 3 раза в неделю. URR 68–75%, Kt/V
1,4–1,6. Коррекция тяжелой степени анемии осуществлялась гемотрасфузиями,
внутривенной инфузией железа [III] гидроксид сахарозного комплекса (венофера) со
стартовой дозы 500 мг и в последующем 100 мг в нед, внутривенным введением
эритропоэз-стимулирующих препаратов короткого действия (3 раза в неделю в дозе
12000 МЕ/нед и далее 24000 МЕ/нед). Несмотря на проводимую терапию с постоянным
применением Fe-содержащих препаратов и увеличением дозы эпоэтина, сохранялась
тяжелая анемия, что послужило основанием для всестороннего обследования
пациента, включая стернальную пункцию, с целью исключения причины ее
резистентности. К началу 2005 г. дефицит железа был преодолен (ферритин — 202
мкг/л, TSAT > 20%), однако уровень Нb по-прежнему находился в диапазоне от 50 до
80 г/л.
В начале 2008 г. назначен дарбэпоэтин альфа в дозе 90 мкг/нед (коэффициент
конверсии 1:267), уровень Нb в течение месяца повысился до целевого значения,
однако его прирост составил около 30 г/л мес, в связи с чем доза препарата была
уменьшена на 1/3. В последующем в поддерживающей фазе доза дарбэпоэтина альфа
составляла 30 мкг/нед, и целевой диапазон Нb сохранялся в течение 8 месяцев.
Повторное назначение ЭСП короткого действия в дозе 6000–12000–24000 МЕ/нед в
течение 5 последующих месяцев вновь сопровождалось развитием резистентной
анемии, которая вторично была преодолена переходом на лечение дарбэпоэтином
альфа в дозе 30 мкг/нед (рис. 2).
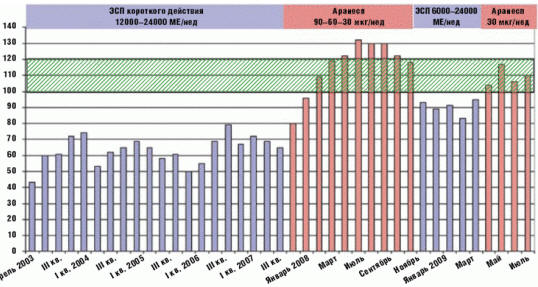
Рис. 2. Динамика уровня гемоглобина на фоне терапии
различными эритропоэз-стимулирующими препаратами
В сентябре 2009 г. пациент умер, причина летального исхода была обусловлена
внезапной кардиальной смертью.
Основной особенностью представленного клинического наблюдения ГД-пациента с
анемией тяжелой степени тяжести является длительно существующая резистентность
анемии к высоким дозам ЭСП короткого действия, которую, несмотря на восполнение
дефицита железа, удалось преодолеть только переходом на лечение дарбэпоэтином
альфа. При этом переход с эпоэтина альфа на дарбэпоэтин альфа был связан с
быстрым достижением целевого уровня Нb и существенным уменьшением дозы препарата
в пересчете на эпоэтин альфа (коэффициент конверсии 1:267). К сожалению, из-за
временного отсутствия дарбэпоэтина альфа повторный курс терапии ЭСП короткого
действия вновь сопровождался снижением Нb и развитием резистентности, которую
повторно удалось преодолеть минимальной дозой дарбэпоэтина альфа (коэффициент
конверсии 1:800!). Наше наблюдение свидетельствует, что причина резистентности
анемии может быть обусловлена типом ЭСП.
Управление анемией остается трудной задачей у существенной части диализных
пациентов. К сожалению, у 10–20% пациентов cнижается или отсутствует реакция на
эритропоэтин, несмотря на терапию большими дозами. Так как анемия и устойчивость
к ЭСП способствуют повышению заболеваемости и летальности, важно понимать
этиологические факторы и способы преодоления этого синдрома с целью улучшения
клинических исходов.
Литература
- Anemia Management in People with Chronic Kidney Disease. NICE Clinical
Guideline (February 2011).
- Coresh J., Astor B. C., Greene T. et al. Prevalence of chronic
kidney disease and decreased kidney function in the adult // Am J Kidney Dis.
2003; 41 (1): 1–12.
- Locatelli F., Covic A., Eckardt K. U., Wiecek A., Vanholder R.
ERA-EDTA ERBP Advisory Board: Anaemia management in patients with chronic
kidney disease: a position statement by the Anaemia Working Group of European
Renal Best Practice (ERBP) // Nephrol Dial Transplant. 2009; 24: 348–354.
- Priyadarshi A., Shapiro J. Erythropoietin resistance in the
treatment of the anemia of chronic renal failure // Semin Dial. 2006; 19:
273–278.
- Portoles J., Lopez-Gomez J. M., Aljama P. MAR Study Group: A
prospective multicentre study of the role of anaemia as a risk factor in
haemodialysis patients: the MAR Study // Nephrol Dial Transplant. 2007; 22:
500–507.
- Kilpatrick R. D., Critchlow C. W., Fishbane S. et al. Greater
epoetin alfa responsiveness is associated with improved survival in
hemodialysis patients // Clin J Am Soc Nephrol. 2008; 3: 1077–1083.
- National Kidney Foundation: NKF-DOQI Clinical Practice Guidelines for the
Treatment of Anemia of Chronic Renal Failure. New York, National Kidney
Foundation, 2006.
- Eknoyan G., Latos D. L., Lindberg J. Practice recommendations for
the use of L-carnitine in dialysis-related carnitine disorder. National Kidney
Foundation Carnitine Consensus Conference // Am J Kidney Dis. 2003; 41:
868–876.
- Ganz T. Hepcidin, a key regulator of iron metabolism and mediator
of anemia of infl ammation // Blood. 2003; 102: 783–788.
- Nicolas G., Chauvet C., Viatte L. et al. The gene encoding the
iron regulatory peptide hepcidin is regulated by anemia, hypoxia, and
inflammation // J Clin Invest. 2002; 110: 1037–1044.
- Atanasiu V., Manolescu B., Stoian I. Hepcidin the link between
inflammation and anemia in chronic renal failure, Rom // J Intern Med. 2006;
44: 25–33.
- Sela B. A. Hepcidin: the discovery of a small protein with a
pivotal role in iron homeostasis // Harefuah. 2008; 147: 261–266.
- Costa E., Pereira B. J., Rocha-Pereira P. et al. Role of
prohepcidin, inflammatory markers and iron status in resistance to rhEPO
therapy in hemodialysis patients // Am J Nephrol. 2008; 28: 677–683.
- Costa E., Lima M., Alves J. M. et al. Inflammation, T-cell
phenotype, and inflammatory cytokines in chronic kidney disease patients under
hemodialysis and its relationship to resistance to recombinant human
erythropoietin therapy // J Clin Immunol. 2008; 28: 268–275.
- Cooper A. C., Mikhail A., Lethbridge M. W. et al. Increased
expression of erythropoiesis inhibiting cytokines (IFN-gamma, TNF-alpha,
IL-10, and IL-13) by T cells in patients exhibiting a poor response to
erythropoietin therapy // J Am Soc Nephrol. 2003; 14: 1776–1784.
- Locatelli F., Canaud B., Eckardt K. et al. Oxidative stress in
endstage renal disease: an emerging threat to patient outcome // Nephrol Dial
Transplant. 2003; 18: 1272–1280.
- Panichi V., Migliori M., De Pietro S. et al. Plasma C-reactive
protein in hemodialysis patients: a cross-sectional, longitudinal clinical
survey // Blood Purif. 2000; 18: 30–36.
- Del Vecchio L., Pozzoni P., Andrulli S., Locatelli F.
Inflammation and resistance to treatment with recombinant human erythropoietin
// J Ren Nutr. 2005; 15: 137–141.
- Movilli E., Cancarini G. C., Vizzardi V. и соавт. Epoetin
requirement does not depend on dialysis dose when Kt/N >1.33 in patients on
regular dialysis treatment with cellulosic membranes and adequate iron stores
// J Nephrol. 2003; 16: 546–551.
- Molina M., Navarro M. J., Palacios M. E. и соавт. Importance of
ultrapure dialysis liquid in response to the treatment of renal anaemia with
darbepoetin in patients receiving haemodialysis // Nefrologia. 2007; 27:
196–201.
- Kitamura Y., Satoh K., Satoh T., Takita M., Matsuura A. Effect of
L-carnitine on erythroid colony formation in Mouse bone marrow cells //
Nephrol Dial Transplant. 2005; 20: 981–984.
- Reuter S. E., Faull R. J., Ranieri E., Evans A. M. Endogenous
plasma carnitine pool composition and response to erythropoietin treatment in
chronic haemodialysis patients // Nephrol Dial Transplant. 2009; 24: 990–996.
- Al-Hilali N., Al-Humoud H., Ninan V. T., Nampoory M. R., Puliyclil M.
A., Johny K. V. Does parathyroid hormone affect erythropoietin therapy in
dialysis patients? // Med Princ Pract. 2007; 16: 63–67.
- Kalantar-Zadeh K., McAllister C. J., Lehn R. S. et al. Effect of
malnutrition-inflammation complex syndrome on EPO hyporesponsiveness in
maintenance hemodialysis patients // Am J Kidney Dis. 2003; 42: 761–773.
- Axelsson J., Qureshi A. R., Heimburger O. и соавт. Body fat mass
and serum leptin levels influence epoetin sensitivity in patients with ESRD //
Am J Kidney Dis. 2005; 46: 628–634.
- Kotanko P., Thijssen S., Levin N. W. Association between
erythropoietin responsiveness and body composition in dialysis patients //
Blood Purif. 2008; 26: 82–89.
- Qureshi I. Z., Abid K., Ambreen F., Qureshi A. L. Angiotensin
converting enzyme inhibitors impair recombinant human erythropoietin induced
erythropoiesis in patients with chronic renal failure // Saudi Med J. 2007;
28: 193–196.
- Saudan P., Halabi G., Perneger T. и соавт. Western Switzerland
Dialysis Group: ACE inhibitors or angiotensin II receptor blockers in dialysed
patients and erythropoietin resistance // J Nephrol. 2006; 19: 91–96.
Статья опубликована в журнале
Лечащий Врач

