Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Фармакоэкономическая модель помповой инсулинотерапии у детей
и подростков с сахарным диабетом 1-го типа
Е. Г. Михайлова, кандидат медицинских наук
ГДКБ № 1, Самара
Сахарный диабет (СД) 1-го типа — хронически протекающее эндокринное
заболевание, характеризующееся абсолютным дефицитом эндогенного инсулина,
острыми и хроническими осложнениями.
Экономические проблемы СД базируются на общих положениях: определение прямых
затрат, связанных с заболеванием (на медикаменты, средства контроля и средства
введения, оборудование, лабораторные исследования, уход в больнице или дома), и
определение второстепенных расходов, связанных с заболеванием (потеря
трудоспособности, инвалидность и преждевременная смерть). Важным является и
определение затрат, которые несет сам больной (оплата медицинских услуг, потеря
времени на поиски работы, страховки и т. п.), а также определение наиболее
эффективного использования ресурсов здравоохранения. Расчеты, представленные
ниже, основаны на эпидемиологических данных и не рассматривают косвенные
расходы, которые по оценкам экспертов составляют не менее половины всех затрат
на диабет.
Известно, что основные расходы, связанные с СД, приходятся не на лечение
самого диабета, а на лечение его осложнений, которые являются причиной ранней
инвалидизации и смерти больных. При этом доля этих расходов достигает 90% от
всех прямых затрат, связанных с лечением больных СД. Поэтому экономический
аспект лечения осложнений СД является одним из важных в плане ожидаемого
положительного эффекта от внедрения новых лекарственных средств, средств
введения и мониторинга, а также новых технологий в лечении СД в целом.
Поэтому клиническую эффективность целесообразно оценивать в различных
формирующих ее сферах: не только привлекая показатели работы эндокринологической
службы (уровень регоспитализации как весьма приблизительный показатель частоты
обострений и рецидивов), но и оценивая безопасность и переносимость лечения, а
также приверженность к нему, социальное функционирование и качество жизни (КЖ)
пациентов. Наиболее распространенная количественная единица измерения
«полезности» терапии, вытекающая из предпочтения пациента достичь благополучного
состояния здоровья, QALY (сохраненные годы качественной жизни), объединяет и
взвешивает клинические и гуманистические (КЖ и предпочтения пациента) результаты
терапии. Год жизни в состоянии «абсолютного здоровья» соответствует 1 QALY,
состояние смерти — 0 QALY, а страдания (в том числе от нежелательных явлений
терапии) уменьшение полученных QALY.
Фармакоэкономический анализ «затраты/полезность» позволяет дать всеобъемлющую
оценку результатов любого медицинского вмешательства с позиции пациента как
целостной личности с учетом его предпочтений, общей для всех людей потребности в
независимой и не сопряженной со страданиями жизнью.
Материалы и методы
Проанализированы статистические показатели работы детской эндокринологической
службы Самарской области за период 2007–2009 гг. Системы подкожного введения
инсулина используются в области с 2007 г., 84 человека получают инсулинотерапию
с помощью помпы в течение последних двух лет.
Анализу подвергались данные о наиболее часто встречающихся острых осложнениях
СД, требующих экстренной госпитализации, таких как диабетический кетоацидоз.
Также были проанализированы данные о поздних осложнениях диабета, таких как
диабетическая нефропатия, ретинопатия, полинейропатия. Были рассмотрены затраты
на лечение этих осложнений.
Приведены сравнительные данные о потребности в медикаментозном лечении, в
частности инсулинотерапии, а именно: общая суточная доза инсулина, относительная
и абсолютная чувствительность к инсулину, стоимость базисной терапии инсулином с
применением традиционных средств введения (шприц-ручки) и с применением
инсулиновых помп.
Рассмотрены сравнительные показатели компенсации течения диабета (уровень
гликированного гемоглобина крови) у пациентов, получающих инсулинотерапию
шприц-ручками и с помощью системы подкожного введения инсулина.
В модели рассмотрен ряд клинических ситуаций, или сценариев (табл. 1).
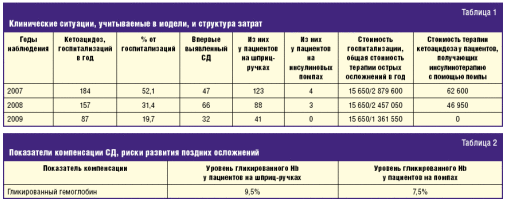
Таким образом, общие прямые затраты на госпитализацию пациентов с острыми
осложнениями СД, такими как кетоацидоз, у пациентов-пользователей помп
составляют не более 2% всех затрат от общего числа пациентов. За 2009 г. ни один
пациент, получающий помповую инсулинотерапию, не был госпитализирован с
диабетическим кетоацидозом. Тогда как с данным осложнением ряд
пациентов-подростков, использующих шприц-ручки, с плохой комплаентностью к
лечению были госпитализированы неоднократно.
Общепринятым является метод оценки компенсации диабета на основании уровня
гликированного гемоглобина HbA1 (его контроль и оценка позволяет
судить о течении СД и его компенсации за последние 3 мес). Доказано, что
снижение уровня гликированного гемоглобина на каждую единицу позволяет снизить
риск развития поздних осложнений СД по различным данным от 15% до 30%.
Исходя из данного наблюдения (табл. 2), можно предположить в будущем снижение
риска развития поздних осложнений в результате применения систем подкожной
инфузии инсулина на 30–60%. Динамика снижения числа поздних осложнений у детей и
подростков с СД с начала внедрения помповой инсулинотерапии приведена в табл. 3.
С учетом срока заболевания СД до развития поздних осложнений (от 5 до 10 лет),
приведенная статистика является показательной. Однако достоверно оценить влияние
на снижение данных показателей возможно лишь при охвате помповой
инсулинотерапией не менее 50% детей и подростков с СД 1-го типа.
Анализируя расходы на лечение приведенных выше осложнений, следует учитывать
не только затраты на специализированную офтальмологическую помощь (26 500
руб./год), но и затраты на диализ в случае развития диабетической нефропатии
(табл. 4).
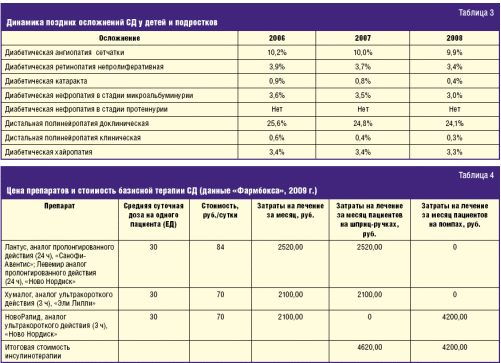
Снижение затрат на инсулинотерапию связано не только с переходом у пациентов
на помпах на ультракороткие аналоги как в базальном, так и в болюсном режиме, но
также и в связи с наблюдающимся уменьшением суточной потребности в инсулине.
Соответственно, учитывался фактор снижения среднесуточной дозы инсулина.
Наиболее показательной по данным критериям является группа подростков со стажем
диабета не менее 5 лет, демонстрирующих признаки инсулинорезистентности (30–40%
всех пациентов с диабетом, 250–300 пациентов). При проведении расчетов установок
помп, согласно алгоритмам ЭНЦ РАМН, проводилось снижение общей суточной дозы на
25–30%. Суммируя вышеизложенное, уже существующая суммарная ежемесячная экономия
на лекарственных препаратах у группы детей на помпах составляет в настоящее
время 253 000 руб.
Если общие прямые расходы пересчитать на одного больного в год, то получим
более или менее сравнимые данные. Так, в США прямые расходы на одного больного в
год составили в 1997 г. — $5512,5, в Англии — $3080, в Финляндии — $3209, в
Австралии — $2060, в странах Центральной и Южной Америки лишь $353. Величина
этих расходов в первую очередь зависит от уровня медицинской помощи и может не
соответствовать необходимым и достаточным расходам на диабет.
Расчеты прямых расходов на диабет построены исходя из стоимостной ситуации в
России в отношении лекарственных средств, средств самоконтроля, средств
введения, оборудования, лечения в условиях стационара и амбулатории, обучения
больных и т. д. Эти расходы существенно зависят от наличия осложнений диабета и
их тяжести. Так, на офтальмологическую помощь больному с начальной ретинопатией
расходуется в среднем $68,6 в год, с тяжелой пролиферативной формой — $1030, т.
е. в 15 раз больше. На лечение больного с нефропатией в начальной стадии
расходуется $245 в год, с хронической почечной недостаточностью (ХПН) $2012 без
учета расходов на гемодиализ, трансплантацию почки; стоимость лечения ХПН в США
— $45 000 в год.
При СД 1-го типа без осложнений средние прямые затраты составили $1124, при
СД 2-го типе — $853 в год. Они заметно возрастают с появлением осложнений,
средние прямые расходы на одного больного с СД 1-го типа возрастают до $2146, с
СД 2-го типа — до $1786 в год. При наличии у больных ХПН, отслойки сетчатки и
слепоты, диабетической стопы, требующей не только консервативного, но и
хирургического лечения (пластика сосудов, ампутация с последующим
протезированием), инфаркта миокарда, нарушения мозгового кровообращения — прямые
расходы резко возрастают, в среднем они составляют $24 276 в год на одного
больного с СД 1-го типа и $8630 — с СД 2-го типа.
Исходы диабета за последние три года в Самарской области следующие. В 2006
году летальный исход пациента с диабетом от сепсиса, в 2007 году — терминальной
стадии миастении. В 2008 году летальных исходов нет.
Обсуждение
Несмотря на более низкую стоимость терапии шприц-ручками, ее полная стоимость
сравнима со стоимостью терапии инсулиновыми помпами, обладающим благоприятным
профилем нежелательных действий, большей полезностью терапии и меньшей
стоимостью в расчете на 1 QALY. Так, в перерасчете на одного пациента в год
только лечение острых осложнений диабета составляет 6411 руб., тогда как
применение систем подкожной инфузии инсулина с учетом расходных материалов 10
613 руб.
Более важным представляется перспективное снижение затрат на лечение поздних
осложнений СД у пациентов, применяющих помповую инсулинотерапи, а также
сохранение такого показателя, как КЖ и снижение инвалидизации.
Таким образом, системы подкожного введения инсулина с учетом преимуществ в
эффективности и переносимости становятся научно обоснованным методом выбора для
лечения подгруппы пациентов с лабильным течением СД, подростков с явлениями
инсулинорезистентности, детей раннего возраста, отличающихся повышенным риском
развития неврологических и метаболических расстройств. Возможно, полученные
данные можно распространить на всех больных СД из группы риска развития
указанных нежелательных осложнений.
Порог «затраты/полезность» в зарубежных исследованиях соответствует 20 тыс.
канадских долларов 1992 г. (примерно 15 тыс. долларов США) за 1 QUALY [7]. При
международном сопоставлении медицинских затрат («корзины» медицинских услуг)
затраты на лечение в России в 5 раз меньше, чем в США (табл. 5).

Контролируемые сравнительные исследования американских ученых (DCCT) в
течение 10 лет показали, что интенсивная инсулинотерапия больных
инсулинозависимым СД снижает риск развития пролиферативной ретинопатии на
50–70%, нефропатии — на 40%, нейропатии — на 80%, макроангиопатии — на 40%; в
7–10 раз снижает показатели временной нетрудоспособности, в том числе сроки
стационарного лечения; минимум на 10 лет продлевает трудовую деятельность.
Таким образом, интенсивная инсулинотерапия с помощью инсулиновых помп
является самым эффективным и более физиологичным методом введения инсулина,
который имитирует работу поджелудочной железы. У больных СД, имеющих инсулиновые
помпы с соответствующим инсулином, жизненные интересы практически совпадают с
таковыми у здорового человека. Ребенок, подросток, взрослый человек с
инсулинозависимым СД могут учиться, работать, полноценно жить в режиме здорового
человека, а не делать множественные инъекции и проколы для анализа сахара крови.
Главная цель врача и больного при лечении диабета заключается в достижении
уровня гликемии, близкого к нормальным показателям. Реальным путем достижения
этой цели является интенсивная терапия с использование инсулиновых помп.
Интенсивная терапия с помощью помп возможна только при наличии современных
средств контроля за гликемией (глюкометры, системы мониторинга глюкозы в
реальном времени и т. д.) и обучения больных самоконтролю.
Литература
- Wolfgan Gruber et al. The Economic of Diabetes and Diabetes care //
Сахарный диабет». 2005, № 2.
- Pickup J. C. et al. Prevalence — Diabetes Atlas, IDF (20–79 Years
old). Determinants of glycemic control in type 1 diabetes during intensified
therapy with MDI of insulin or CSII: importance of BG variability // Diabete
Metab Res Rev. 2006, 22: 232–237.
- Tamborlane W. V. et al. Insulin pump therapy in childhood
diabetes mellitus: guidelines for use // Treat Endocrinol. 2003, 2: 11–21.
- Hirsch I. B. et al. Should minimal BG variability become the gold
standart of glycemic comtrol? // J Diabetes Compl. 2005, 19: 178–181.
Статья опубликована в журнале
Лечащий Врач

