Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Функциональные
расстройства сфинктера Одди в практике терапевта
С.Н. Мехтиев, О.А.
Мехтиева, Ю.Р. Куликова
Рассмотрены современные подходы к диагностике и
лечению функциональных расстройств сфинктера Одди (ФРСО).
Приведены схема терапии и профилактики ФРСО по
материалам Римских критериев IV, 2016.
Ключевые слова / keywords: Актуальная
тема, Болевой абдоминальный синдром, Лечение,
Сфинктер Одди, Функциональное билиарное
расстройство, Abdominal pain syndrome, Treatment,
Oddi’s sphincter, Functional biliary disorder
Нередко, сталкиваясь в клинической практике с
болевым абдоминальным синдромом, локализованным в
эпигастральной области, правом или левом
подреберьях, врачу-терапевту необходимо провести
дифференциальный диагноз и, при отсутствии
структурных изменений, верифицировать наличие у
пациента функционального билиарного расстройства
(ФБР).
На сегодняшний день известно, что данная
патология встречается более чем у 15% взрослого
населения, прогрессивно увеличиваясь с возрастом
[1–3]. При этом на долю функциональных расстройств
сфинктера Одди (ФРСО) приходится более чем 70% всех
случаев ФБР. Это связано с большим числом
предрасполагающих факторов, в том числе частым
применением холецистэктомий. Важно учитывать, что
2/3 всех случаев ФБР развиваются на фоне
существующего поражения желудочно-кишечного тракта (ЖКТ),
в том числе других функциональных
гастроинтестинальных расстройств [4].
В последних Римских критериях IV 2016 г.
рассматриваются такие виды ФБР, как функциональная
билиарная боль, функциональное расстройство желчного
пузыря (ФРЖП), ФРСО билиарного и панкреатического
типов (ФРБС и ФРПС) (рис. 1).

Рис. 1. Строение сфинктера Одди
Проблема ФРСО на сегодняшний день является крайне
актуальной. Это связано с тем, что его диагностика,
основанная на оценке клинических и
лабораторно-инструментальных признаков, требует
применения инвазивных методик (манометрии СО,
эндоскопической ретроградной холангиопанкреатографии
(ЭРХПГ)), что представляет собой сложную задачу.
Вопросы лечения ФРСО также не имеют окончательного
решения, прежде всего в отношении определения
показаний к эндоскопическим и хирургическим методам.
Так, недавно проведенные контролируемые исследования
показали, что сфинктеротомия у больных с
постхолецистэктомическими болями в ряде случаев не
превосходит по эффективности лечения плацебо [4].
В целом, по мнению экспертов, на сегодняшний день
существует острая необходимость в проведении
проспективных исследований с целью обеспечения
врачей, занимающихся данной категорией пациентов,
наиболее эффективными диагностическими и
терапевтическими методиками.
Итак, при обнаружении ФРСО врачу-клиницисту важно
знать ответы на следующие вопросы:
- Каковы основные этиопатогенетические
механизмы развития ФРСО?
- Каковы современные клинические критерии
диагностики ФРСО?
- Какие на сегодняшний день
лабораторно-инструментальные методы необходимы
для постановки диагноза ФРСО?
- Как правильно сформулировать диагноз у
пациента с ФРСО?
- Какие существуют современные подходы к
лечению ФРСО?
- Каковы показания для эндоскопического (сфинктеропапиллотомии)
и хирургического лечения при ФРСО?
Основные этиопатогенетические механизмы
развития ФРСО
В возникновении ФРСО участвует целый комплекс
этиологических факторов, приводящих к нарушениям
вегетативной и гуморальной регуляции мышечного
тонуса гладкой мускулатуры СО, а также тесно
взаимосвязанных с этим реологических свойств желчи.
К наиболее значимым относятся:
- наследственная предрасположенность
(ферментативные дефекты синтеза солюбилизантов
желчи, синдром Жильбера);
- врожденная патология (аномалии строения
желчевыводящих путей);
- конституционная предрасположенность
(астенический тип телосложения или ожирение);
- пожилой возраст (снижение чувствительности
СО к нейрогормональным стимулам);
- хронические заболевания ЖКТ (гастрит,
дуоденит, колит, илеит, язвенная болезнь,
целиакия), при которых нарушается выработка
кишечных гормонов (гастрина, секретина,
холецистокинина и др.), влияющих на моторику СО;
- хронические заболевания печени (расстройство
функции СО вследствие нарушения выработки
желчных кислот, изменений реологических свойств
желчи и холестаза);
- хронические воспалительные процессы органов
брюшной полости и малого таза: аднексит, киста
яичника, пиелонефрит и др. Причина ФРСО в этих
случаях связана с тем, что в ответ на
раздражение пораженного органа, вследствие
висцеро-висцеральных рефлексов, изменяется
чувствительность СО;
- инфекции (бактериальные, вирусные, глистные,
паразитарные, лямблиоз). Механизм ФРСО в данном
случае связан с тем, что токсины вирусов и
бактерий воздействуют на нервно-мышечный аппарат
СО, вызывая его повышенную сократимость;
- гормональные расстройства: сахарный диабет,
гипер- или гипотиреоз, гиперэстрогенемия (в том
числе при беременности), ожирение;
- послеоперационные состояния —
холецистэктомия, резекция желудка, кишечника,
наложение анастомозов, ваготомия;
- аллергические заболевания (вследствие
повышенного раздражения аллергенами
нервно-мышечного аппарата СО нарушается
взаимосвязь между его сокращением и
расслаблением);
- психоэмоциональные перегрузки (что приводит
к нарушению вегетативной регуляции СО);
- гиподинамия (что приводит к застою желчи и
нарушению ее реологических свойств);
- алиментарные нарушения (вследствие
употребления пищи, бедной растительными
волокнами, а также с избытком углеводов и
животных белков, нерегулярного питания,
переедания, быстрой еды, непережевывания,
голодания с резкой редукцией массы тела,
длительного парентерального питания возникают
нарушения реологических свойств желчи);
- применение лекарственных препаратов,
приводящих к нарушению реологических свойств
желчи (пероральных контрацептивов, препаратов
для нормализации липидного обмена,
цефалоспоринов 3-го поколения, производных
сандостатина).
Патогенез ФРБС
Классическое учение о ФРБС заключалось в том, что
в его основе лежит повышение давления в билиарном
отделе СО, а это, в свою очередь, нарушает
опорожнение ЖП и приводит к последующему росту
внутрипузырного давления и возникновению билиарной
боли.
Однако теоретические и экспериментальные данные
указывают на более сложную патофизиологию этого
процесса [5]. Считается доказанным, что динамика
сокращения/расслабления СО значимо изменяется после
холецистэктомии. Так, исследования на животных
показали наличие в данной зоне cholecystosphincteric
рефлекса [6]. Взаимодействие этих органов
осуществляется по механизму обратной связи, когда
повышение давления в ЖП приводит к релаксации СО.
Прерывание этого рефлекса может повлиять на
изменение ответа сфинктера на холецистокинин (ХЦК).
При этом из-за потери иннервации изменяются
непосредственные сократительные эффекты влияния ХЦК
на гладкие мышцы. Аналогичное воздействие на
базальное давление СО и чувствительность его к ХЦК
также было описано в организме человека [7].
По мнению экспертов, нарушение сокращения СО,
такое как гипертонус, может диагностироваться в
клинической практике, однако больше в качестве
маркера этого синдрома, а не причины [4].
Вследствие ФРБС происходит некоординированный
отток желчи, что может приводить к нарушениям как в
работе пищеварительной системы, так и организма в
целом (табл. 1).
Таблица 1. Последнем нарушений
сократительной функции СО и физиологического оттока
желчи
| Механизм |
Последствие |
| 1. Мальдигестия и мальабсорбция жиров |
Похудание
Стеаторея
Нарушение всасывания жирорастворимых витаминов
А, D: E, К
Гипохолестеринемия (редко)
Оксалатурия и развитие мочекаменной болезни |
2. Нарушение активации панкреатических
ферментов
в двенадцатиперстной кишке (ДПК) |
Вторичная экзокринная недостаточность
поджелудочной железы |
| 3. Ухудшение бактерицидных свойств желчи
(недостаточное ее концентрирование в ЖП) |
Развитие синдрома избыточного бактериального
роста (СИБР) в тонкой кишке: кишечная диспепсия,
диарея |
4. Нарушение энтерогепатической циркуляции
желчных
кислот вследствие их преждевременной
деконъюгации и повышенной потери с калом в
условиях СИБР и диареи |
Нарушение реологических свойств желчи,
билиарный сладж, ЖКБ
Повреждение слизистой кишечника токсичными
желчными кислотами |
| 5. Нарушение моторной активности кишки |
Чередование запоров (при застое желчи) и
диареи (при повышенном сбросе желчи) |
6. Дуоденальная гипертензия вследствие
мальабсорбции
жиров, СИБР |
Дуоденогастральный рефлюкс, рефлюкс-гастрит
Ухудшение нарушений оттока желчи и
панкреатического сока в ДПК |
Патогенез ФРПС
По последним представлениям считается, что
гипертензия панкреатического сфинктера (ПС) может
вызвать не только функциональную боль
панкреатического типа, но и собственно развитие
рецидивирующего панкреатита. Повышение давления в
панкреатическом отделе СО может быть связано с
обструкцией сфинктера (при опухолях сосочка,
закупорке протоков камнями, слизистыми пробками,
формировании муцинозных новообразований в
интрапанкреатическом протоке), а также его спазмом
(например, при приеме опиатов) [8].
У пациентов с необъяснимыми приступами
панкреатита часто регистрируется повышенное давление
в ПС. Патогенетическим основанием единства ФПРС и
панкреатита является тот факт, что повышенное
давление в ПС было описано у 50– 87% пациентов с
хроническим панкреатитом различных этиологий [9,
10]. Играет ли это ведущую роль в патогенезе
заболевания или является следствием прогрессирования
хронического панкреатита, пока не установлено.
Доказательством того, что повышенное давление ПС
способно вызвать панкреатит, является факт
исчезновения атак после абляции сфинктера [11].
Эксперты свидетельствуют об увеличении
вероятности повторных приступов панкреатита у
пациентов с повышенным давлением в ПС при отсутствии
данного лечения в 3,5 раза [4].
Однако существующее мнение о том, что ФРПС
приводит к панкреатической боли при отсутствии
доказанных признаков панкреатита, по мнению
большинства специалистов, в большей степени является
теоретическим.
Клинические критерии диагностики ФРБС и ФРПС
Подозрение на ФРСО должно возникать при наличии
болевого абдоминального синдрома, который
характеризуется рецидивирующими приступами болей до
30 и более минут в эпигастральной области и правом
подреберье с иррадиацией в правую лопатку (при ФРБС);
в левом подреберье с иррадиацией в спину (при ФРПС).
Боль развивается, как правило, через 30–40 минут
после еды, нередко в середине ночи. Боль не
уменьшается после дефекации, приема антацидов,
перемене положения тела.
Болевой синдром часто сопровождается проявлениями
билиарной диспепсии (горечь во рту, воздушные
отрыжки, чувство быстрого насыщения, тяжесть и боль
в эпигастрии, тошнота и эпизодическая рвота,
приносящая облегчение), а также кишечной дисфункции
в виде неустойчивого стула. Как у большинства
пациентов с функциональными гастроинтестинальными
расстройствами, при ФРСО также нередко встречается
астеновегетативный синдром (раздражительность,
повышенная утомляемость, головная боль, повышенная
потливость).
При ФРСО отмечается наличие общих клинических
критериев, характерных для всей функциональной
патологии пищеварительной системы, а именно:
- продолжительность основных симптомов не
менее 3 месяцев на протяжении последнего года;
- отсутствие органической патологии;
- множественный характер жалоб при общем
хорошем состоянии и благоприятное течение
заболевания без заметного прогрессирования;
- важная роль в провоцировании приступов боли
психоэмоциональных факторов.
По рекомендациям Римского консенсуса IV, ФРБС
диагностируется у пациентов с болями билиарного
типа, в том числе с болями после холецистэктомии,
когда камни и другие патологии исключены (табл. 2).
Таблица 2. Критерии диагностики
ФРСО (Римский консенсус IV)
ФРБС
|
ФРПС
|
|
Основные критерии |
1) Типичная билиарная боль;
2) Отсутствие камней желчных протоков или
других структурных нарушений;
3) Повышение печёночных ферментов или
расширенный желчный проток более 0,6 см (одно
из двух, но не оба вместе)
|
1) Задокументированные повторные эпизоды
атак (обострений) панкреатита (типичной боли с
повышенной амилазой или липазой < 3 раза выше
нормы и/или визуальные доказательства острого
панкреатита (КТ, МРТ)
2) Исключение других этиологий панкреатита;
3) Отсутствие изменений поджелудочной железы
(нормальные размеры поджелудочной железы и
Вирсунгова протока), микрохолелитиаза при
эндоскопическом ультразвуковом исследовании (ЭУЗИ)
4) Повышенное давление панкреатического СО при
манометрии |
|
Поддерживающие
критерии |
1) Нормальные показатели амилазы/липазы;
2) Повышение уровня давления с СО при
манометрии;
3) Гепатобилиардная сцинтиграфия (нормальные
показатели ФВЖП);
4) Холицистоэктомия в анамнезе
|
1) Нормальные показатели АЛТ, АСТ, ЩФ,
ГГТП (но могут быть повышены при сопутствующей
патологии печени);
2) Повышение амилазы/липазы крови, связанное
по времени не менее чем с двумя эпизодами
болей;
3) Гепатобилиарная сцинтиграфия (нормальные
показатели ФВЖП)
4) Холицистоэктомия в анамнезе |
|
Отличия от
Римских критериев III (2006 г.) |
1) Обязательным теперь является наличие
повышения печёночных трансамилаз или
расширения желчного протока.
2) Нормальные значения амилазы/липазы
перенесены в поддерживающие критерии (может
быть их повышение на фоне приступа боли)
3) Добавлено «повышение давления в СО по
данным манометрии», поскольку в клинических
исследованиях было показано, что наличие
данного фактора может быть предиктором
позитивного ответа на сфинктеротомию.
4) Включена гепатобилиарная сцинтиграфия, но
ценность её обсуждается |
1) Обязательным теперь считается наличие
задокументированных атак панкреатита.
2) Повышение амилазы/липазы более 3N
|
По мнению специалистов, участвующих в принятии
Римских критериев IV, ФРПС может рассматриваться у
больных с документированным острым рецидивирующим
панкреатитом, после исключения всех известных
этиологий и поиска структурных аномалий, а также при
повышении давления в панкреатическом СО при
манометрии [4].
При физикальном обследовании пациента с ФРСО
часто выявляется появление налета желто-коричневого
цвета на корне языка (при развитии
дуоденогастрального рефлюкса), болезненность при
пальпации в точке Дежардена (в проекции СО),
болезненность при пальпации поджелудочной железы по
Гротту, зоне Шоффара, Губергрица, точке Мейо–Робсона,
точке Кача (при ФРПС и обострении панкреатита) (рис.
2).
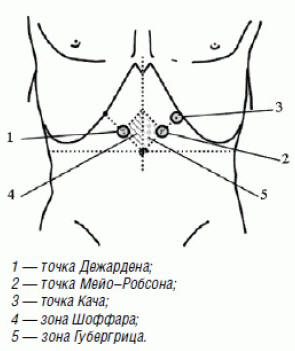
Рис. 2. Болевые точки и зоны
при ФБР и панкреатите
Лабораторно-инструментальные методы,
необходимые для постановки диагноза ФРСО
Основными доступными методами верификации ФРСО
являются: биохимический анализ крови (изменение
активности печеночных или панкреатических ферментов,
хронологически связанной с абдоминальными болями), а
также ультразвуковое исследование брюшной полости,
при котором у ряда пациентов обнаруживается
расширение холедоха более 6 мм.
Однако ферменты печени, повышающиеся при
приступах болей в животе, могут являться признаком
не только обструкции СО при спазме (или прохождении
камней), но и других заболеваний печени,
панкреатобилиарной системы. А расширение холедоха
часто не регистрируется.
В таких ситуациях в качестве оптимального
исследования можно рекомендовать эндоскопическое
ультразвуковое исследование (ЭУЗИ), которое является
более чувствительным, по сравнению с УЗИ, методом
для обнаружения дилятации холедоха, мелких камней и
осадка в желчевыводящих путях, органических
изменений СО, небольших опухолей и начальных
признаков хронического панкреатита.
Данная методика лучше, чем МРТ/ЭРХПГ/МСКТ, в
определении камней желчного протока. Ее
специфичность и чувствительность превышает 98%
[12–15]. При этом ЭУЗИ практически единственный
метод для выявления конкрементов меньше 3 мм, а его
использование помогает избежать выполнения
инвазивных контрастных исследований, в частности
ЭРХПГ.
По мнению экспертов, диагностика ФРСО при помощи
инвазивных инструментальных методов (ЭРХПГ,
манометрия СО) должна осуществляться прежде всего
для определения показаний для оперативного
(эндоскопического) лечения или в случае проведения
дифференциальной диагностики, в том числе при
неясной причине развития острого панкреатита.
В этой связи важно отметить, что, так как
значимая диагностическая и терапевтическая роль
ЭРХПГ с манометрией СО у больных с подозрением на
панкреатические боли без признаков панкреатита не
была доказана, пациентам, перенесшим однократный
эпизод необъяснимого острого панкреатита, проводить
ЭРХПГ и манометрию СО не рекомендуется. Данное
утверждение основано на том, что, как показала
клиническая практика, второй эпизод может никогда не
произойти или может быть отсроченным на много лет
[1].
Проведение ЭРХПГ у пациентов с нормальными
лабораторными и ультразвуковыми параметрами (ранее
ДСО III типа), по мнению экспертов, является
клинически не обоснованным и имеет
судебно-медицинские последствия в случае
возникновения осложнений.
Преимуществом методики ЭРХПГ является возможность
оценки как панкреатического, так и билиарного
сфинктеров. Но этот метод, однако, имеет ряд
недостатков. К ним относятся короткие периоды
записи, а также артефакты, возникающие при условии
движения (сокращения/расслабления) СО. Важно
отметить, что в достаточной степени не были изучены
эффекты влияния на СО препаратов, обычно
используемых для премедикации и/или анестезии
пациентов. Особое внимание специалисты также уделяют
невозможности повторного воспроизведения этого
метода.
Как показали результаты исследований, выполнение
ЭРХПГ у больных с ФРСО (как с манометрией, так и без
нее) связано с высоким риском развития панкреатита,
вероятность которого составляет 10–15%, даже в руках
опытных специалистов с использованием наиболее
безопасного панкреатического стента [16, 17].
В Римских критериях III манометрия СО была
рекомендована пациентам с подозрением на ДСО
билиарного типа II. Эта позиция была основана на
трех рандомизированных исследованиях, результаты
которых продемонстрировали, что манометрия
предсказывает эффективность сфинктеротомии. Тем не
менее в клинической практике билиарная
сфинктеротомия часто выполнялась у этих пациентов
эмпирически. На основании выводов исследования
EPISOD, манометрия больше не рекомендуется пациентам
без объективных признаков нарушения функции СО (ДСО
билиарного типа III) [18].
По мнению некоторых исследователей, единственное
доказательство того, что СО является (или был)
причиной боли, это полное ее купирование у пациентов
после абляции сфинктера [11]. В целом имеющиеся в
распоряжении специалистов аргументы по большей части
теоретические, а оценка значимости диагностических
методов не основана на достоверных данных и требует
дальнейшего уточнения.
Несмотря на это, рабочей группой экспертов были
представлены алгоритмы диагностики ФРБС и ФРСО (рис.
3 и 4).

Рис. 3. Алгоритм диагностики
ФРБС {по материалам Римских критериев IV, 2016)
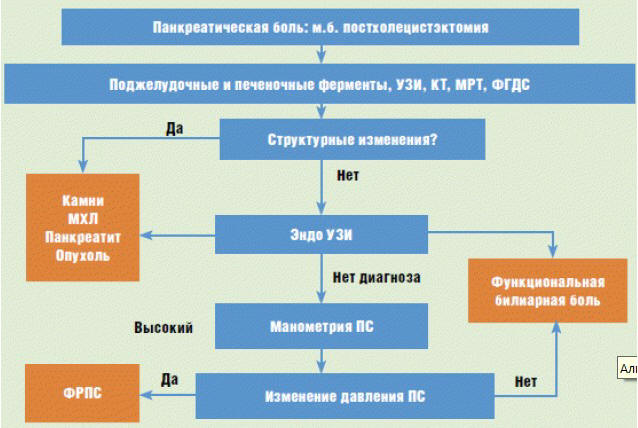
Рис. 4. Алгоритм диагностики
ФРПС {по материалам Римских критериев IV, 2016)
Правила формулировки диагноза ФРСО
В диагноз предлагается выносить тип ФРСО, а также
ассоциированные с ним другие заболевания
пищеварительной системы. Например:
- «Желчекаменная болезнь. Холецистэктомия в
2010 г. Функциональное расстройство билиарного
сфинктера Одди».
- «Хронический панкреатит с рецидивирующим
болевым синдромом, обострение. Функциональное
расстройство панкреатического сфинктера Одди».
Для рубрификации в МКБ-10 применяется шифр: К
83.4 Спазм сфинктера Одди.
Современные подходы к лечению ФРСО
При лечении ФРСО необходимым условием,
обеспечивающим эффективность проводимой терапии,
является соблюдение диеты № 5, рекомендаций по
образу жизни и медикаментозной терапии (табл. 3).
Таблица 3. Рабочая схема
лечения и профилактики ФРСО (по материалам Римских
критериев IV, 2016)
| ФРБС
|
ФРПС
|
|
Лечение обострения |
| Диете № 5, дробное питание не
менее 4 раз в день, исключая жирное, жаренное,
острое, копченое, алкоголь. Включает продукты,
способствующие желчеоттоку (овсянка, греча,
творог, нежирные сорта рыбы и др),
естественные пребиотики |
1-й этап – снижение базального давления СО
и коррекция дуоденальной гипертензии:
Эукинетик (гимекромон 200 мг за 30 минут до
еды; или мебеверин 200 мг за 20-30 минут до
завтрака и до ужина; или тримебутин 200 мг 3
раза в день – 4-8недель);
Фермент (панкреатин по 10000 ЕД 3 раза в день
во время еды – 4 недели, затем 1 раз в день в
максимальный прием пищи);
Антацид 3-4 раза в день через 30 минут после
еды и на ночь – 2 недели;
По показаниям (при упорном болевом синдроме)
амитриптилин, ненаркотические анальгетики |
1-этап – коррекция интрадуоденального рН,
секреции поджелудочной железы, базального
давления СО и дуоденальной гипертензии:
Ингибитор протонной помпы (рабепразол,
лансопразол, омепразол, пантопразол) утром
натощак и вечером в 20 часов 4 недели, далее
только утром – 4 недели;
Эукинетик (гимекромон 200 мг за 30 минут до
еды; или мебеверин 200 мг за 20–30 минут до
завтрака и до ужина; или тримебутин 200 мг 3
раза в день –4-8 недель);
Фермент (панкреатин по 25 000 ЕД 3 раза в день
во время еды – 4 недели, затем 1 раз в день в
максимальный прием пищи);
Антацид 3-4 раза в день через 30 минут после
еды и на ночь – 2 недели
|
2-й этап –коррекция СИБР и
кишечного дисбиоза:
Синбиотик (Максилак) – 4 недели;
Деконтаминация тонкой кишки (при избыточном
росте условно-патогенной флоры) – рифаксимин
400 мг 3 раза в день 7 дней в комбинации с
Энтеролом по 1 капсуле 2-3 раза в день |
3-й этап – нормализация
реологических свойств желчи:
Урсодезоксихолевая кислота (УДХК); Урдокса 250
мг по 1 капсуле через 30–60 минут после ужина
1 неделю, затем еженедельное титрование дозы
до 10–15 мг/кг/сут в течение 3-6 месяцев с
обязательным применением в первые 2-4 недели
эукинетика |
|
Противорецидивное лечение |
1.Профилактика нарушений
реологических свойств желчи:
Диета № 5, гидрохолеретики (щелочные
минеральные воды по ½-1 стакану без газа
комнатной температуры, за 30 минут до еды 3
раза в день. Курс 1 месяц 2-3 раза в год);
Коррекция факторов риска (несбалансированное
питание, гиподинамия, курение, хронических
очагов инфекции);
Лечение сопутствующих заболеваний, вызывающих
билиарные нарушения, по возможности –
исключение медикаментов гормональных
контрацептивов, цефалоспоринов 3-го поколения,
Фибратов);
Курсы УДХК (Урдкса) в дозе 5-10 мг/кг
однократно вечером 3 месяца 2 раза в год или
постоянная поддерживающая терапия;
Фитотерапия: препараты артишока, желчегонные
сборы курсами по 4 недели 2-3 раза в год.
2.Эукинетик – по требованию, курсами весной и
осенью:
Курсы Гимекромона (Одестона) по 400 мг х 3
раза в день за 30 минут до еды; или мебеверина;
или тримебутина; курсами 8–12 недель 2 раза в
год.
3. Профилактика кишечного дисбиоза:
Курсы пребиотиков 2 раза в год |
Эксперты пришли к выводу, что пациенты с
рецидивирующим острым панкреатитом, который остается
необъяснимым после детального исследования, могут
быть уверены, что эти атаки также могут спонтанно
проходить. Если они продолжают рецидивировать, то,
как правило, это происходит по тем же причинам (ФРПС)
и редко бывает опасным для жизни. Данным пациентам
рекомендуется избегать факторов, которые могут
спровоцировать эти атаки (таких как употребление
алкоголя, опиатов) [19].
В качестве терапевтических средств экспертами
рассматриваются антагонисты кальция (нифедипин),
ингибиторы фосфодиэстеразы-5, тримебутин, гиосцина
бутилбромид, октреотид и нитраты. По данным
литературы, все эти препараты снижают базальное
давление СО во время экстренной манометрии как у
пациентов с ФРСО, так и у бессимптомных
добровольцев. Французская группа исследователей,
используя в качестве терапевтических средств
тримебутин и нитраты, смогла избежать проведения
сфинктеротомии у 77% больных с ФРСО [20].
Дополнительное применение антагонистов
H2-гистаминовых рецепторов, габексата мезилата и
других гастрокинетических агентов также показало их
ингибирующее действие на моторику СО [21].
В качестве противоболевого агента эффективно
может быть использован амитриптилин, в комбинации с
простыми анальгетиками [21].
Следует заметить, что ни один из вышеописанных
препаратов не явился специфическим для СО, и,
следовательно, он мог давать положительный
обезболивающий эффект у больных с синдромами ФББ.
Электромиостимуляция [22] и акупунктура [23]
также были эффективны для уменьшения давления СО, но
их долгосрочная эффективность не была оценена в
исследованиях.
Весьма перспективным средством, воздействующим на
СО, является селективный холеспазмолитик с
эукинетическим действием — гимекромон (Одестон).
Препарат оказывает избирательное спазмолитическое
действие на СО и сфинктер желчного пузыря. Обладая
желчегонным свойством, гимекромон приводит к
уменьшению застоя желчи, препятствует образованию
билиарного сладжа и камней. Препарат способствует
адекватному поступлению желчи в ДПК, что улучшает
процесс пищеварения в ней и тем самым уменьшает
дуоденальную гипертензию.
Многие специалисты предлагают использовать
лечение УДХК, которое решает проблему профилактики и
лечения микролитиаза, в том числе у пациентов,
перенесших холецистэктомию. Как препарат с
литолитическим и холеретическим действием, УДХК
улучшает все звенья энтерогепатической циркуляции
желчных кислот. Кроме этого, УДХК, замещая токсичные
желчные кислоты, уменьшает повреждение слизистой
оболочки ДПК и желудка вследствие дуоденальной
гипертензии и дуоденогастрального рефлюкса.
В нашей клинической практике мы используем
препарат УДХК — Урдокса, который обладает
биоэквивалентностью, адекватной оригинальному
препарату.
Хирургическое (эндоскопическое) лечение ФРСО
На сегодняшний день существует несколько
инвазивных методов лечения ФРПС: эндоскопическая
сфинктеротомия билиарного, панкреатического
сфинктеров; хирургическая сфинктеропластика СО,
инъекции ботулотоксина в СО.
Следует отметить, что из-за рисков и
неопределенностей, связанных с инвазивными
подходами, на начальном этапе эксперты рекомендуют
максимально использовать консервативное лечение.
Так, в слепых рандомизированных исследованиях
было показано, что около 30% пациентов с
хирургической имитацией лечения ФРСО имели
долгосрочный противоболевой эффект [18, 24–26].
Заключение консенсуса оставило без изменения
подход в лечении пациентов с доказанной обструкцией
СО (бывший билиарный ДСО I типа) с помощью
эндоскопической сфинктеротомии без манометрии. В
настоящий момент вопрос об ЭРХПГ со сфинктеротомией
представляется целесообразным в тех случаях, когда
при манометрии выявляются отклонения. При этом
исследование EPISOD показало, что нет никаких
оснований для проведения манометрии или
сфинктеротомии у пациентов с нормальными
лабораторными данными и данными визуализации по
сцинтиграфии (ранее ДСО III типа) [18].
Эксперты указывают на необходимость изучения
факторов риска неблагоприятного исхода
сфинктеротомии у больных с подозрением на ФРСО
(предшествующий ДСО II типа) (рис. 5).

Рис. 5. Предикторы эффективности
эндоскопической сфинктер от амин при ФРСО (по
материалам Римских критериев IV, 2016)
В качестве перспективных критериев отбора
рассматриваются ряд лабораторных данных, фактический
размер желчного протока и динамика изменения его
размера (расширение) после операции, характер и
степень тяжести боли, наличие других функциональных
расстройств, психологических факторов, причина для
холецистэктомии и ответ на нее, а также любые другие
возможные методы диагностики [16, 17].
Важно учитывать, что сфинктеротомия увеличивает
риски кровотечения и перфорации двенадцатиперстной
кишки, частота которых составляет около 1% случаев.
Кроме того, после этой манипуляции значительно
возрастает риск для последующего рестеноза, особенно
после панкреатической сфинктеротомии [4].
Хирургическая сфинктеропластика СО рекомендуется
только в случае неудачной эндоскопической терапии.
При этом у пациентов с интактным ЖП меньше шансов
клинического ответа (купирование билиарной боли) на
билиарную сфинктеротомию, чем у больных с удаленным
ЖП [27, 28]. Ответ, в виде купирования билиарной
боли, был более вероятен, если желчный проток был
расширен. Причем у 43% пациентов этой категории
отмечалось долгосрочное облегчение боли [29].
Перспективным подходом, по данным экспертов,
являются инъекции ботулотоксина в СО, которые
приводят к временному его расслаблению. При этом не
было зарегистрировано никаких осложнений, однако
пока нет достаточных доказательств, подтверждающих
длительную эффективность этого метода [30, 31].
В целом показаниями для проведения инвазивных
методов лечения являются: неэффективность
медикаментозной терапии на протяжении 3–6 месяцев,
рецидивирующий панкреатит и повышение давления в ПС
при манометрии, а также обнаружение стеноза СО (рис.
6). Эксперты рекомендуют подходить к инвазивным
процедурам во всех клинических ситуациях с большой
осторожностью, учитывая краткосрочные и долгосрочные
риски, а также ограниченные доказательства от их
пользы. При этом большинство специалистов указывает
на необходимость проведения дополнительных строгих
испытаний.

Рис. 6. Рекомендации по лечению ФРСО {по
материалам Римских критериев IV, 2D1G)
Таким образом, в Римских критериях IV (2016) были
несколько по-новому унифицированы клинические
критерии различных видов ФБР, уточнены показания для
диагностических манипуляций и инвазивных
вмешательств, рассмотрены подходы их лечения. Однако
большинство из предложенных методов требует
дальнейших исследований.
Литература
- Bielefeldt K. The rising tide of
cholecystectomy for biliary dyskinesia //
Aliment Pharmacol Ther. 2013; 37: 98–106.
- Bielefeldt K., Saligram S., Zickmund S. L.
et al. Cholecystectomy for biliary dyskinesia:
how did we get there? // Dig Dis Sci. 2014; 59:
2850–2863.
- Hofeldt M., Richmond B., Huffman K. et al.
Laparoscopic cholecystectomy for treatment of
biliary dyskinesia is safe and effective in the
pediatric population // Am Surg. 2008; 74:
1069–1072.
- Cotton P. B., Elta G. H., Carter C. R.,
Pasricha P. J., Corazziari E. S. Rome IV.
Gallbladder and Sphincter of Oddi Disorders //
Gastroenterology. 2016. ISSN: 1528–0012, Vol:
150, Issue: 6, Page: 1420–1429.e2
- Thune A., Jivegard L., Conradi N. et al.
Cholecystectomy in the catdamage speric hole
dochalnervesand impairs re?ex regulation of the
sphincter of Oddi. A mechanism for
postcholecystectomy biliary dyskinesia // Act a
Chir Scand. 1988; 154: 191–194.
- Thune A., Saccone G. T., Scicchitano J. P.
et al. Distension of the gall bladder inhibits
sphincter of Oddi motility in humans // Gut.
1991; 32: 690–693.
- Middelfart H. V., Matzen P., Funch-Jensen P.
Sphincter of Oddi manometry before and after
laparoscopic cholecystectomy // Endoscopy. 1999;
31: 146–151.
- Pariente A., Berthelemy P., Arotcarena R.
The underestimated role of opiates in sphincter
of Oddi dysfunction // Gastroenterology.
2013;144:1571.
- Tarnasky P. R., Hoffman B., Aabakken L. et
al. Sphincter of Oddi dysfunction is associated
with chronic pancreatitis // Am J Gastroenterol.
1997; 92: 1125–1129.
- Bll C., Rabenstein T., Schneider H. T. et al.
Safety and efficacy of pancreatic sphincterotomy
in chronic pancreatitis // Gastrointest Endosc.
1998; 48: 244–249.
- Petersen B. T. Sphincter of Oddi dysfunction,
part2: Evidence-based review of the
presentations, with «objective» pancreatic
ndings (types I and II and of presumptive type
III // Gastrointest Endosc. 2004; 59: 670–687.
- Majeed A. W., Ross B., Johnson A. G. The
preoperatively normal bile duct does not dilate
after cholecystectomy: results of a veyearstudy
// Gut. 1999; 45: 741–743.
- Hughes J., Lo Curcio S. B., Edmunds R. et al.
The common duct after cholecystectomy: Initial
report of a ten-year study // JAMA. 1966; 197:
247–249.
- Benjaminov F., Leichtman G., Naftali T. et
al. Effects of age and cholecystectomy on common
bile duct diameter as measured by endoscopic
ultrasonography // Surg Endosc. 2013; 27:
303–307.
- Senturk S., Miroglu T. C., Bilici A. et al.
Diameters of the common bile duct in adults and
postcholecystectomy patients: a study with
64-slice CT // Eur J Radiol. 2012; 81: 39–42.
- Mazaki T., Mado K., Masuda H. et al.
Prophylactic pancreatic stent placement and
post-ERCP pancreatitis: an updated meta-analysis
// J Gastroenterol 2014; 49: 343–355.
- Akshintala V. S., Hutfless S. M., Colantuoni
E. et al. Systematic review with network
meta-analysis: pharmacological prophylaxis
against post-ERCP pancreatitis // Aliment
Pharmacol Ther. 2013; 38: 1325–1337.
- Cotton P. B., Durkalski V., Romagnuolo J. et
al. Effect of endoscopic sphincterotomy for
suspected sphincter of Oddi dysfunction on
pain-related disability following
cholecystectomy: the EPISOD randomized clinical
trial // JAMA. 2014; 311: 2101–2109.
- Lee S. P., Nicholls J. F., Park H. Z.
Biliary sludge as a cause of acute pancreatitis
// N Engl J Med. 1992; 326: 589–593.
- Vitton V., Delpy R., Gasmi M. et al. Is
endoscopic sphincterotomy avoidable in patients
with sphincter of Oddi dysfunction? // Eur J
Gastroenterol Hepatol. 2008; 20: 15–21.
- Wu Q., Cotton P. B., Durkalski V. et al.
Sa1499 duloxetine for the treatment of patients
with suspected sphincter of Oddi dysfunction: an
open-label pilot study // Gastrointest Endosc.
2011; 73 (Suppl): AB189.
- Guelrud M., Rossiter A., Souney P. F. et al.
The effect of transcutaneous nerve stimulation
on sphincter of Oddi pressure in patients with
biliary dyskinesia // Am J Gastroenterol. 1991;
86: 581– 585.
- Lee S. K., Kim M. H., Kim H. J. et al.
Electroacupuncture may relax the sphincter of
Oddi in humans // Gastrointest Endosc. 2001; 53:
211–216.
- Sherman S., Lehman G., Jamidar P. et al.
Efficacy of endoscopic sphincterotomy and
surgical sphincteroplasty for patients with
sphincter of Oddi dysfunction (SOD); randomized,
controlled study // Gastrointest Endosc. 1994;
40: A125.
- Toouli J., Roberts-Thomson I. C., Kellow J.
et al. Manometry based randomised trial of
endoscopic sphincterotomy for sphincter of Oddi
dysfunction // Gut. 2000; 46: 98–102.
- Geenen J. E., Hogan W. J., Dodds W. J. et al.
The efficacy of endoscopic sphincterotomy after
cholecystectomy in patients with
sphincter-of-Oddi dysfunction // N Engl J Med.
1989; 320: 82–87.
- Heetun Z. S., Zeb F., Cullen G. et al.
Biliary sphincter of Oddi dysfunction: response
rates after ERCP and sphincterotomy in a 5-year
ERCP series and proposal for new practical
guidelines // Eur J Gastroenterol Hepatol. 2011;
23: 327–333.
- Botoman V. A., Kozarek R. A., Novell L. A.
et al. Long-term outcome after endoscopic
sphincterotomy in patients with biliary colic
and suspected sphincter of Oddi dysfunction //
Gastrointest Endosc.1994; 40: 165–170.
- Choudhry U., Ruffolo T., Jamidar P. et al.
Sphincter of Oddi dysfunction in patients with
intact gallbladder: therapeutic response to
endoscopic sphincterotomy // Gastrointest Endosc.
1993; 39: 492–495.
- Pasricha P. J., Miskovsky E. P., Kalloo A.
N. Intrasphincteric injection of botulinum toxin
for suspected sphincter of Oddi dysfunction //
Gut. 1994; 35: 1319–1321.
- Wehrmann T., Seifert H., Seipp M., et al.
Endoscopic injection of botulinum toxin for
biliary sphincter of Oddi dysfunction //
Endoscopy. 1998; 30: 702–707.
С.Н. Мехтиев, доктор медицинских наук, профессор
О.А. Мехтиева, кандидат медицинских наук Ю.Р.
Куликова ФГБОУ ВО СПбГМУ им. И.П. Павлова МЗ РФ,
Санкт-Петербург
Статья опубликована на сайте
http://www.gastroscan.ru

