Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Вегетативная
дизрегуляция в механизмах формирования проявлений
метаболического синдрома
С.И. Ксенева1*,
Е.В. Бородулина1, О.Ю. Трифонова1,
В.В. Удут1,2
1 Научно-исследовательский
институт фармакологии и регенеративной медицины
имени Е. Д. Гольдберга, Томский национальный
исследовательский медицинский центр Российской
академии наук, 634028, Российская Федерация,
Томск, ул. Нахимова, 1а
2 Национальный исследовательский
Томский государственный университет, 634028,
Российская Федерация, Томск, пр. Ленина, 36
Концепция метаболического синдрома как группы
факторов риска сахарного диабета 2-го типа и
кардиоваскулярных заболеваний претерпела за
последние годы ряд эволюционных изменений.
Введение в патогенез метаболического синдрома
вегетативной дисфункции открывает возможность для
включения в кластер метаболического синдрома
целого ряда нозологий, оказывает взаимовлияние на
течение и клинические проявления патологий,
входящих в метаболический синдром. Для
подтверждения этого проведено одномоментное
поперечное исследование, в рамках которого
обследована сплошная выборка из 158 пациентов с
метаболическим синдромом. Выявлено, что на фоне
метаболического синдрома частота встречаемости
кардиальной автономной нейропатии достигает 37,5%.
Показан ряд особенностей гастроэзофагеальной
рефлюксной болезни у пациентов с метаболическим
синдромом — в структуре жалоб преобладает
регургитация, при фиброгастродуоденоскопии в 38%
выявляется эндоскопически негативная форма
болезни, а по данным суточной рН-метрии, при
высоком показателе DeMeester, в положении лежа
более 25% времени имеет место щелочной рефлюкс. У
мужчин молодого возраста с метаболическим
синдромом выявлена высокая частота встречаемости
увеличения размеров и объема предстательной
железы, количество баллов по опроснику IPSS,
соответствующее начальным проявлениям
гиперпластических заболеваний предстательной
железы на фоне инсулинорезистентности и
нормального уровня андрогенов. Показано, что
дисфункция вегетативной нервной системы (наравне с
инсулинорезистентностью) является основным
связующим звеном в развитии метаболического
синдрома. Это дает основание к включению
обозначенных состояний — кардиальной автономной
нейропатии, симптомов нижних мочевых путей и
гастроэзофагеальной рефлюксной болезни в кластер
метаболического синдрома.
Ключевые слова: метаболический синдром,
кардиальная автономная нейропатия, симптомы нижних
мочевых путей, гастроэзофагеальная рефлюксная
болезнь
Конфликт интересов: авторы заявляют об
отсутствии конфликта интересов
Прозрачность финансовой деятельности:
никто из авторов не имеет финансовой
заинтересованности в представленных материалах или
методах
Удут Владимир Васильевич, член-корреспондент
РАН, Научно-исследовательский институт
фармакологии и регенеративной медицины имени Е. Д.
Гольдберга, Томский национальный исследовательский
медицинский центр Российской академии наук;
заместитель директора по научной и лечебной
работе, старший научный сотрудник лаборатории
моделирования физических процессов биологии в
медицине, Национальный исследовательский Томский
государственный университет. E-mail: udutv@mаil.ru.
Введение
Метаболический синдром (МС) представляет собой
группу модифицируемых и влияющих друг на друга
факторов риска развития сердечно-сосудистых
заболеваний (CCЗ) и сахарного диабета (СД) 2-го
типа [1]. Такое определение МС, учитывая, что оно
не включает многие факторы, определяющие
абсолютный риск ССЗ (возраст, пол, курение),
предполагает детальное понимание этиологии и
патогенеза МС, так как в противном случае нельзя
вести речь о возможности коррекции и тем более о
превенции сердечно-сосудистых осложнений. Тем не
менее патогенез МС остается предметом интенсивных
обсуждений, в большинстве научных работ он
сводится к инсулинорезистентности (ИР) как к
общему патогенетическому механизму промоции,
формирования основных компонентов МС [2, 3].
Следует подчеркнуть, что предрасположенность к
ИР — это исторически установленный механизм
адаптации человеческого тела к изменяющимся
внешним условиям для поддержания энергетического
баланса и нормального функционирования всех
органов и систем. Однако при нынешнем
гиподинамическом образе жизни и хроническом
переедании жиров, а также при наличии других
неблагоприятных факторов, этот механизм становится
патологическим и приводит к развитию артериальной
гипертензии (АГ), атеросклероза и СД 2-го типа
[4]. Именно этих нозологий зачастую касаются
существующие схемы патогенеза МС. При этом
достаточно логичную патогенетическую цепочку можно
выстроить в плане развития атеросклероза и СД 2-го
типа. Но если вести речь о формировании АГ, то
механизмы, благодаря которым ИР приводит к ее
развитию, полностью не раскрыты. Предполагается,
что инсулин действует на мембранные каналы клеток,
регулирующие поступление натрия и кальция внутрь
клетки [5]. При ИР инсулин не способен уменьшать
приток кальция в клетки, что, вероятно, играет
роль в развитии АГ. Кроме того, считается, что
гиперинсулинемия приводит к развитию вегетативной
дисфункции, а именно повышению активности
симпатической нервной системы (СНС), реализующейся
главным образом через центральные звенья
симпатической регуляции кровообращения — угнетение
активности α2-адренорецепторов и I1-имидазолиновых
рецепторов [6]. В настоящее время существуют
убедительные доказательства непосредственной связи
активности СНС с избыточной массой тела, в
частности, за счет ауто-, пара- и эндокринных
функций жировой ткани — секреции лептина,
резистина, адипсина, адипонектина, свободных
жирных кислот, ФНО-α, инсулиноподобного фактора
роста, ингибитора активатора плазминогена,
ангиотензиногена, интерлейкинов, простагландинов,
эстрогенов [7].
В клинической практике МС — своеобразная
пространственно-временная модель полиморбидности,
комплекс ССЗ и метаболических нарушений,
патогенетически взаимосвязанных через ИР или
липотоксичность. Например, к МС можно отнести
синдром поликистозных яичников, формирующийся,
когда гиперсекреция инсулина стимулирует выработку
андрогенов тека-клетками яичников, андрогены
нарушают нормальное развитие фолликулов, приводя к
множественной атрезии [8]; или неалкогольную
жировую болезнь печени, развивающуюся вследствие
накопления избыточного количества триглицеридов и
других производных холестерина в гепатоцитах [9].
Таким образом, сама концепция МС как кластера
факторов риска СД 2-го типа и кардиоваскулярных
заболеваний претерпела за истекшие годы ряд
эволюционных преобразований, а введение в
патогенез МС вегетативной дисфункции как фактора
его прогрессии открывает возможность для включения
в кластер МС целого ряда нозологий, которые по
принципу суперпозиции оказывают взаимовлияние на
течение и клинические проявления патологий,
входящих в МС.
Материал и методы
На базе клиники Научно-исследовательского
института фармакологии и регенеративной медицины
имени Е.Д. Гольдберга проведено одномоментное
поперечное исследование, в рамках которого
обследована сплошная выборка из 158 пациентов с
МС, верифицированным согласно рекомендациям
Всемирной организации здравоохранения (2009) по
наличию не менее трех из пяти перечисленных
критериев:
- абдоминальное ожирение (для европеоидов —
более 94 см у мужчин и 80 см у женщин);
- триглицериды более 1,7 ммоль/л или
медикаментозная терапия гипертриглицеридемии;
- снижение ЛПВП (у мужчин <1,0 ммоль/л) или
медикаментозная терапия дислипидемии;
- повышенный уровень артериального давления
(АД) более 130/85 мм рт. ст. или прием
антигипертензивной терапии пациентом с АГ в
анамнезе;
- повышенный уровень гликемии натощак или
прием сахароснижающей терапии.
Пациенты в возрасте от 27 до 60 лет (средний
возраст 49,67±0,81 года, среди них 61 мужчина и 97
женщин) подписали форму информированного согласия
на обследование, согласно Хельсинкской декларации
Всемирной медицинской ассоциации.
Обследование пациентов включало анализ жалоб,
анамнеза и клинического осмотра. При физикальном
обследовании рассчитывали индекс массы тела (ИМТ)
по формуле: масса тела (кг)/рост (м2). Уровень АД
изучали согласно международным рекомендациям путем
суточного мониторирования АД (СМАД) с помощью
системы Meditech АВРМ-04 (Венгрия). Общепринятыми
лабораторными методами исследования проводился
биохимический анализ крови. Всем пациентам
мужского пола проводилось урологическое
обследование — тестирование по опроснику IPSS и
определение гормонального статуса. Для
количественной оценки расстройств мочеиспускания и
качества жизни использовали опросник IPSS-QOI (International
Prostate Symptom Score — Quality of life),
рекомендованный 4-й Международной консультацией по
доброкачественной гиперплазии предстательной
железы. Трансректальное ультразвуковое
исследование предстательной железы, ультразвуковую
диагностику мочевого пузыря (с определением
наличия и количества остаточной мочи), почек и
органов брюшной полости проводили на
ультразвуковом сканере ClearVue 550 (США).
Гормональный статус пациентов — уровень инсулина,
тестостерона, дегидротестостерона определялся
методом ИФА на анализаторе Lisa Scan EM (ERBA,
Чехия). ИР диагностировали по расчетному индексу
HOMA-R, где HOMA-R = глюкоза натощак (ммоль/л) ×
инсулин натощак (мкЕд/мл) / 22,5. Значение больше
2,27 считали показателем ИР.
Пациентам проводилась диагностика
гастроэзофагеальной рефлюксной болезни (ГЭРБ) в
соответствии с международными рекомендациями по
наличию характерных симптомов (изжога и
регургитация) или на основании результатов
исследований, демонстрирующих наличие рефлюкса
содержимого желудка (рН-метрия) или его
повреждающего влияния (эндоскопия) [10].
Всем пациентам проводили анализ вариабельности
ритма сердца (ВРС) с помощью
аппаратно-программного комплекса «Поли-спектр»
(ООО «Нейро-Софт», Россия). Регистрацию и
интерпретацию результатов ВРС проводили в
соответствии со стандартами измерения,
физиологической интерпретации и клинического
использования ВРС, разработанными рабочей группой
Европейского общества кардиологов и
Североамериканского общества по электростимуляции
и электрофизиологии [11]. Определяли общую
мощность спектра (TP), ее высоко- (HF),
низкочастотные (LF) и очень низкочастотные (VLF)
компоненты. Выделение трех частотных диапазонов
обусловлено различием их формирования: диапазон
очень низких частот отражает функциональное
состояние надсегментарных структур; диапазон
низких частот — симпатическую и диапазон высоких
частот — парасимпатическую нервную систему на
сегментарном уровне. Оценку показателей проводили
с учетом абсолютных и относительных (%VLF, %LF, %HF)
значений мощности спектра каждого частотного
диапазона в исходном состоянии и направленности их
реагирования в ответ на активную ортостатическую
пробу. Рассчитывали отношение %LFортопроба/%LFфон
и %VLFортопроба/%VLFфон.
Соотношение %LFортопроба/%LFфон
менее 1,0 в сочетании с коэффициентом %VLFортопроба/%VLFфон
более 1,0 свидетельствовало о формировании
кардиальной автономной нейропатии (КАН) [12].
Для обработки результатов использовали методы
вариационной статистики с использованием
компьютерной программы Statistica. Статистический
анализ результатов работы предварялся проверкой
соответствия вида распределения непрерывных
переменных закону нормального распределения (с
помощью графического представления выборок на фоне
кривой Гаусса, а также критерия Колмогорова —
Смирнова). Количественные показатели выражали в
виде среднего ± стандартной ошибки среднего (М±m).
Для всех статистических тестов различия были
значимыми при p<0,05. Для атрибутивных и
порядковых признаков внутри- и межгрупповые
различия оценивали с помощью t-критерия Стьюдента,
ранговым тестом Уилкоксона — Манна — Уитни. Для
сравнения качественных признаков использовали
метод углового преобразования Фишера.
Работа выполнена в рамках научного проекта №
8.1.21.2018.
Результаты и обсуждение
Основу для анализа составили результаты
обследования 158 пациентов с МС в возрасте от 27
до 60 лет (средний возраст 49,67±0,81 года, среди
них 61 мужчина и 97 женщин). У всех обследуемых
пациентов с МС диагностирована гипертоническая
болезнь 1–2-й степени, а объем талии превышал 94
см у мужчин и 80 см у женщин. В отношении третьего
критерия: у 41% пациентов с МС выявлена
дислипопротеидемия, а у 34% — нарушение
толерантности к углеводам, сочетание названных
симптомов в различных комбинациях встречалось у
25% пациентов.
Выявлено, что с нарастанием массы тела
отмечается тенденция к увеличению фоновой
активности симпатических влияний на сердечный ритм
в покое при уменьшении вклада надсегментарных
структур (табл. 1). В ответ на ортостатическую
пробу у пациентов с МС выявлено незначимое, но
отчетливо прослеживаемое снижение вклада
симпатических влияний при увеличении вклада
надсегментарных структур в регуляцию сердечной
работы. Выраженность этих изменений возрастает при
увеличении ИМТ. Прирост вклада надсегментарных
структур в ВРС, обеспечивающих автоматизм
сердечного ритма, свидетельствует о возрастающем
влиянии нейрогуморального звена, отсутствие же
реагирования СНС в ответ на ортопробу при исходной
гиперсимпатикотонии указывает, что нарастание
метаболических изменений приводит к снижению
чувствительности барорефлекса и истощению резервов
для адекватной реакции со стороны вегетативного
обеспечения функции.
Таблица 1. Показатели ВРС в
покое и при проведении ортостатической пробы у
пациентов с метаболическим синдромом в зависимости
от ИМТ (М±m)
ИМТ,
кг/м2
|
%VLF
(в
покое)
|
%LF
(в
покое)
|
%HF
(в
покое)
|
%VLF
(орто-
проба)
|
%LF
(орто-
проба)
|
%HF
(орто-
проба)
|
VLFopтonpoбa/
%VLFфoн
|
%LFopтonpoбa/
%LFфoн
|
25-30
|
55,10±
2,65
|
20,55±
1,93
|
18,39±
2,22
|
53,38±
3,41
|
28,13±
2,63
|
14,46±
1,23
|
1,01±
0,06
|
1,23+
0,12
|
30-35
|
56,02±
3,05
|
23,68±
2,06
|
20,34±
2,56
|
55,19±
3,44
|
26,48±
3,07
|
12,29±
0,87
|
1,16±
0,19
|
1,09+
0,12
|
35-40
|
54,23±
4,50
|
25,92±
2,84
|
19,69±
4,09
|
61,43±
5,09
|
25,64±
3,14
|
11,50±
4,42
|
1,29+
0,13
|
1,07±
0,14
|
>40
|
54,00±
10,28
|
26,33±
5,67
|
21,67±
8,93
|
66,50±
6,96
|
24,50±
4,60
|
11,00±
4,65
|
1,35±
0,28
|
0,87±
0,48 |
Такое изменение вегетативного обеспечения
функций — преобладание центрального контура
регуляции сердечного ритма над сегментарным при
физической нагрузке на фоне гиперсимпатикотонии в
покое — приводит к ряду клинических проявлений.
Безусловно, существует четкая взаимосвязь между
гиперсимпатикотонией и АГ; одним из ведущих
механизмов повышения АД в данной ситуации
считается активация почечных симпатических нервов
и ренин-ангиотензин-альдостероновой системы. Для
АГ на фоне описанных вегетативных изменений
характерен ряд особенностей суточного профиля АД,
которые мы подтвердили в своем исследовании (табл.
2) — лабильное течение АГ с большими перепадами АД
в течение суток и снижением коэффициента средних
значений АДдень/ночь, что является
важным и независимым фактором высокого риска
сердечно-сосудистых событий.
Однако более значимым кардиососудистым
проявлением вегетативной дисфункции в связи с
манифестацией широкой полинейропатии при МС
является формирование КАН. В литературе КАН не
описывается как компонент МС, но многие
исследователи считают ее подводным камнем в
диагностике и лечении сердечнососудистой патологии
у пациентов с МС: у данной когорты пациентов до
самых последних стадий заболевания может
отсутствовать болевой синдром и, к сожалению,
характерные жалобы появляются нередко уже в
предынфарктном состоянии. При тестировании
пациентов с МС, КАН выявляется у 37,5% пациентов,
при этом считается, что она на 50% ухудшает
прогноз в отношении продолжительности жизни
больных.
Таблица 2. Показатели
суточного мониторирования АД у пациентов с МС
|
Показатели
|
Значение
(М±т) |
|
Усредненные
значения систолического АД за сутки, мм рт.
ст. |
142,92±2,89
|
|
Усредненные
значения диастолического АД за сутки, мм рт.
ст. |
92,38±2,18
|
|
Индекс времени
систолического АД за сутки, % |
36,85±7,64
|
|
Индекс времени
диастолического АД за сутки, % |
45,38±7,56
|
|
Вариабельность
систолического АД за сутки, мм рт. ст. |
12,46±0,69
|
|
Вариабельность
диастолического АД за сутки, мм рт. ст. |
11,00+0,58
|
|
Суточный индекс
систолического АД, % |
10,85±0,98
|
|
Суточный индекс
диастолического АД, % |
9,77±1,57
|
Часто встречающейся при МС патологией является
ГЭРБ. Известно, что ожирение даже при отсутствии
диафрагмальных грыж способствует увеличению
частоты и продолжительности спонтанных релаксаций
нижнего пищеводного сфинктера (НПС), как основного
патогенетического фактора ГЭРБ [13]. Такое
нарушение моторно-эвакуаторной функции желудка и
снижение тонуса НПС при отсутствии органических
причин может быть объяснено дизрегуляцией
вегетативной нервной системы.
Выявлено, что для течения ГЭРБ на фоне МС
характерен ряд особенностей. Считается, что
основным (в 80% случаев) и нередко единственным
симптомом ГЭРБ является изжога. Однако на этапе
анализа жалоб стало очевидно, что ГЭРБ при ИМТ
отличается атипичным течением. Более чем у
половины пациентов (56,3%) ведущей жалобой была
регургитация, тогда как лишь 40,6% отмечали
наличие изжоги. При эндоскопическом исследовании
атипичность течения ГЭРБ на фоне ИМТ стала еще
более явной — у 38% пациентов выявлялась
эндоскопически негативная форма заболевания, когда
клиническая симптоматика и морфологические
изменения на клеточном уровне не сопровождаются
наличием эзофагита.
При анализе рН-грамм в пищеводе использовали
показатели DeMeester. В исследовании
рекомендованные показатели были дополнены оценкой
идентичных параметров для рН более 7.
В процессе проведения суточной рН-метрии
пациентам с МС и ГЭРБ, в том числе с ее эрозивными
вариантами, было выявлено, что у ряда пациентов не
отмечается патологических по количеству и
длительности рефлюксов с рН<4. В некоторых случаях
возникновение симптома изжоги не совпадало с
регистрируемыми кислыми забросами. При этом
оказался высоким процент времени лежа с рН>7 —
25,22±5,48%, что свидетельствует о значимом вкладе
щелочных рефлюксов в формирование ГЭРБ у данной
группы пациентов.
Другим проявлением вегетативного дисбаланса,
влияющим на качество жизни мужчин, являются
симптомы нижних мочевых путей (СНМП).
При тестировании по опроснику IPSS у 90%
мужчин, включенных в исследование, суммарное
количество баллов было от 1 до 9. Такое количество
баллов по IPSS может явиться индикатором
гормонально-метаболического нездоровья пациента,
учитывая, что одним из ведущих механизмов
патогенетического единства МС и СНМП является ИР/гиперинсулинемия
[14]. Другим механизмом может выступать
андрогенный дефицит, проявлениями которого
являются возникновение и прогрессирование ожирения
и ИР. Однако в проведенном исследовании у
пациентов с МС не было выявлено снижения уровня
андрогенов: как тестостерона, так и
дегидротестостерона (табл. 3).
Более того, у 16,7% пациентов с МС отмечался
уровень тестостерона, превышающий референтные
значения. Следует отметить, что зависимостей
уровней тестостерона или дегидротестостерона и
концентраций инсулина, глюкозы и индекса ИР
выявлено не было. Вероятно, причина нарушений в
урологической сфере у мужчин с МС может
свидетельствовать о потере висцеросенсорной
иннервации мочевого пузыря и являться отражением
глобальной вегетативной дисфункции.
Заключение
Таким образом, вегетативная дисфункция при МС
детерминирует лабильное течение АГ, лежит в основе
формирования КАН и клинических проявлений СНМП и
ГЭРБ, что дает основание к включению обозначенных
патологических состояний в кластер МС. Это диктует
необходимость рассматривать патогенез МС с точки
зрения инициации-промоции-прогрессии, как
представлено на рисунке 1.
Мы предлагаем рассматривать МС не как кластер
факторов риска развития CCЗ и СД 2-го типа, а как
конгломерат нозологий, объединенных единым
патогенезом. Это подводит к необходимости
рассмотрения КАН, ГЭРБ,
Таблица 3. Данные
гормонального статуса у пациентов мужского пола с
метаболическим синдромом
|
Показатели
|
Значение
(M±m) |
|
Общий
тестостерон, нг/дл |
б,75±0,42
|
|
Дегидротестосгерон, пг/мл |
504,02±16,38
|
|
Инсулин, мкЕд/мл
|
8,24±0,98
|
|
Индекс HOMA-R
|
2,50±0,33
|
СНМП как компонентов МС, а не как
ассоциированных с ним состояний. В таком случае
важна разработка единых диагностических критериев
и включение диагноза «метаболический синдром» в
список медицинских стандартов. С точки зрения
доказательной медицины желательно целенаправленное
проведение многоцентровых исследований для
разработки многофакторного метода лечения с
совместным применением препаратов различной
фармакологической направленности для оптимизации
достижения необходимого терапевтического эффекта.
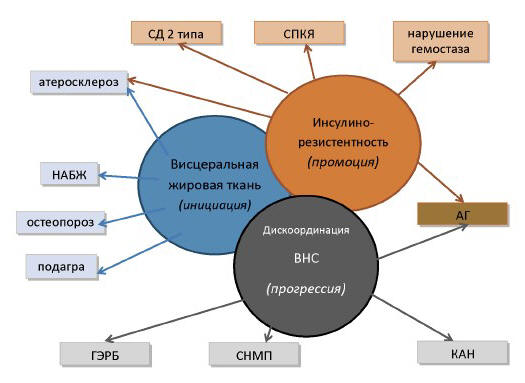
Рис. 1. Схема патогенеза
нозологических проявлений метаболического синдрома
Литература
- Grundy S. M. Obesity, Metabolic Syndrome
and Cardiovascular Disease. J. Clin.
Endocrinol. Metab. 2004; 89: 2595–2600.
- International Diabetes Federation, and
World Health Organization Definitions of the
Metabolic Syndrome as Predictors of Incident
Cardiovascular Disease and Diabetes. Diabetes
Care. 2007; 30(1): 8–13.
- Reaven G. M. The metabolic syndrome: is
this diagnosis necessary? Am. J. Clin. Nutr.
2006; 6(83): 1237–1247.
- Standi E. Aetiology and consenquences of
the metabolic syndrome. Eur. Heart J. 2005; 7:
10–13.
- Пашенцева А. В., Вербовой А. Ф., Шаронова
Л. А. Инсулинорезистентность в терапевтической
клинике. Ожирение и метаболизм. 2017; 14(2):
9–17.
- McCary M. Elevated sympathetic activity
may promote insulin resistance syndrome by
activating alpha1-adrenergic receptors on
adypocytes. Med. Hypothes. 2004; 62(5):
830–838.
- Di Bona G. F. Sympathetic nervous system
and the kidney in hypertension. Curr. Opin.
Nephrol. Hypertens. 2002; 11: 197–200.
- Katsiki N., Georgiadou E., Hatzitolios A.
I. The role of insulin-sensitizing agents in
the treatment of polycystic ovary syndrome.
Drugs. 2009; 69(11): 1417–1431.
- Musso G., Gambino R., Cassader M.
Non-alcoholic fatty liver disease from
pathogenesis to management: an update. Obesity
Reviews. 2010; 11(6): 430–445.
- Vakil N., van Zanten S., Kahrilas P., Dent
J., Jones R.; Global Consensus Group. The
Montreal definition and classification of
gas-troesophageal reflux disease: A global
evidence-based consensus. Am. J. Gastroenterol.
2006; 101: 1900–1920.
- Task Force of the European Society of
Cardiology and the American Society of Pacing
Electrophysiology. Heart rate variability:
standards of measurement, physiological
interpretation, and clinical use. Circulation.
1996; 93: 1043–1065.
- Kseneva S. I., Borodulina E. V., Trifonova
O. Y., Udut V. V. Cardiac Autonomic Drive
during Arterial Hypertension and Metabolic
Disturbances. Bulletin of Experimental Biology
and Medicine. 2016; 161(2): 237–240.
- Bray G. Drag treatment of the overweight
patient. World J. Gas-troenterol. 2007;
132(6): 2239–2252.
- McVary K. Lower urinary tract symptoms and
sexual dysfunction: epidemiology and
pathophysiology. Br. J. Urol. International.
2006; 97(2): 23–28.
Статья опубликована на сайте
http://www.gastroscan.ru

