Биологическая активность липопротеидов высокой плотности
Раповец В.А.
Врач-кардиолог ГУ « ЦП ДФиТ МВД РБ»
Резюме
ИБС остается ведущей причиной смерти и инвалидности в Европе и США. Несмотря на
значительные успехи в коррекции атерогенных липопротеинов, остается не решенным
вопрос о фармакологическом воздействии на уровень холестерина липопротеинов
высокой плотности ( ХС ЛПВП). Последние исследования выявили неоднородность
структуры, метаболизма, биологической активности частиц ЛПВП. В условиях
атерогенеза выявлена значительная трансформация ЛПВП, приводящая к снижению их
протекторной функции.
Ключевые слова: холестерин,липопротеиды высокой плотности, атеросклероз.
CHD remains the leading cause of death and disability in Europe and the United
States. Despite significant progress in the correction of atherogenic
lipoproteins, it remains unresolved the question of the pharmacological effects
on cholesterol levels of high density lipoprotein
(HDL). Recent studies have revealed heterogeneity of structure, metabolism,
biological activity of HDL particles. In atherogenesis conditions revealed a
significant transformation of HDL, leading to a decrease in their sacrificial
function.
Keywords: cholesterol, high density lipoprotein, atherosclerosis.
Rapovets V.A.
Традиционно считается, что чем выше содержание ХС ЛПВП в плазме, тем активнее
проявляется защитная функция ЛПВП. И целью профилактики сердечно-сосудистых
заболеваний (ССЗ) является повышение этого показателя.
Так, по данным Фрэмингемского исследования, низкие уровни ХС ЛПВП являются
достоверно более мощным липидным фактором риска, чем высокие уровни. По меньшей
мере в пяти различных популяционных исследованиях была подтверждена тесная
корреляция между ИБС и низкими уровнями ХС ЛПВП, не зависимая от других
факторов.
Также низкий уровень ЛПВП ассоциировался с показателем плохой выживаемости после
операции аорто-коронарного шунтирования [ 2 ]. Согласуясь с данными о
неодинаковом риске развития ИБС у представителей разного пола, показано, что
уровни ХС ЛПВП у женщин в среднем на 25 % выше, чем у мужчин. Отмечена тенденция
к повышению их уровней под влиянием эстрогенов и снижению под влиянием
андрогенов. Низкие уровни ХС ЛПВП у женщин наблюдаются при сахарном диабете и
ожирении, что значительно повышает риск ИБС. У долгожителей уровни ЛП этого
класса обычно высокие, что частично может носить семейный характер.
Среди белых американцев средний уровень ЛПВП составляет 1,2 ммоль / л (45 мг
/ дл) у мужчин и 1,4 ммоль / л (55 мг / дл) у женщин [ 2 ]. Ежедневный прием
алкоголя в небольших количествах сочетается с пониженным риском развития ИБС и
высокими уровнями ЛПВП. Механизмы этого неизвестны. У больных метаболическим
синдромом, при медленном похудании, увеличивается в плазме ХС ЛПВП. А при
быстром похудании, более 4 кг в месяц, этот показатель снижается ( Wirth A.,
2006).
В рекомендациях [3] по скринингу кардиваскулярных рисков уровень ХС ЛПВП
признан сильным риск-фактором ( класс I уровень С). До начала лечения
дислипидемии рекомендован анализ ХС ЛПВП ( класс I уровень С). Не требуется
лечение с целью контроля ХС ЛПВП (Класс 3 уровень С).
При проведении профилактических мероприятий было установлено, что
табакокурение сопровождается понижением уровней ХС ЛПВП , а регулярная
физическая активность – их повышением. Регулярные физические тренировки приводят
к росту уровней ХС ЛПВП у лиц, перенесших инфаркт миокарда.
Было доказано, что диета с низким содержанием жира и высоким процентом углеводов
приводит к снижению уровня ХС ЛПНП,ХС ЛПВП, и ТГ. А снижение массы тела и
повышение физической активности повышает концентрацию ХС ЛПВП [ 9 ].
В исследовании Kaiser Permanente установлено, что каждое повышение уровня ХС
ЛПВП на 5 мг/дл связано с 4%-м сокращением риска госпитализации по причине
сердечных заболеваний или инсульта. А понижение уровня ХС ЛПВП на 6,5 мг/дл в
свою очередь увеличивало риски госпитализации на 11%.
По результатам исследования НАТS у 160 больных ИБС был подтвержден
ангиографически стеноз коронарных артерий и низкий уровень ХС ЛПВП . Назначение
витамина Е в сутки 800 мг, витамина С 25 мг, бетакаротина 100 мг, селена,
симвастатина, ниацина проводилось 3 года. В группе симвастатин+ниацин
установлено повышение ХС ЛПВП на 26%, низкая частота сердечно-сосудистых событий
(ССС)- 3%. В группе антиоксидантов- 21% ССС, в группе симвастатин+
ниацин+антиоксиданты- 14% ССС.Назначение магния 20 ммоль (487mg) в сутки в
течение 8 недель достоверно снизило уровень ОХС в плазме крови на 1,3 ммольл (Parki
P.S.,1990).
В исследовании ALPINE назначение больным АГ атенолола и гипотиазида снизило
уровень ХС ЛПВП и повысило уровень ХС ЛПНП [10]. FISH –трайл показал, что у
больных АГ монотерапия метопрололом приводила к значительному росту уровня ТГ и
снижению уровня ЛПВП.В исследовании SLIP лечение больных АГ верапамилом 240
мгсутки достоверно увеличило уровень ЛПВП. В трайле TOMHS при лечении больных
АГ уровень ЛПВП снизился на 0,6+_0,7 мгдл в группе ацебутолола 400 мгсут. И
повысился на 0,2+-0,7 мгдл в группе амлодипина 5 мгсут. А также на 0,6+-0,8
мгдл в группе хлорталидона 15 мгсут.
ЛПВП представляют собой сложную группу частиц, переносящих приблизительно 20 %
всего холестерина плазмы [1 ] .
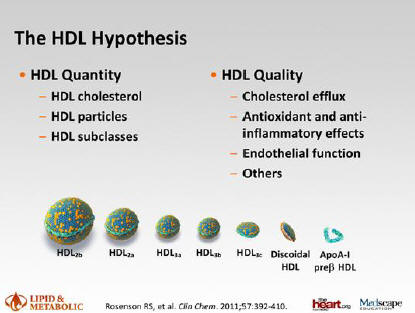
Рисунок 1.Подклассы ЛПВП и их функции.
В плазме преобладают сферические ЛПВП [6 ] . Они крупных размеров, от 8 до 12
нм. В гидрофобном ядре содержат эфиры ХС и триглицеридов (ТГ). По плотности
частиц выделены два основных подкласса ЛПВП. ЛПВП2- это большие, легкие, богатые
липидами частицы. И ЛПВП3- частицы меньших размеров, плотные, богатые белком.
Методом гель-электрофореза разделены субфракции ЛПВП, по убыванию размера это
ЛПВП2b, ЛПВП2a, ЛПВП3a, ЛПВП3b, ЛПВП3c. Установлено преобладание свободного ХС
над эфирами ХС, сфингомиелина над фосфатидилхолином для ЛПВП2в с уменьшением
пропорции вправо к ЛПВП3с.
Дисковидные ЛПВП имеют малые размеры, менее 7 нм. Содержат меньше липидов, менее
30%, и больше аполипопротеидов А1 (апоА1). Последние преобладают среди белков
ЛПВП (70%). Подвижные амфипатические . -спирали апоА1 активно связывают липиды и
выполняют основную функцию ЛПВП. Применяя двумерный электрофорез, открыты
подвиды ЛПВП- это пре . - частицы, содержащие апоА1 и фосфолипиды.
ЛПВП осуществляют обратный транспорт ХС из периферических тканей, в том числе из
стенок артерий, в печень. Бедные липидами и богатые апоА1 ,маленькие частицы
ЛПВП вызывают редуцирование атеросклеротической бляшки, осуществляя отток ХС из
макрофагов путем АВСА1(кассетный транспортный белок). Это обусловлено большей
текучестью поверхностного слоя ЛП и конформацией апоА1. Крупные ЛПВП, так как их
больше числом, через ABCG1 транспортируют ХС и 7-кетостерины. А посредством
скэвенджер-рецепторов класса В типа 1 (SR-B1) поглощают эфиры ХС. Без рецепторов
проходит пассивная диффузия ХС по градиенту концентрации.
Маленькие плотные ЛПВП3 защищают ЛПНП от перекисного окисления свободными
радикалами. Альдегиды и окисленные ФЛ восстанавливаются путем окисления
метиониновых остатков апоА1.
Сферические ЛПВП в большей мере, чем дисковидные, ингибируют:синтез
провоспалительных цитокинов, адгезию моноцитов к эндотелию, экспрессию молекул
адгезии на клетках эндотелия, активацию нейтрофилов и их инфильтрацию в стенки
артерий.
ЛПВП3 тормозят и аннулируют апоптоз клеток эндотелия, вызванного факторами
роста. Стимулируют миграцию и выживание эндотелиальных клеток. Уменьшают выход в
цитоплазму цитохрома С и фактора индукции апоптоза. ЛПВП2,ЛПВП3 через SR-B1 и
сфингозин-1-фосфат запускает фосфорилирование эндотелиальной NO-синтетазы.
Стимулируют синтез простациклинов (ПГI2). Такой механизм присущ для никотиновой
кислоты и дальцетрапиба. ЛПВП2, имея апоЕ, ингибируют активацию
тромбоцитов,тканевой фактор свертывания крови,Х,Vа,VIIIа фактор.
При инфекции ЛПВП через апоА1 связывают и утилизируют циркулирующие липо-
полисахариды. Плотные ЛПВП, диаметром 15-21 нм, через апоL1, апоА2,
апоС1,апоС2,апоС3 вызывают лизис трипаносом.
При патологических состояниях: дислипидемии, резистентности к инсулину,
воспалении, инфекциях, ССЗ- наблюдается снижение нормальной биологической
активности ЛПВП. В структуре ЛПВП3 уменьшаются эфиры ХС, апоА1, параоксоназы1,
лецитинхолестеринацилтрансферазы. Увеличивается уровень ТГ. Снижается
антиоксидантная и противовоспалительная активность.
Установлено, что уровень ХС ЛПВП не зависит от функции оттока ХС из
макрофагов, и не может быть сегодня маркером сердечно-сосудистых заболеваний (
ССЗ). У лиц с генетически детерминированным высоким уровнем ЛПВП не
наблюдается снижения сердечно-сосудистых заболеваний ( Benjamin Voight,
Philadelphia, online, May 16, 2012, Lancet) . Индоазиаты имеют самые высокие
показатели заболеваемости ИБС, несмотря на то, что почти половина из них на
протяжении всей жизни придерживаются вегетарианства.
При построении функций 30-летней выживаемости среди мужчин 40-59 лет достоверная
наибольшая выживаемость установлена при уровне ХС ЛПВП 1,7 ммольл и не выше
(Меньщиков А.А.,2013,РФ).
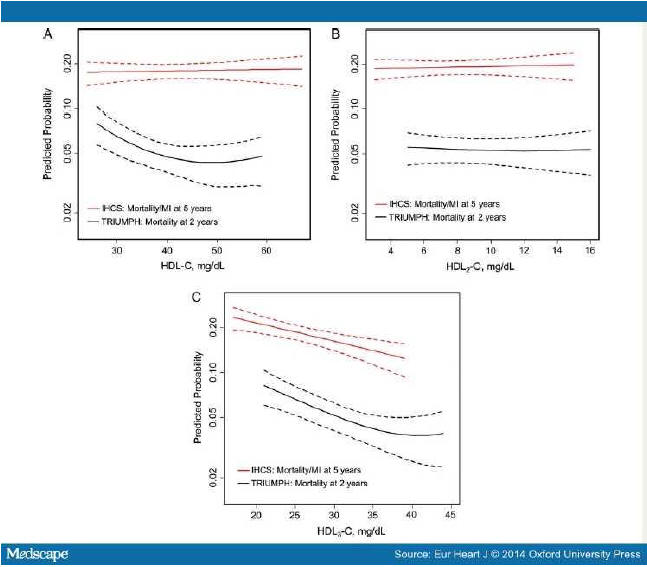
Исследования TRIUMPH и IHCS [5]. Изучалась связь подклассов ХС ЛПВП (HDL-C)
прогнозом вторичной профилактики ИБС.
Методы. Проанализированы данные двух когорт: TRIUMPH study обследовано 2465
больных острым инфарктом миокарда; IHCS study обследовано 2414 пациента методом
коронарной ангиграфии. Всем пациентам определены базовые подклассы ХС ЛПВП
ультрацентрифугированием. Стратифицировали тертили HDL-C и два подкласса
(HDL2-C, HDL3-C). Пациенты были среднего возраста (TRIUMPH: 58.2 ± 12.2 лет;
IHCS: 62.6 ± 12.6 лет).
Большинство из них были мужчины (TRIUMPH: 68.0%; IHCS: 65.5%). В трайле IHCS
были ниже значения HDL-C (34.6 ± 10.1 mg/dL) по сравнению с TRIUMPH (40 ± 10.6
mg/dL). Доля HDL3-C составила >3/4 от HDL-C (коэффициент HDL3-C/HDL-C равнялся
0.78 ± 0.05 в обоих когортах). Результаты. За 2 года наблюдения в исследовании
TRIUMPH смертность составила 226 случаев (9.2%). За 5 лет наблюдения IHCS
летальность от инфаркта миокарда констатирована среди 401 больных (16.6%) . Не
установлено зависимости событий с уровнями HDL-C и HDL2-C. В отличие от этого,
низкий тертиль HDL3-C достоверно ассоциировался в каждой когорте с высоким более
50% риском. В трайле TRIUMPH корреляция смертности с HDL3-C составляла HR 1.57;
95% CI, 1.13–2.18 ; в исследовании IHCS для показателя смертности от инфаркта
миокарда : HR 1.55; 95% CI, 1.20–2.00).
Рисунок 2.
Скорректированные сплайн-кривые параметров ЛПВП в ассоциации с прогнозом
смертности и смертности от инфаркта миокарда. По X-оси представлены значения
параметров HDL-С и по Y-оси представлены предикторы смертности через 2 года в
TRIUMPH. А также смертность от инфаркта миокарда через 5 лет в IHCS после
корректировки всех кривых. Пунктирные линии показывают 95% доверительный
интервал. (А) для ХС ЛПВП, (В) HDL2-С, (С) HDL3-С.
* Результаты были совместимы по модели 1, 2, и 3.
Модель 1 была без корректировок в обеих группах. Модель 2 была скорректирована
по GRACE score в TRIUMPH, и по возрасту и полу в IHCS.
Выводы TRIUMPH и IHCS [5].
1.Результаты проведенного исследования, дополненные приоритетным биологическим,
эпидемиологическим , клинически доказанным материалом, дают право выделить
подкласс HDL3 качестве основного маркера риска.
2. Проводя вторичную профилактику, следует учитывать повышенный риск для
долго-срочных жестких клинических событий, связанных с низким уровнем HDL3-C.
Это не касается значений HDL2-C или HDL-C.
3. Полученные результаты подчеркивают важность разделения ЛПВП на подклассы для
стратификации риска.
В исследовании GISSI-HF [4] установлено значительное снижение уровня ХС ЛПНП
через 3 года лечения розувастатином. Однако препарат не улучшал клинические
показатели. Не было объяснено отсутствие различий в отношении первичных и
вторичных конечных точек. Назначение больным ИБС фибратов и никотиновой кислоты
[6] увеличивает концентрацию ЛПВП, но, парадоксально, не сокращает смертность.
Применение препарата RVX-280 на фоне терапии статинами повысило ЛПВП на
10,9%, снизило ЛПНП на 16%, но не повлияло на частоту сердечно-сосудистых
осложнений. Есть сообщения, что применение ниацина увеличивает ЛПВП, но
достоверно не улучшает статистику сердечно-сосудистого риска ( Sekar Kathiresan.
Massachusetts General Hospital, Boston ).
В исследовании FIELD назначение фенофибрата в дозе 200 мгсутки в течение 5
лет больным сахарным диабетом 2 типа значимо снизило частоту сердечно-сосудистых
событий, но незначительно повысило ХС ЛПВП на 2%. Тот же результат был получен в
трайле VA-HIT после лечения гемфиброзилом.
В испытании The ACCORD Study Group проверяли гипотезу, что использование
фенофибрата для повышения ХС ЛПВП плазмы и снижения триглицеридов плазмы у
больных диабетом 2-го типа, уже получающих терапию симвастатином, приведет к
дополнительной сердечно-сосудистой пользе по сравнению с терапией одним
симвастатином. Однако частоты первичного исхода не различались достоверно между
группой фенофибрата и плацебо во время 4.7 лет лечения и наблюдения [8] .
Препарат дальцетрапиб у больных сахарным диабетом повысил концентрацию ХС ЛПВП
на 31% по сравнению с плацебо. Ингибиторы СЕТР [7] значительно повышали уровни
ЛПВП ,но существенно не влияли на кардиоваскулярные события . Исследования
CETP-ингибиторов дают противоречивые результаты. Так в исследовании ILLUMINATE
терапия торцетрапибом, несмотря на значимое повышение уровня ЛПВП на 71% и
снижение уровня ЛПНП на 24%, ассоциировалась с увеличением частоты развития ССЗ
на 25% и общей смертности на 58%. Другой представитель данной группы препаратов
– дальсетрапиб – в исследовании dal-OUTCOMES у больных, недавно перенесших
острый коронарный синдром (ОКС), приводил к увеличению концентрации ХС ЛПВП в
крови, но не отличался от плацебо по частоте возникновения первичных конечных
точек (смерть от ИБС, нефатальный острый инфаркт миокарда,
ишемический инсульт, нестабильная стенокардия и пр.).
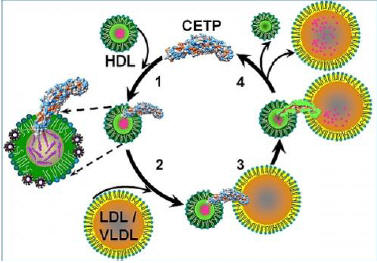
Рисунок 3. (1) CETP проникает в HDL. (2) Образование пор
с обоих концов CETP. (3) Поры сопрягаются с полостью в CETP, образуя канал для
трансфера холестерина, (4) что приводит к уменьшению HDL в размере. (Иллюстрация
Gang Ren / Berkeley Lab.)
Результаты исследований ILLUMINATE и dal-OUTCOMES позволяют предположить, что
гипотеза о целесообразности повышения уровня ХС ЛПВП для борьбы с атеросклерозом
не имеет сегодня реальных подтверждений, следовательно, поиск аналогичных
препаратов не имеет смысла. Таким образом, основной целью терапии,
корректирующей уровень липидов в крови, по-прежнему является снижение уровня ХС
ЛПНП в крови. В настоящее время статины превосходят все другие классы
гиполипидемических средств в отношении снижения уровня данного показателя
липидного профиля.
Заключение
Разнообразие классов ЛПВП обусловлено неоднородностью физических, химических,
функциональных параметров частиц ЛПВП. Биологическая активность ЛПВП
детерминирована композицией белков и липидов. ЛПВП3 обладают выраженными
антиатерогенными свойствами. Однако при патологических состояниях наблюдается
трансформация частиц ЛПВП и утрата естественного уровня метаболизма. Уровень ХС
ЛПВП не может быть маркером ССЗ.
Литература.
1.Источник в интернете : http://meduniver.com/Medical/Therapy/100017.html
2. Enas A. Enas, Annamalai Senthilkumar, Chacko Vinod, Neal Puthuma.
Dyslipidaemia Among Indo-Asians Strategies for Identification and Management.
British Journal of Diabetes and Vascular Disease. 2005;5(2):81-90.
3. European Heart Journal (2011) 32, 1769–1818. ESC/EAS GUIDELINES. doi:10.1093/eurheartj/ehr158.
ESC/EAS Guidelines for the management of dyslipidaemias.
4. Lancet. 2008 Oct 4;372(9645):1231-9. doi: 10.1016/S0140-6736(08)61240-4. Epub
2008 Aug 29. Effect of rosuvastatin in patients with chronic heart failure (the
GISSI-HF trial): a randomised, double-blind, placebo-controlled trial.
5. Seth S. Martin, Arif A. Khokhar, Heidi T. May et al. HDL Cholesterol
Subclasses, Myo-cardial Infarction, and Mortality inSecondary Prevention.Eur.
Heart J. 2015;36(1):22-30.
6. Бабинцева Я.Д. , Л. Камон, Д. Чепмен, М. Ломм, В. П. Карагодин, А. Контуш, А.
Н. Орехов. Биологическая активность фракций липопротеидов высокой плотности и их
роль в развитии сердечно-сосудистых заболеваний. Тер.архив.2016.Том
88.9:111-119.
7. Источник: http://www.medscape.org/viewarticle/762742
8. The ACCORD Study Group. Effects of Combination Lipid Therapy in Type 2
Diabetes Mellitus. N Engl J Med 2010. Published on March 14, 2010, updated on
March 18, 2010, at NEJM.org
9.Barter P. HDL-C: Role as a risk modifier. Atherosclerosis Supplements, Volume
12, Issue 3, Nov. 2011, P. 267-270.
https://doi.org/10.1016/S1567-5688(11)70885-6
10. Lindholm LH, Persson M, Alaupovic P, ALPINE study. J
Hypertens. 2003 Aug;21(8): 1563-74.