Результаты применения препарата железа изомальтозат 1000 у
пациентов с хронической сердечной недостаточностью. Пилотное исследование
PER R. HILDEBRANDT*, MD, NIELS E. BRUUN†, MD, OLAV W. NIELSEN‡, MD,
EMIL PANTEV§, MD,
FARZAD SHIVA¶, MD, LARS VIDEB.K**, MD, GERHARD WIKSTROM††, MD & LARS L. THOMSEN,
MD
*Glostrup University Hospital, Glostrup;
†GentofteUniversity Hospital, Hellerup;
‡Bispebjerg University Hospital, Copenhagen, Denmark;
§Helsingborg Hospital, Helsingborg; Karlstad Hospital, Karlstad, Sweden;
**Odense University Hospital, Odense, Denmark;
††UppsalaUniversity Hospital, Uppsala, Sweden;
‡‡Pharmacosmos A/S, Holbaek,
Correspondence to:
Dr P.R. Hildebrandt, Department of Cardiology, Glostrup University Hospital, Ndr
Ringvej 57,
2600 Glostrup, Denmark
E-mail: p.hildebrandt@dadlnet.dk
Ключевые слова
• Анемия
• Хроническая сердечная недостаточность
• Внутривенное железо
• Дефицит железа
РЕЗЮМЕ
Препараты внутривенного железа показали свою эффективность у пациентов с
хронической сердечной недостаточностью (ХСН) и дефицитом железа. Железа
изомальтозат 1000 (Монофер)
– это новый препарат железа для внутривенного введения, обладающий низкой
иммунологической активностью изомальтозата в сочетании с низкой токсичностью
свободного железа.
Основной целью данного открытого, несравнительного, многоцентрового пилотного
исследования было оценить безопасность использования железа изомальтозата 1000 у
пациентов с ХСН и анемией. Также оценивалось влияние этого препарата на
показатели обмена железа, анемии и на качество жизни больных. В течение
8-недельного периода исследования в шести визитах приняли участие двадцать
пациентов с ХСН и железодефицитной анемией. В начале исследования пациентам
вводили железа изомальтозат 1000 (средняя доза составила 868 мг, в диапазоне
650-1000 мг). У пациентов не отмечалось каких-либо неблагоприятных реакций,
связанных с лечением, острых анафилактических реакций или аллергических реакций
замедленного типа, не выявлялось клинически значимых изменений лабораторных
показателей или жизненно важных функций. По сравнению с исходными данными за
четыре недели уменьшился дефицит железа и анемия, и улучшились показатели
качества жизни в среднем на 49%. В этом безопасном пилотном исследовании
пациентам с ХСН вводили железа изомальтозат 1000 в виде однократной дозы,
быстро, без тестовой дозы. Препарат улучшил оценку качества жизни и хорошо
переносился больными.
ВВЕДЕНИЕ
Хроническая сердечная недостаточность (ХСН) часто связана с анемией1,2, а низкий
уровень гемоглобина (Hb) при ХСН является предиктором увеличения смертности3,4.
Патофизиологический механизм развития анемии при ХСН включает в себя дефицит
железа2. Коррекция железодефицитной анемии путем парентерального введения железа
у больных с ХСН является относительно новой схемой лечения3,5–9. Таким образом,
является оправданным создание новых препаратов железа для внутривенного введения
с улучшенным профилем "польза/риск".
В последнее время были разработаны новые парентеральные препараты железа, в их
числе и железа изомальтозат 1000 (Monofer,
Pharmacosmos A/S, Holbaek, Дания). Основной целью данного пилотого исследования
было определение безопасности железа изомальтозата 1000, назначаемого больным
ХСН с анемией в относительно высоких внутривенных дозах без начальной тестовой
дозы. Дополнительной целью было определить влияние железа изомальтозата 1000 на
маркеры дефицита железа, анемии и качество жизни (КЖ) у больных с ХСН.
МАТЕРИАЛЫ И МЕТОДЫ
Дизайн исследования, результаты и критерии допустимости
Это открытое, многоцентровое, международное исследование проводилось в четырех
центрах в Дании и в трех центрах в Швеции. Первичными конечными точками
безопасности исследования были: нежелательные явления (НЯ), серьезные
нежелательные явления (СНЯ), физикальное обследование, жизненно важные параметры
(артериальное давление, пульс, вес и электрокардиограмма), гематологические
(гемоглобин, общий анализ крови с подсчетом лейкоформулы и тромбоцитов) и
биохимические параметры (натрий, калий, креатинин, альбумин, мочевина, билирубин
и АлТ). Вторичные конечные точки включали: значения гемоглобина, насыщение
трансферрина (TSAT), уровень ферритина в сыворотке и концентрация сывороточного
железа до начала исследования и через 1, 2, 4 и 8 недель по сравнению с исходным
значением; изменения от исходного уровня для каждого из этих параметров;
линейные аналоговые шкалы оценки качества
жизни (LASA) в начале и через 4 и 8 недель по сравнению с исходными
показателями, а также изменения в баллах LASA по сравнению с исходными.
LASA – валидированнная оценка качества жизни, состоящая из трех линейных
визуальных аналоговых шкал по 100 мм (0 -худшее), включающих измерение уровня
энергии пациента, его ежедневной активности и общее качество жизни.
В исследование включались пациенты не моложе 18 лет, при уровне гемоглобина
менее 11 г/дл, уровне ферритина менее 800 мкг/л, прогнозируемой
продолжительности жизни не менее 12 месяцев. Пациенты включались в исследование
после подписания письменного информированного согласия. Уровень ферритина менее
800 мкг/л был выбран для исключения возникновения перегрузки железом. Дефицит
железа по уровню ферритина не оценивался, так как ферритин является маркером
острого воспаления. Пациенты исключались из исследования, если анемия была
нежелезодефицитной. После утверждения поправок к протоколу, порог гемоглобина
был изменен до менее 11,5 г/дл для женщин и до 12 г/дл для мужчин. Диагноз
хронической сердечной недостаточности устанавливался лечащим врачом.
Пациенты исключались из исследования, если выявлялось, что анемия у них не
связана с дефицитом железа (например, гемолитическая анемия), что у них имеется
перегрузка железом или нарушения усвоения железа (гемохроматоз или гемосидероз),
имеется повышенная чувствительность к декстрану железа или моно-дисахаридному
комплексу. Пациенты исключались из исследования, если в анамнезе были указания
на поливалентную аллергию, цирроз печени или гепатит, на острые или хронические
инфекции, ревматоидный артрит, беременность или уход за ребенком, на активное
кровотечение, на плановую операцию во время исследования, при которой ожидалась
бы значительная кровопотеря. Участие в любом другом клиническом исследовании за
3 месяца до скрининга также служило критерием исключения из данного
исследования.
Проведение исследования
Пациенты приняли участие в шести визитах в течение 8-недельного периода
исследования. Согласно протоколу, железа изомальтозат 1000 вводился 4
внутривенными болюсными инъекциями по 100-200 мг железа/доза в начале
исследования и на 1, 2 и 4 неделе (последнее введение могло состоять из общей
оставшейся дозы, если суммарная доза вводимого препарата превышала 800 мг) или в
виде однократной высокодозной инфузии на начальном этапе. Решение, назначить ли
пациенту 4 болюсных введения в течение месяца или однократно ввести высокую дозу
препарата, принималось лечащим врачом. Если разовая доза препарата превышала 20
мг железа/кг, то она разделялась на две дозы и вводилась приблизительно с
интервалом в 7 дней (одна неделя). Совокупная расчетная потребность железа и
суммарно вводимая доза для каждого пациента были основаны на целевом гемоглобине
13 г/дл (8,1 ммоль/л) и рассчитывались в соответствии с формулой Ganzoniом. Если
разовая доза препарата превышала 20 мг железа/кг, то она разделялась на две дозы
и вводилась приблизительно с интервалом в 7 дней (одна неделя). Совокупная
расчетная потребность железа и суммарно вводимая доза для каждого пациента были
основаны на целевом гемоглобине 13 г/дл (8,1 ммоль/л) и рассчитывались в
соответствии с формулой Ganzoni10: Общий дефицит железа (мг) = масса тела (кг) *
(целевой Hb фактический Hb) (г/л) * 0,24 + депо железа (принимается за 500 мг).
Помимо железа изомальтозата 1000, пациент мог получать лечение
эритропоэзстимулирующими агентами (ЭСА) в соответствии со стандартами больницы.
Было желательно, чтобы доза ЭСА в течение всего исследования оставалась
постоянной. Гемотрансфизия противоречила протоколу, и, если проводилась по
медицинским показаниям, то пациент исключался из исследования, но не из анализа
безопасности.
Лабораторное исследование включало гематологическое (Hb, полный анализ крови с
подсчетом лейкоформулы и тромбоцитов) и биохимическое (натрий, калий, креатинин,
альбумин, мочевина, билирубин и печеночные ферменты) исследование, которые
проводились во время скрининга, в начале и на 1, 2, 4 и 8 неделях. Жизненно
важные функции и биохимические параметры [гемоглобин, гематокрит (HCT), TSAT,
сывороточное железо и ферритин в сыворотке] были оценены в начале и на 1, 2, 4 и
8 неделях. ЭКГ была зафиксирована в начале и на 8 неделе. Все пробы крови были
проанализированы в центральной лаборатории. Полный физикальный осмотр был
выполнен при скрининге и на 8 неделе. Шкала LASA применялась в начале
исследования и через 6 и 8 недель от начала, соответственно. Исследование
полностью отвечало требованиям Хельсинкской декларации и международной
конференции по гормонизации надлежащей клинической практики для клинических
испытаний.
Статистические методы
Формальный рассчет необходимого объема выборки для этого пилотного безопасного
исследования у больных ХСН не проводился, и, следовательно, исследование не было
достаточно эффективным.
Анализ основных жизненно важных параметров и физикальное обследование
основывались на описательных статистиках для непрерывных переменных (АД, пульс и
вес тела) и для дискретных переменных (физикальное обследование и ЭКГ). Частота
нежелательных явлений (НЯ) была представлена количеством и процентом пациентов и
событий, соответственно, и сведена в таблицы Медицинским Словарем для
регулирующего действия предпочтительных терминов11 . Лабораторные данные были
сведены в таблицы и представлены в виде абсолютных значений и в виде изменений
по сравнению с исходным.
Результат измерения, проводимого на старте для каждой из вторичных конечных
точек (Hb, гематокрит, TSAT, сывороточное железо, ферритин сыворотки и анкета КЖ),
сравнивался с результатом измерения при каждом последующем визите. Конечные
точки были проанализированы с помощью дисперсионного анализа (ANOVA) в
регрессионной модели, где визит был фиксированным фактором. Предполагаемые
корреляции результатов между визитами рассматривались с помощью неограниченной
ковариационной матрицы. Результаты изменений по сравнению с исходными значениями
анализировались с помощью различаемости наименьших квадратов средней оценки по
сравнению с исходным, и каждая из этих оценок была подвергнута тестированию с
нулевой гипотезой по сравнению с исходным значением, используя Т-критерий. Кроме
того, были представлены соответствующие Р-значения и 95% доверительный интервал.
В случае выраженного асимметричного распределения данных, применялась
непараметрическая статистика, тест Уилкоксона и Hodges-Lehmann CI. Изменения по
сравнению с исходным на 4 и 8 неделе для каждого из трех вопросов качества жизни
(LASA) были проанализированы таким же образом.
РЕЗУЛЬТАТЫ
Характер пациентов и демография
Из тридцати восьми обследованных пациентов 20 пациентов вошли в исследование и
получили, по крайней мере, 1 дозу железа изомальтозата 1000, и, следовательно,
составили группу (пул) для определения безопасности препарата. Причинами
невключения в исследование были: слишком высокий уровень гемоглобина в 13
случаях, отзыв информированного согласия в 2 случаях, гемотрансфузия в период
между скринингом и запланированной рандомизацией в 1 случае, уровень ферритина
сыворотки крови более 800 мкг/л в 1 случае и другая причина анемии -в 1 случае.
Из 20 пациентов, включенных в исследование, было 10 (50%) мужчин и 10 (50%)
женщин. Все они были европеоидной расы. Средний возраст составил 75 лет
(диапазон 61-88 лет). Два пациента были выведены из исследования после того, как
подверглись воздействию исследуемого препарата вследствие «других причин», таким
образом, 18 пациентов завершили полный 8 недельный период исследования. Ни один
из 20 пациентов не получал лечение эритропоэзстимулирующими агентами (ЭСА).
Воздействие железа изомальтозата 1000
Все 20 пациентов получили однократную высокодозную инфузию препарата. Среднее
время инфузии было 59,8 минут (в диапазоне 50-67 минут). Общая доза препарата,
приходящаяся на одного пациента за 8-недельный период колебалась от 650 до 1000
мг, составляя в среднем 868 мг. Ни одному из пациентов не потребовалось дробить
дозу.
Безопасность исследования
Среди 20 пациентов, подвергшихся воздействию железа изомальтозата 1000, у 13
(65%) наблюдалось в общей сложности 25 НЯ, из которых 18 были несерьезными, 7
серьезными (табл. 1). Ни одно из НЯ не классифицируется как возможно или
вероятно связанное с
Монофером. За исключением головокружения, которое возникло дважды у одного
пациента, все остальные события встречались только один раз. Смертельных
(летальных) исходов за время исследования не было. Острых анафилактических/
анафилактоидных реакций или аллергических реакций замедленного типа не было.
Клинически значимых изменений определяемых лабораторных показателей или жизненно
важных функций не было. Число больных с нарушениями на ЭКГ, классифицированных
исследователем как клинически значимые, было: 4 -в исходном состоянии, 2 -на
первой неделе, 2 -на второй неделе, 1-на четвертой неделе и 4 -на восьмой
неделе. Изменения на ЭКГ включали признаки перенесенного инфаркта миокарда,
блокады левой или правой ножки пучка Гиса, сниженного вольтажа и не выявили
нового или прогрессирования имеющегося заболевания. Все они могут быть объяснены
историей болезни пациента.
Эффективность результатов
Значения и их изменения, по сравнению с исходными параметрами, приведены в
таблицах 2 и 3. По сравнению с исходным значением, ферритин в сыворотке крови
был значительно повышен во время всех визитов, в то время как увеличение
сывороточного железа и TSAT были статистически значимы через одну неделю от
исходного уровня. Прирост уровня гемоглобина не имел статистической значимости.
Наибольший прирост по сравнению с исходным уровнем гемоглобина был отмечен через
2 недели со значением 0,47 г/дл и поддерживался спустя 8 недель.
Результаты шкалы LASA в начале и через 4 и 8 недель после начала исследования
приведены в таблице 4. Все шкалы LASA (оценка «Энергетический уровень»,
«возможность осуществлять повседневную деятельность» и «общее КЖ») показали
значительное улучшение через 4 недели после начала лечения с увеличением
эмпирического среднего значения на 49%, 38% и 23%, соответственно. Через 8
недель после начала лечения увеличение составило 34%, 20% и 13%, соответственно,
а статистическая значимость была достигнута только для шкалы «энергетический
уровень» на 8-й неделе (табл. 4).
Таблица 1. Частота нежелательных явлений, не имеющих связи
с лечением
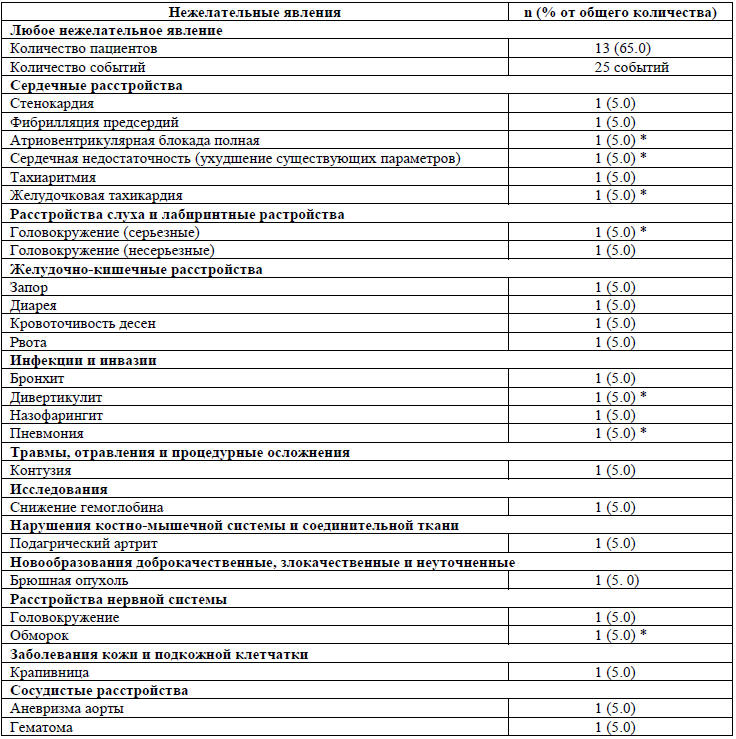
Критерии для классификации по степени серьезности, как было определено в
протоколе считались выполненными, если происходило одно из следующих событий,
независимо от того, связано или нет это событие было с исследуемым препаратом:
(i) смертельный исход; (ii) опасный для жизни (субъект под непосредственной
угрозой смерти); (iii) потребовалась госпитализация в стационар или продление
срока госпитализации; (iv) привело к стойкой или выраженной
нетрудоспособности/инвалидности; (v) была врожденная аномалия/врожденный дефект,
и (vi) включены другие важные медицинские осложнения. *-7 событий
классифицируются как серьезные. Ни одно из них не было классифицировано как
возможно или вероятно связанное с Монофером. Больной выздоровел во всех случаях.
Таблица 2. Биохимические лабораторные показатели,
включенные в анализ эффективности, показаны как среднее значение, m±SD
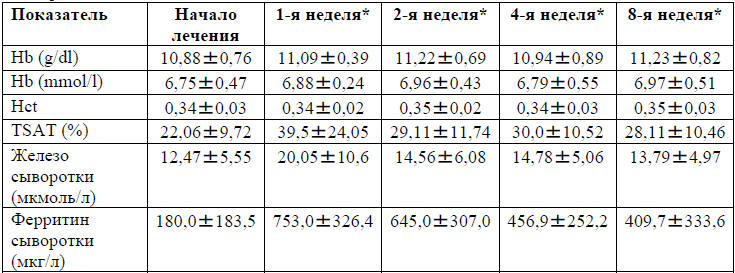
*Количество полных недель, прошедших с начала лечения. Hb-гемоглобин;
Hct-гематокрит; TSATсатурация трансферрина
Таблица 3. Биохимические лабораторные показатели,
включенные в анализ эффективности, показаны как среднее значение парных
изменений от начала лечения, m±SD
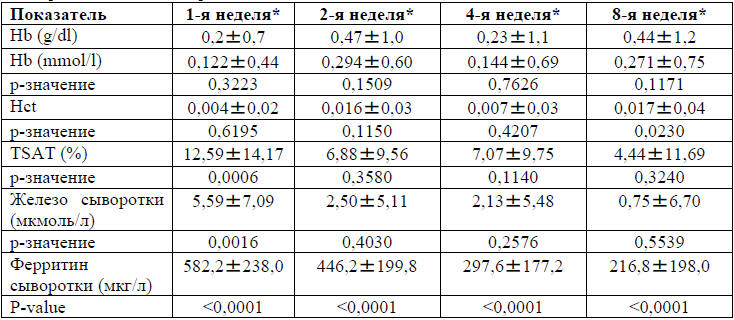
*-Количество полных недель, прошедших с начала лечения. Hb-гемоглобин;
Hct-гематокрит; TSATсатурация трансферрина.
Таблица 4. LASA шкалы качества жизни
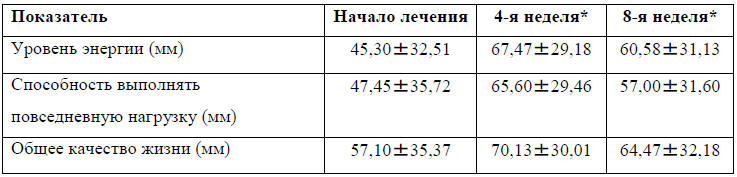
*-Количество полных недель, прошедших с начала лечения. LASA – линейная
визуальная аналоговая шкала
ОБСУЖДЕНИЕ
Комплексная патофизиология анемии при ХСН включает в себя дефицит железа.
Коррекция железодефицитной анемии у больных ХСН становится важным, потенциально
новым способом лечения. Первоначальные испытания выявили эффективное сочетание
парентерального железа с эритропоэз-стимулирующими препаратами у больных с ХСН и
анемии5,6. Совсем недавно, самостоятельное (изолированное) внутривенное введение
железа (т.е. без одновременного применения эритропоэз-стимулирующих агентов)
продемонстрировало улучшение маркеров функции сердца у больных с ХСН и
анемией3,7,8. В рандомизированном исследовании у 35 больных ХСН с дефицитом
железа с или без анемии12 было найдено улучшение симптомов, качества жизни и
толерантности к физической нагрузке, что крайне важно для пациентов с анемией.
Последнее большое, рандомизированное плацебо-контролируемое исследование
FAIR-HF7 (Ferriccarboxymaltose in patients with heart failure and iron
deficiency – железа карбоксимальтозат у больных ХСН и железодефицитом) у 459
пациентов с ХСН с дефицитом железа с или без анемии показал клинически важное и
статистически значимое улучшение при применении внутривенного железа по данным
глобальной самооценки пациентов (self-reported Patient Global Assessment), теста
6-минутной ходьбы и функционального класса сердечной недостаточности по NYHA по
сравнению с плацебо. Не было получено различий по степени улучшения между
пациентами с или без анемии. Эти обнадеживающие результаты могут привести к
более широкому применению препаратов железа у пациентов с ХСН.
В настоящее время доступные препараты парентерального железа считаются одинаково
эффективными, но различаются по молекулярному размеру, фармакокинетике и профилю
побочных реакций. Применявшийся примерно 70 лет назад комплекс железа
оксигидроксид был токсичным13 . Токсичность была уменьшена путем создания
соединения, в котором железо находилось в ядре, окруженном оболочкой углеводов.
Эта оболочка состояла из молекул, таких как декстран, декстрин, глюконат или
сахароза. Первые декстрансодержащие внутривенные препараты железа обладали
высоким риском анафилаксии. Использование низкомолекулярного декстрана железа
позволило значимо снизить этот . Реакции на железо происходят при использовании
всех внутривенных препаратов железа, но, как правило, это не иммунносвязанные
реакции13 . Препараты железа, имеющие слабо связанное железо, могут быть
назначены только в относительно низких дозах из-за риска токсичности свободного
железа.
Таким образом, важной является разработка новых соединений железа для
внутривенного введения с оптимизированным профилем польза/риск. В последнее
время были разработаны новые препараты железа для внутиривенного, в том числе
фекумокситол (Ferumoxytol) (Feraheme, AMAG Pharmaceuticals, Inc, Lexington,
Массачусетс, США), железа карбоксимальтозат (Ferinject, Вифор Pharma,
Санкт-Галлен, Швейцария) и железа изомальтозат 1000 (Monofer).
В этих новейших внутривенных препаратах железо связано достаточно крепко, что
позволяет однократно и быстро вводить в организм высокие дозы железа. Кроме
того, эти препараты имеют минимальный риск анафилаксии и, следовательно, не
требуют введения тестовой дозы. Одним из таких соединений является Monofer,
который применялся во время клинических испытаний у пациентов с хронической
болезнью почек в высоких разовых дозах (одно быстрое введение дозы до 1800 мг)
важной является разработка новых соединений железа для внутривенного введения с
оптимизированным профилем польза/риск. В последнее время были разработаны новые
препараты железа для внутиривенного, в том числе фекумокситол (Ferumoxytol) (Feraheme,
AMAG Pharmaceuticals, Inc, Lexington, Массачусетс, США), железа
карбоксимальтозат (Ferinject, Вифор Pharma, Санкт-Галлен, Швейцария) и железа
изомальтозат 1000 (Monofer). В этих новейших внутривенных препаратах железо
связано достаточно крепко, что позволяет однократно и быстро вводить в организм
высокие дозы железа. Кроме того, эти препараты имеют минимальный риск
анафилаксии и, следовательно, не требуют введения тестовой дозы. Одним из таких
соединений является Monofer, который применялся во время клинических испытаний у
пациентов с хронической болезнью почек в высоких разовых дозах (одно быстрое
введение дозы до 1800 мг)16 . Все пациенты в этом исследовании получили
однократную быстро введённую инфузию железа изомальтозата 1000. Такой способ
введения, по сравнению с повторяющимися инъекциями, особенно удобен для
амбулаторных пациентов и является ресурсосохраняющим как для пациентов, так и
для медицинских работников17.
Основной целью данного исследования было определение безопасности препарата, и
анализ нежелательных явлений, происходящих в течение 8 недель с момента начала
исследования, связанных или не связанных с исследуемым препаратом, которые были
зафиксированы в соответствии с клиническим протоколом исследования. Критерии для
определения НЯ и их подразделение на серьезные и несерьезные события
соответствуют критериям, описанным в протоколе испытания. Это дало достоверную
оценку параметров безопасности. В этом исследовании не было НЯ, связанных с
лечением препаратами железа.
Что касается клинической химии, лейкоцитов и тромбоцитов, то клинически значимых
изменений средних значений этих показателей в течение времени не наблюдалось.
Изменения на ЭКГ, выявленные в ходе исследования, но отсутствавшие в начале
исследования, могут быть объяснены анамнезом заболевания пациента. Не было
выявлено анафилактических, анафилактоидных или реакций гиперчувствительности
замедленного типа.
Определяемые параметры, включая лабораторные показатели, не отличались от
таковых в других исследованиях. По сравнению с другими исследованиями по
применению внутривенного железа у больных ХСН, увеличение гемоглобина было
незначительным и недостоверным, что может объясняться небольшим числом пациентов
(для того, чтобы получить статистическую значимость для фактических различий и
стандартных ошибок, наблюдаемых в настоящем исследовании, в него должны быть
включены около 50 пациентов с ХСН). Кроме того, относительно высокий уровень
гемоглобина в начале исследования может объяснять довольно скромный его прирост
в процессе исследования. Обоснованием для относительно высокого уровня
гемоглобина было включение клинически соответствующих групп пациентов, по
крайней мере с умеренной анемией, отражающих когорту больных, обычно
госпитализируемых для лечения сердечной недостаточности. Кроме того, в настоящем
исследовании ни одного пациента не лечили комбинированным введением
эритропоэз-стимулирующих агентов. Средний уровень ферритина в настоящем
исследовании значительно улучшился, отражая быстрое пополнение запасов железа.
Уровень ферритина менее 800 мкг/л был выбран для исключения возникновения
перегрузки железом. Ни у одного из пациентов не были выявлены признаки
перегрузки железом. В настоящее время трудно сделать вывод о том, что
относительно небольшой прирост уровня гемоглобина свидетельствует, что есть
место для более агрессивного режима дозирования. Рассчитанная общая доза была
основана на целевом гемоглобине 13 г/дл. В настоящее время не существует единого
мнения относительно оптимального целевого значения гемоглобина у пациентов с ХСН.
Среднее значение гемоглобина через 8 недель составило 11,2 г/дл. В будущих
исследованиях следует изучить, является ли эта величина оптимальным целевым
значением для данных пациентов.
Кроме того, относительно высокий уровень гемоглобина в начале исследования
может объяснять довольно скромный его прирост в процессе исследования.
Обоснованием для относительно высокого уровня гемоглобина было включение
клинически соответствующих групп пациентов, по крайней мере с умеренной анемией,
отражающих когорту больных, обычно госпитализируемых для лечения сердечной
недостаточности. Кроме того, в настоящем исследовании ни одного пациента не
лечили комбинированным введением эритропоэз-стимулирующих агентов. Средний
уровень ферритина в настоящем исследовании значительно улучшился, отражая
быстрое пополнение запасов железа. Уровень ферритина менее 800 мкг/л был выбран
для исключения возникновения перегрузки железом. Ни у одного из пациентов не
были выявлены признаки перегрузки железом. В настоящее время трудно сделать
вывод о том, что относительно небольшой прирост уровня гемоглобина
свидетельствует, что есть место для более агрессивного режима дозирования.
Рассчитанная общая доза была основана на целевом гемоглобине 13 г/дл. В
настоящее время не существует единого мнения относительно оптимального целевого
значения гемоглобина у пациентов с ХСН. Среднее значение гемоглобина через 8
недель составило 11,2 г/дл. В будущих исследованиях следует изучить, является ли
эта величина оптимальным целевым значением для данных пациентов.
ХСН является хроническим заболеванием с высоким уровнем смертности и
госпитализации, и сопровождается ухудшением качества жизни, несмотря на
современное лечение. Важно определить новые методы и подходы лечения для
улучшения положения больных с ХСН. Также важно отметить, что, несмотря на
относительно небольшое число пациентов с ХСН и незначительное увеличение
гемоглобина, было получено достоверное улучшение качества жизни больных по
сравнению с началом лечения.
ВЫВОДЫ
Выводы, которые можно сделать из этого исследования, ограничены открытым
неконтролируемым дизайном и сравнительно небольшим размером выборки. Таким
образом, для подтверждения безопасности и эффективности результатов настоящего
пилотного исследования необходимы большие контролируемые исследования с более
длительными сроками наблюдения. Тем не менее, основная цель – проверка
безопасности применения высокой разовой дозы изомальтозата железа 1000 в
экспериментальном исследовании и в реальных клинических условиях у 20 уязвимых
пожилых больных с ХСН была достигнута за 8-недельный период. У этих больных,
получивших железа изомальтозат 1000 (Monofer)
в виде однократной быстрой внутривенной инфузии в 1000 (Monofer) в виде
однократной быстрой внутривенной инфузии в относительно высоких дозах и без
первоначальной тестовой дозы, улучшились показатели качества жизни, была
продемонстрирована очень хорошая переносимость препарата, и не наблюдались
связанные с лечением нежелательные явления.
Сайт препарата Монофер -
www.monofer.ru
Список литературы
1. Anand IS. Anemia and chronic heart failure implications and treatment options.
J Am Coll Cardiol 2008; 52: 501–11.
2. Nanas JN, Matsouka C, Karageorgopoulos D, et al. Etiology of anemia in
patients with advanced heart failure. J Am Coll Cardiol 2006; 48: 2485–9.
3. Bolger AP, Bartlett FR, Penston HS, et al. Intravenous iron alone for the
treatment of anemia in patients with chronic heart failure. J Am Coll Cardiol
2006; 48: 1225–7.
4. Ezekowitz JA, McAlister FA, Armstrong PW. Anemia is common in heart failure
and is associated with poor outcomes: insights from a cohort of 12 065 patients
with new-onset heart failure. Circulation 2003; 107: 223–5.
5. Silverberg DS, Wexler D, Blum M, et al. The use of subcutaneous
erythropoietin and intravenous iron for the treatment of the anemia of severe,
resistant con-gestive heart failure improves cardiac and renal function and
functional cardiac class, and markedly reduceshospitalizations. J Am Coll
Cardiol 2000; 35: 1737–44.
6. Silverberg DS, Wexler D, Sheps D, et al. The effect of correction of mild
anemia in severe, resistant congestive heart failure using subcutaneous
erythropoietin and intravenous iron: a randomized controlled study. J Am Coll
Cardiol 2001; 37: 1775–80.
7. Anker SD, Comin Colet J, Filippatos G, et al. Ferric carboxymaltose in
patients with heart failure and iron deficiency. N Engl J Med 2009; 361:
2436–48.
8. Toblli JE, Lombrana A, Duarte P, Di Gennaro F. Intravenous iron reduces
NT-pro-brain natriuretic peptide in anemic patients with chronic heart failure
and renal insufficiency. J Am Coll Cardiol 2007; 50: 1657–65.
9. Usmanov RI, Zueva EB, Silverberg DS, Shaked M. Intravenous iron without
erythropoietin for the treatment of iron deficiency anemia in patients with
moderate to severe congestive heart failure and chronic kidney insufficiency. J
Nephrol 2008; 21: 236–42.
10. Ganzoni AM. [Intravenous iron-dextran: therapeutic and experimental
possibilities]. Schweiz Med Wochenschr 1970; 100: 301–3.
11. Medical Dictionary for Regulatory Activities Maintenance and Support
Services Organization. Accessed at http:// www.meddramsso.com/
12. Okonko DO, Grzeslo A, Witkowski T, et al. Effect of intravenous iron sucrose
on exercise tolerance in anemic and nonanemic patients with symptomaticchronic
heart failure and iron deficiency FERRIC-HF: a randomized,
controlled,observer-blinded trial. J Am Coll Cardiol 2008; 51: 103–12.
13. Macdougall IC. Evolution of iv iron compounds over the last century. J Ren
Care 2009; 35(Suppl. 2): 8–13.
14. Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. On the relative safety of
parenteral iron formulations. Nephrol Dial Transplant 2004; 19: 1571–5.
15. Chertow GM, Mason PD, Vaage-Nilsen O, Ahlmen J. Update on adverse drug
events associated with parenteral iron. Nephrol Dial Transplant 2006; 21:
378–82.
16. Wikstrom B, Bhandari S, Barany P, et al. Iron isomaltoside 1000: a novel
intravenous iron for treating iron deficiency in chronic kidney disease. J
Nephrol 2010 (in press).
17. Peebles G, Stanley S. Evaluation of a service reconfiguration for managing
intravenous iron supplementation in non-haemodialysis patients with chronic
renal failure. J Outcomes Res 2004; 8:15–25.