Гастроэзофагеальная
рефлюксная болезнь, ассоциированная с
дуоденогастроэзофагеальным рефлюксом, у больных с
билиарной патологией: особенности течения и
микробного биоценоза эзофагогастродуоденальной зоны
Г.С. Джулай, Е.В.
Секарева, В.М. Червинец, Е.С. Михайлова, Т.Е. Джулай
Кафедра факультетской терапии, кафедра
микробиологии, вирусологии и иммунологии Тверской
государственной медицинской академии Минздрава
России
ГЭРБ — гастроэзофагеальная рефлюксная болезнь
ДГЭР — дуоденогастроэзофагеальный рефлюкс
ДПК — двенадцатиперстная кишка
ЖКБ — желчно-каменная болезнь
СО — слизистая оболочки
СОП — слизистая оболочка пищевода
ХБХ — хронический бескаменный холецистит
ЭГДЗ — эзофагогастродуоденальная зона
Сведения об авторах:
Секарева Елена Валерьевна — к.м.н., асс. каф.
факультетской терапии
Червинец Вячеслав Михайлович — д.м.н., проф., зав.
каф. микробиологии, вирусологии и иммунологии
Михайлова Елена Сергеевна — к.м.н., асс. каф.
микробиологии, вирусологии и иммунологии
Джулай Татьяна Евгеньевна — ординатор каф.
факультетской терапии
Контактная информация:
Джулай Галина Семеновна — д.м.н., проф., зав.
каф. факультетской терапии; тел.: +7(482)244-4767;
e-mail: djoulаi@mаil.ru
Резюме
Цель исследования. Изучение особенностей
клинического течения гастроэзофагеальной рефлюксной
болезни (ГЭРБ), ассоциированной с
дуоденогастроэзофагеальным рефлюксом (ДГЭР), у
пациентов с хроническим бескаменным холециститом
(ХБХ) и желчно-каменной болезнью (ЖКБ), а также
качественных и количественных характеристик
патомикробиоценозов эзофагогастродуоденальной зоны
при их сочетанном течении.
Материалы и методы. У 83 больных ГЭРБ,
ассоциированной с ДГЭР и протекающей в сочетании с
ХБХ или ЖКБ, детально изучены клинические
особенности, морфологические, моторно-тонические
характеристики эзофагогастродуоденальной зоны,
микробный биоценоз мукозной флоры пищевода, желудка
и двенадцатиперстной кишки (ДПК).
Результаты. Показано, что при ХБХ и ЖКБ,
сочетающихся ГЭРБ, имеет значение нарушение
пропульсивной активности ДПК в виде сочетания
явлений гастростаза и дискинезии ДПК с
дискоординацией как антродуоденальной, так и
дуоденоеюнальной пропульсии и развитием
дуоденогастрального рефлюкса и ДГЭР, в свою очередь
определяющих значения рН в пищеводе и желудке.
Патомикробиоценоз верхних отделов пищеварительного
тракта характеризуется увеличением количественного и
качественного состава мукозной микрофлоры.
Условно-патогенные микроорганизмы
отличаются наличием цитотоксической, гемолитической,
лецитиназной, казеинолитической, уреазной, РНКазной
активности.
Заключение. Выявленные особенности
протекания ГЭРБ, ассоциированной с ДГЭР, у пациентов
с патологическими состояниями билиарного тракта
заставляют искать новые терапевтические подходы,
базирующиеся на коррекции моторно-тонических
нарушений в деятельности пищеварительной системы и
патомикробиоценозов мукозной флоры пищевода, желудка
и ДПК.
Ключевые слова: гастроэзофагеальная
рефлюксная болезнь, дуоденогастроэзофагеальный
рефлюкс, сочетанное течение при билиарной патологии,
микробные биоценозы.
Успехи лечения пациентов с гастроэзофагеальной
рефлюксной болезнью (ГЭРБ) в большей степени
касаются ее варианта, ассоциированного с
гастроэзофагеальным рефлюксом, и пока не столь
очевидны при наличии дуоденогастроэзофагеального
рефлюкса (ДГЭР) [1—3]. Механизм поражения пищевода
при ДГЭР связан как с непосредственным влиянием
желчных кислот, лизолецитина и панкреатических
ферментов на эпителий слизистой оболочки пищевода (СОП),
так и со способностью желчных кислот
взаимодействовать с мускариновыми рецепторами
гладких мышечных клеток и вызывать их функциональные
нарушения, приводящие к нарушению моторики пищевода
и замедлению пищеводного клиренса [4—6].
Явления ДГЭР в основном наблюдаются при
патологических состояниях билиарного тракта,
сопровождающихся моторно-тоническими расстройствами
зоны антродуоденального перехода, в частности у
больных хроническим бескаменным холециститом (ХБХ) и
желчно-каменной болезнью (ЖКБ) [2, 7, 8].
Клинические особенности сочетанного течения ГЭРБ и
патологических состояний билиарного тракта
продолжают изучаться, в том числе в аспекте участия
дисбиотических явлений в верхних отделах
пищеварительного тракта. Это тем более актуально,
что формированию морфологических основ эзофагита
способствует микробный патобиоценоз СОП, выявляемый
при ГЭРБ. Однако качественные и количественные
характеристики его в настоящее время детально не
выяснены [9, 10].
Целью работы явилось изучение особенностей
клинического течения ГЭРБ, ассоциированной с ДГЭР, у
пациентов с ХБХ и ЖКБ, а также качественных и
количественных характеристик патомикробиоценозов
эзофаго-гастродуоденальной зоны (ЭГДЗ) при их
сочетанном течении.
Материалы и методы
Обследовали 83 женщин в возрасте от 26 до 62 лет
(55,3±12,2 года). Критериями включения в группу
обследования (при условии получения информированного
согласия пациентки) было наличие у больных с ХБХ и
ЖКБ типичных для ГЭРБ жалоб (изжога, регургитация,
дисфагия), явлений дуоденогастрального рефлюкса и
ДГЭР с эпизодами рН >8 в пищеводе, стойким привкусом
горечи, отрыжкой горьким, эндоскопически различимым
забросом желчи в желудок и пищевод, а также
дистального эзофагита разной степени выраженности.
Критерии исключения: язвенная болезнь желудка и
состояния после операций на желудке, злокачественные
новообразования любой локализации, заболевания,
протекающие со стойким снижением трудоспособности
(жизнедеятельности) и качества жизни, в частности
сердечно-сосудистой и нервной систем, сахарный
диабет тяжелого течения, длительный (более 1 мес)
прием нестероидных противовоспалительных препаратов.
У всех больных комплексно исследованы
эндоскопические характеристики, микроскопическая
картина гастробиоптатов, параметров рН-метрии,
электрогастроэнтерографии на аппарате Гастроскан-ГЭМ
(НПП «Исток-Система», Фрязино). Состояние билиарного
тракта верифицировано данными ультразвукового
сканирования, компьютерной либо магнитно-резонансной
томографии брюшной полости, при необходимости —
эндоскопической ретроградной холангиопанкреатографии.
Микробный состав ЭГДЗ изучали до начала лечения в
114 биоптатах 38 больных ХБХ (1-я группа) из
визуально неизмененных участков СО нижней трети
пищевода, антрального отдела желудка и
двенадцатиперстной кишки (ДПК) и в 135 биоптатах 45
больных ЖКБ (2-я группа) и сравнивали с данными
исследования 10 практически здоровых добровольцев
[9]. Стерилизацию эндоскопической аппаратуры
осуществляли по методике, рекомендованной фирмой
Olympus и исключающей дополнительную контаминацию
биоптатов. Контроль на стерильность показал ее
абсолютную надежность. Микрофлору выделяли с
использованием классических бактериологических
методик. Изучали признаки, ассоциированные с
патогенностью: лецитиназной, желатиназной,
каталазной (по В.М. Никитину, 1986),
казеинолитической (по В.М. Червинцу и соавт., 2004),
гемолитической (по В.О. Агаповой, 1999),
антилизоцимной (по О.В. Бухарину и соавт., 1984),
уреазной (Urease Test Broth BBL, USA) активностью
микроорганизмов.
Для систематизации и анализа полученных
результатов создана электронная база данных.
Статистическую обработку данных проводили с помощью
пакета программ Microsoft Office Excel и
Биостатистика (версия 4.03). Использовали
однофакторный дисперсионный анализ, критерий χ2.
Критический уровень значимости при проверке
статистических гипотез принимали равным 0,05.
Результаты
В процессе обследования больных ГЭРБ,
сочетающейся с ХБХ и ЖКБ, установлено, что явления
ДГЭР во всех случаях провоцируют изжогу, выступающую
основным пищеводным симптомом, которая у 86,7%
пациентов сопровождалась регургитацией горького
содержимого, отрыжкой и устойчивым горьким
привкусом. Эпизоды изжоги, как правило, затягивались
и обусловливали необходимость последовательного
приема нескольких доз антацидных средств.
Внепищеводные симптомы отмечали 38,6% больных с ДГЭР,
в 62,5% наблюдений они представлены рефлюксзависимым
бронхообструктивным синдромом, в 25% — стойким
неприятным запахом изо рта, в 12,5% — ощущением
жжения в кончике языка. У всех пациентов имелась
комбинация симптомов желудочной, кишечной и
билиарной диспепсии разной степени выраженности.
Морфологическим субстратом действия ДГЭР у
пациентов с ГЭРБ были неспецифичные
воспалительно-эрозивные изменения СОП, выявляемые
при эзофагогастродуоденоскопии и гистологическом
исследовании биоптатов из дистального отдела
пищевода. При гистологическом исследовании биоптатов
СОП обнаруживали в многослойном плоском
неороговевающем эпителии преобладание дистрофических
изменений над воспалительными. Они были наиболее
выражены в поверхностных слоях эпителиального пласта
и проявлялись его значительным, но неравномерным
утолщением, паракератозом, гидропической дистрофией
кератоцитов, акантозом [8].
Гистологическая картина биоптатов СО желудка у
пациентов соответствовала критериям неатрофического
(поверхностного) хронического гастрита и
характеризовалась преобладанием легкой (53%) и
умеренной (39,8%) активностью воспалительного
процесса. У 20,5% больных обнаружена атрофия
пилорических желез с кишечной метаплазией как
полного, так и неполного типа. Отличительной
особенностью строения при ДГЭР было наличие
фовеолярной гиперплазии покровно-ямочного эпителия,
являющейся ранним признаком дисрегенеративных
процессов.
При изучении рН в пищеводе натощак
регистрировались значения рН, соответствующие как
щелочной (в 4,8% случаев), так и кислой (в 15,7%)
среде, что могло затруднять диагностику типа
рефлюкса. Стимуляция желудочной секреции у 48,7%
пациентов провоцировала возникновение щелочных
гастроэзофагеальных рефлюксов, которые
соответствовали критериям патологического рефлюкса,
действуя более 5 мин.
При оценке уровня рН в желудке у 22,9% больных
зафиксированы базальные значения более 8,0,
гиперацидность натощак отмечена только у 12,8%. При
стимуляции кислотообразования выявлен положительный
ответ секреторного аппарата желудка лишь у 16,9%
пациентов. В 61,4% случаев происходило увеличение рН
в теле желудка до значений, соответствующих щелочной
среде, что у 84,3% больных расценено как проявление
дуоденогастрального рефлюкса (ДГР) (рН более 8,0).
Изучение биоэлектрической активности
гастродуоденальной зоны выявило нарушения
моторно-эвакуаторной функции желудка и ДПК в виде
сочетания явлений гастростаза и дискинезии ДПК с
дискоординацией как антродуоденальной, так и
дуоденоеюнальной пропульсии. Так, регистрируемый
электрофизиологический ответ желудка после пищевой
стимуляции у всех пациентов характеризовался
умеренной силой. Доля амплитуды желудочного ответа в
суммарном потенциале составила 26,7±4,01%, а
отношение мощностей — 31,2±1,68%. При этом среднее
количество желудочных циклов в минуту
соответствовало уровню нормальной пейсмейкерной
активности желудка (2—4 сокращения в минуту) и
составляло 2,2±0,1. Коэффициент ритмичности
желудочных сокращений индивидуально варьировал
(19,7±15,27), зачастую значительно превышая условную
норму (4,85±2,1 по В.А. Ступину и соавт., 2005), что
свидетельствовало о непропульсивных сокращениях
гладкой мускулатуры желудка по типу гастростаза.
Постпрандиальный электрофизиологический ответ ДПК
не был адекватен по силе желудочной активности. Это
проявлялось снижением доли дуоденального компонента
суммарного частотного спектра электрической
активности желудочно-кишечного тракта — амплитуда и
отношение мощностей составляли соответственно 10,1±
6,36 и 2,1±0,63%. В ряде случаев в момент ДГР
наблюдали резкое падение электрической активности
желудка и возрастание активности ДПК. При этом число
циклов электрофизиологической активности ДПК в
минуту лежало в узком коридоре значений и имело мало
индивидуальных различий — 11,5±0,18. Коэффициент
ритмичности сокращений ДПК превышал условную норму,
составив 4,0±3,75, и был подвержен значительным
индивидуальным колебаниям (картина дуоденостаза с
гипермоторной дискинезией ДПК).
Большое значение для характеристики моторики ЭГДЗ
имеет показатель, отражающий координированную
пропульсию пищевого химуса между отдельными
участками желудочно-кишечного тракта. Так,
коэффициент сравнения электрофизиологической
активности желудка и ДПК в зоне антродуоденального
перехода составил 32,3±20,95, тогда как в зоне
дуоденоеюнального перехода — 0,3±0,07.
Анализ патомикробиоценозов верхних отделов
пищеварительного тракта производили с учетом ведущей
патологии билиарного тракта (рис. 1). У больных ХБК
и ЖКБ в биоптатах из СОП выявлялись почти 15 родов
микроорганизмов. Количество выделенных бактерий у
больных ХБХ колебалось от 3,2 до 6,1 lg КОЕ/г, у
пациентов с ЖКБ — от 2,8 до 5,5 lg КОЕ/г. Чаще
высевались стрептококки (у 92 и 100% больных в 1-й и
2-й группах соответственно), стафилококки (87 и
84%), энтеробактерии (51 и 59%). Helicobacter pylori
обнаруживали у 8% больных ХБК и у 31% с ЖКБ.
Микроорганизмы во всех случаях встречались в виде
сочетания 3—8 культур, представленных
стрептококками, стафилококками, бактероидами и
энтеробактериями, лактобациллами, коринебактериями,
бациллами, грибами рода Candida и другими бактериями
(рис. 2).

Рис. 1. Спектр и
распространенность микроорганизмов СОП, СО желудка и
ДПК здоровых людей
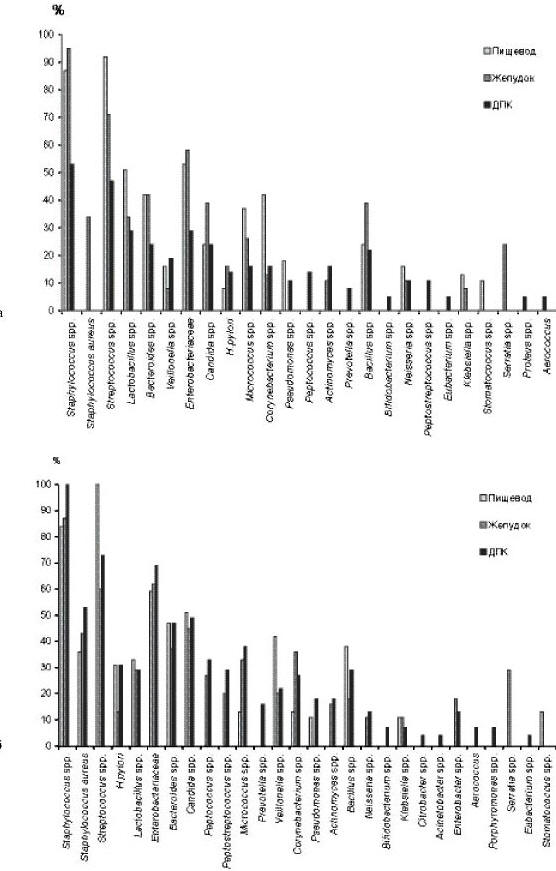
Рис. 2. Частота выделения
микроорганизмов из биоптатов СОП, СО желудка и ДПК у
больных ХБХ (а) и ЖКБ (б)
В биоптатах из антрального отдела желудка больных
с билиарной патологией определялось до 18 родов
микроорганизмов. У пациентов с ХБХ и ЖКБ отмечено
преобладание стафилококков (соответственно в 95 и
87% выделений), стрептококков (71 и 60%) и бактерий
семейства Enterobacteriaceae (58 и 62%). Их
количество у больных ХБХ колебалось от 3,2 до 5,3 lg
КОЕ/г, у пациентов с ЖКБ — от 3,1 до 5,4 lg КОЕ/г.
H. pylori выделялся у 16% больных ХБК и у 13%
пациентов с ЖКБ. Микроорганизмы в монокультуре не
встречались. Бактерии выделялись в среднем по 5—6
культур в биоптате. Чаще выявлялись сочетания
стафилококков со стрептококками, коринебактериями,
грибами рода Candida, бактероидами, микрококками,
энтеробактериями, бациллами.
Из биоптатов СО ДПК у больных ХБХ выделялось 19
родов микроорганизмов, наиболее часто представленных
стафилококками, стрептококками, энтеробактериями,
лактобациллами, бактероидами в количестве 3,2—4,9 lg
КОЕ/г. У больных ЖКБ обнаруживали признаки активации
условно-патогенной микрофлоры с выделением до 28
различных родов и видов микроорганизмов. При этом в
73—100% случаев доминировали стрептококки и
стафилококки. Количество микроорганизмов достигало
3,3— 5,2 lg КОЕ/г. H. pylori обнаруживали в 14%
случаев ХБК и в 31% — при ЖКБ. В монокультуре
микроорганизмы не встречались. Сочетания 2—7 культур
чаще были представлены бактероидами,
энтеробактериями, стафилококками, стрептококками,
пептококками, пептострептококками и кандидами.
Изучение биохимических свойств выделенной
микрофлоры из пораженных участков СО ЭГДЗ показало,
что они имеют высокие уровни признаков,
ассоциированных с патогенностью. Так, по сравнению с
бактериями, выделенными из СО здоровых людей, в
большем числе случаев обнаруживались гемолитические
стафилококки и стрептококки. В отличие от здоровых
лиц, выявлялись штаммы бактерий с гемолитической
активностью, представляющие роды Neisseria,
Enterobacter, Pseudomonas, Veillonella, Bacillus,
Citrobacter, Serratia, Peptococcus, E. coli.
У пациентов с ГЭРБ, протекающей с ХБК и ЖКБ,
идентифицированы бактерии, обладающие лецитиназной
активностью: стафилококки, стрептококки, бациллы,
коринебактерии, псевдомонады и энтеробактерии. У
этих больных обнаруживали также штаммы
микроорганизмов, обладающие РНКазной активностью:
псевдомонады, стафилококки, стрептококки,
энтеробактерии и даже лактобациллы.
Казеинолитическая активность отмечалась у
псевдомонад, стрептококков, стафилококков и
бактероидов. Помимо H. pylori фермент уреаза
продуцировался пептококками, микрококками
стрептококками, стафилококками, псевдомонадами и
грибами рода Candida.
Обсуждение
В последние десятилетия на повестке дня
повседневной практики клиницистов встала проблема
сочетанного течения заболеваний. Причина этого не
только в обнаружении закономерно связанных между
собой сочетанных пар и триад нозологий, но и в
необходимости выработки сбалансированной тактики
лечения в условиях сочетанного течения хронических
заболеваний, касаются ли они одной или нескольких
вовлеченных в процесс систем органов [11]. Анализ
особенностей сочетанного течения особенно актуален в
отношении патологических состояний пищеварительного
тракта, который является удивительным природный
конвейером, где все процессы взаимосвязаны, строго
последовательны и целесообразны.
Поэтому проблема сочетанности (коморбидности) в
гастроэнтерологии должна изучаться во всей
совокупности «ассоциированных с ней явлений и
феноменов» [11], а именно с точки зрения сочетания
структурных, функциональных, клинических аспектов с
практическим выходом на принципы формирования
лечебных, реабилитационных и профилактических
программ ведения пациентов.
С этой точки зрения исследование течения
нозологических пар ГЭРБ—ХБХ и ГЭРБ—ЖКБ
представляется оправданным и своевременным.
Настоящее исследование подтвердило значение ДГЭР,
сопровождающего билиарную патологию [7, 12—14], в
качестве одного из ведущих механизмов
рефлюкс-эзофагита и антрального рефлюкс-гастрита.
Так, установлено, что при ХБХ и ЖКБ, сочетающихся с
ГЭРБ, имеет значение нарушение пропульсивной
активности ДПК в виде сочетания явлений гастростаза
и дискинезии ДПК с дискоординацией как
антродуоденальной, так и дуоденоеюнальной пропульсии
и развитием ДГР и ДГЭР, в свою очередь определяющих
рН в пищеводе и желудке. При этом
причинно-следственные соотношения моторно-тонических
расстройств пилородуоденальной зоны и билиарного
тракта еще нуждаются в уточнении.
Выявленные типичные воспалительные изменения в СО
антрального отдела желудка и дистального отдела
пищевода у больных данной категории сочетаются с
микробным дисбалансом верхних отделов
пищеварительного тракта в виде увеличения
количественного и качественного состава мукозной
микрофлоры. Условно-патогенные микроорганизмы
характеризовались наличием цитотоксической,
гемолитической, лецитиназной, казеинолитической,
уреазной, РНКазной активности, что позволяет
предположить их активное участие в реализации
воспалительных процессов. Это согласуется с мнением
В.М. Бондаренко и соавт. [15], В.В. Чернина [10] о
том, что широкое распространение дисбиозов служит
одним из важнейших факторов, определяющих
наблюдаемое в настоящее время увеличение частоты и
тяжести острых и хронических заболеваний
пищеварительного тракта.
Заключение
Установленные особенности течения ГЭРБ,
ассоциированной с ДГЭР, у пациентов с
патологическими состояниями билиарного тракта
заставляют искать новые терапевтические подходы,
базирующиеся на коррекции моторно-тонических
нарушений в функционировании пищеварительной системы
и патомикробиоценозов мукозной флоры пищевода,
желудка и ДПК.
Литература
- Маев И.В., Кучерявый Ю.А. Достижения в
диагностике и лечении гастроэзофагеальной
рефлюксной болезни. Фармате-ка 2007; 2: 49—52.
- Лапина Т.Л., Буеверов А.О. Горечь во рту:
интерпретация гастроэнтеролога. Клин перспект
гастроэнтерол, гепатол 2013; 3: 18—24.
- Fein M., Maroske J., Fuchs K.-H. Importance
of duodenogastric reflux in gastro-oesophageal
reflux disease. Br J Surg 2006; 93 (12):
1475—1482.
- Ивашкин В.Т., Трухманов А.С. Холинергическая
стимуляция: ее роль в осуществлении двигательной
функции пищевода и клиренса при
гастроэзофагеальной рефлюксной болезни. Клин
перспект гастроэнтерол, гепатол 2011; 4: 3—8.
- Raufman, J.P. , Cheng K., Zimniak P.
Activation of muscarinic receptor signaling by
bile acids: physiological and medical
implications. Dig Dis Sci 2003; 48 (8):
1431—1444.
- Brilliantino A., Monaco L., Schettino V. et
al. Prevalence of pathological duodenogastric
reflux and the relationship between
duodenogastric and duodenogastrooesophageal
reflux in chronic gastrooesophageal reflux
disease. Eur J Gastroenterol Hepatol 2008; 20
(12): 1136—1143.
- Ильченко А.А. Болезни желчного пузыря и
желчных путей. Руководство для врачей. М: МИА;
2011.
- Джулай Г.С., Секарева Е.В., Курицын В.М.,
Джулай Т.Е. Клинико-патогенетические варианты
гастроэзофагеальной рефлюксной болезни: факторы
риска и предикторы развития. Тер арх 2013; 2:
8—12.
- Михайлова Е.С., Червинец В.М., Червинец Ю.В.
и др. Микрофлора желудочно-кишечного тракта у
больных хроническим холециститом. ЖМЭИ 2007; 4:
103—105.
- Чернин В.В. Болезни пищевода, желудка и
двенадцатиперстной кишки: Руководство для
врачей. М: МИА; 2010.
- Верткин А.Л., Румянцев М.А., Скотников А.С.
Коморбидность. Клин мед 2012; 10: 4—11.
- Koek G.H., Vos R., Sifrim D. et al.
Mechanisms underlying duodeno-gastric reflux in
man. Neurogastroenterol Motil 2005; 17 (2):
191—199.
- Ducrotte P., Chaput U. Pathophysiology of
gastro-oesophageal reflux.
Hepato-Gastroenterologie 2005; 2 (4): 362—369.
- De Giorgi F., Palmiero M., Esposito J. et al.
Pathophysiology of gastroesophageal reflux
disease. Acta Otorhinolaryngol Ital 2006; 26
(5): 241—246.
- Бондаренко В.М., Червинец В.М., Воробьёв
А.А. Роль персистенции условно патогенных
бактерий в патогенезе язв желудка и
двенадцатиперстной кишки. ЖМЭИ 2003; 4: 11—17.
Статья опубликована на сайте
http://www.gastroscan.ru