Хроническая сердечная недостаточность
Раповец ВА
Врач-кардиолог
1..Хроническая сердечная недостаточность (ХСН) - это клинический
синдром, характеризующийся типичными симптомами (например, одышка, отек лодыжек
и усталость), которые могут сопровождаться признаками (например, повышенным
давлением в яремной вене, периферическими отеками), вызванными структурной и /
или функциональной патологией сердца, приводящей к снижению сердечного выброса и
/ или повышению внутрисердечного давления в покое или во время стресса [1 ].
Нынешнее определение ХСН ограничивается стадиями, на которых
проявляются клинические симптомы. До того, как клинические симптомы станут
очевидными, пациенты могут иметь бессимптомные структурные или функциональные
нарушения со стороны сердца (систолическая или диастолическая дисфункция левого
желудочка (ЛЖ) ,которые являются предшественниками ХСН. Признание этих
предшественников важно, потому что они связаны с плохими результатами, и начало
лечения на стадии предшественника может снизить смертность у пациентов с
бессимптомной систолической дисфункцией ЛЖ [1 ].
![Табл. Маркеры ХСН [11 ].](images/art/all24/new_pa168.jpg)
Табл.
Маркеры ХСН [11].
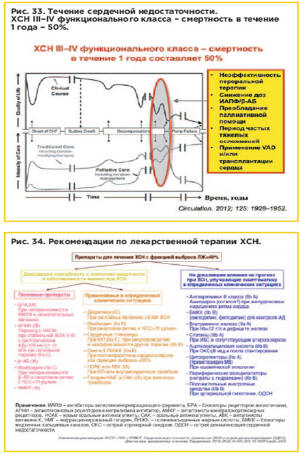
Прогноз больных с клиническими проявлениями ХСН очень
серьезный, что отражает такой ее фундаментальный признак, как прогрессирующий
характер. По данным Фремингемского исследования (наблюдение с 1948 по 1988 г.)
средняя продолжительность жизни с момента установления диагноза ХСН составляла
1,7 года для мужчин и 3,2 года для женщин, а показатель 5-летней выживаемости —
25 и 38% соответственно. Даже в современных условиях (данные Британии на 2001
г.) выживаемость пациентов с клинически манифестированной ХСН на протяжении 5
лет ниже, чем у больных с впервые диагностированными злокачественными
эпителиальными опухолями разных локализаций, кроме рака легкого
[3 ].
Клинический прогноз ХСН тем хуже, чем выше степень ее клинической
тяжести. Так, показатель смертности в течение 1 года у больных с ХСН I–II ФК по
NYHA составляет 6–10%, возрастая до 25–40% у больных с тяжелой (IV ФК по NYHA)
ХСН.
Пациенты с симптомной ХСН, но относительно сохраненной
систолической функцией ЛЖ (ФВ <40–45%) характеризуются лучшей (приблизительно
вдвое — по данным 5-летнего наблюдения) выживаемостью, чем пациенты с ХСН и
сниженной ФВ ЛЖ.
Лечение больных с ХСН требует больших средств, объем которых в
странах Западной Европы и Северной Америке составляет 1–2% общих затрат на
здравоохранение; ⅔ этих средств приходится на стационарное лечение больных с ХСН,
которых госпитализируют по поводу декомпенсации их клинического состояния.
Согласно так называемым фармакоэкономическим подсчетам, стоимость оказания
медицинской помощи пациентам с ХСН в странах Западной Европы (Франция,
Нидерланды, Германия, Бельгия) возрастает пропорционально тяжести их
клинического состояния, составляя в год для больных I–II ФК в среднем 827 евро,
III — 2029 евро и IV, клинически наиболее тяжелого, — 13 994 евро.
Соответствующие подсчеты показали, что постоянный прием ингибиторов АПФ и
блокаторов β-адренорецепторов больными с ХСН, снижая риск повторных
госпитализаций по поводу декомпенсации кровообращения, требует меньше затрат,
чем неоднократные эпизоды стационарного лечения, обусловленные неполучением
необходимой систематической терапии указанными нейрогуморальными антагонистами.
2. По современным эпидемиологическим и статистическим данным
у больных с ХСН 75–80% смертельных исходов имеют кардиальную природу, причем
приблизительно в половине случаев они соответствуют критериям внезапной смерти,
другая же половина пациентов гибнет от прогрессирующей насосной СН. Остальные
20–25% смертельных случаев среди больных с ХСН приходится на некардиальные
причины, среди которых ведущая роль принадлежит пневмонии, ТЭЛА и мозговому
инсульту [3 ].
Эпидемиологические исследования четко продемонстрировали ведущую
роль АГ и ИБС как популяционных факторов риска ХСН. Впрочем, вычленение роли
каждого из указанных факторов в возникновении ХСН является проблематичным,
поскольку АГ и ИБС сосуществуют приблизительно у 40% таких больных. По данным
как эпидемиологических данных, так и современных многоцентровых исследований,
ХСН сопряжена с ИБС у 60–65% больных.
Таблица . Популяционные факторы риска развития ХСН среди лиц в
возрасте 40–89 лет по данным Фремингемского исследования (по Levy D. et al.,
1996 ) [3].
|
Фактор риска |
Распространенность фактора риска в популяции, % |
Повышение риска по сравнению с популяционным показателем, % |
|
мужчины |
женщины |
мужчины |
женщины |
|
АД ≥140/90 |
60 |
62 |
2,1 |
3,4 |
|
ИМ |
10 |
3 |
6,3 |
6,0 |
|
Стенокардия |
11 |
9 |
1,4 |
1,7 |
|
Диабет |
8 |
5 |
1,8 |
3,7 |
|
ГЛЖ |
4 |
3 |
2,2 |
2,9 |
|
Клапанные пороки сердца |
5 |
8 |
2,5 |
2,1 |
В последнее время увеличилось количество данных относительно более
весомого, чем это представлялось ранее, значения АГ как фактора риска развития
СН. Подчеркивается, что роль АГ как фактора риска и каузальной причины
клинически имеющейся ХСН в эпидемиологических исследованиях
недооценивается, поскольку при развитии последней ранее повышенное АД у многих
больных снижается до нормы вследствие насосной несостоятельности сердца.
Результаты анализа, проведенного Национальным институтом сердца, легких и крови
США, свидетельствуют, что у 75% больных с ХСН ранее отмечали АГ. Последняя
повышает риск развития СН пропорционально степени повышения АД, причем повышение
САД является более значимым в отношении развития ХСН, чем повышение ДАД,
независимо от возраста и пола.
Наиболее частой нозологической причиной ХСН в Европе и США в
настоящее время считают ИБС, которую, по данным эпидемиологических и
многоцентровых клинических исследований, диагностируют у 60–75% таких больных.
Есть веские основания считать, что 2-е место среди этиологических факторов ХСН
занимает системная АГ, однако частое сочетание ИБС и АГ затрудняет оценку
истинной роли последней в возникновении ХСН. Так, по статистическим и
эпидемиологическим данным ИБС и АГ (отдельно или в сочетании) обусловливают
возникновение 75–80% всех случаев ХСН.
3. Снижение насосной способности сердца может быть следствием таких
патофизиологических факторов: гемодинамической перегрузки
желудочков (в большинстве случаев ЛЖ); первичного поражения миокарда; нарушения
наполнения ПЖ или ЛЖ. Перегрузка ЛЖ может быть обусловлена повышенным
сопротивлением систолическому выбросу крови («перегрузка давлением») или
повышенным диастолическим объемом крови («перегрузка объемом»). Первый вариант
отмечают при АГ и аортальном стенозе, второй — при аортальной недостаточности.
Перегрузка ПЖ давлением характерна для легочной гипертензии и стеноза ЛА,
объемом — для септальных дефектов со сбросом слева направо
[3 ].
Первичное поражение сердечной мышцы выявляют при ИБС и
некоронарогенных поражениях. При ИБС такое поражение по характеру не является
диффузным и может проявляться некрозом (при остром ИМ), постинфарктными
рубцовыми изменениями, ишемией и гибернацией (см. далее) миокарда. Вместе с тем
для некоронарогенных заболеваний миокарда характерно диффузное поражение
последнего (ДКМП, большинство миокардитов, вторичные кардиомиопатии).
Нарушение наполнения ЛЖ или ПЖ отмечают при укорочении диастолы (тахисистолии),
при наличии механического препятствия его наполнению (перикардит, AV-стеноз,
миксома) и при нарушениях его расслабления в диастолу. Последнее наблюдают при
рестриктивных поражениях миокарда, его ишемии, концентрической гипертрофии (АГ,
ГКМП), аортальный стеноз).
Приведенные патофизиологические факторы снижения насосной
способности сердца нередко сочетаются. Например, при аортальном стенозе или АГ с
ГЛЖ перегрузка последнего давлением сочетается с нарушением его диастолического
наполнения; а при наличии постинфарктного кардиосклероза у пациента с ИБС и
сопутствующей АГ перегрузка давлением и диастолическая дисфункция ЛЖ сочетаются
с первичным поражением миокарда.
При отсутствии радикального этиотропного корригирующего влияния
(преимущественно хирургического при наличии показания) каждый из трех
вышеуказанных главных факторов выступает в роли перманентно действующего
триггера (запускающего фактора) возникновения и дальнейшего развития ХСН.
Ремоделирование ЛЖ — совокупность патологических изменений
величины, массы и формы ЛЖ с соответствующим нарушением его нормального
функционирования. Характерными макропризнаками ремоделированного ЛЖ являются его
гипертрофия, дилатация и деформация (так называемая сферизация) полости.
Объединение последних трех признаков является типичным для
первично-миокардиального поражения и перегрузки объемом. Для ХСН, обусловленной
перегрузкой давлением и/или нарушением диастолического наполнения ЛЖ, выраженная
дилатация последнего не является характерной, за исключением финальной
клинической стадии, когда компенсаторные возможности гипертрофированного ЛЖ
практически исчерпаны.
Главный фундаментальный признак ремоделирования ЛЖ — ГЛЖ. Это
приспособительный феномен, направленный на поддержание способности первично
пораженного или перегруженного миокарда развивать достаточное внутрижелудочковое
давление в систолу путем уменьшения рабочей нагрузки на единицу его массы.
Однако в процессе эволюции гипертрофия миокарда теряет свое приспособительное
значение и становится одним из факторов прогрессирования ХСН. Это объясняется
тем, что, в отличие от физиологической, так называемой рабочей гипертрофии (у
спортсменов, здоровых лиц, занимающихся интенсивной физической работой),
гипертрофия миокарда при его перегрузке или повреждении является биологически
неполноценной. Неполноценность патологической гипертрофии миокарда, в частности,
состоит в том, что при ней:
а) рост массы миофибрилл преобладает над ростом массы митохондрий;
б) увеличение площади мембраны отстает от роста общей массы
кардиомиоцита;
в) рост массы миокарда опережает рост капилляров;
г) происходит интенсивное периваскулярное образование
соединительной ткани (реактивный фиброз);
д) наблюдается трансформация процессов белкового синтеза в сторону
образования изоформ регуляторных и эффекторных протеинов, присущих
эмбриональному периоду (так называемая фетализация миокардиального фенотипа).
В результате указанных изменений развиваются энергодефицит,
перегрузка ионами Са2+ и неполноценное функционирование
гипертрофированных кардиомиоцитов с соответствующим нарушением систолической
и/или диастолической функции ЛЖ. В формировании диастолической несостоятельности
миокарда важная роль также принадлежит фиброзным (очаговым или диффузным)
изменениям ремоделированного ЛЖ.
4. Снижение сердечного выброса обусловливает ряд системных
компенсаторных реакций, направленных на поддержание достаточного перфузионного
давления в сосудистой системе. Последнее обеспечивается «включением»
соответствующих компенсаторных механизмов, которые можно условно
разделить на кардиальные, сосудистые и почечные [3
].
К кардиальным механизмам компенсации кровообращения при ХСН
принадлежат повышение ЧСС, рост инотропной (сократительной) функции миокарда и
его гипертрофия. Сосудистый механизм компенсации представлен системной
периферической вазоконстрикцией, направленной на поддержание необходимого
системного АД. Почечный путь компенсации кровообращения состоит в задержке ионов
Na+ и воды, направленный на увеличение ОЦК, то есть на то же
поддержание системного АД.
5. Изменения со стороны сосудистой системы. При клинически
манифестированной ХСН периферические сосуды (в большей степени артериальные)
находятся в состоянии перманентной констрикции, что обусловлено постоянным
действием существенно повышенных концентраций ангиотензина II, норадреналина,
эндотелина-1, вазопрессина на гладкомышечный слой их стенки. Кроме этого,
ангиотензин II и эндотелин-1 обусловливают гипертрофию последнего. Сужение
просвета сосудов, наряду с гипертрофией их мышечного слоя, которое характерно
также для АГ, получило название «ремоделирование сосудов». Выраженность этого
феномена возрастает с клиническим прогрессированием ХСН.
Характерным для ХСН изменением со стороны сосудов является также
нарушение функции эндотелия. Существенную роль в реализации этого
феномена играет снижение концентрации оксида азота, которое обусловлено,
во-первых, угнетением его синтеза в эндотелиоцитах и, во-вторых — повышением его
биохимической (свободнорадикальной) инактивации. Вследствие снижения
концентрации NO в стенке сосудов в значительной степени уменьшается защитное
действие физиологических концентраций NO в отношении вазоконстрикции,
тромбообразования и активации клеточного звена системного воспаления, играющих
существенную роль в прогрессировании ХСН.
6. У больных ХСН на фоне ИБС нарушения сердечного ритма и
проводимости сердца являются практически постоянными осложнениями. Основной
причиной аритмий считают «электрически нестабильный миокард»: изменение
электрофизиологических свойств миокарда в области поражения; изменение
метаболизма в периинфарктной зоне, потеря электрической стабильности миокарда;
электролитный дисбаланс в миокарде (потеря кардиомиоцитами калия, магния,
повышение уровня калия во внеклеточной среде); гиперкатехоламинемия, развитие
феномена re-entry.
Классификация нарушений ритма и проводимости сердца у больных ИБС и
ХСН (H.Wellens, A.Gorgels, The ECG inacute MI and unstable angina, Boston,
2003):
1. Электрическая нестабильность:
• желудочковые эстрасистолы (80–90%);
• желудочковая тахикардия (15%);
• фибрилляция желудочков (2,5–5%);
• ускоренный идиовентрикулярный ритм.
2. Нарушение насосной функции сердца/чрезмерная симпатическая стимуляция:
• синусовая тахикардия (90%);
• фибрилляция или трепетание предсердий (25%);
• пароксизмальная суправентрикулярная тахикардия.
3. Брадиаритмия и нарушения проводимости:
• синусовая брадикардия (6–9%);
• атриовентрикулярная блокада (12–20%);
• нарушение внутрижелудочковой проводимости.
7. Относительно наличия в анамнезе анемии в качестве предиктора
неблагоприятного исхода ХСН, то данные — противоречивые. Отмечено отрицательное
влияние повышенной концентрации провоспалительных, ровно, как и воспалительных
цитокинов, на транспортную форму железа — трансферрин при ХСН III-IV ФК, что
проявлялось его снижением у пациентов с ХСН и анемичeским
синдромом [2 ].
Классификация ХСН.
Основная терминология, используемая для описания ХСН является
исторической и основана на измерении фракции выброса ЛЖ ( LVEF) . ХСН включает
широкий спектр пациентов. Нормальный.LVEFобычносчитается.≥50%; ХСН с
сохраненной ФВ (HFpEF) с пониженной LVEF . ХСН со сниженной ФВ <40% (HFrEF).
Пациенты с LVEF в диапазоне 40–49% представляют «серую зону», которую мы теперь
определяем как HFmrEF.
Табл. Классификация ХСН по ФВ [1].
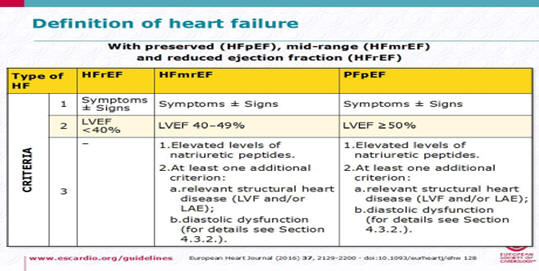
Дифференциация пациентов с ХСН на основе ФВ ЛЖ важна из-за
различий в этиологии, демографии, сопутствующих заболеваниях и реакции на
терапию. В большинстве клинических исследований, опубликованных после 1990
года, были отобраны пациенты на основе LVEF [обычно измеряемые с помощью
эхокардиографии, радионуклидной техники или сердечного магнитного резонанса (CMR)],
и только у пациентов с HFrEF показано, что терапия снижает как заболеваемость,
так и смертность.
Связь между ЧСС в покое и исходами была проанализирована в двух
[10 ] крупных
клинических испытаниях. В исследование было включено 13 562 пациента с ХСН со
сниженной ФВ; с синусовым ритмом (СР) -75%. Полученные данные были
скорректированы с учетом прогностических исходных переменных, включая уровни
NT-proBNP. Интересно, что при всех исходах, среди пациентов с СР сердцебиение
было связано с повышенным риском. Напротив, не было никакой связи между ЧСС и
исходами среди пациентов с ФП. Кроме того, изменения ЧСС от исходного уровня до
12 месяцев, проанализированы у 7756 пациентов с СР. В 64% случаев изменение
составило <10 ударов в 1 минуту, тогда как оно было уменьшено на > 10 ударов в 1
минуту в 16% . ЧСС увеличилось на > 10 ударов в 1 минуту у 20%. Увеличение ЧСС
было связано с повышением риска на все последующие результаты у 20-50%. Это
исследование является еще одним анализом, в котором прогностическая важность ЧСС
у пациентов с HFrEF и при СР подчеркивается даже после корректировки на
натрийуретические пептиды.
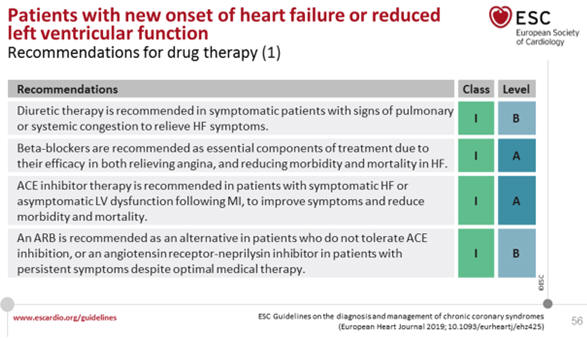
Лечение пациентов с симптомной ХСН со сниженной ФВ
[1 ].
Было показано, что нейрогормональные антагонисты (ИАПФ,
спиронолактон, БАБ ) улучшают выживаемость у пациентов с HFrEF и рекомендуются
для лечения каждого пациента с HFrEF, если нет противопоказаний. Недавно было
показано, что новое соединение (LCZ696), объединяющее фрагменты ингибитора БРА (валсартан)
и неприлизина (NEP) (сакубитрил), превосходит ИАПФ (эналаприл) в снижении риска
смерти и госпитализации по поводу ХСН. в одном испытании со строгими критериями
включения / исключения. Поэтому рекомендуется использовать сакубитрил /
валсартан для замены ИАПФ у амбулаторных пациентов с HFrEF, которые остаются
симптоматическими, несмотря на оптимальную терапию, и которые соответствуют этим
критериям исследования. Доказано, что БРА не снижают смертность у пациентов с
HFrEF, и их применение должно быть ограничено пациентами с непереносимостью ИАПФ
или теми, кто принимает ИАПФ, но не переносит спиронолактон. Ивабрадин снижает
повышенную частоту сердечных сокращений, часто наблюдаемую при HFrEF, а также
улучшает результаты, и его следует учитывать при необходимости. Вышеуказанные
препараты следует применять в сочетании с диуретиками у пациентов с симптомами и
/ или признаками застойных явлений. Использование диуретиков следует
модулировать в соответствии с клиническим статусом пациента.
Табл. Лечение больных ХСН со сниженной ФВ
[1].
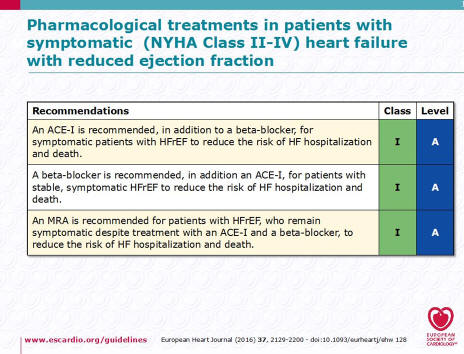
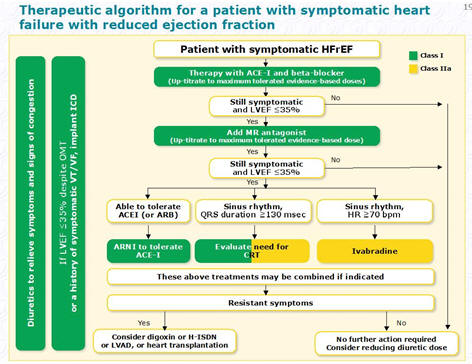
Табл. Основные группы препаратов и их дозы для лечения ХСН
[1].
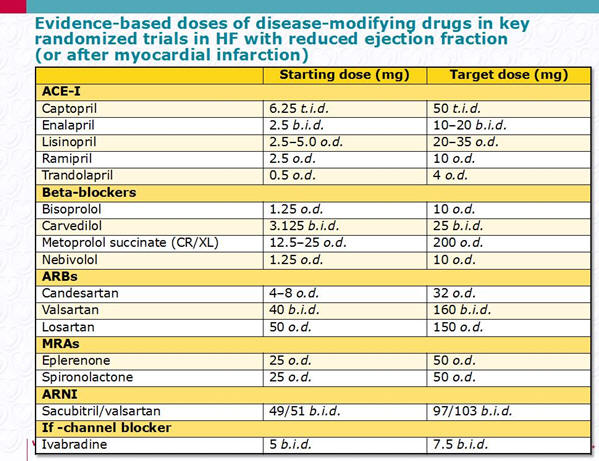
Ивабрадин, в отличие от других препаратов, повышает риск развития
пароксизмальной ФП.
Табл. БАБ рекомендуются для лечения больных с систолической ХСН
[7 ].

Табл. Диуретики, БАБ, ИАПФ/БРА рекомендуются для лечения больных
ХСН со сниженной ФВ [7 ].
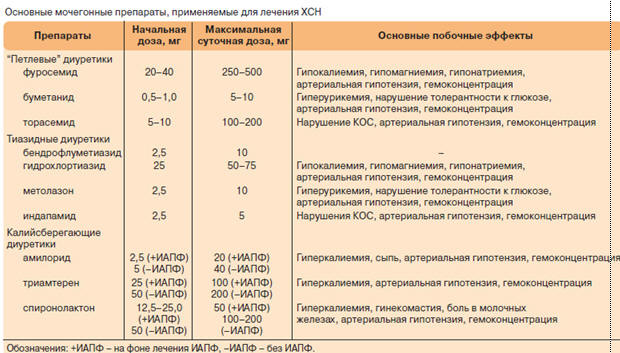
Необходимость назначения диуретиков [8
] больным ХСН с признаками задержки жидкости ни у кого не вызывает
сомнений. Их эффективность доказана многолетним опытом успешного применения.
Диуретики “заведомо” относят к уровню доказательности А, так как проведение
плацебо-контролируемых исследований с ними было бы неэтичным. В результате
применения диуретиков у пациента быстро уменьшается выраженность одышки, отеки,
увеличивается толерантность к физической нагрузке. Диуретики облегчают работу
сердечной мышцы, уменьшая давление наполнения ЛЖ, что ведет к увеличению
сердечного выброса, улучшению перфузии миокарда, а также к уменьшению объемов
камер сердца и степени клапанной регургитации. Мочегонные лекарственные средства
принято классифицировать по механизму действия, скорости наступления и
длительности эффекта, влиянию на кислотно-основное состояние (КОС). В
зависимости от механизма действия диуретики подразделяют на:
- ингибиторы карбоангидразы;
- осмотические диуретики;
- “петлевые” диуретики (усиливающие выведение из организма главным образом
Na+, Cl–);
- тиазиды и тиазидоподобные диуретики (усиливающие выведение из организма
главным образом Na+, К+, Cl–);
- антагонисты минералокортикоидных рецепторов;
- ингибиторы почечных эпителиальных натриевых каналов (непрямые АА,
калийсберегающие рецепторы).
Первые две группы препаратов играют важную роль в лечении
пациентов с неврологической патологией: маннитол успешно используется для
профилактики и лечения отека мозга, в то время как ацетазоламид обладает
противосудорожной активностью. Основные группы мочегонных средств, применяемых в
лечении ХСН, их дозы и наиболее частые побочные эффекты представлены в таблице.
Группа “петлевых” диуретиков получила свое название в связи с их
“точкой приложения” – эти препараты блокируют реабсорбцию ионов Cl–,
а также Na+, К+ в восходящей части петли Генле, вследствие
чего уменьшается реабсорбция воды. Наиболее распространенные представители этого
класса – фуросемид, торасемид и этакриновая кислота. “Петлевые” диуретики по
силе своего мочегонного действия превосходят другие группы мочегонных средств,
поэтому их использование лежит в основе лечения отечного синдрома при ХСН.
Современный взгляд на диуретическую терапию больных ХСН подразумевает две фазы
лечения . На первом этапе, когда пациент находится в состоянии декомпенсации
(т.е. имеется застой большого количества жидкости в организме), проводится
форсированный диурез. В этот период доза “петлевого” диуретика должна
обеспечивать выделение пациентом на 800–1000 мл больше жидкости за сутки, чем он
употребляет (и соответствующее уменьшение массы тела). Второй этап –
поддерживающий, доза диуретика должна обеспечивать стабильную массу тела
больного и умеренный положительный диурез (на 200 мл больше, чем он выпивает).
Блокаторы β-адренергических рецепторов.
Рациональным обоснованием применения БАБ [9] в лечении ХСН является
блокада САС, которая находится в состоянии хронической гиперактивации у больныхс
декомпенсацией и определяет плохой прогноз (высокую смертность) этих пациентов .
Активность САС прогрессивно нарастает параллельно увеличению тяжести ХСН,
причем, начиная со II стадии болезни или со II ФК, преобладающими становятся
негативные дезадаптивные свойства катехоламинов [373–375]. В связи с этим применение БАБ
становится наиболее целесообразным и эффективным у пациентов с клинически
выраженной ХСН II –IV ФК. Доказано, что гиперактивация САС способствует
достоверному увеличению как риска внезапной смерти, так и смерти от
прогрессирования декомпенсации. Поэтому основная идея применения БАБ в лечении
больных ХСН – это улучшение прогноза и снижение смертности. В настоящее время
доказано, что БАБ оказывают блокирующее действие и на некоторые другие нейрогормональные
системы, ответственные за прогрессирование ХСН – РААС, эндотелиновую систему и систему цитокинов. Таким образом, БАБ в лечении ХСН – это не
только средства, блокирующие влияние катехоламинов на β-адренергические
рецепторы (хотя это очень важно), но и комплексные нейрогормональные модуляторы,
оптимально дополняющие эффекты иАПФ.
Негативные последствия гиперактивации САС максимально проявляются в
результате чрезмерной стимуляции β1‑рецепторов, поэтому
применение β1селективных (часто ошибочно используется термин кардиоселективных) БАБ в лечении больных ХСН вполне обосновано и эффективно. Хотя
имеются предположения, что использование БАБ с дополнительными свойствами,
например, β1-, β2-, α1‑блокатора карведилола или
высокоселективного БАБ небиволола, одновременно увеличивающего
синтез оксида азота в эндотелиальных клетках, может быть более
эффективным за счет дополнительных вазодилатирующих свойств . Однако данные
реальной практики этого не подтверждают.
К положительным свойствам БАБ при ХСН относится способность:
• уменьшать дисфункцию и смерть кардиомиоцитов как путем
некроза, так и апоптоза;
• уменьшать число гибернированных (находящихся в «спячке»)
кардиомиоцитов;
• при длительном применении за счет увеличения зон
сокращающегося миокарда улучшать показатели гемодинамики;
• повышать плотность и аффинность β-адренорецепторов,
которые резко снижены у больных ХСН;
• уменьшать гипертрофию миокарда;
• снижать ЧСС, что является «зеркалом» успешного применения
БАБ у больных ХСН. Уменьшение ЧСС минимум на 15 % от исходной величины
характеризует правильное лечение БАБ больных ХСН;
• уменьшать степень ишемии миокарда в покое и особенно при
физической активности;
• несколько уменьшать частоту желудочковых аритмий;
• оказывать антифибрилляторное действие, что снижает риск
внезапной смерти. Таким образом, наряду с улучшением прогноза, БАБ
уменьшают степень ремоделирования сердца, то есть оказывают
кардио-протективное действие, позволяющее замедлять прогрессирование
декомпенсации и снижать число госпитализаций . Главным же негативным свойством в
течение многих лет, препятствующим включению БАБ в число основных препаратов для
лечения ХСН, считался их отрицательный инотропный эффект, который, по мнению
многих кардиологов и терапевтов, был способен стимулировать усугубление
проявлений ХСН. В настоящее время доказана некая двухфазность влияния БАБ на
центральную гемодинамику у больных ХСН .Действительно, в первые 2 недели лечения
этими препаратами сердечный выброс может снижаться (как за счет уменьшения
собственно сократимости, так и в результате снижения ЧСС), а клинические
проявления ХСН даже несколько нарастать. Но затем в результате уменьшения
тахикардии и потребления миокардом кислорода гибернированные кардиомиоциты
восстанавливают свою сократимость и сердечный выброс начинает расти. Причем
некоторые БАБ (карведилол) при длительном применении позволяют добиваться
бoльшего роста ФВ, чем номинальные положительные инотропные агенты (в частности,
сердечные гликозиды) .
Табл. Рекомендации класса
IA больным ХСН со сниженной ФВ.
Девайсы и реваскуляризация
[7].

Больным ХСН с высокой степенью АВ блокады рекомендуется
CRT. Имплантация
кардиовертера-дефибриллятора рекомендуется пациентам с нестабильной
гемодинамикой и документально подтвержденными желудочковыми нарушениями ритма,
как правило пациентам с симптоматической ХСН, ФВ менее 35%, для снижения риска
внезапной смерти и общей смертности. CRT
рекомендуется больным с симптоматической ХСН на фоне синусового ритма с
уширением QRS
более 150 мс и БЛНПГ, ФВ менее 35%, для уменьшения симптомов и смертности.
Симптомная ХСН с сохраненной ФВ.
Диагноз HFpEF остается сложным. LVEF нормален, а признаки и
симптомы ХСН часто неспецифичны и плохо различают сердечную недостаточность и
другие клинические состояния. Диагноз хронической HFpEF, особенно у типичного
пожилого пациента с сопутствующими заболеваниями и без явных признаков
перегрузки объемом является громоздким, и подтвержденный золотой стандарт
отсутствует. Чтобы улучшить специфичность диагностики HFpEF, клинический диагноз
должен быть подкреплен объективными показателями сердечной дисфункции в покое
или во время упражнений. Диагноз HFpEF требует выполнения следующих условий:
первоначальная оценка состоит из клинического диагноза, совместимого с
алгоритмом, представленным выше, и оценки LVEF с помощью эхокардиографии. Предел
50% для диагностики HFpEF является произвольным; пациенты с LVEF между 40 и 49%
часто классифицируются как HFpEF . Мы определяем HFpEF как LVEF ≥50% и считаем
пациентов с LVEF между 40 и 49% серой областью, которая может быть обозначена
как HFmrEF. Клинические признаки и симптомы сходны для пациентов с HFrEF, HFmrEF
и HFpEF. ЭКГ в покое может выявить такие нарушения, как ФП, гипертрофия ЛЖ и
нарушения реполяризации. При нормальной концентрации в плазме BNP <35 пг / мл
и / или NT-proBNP <125 пг / мл диагноз HFpEF, HFmrEF или HFrEF маловероятен.
- Наличие симптомов и / или признаков сердечной недостаточности.
- «Сохраненная» ФВ (определяется как LVEF ≥50% или 40–49% для HFmrEF)
- Повышенные уровни NP (BNP> 35 пг / мл и / или NT-proBNP> 125 пг / мл)
- Объективное свидетельство других функциональных и структурных изменений
сердца, лежащих в основе ХСН.
- В случае неопределенности может потребоваться стресс-тест или инвазивное
измерение повышенного давления наполнения ЛЖ для подтверждения диагноза .
Хотя существует четкое согласие с тем, что для диагностики HFrEF
требуется LVEF <40%, точное определение HFpEF менее ясно. Согласно определению,
для диагностики HFpEF требуется LVEF ≥50%, тогда как считается, что у пациентов
с LVEF от 40 до 49% имеется HFmrEF . Пациенты с HFmrEF обычно включались в
испытания HFpEF. По мере появления новых данных и анализов можно будет дать
рекомендации для каждого фенотипа в отдельности.
В клинической практике и клинических испытаниях, по сравнению с
пациентами с HFrEF, в настоящее время только немного меньше пациентов с HFpEF и
HFmrEF получают диуретики, бета-блокаторы, ИАПФ, БРА. Это может отражать лечение
сопутствующих сердечно-сосудистых заболеваний, таких как гипертензия, ИБС и ФП,
или экстраполяцию результатов испытаний, проведенных для этих состояний, на
лечение больных ХСН со сниженной ФВ.
Патофизиология, лежащая в основе HFpEF и HFmrEF, является
гетерогенной, и они связаны с различными фенотипами, включая различные
сопутствующие сердечно-сосудистые заболевания (например, ФП , артериальная
гипертензия, легочная гипертензия) и не сердечно-сосудистые заболевания [диабет,
хроническая болезнь почек, анемия, дефицит железа, ХОБЛ и ожирение. По
сравнению с пациентами с HFrEF, госпитализации и смерти у пациентов с HFmrEF /
HFpEF с большей вероятностью будут не сердечно-сосудистыми. Поэтому пациентов
следует обследовать на наличие сердечно-сосудистых и не сердечно-сосудистых
сопутствующих заболеваний, которые, если они присутствуют, должны проводиться с
помощью вмешательств, которые, как было показано, улучшают симптомы,
самочувствие или исходы, связанные с этой сопутствующей болезнью, а не
усугубляют ХСН.
До сих пор не было доказано, что лечение снижает заболеваемость или
смертность у пациентов с HFpEF или HFmrEF. Тем не менее, поскольку эти пациенты
часто являются пожилыми людьми с выраженными симптомами и часто имеют низкое
качество жизни важной целью терапии может быть ослабление симптомов
и улучшение самочувствия.
Диуретики обычно улучшают застойные явления, если они присутствуют,
тем самым улучшая симптомы и признаки ХСН. Доказательства того, что диуретики
улучшают симптомы, сходны по всему спектру ФВЛЖ. Доказательств того, что
бета-адреноблокаторы и спиронолактон улучшают симптомы у этих пациентов,
недостаточно. Существуют противоречивые данные об улучшении симптомов у
пациентов, получавших БРА (улучшение было только у кандесартана в классе NYHA) и ИАПФ.
Для пациентов с синусовым ритмом есть некоторые доказательства
того, что небиволол, дигоксин, спиронолактон и кандесартан могут уменьшить
госпитализации по поводу ХСН. Для пациентов с ФП бета-адреноблокаторы не
эффективны, а дигоксин не изучен. Доказательства в поддержку ИАПФ, БРА
неубедительны.
Испытания ИАПФ, БРА, БАБ, спиронолактонa
не смогли снизить смертность у пациентов с HFpEF или HFmrEF. Тем не менее, у
пожилых пациентов с HFrEF, HFpEF или HFmrEF небиволол снижал комбинированную
конечную точку смерти или сердечно-сосудистой госпитализации, без значительного
взаимодействия между эффектом лечения и исходным LVEF.
Табл. Лечение больных ХСН с сохраненной ФВ
[1].

Лечение пациентов с бессимптомной ХСН и сниженной ФВ.
В эту клиническую группу входят больные, у которых по данным
инструментального исследования выявлено уменьшение величины ФВ ЛЖ, но которые не
обращаются к врачу по поводу типичных для ХСН жалоб, не имеют явных объективных
признаков застойной СН и не получают лечения по поводу ХСН
[3 ].
Хотя в разных эпидемиологических исследованиях использовали
различные критерии систолической дисфункции ЛЖ, распространенным ее
ЭХОКГ-критерием является величина ФВ ЛЖ <40%. Распространенность установленной
по данному критерию бессимптомной дисфункции (БСД) ЛЖ в популяции взрослых
колеблется, по данным разных исследований, от 0,9 до 3,4%, что является
сопоставимым с распространенностью клинически выраженной ХСН. Распространенность
БСД ЛЖ значительно выше среди мужчин (в 2–4 раза по сравнению с женщинами),
среди лиц пожилого возраста и у пациентов с ранее установленным диагнозом ИБС
(4–8,5%).
При проспективном наблюдении ежегодно регистрируют появление
клинически выраженной ХСН у 5–20% пациентов с БСД ЛЖ; ежегодно умирают 5,1–10,5%
лиц с БСД ЛЖ. Указанный уровень смертности занимает промежуточное место между
уровнями смертности, регистрирующимися у пациентов, перенесших ИМ с сохраненной
ФВ ЛЖ, и у больных с клинически манифестированной систолической дисфункцией ЛЖ.
Скрининговые исследования уровней циркулирующего МНУП или его
N-концевого фрагмента в определенных когортах пациентов с сердечно-сосудистыми
заболеваниями с повышенным риском развития БСД ЛЖ (после ИМ, с неконтролируемой
АГ, сопутствующим сахарным диабетом и некоторые др.)
представляются целесообразными с точки зрения отбора пациентов для дальнейшего
эхоКГ-исследования.
Учитывая высокую вероятность трансформации БСД ЛЖ в клинически
выраженную СН с ее значительно худшим прогнозом, приоритетной задачей является
назначение пациентам с БСД ЛЖ лечения, способного уменьшить прогрессирование СН
и предотвратить появление клинических симптомов ХСН.
Специально спланированные клинические исследования по данному
вопросу с вовлечением достаточного количества пациентов на сегодня проведены
только для одной группы препаратов, а именно ингибиторов АПФ. В
известном многоцентровом исследовании SAVE (1992), в которое были включены
пациенты с БСД ЛЖ после ИМ, длительный прием каптоприла ассоциировался с
уменьшением количества госпитализаций по поводу клинически выраженной СН на 22%.
Наиболее весомые результаты относительно влияния ингибиторов АПФ на клинический
прогноз пациентов с БСД ЛЖ получены в исследованиях SОLVD Prevention (1992) и
ретроспективном субисследовании Х-SOLVD (2003). В так называемое
профилактическое исследование SОLVD (SОLVD Prevention) включили 4228 пациентов с
БСД ЛЖ, половина из которых получала эналаприл в дозе 10 мг 2 раза в сутки (с
предшествующим клиническим титрованием, начиная с начальной дозы 2,5 мг 2 раза в
сутки), а другая половина — плацебо. Дальнейшее продолжительное (около 4 лет)
наблюдение пациентов продемонстрировало выраженное (на 37%) и достоверное
снижение риска развития СН у пациентов, которые принимали эналаприл, по
сравнению с группой плацебо [3 ].
В ретроспективном субисследовании Х-SOLVD прослежено влияние
применения эналаприла в течение 4 лет на дальнейшую «клиническую судьбу»
пациентов с учетом того, что после окончания исследования SOLVD больные
группы плацебо были переведены на дальнейшее постоянное лечение данным
препаратом. Наблюдение пациентов в течение последующих 8 лет (удалось проследить
судьбу почти всех исследуемых) показало, что выживаемость больных, которые
начали принимать эналаприл еще до появления клинических признаков СН, со
временем начала повышаться по сравнению с больными, принимавшими плацебо, с
соответствующим достоверным различием через 12 лет наблюдения .
Указанная разница достигнута за счет показателя смертности от
сердечно-сосудистых причин, поскольку смертность среди указанных больных от
некардиальной патологии достоверно не отличалась. По расчетным данным (Х-SOLVD)
раннее назначение эналаприла в исследовании SOLVD Prevention привело к росту
средней продолжительности жизни на 9,2 мес.
Таким образом, назначение и постоянное применение ингибиторов АПФ
(с формальных позиций доказательной медицины — именно эналаприла) является
стандартом лечения пациентов с доклинической систолической дисфункцией ЛЖ.
Несмотря на отсутствие специально спланированных соответствующих
исследований, есть основания предполагать, что применение блокаторов
β-адренорецепторов дополнительно к базисной терапии ингибиторами АПФ у пациентов
с БСД ЛЖ будет способствовать дальнейшему улучшению клинического прогноза таких
больных, подобно тому, как это имеет место при комбинировании указанных средств
у больных с клинически манифестированной ХСН. Весомым аргументом в пользу такой
точки зрения являются результаты многоцентрового исследования САРRIСОRN (2001).
Они показали, что включение больным с компенсированной гемодинамикой, но
сниженной ФВ ЛЖ (<40%) в острый период ИМ в стандартную базисную терапию
(включающую ингибитор АПФ), блокатора β-адренорецепторов карведилола и
дальнейший длительный (в среднем 1,3 года) прием последнего ассоциировался с
достоверным снижением общей смертности на 23%, нефатального ИМ — на 41% по
сравнению с группой больных, которые вместо карведилола получали плацебо. В
действующих Европейских рекомендациях по лечению ХСН предусмотрено
комбинирование ингибиторов АПФ и блокаторов β-адренорецепторов как стандартный
подход у пациентов с БСД ЛЖ, перенесших ИМ.
Выводы.
1. Для диагностики типов ХСН используются ЭХОКГ-признаки: дилатация
ЛП, гипертрофия ЛЖ, ФВ.
2. При ЭХОКГ больным ХСН на фоне ФП проводится коррекция ЧСС, или
используется МРТ.
3. Наличие ФП у больных с ХСН со сниженной ФВ (HFrEF )
ассоциируется с наиболее тяжелыми побочными эффектами, такими как ишемический
инсульт.
Литература.
1.2016 ESC Guidelines for the diagnosis and treatment of acute and chronic
heart failure: The Task Force for the diagnosis and treatment of acute and
chronic heart failure of the European Society of Cardiology (ESC). European
Heart Journal, Volume 37, Issue 27, 14 July 2016, Pages 2129–2200.
2. Фазулина К.С. Декомпенсация хронической сердечной недостаточности: от
патогенеза к прогнозу. Кардиоваскул.терапия и проф.,2016,15,стр.78-82.
3. Интернет-ресурс. Руководство по кардиологии. Секция 14. Глава 2. Хроническая
сердечная недостаточность. https://compendium.com.ua/clinical-guidelines/cardiology/section-14/glava-2-hronich
4. Jolanta M. Siller-Matula et al. Heart failure subtypes and thromboembolic
risk in patients with atrial. IJCA-26366; p. 7.
5. Karina V Bunting et al. A Practical Guide to Assess the Reproducibility of
Echocardiographic Measurements. Journal of the American Society of
Echocardiography. 2019. October 22.
6. John G F Cleland, Alexander R Lyon, Theresa McDonagh, John J V McMurray. The
year in cardiology: heart failure. European Heart Journal. 2020. January 6.
7. 2019 ESC Guidelines for the diagnosis and management of chronic coronary
syndromes: The Task Force for the diagnosis and management of chronic coronary
syndromes of the European Society of Cardiology (ESC). European Heart Journal,
Volume 41, Issue 3, 14 January 2020, Pages 407–47.
8. Гендлин Г.Е. Современная диуретическая терапия пациентов с хронической
сердечной недостаточностью. Интернет-ресурс. Киберлинк.
9. Клинические рекомендации ОССН – РКО – РНМОТ. Сердечная недостаточность:
хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика
и лечение. Интернет. DOI: 10.18087 / cardio. 2475.
10. Docherty KF, Shen L. et al. Relationship between heart rate and outcomes in
patients in sinus rhythm or atrial fibrillation with heart failure and reduced
ejection fraction. Eur J Heart Fail. 2019. Dec 17. doi: 10.1002/ejhf.1682.
11. Кириченко А.А., Эбзеева Е.Ю. Хроническая сердечная недостаточность в
практике терапевта: трудно ли ее распознать? Consilium Medicum. 2019; 21 (1):
46–9.
Приложение.