
1.1. ЭТИОЛОГИЯ
На развитие и прогрессирование атеросклероза оказывают влияние многие внешние
и внутренние факторы, называемые факторами риска (ФР). В настоящее время
известно более 30 факторов, действие которых увеличивает риск возникновения
атеросклероза, его осложнений. Все ФР подразделяются на немодифицируемые
(возраст старше 50-60 лет; мужской пол, отягощённая наследственность) и
модифицируемые (дислипидемия, повышенное содержание в крови холестерина,
триглицеридов, атерогенных липопротеинов, снижение концентрации антиатерогенных
ЛВП, артериальная гипертензия (АГ), курение, ожирение, гипергликемия, сахарный
диабет, гиподинамия, нерациональное питание). Концепция ФР атеросклероза имеет
важное значение для понимания патогенеза и проведения профилактики заболевания.
ФР способствуют возникновению и прогрессированию атеросклероза и ассоциируются с
более высоким риском развития болезни. Уменьшение выраженности или ликвидация
модифицируемых ФР сопровождается снижением заболеваемости и частоты осложнений.
В настоящее время доказано, что в состав наиболее значимых ФР атеросклероза
входят: дислипидемия, АГ, курение, ожирение, сахарный диабет.
Повышенное содержание в крови холестерина, триглицеридов, атерогенных
липопротеинов (гиперлипидемии, ГЛП) являются главным фактором риска
атеросклероза, ИМ, хронических форм ИБС, мозгового инсульта, облитерирующего
атеросклероза артерий нижних конечностей. Концентрация в плазме крови общего
холестерина (ХС) и его атерогенных фракций тесно коррелирует с заболеваемостью и
смертностью от ИБС. Самый низкий уровень смертности от ИБС наблюдается при
концентрации общего ХС менее 5,2 ммоль/л. При повышении его концентрации до
5,3-6,5 ммоль/л регистрируется рост смертности среди больных ИБС, которая резко
увеличивается при достижении уровня общего ХС свыше 7,8 ммоль/л.
Содержание общего ХС ниже 5,2 ммоль/л считается оптимальным. Количество
общего ХС 5,3-6,5 ммоль/л принято считать пограничным, 6,6-7,7 ммоль/л -
повышенным, более 7,8 ммоль/л - высоким. В Европе высокий уровень общего ХС
встречается у 25% взрослого населения. Для ЛНП оптимальный уровень составляет
менее 3,4 ммоль/л, пограничный - 3,4-4 ммоль/л). За оптимальную концентрацию
триглицеридов принимают его значения менее 1,7 ммоль/л.
Поэтому знание и изучение нарушений липидного обмена является обязательным
условием эффективной профилактики заболеваний сердечно-сосудистой системы,
определяющих прогноз жизни, трудоспособность, физическую активность людей
пожилого возраста. В плазме крови есть три основных класса липидов: 1)
холестерин (ХС) и его эфиры, 2) триглицериды (ТГ), 3) фосфолипиды (ФЛ).
Наибольшее значение в атерогенезе имеют ХС и ТГ. Основной транспортной формой
липидов являются липопротеины (ЛП), в которых ХС, ТГ, ФЛ связаны с
белками-апопротеинами.
ЛП состоят из центральной части, содержащей нерастворимые в воде липиды, а
также из оболочки, состоящей из апопротеинов, растворимых в воде
неэстерифицированных ХС, ФЛ. Молекулы апопротеинов имеют неполярный гидрофобный
участок, связанный с липидами, полярный гидрофильный участок, расположенный на
поверхности ЛП и обращенный к окружающей липопротеин плазме крови. Гидрофильный
участок апопротеина образует водорастворимые связи с молекулами воды. Такая
структура ЛП определяет их свойство быть частично водо- и жирорастворимыми.
В зависимости от плотности и размеров частиц ЛП различают несколько классов:
1.Хиломикроны (ХМ) почти полностью (на 80-95%) состоят из ТГ. Они
являются основной транспортной формой пищевых ТГ, перенося их из тонкого
кишечника в скелетную мускулатуру, миокард, жировую ткань. В плазме крови ХМ
расщепляются липопротеинлипазами до глицерина, свободных неэстерифицированных
жирных кислот (НЭЖК). Остатки ХМ захватываются гепатоцитами и быстро удаляются
из крови.
2.Липопротеины очень низкой плотности (ЛОНП) - это крупные ЛП, содержащие
около 55% ТГ, 19% ХС, 8% белка (апопротеинов В-100, Е, С-I, С-II). Этот класс ЛП
является главной транспортной формой эндогенных ТГ, синтезируемых в печени. В
крови ЛОНП подвергаются воздействию липопротеинлипазы, происходит расщепление ТГ
на глицерин, НЭЖК, которые используются миокардом, скелетной мускулатурой в
качестве энергетического субстрата. Остатки ЛОНП превращаются в ЛП промежуточной
плотности (ЛПП), которые удаляются печенью из крови. Небольшая часть
трансформируются в ЛП низкой плотности (ЛНП) и удаляются из крови.
3.Липопротеины низкой плотности (ЛНП) являются основной транспортной
формой ХС. Содержат около 6% ТГ, 50% ХС, 22% белка. Примерно 2/3
быстрообменивающегося пула ХС синтезируется в печени, 1/3 поступает с пищей.
Ключевым ферментом, определяющим скорость синтеза эндогенного ХС, является
гидроксил метил-глутарил-КоА-редуктаза (ГМГ-КоА-редуктаза). Дальнейший
метаболизм ЛНП осуществляется следующим образом: происходит захват ЛНП
специфическими рецепторами гепатоцитов, затем частицы поглощаются гепатоцитами,
подвергаются гидролизу с образованием свободного ХС, белка, жирных кислот,
утилизируемых клетками.
Количество внутриклеточного свободного ХС является важнейшим фактором,
регулирующим скорость синтеза специфических ЛНП-рецепторов гепатоцитов, с
помощью которых осуществляется захват частиц ЛНП. При снижении количества
внутриклеточного ХС возрастает активность ГМГ-КоА-редуктазы, скорость синтеза
эндогенного ХС. Одновременно увеличивается синтез ЛНП-рецепторов гепатоцита и
активизируется захват, поглощение ЛНП из кровотока, внутриклеточный катаболизм.
В результате содержание ХС в клетке восстанавливается. Наоборот, при высокой
внутриклеточной концентрации свободного ХС замедляется синтез эндогенного ХС,
ЛНП-рецепторов и уровень внутриклеточного ХС постепенно нормализуется. Описанный
принцип обратной связи между внутриклеточной концентрацией ХС и скоростью
метаболических процессов используется для лечения некоторых нарушений липидного
обмена.
Второй путь катаболизма ЛНП - свободнорадикальное перекисное окисление ЛНП.
Свободные радикалы, образующиеся в процессе обмена веществ, являются
высокоактивными и нестабильными молекулами, которые легко окисляют ЛНП.
Образуются модифицированные (окисленные) ЛНП, которые плохо распознаются В- и
Е-рецепторами гепатоцитов и поэтому не участвуют в нормальном физиологическом
пути катаболизма. Окисленные ЛП захватываются макрофагами, которые
трансформируются в пенистые клетки, входящие в состав атеросклеротических
бляшек.
Модифицированные ЛНП вызывают повреждение сосудистого эндотелия, запуская
целый каскад патологических реакций со стороны сосудистой стенки. В норме
процессы перекисного окисления липидов слабо выражены. Они существенно
усиливаются при различных заболеваниях сердечно-сосудистой системы, являясь
одним из важных этиологических факторов, способствующих возникновению
и прогрессированию заболевания. ЛНП относятся к наиболее атерогенной фракции ЛП.
Увеличение общего содержания ЛНП, особенно модифицированных окисленных ЛП,
ассоциируется с высоким риском возникновения атеросклероза и его осложнений.
4. Липопротеин (a), или ЛП (a), близок по своим
физико-химическим свойствам к ЛНП, отличаясь от них наличием в оболочке
апопротеина. Последний близок по своим свойствам к плазминогену и поэтому может
конкурировать с плазминогеном за места связывания на фибрине, ингибировать
фибринолитическую активность крови. ЛП (a) относятся к числу атерогенных ЛП: их
повышенный уровень в крови почти всегда ассоциируется с развитием атеросклероза
и ИБС, а также с высоким риском тромботических осложнений.
5. Липопротеины высокой плотности (ЛВП) - самые мелкие и плотные
частицы ЛП. Они содержат всего 5% ТГ, 22% ХС и самое большое количество белка
(40%) - апопротеинов А-I, А-II и С и относятся к ЛП, обладающим антиатерогенными
свойствами. Последние определяются участием ЛВП в катаболизме всех остальных ЛП,
поскольку с помощью ЛВП осуществляется обратный транспорт ХС из периферических
органов, в том числе из артериальной стенки, с поверхности хиломикронов и ЛОНП,
макрофагов и гладкомышечных клеток, в печень, где происходят его утилизация и
превращение в желчь. Синтез “зрелых” частиц ЛВП как раз и осуществляется
благодаря присоединению свободного ХС от других ЛП и периферических тканей к
начальным формам ЛВП, имеющим форму дисков. Синтез полноценных сферических ЛВП
происходит при обязательном участии ХМ, ЛОНП, ЛНП. ЛВП в процессе метаболизма
ХМ, ЛОНП, ЛНП присоединяют к себе их апопротеины А и С, оказывающие влияние на
активность многочисленных ферментных систем, участвующих в метаболизме липидов.
Снижение содержания ЛВП, наряду с увеличением ЛНП, сопровождается значительным
увеличением риска формирования атеросклероза. Факторами, способствующими
снижению ЛПВП, являются: принадлежность к мужскому полу, ожирение,
гипертриглицеридемия, высокое потребление углеводов, сахарный диабет, курение.
Большое количество антиатерогенных ЛПВП связывают с принадлежностью к женскому
полу, высоким уровнем эстрогенов, высокой физической активностью, снижением
массы тела, умеренным потреблением алкоголя. Важность повышения АД (более 20%) в
качестве ФР доказана в ряде эпидемиологических исследований экономически
развитых стран. Выявлена тесная связь между уровнем диастолического АД и
частотой развития ИБС и инсульта. Артериальная гипертензия оказывает
существенное влияние на прогрессирование атеросклероза. Риск возникновения
клинических проявлений атеросклероза у больных АГ примерно в 3-4 раза выше, чем
у пациентов без повышения АД. Повышенное АД оказывает повреждающее действие на
эндотелий артериальных сосудов, нарушается функция эндотелия, интима сосудов
пропитывается липидами.
Степень риска, связанного с курением сигарет, сопоставима с риском
гиперлипидемии, АГ. Вероятность развития сердечно-сосудистых заболеваний у
курящих примерно в 2-3 раза выше, чем у некурящих. Значение курения как ФР
выросло в связи с распространением этой вредной привычки у 40-50% населения.
Курение ассоциируется с дисфункцией эндотелия, являющейся пусковым фактором
атеросклероза. При курении увеличивается количество фибриногена, повышается
адгезия тромбоцитов. Это приводит к снижению ЛВП, повышению тонуса сосудов.
Прекращение курения приводит к снижению обострений ИБС на 50% в течение 1 года.
Ожирение относится к числу наиболее значимых, легко модифицируемых ФР.
Является не только независимым ФР болезней сердечно-сосудистой системы (ССС), но
и пусковым механизмом других факторов риска атеросклероза (АГ, гиперлипидемии,
инсулинорезистентности, сахарного диабета). Выявлена прямая зависимость между
уровнем смертности от болезней ССС и массой тела (МТ). Анализ результатов
Фремингемского исследования показал, что на протяжении 26 лет частота
заболеваний ССС в целом, ИБС, ИМ, внезапной сердечной смерти возрастала в
зависимости от величины избыточной МТ как у мужчин, так и у женщин. Даже
у женщин, индекс массы тела (ИМТ) которых не выходил за пределы нормальных
значений (меньше 25 кг/м2) и составил 23–25 кг/м2, риск
возникновения ИБС на 50% выше, чем у пациенток с ИМТ ниже 21 кг/м2.
При увеличении ИМТ до 25-29 кг/м2 относительный риск ИБС возрастал
в 2 раза, а при ИМТ выше 29 кг/м2 - в 3 раза. В США больные с ИМТ
более 30 кг/м2 ежегодно проводят в стационаре на 3 дня дольше, чем
пациенты с ИМТ менее 23 кг/м2, что соответствует 70 миллионам
“лишних” койко-дней в год.
Повышенный риск сердечно-сосудистых заболеваний характерен не только для
ожирения как такового, но и для самого процесса прибавки массы тела. Этот факт
был убедительно продемонстрирован во Фремингемском исследовании, показавшем
высокую степень корреляции величины прибавки массы тела после 25 лет с риском
сердечно-сосудистых заболеваний. Похудание уменьшало степень риска. Во всех
современных эпидемиологических исследованиях, посвященных изучению ФР ИБС
и атеросклероза, подчеркивается тесная связь, существующая между ожирением
и такими ФР как АГ, ГЛП и сахарный диабет. Именно эта взаимосвязь, наряду
с независимым влиянием ожирения как такового, играет главную роль в увеличении
степени риска сердечно-сосудистых заболеваний у лиц, страдающих избыточной
массой тела.
Ожирению сопутствует ряд ГЛП, предрасполагающих к развитию ИБС, включая
гиперхолестеринемию, гипертриглицеридемию, снижение уровня ХС ЛВП, повышение
уровня апопротеина В и мелких плотных частиц ЛНП. Ожирение существенно повышает
риск возникновения сахарного диабета I и II типа. У женщин, прибавивших в весе
после 18 лет всего 5–7,9 кг, риск возникновения сахарного диабета вдвое больше,
чем у женщин со стабильной массой тела. У женщин с прибавкой массы тела 8 кг
и более риск увеличивается в 3 раза. У пациентов среднего возраста, похудевших
по разным причинам более чем на 5 кг, риск возникновения сахарного диабета
уменьшается на 50%.
Ожирение закономерно сопровождается увеличением активности адипоцитов брюшной
полости, которые секретируют свободные жирные кислоты непосредственно в систему
воротной вены, что подавляет поглощение инсулина печенью. В результате
повышается концентрация инсулина в периферическом кровотоке и снижается
чувствительность тканей к инсулину, развивается инсулинорезистентность. Высокие
концентрации свободных жирных кислот повышают содержание ТГ в крови.
В последние годы много внимания уделяется изучению клинической картины
и патогенеза так называемого “метаболического синдрома” (“синдрома Х”), который
очень часто сочетается с ожирением. В основе этого синдрома лежат
инсулинорезистентность, гипертриглицеридемия и АГ. У лиц с метаболическим
синдромом существенно повышен риск возникновения ИМ, внезапной смерти
и сахарного диабета. В связи с этим N.M. Kaplan предложил называть сочетание
таких ФР как ожирение, инсулинорезистентность, ГЛП и АГ “смертельным квартетом”.
Инсулинорезистентность и гиперинсулинемия рассматриваются в настоящее время
в качестве пусковых факторов, инициирующих целый ряд механизмов, приводящих
в конечном счете к развитию на фоне ожирения ГЛП, АГ и ИБС. Ожирение
сопровождается активацией РАС и САС, уменьшением секреторного ответа
натрийуретического пептида, что оказывает влияние на патогенез атеросклероза,
ИБС и АГ.
Сахарный диабет I и II типа сочетается со значительным увеличением
заболеваемости атеросклерозом и тяжестью течения многих его клинических
проявлений, при этом риск развития сердечно-сосудистых заболеваний увеличивается
в 2–4 раза у мужчин и в 3–7 раз у женщин. При сахарном диабете I типа дефицит
инсулина приводит к снижению активности липопротеидлипаз и увеличению синтеза
триглицеридов. Сахарный диабет II типа часто сочетается с гиперлипидемией IV
типа и увеличением синтеза ЛОНП и ЛНП. Особенно неблагоприятным является
сочетание нарушений углеводного обмена с некоторыми другими ФР:
гипертриглицеридемией, АГ, курением и ожирением. По сути сахарный диабет II типа
в большинстве случаев развивается в результате имеющейся у больного
инсулинорезистентности, которая при сочетании с ожирением, АГ и гипертриглицеридемией
ведет к возникновению метаболического синдрома.
Для сахарного диабета характерен процесс гликозилирования ЛП с образованием
модифицированных форм ЛНП, ЛВП. Гликозилированные ЛНП отличаются меньшим
сродством к специфическим В- и Е-рецепторам гепатоцитов, что способствует
уменьшению скорости элиминации ЛП. Гликозилированные ЛНП вызывают повреждение
эндотелия, активируют проникновение моноцитов в интиму артерий, трансформацию
макрофагов в пенистые клетки, пролиферацию гладкомышечных клеток, способствуя
развитию атеросклероза.
Имеется линейная зависимость между заболеваемостью атеросклерозом
и возрастом. Чем больше возраст, тем сильнее выражен атеросклероз и чаще
встречаются тяжелые клинические проявления атеросклероза (ИБС, инфаркт миокарда,
ишемический инсульт). В последние годы в экономически развитых странах
отмечается значительный рост заболеваемости среди сравнительно молодых лиц
(моложе 50 лет). До 55 лет заболеваемость ИБС, церебральным и периферическим
атеросклерозом среди мужчин в 3–4 раза выше, чем среди женщин. В более старшей
возрастной группе (старше 65–70 лет) заболеваемость не зависит от пола. Это
связывают с содержанием у женщин эстрогенов, которые вызывают вазопротективный
эффект, оказывая влияние на липидный обмен. До наступления менопаузы у женщин
наблюдается более высокое содержание ХС ЛВП и более низкая концентрация ХС ЛНП,
при этом риск развития ИБС, инфаркта миокарда и мозгового инсульта примерно
в 8–10 раз меньше, чем у мужчин того же возраста. В менопаузе защитное действие
эстрогенов уменьшается и риск возникновения осложнений атеросклероза
увеличивается. В целом мужчины заболевают атеросклерозом на 10 лет раньше, чем
женщины.
Риск развития атеросклероза существенно повышается у лиц, близкие
родственники которых страдали ИБС, церебральным и периферическим атеросклерозом.
Причем такая наследственная предрасположенность проявляется преимущественно
у пациентов сравнительно молодого и среднего возраста (до 55 лет). В более
старших возрастных группах генетические факторы оказываются, по-видимому, менее
значимыми, уступая место многочисленным приобретенным ФР (АГ, сахарный диабет,
курение, ожирение). Наследственная предрасположенность к сравнительно раннему
возникновению атеросклероза связана с генетически детерминированным повреждением
различных звеньев метаболизма липидов, структуры и функции эндотелия, активности
ферментных систем гладкомышечных клеток, особенностями функционирования
сосудисто-тромбоцитарного и коагуляционного гемостаза. Первичная семейная
комбинированная гиперлипидемия с умеренным повышением ЛНП, ЛОНП и ТГ наблюдается
у больных, перенесших ИМ в возрасте младше 55 лет. Генетически детерминированное
низкое содержание в плазме крови антиатерогенных ЛВП встречается примерно у 25%
больных с ранним развитием ИБС. Учитывая многочисленность этиологических
факторов, оказывающих влияние на различные звенья патогенеза атеросклероза, есть
основания считать, что наследственная предрасположенность к различным нарушениям
обмена, лежащим в основе развития атеросклероза, встречается еще чаще.
Малоподвижный образ жизни является важнейшим фактором формирования целого
ряда заболеваний сердечно-сосудистой системы: АГ, ИБС, атеросклероза. У лиц
с низкой физической активностью наблюдаются неадекватные реакции
сердечно-сосудистой, дыхательной, нервной и других систем на любые внешние
воздействия, в том числе психоэмоциональный стресс: возникает чрезмерная
активация САС, РАС, усиливается выброс в кровяное русло катехоламинов и других
биологически активных веществ, так или иначе оказывающих повреждающее действие
на сосудистую систему, миокард и проводящую систему сердца. Недостаточная
физическая активность закономерно сопровождается развитием ожирения, нарушениями
липидного обмена, склонностью пациентов к спастическим реакциям, повышению АД,
снижению скорости метаболических процессов, что также способствует развитию
атеросклероза. В исследовании MRFIT (2001) показано, что у пациентов со
сниженной физической активностью смертность от ИБС на 27% выше, чем у лиц,
которые регулярно подвергались физическим нагрузкам.
Высококалорийное питание с большим содержанием в пищевом рационе животных
жиров является важнейшим ФР атеросклероза. Такой характер питания способствует
развитию ожирения, нарушениям углеводного и липидного обменов, которые лежат
в основе формирования атеросклероза. При хроническом употреблении в пищу
продуктов с высоким содержанием насыщенных жирных кислот и ХС (преимущественно
животный жир) в гепатоцитах накапливается избыточное количество ХС и по принципу
отрицательной обратной связи в клетке снижается синтез специфических
ЛНП-рецепторов, уменьшается захват и поглощение гепатоцитами атерогенных ЛНП,
циркулирующих в крови. Сравнительно “новым” и окончательно не доказанным ФР
атеросклероза является гипергомоцистеинемия. Тем не менее в ряде исследований (Framingham
Heart Study;
European Concerted Action
Project; Hordaland
Homocysteine Study; COMAC)
показана высокая корреляция между уровнем гомоцистеина в крови и риском развития
атеросклероза, ИБС и ишемической болезни мозга (ИБМ).
Гомоцистеин представляет собой деметилированное производное незаменимой
аминокислоты метионина, поступающего в организм с пищей. Циркулирующий в крови
гомоцистеин подвергается внутриклеточному метаболизму с образованием
цистатионина, который в дальнейшем превращается в цистеин. Нормальный метаболизм
гомоцистеина возможен только с участием ферментов, кофакторами которых являются
витамины В6, В12 и фолиевая кислота. Дефицит этих
витаминов приводит к повышению содержания в крови гомоцистеина. Механизм
атерогенного действия гомоцистеина пока не выяснен. Предполагают, что
в присутствии гомоцистеина протеогликаны клеток сосудистой стенки теряют
способность к поперечной сшивке и формированию нормальной здоровой ткани.
Поврежденные гомоцистеином, они образуют в стенке артерий не волокнистую,
а гранулированную структуру и, склеиваясь друг с другом, образуют своеобразные
крупные “комки” на поверхности которых откладываются атерогенные ЛП. Повышенное
содержание гомоцистеина активирует перекисное окисление липидов и образование
модифицированных ЛНП, повреждающих эндотелий сосудистой стенки, ингибирующих
продукцию эндотелиального вазодилатирующего фактора (NO) и способствующих
пролиферации гладкомышечных клеток и образованию пенистых клеток.
Пределы нормальных значений гомоцистеина в сыворотке крови находятся в
достаточно широком диапазоне, потому что зависят от пола, возраста, этнической
принадлежности. Уровень гомоцистеина увеличивается на протяжении жизни: в
детстве его уровень составляет примерно 5 мкмоль/л, затем
его концентрация постепенно повышается, причем у женщин репродуктивного возраста
уровень гомоцистеина на 20% меньше, чем у мужчин. Оптимальный уровень
гомоцистеина для практически здоровых лиц составляет 8,5-11,0 мкмоль/л.
По степени повышения уровня гомоцистеина выделяют три степени
гипергомоцистеинемии: умеренная степень – 11,1-15,0 мкмоль/л; средняя степень –
15,1-20,0 мкмоль/л; высокая степень – более 20,0 мкмоль/л. ГГЦ может развиваться
вследствие воздействия и взаимодействия целого ряда факторов (рисунок 1).
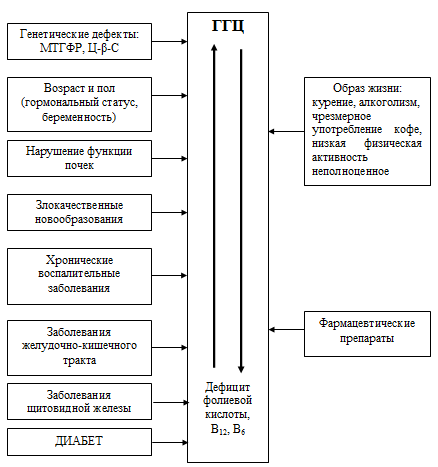
Рисунок 1. Факторы, влияющие на обмен гомоцистеина и развитие
гипер-гомоцистеинемии (Шевченко О.П., 2004).
Результаты исследований последних лет позволили установить, что наличие
гипергомоцистеинемии повышает риск раннего развития атеросклероза, венозных и
артериальных тромбозов независимо от традиционных факторов риска. Риск развития
тромбозов имеет дозозависимый характер и отмечается при значениях гомоцистеина
выше 10 мкмоль/л. Гипергомоцистеинемия относится к прогностическим маркерам
летального исхода при ССЗ. Повышение концентрации гомоцистеина у беременных
свидетельствует об угрозе спонтанного выкидыша и гипотрофии плода.
Исследование, проведенное нами на базе Самарского областного клинического
кардиологического диспансера (СОККД, 2006) и включавшее 87 пациентов, выявило
повышение исходного уровня гомоцитсеина более 11 мкмоль/л у 73,4% пациентов,
страдающих хроническими формами ИБС. Среднее значение гомоцистеина в изучаемой
группе составило 13,0±2,1 мкмоль/л, и достоверно отличалось от уровня
гомоцистеина в контрольной группе (8,7±0,7 мкмоль/л; р = 0,0043).
Умеренная гипергомоцистеинемия приблизительно в 40% случаев обусловлена
генетическими дефектами. Основное клиническое значение имеют полиморфизмы
ферментов, участвующих в метаболизме гомоцистеина – цистатионин-β-синтазы
(Ц-β-С) и метилентетрагидрофолат редуктазы (МТГФР). Дефект гена Ц-β-С приводит к
тяжелой форме гипергомоцистеинемии, но встречается довольно редко. Полиморфизм
гена МТГФР сопровождается развитием умеренной гипергомоцистеинемии и
встречается, по разным данным, у 10-25% лиц здоровой популяции. В настоящее
время описано около двадцати полиморфизмов в гене МТГФР, но наиболее часто
встречаемой и хорошо изученной является мутация С667Т. В результате проведенных
исследований изучена активность фермента, которая снижается до 30% от
нормального уровня при гомозиготном носительстве, и до 65% – при гетерозиготном.
Исследования последних лет показали, что при гомозиготной мутации С677Т гена
МТГФР наблюдается стойкая умеренная гипергомоцистеинемия, обуславливающая
высокий риск развития ССЗ, склонность к тромбообразованию, а также нарушения
функции нервной системы и развитие психических отклонений. Однако измерение
плазменного уровня гомоцистеина при гомозиготном состоянии 677ТТ гена МТГФР
является обязательным, поскольку именно гипергомоцистеинемия, а не сам
полиморфизм рассматривается как независимый фактор риска тромбоза.
Другой причиной развития гипергомоцистеинемии является нарушение функции
почек, которые играют важную роль и в метаболизме и выведении гомоцистеина. У
пациентов, находящихся на гемодиализе, отмечается сопутствующая
гипергомоцистеинемия, сопровождающаяся высоким риском развития атеросклероза, а
вероятность инфаркта миокарда и других проявлений острого коронарного синдрома у
таких пациентов в 5-10 раз выше, чем в общей популяции.
Гипергомоцистеинемия отмечается при заболеваниях, сопровождающихся нарушением
всасывания или повышенным потреблением фолиевой кислоты и витаминов В6
и В12 (воспалительные заболевания кишечника, злокачественные
опухоли). Развитию гипергомоцистеинемии способствует ряд фармацевтических
препаратов (метотрексат, метилпреднизолон, эстрогенсодержащие контрацептивы,
противосудорожные препараты, фибраты, холестирамин, колистепол, метформин).
Существенное влияние на уровень гомоцистеина в крови оказывают чрезмерное
потребление кофе, психоэмоциональные нагрузки, малоподвижный образ жизни,
неправильное питание. Курение – один из наиболее сильных факторов, влияющих на
уровень гомоцистеина. Каждая выкуренная за день сигарета увеличивает уровень
гомоцистеина на 1% у женщин и на 0,5% у мужчин. У женщин, выкуривающих 20 и
более сигарет в день, уровень гомоцистеина выше, чем у некурящих, на 18%.
Умеренное употребление алкоголя способствует некоторому снижению уровня
гомоцистеина, но у лиц, страдающих хроническим алкоголизмом, содержание
гомоцистеина в плазме крови повышено почти вдвое. Нерациональное питание и
недоедание за счет снижения содержания в рационе овощей и свежих фруктов
приводят к дефициту витаминов и к повышению уровня гомоцистеина. При строгой
вегетарианской диете может развиться алиментарный дефицит витамина В12,
потому что его источником является исключительно животная пища.
В последние годы в литературе широко обсуждается вопрос о роли воспаления
в формировании неосложненной и осложненной атеросклеротической бляшки.
К настоящему времени получено много доказательств наличия такого воспаления
в очаге атеросклеротического поражения: присутствие в нем большого количества
макрофагов, активированных Т-лимфоцитов, тучных клеток, тромбоцитов. Продукция
этими клетками различных цитокинов (в первую очередь, фактора некроза опухолей
α, интерлейкинов), действительно, может способствовать повреждению сосудистого
эндотелия и “пропитыванию” интимы модифицированными атерогенными ЛП. Известные
маркеры воспаления, в том числе повышенный уровень СR-протеина, скорее указывают
не на наличие атеросклеротического поражения сосудистой стенки, а на
нестабильность атеросклеротической бляшки, которая лежит в основе формирования
так называемого острого коронарного синдрома - нестабильной стенокардии
и острого ИМ. В последние годы определенное значение в генезе
атеросклеротических поражений придается цитомегаловирусной и хламидийной
инфекции, широко распространенной среди взрослого населения. Антигены этих
возбудителей нередко обнаруживают в атеросклеротических бляшках, а высокие титры
антител определяются у значительной части больных ИБС. Имеются данные о том, что
хламидийная инфекция ассоциируется с большим риском смертельных и несмертельных
обострений ИБС. Предполагают, что присутствие хламидий в сосудистой стенке
способствует окислению (модификации) ЛНП, что сопровождается повреждением
эндотелия и образованием пенистых клеток, участвующих в формировании
атеросклеротической бляшки. Тем не менее вопрос о правомочности отнесения
цитомегаловирусной и хламидийной инфекции к числу ФР атеросклероза и ИБС требует
дальнейших исследований и более убедительных доказательств. |