Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Глава 5. ПАТОФИЗИОЛОГИЧЕСКИЕ И МОРФОЛОГИЧЕСКИЕ АСПЕКТЫ
ОТДАЛЕННОГО ПЕРИОДА БОЕВОЙ ЧМТ И ПОСЛЕДСТВИЙ ХРОНИЧЕСКОГО ПСИХОЭМОЦИОНАЛЬНОГО
СТРЕССА
В предыдущей главе были показаны как клиническое сходство, так и различия
между двумя составляющими отдаленных последствий боевой ЧМТ, полученной в
условиях современных вооруженных конфликтов – последствиями физической травмы
головного мозга и травмы психологической, составляющей основу боевого ХПЭС,
который затем выливается в клинические проявления ПТСР. Совершенно закономерно
при этом возник вопрос о возможном сходстве и различиях патофизиологических
механизмов формирования как последствий ЧМТ, так и последствий хронического
боевого стресса. Также вследствие того, что на основании определенной близости
клинических проявлений последствий ЧМТ и ХПЭС боевой обстановки было высказано
предположение о возможной трансформации исключительно функциональных
расстройств, характерных для последствий ХПЭС, в церебральные органические,
возникла необходимость подтверждения указанного предположения с помощью
нейрофизиологических и нейроморфологических исследований.
В настоящей главе как раз и рассматриваются проблемы сходства и различий
некоторых патофизиологических и патоморфологических аспектов отдаленного периода
боевой ЧМТ и последствий боевого ХПЭС. Результаты получены в процессе
сравнительного изучения трех категорий пациентов, представленных в предыдущей
главе: а) с последствиями боевой ЧМТ, полученной в условиях боевого ХПЭС; б) с
последствиями только боевого ХПЭС, не сопровождавшегося ЧМТ; в) с последствиями
бытовой ЧМТ. Отдельно рассматриваются изменения биоэлектрической активности
головного мозга, особенности мозгового кровотока и патоморфологических,
нейровизуализационных изменений головного мозга. В представленных исследованиях,
как уже указывалось выше, не участвовали больные, страдавшие выраженными
клиническими формами хронической алкогольной зависимости и наркоманиями, что
позволило нам уже на этапе планирования исследований исключить вероятность
влияния наркологических аспектов проблемы на патофизиологические и
патоморфологические механизмы формирования отдаленных последствий боевой ЧМТ и
ХПЭС. Также в данной главе не представлены в деталях особенности формирования
вторичной по отношению к боевой травме сердечно-сосудистой патологии. Как
проблемы посттравматической хронической алкогольной зависимости, так и проблемы
развития вторичной по отношению к травме сердечно-сосудистой патологии, раннего
атеросклероза представлены в отдельных главах.
5.1. Характеристика изменений биоэлектрической активности
Всем больным проведено ЭЭГ исследование не менее трех раз: при первом
обращении в Свердловский областной клинический психоневрологический госпиталь
для ветеранов войн, т.е. через 1 - 7 лет после ЧМТ или перенесенного ХПЭС, затем
через 4 - 15 лет и через 10 и более лет после травматического или стрессового
воздействия (таблица 5.1). В процессе интерпретации результатов исследований мы
старались придерживаться известных классификаций.
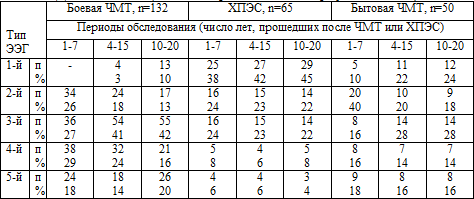
Таблица 5.1. Динамика ЭЭГ ( по классификации Е.А.
Жирмунской, 1993)
Примечание:
1-й тип ЭЭГ- организованный во времени и пространстве
2-й тип ЭЭГ- гиперсинхронный, моноритмичный
3-й тип ЭЭГ- десинхронный
4-й тип ЭЭГ- дезорганизованный с преобладанием альфа-активности
5-й тип ЭЭГ- дезорганизованный с преобладанием тета - дельта- активности
Организованный, 1-й тип ЭЭГ достоверно чаще (р<0,05) во все периоды времени
диагностирован у больных с последствиями ХПЭС, однако и у них при последнем,
3-м, исследовании он регистрировался всего в 45%. В динамике не произошло
достоверного увеличения нормально организованных ритмов на ЭЭГ у больных как с
боевой, так и с бытовой ЧМТ.
Частота представленности гиперсинхронного, 2-го типа ЭЭГ достоверно (р<0,05)
уменьшилась в течение отдаленного периода ЧМТ у больных с боевой и бытовой
травмой в анамнезе, у больных же с последствиями ХПЭС - без существенных
различий в динамике. Это в определенной степени подтверждает клиническую
стабильность ваготонических сдвигов в течение многих лет после перенесенного
ХПЭС, так как гиперсинхронный тип ЭЭГ в вегетологии коррелирует с ваготонией (Зенков
Л. Р., Ронкин М.А., 1991).
В отдаленном же периоде ЧМТ, независимо от условий получения травмы (боевая,
бытовая) достоверно увеличилась представленность десинхронного, 3-го типа ЭЭГ,
что может быть связано с нарастающим преобладанием симпатикотонии, развитием
вторичных сосудистых церебральных расстройств, а также субдепрессии и депрессии.
Это согласуется с литературными данными, тенденция к преобладанию десинхронного
типа ЭЭГ в отдаленном периоде ЧМТ отмечена, например, Е.М. Бурцевым, А.С.
Бобровым (1986), М.А. Шерманом (1995, 2004), К.М. Суркиным (1997).
Дезорганизованные, 4-й и 5-й типы ЭЭГ достоверно чаще (р<0,05) во все периоды
времени и без определенной динамики регистрировались у больных с последствиями
боевой и бытовой ЧМТ, чем у больных с последствиями ХПЭС, что связано с более
грубыми нарушениями таламо–кортикальных и корково-подкорковых взаимодействий
после физической травмы.
Необходимо отметить, что у больных с ЧМТ в анамнезе (как боевой, так и
бытовой) уже при втором исследовании произошло статистически достоверное (р<0,05)
уменьшение представленности 2-го типа ЭЭГ (синхронного, моноритмичного) по
сравнению с первичным исследованием. Сохранилось также статистически достоверное
(р<0,05) преобладание дезорганизованных, 4-го и 5-го типов ЭЭГ у больных с ЧМТ
по сравнению с больными с исключительно последствиями ХПЭС. В целом картина ЭЭГ
в динамике позволяет предположить наличие нарушений как в коре головного мозга,
так и в диэнцефально-стволовых структурах.
При анализе вариантов пароксизмальной активности, которая была отмечена у
всех наблюдавшихся нами пациентов, были выделены 5 вариантов ЭЭГ. Убедительной
динамики ЭЭГ, проведенной у каждого больного не менее трех раз в течение
отдаленного периода травматического повреждения мозга или ХПЭС, не отмечено ни в
одной из групп наблюдавшихся больных (р>0,05). Полученные данные последнего ЭЭГ
обследования представлены в таблице 5.2.
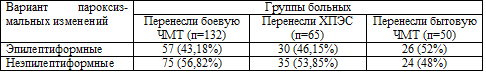
Таблица 5.2. Варианты пароксизмальных изменений на ЭЭГ
|
Варианты изменений ЭЭГ |
После боевой ЧМТ (n=132) |
После ХПЭС (n=65) |
После бытовой ЧМТ (n=50) |
| Диффузная эпилептиформная
активность с явлениями
билатеральной синхронии |
39 (29,6%)
|
17 (26,2%) |
15 (30%) |
| Диффузная эпилептиформная
активность без явлений
билатеральной синхронии |
9 (6,8%)
|
11 (16,9%) |
4 (8%) |
| Очаговые эпилептиформные
изменения |
9 (6,8%) |
2 (3,1%) |
7 (14%) |
| Диффузные пароксизмальные неэпилептиформные изменения |
53 (41,7%) |
31 (47,7%) |
20 (40%) |
| Очаговые пароксизмальные неэпилептиформные изменения |
22 (16,7%) |
4 (6,2%) |
4 (8%) |
Наиболее часто у больных всех групп регистрировались диффузные
неэпилептиформные пароксизмальные изменения, что отражает неспецифичность метода
исследования и одинаковый ответ биоэлектрической активности мозга на разные
повреждающие факторы. Диффузная эпилептическая активность без явлений
билатеральной синхронии достоверно чаще (р<0,05) регистрировалась у больных,
перенесших только ХПЭС, что связано с меньшей травматизацией неспецифических
регулирующих систем мозга у больных этой группы, нежели у больных с
последствиями боевой и бытовой ЧМТ. Фокальные же изменения как эпилептического,
так и неэпилептического характера достоверно чаще (р<0,05) регистрировались у
больных с последствиями боевой ЧМТ, что, по всей вероятности, связано с
механизмом данной травмы и отражает корковые нарушения.
Обращает на себя внимание приблизительно одинаковое соотношение больных с
эпилептиформными и неэпилептиформными пароксизмальными изменениями на ЭЭГ во
всех группах (таблица 5.3).
Таблица 5.3. Сгруппированные варианты пароксизмальных
изменений на ЭЭГ
Одинаково часто встречалась диффузная эпилептиформная активность в сочетании
с билатерально синхронными вспышками высокоамплитудных тета-колебаний, а также
комплексами пик-медленная волна; можно предположить, что как ЧМТ, так и ХПЭС
могут вызывать аналогичные патологические сдвиги в биоэлектрической активности
головного мозга. Но если возникшие в результате ЧМТ наиболее выраженные,
эпилептического типа изменения на ЭЭГ сопутствуют клиническим проявлениям
эпилептического синдрома, посттравматической эпилепсии, то при аналогичных
вариантах ЭЭГ у лиц, перенесших ХПЭС, клиники эпилепсии не наблюдается, хотя,
возможно, предрасположенность к возникновению эпилептических пароксизмов уже
существует.
Проведено сопоставление варианта изменений на ЭЭГ с клиническим вариантом
развития неврологической патологии в результате ЧМТ или ХПЭС. При этом
учитывались также как характер «фоновой» ЭЭГ, так и варианты пароксизмальных
изменений (таблицы 5.4 и 5.5).
Таблица 5.4. Тип «фоновой» ЭЭГ (по Е.А. Жирмунской, 1993) в
зависимости от ведущего неврологического синдрома
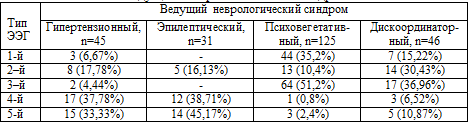
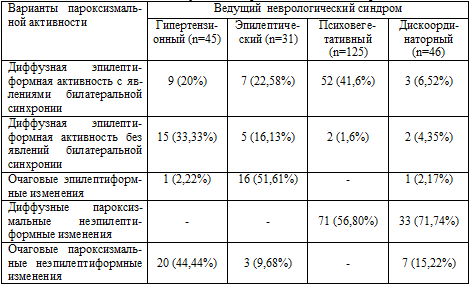
Таблица 5.5. Распределение вариантов пароксизмальной
активности в зависимости от ведущего неврологического синдрома.
Организованный, 1-й тип ЭЭГ достоверно чаще (р<0,05) регистрировался у
больных с психовегетативным синдромом (35,2%). Десинхронный, 3-й тип ЭЭГ также
достоверно чаще регистрировался у пациентов с психовегетативным (51,2%) и
дискоординаторным (36,96%) синдромами, что может быть связано со страданием
каудальных отделов ствола. Гиперсинхронный, 2-й вариант ЭЭГ также достоверно
чаще (30,43%) регистрировался у больных с дискоординаторным синдромом (вероятно,
за счет дисбаланса в деятельности лимбико-ретикулярного комплекса – по данным
Л.Р Зенкова, 1996). Дезорганизованные, 4-й и 5-й типы ЭЭГ преобладали у больных
с гипертензионным и эпилептическим синдромами, что, возможно, связано с более
глубоким поражением лимбико-ретикулярного комплекса, нарушением межполушарных и
проекционных связей.
При рассмотрении вариантов пароксизмальной активности оказалось, что для
больных с психовегетативным синдромом наиболее характерной (р<0,05) являлась
диффузная неэпилептиформная пароксизмальная активность (56,8%), а уже затем -
диффузная эпилептиформная активность в сочетании с билатеральной синхронией
(41,8%). Вероятно, вовлечение ствола мозга и появление в связи с этим
бисинхронной пароксизмальной активности обусловлено тем, что психовегетативный
синдром «трансформировался» в течение длительного периода травматического
страдания мозга из гипертензионно-гидроцефального синдрома, но патология
срединных структур мозга остается при этом достаточно выраженной, что
проявляется пароксизмальной билатеральной синхронией.
Диффузная эпилептиформная активность без явлений билатеральной синхронии и
фокальные, локализованные пароксизмальные изменения на ЭЭГ неэпилептиформного
характера (соответственно в 33,3% и 44,4%) достоверно чаще регистрировались у
больных с гипертензионным синдромом, что, возможно, связано с характером и
механизмом травмы. Очаговые же эпилептиформные изменения, регистрировавшиеся,
как правило, в височных областях мозга, чаще (р<0,05) отмечались у больных с
эпилептическим синдромом, посттравматической эпилепсией (51,5%).
Приведем пример.
Больной Б., 1967 г. рожд. Наблюдается с 1991 г. с диагнозом: последствия ЧМТ
в виде компенсированного гипертензионного синдрома, церебрастенического
синдрома; височная эпилепсия с абсансоподобными эпилептическими припадками,
эпизодами «дежа вю». В 1985-1987 гг. проходил срочную военную службу в
Афганистане, где в 1986 г. в результате взрыва мины получил легкую контузию
головного мозга, лечился в госпитале в течение месяца. В 1987 г. – повторная
боевая травма - касательное осколочное ранение в область левого глаза, без
потери сознания. В этом же году перенес гепатит и малярию.
В течение первых двух лет после ЧМТ беспокоили частые головные боли, с
эпизодами их усиления по типу ликвородинамических кризов до 7 раз в месяц. Затем
частота приступов головных болей уменьшилась до 1-2 раз в месяц, уменьшилась и
их интенсивность. Кошмарные, стереотипные ночные сновидения, в основном
отражающие боевую обстановку, беспокоили сразу после демобилизации, но
максимальную выраженность приобрели через 5-6 лет после возвращения к мирной
жизни. В этот же период, через 5-6 лет после получения ЧМТ, впервые отметил, что
возникают эпизоды «уже виденного», состояния, при которых больной «застывает» в
любой позе, а также стереотипные состояния деперсонализации, во время которых
больному кажется, что «зверь живет внутри меня». Частота всех вариантов
пароксизмов – до нескольких в месяц.
Об-но: следы ранения в области левой орбиты. Сглажена правая носогубная
складка. Легко выраженный акцент сухожильных рефлексов справа. Горизонтальный
мелкоразмашистый с элементами ротаторного нистагм при отведении глазных яблок в
обе стороны, «мраморность» окраски кожи дистальных отделов голеней, стоп. В
беседе обстоятелен, склонен к излишней детализации, быстро истощается.
Психологическое исследование по методике И.О. Котенева (1998) выявило вторичные
признаки ПТСР (положительные ответы на 6 вопросов из 10), опросник Басса-Дарки –
наличие вербальной агрессии, подозрительности, угрызений совести, чувства вины.
Опросник Спилбергера выявил умеренное повышение уровня ситуационной и личностной
тревожности - на 42% по обеим шкалам.
МРТ головного мозга: признаки легко выраженной открытой наружно-внутреней
гидроцефалии.
ЭЭГ: а) через 5 лет после ЧМТ (рис. 5.1): гиперсинхронный тип кривой,
пароксизмальная активность эпилептиформного типа в области левого виска; б)
через 13 лет после ЧМТ (рис. 5.2): десинхронизированный вариант записи, очаговые
эпилептиформные изменения слева в височной област.
После неоднократно проведенного лечения, включавшего курсы медикаментозной,
семейной и индивидуальной психотерапии, при назначении постоянного приема
противоэпилептических препаратов наступало улучшение: прекращались головные
боли, уменьшалась частота эпилептических припадков до единичных в месяц. Но
через 2-3 мес. на фоне нерегулярного приема противоэпилептической терапии
возобновлялись головные боли с частотой приступов до 2-3 в месяц, учащались
эпилептические припадки до 6-7 раз в месяц.
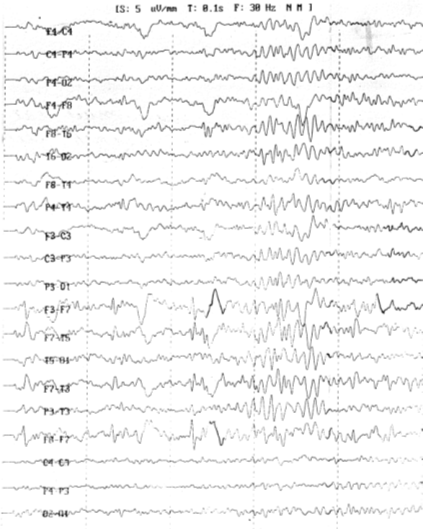
Рис. 5.1. ЭЭГ больного Б., 1967 г.рожд., записанная через 5
лет после ЧМТ: гиперсинхронный тип кривой, пароксизмальная активность
эпилептиформного типа в области левого виска.
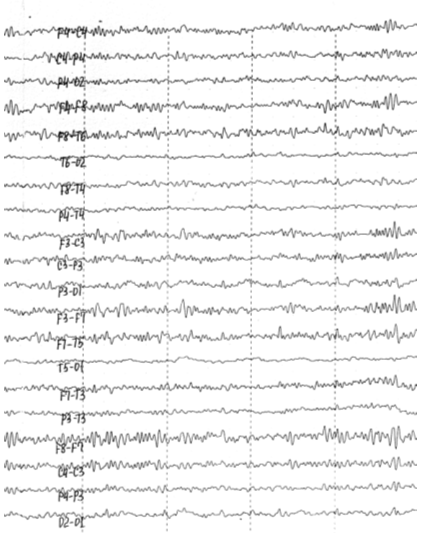
Рис. 5.2. ЭЭГ больного Б., 1967 г. рожд., записанная через
13 лет после ЧМТ: десинхронизированный вариант записи, очаговые эпилептиформные
изменения слева в височной области.
Таким образом, у больного, перенесшего легкую контузию головного мозга в
условиях ХПЭС, полиморфные височные пароксизмы дебютировали через 6 лет после
получения ЧМТ. Их частота и характер в течение отдаленного периода ЧМТ не
изменились. ЭЭГ выявляет признаки поражения срединных и корковых структур мозга.
В динамике отдаленного периода, через 13 лет после получения ЧМТ, происходит
транформация гиперсинхронного, 2-го типа ЭЭГ в десинхронный, 3-й при наличии
фокальных, локализованных в височных отделах изменений биоэлектрической
активности эпилептиформного характера.
В целом, таким образом, в динамике отдаленного периода боевой ЧМТ и ХПЭС
происходит достоверное увеличение представленности десинхронного, 3-го типа ЭЭГ,
при этом у больных с последствиями боевой ЧМТ выявленные изменения происходят
отчетливо быстрей (р<0,05), нежели у лиц, перенесших только ХПЭС. Фокальные
пароксизмальные изменения эпилептиформного и неэпилептиформного характера также
отчетливо (р<0,05) преобладают у больных с последствиями боевой ЧМТ, нежели
среди перенесших только ХПЭС. Одинаковое соотношение эпилептиформных и
неэпилептиформных пароксизмальных изменений на ЭЭГ у больных с разными
повреждающими факторами (боевая ЧМТ и ХПЭС) свидетельствует о
предрасположенности больных с последствиями ХПЭС к возникновению эпилепсии.
Имеется определенная зависимость вариантов изменений на ЭЭГ от характера
клинических проявлений. Дезорганизованные, 4-й и 5-й типы ЭЭГ наиболее
характерны для больных с гипертензионным и эпилептическим синдромами,
десинхронный, 3-й тип – для больных с психовегетативным и дискоординаторным
синдромами, гиперсинхронный, 2-й тип – для больных с дискоординаторным
синдромом, и организованный, 1-й тип ЭЭГ характерен для больных с
психовегетативным синдромом.
5.2. Сравнительные результаты ультразвуковых и реографических исследований
В данном разделе мы сочли возможным объединить результаты исследования
мозгового кровотока реографическим и ультразвуковым (допплеросонографическим)
методами и данные, полученные при проведении эхоэнцефалоскопии (ЭхоЭС), так как
три этих метода могут давать определенное представление о состоянии
внутричерепного давления и его составляющих..
По данным проведенной ЭхоЭС, в отдаленных периодах боевой и бытовой ЧМТ, а
также полученного боевого ХПЭС случаев смещения М-Эхо не отмечалось. Усредненный
показатель ширины 3-го желудочка для всех трех исследуемых групп больных
составил 6,2±0,13 мм при диапазоне индивидуальных колебаний от 5,0 до 8,0 мм. В
то же время у больных, перенесших тот или иной вариант ЧМТ, ширина 3-го
желудочка достоверно (р<0,05) больше, чем у больных, перенесших только боевой
стресс, но не переносивших физической травмы мозга. Средний показатель ширины
3-го желудочка среди больных с последствиями боевой травмы равен 6,91±0,15 мм, с
последствиями бытовой ЧМТ - 6,76±0,22 мм, с последствиями исключительно боевого
ХПЭС, но при отсутствии факта получения травмы мозга - 6,11±0,12 мм. У 46
(36,8%) больных с последствиями боевой ЧМТ, у 14 (28%) с последствиями бытовой
ЧМТ, а также у 5 (9,43%) больных с последствиями боевого ХПЭС выявлена умеренная
пульсация Эхо-сигнала, что также может свидетельствовать о ликворно-сосудистых
нарушениях.
Таким образом, для больных с последствиями боевой и бытовой ЧМТ характерно
увеличение ширины 3-го желудочка, по сравнению с больными, перенесшими только
ХПЭС (р<0,05). Выявление умеренной пульсации Эхо-сигнала, косвенно
свидетельствующей о наличии сосудистой патологии головного мозга, также
преобладает (р<0,05) у больных с последствиями ЧМТ, нежели перенесших только
ХПЭС. Все это может указывать на преобладание ликворно-сосудистых расстройств у
пациентов с последствиями ЧМТ по сравнению с больными, имеющими только
последствия ХПЭС. В то же время, как свидетельствуют полученные результаты, ХПЭС,
сопутствующий боевой ЧМТ увеличивает вероятность данных нарушений.
Сравнительные показатели реоэнцефалографии (РЭГ) у больных с последствиями
ЧМТ и ХПЭС представлены в таблице 5.6.
Согласно полученным данным, у пациентов, перенесших ЧМТ, преобладают признаки
повышения периферического сосудистого сопротивления (ПСС) и нарушения венозного
оттока, что можно объяснить снижением эластичности сосудистой стенки, а
возможно, формированием начальных стадий атеросклеротического процесса.
Преобладание в этой же группе больных с нарушениями венозного оттока косвенно
свидетельствует о проявлениях внутричерепной гипертензии, связанной с
перенесенной ЧМТ.
Таблица 5.6. Сравнительные показатели РЭГ

Примечания:
ПК - пульсовое кровенаполнение
ВО - венозный отток
ПСС - периферическое сосудистое сопротивление
РИ - реографический систолический индекс
-- - умеренное снижение показателей ПК, ВО и РИ
--- - значительное снижение показателей ПК, ВО и РИ
N - усредненные нормальные показатели
++ - умеренное повышение ПСС
+++ - значительное повышение ПСС
Мы отдаем себе отчет в определенной рутинности метода РЭГ, хотя некоторые
исследователи, и не без оснований, не согласны с этим и с успехом используют
данную методику, в том числе и в клинической практике (Шестаков В.В., 2002).
Полученные нами данные, не претендуя на истину в последней инстанции, тем не
менее отчетливо свидетельствуют о различиях в состоянии церебрального кровотока
у больных, представляющих разные группы. В следующих главах, посвященных
развитию сердечно-сосудистой, в том числе цереброваскулярной, патологии у
больных с последствиями боевой ЧМТ, будут более подробно представлены данные
исследований мозгового кровообращения с помощью транскраниальной ультразвуковой
допплерографии (УЗДГ). В данном же разделе приводятся сведения о результатах
УЗДГ исследований, проведенных 28 больным с последствиями боевой ЧМТ. Основные
зарегистрированные усредненные показатели кровотока в сосудах головного мозга
следующие: линейная скорость кровотока (ЛСКm) = 43± см/сек; пульсационный индекс
(ПИm) = 0,83± ; индекс вазомоторной реактивности (ИВМРm) = 49± ; коэффициенты
реактивности сосудистой стенки - КР+m = 1,29± ; КР-m = 0,39± .
Таким образом, показатели скорости мозгового кровотока и пульсационного
индекса соответствовали нормальным возрастным величинам (Гайдар Б.В. с соавт.,
1994). Но показатели реактивности сосудов оказались значительно сниженными по
сравнению с возрастной нормой (р<0.05), что указывает на нарушение
нейрогуморальных механизмов регуляции кровообращения у больных, перенесших ЧМТ.
Данное предположение находит свое подтверждение и при определении показателей
биологического возраста (БВ).
Биологический возраст (БВ), определенный у 28 больных с последствиями боевой
ЧМТ по методике А.А. Токаря с соавт. (1990), отличался от должного БВ на 33,11%
(средний календарный возраст = 35,5±0,43 лет, полученный при исследовании =
51,37±2,77 лет). Подобное совпадение в очередной раз может подтверждать
предположение о раннем развитии сосудистой, в том числе церебральной, патологии
у лиц, перенесших боевую травму мозга (Бурцев Е.М., Бобров А.С., 1986; Нестерова
М.В., 1992; Мякотных В.С., 1998; Боровкова Т.А., 1999; Ямпольская В.В., 2007).
5.3. Сравнительная динамика патоморфологических изменений
Изучение сравнительной динамики патоморфологических изменений головного мозга
в отдаленном периоде «легкой» боевой ЧМТ проведено 44 пациентам с последствиями
боевой ЧМТ и 31 больному с последствиями бытовой ЧМТ. Исследование производилось
с использованием МРТ и у каждого пациента – дважды: через 1 - 5 лет после
полученной травмы головного мозга и затем через 10 и более лет после указанной
травмы.
Для оценки степени гидроцефалии желудочковой системы использовались
абсолютные и относительные величины. При МРТ-сканировании определяли следующие
линейные размеры: а) ширину переднего рога левого бокового желудочка на уровне
средней трети головки хвостатого ядра; б) ширину 3-го желудочка в задней трети
на уровне эпифиза; в) ширину сильвиевой борозды на сагиттальном срезе.
Вычислялись коэффициенты: индекс передних рогов (ИПР) и индекс 3-го желудочка (ИТЖ)
(Верещагин Н.В., Брагина Л.К., 1986).
У пациентов с последствиями боевой ЧМТ усредненные показатели ширины
переднего рога в динамике были 3,68±0,28 и 4,44±0,34 мм (р<0,05), поперечных
размеров 3-го желудочка - 4,69±0,36 и 5,55±0,43 мм (р<0,05), ширины сильвиевой
борозды - 5,45±0,12 и 6,34±0,25 мм. Среднее увеличение ширины переднего рога за
истекший период, таким образом, составило 1,01± мм, 3-го желудочка - 1,11± мм,
сильвиевой борозды - 0,89± мм (р<0,05).
У представителей группы сравнения эти же показатели выглядели следующим
образом: ширина переднего рога - 3,45±0,10 и 3,50±0,21 мм, поперечные размеры
3-го желудочка - 4,41±0,24 и 4,45±0,17 мм, ширина сильвиевой борозды - 5,52±0,33
и 5,56±0,08 мм. Среднее увеличение ширины переднего рога за период наблюдения
составило 0,05± мм, 3-го желудочка - 0,04± мм, сильвиевой борозды - 0,04± мм (р>0,05).
Таким образом, у больных с последствиями боевой ЧМТ имеется достоверная и
отчетливая тенденция к нарастанию гидроцефалии желудочковой системы и корковой
атрофии в динамике отдаленного периода травматической болезни мозга, в то время
как у больных с последствиями бытовой ЧМТ выявленные изменения незначительны и
статистически недостоверны.
Динамика индексов – относительных показателей измерения различных отделов
желудочковой системы представлена в таблице 5.7.
Таблица 5.7. Динамика усредненных относительных показателей
(индексов) различных отделов желудочковой системы.
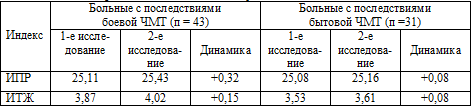
Достоверных изменений в динамике со стороны индексов желудочковой системы
нами не отмечено (во всех случаях р>0,05), т.к., вероятно, относительные
показатели являются более устойчивой величиной, нежели абсолютные параметры,
хотя тенденции к увеличению индексов отмечаются при анализе всех показателей.
Приведем пример.
Больной Г., 1965 г. рожд. Наблюдается с 1990 г. с диагнозом: отдаленные
последствия ЧМТ с гипертензионным синдромом, психоорганический синдром,
астено-эксплозивный вариант, с частыми аффектами.
Срочная военная служба в Афганистане в 1984 – 1985 гг. За этот период дважды
перенес сотрясение головного мозга, лечился в госпитале. Перенес острый вирусный
гепатит.
Непосредственно после ЧМТ появились головные боли, практически
ежедневные, которые резко усилились после демобилизации. В течение первых 5 лет
после ЧМТ головные боли носили отчетливо гипертензионный характер: беспокоили в
утренние часы, сопровождались тошнотой и рвотой, болезненностью при движениях
глазных яблок, купировались приемом мочегонных и спазмолитических средств. Затем
характер головных болей изменился, они возникали даже после небольшой
психоэмоциональной нагрузки, носили «сжимающий» характер, не купировались
приемом мочегонных препаратов. Отмечает резкое изменение характера после службы
в Армии, стал подозрительным, недоверчивым, через 4 -5 лет после демобилизации
появилась агрессивность, злобность, раздражительность, ухудшился ночной сон,
стал быстро утомляться, снизилась память и работоспособность.
Об-но: тремор век, более выраженный слева, снижена мышечная сила в правой
кисти, слегка пошатывается в позе Ромберга, гипергидроз дистальных отделов
конечностей. Внимание неустойчивое, истощаем. Выявляется психическая астения,
снижение памяти на текущие и прошлые события. При использовании психологического
опросника Басса-Дарки выявлены выраженные признаки физической агрессии,
раздражительности, негативизма, обиды, подозрительности, вербальной агрессии.
Психиатром отмечено нарастание эксплозивности, учащения аффектов в поведении
больного в течение последних 5 лет.
Глазное дно: расширение и полнокровие венозной сети.
ЭЭГ: на фоне диффузно-дизритмических изменений регистрируется очаговая
пароксизмальная активность неэпилептического характера в правой височной
области.
МРТ исследование проведено через 5 и 14 лет после получения ЧМТ. Ширина
переднего рога левого бокового желудочка при первом исследовании составила 5,7
мм, при втором – 6,6 мм, увеличение - 0,9 мм; ширина 3-го желудочка при первом
исследовании – 4,9 мм, при втором – 6,2 мм, увеличение – 1,3 мм; ширина
сильвиевой борозды при первом исследовании – 5,4 мм, при втором – 5,8 мм,
увеличение – 0,4 мм. Динамика индексов составила: ИПР – 25,10 – 25, 12,
увеличение – на 0,02; ИТЖ – 3,80 и 4,03, увеличение – на 0,23.
Повторные курсы лечения включали эуфиллин, диазепам, витамины, неулептил,
грандаксин, циркулярный душ, иглорефлексотерапию, психотерапию. После
проведенных курсов лечения становился спокойнее, уменьшалась частота аффектов с
1 - 2 раз в день до 1 раза в неделю, улучшался сон. Неоднократно рекомендовались
занятия аутогенной тренировкой, которыми больной пренебрегал.
Таким образом, у больного с выраженным психоорганическим синдромом с
прогредиентным течением, в динамике отдаленного периода травматической болезни
мозга происходит нарастание гидроцефалии желудочковой системы и корковой
атрофии. При этом собственно гипертезионные жалобы уходят на второй план,
уступая место психическим расстройствам.
Выявленные морфологические изменения отчетливо свидетельствуют о
продолжающемся нарастании атрофии мозгового вещества на уровне желудочковой
системы даже в отдаленном периоде после легкой боевой ЧМТ, полученной в условиях
ХПЭС, и при этом активность прогредиентного посттравматического процесса выше (р<0,05),
чем при получении бытовой травмы. Возможно, длительно существующая дисфункция
неспецифических регулирующих систем головного мозга усиливает органические
расстройства в диэнцефально-стволовых отделах, образуя своеобразный «порочный
круг».
При оценке степени выраженности гидроцефалии 3-го желудочка и расширения
сильвиевой борозды использовались данные С.Б. Вавилова (1979), согласно которым
ширина 3-го желудочка в возрасте 28 - 40 лет в норме равна от 3,5 до 4,3 мм, а
ширина сильвиевой борозды - 2,5 – 4 мм. Исходя из этих данных, ширина 3-го
желудочка 4,5 - 5,5 мм оценивалась нами как легкая степень гидроцефалии, 5,5 -
6,5 мм - как умеренная степень, и более 6,5 мм - выраженная. При оценке степени
корковой атрофии легкая ее степень диагностировалась при ширине сильвиевой
борозды 4 - 5 мм, умеренная – 5 - 6 мм, выраженная – больше 6 мм.
Исходя из данных предпосылок, проанализирована степень корковой атрофии и
желудочковой гидроцефалии в зависимости от ведущего неврологического синдрома и
типа психических расстройств (таблицы 5.8 и 5.9).
Выраженная желудочковая гидроцефалия преобладает у больных с эпилептическим
синдромом (р<0,05), вероятно, за счет того, что эпилептический процесс
изначально накладывается на посттравматическую гипертензию. Умеренная же
гидроцефалия более характерна для больных с гипертензионным синдромом.
Таблица 5.8. Выраженность морфологических изменений
головного мозга в зависимости от ведущего неврологического синдрома
| Варианты и степени атрофии |
Гипертензионный смндром (n = 45) |
Эпилептический синдром (n = 26) |
Р |
| А) желудочковая
- легкая ст.
- умеренная ст.
- выраженная ст. |
10 (22,22%)
18 (40%)
17 (37,78%) |
-
5 (19,23%)
21 (80,77%) |
< 0,05
< 0,05
< 0,05 |
| Б) корковая - легкая ст.
- умеренная ст.
- выраженная ст.
- отсутствует |
5 (11,11%)
5 (11,11%)
4 (8,89%)
31 (68,89%) |
5 (19,23%)
6 (23,07%)
10 (38,46%)
5 (19,23%) |
> 0,05
< 0,05
< 0,05
< 0,05 |
Таблица 5.9. Выраженность морфологических изменений
головного мозга в зависимости от преобладающего психического расстройства.
| Варианты атрофии |
Психоорганический
синдром
(n= 47) |
Астено-невротические и тревожно-депрессивные
расстройства (n=26) |
р |
| А) желудочковая
- легкая ст.
- умеренная ст.
- выраженная ст. |
6 (6,2%)
21 (44,7%)
20 ( 42,7%) |
20 (76,92%)
2 (7,69%)
4 (15,38%) |
< 0,05
< 0,05
< 0,05 |
| Б) корковая - легкая ст.
- умеренная ст.
- выраженная ст.
- отутствует |
9 (19,15%)
12 (25,53%)
12 (25,53%)
14 (29,79%) |
1 (3,8%)
1 (3,8%)
2 (7,7%)
22 (84,62%) |
< 0,05
< 0,05
< 0,05
< 0,05 |
Корковая атрофия всех степеней достоверно чаще (р<0,05) встречается у больных
с эпилептическим синдромом. Для психоорганического синдрома также характерна
умеренная и выраженная желудочковая гидроцефалия, а корковая атрофия менее
выражена - преимущественно легкой и умеренной степени. При других вариантах
психических расстройств корковая атрофия, также как и желудочковая гидроцефалия,
менее характерны.
Данные анализа патоморфологических церебральных изменений в зависимости от
характера повреждающего фактора представлены в таблице 5.10.
Таблица 5.10. Сравнительные варианты морфологических
изменений головного мозга у больных с последствиями боевой и бытовой ЧМТ
| Варианты изменений |
Последствия боевой ЧМТ (n=44) |
Последствия бытовой
ЧМТ (n=31) |
| Только желудочковая гидроцефалия |
17 (38,64%) |
23 (74,19%) |
| Только корковая атрофия |
7 (15,91%) |
4 (12,9%) |
| Сочетанные изменения |
20 (45,45%) |
4 (12,9%) |
Очевидно, что увеличение ширины переднего рога левого бокового желудочка и
3-го желудочка, а также ширины сильвиевой борозды достоверно преобладает у
больных с последствиями боевой ЧМТ, по сравнению с больными с последствиями
бытовой ЧМТ. Изменения же только со стороны желудочковой системы чаще
встречаются у больных с последствиями бытовой ЧМТ, а смешанные формы и изменения
только со стороны субарахноидального пространства преобладают у больных с
последствиями боевой ЧМТ (р<0,05).
Резюме
Таким образом, выявлено сходство в изменениях на ЭЭГ у больных с
последствиями боевой ЧМТ и ХПЭС: в динамике отдаленного периода происходит
достоверное увеличение десинхронного типа ЭЭГ, однако у больных с последствиями
ЧМТ десинхронизация происходит достоверно быстрее, в более короткие сроки.
Одинаковое соотношение больных с эпилептиформными и неэпилептиформными
проявлениями на ЭЭГ свидетельствует о неспецифической реакции мозга на различные
повреждающие факторы, а также о предрасположенности больных с последствиями ХПЭС
к возникновению эпилепсии. Очаговые изменения биоэлектрической активности в
височных отделах мозга более характерны для больных с последствиями боевой ЧМТ,
нежели для последствий ХПЭС, для которых преобладающими являются диффузные
неэпилептиформные изменения. Более грубые изменения на ЭЭГ, сохраняющиеся в
течение многих лет, выявлены у больных с преимущественно эпилептическими и
гипертензионно-гидроцефальными синдромами. Исследования сосудов мозга у больных
с последствиями боевой ЧМТ и ХПЭС свидетельствуют о нарушении нейрогуморальной
регуляции сосудистого тонуса и признаках развивающейся сосудистой церебральной
патологии. В динамике отдаленного периода после перенесенной боевой ЧМТ
происходит нарастание желудочковой гидроцефалии и корковой атрофии, при этом
степень желудочковой гидроцефалии прямо коррелирует с выраженностью
психопатологических расстройств, а корковой атрофии – с развитием эпилепсии.

