
ГЛАВА 9. ОЦЕНКА
ТЯЖЕСТИ СОСТОЯНИЯ БОЛЬНЫХ
Следующая немаловажная проблема, с которой сталкиваются врачи РКЦН,
да и вообще врачи-интенсивисты – это оценка тяжести состояния различных по весу
и срокам жизни больных, находящихся в различных лечебных учреждениях, поскольку
это определяет не только перевод в то или иное специализированное отделение, но
и существенно сказывается на стоимости проводимого лечения. Так, расходы на
содержание ОРИТ в США достигают 15-20% общебольничных финансовых затрат, что
соответствует примерно 1% валового национального продукта страны (Pollack M.M.
et al., 1991). Неудержимое возрастание затрат на ОРИТ превратилось в столь
актуальную проблему, что потребовало отдельного заседания 1-го Всемирного
конгресса детских анестезиологов и реаниматологов (Балтимор, США, 1990 г.) для
обсуждения эффективности использования этих отделений. Одним из путей повышения
эффективности работы койки был признан правильный отбор больных для лечения в
отделении реанимации и/или интенсивной терапии, что возможно только на основе
объективной стандартизированной оценки тяжести состояния. Конечно, с данной
проблемой сталкиваются врачи не только в США, но и в других странах мира, в
частности и в России. Так, эксперты ВОЗ проанализировали врачебные назначения,
сделанные в 21 больнице России, Казахстана и Молдавии. Анализ показал, что более
половины детей получают необоснованную терапию, включающую кислород,
антибиотики, инфузию и т.д. (Duke T., 2002; Tamburlini G., 2002; Weber M.,
2002).
С другой стороны, недооценка степени тяжести может повлечь
недостаточную или некорректную терапию, что может привести к ухудшению состояния
больного и/или к смерти (Duke T. et al., 2003).
Кроме того, объективная оценка тяжести состояния позволяет выделить
однородные по степени тяжести группы больных, оценить эффективность работы ОРИТ,
провести сравнение результатов деятельности нескольких ОРИТ, облегчить
сопоставление эффективности различных видов терапии.
Тесная связь тяжести состояния больного при поступлении в ОРИТ с
прогнозом еще более увеличивает область ее применения, прежде всего для оценки
качества лечения, его стандарта. Такой подход актуален для страховой медицины,
так как современные модели анализа качества и эффективности основаны на
определении соответствия реального и прогнозируемого (предполагаемого)
результата. Корректность прогнозирования при этом приобретает принципиальное
значение.
К сожалению, в настоящее время, судя по нашему опыту, у некоторых
детских врачей (педиатров, реаниматологов, неонатологов и т.д.) происходит
смешивание двух медицинских понятий «степень тяжести состояния» и «степень
тяжести заболевания». Иногда с этим обстоятельством связано «непонимание»
врачами друг друга.
В педиатрической практике для интегральной количественной оценки
тяжести состояния используются различные системы шкал. В настоящее время в
литературе опубликовано более четырех десятков шкал (систем) оценки степени
тяжести взрослых и детей, однако лишь немногие из них можно считать
общепринятыми. Заметим, что большинство шкал, используемых в мире, опубликовано на сайте www.mefal.org (открыт для бесплатного
доступа, надо только зарегистрироваться, что не представляет никаких
сложностей), некоторые из них, широко используемые в неонатологии, в том числе и
при транспортировке новорожденных, представлены в приложении. Достаточно часто
пишут, что первую шкалу предложила американский акушер Апгар В. в 1952 году.
Возможно, в неонатологии это и так, а в медицине – нет. Насколько нам известно,
первую шкалу, разделяющую больных по степеням тяжести, предложил великий русский
хирург Пирогов Н.И. в 1854 году. Практически за 100 лет до Вирджинии Апгар.
Правда, про это почему-то забывают...
Достаточно условно шкалы, используемые в медицине «раннего
возраста», можно сгруппировать следующим образом (ниже мы приведем общепринятую
классификацию).
Ранговые шкалы оценки в различных областях:
– Apgar – шкала оценки тяжести интранатальной асфиксии;
– Silverman – шкала оценки тяжести дыхательных расстройств при
СДР I типа;
– ISS (Injury severity score ) – шкала
оценки
тяжести
травмы;
– TISS (Trauma injury severity score) –
шкала оценки
повреждения
при травмах;
– GCS (Glasgo coma score ) – шкала
комы
Глазго;
– SSS (Septic servity score ) – оценка
тяжести
сепсиса.
Шкалы оценки общей тяжести состояния:
– SAPS (Simplified acute physiology score) –
упрощенная
шкала оценки
физиологических
расстройств;
– APACHE (Acute Physiology and Chronic Health Evaluations ) –
шкала оценки острых физиологических расстройств и хронических нарушений
состояния;
– PSI (Physiology stability index) – индекс физиологической
стабильности;
– TISS (Therapeutic intervention scoring system) – система оценки
агрессивности терапевтических вмешательств.
Прогностические оценочные шкалы:
– MPM (Mortality prediction model) – система оценки вероятности
летального исхода;
– PRISM (Pediatric risk of mortality) – риск летального исхода
у детей;
– MOSF (Multiple Organ System Failure) – система оценки
полиорганной недостаточности.
Шкалы оценки тяжести состояния (ОТС), как правило, применяются для
того, чтобы более точно определить исход заболевания при неясном прогнозе. К
сожалению, достаточно неопределенные понятия очень часто используются в данных
ситуациях. Например, чрезвычайно популярная в отечественных отделениях
интенсивной терапии (ОИТ) качественная система ОТС – средней тяжести, тяжелое,
очень и крайне тяжелое состояние больного. Проблемы с такими ступенчатыми
качественными шкалами заключается в чрезвычайно широкой вариабельности их
интерпретации, вследствие различий в восприятии этих терминов разными
специалистами, участвующими в лечебном процессе. Подобные определения
характеризуются крайне низкой степенью воспроизводимости.
В детской медицине имеется более 20 детских шкал оценки тяжести
состояния у детей, имеющих высокую степень доказательности. Однако
наиболее
часто в
клинической
практике
используются
системы PRISM (Pediatric Risk of Mortality Score), PIM
(Pediatric Index of Mortality), PEMOD (Pediatric Multiple Organ Dysfunction
Score) и PELOD (Pediatric
Logistic Organ Dysfunction Score). Данные оценочные
системы позволяют надежно рассчитывать тяжесть состояния доношенных
новорожденных, находящихся в критическом состоянии.
Существенные различия физиологических параметров функционирования
систем и органов у маловесных и недоношенных новорожденных, а также и наличие
специфических заболеваний и патологических состояний существенно ограничивает
валидность существующих педиатрических систем оценки тяжести состояния. Они
несовершенны применительно к недоношенным, потому что в них отсутствуют
перинатальные факторы, которые существенно влияют на выживаемость данного
контингента детей. Шкалы тяжести неонатальной заболеваемости должны использовать
тщательно отобранную специфическую демографическую, физиологическую и
клиническую информацию для количественной оценки риска развития летального
исхода. Для оценки тяжести состояния недоношенных новорожденных чаще всего
применяются оценочные системы SNAP (Score for Neonatal Acute Рhysiology) и CRIB
(Clinical Risk Index for Babies). Как правило, они представляют собой инструмент
для сравнительной оценки риска развития неблагоприятного исхода.
Современные шкалы ОТС подразделяются на две большие группы –
предективные шкалы (системы PRISM, PIM, CRIB, SNAP) и шкалы текущей
оценки состояния (PЕMOD, PELOD, NEOMOD). Первые были разработаны для того,
чтобы лучше описать тяжесть заболевания путем определения исходного состояния
популяции тяжелобольных детей. Они способны максимально точно предсказывать риск
гибели среди различных групп пациентов педиатрических ОИТ. Другая группа шкал
были разработаны для того, чтобы лучше описать тяжесть заболевания в течение
всего периода нахождения ребенка в ОИТ. Они предполагают необходимость
ежедневного сбора данных о степени нарушения функции органов и систем с момента
поступления ребенка в ОИТ до выписки или гибели больного и предназначены для
того, чтобы максимально значимо отразить степень и характер дисфункции органов и
систем у различных групп больных в динамике течения заболевания. В состав шкал
могут быть включены различные переменные, включающие клинические данные, такие
как частота сердечных сокращений, частота дыханий, сердечный индекс и т.п.,
лабораторные данные – например, уровень креатинина крови или парциальное
давление кислорода в артериальной крови. В шкалы могут быть включены и другие
оценочные системы. Например, вхождение в структуру шкалы PRISM оценки по шкале
ком Глазго. Каждой переменной соответствует свой балл, соответствующий удельному
весу ее предективной способности. Баллы со всех переменных, включенных в шкалу,
суммируются и на основании полученных результатов, вычисляется риск гибели.
Системы ОТС предназначены для групповой оценки, а не
индивидуального прогноза. Соответственно, и набор данных осуществляется также
среди группы больных. Соответствие уровня прогнозируемой летальности реальной
является основной конечной точкой оценки их валидности. Смерть, наиболее жесткий
показатель, не требующий консенсуса в оформлении диагноза и не зависимый от
внутреннего контроля исследователя.
Дискриминационная способность шкалы (дискриминация) и ее калибровка
– две наиболее важные характеристики любой оценочной системы. Дискриминация –
это способность теста различать пациентов на тех, у кого имеется вероятность
искомого исхода (например, гибели), и тех, у кого ее нет. Дискриминационная
(предсказательная) способность наиболее оптимально определяется путем измерения
площади под характеристической (ROC) кривой. Калибровка шкалы – это степень
соответствия между предсказанным искомым исходом (например, смерть) и реально
наблюдаемой частотой исхода. Для статистического анализа калибровки обычно
используется тест соответствия Хосмер–Лемешева. Уровень (значение) р для
калибрации < 0,05 предполагает, что это статистически значимая разница между
наблюдаемой и предсказанной летальностью, которая противоречит тому, что хотели
найти. Традиционно предполагается, что калибрация хорошая, если значения р >
0,10. Более высокие значения р являются еще более предпочтительными.
Предиктивные шкалы. Шкала PRISM III может применяться у
критически больных новорожденных, младенцев, детей и подростков, но не
предназначена для недоношенных новорожденных и взрослых. Она была создана в 1996
году M. Pollack et al. на основе модификации ранее существующей шкалы PRISM и
включает в себя 17 переменных, мониторинг которых осуществляется в течение
первых 12 часов поступления ребенка в ОИТ (PRISM III-12) или в течение первых
суток (PRISM III-24). В разработку вводятся наиболее аномальное значение каждого
исследуемого признака. Ее валидность была апробирована в крупномасштабных
мультицентровых исследованиях на территории Северной Америки. Дискриминационная
способность PRISM III-24 составляет 0,944+0,021, калибрационная способность (р =
0,5504), для PRISM III-12 соответственно 0,941+0,021 и 0,4168.
Шкала PIM. Первая ее версия была представлена в 1997 году, в 2003
году появилась усовершенствованный ее вариант PIM-2. Шкала включает 10
переменных. Валидность системы была оценена на 20 787 тяжелобольных детях 14
педиатрических ОИТ Австралии, Новой Зеландии и Великобритании. Дискриминационная
способность PIM-2 составляет 0,90, калибрационная способность (р = 0,17). Ее
использование приемлемо для доношенных новорожденных.
У недоношенных пациентов эта группа шкал представлена оценочными
системами SNAP, SNAPPE (Score for Neonatal Acute Рhysiology – Perinatal
Extention) SNAP-II, CRIB и CRIB-II, которые основываются на информации,
собранной в течение первых 24 часов после рождения.
Шкалы текущей оценки тяжести состояния. У детей для подсчета
количества пораженных органов и систем можно использовать шкалу PEMOD. Это
полуколичественная шкала, основанная на принципе, что чем больше органов
вовлечено в мультиорганную дисфункцию (МОД), тем тяжелее состояние ребенка.
Число поврежденных систем может варьировать от 0 до 6. Однако необходимо
помнить, что для пациентов ОИТ уровень летальности зависит не только от числа
пораженных систем, но также и относительной «значимости» и степени дисфункции
каждой из систем. В настоящее время доказано, что у детей формирование
кардиоваскулярной и неврологической дисфункций более значимо для оценки исхода,
чем развитие почечной или печеночной дисфункций. Роль удельного веса и степени
тяжести дисфункции различных органов и систем принимается в расчет в системе
PELOD. Она создавалась на основе методологий доказательной медицины тремя
независимыми группами исследователей на базе педиатрических ОИТ университетских
клиник. Шкала оценивает шесть систем на основе анализа 12 переменных. Ее
валидность оценивалась на базе 7 детских ОИТ Канады, Франции и Швейцарии путем
исследования 1806 пациентов, из которых 115 погибло, дискриминационная
способность – 0,91+0,01, калибрационная 0,54. Недавние исследования
выявили, что при сепсисе у детей прогностическая способность шкалы PELOD
существенно повышается, когда принимаются во внимание не только ее данные, но и
оценивается септический статус (сепсис, тяжелый сепсис, шок). Данное
обстоятельство послужило причиной того, что эта шкала рекомендуется для оценки
тяжести состояния доношенных новорожденных и детей, заболевших сепсисом.
Хотя шкалы мультиорганной дисфункции достаточно хорошо
исследованы применительно к общепедиатрической практике, в неонатальной медицине шкалам
множественной органной дисфункции уделено значительно меньшее внимание. NEOMOD (Neonatal
Multiple Organ Disfunction Score), единственная шкала неонатальной органной
дисфункции, которая была получена на достаточно значимой выборке недоношенных
новорожденных. Она была создана в процессе проспективного исследования 142
новорожденных с экстремально низкой массой тела на протяжении 28 дней после
рождения. Данная система оценивает семь параметров (несостоятельность ЦНС,
сердечно-сосудистой системы, органов дыхания, почек, гастроинтестинального
тракта, состояние гемокоагуляции и кислотно-щелочное состояние).
Значительный интерес представляет использование шкалы неонатальной
терапевтической агрессии – Neonatal Therapeutic Intervention Scoring System (NTISS).
Система NTISS основана на положении, что вне зависимости от диагноза чем тяжелее состояние
больного, тем более инвазивным и травмирующим является лечение, позволяющие
стабилизировать или улучшить состояние больного. Данная шкала имеет определенное
преимущество – это прежде всего простота использования и возможность
ретроспективного анализа групп пациентов при минимуме клинических данных. В то
же время существенным ограничением ее применения является необходимость в
стандартизации тактики интенсивной терапии. Иначе в клиниках с различной
диагностической и лечебной тактикой можно получить несопоставимые результаты
оценки тяжести состояния в исходно равнозначных группах тяжелобольных
новорожденных.
Необходимо отметить, что все обсуждаемые шкалы ОТС высоковалидны в
отношении только краткосрочных прогнозов (смерть в ОИТ). На их основании
затруднительно оценивать исход заболевания и характер его течения после перевода
ребенка из ОИТ. Для всех современных шкал ОТС наиболее важной является проблема
смещения результатов, связанное с влиянием лечебной тактики, так как шкалы
включают переменные, модулирующиеся в процессе проведения интенсивной терапии.
Таким образом, они не способны отдифференцировать влияние интенсивной терапии на
тяжесть болезни.
Как и для всякой формализованной оценочной системы, для них
характерно отсутствие возможности внесения коррекции в ОТС в ответ на
воздействие современных технологий жизнеобеспечения и прежде всего искусственной
вентиляции легких. Поэтому имеется опасность того, что в более прогрессивных ОИТ
будет искусственно занижаться риск гибели ребенка. Смещение результатов
характерно и для ОИТ с высокой (> 20%) досуточной летальностью.
По мнению Зильбера А.П. (2006), интересующегося проблемами
объективизации тяжести состояния у больных более 25 лет и сравнившего
эффективность применения наиболее распространенных за рубежом шкал, различные
системы объективизации тяжести состояния больных более или менее совпадают по
результатам.
Достаточно большое количество неонатальных центров за рубежом
используют неонатальную шкалу Therapeutic Intervention Scoring System (NTISS).
Эта шкала была предложена в 1974 году Cullen D.J. et al. для взрослых, а в 1992
году модифицирована Gray J.E. et al. для применения у новорожденных.
Таблица 81. Система оценки данных, полученных по шкале TISS (Gray
J.E. et al., 1992)
|
Класс тяжести состояния
|
I
|
II
|
III
|
IV
|
|
Оценка TISS |
1-12
|
13-20
|
21-30
|
более 30
|
|
Оценка TISS при поступлении |
*
|
11,4
|
20,3
|
34,8
|
|
Оценка TISS |
менее 10
|
10-19
|
20-39
|
более 40
|
|
Оцениваемый риск |
низкий
|
между низким и умеренным
|
умеренный
|
высокий
|
|
Смертность (%) |
1
|
4-5
|
18-20
|
20-30
|
На наш взгляд, данная шкала имеет ряд преимуществ перед другими
аналогичными системами оценки в силу ряда обстоятельств.
Оценка степени тяжести производится 1 раз в сутки, ретроспективно,
учитывая все примененные за истекшие сутки и используемые на момент оценки
мероприятия реанимации и интенсивной терапии. Она не требует никаких сложных
аналитических приемов и технологий, поэтому может использоваться в небольших
лечебных учреждениях (роддома, ЦРБ и т.д.), не имеющих мощных лабораторий для
проведения функциональных и биохимических исследований.
Является первой количественной оценочной системой, предназначенной
исключительно для ОРИТ (система оценки сложности и агрессивности лечения).
Связано это с тем, что, как мы уже указывали, NTISS основана на положении, что
вне зависимости от диагноза чем тяжелее состояние больного, тем более инвазивным
и травмирующим является лечение.
Подсчет TISS в течение первых 16 часов пребывания в ОРИТ позволил
придать классам тяжести больных числовое значение, причем оценка TISS
кореллировала с тяжестью состояния больных.
Как видно из таблицы 81, оценка по шкале TISS позволяет разделить
больных на группу высокого риска (3-4 класс тяжести), которые должны получать
лечение, возможное только в ОРИТ, и группу больных низкого риска, лечение
которых можно проводить и в менее дорогостоящем отделении больницы (1 и 2 класс
тяжести). На этом принципиальном различии больных по степени тяжести по ТISS
основан расчет важнейшего показателя деятельности ОРИТ – эффективности работы.
Так, например, больные 1 класса тяжести не должны поступать в ОРИТ
по определению и, соответственно, могут находиться на лечении, как правило,
кратковременном, на отделении патологии новорожденных родильного дома или ЦРБ.
На наш взгляд, внедрение в работу отделений реанимации и
интенсивной терапии новорожденных шкал, необязательно NTISS, но обязательно
общепринятых и широко используемых по крайней мере в большинстве стран, позволит
стандартизировать не только подходы к больным, но и подходы к научным
исследованиям. То есть в определенном смысле мы говорили бы на одном языке.
Конечно, как и любая шкала, достаточно вспомнить многочисленные
дискуссии по поводу шкалы Апгар В., TISS не лишена недостатков. Например, на них
указывает Зильбер А.П. (2006): «Недостаток шкалы TISS состоит в субъективной
оценке потребности в том или ином методе диагностики и лечения. Кроме того, надо
учитывать возможности лечебного учреждения, где некоторых «дорогих» по баллам
методов может не оказаться, и поэтому их и не назначают».
Для возможности использования шкалы NTISS в стационарах нашей
страны, считаем необходимым привести ее полностью:
Таблица 82. Neonatal Therapeutic Intervention Scoring System (NTISS)
(неонатальная шкала терапевтической агрессии) (Gray J.E. et al., 1992)
|
Параметры
|
Перечень
|
Баллы |
|
Респираторная система |
Дополнительный кислород (1) |
1
|
|
Применение сурфактанта |
1
|
|
Уход за трахеостомой [2] |
1
|
|
Наложение трахеостомы [2] |
1
|
|
Применение постоянного положительного давления в дыхательных
путях [1] |
2
|
|
Эндотрахеальная интубация |
2
|
|
Механическая вентиляция легких [1] |
3
|
|
Механическая вентиляция легких с мышечной релаксацией [1] |
4
|
|
Высокочастотная вентиляция [1] |
4
|
|
Экстракорпоральная мембранная оксигенация |
4
|
|
Кардиоваскулярная система |
Введение индометацина |
1
|
|
Нагрузка объемом / болюсное введение растворов (≤ 15 мл/кг) [3] |
1
|
|
Использование вазопрессоров (1 препарат) [4] |
2
|
|
Нагрузка объемом(> 15 мл/кг) [3] |
3
|
|
Использование вазопрессоров (> 1 препарат) [4] |
3
|
|
Резервный пейсмекер [5] |
3
|
|
Функционирующий пейсмекер [5] |
4
|
|
Кардиопульмональная реанимация |
4
|
Окончание таблицы 82
|
Параметры
|
Перечень
|
Баллы |
|
Лекарственная терапия |
Использование антибиотиков (≤ 2 препаратов) [6] |
1
|
|
Использование диуретиков (энтерально) [7] |
1
|
|
Использование стероидов (постнатально) |
1
|
|
Использование антиконвульсантов |
1
|
|
Использование аминофилина |
1
|
|
Другие внеплановые медикаменты |
1
|
|
Использование антибиотиков (> 2 препаратов) [6] |
2
|
|
Использование диуретиков (парэнтерально) [7] |
2
|
|
Лечение метаболического ацидоза |
3
|
|
Калийсвязывающие растворы |
3
|
|
Мониторинг |
Частое определение состояния витальных функций |
1
|
|
Кардиореспираторный мониторинг |
1
|
|
Венесекция (5-10 проб крови) [8] |
1
|
|
Строгий термоконтроль окружающей среды |
1
|
|
Неинвазивный мониторинг оксигенотерапии |
1
|
|
Мониторинг артериального давления |
1
|
|
Мониторинг центрального венозного давления |
1
|
|
Мочевой катетер |
1
|
|
Строгий количественный контроль |
1
|
|
Активная венесекция (> 10 заборов проб крови) [8] |
2
|
|
Метаболизм/
питание |
Зондовое питание |
1
|
|
Внутривенные жировые эмульсии |
1
|
|
Внутривенные аминокислотные растворы |
1
|
|
Фототерапия |
1
|
|
Использование инсулина |
2
|
|
Использование концентрированных растворов калия |
3
|
|
Трансфузия |
Внутривенный иммуноглобулин |
1
|
|
Трансфузия эритроцитарной массы (≤ 15 мл/кг) [9] |
2
|
|
Частичная обменная трансфузия |
2
|
|
Трансфузия эритроцитарной массы (> 15 мл/кг) [9] |
3
|
|
Трансфузия тромбовзвеси |
3
|
|
Трансфузия лейковзвеси |
3
|
|
Повторная обменная трансфузия |
3
|
|
Процедуры |
Транспорт пациента |
2
|
|
Один дренаж в грудной клетке [11] |
2
|
|
Малое оперативное вмешательство [12] |
2
|
|
Несколько дренажей в грудной клетке [11] |
3
|
|
Торакоцентез |
3
|
|
Большое (полостное) оперативное вмешательство [12] |
4
|
|
Перикардиоцентез [13] |
4
|
|
Перикардиальный дренаж [13] |
4
|
|
Диализ |
4
|
|
Сосудистый доступ |
Периферический венозный катетер |
1
|
|
Артериальная линия |
2
|
|
Центральный венозный катетер (линия) |
2
|
Где:
– показатели в квадратных скобках («[ ]») взаимоисключающие
друг друга;
– частичные и повторные обменные трансфузии не являются
взаимоисключающими;
– эндотрахиальная интубация и трахеостомия не являются
взаимоисключающими;
– использование калийсвязывающих растворов и концентрированных
растворов калия не являются взаимоисключающими.
NTISS = СУММА значений всех показателей.
Интерпретация:
– минимальное значение: 0;
– максимальное значение: 100.
Изучая катамнез детей, перенесших тяжелую перинатальную патологию,
мы с нашими сотрудниками Жидковой О.Н., Курзиной Е.А. столкнулись с проблемой
оценки тяжести состояния больного в течение болезни в целом и с необходимостью
выделения однородных по степени тяжести групп больных.
Описанные нами выше и применяемые в неонатальной практике шкалы для
оценки тяжести состояния (SNAP, CRIB, PRISM, NSS, и др.) не позволяют провести
интегративнодинамическую оценку тяжести болезни в целом. Уточним, что
применительно к данной ситуации болезнь понимается не как какая-либо конкретная
нозологическая форма, а как состояние, отличное от состояния здоровья.
Под интегративно-динамической оценкой тяжести болезни мы понимаем
совокупный показатель, который количественно характеризовал бы тяжесть течения
заболевания в целом за весь период пребывания ребенка в ОРИТ.
Выбор шкалы, которая может быть использована как основа для
проведения интегративнодинамической оценки, определяется возможностью
использования шкалы в реальных клинических условиях. Как мы уже отмечали,
применение шкал, основанных на учете клинических и лабораторных показателей,
часто ограничено из-за недоступности оценки всех используемых в шкале
параметров. Поэтому, на наш взгляд, из всего многообразия шкал именно шкала
NTISS является наиболее подходящей для решения поставленной задачи, поскольку
может быть использована как для проспективной, так и для ретроспективной оценки
тяжести состояния, что важно при проведении многих научных исследований, в том
числе катамнестических.
Исходя из поставленной цели (разработать подход к
интегративно-динамической оценке тяжести течения болезни у новорожденных в ОРИТН
вне зависимости от нозологической формы), мы, совместно с Жидковой О.Б. и
Курзиной Е.А., обследовали 136 детей 1991 и 1994 гг. рождения (48 и 88 детей соответственно),
находившихся в период новорожденности в отделениях реанимации и интенсивной
терапии.
Случайность выборки обеспечена включением в группу всех детей,
находившихся на лечении в стационаре за определенный календарный период. Все
дети родились в родильных домах г. Санкт-Петербурга и были переведены в ОРИТН
ДГБ № 1 в возрасте 0-14 суток жизни. На сроке гестации 28-31 неделя родились
11,8% детей; 32-34 недели – 16,9% детей; 35-36 недель – 14,7% детей; 37 и более
недель – 56,6% детей.
В катамнезе дети обследованы в возрасте 8 и 11 лет. Данные о
состоянии здоровья детей получены в результате осмотра, обследования
врачами-специалистами и анализа амбулаторных карт. Методы объективного
обследования включали: педиатрический осмотр (оценка особенностей физического
развития и состояния основных функциональных систем, наличия пороков развития и
стигм дизэмбриогенеза); ультразвуковую диагностику (УЗИ органов брюшной полости
и почек, ЭХОКГ, НСГ, УЗИ щитовидной железы по показаниям); электрокардиографию;
спирометрию и функцию внешнего дыхания; по показаниям – компьютерную томографию
органов грудной клетки, электроэнцефалографию, клинический и биохимический
анализ крови, оценку параметров гемостаза, анализ на гормоны щитовидной железы.
Проводилось обследование врачами-специалистами: пульмонологом, аллергологом,
невропатологом; кардиологом; по показаниям – гематологом, иммунологом,
эндокринологом, гастроэнтерологом, нефрологом.
Статистическая обработка результатов проведена с помощью пакета
компьютерных программ SPSS 13.0. Использованы описательная статистика,
непараметрические критерии, кластерный и дискриминантный анализ.
Оценка тяжести состояния детей в периоде новорожденности
проводилась ретроспективно с использованием данных из историй болезни. Была
использована шкала NTISS как наиболее подходящая для ретроспективного анализа. В
зависимости от оценки NTISS различают 4 класса тяжести состояния: I класс – менее 10 баллов; II класс –
10-19 баллов; III класс – 20-29 баллов; IV класс – 30 и более баллов.
Тяжесть состояния ребенка оценивали по шкале NTISS посуточно с
первых суток жизни до момента перевода из ОРИТН в профильное отделение. При
оценке тяжести состояния каждого ребенка за весь период наблюдения посуточные
оценки NTISS суммировались. Тяжесть состояния каждого ребенка за весь период
наблюдения охарактеризована с помощью следующих параметров:
– сумма всех оценок NTISS, составляющих более 9 баллов, за весь
период наблюдения (сумма NTISS > 10);
– сумма всех оценок NTISS, составляющих более 19 баллов, за
весь период наблюдения (сумма NTISS > 20);
– сумма всех оценок NTISS, составляющих более 29 баллов, за
весь период наблюдения (сумма NTISS > 30);
– максимальный балл NTISS (NTISS max).
Первые три параметра получены путем сложения посуточных оценок
NTISS, превышающих 9, 19, 29 баллов соответственно. Общую тяжесть состояния
ребенка за весь период наблюдения характеризует параметр «сумма NTISS > 10»
(сумма всех оценок NTISS, составляющих более 9 баллов, за весь период
наблюдения). Оценка NTISS более 9 баллов соответствует тяжести состояния,
начиная со II класса и выше. Необходимость введения 2 и 3 параметров (сумма
NTISS > 20 и сумма NTISS > 30) обусловлена тем, что динамика оценки NTISS за
весь период наблюдения может быть различной при одинаковом общем суммарном
балле. Параметры 2 и 3 являются уточняющими при делении детей на группы.
Максимальный балл по шкале NTISS характеризует максимальную
отмеченную за весь период наблюдения тяжесть состояния.
На рисунке 34 представлен пример динамики посуточной оценки NTISS за весь
период наблюдения для одного ребенка и продемонстрированы параметры, по
которым производилась
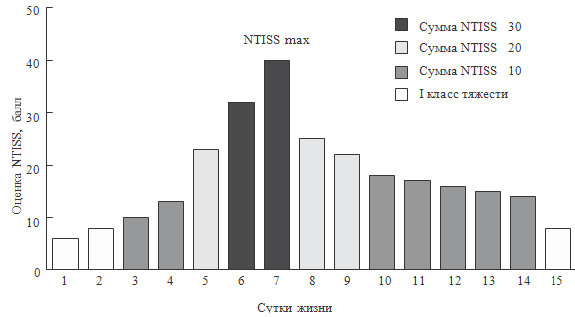
Рисунок 34. Пример динамики посуточной оценки по шкале NTISS
оценка. Область под кривой является графическим выражением
интегративно-динамической оценки тяжести состояния ребенка за весь период
болезни в целом и характеризуется суммарным баллом NTISS. Серым цветом выделена
область, соответствующая сумме всех оценок NTISS, превышающих 9 баллов (класс
тяжести выше I). Штриховка «горизонтальная полоска» на сером фоне соответствует
сумме всех оценок NTISS, превышающих 19 баллов (класс тяжести выше II).
Штриховка «вертикальная полоска» на сером фоне и на фоне «горизонтальной
полоски» соответствует сумме всех оценок NTISS, превышающих 29 баллов (класс
тяжести выше III).
По всем указанным параметрам NTISS все дети были разделены на 5
групп с использованием кластерного анализа (ступенчатая кластеризация).
В таблице 83 приведена характеристика параметров NTISS в
зависимости от группы.
Таблица 83. Характеристика параметров NTISS в группах*
|
Параметры NTISS (балл)
|
Группы
|
|
I
n = 24
|
II
n = 46
|
Ш
n = 32
|
IV
n = 17
|
V
n = 17
|
|
Сумма NTISS > 10 |
13
(0-20)
|
38 (24-50)
|
89
(57-119)
|
182,5 (123-247)
|
362 (277-630)
|
|
Сумма NTISS > 20 |
0
(0-16)
|
0
(0-22)
|
0
(0-46)
|
21
(0-152)
|
22
(0-178)
|
|
Сумма NTISS > 30 |
0
|
0
|
0
|
0
|
0
(0-33)
|
|
NTISS max |
13
(7-20)
|
15 (12-21)
|
17 (13-28)
|
20,5 (14-25)
|
22,5 (16-33)
|
*Ïðèìå÷àíèå. Распределение параметров NTISS не подчиняется
нормальному закону. Указаны значение медианы и интервал от 5 до 95 процентилей.
На рисунке 35 представлена графическая иллюстрация посуточной
динамики оценки NTISS у детей каждой из пяти групп.
Методом дискриминантного анализа получена математическая модель,
описывающая распределение детей на группы. Наиболее значимыми (р < 0,001) для
построения модели
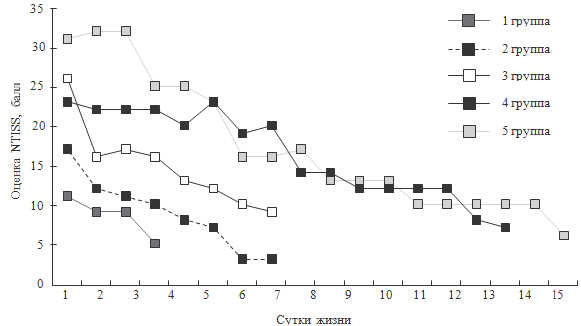
Рисунок 35. Динамика посуточной оценки NTISS для детей I-V групп
параметрами являются: сумма NTISS > 10 и NTISS max. Оставшиеся два
параметра уточняют модель. Общая работоспособность модели составляет 78%. Это
означает, что по выработанным в результате анализа математическим правилам 78%
детей исходной выборки распределены по группам правильно. Дети II–V групп
распределены правильно в 75-94% случаев. Тогда как
46% детей I группы при проверке модели были отнесены ко II группе.
Это связано с тем, что у части детей, отнесенных нами к I группе, отмечался
относительно высокий максимальный балл NTISS, обусловленный проведением в 1
сутки жизни инвазивных процедур (интубации, транспортировки, множественных
заборов крови для анализов). Однако в целом эти дети потребовали
кратковременного (в течение 1-2 суток) лечения в ОРИТ, что подтверждается низким
суммарным баллом NTISS, поэтому они были оставлены в I группе.
Основным параметром при разделении детей на группы является
параметр «сумма NTISS > 10 баллов», характеризующий общую тяжесть состояния за
весь период наблюдения. Именно для этого параметра не перекрываются диапазоны
при разделении на группы (см. таблицу 83). Одинаковая суммарная оценка NTISS
может складываться как за счет относительно невысоких посуточных, но длительно
сохраняющихся оценок NTISS, так и за счет высоких посуточных баллов NTISS,
отмечавшихся в течение более короткого времени. Особенно эта разница заметна у
детей IV-V групп: например, длительность принадлежности к III классу тяжести по
NTISS колеблется от 0 до 8 суток и, соответственно, суммарный балл NTISS за этот
промежуток времени составит от 0 до 178 баллов.
Клиническая характеристика групп представлена ниже.
I группа: дети, которым была необходима непродолжительная
интенсивная терапия. Длительность пребывания в отделении реанимации составила
2-3 дня. Для 50% детей продолжительность ИВЛ составила менее 12 часов, не
нуждались в ИВЛ – 22% детей 1 группы.
II группа: длительность пребывания в отделении реанимации в среднем
составляла 5 дней (максимально до 10 дней). Максимальный балл NTISS 20-21 балл
отмечался однократно в день транспортировки у 5% детей. Для 70% детей
длительность ИВЛ не превышала 48 часов.
III группа: длительность пребывания в отделении реанимации
составила в среднем 7 дней (максимально до 12 дней). Для 80% детей длительность ИВЛ составляла
от 48 до 145 часов.
IV группа: длительность пребывания в отделении реанимации составила
15 дней (от 10 до 37 дней). Длительность ИВЛ в среднем составила 192 часов (8
дней), для 80% детей длительность ИВЛ находилась в интервале от 120 до 590 часов
(от 5 до 24 дней).
V группа: длительность пребывания на отделении реанимации составила
в среднем 33 дня (от 15 до 47 дней). Более чем для 50% детей длительность ИВЛ
превысила 360 часов (15 дней). Максимальная длительность ИВЛ в этой группе
составила 912 часов (38 дней).
Как видно из таблицы 83, большинство детей относится ко II и III
группам (34 и 23% соответственно).
Таким образом, тяжесть течения болезни, оцененная в динамике за
весь период наблюдения в ОРИТН, возрастает от I к V группе. В дальнейшем
полученные в результате анализа группы мы называли «группами тяжести течения
болезни в неонатальном периоде».
Зависимость тяжести течения болезни от срока гестации носит
умеренный характер (коэффициент корреляции Спирмена = -0,5 (р = 0,00)). На
рисунке 36 представлено распределение детей по группе и сроку гестации.
Как видно из рисунка 36, все группы гетерогенны по сроку гестации.
Это отражает тот факт, что одинаковая тяжесть течения болезни отмечается у детей
с различными сроками гестации. Но при преобладании в целом по выборке доношенных
детей (57%) доля недоношенных увеличивается от I к IV и V группам в 3,4 раза.
Это отражает то обстоятельство, что дети с тяжелым течением болезни среди
недоношенных встречаются чаще.
Разработанный подход к оценке динамики тяжести состояния позволяет
количественно охарактеризовать тяжесть течения перинатальной патологии в целом
за весь период
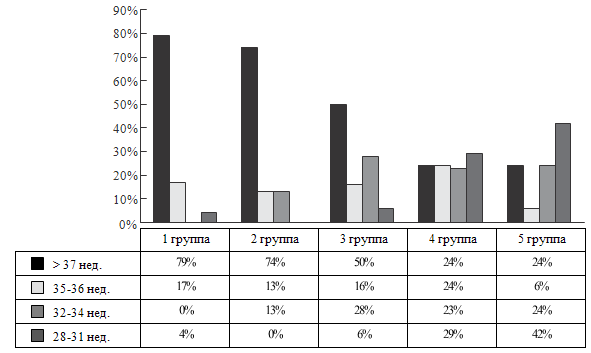
Рисунок 36. Распределение детей по группе и сроку гестации
наблюдения новорожденного в ОРИТН, т.е. позволяет получить
интегративно-динамическую оценку тяжести болезни, что крайне важно и дает
возможность выделения однородных по тяжести групп больных.
Цыбулькин Э.К. и Иванеев М.Д. подчеркивают: важность оценки тяжести
состояния в ОРИТ определяется тем, что тяжесть состояния, но не сама
нозологическая форма является важнейшим определяющим ближайший исход фактором.
Именно оценка тяжести состояния позволяет дифференцировать больных по основному
значимому качественному признаку и формировать однородные по исходной тяжести
состояния группы (классы), что придает самому понятию тяжесть состояния
конкретное смысловое значение (Иванеев М.Д. с соавт.,1993; Цыбулькин Э.К., Иванеев М.Д., 1994).
Однако тяжесть состояния, оцененная одномоментно, характеризует
состояние больного только в конкретный момент времени, именно в тот момент,
когда эта оценка производится, даже если критерии, используемые для расчета,
оцениваются за определенный временной промежуток (1, 6, 12 или 24 часа). В то же
время при одинаковой тяжести состояния, например в момент поступления, или через
определенное количество часов после поступления динамика болезни в целом может
быть различной. Кроме того, максимальная оценка по шкале у одного ребенка может
быть в течение одного дня, а у другого в течение, например, 5 дней. В то же
время оценка динамики тяжести состояния за весь период наблюдения в ОРИТ дает
возможность интегративно-динамической оценки тяжести заболевания в целом.
Подобный подход позволил нам ретроспективно оценить тяжесть болезни у детей,
находившихся в ОРИТ в периоде новорожденности и выделить группы по тяжести
течения болезни.
Оценка тяжести течения болезни в целом в неонатальном периоде также
дает возможность учесть влияние на состояние здоровья в катамнезе комплекса
факторов, ей сопутствующих: формирование деструктивных изменений, последействие
экстремального состояния, задержки скорости роста и дифференцировки тканей,
нарушение процессов формирования функциональных связей в организме,
психоэмоциональная дезадаптация. Таким образом, во-первых, предложенный метод
оценки тяжести состояния новорожденного с помощью модифицированной шкалы NTISS за весь период наблюдения в ОРИТ
является интегративнодинамической оценкой, которая отражает тяжесть течения
болезни в целом. Во-вторых, принцип разделения детей на группы по тяжести
течения заболевания может быть использован при проведении как проспективных, так
и ретроспективных катамнестических исследований, что мы (Жидкова О.Б., Иванов
Д.О. с соавт., 2006-2007) и сделали в дальнейшем, исходя из предпосылки, что
вместе с развитием в неонатальной практике реанимационных технологий, улучшением
условий выхаживания и увеличением выживаемости детей, перенесших тяжелую
перинатальную патологию, растет потребность в изучении особенностей развития и
заболеваемости этих детей в последующем.
Влияние перинатальной патологии на развитие ребенка связано, с
одной стороны, с фактом наличия самой болезни: формирование заболеваний
вследствие деструктивных изменений в органах и тканях, последействие пережитого
экстремального состояния (постреанимационная болезнь). С другой стороны, влияние
это обусловлено возрастом больного ребенка: задержка скорости роста и
дифференцировки тканей, нарушение процессов формирования функциональных связей в
организме, психоэмоциональная дезадаптация именно в неонатальном периоде имеют
исключительное значение.
Вопросам, связанным с развитием детей и формированием патологии в
катамнезе, посвящено множество работ и в России, и в мире. Особенно интенсивно
изучаются проблемы формирования неврологических нарушений, патологии дыхательной
системы, развития и заболеваемости недоношенных детей. Однако катамнестические
исследования, построенные на выделении отдельных нозологических форм, или
патологии отдельных систем органов, или определенного срока гестации, или
последствий применения того или иного метода лечения, позволяя решить отдельные
задачи, не позволяют выявить общие закономерности формирования состояния
здоровья детей.
На наш взгляд, для выявления такого рода закономерностей необходимо
использование подходов, позволяющих интегративно оценить влияние всего комплекса
факторов, сопутствующих наличию перинатальной патологии. В качестве подобной
обобщающей характеристики может быть использована тяжесть течения болезни.
Тяжесть течения болезни является критерием, позволяющим объединить детей по
одному качественному признаку, независимо от формы патологии. По мере увеличения
тяжести болезни возрастает влияние на ребенка всего комплекса факторов, ей
сопутствующих.
Рассмотрение взаимосвязи тяжести течения болезни в неонатальном
периоде и состояния здоровья в катамнезе, по нашему мнению, позволит выявить
закономерности, которые могут служить основой для прогноза развития и
заболеваемости детей.
Для оценки тяжести течения болезни в неонатальном периоде
использована интегративнодинамическая оценка тяжести течения болезни. Оценка
проводилась ретроспективно с использованием данных из историй болезни
новорожденных. Интегративная оценка тяжести болезни получена как сумма всех
посуточных оценок тяжести состояния в динамике болезни. Посуточная оценка
тяжести состояния проводилась по шкале NTISS. Подробнее разделение на группы по
тяжести течения болезни в неонатальном периоде и клиническая характеристика
групп представлена нами выше. Поскольку выборка формировалась как сплошная,
представлен весь спектр патологии, характерный для перинатального отделения III
уровня, включая хирургическую патологию.
Как мы уже указывали, но тяжести течения болезни дети были
разделены на 5 групп (см. таблицу 83). Тяжесть течения болезни возрастает от I к
V группе. Характеристика состояния здоровья детей в катамнезе произведена по 30
качественным и количественным параметрам с ориентацией на возможно более полное
описание состояния здоровья ребенка. На серии рисунков 36-43 представлена
характеристика параметров состояния здоровья в зависимости от группы.
Рисунок 37. Распределение по полу и гармоничности развития в
зависимости от группы
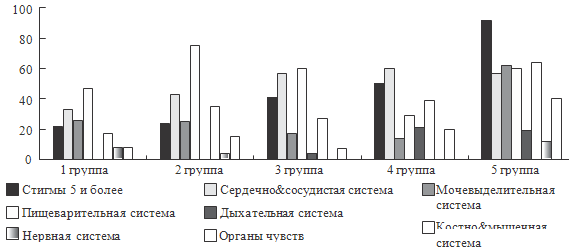
Рисунок 38. Структурные аномалии развития в зависимости от группы
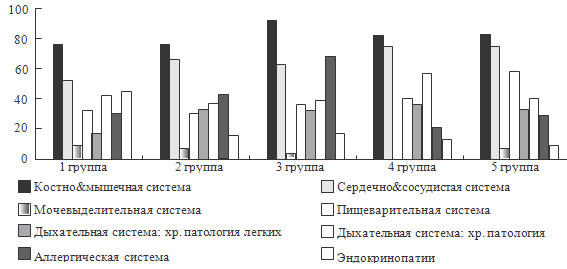
Рисунок 39. Хронические заболевания и функциональные нарушения в
зависимости от группы
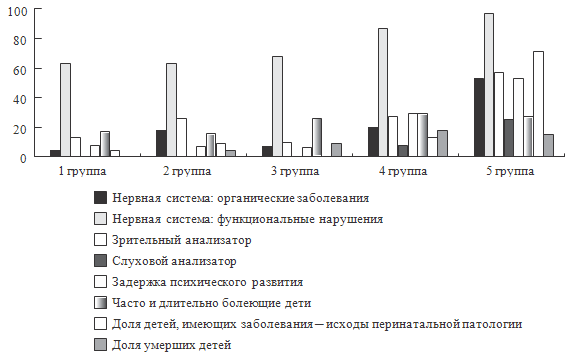
Рисунок 40. Хронические заболевания и функциональные нарушения в
зависимости от группы (продолжение)
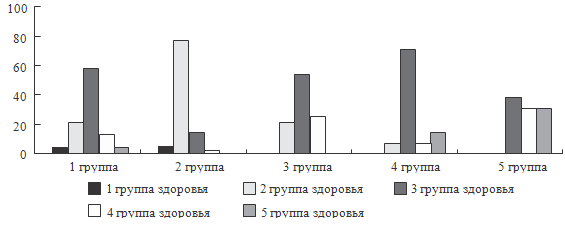
Рисунок 41. Распределение по группам здоровья в зависимости от
группы
Кратко характеризуя особенности формирования патологии в катамнезе,
можно отметить следующее. Как видно из представленных рисунков, для целого ряда
параметров, характеризующих физическое развитие, наличие аномалий развития,
формирование хронических заболеваний и функциональных нарушений, а также по
количественным характеристикам состояния здоровья, уровню инвалидизации и
смертности отмечаются различия между группами.
Однако ни один из 30 параметров, характеризующих состояние здоровья
ребенка, взятый отдельно от остальных, не определяет полностью связь между
тяжестью течения заболевания в неонатальном периоде и состоянием здоровья детей
в катамнезе. Ни по одному отдельно взятому параметру не установлено достоверных
различий между всеми 5 группами (использованы критерий Крускала–Уоллиса и
двусторонний вариант точного критерия Фишера).
Поэтому для дальнейшего анализа связи тяжести течения болезни в
неонатальном периоде и состояния здоровья детей использовалась обобщенная
характеристика состояния
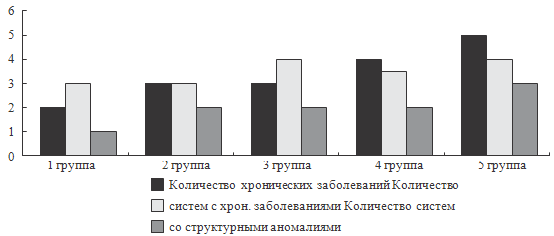
Рисунок 42. Количественные характеристики состояния здоровья в
зависимости от группы (указаны значения медианы)
здоровья в катамнезе. Для выявления указанной взаимосвязи
использован дискриминантный анализ. Дискриминантный анализ – метод многомерной
статистики, позволяющий отнести объект с определенным набором признаков к одному
из известных классов. В данном случае в качестве набора признаков выступают все
30 параметров, характеризующих состояние здоровья в катамнезе. В качестве
классов выступают номера групп тяжести течения болезни в неонатальном периоде.
Методом дискриминантного анализа получена математическая модель, на основании
которой с определенной долей вероятности прогнозировалась принадлежность детей к
группе по тяжести течения болезни на основе анализа признаков, характеризующих
состояние здоровья в катамнезе. При сравнении фактической (по тяжести течения
болезни в неонатальном периоде) и спрогнозированной (по параметрам состояния
здоровья в катамнезе) принадлежности к группе доля правильно спрогнозированных
результатов составляет 90,1% (по группам от 85 до 100%).
Наибольшую информационную значимость для построения модели (>
90%, p < 0,1) имеют 16 из 30 параметров: наличие структурных аномалий сердца, наличие
функциональных нарушений МВС, наличие структурных аномалий ЖКТ, наличие
функциональных нарушений ЖКТ, наличие нарушений слуха, наличие врожденных
аномалий ЦНС, наличие задержки психического развития, наличие эндокринопатий,
наличие хронических заболеваний ВДП, принадлежность ребенка к группе ЧДБД,
гармоничность физического развития, наличие 5 и более стигм, количество систем со структурными аномалиями,
количество хронических заболеваний, количество органных систем с имеющимися
хроническими заболеваниями, количество заболеваний-исходов перинатальной
патологии.
Остальные 14 из 30 параметров являются менее значимыми. Однако, при
исключении параметра, даже имеющего относительно низкую для построения модели
значимость, информативность модели снижается. Увеличение точности
прогнозирования результата по мере увеличения числа включаемых в дискриминантную
модель параметров, отражающих особенности состояния здоровья ребенка,
свидетельствует о значимом влиянии не только совокупности этих факторов, но и
синергического эффекта их взаимосвязи. Таким образом, тесная связь
устанавливается между тяжестью течения болезни в неонатальном периоде и
здоровьем ребенка в целом, а не в плане какой-либо отдельной составляющей.
Совокупность указанных параметров и их взаимосвязь отражает
уникальную характеристику индивидуальной конституции и реактивности, которая
определяет особенности течения патологии в неонатальном и последующих периодах
жизни. Чем более полно охарактеризовано состояние здоровья ребенка, тем лучше
выявляется связь с тяжестью течения болезни
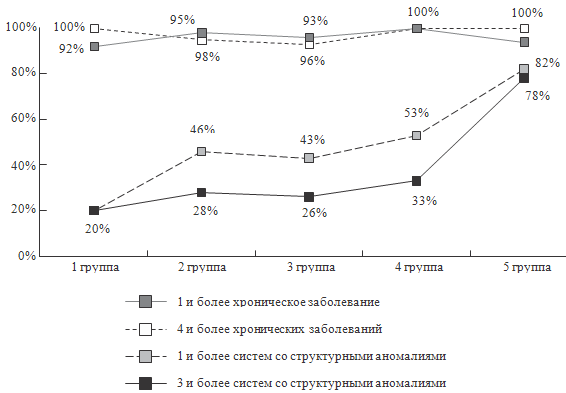
Рисунок 43. Структурные аномалии и хронические заболевания в
зависимости от группы
в неонатальном периоде. В данной работе использованы параметры
состояния здоровья, которые могут быть оценены при рутинной клинической работе.
Взаимосвязь между наличием структурных аномалий, течением патологии
перинатального периода и формированием в последующем хронических заболеваний
можно проиллюстрировать следующим образом (рис. 43).
Из рисунка 43 видно, что наличие структурных аномалий, по крайней
мере одной системы, одинаково часто встречается во всех группах. По мере
увеличения количества измененных систем появляются различия между группами.
Такая же закономерность наблюдается для наличия хронических заболеваний. Так,
доля детей, имеющих структурные аномалии трех и более систем и четыре и более
хронических заболевания, возрастает от I к V группе в 4 раза (от 20 до 80%), то
есть с увеличением количества систем со структурными аномалиями (множественность
изменений) возрастает тяжесть течения перинатальной патологии и количество
хронических заболеваний в последующем.
Таким образом, врожденные функциональные и морфологические
особенности, течение патологии перинатального периода и формирование в
последующем хронических заболеваний являются разными гранями одного целого и
должны рассматриваться в комплексе.
Представление о том, что возникновение, развитие, характер и
течение болезней на протяжении жизни определяется особенностями конституции и
реактивности, является в медицине общепризнанным. Особенности конституции и
реактивности определяют диапазон адаптивных реакций и, как следствие, характер
течения болезней на протяжении всей жизни, в т.ч. в неонатальном периоде, наряду
с течением беременности и родов, своевременностью и правильностью оказания
медицинской помощи. В свою очередь, факторы, явившиеся следствием перенесения
перинатальной патологии, оказывают влияние на конституциональные особенности и
формирование заболеваний в последующем. Таким образом, здоровье ребенка в
катамнезе является результирующей.
В наших представлениях мы опираемся на определение конституции,
предложенное Сиротининым Н.Н. (1966), в котором «…понятие конституции
характеризует совокупность функциональных и морфологических особенностей
организма, определяющая своеобразие его реактивности и сложившаяся на основе
наследственных и приобретенных свойств».
Существование прочных причинно-следственных связей между
индивидуально детерминированными особенностями жизнедеятельности организма и
последствиями перенесенного организмом критического состояния на конкретной
клинической модели было впервые в России показано в работе Ерюхина И.А. и
Шляпникова С.А. (1997). В качестве модели выбрана тяжелая сочетанная травма.
Согласно концепции авторов, «выход из критического состояния сопровождается
неизбежными нарушениями в отдельных звеньях глубинной функциональной интеграции.
Эти нарушения проявляются в различных формах последействия перенесенного
критического состояния на разных этапах последующего жизненного цикла. Именно
это следовое воздействие несет в себе черты исходных, так сказать,
докатастрофических индивидуальных особенностей метаболизма и в целом
жизнедеятельности организма». Представленные положения были положены в основу
понятия об экстремальном состоянии организма. Характер течения
посттравматической болезни, развитие тяжелых осложнений (респираторный
дистресс-синдром взрослого типа, синдром диссеминированного внутрисосудистого
свертывания, синдром системного воспалительного ответа, сепсис), отдаленное
последействие пережитого экстремального состояния рассматриваются как
детерминированные индивидуальной хронобиологической программой. В свою очередь,
следствием функциональной дезинтеграции является изменение индивидуальной
хронобиологической программы.
На наш взгляд, любое критическое состояние может быть рассмотрено с
указанных позиций. Изучение критических состояний с позиций функциональной
дезинтеграции, взаимосвязи особенностей развития самого критического состояния и
его последействия с индивидуально детерминированными особенностями организма
(особенностями конституции и реактивности), состояния здоровья в катамнезе как
результирующей этих взаимосвязанных факторов открывает широкие прогностические
возможности.
Методологическим подходом, позволяющим рассматривать организм, его
поведение в условиях критического состояния и развитие последействия на всех
этапах жизни как единое целое, является рассмотрение организма как сложной живой
динамической системы. Такой подход позволяет применять целый ряд положений
синергетики для описания поведения организма как сложной динамической системы в
условиях болезни и после нее (Хакен Г., 1985-2005; Князева Е.Н., Курдюмов С.П., 2005).
С позиций синергетики развитие болезни можно рассматривать как
состояние потери устойчивости системы, а критические состояния как состояния
максимальной неустойчивости, на грани существования системы. Примером подобной
ситуации в неонатальном периоде можно считать, например, сепсис новорожденных
или развитие синдрома системной воспалительного ответа (ССВО) неинфекционного
генеза при тяжелой асфиксии.
В ряде работ по теории сложных динамических систем одного из
основоположников синергетики Хакена Г. рассмотрены закономерности поведения
сложных систем при потере устойчивости. Поведение любой сложной динамической
системы в условиях потери устойчивости подчиняется ряду закономерностей и
описывается рядом параметров: параметры порядка, принцип подчинения, принцип
круговой причинности. Примером поведения сложной системы обычно служит
поведение жидкости при нагреве или образование волн в океане. При постепенном
повышении температуры жидкости начинаются колебания компонентов системы,
отличные от состояния устойчивости. При этом какие-то колебания затухают,
какие-то нарастают. Амплитуды нарастающих конфигураций – параметры порядка,
описывающие макроскопический порядок, или макроскопическую структуру системы.
Параметры порядка имеют следующие характеристики: параметров
порядка всегда меньше, чем компонентов системы. Поведение системы в целом, в том
числе устойчивых компонентов, полностью определяется параметрами порядка
согласно принципу подчинения. Принцип подчинения резко сокращает число
степеней свободы системы. При изменении параметра порядка система становится
неустойчивой. Таким образом, поведение сложных систем может быть описано и
понято в терминах параметров порядка. В то же время отпадает необходимость
рассматривать действия или поведение отдельных частей, поскольку открывается
возможность описания поведения всей системы в целом с помощью параметров
порядка. Принцип подчинения приводит к сильному сжатию информации.
С другой стороны, компоненты системы, в свою очередь, определяют
действие параметров порядка. Это явление получило название круговой
причинности. Отдельные компоненты системы определяют или даже порождают
параметры порядка. От изначальных характеристик (до потери устойчивости)
компонентов системы зависят параметры порядка, от последних, в свою очередь,
поведение компонентов системы при потере устойчивости и изменение структуры
системы и ее компонентов вследствии потери устойчивости. Так как отдельные
компоненты системы определяют или даже порождают параметры порядка, которые, в
свою очередь, подчиняют себе компоненты системы, последние определяют эволюцию
параметров порядка кооперативно, создается своего рода консенсус между
компонентами.
Параметры порядка обладают еще одной особенностью: их релаксация во
времени происходит медленнее, чем подчиненных им компонентов системы, и
восстановление устойчивости всей системы происходит медленнее, чем отдельных ее
компонентов.
С описанных положений именно тяжесть течения болезни удовлетворяет
характеристикам параметра порядка. Степень тяжести есть степень потери
устойчивости системы, мера функциональной дезинтеграции. Степень органной
недостаточности отдельных органных систем может детерминировать общую тяжесть
состояния, но состояние всех систем организма определяется общей тяжестью
болезни в силу феномена взаимного отягощения (Ерюхин И.А., Шляпников С.А.,
1997). Развитие болезни может быть описано через тяжесть ее течения. На принципе
сжатия информации и получения одной интегративной оценки построены все шкалы
оценки тяжести состояния (Миронов П.И., 2006). Выздоровление от болезни всегда
происходит отсрочено по отношению к восстановлению функций отдельных систем.
Как показано нами, тяжесть течения болезни детерминируется
изначальными структурными особенностями организма. Степень тяжести болезни
возрастает по мере увеличения количества структурных аномалий. С другой стороны,
врожденные функциональные и морфологические особенности детерминируют состояние
здоровья на протяжении жизни. В свою очередь, тяжесть как мера функциональной
дезинтеграции определяет степень структурных изменений компонентов системы и
функциональных связей между ними после болезни.
Таким образом, врожденные функциональные и морфологические
особенности, течение патологии перинатального периода и формирование патологии в
катамнезе являются взаимосвязанными процессами. В силу этой взаимосвязи тяжесть
течения болезни может быть рассмотрена как своего рода «лакмусовая бумажка»,
маркер конституциональных особенностей ребенка и прогностический признак
формирования в последующем заболеваний, обусловленных и этими особенностями, и
перенесенной болезнью, как в плане формирования деструктивных изменений, так и с
точки зрения постреанимационной болезни. Причем тяжесть течения болезни
соотносится именно с состоянием здоровья ребенка в целом, со всей совокупностью
взаимосвязанных факторов. Можно также сказать, что степень функциональной
дезинтеграции в неонатальном периоде соотносится со степенью функциональной
дезинтеграции в катамнезе.
У новорожденных дополнительно существует еще одна сторона проблемы
– болезнь попадает на период максимально активного развития, формирования
функциональных связей системы. По мере увеличения тяжести болезни увеличивается
задержка скорости роста, дезинтеграция функциональных связей, психоэмоциональная
дезадатация (длительность отрыва от матери, объем полученной ребенком негативной
информации).
С нашей точки зрения, оценка влияния конституциональных
особенностей и особенностей реактивности ребенка как факторов, определяющих
диапазон адаптивных реакций, является одной из самых перспективных для поиска
путей совершенствования оказания реанимационной помощи, выхаживания,
реабилитации и абилитации новорожденных детей, а также прогнозирования ближайших
и отдаленных исходов перинатальной патологии.
Выявленная взаимосвязь между характером течения патологии периода
новорожденности и индивидуальными особенностями конституции и реактивности имеет
двойное практическое значение. С одной стороны, данная закономерность позволит
прогнозировать тяжесть и длительность течения перинатальной патологии. С другой
– наличие тяжелого течения перинатальной патологии должно ориентировать врача на
углубленное обследование ребенка с целью выявления множественных микрои
макроаномалий развития, диспансеризации этих детей и их реабилитации.
В Санкт-Петербурге в настоящее время в работе РКЦ используется
формализованная история болезни (см. приложение 5), разработанная Цыбулькиным
Э.К. и Гублером Е.В. и позволяющая при консультировании больных, в том числе и
по телефону, разделить их по сумме баллов на различные по степени тяжести
состояния группы и оценить в динамике изменение степени тяжести.
Конечно, окончательная оценка степени тяжести и готовности больного
к переводу в стационар должна производиться у «постели больного». При этом
больной считается не готовым к транспортировке, если не восстановлены:
– нормальная температура тела;
– удовлетворительные сердечная деятельность и показатели
центральной гемодинамики с адекватной микроциркуляцией;
– удовлетворительные показатели газов крови, то есть не
обеспечена адекватная респираторная поддержка;
– нормальный уровень глюкозы крови.
Естественно возникает вопрос: почему именно с вышеуказанными
нарушениями ребенка нельзя транспортировать в ДГБ? По общепринятым
представлениям длительные отклонения данных жизненно важных показателей будут
иметь фатальные последствия, коррекция которых на последующих этапах, к
сожалению, не всегда позволяет избежать необратимых повреждений.
Исключение из общих правил составляет группа состояний и
заболеваний с невозможностью стабилизации на этапе родильного дома или
соматического отделения реанимации: диафрагмальная грыжа, широкий
трахеопищеводный свищ, массивная аспирация мекония, пороки развития передней
брюшной стенки, мозговых оболочек и т.п. Вопрос транспортировки и риска гибели
больного в таких случаях решается коллегиально, иногда с привлечением
администрации.
Хотелось бы отметить, что перед транспортировкой обязательно
проводится «проба с перекладыванием». Суть ее заключается в том, что
производится смена стационарных систем жизнеобеспечения на транспортные с
оценкой адекватности ответа больного на эту манипуляцию (см. главу 4). По опыту
врачей РКЦН, такие манипуляции иногда приходится повторять многократно,
добиваясь стабильного состояния больного до начала транспортировки.
В таблице 84 представлены параметры, которые должны быть
стабилизированы у новорожденного ребенка перед транспортировкой в Великобритании
(Fenton А.С. et al., 2003).
Таблица 84 . Параметры, требующие стабилизации у новорожденного
перед транспортировкой (Fenton А.С.
et al., 2003)
|
Дыхание
|
|
Должен ли быть ребенок заинтубирован перед транспортировкой?
Показания для интубации перед транспортировкой обычно более жесткие, чем для
новорожденных, находящихся на отделении. В связи с необходимостью
минимизировать любые вмешательства в пути. Если новорожденный более 30
недель гестации, у него стабильны пульс, артериальное давление, частота
дыхания, температура, нормальное PaCO при содержании кислорода во вдыхаемой смеси менее 50%, то он может быть не интубирован.
Если новорожденный нестабилен, срок гестации менее 30 недель и имеет:
– повышение PaCO ;
– одышку;
– потребность в кислороде (во вдыхаемой смеси) более 50%, то
интубация и дыхательная поддержка обязательно необходимы, по крайней мере на
время транспортировки. |
|
Если ребенок был заинтубирован, то интубационная трубка должна
быть оставлена и надежна закреплена во избегания экстубации в пути.
Адекватная респираторная поддержка должна быть обеспечена при
транспортировке. Сурфактант может быть введен при необходимости. |
|
Гемодинамика
|
|
Если ребенок требует повторных анализов газов крови или
нуждается в точном измерении артериального давления, то вопрос об
артериальном доступе должен быть решен до начала транспортировки. Если
отсутствие доступа (венозного или артериального) не будет влиять на лечебную
тактику до и во время транспортировки,
то этот вопрос может быть решен после ее окончания.
Перед транспортировкой должна быть проверена правильность
установки катетера и его безопасность.
Если ребенок нуждается в ведении жидкости и/или инотропов, то
это должно быть начато перед транспортировкой
(так рано, как это установлено). |
|
Температура
|
|
Должна быть произведена оценка температурного баланса и
способы, необходимые для его поддержания. |
|
Глюкоза крови
|
|
Должна быть измерена и стабилизирована концентрация глюкозы
крови. При необходимости ее коррекции должен быть обеспечен венозный доступ. |
|
Наличие инфекционного процесса
|
|
Должен быть проведен скрининг для обнаружения инфекции. При ее
наличии начата терапия. |
|
Информация для родителей
|
|
С родителями должны быть обсуждены цели и место перевода.
Должны быть выяснены их возможности посещения ребенка в стационаре
«перевода». Совместно с акушерами должен быть обеспечен перевод матери в
стационар, где находится ее ребенок. |
|
Информация
|
|
Врач, осуществляющий перевод, должен гарантировать наличие
полной и достоверной информации врачам принимающего отделения. |
По многочисленным наблюдениям, при проведении транспортировки
состояние больных практически никогда не улучшается. Чтобы не показаться
голословными, предлагаем читателям взглянуть на таблицу 85. В ней приведены
данные, полученные Towers G.V. et al. (2000), проанализировавших влияние
транспортировки на некоторые показатели у глубоконедоношенных детей. Обратим
внимание только на один: транспортировка глубоконедоношенных детей в отделения 3
уровня в США приводит к увеличению частоты внутрижелудочковых кровоизлияний III
и IV степени в 2,5 раза, что, конечно, сказывается на летальности и смертности в
данной группе.
Таблица 85. Некоторые показатели у транспортируемых и
нетранспортируемых детей (Towers G.V. et al., 2000)
|
Показатель
|
Не трансп.
|
Транспорт.
|
р
|
|
Количество детей |
285
|
44
|
|
|
Средний вес (г) |
897±187
|
940±155
|
0,14
|
|
Срок гестации (недель) |
27,1±2,0
|
27,5±1,8
|
0,28
|
|
Оценка по Апгар на 5 минуте менее 7б |
73 (26%)
|
13 (30%)
|
0,71
|
Окончание таблицы 85
|
Показатель
|
Не трансп.
|
Транспорт.
|
р
|
|
Оценка по Апгар на 5 минуте менее 3б |
13 (5%)
|
2 (5%)
|
0,68
|
|
Частота «болезни гиалиновых мембран» |
148 (52%)
|
29 (66%)
|
0,12
|
|
Количество новорожденных, получивших эндогенный сурфактант |
127 (45%)
|
27 (61%)
|
0,06
|
|
Количество новорожденных, получивших индометацин |
154 (54%)
|
31 (70%)
|
0,06
|
|
Частота ВЖК III или IV степени |
27 (9%)
|
10 (23%)
|
< 0,02 |
|
Летальность |
15%
|
23%
|
0,26
|
|
Неонатальная смертность |
151/1000
|
233/1000
|
|
Конечно, патогенез возникновения внутрижелудочковых кровоизлияний в
группе детей, подвергшихся транспортировке, многофактерен. Авторы, в частности,
обращают внимание, что не последнюю роль в их возникновении играет отсутствие
антенатальной профилактики кортикостероидами (см. таблицу 86). На этом вопросе
ниже мы еще раз остановимся более подробно.
Таблица 86. Влияние антенатальной профилактики кортикостероидами на
частоту ВЖК у транспортируемых и не транспортируемых новорожденных
|
Показатель
|
Не транспорт.
|
Транспорт.
|
р
|
|
Количество детей |
285
|
44
|
-
|
|
Количество новорожденных у матерей, которых наблюдалось
преждевременное отхождение вод |
182
|
33
|
-
|
|
Количество новорожденных у матерей, которых применяли курсы
антенатальных кортикостероидов |
118 (65%)
|
10 (30%)
|
< 0,001 |
|
Применение антенатальных кортикостероидов у детей с ВЖК III или
IМ степени |
10/27 (37%)
|
1/10 (10%)
|
0,11
|
|
Частота ВЖК III или IV степени, исключая больных, получивших
антенатальную профилактику |
8/64 (13%)
|
8/23 (35%)
|
0,04
|
Заметим, что существуют шкалы, предложенные специально для оценки
транспортировки. Некоторые из этих шкал мы привели в приложении 7.
Для обозначения изменений в состоянии больного, связанных или
обусловленных транспортировкой, введено понятие «цена транспортировки». Для ее
определения должна проводиться бальная оценка состояния больного по одной из
шкал до и после перевода в стационар приема. Для того чтобы состояние больного
осталось стабильным, а не резко ухудшилось, как это, к сожалению, бывает, должны
быть учтены хорошо известные факторы. И, наверное, самые повреждающие из них –
термические факторы. |