
1.2. ПАТОГЕНЕЗ
Патогенез атеросклероза чрезвычайно сложен и многие его звенья до сих пор
остаются малоизученными или имеют различную интерпретацию. Это объясняет
отсутствие единой теории патогенеза этого заболевания, которая объединяла бы все
известные механизмы его развития. Патогенез атеросклероза изучается с середины
XIX века. В 1844 году К. Рокитанский выдвинул тромбогенную теорию его развития,
в 1856 году R. Virchow – инфильтративную, в 1867 году Ю. Конгейм предложил
воспалительную теорию. J. Duguid (1955, 1957) пытался доказать первичность
отложений фибрина в развитии атеросклеротического поражения сосудов.
Согласно представлениям Н.Н. Аничкова и С.С. Халатова (1946) в основе
возникновения атеросклероза лежит инфильтрация в стенку артерий экзогенного
и эндогенного холестерина, что ведет к своеобразной клеточной реакции сосудистой
стенки и формированию атеросклеротической бляшки. В 1958 году А.Л. Мясников
отмечал, что в процессе развития атеросклероза наблюдаются
дегенеративно-некротические изменения, развитию которых способствует
тромбообразование в атеросклеротически измененных сосудах. Исследования Е.И.
Чазова (1961) показали возможность воспроизведения тромба в артериях животных на
фоне только нарушенного состояния стенки сосуда (дисфункции) при отсутствии в
ней атеросклеротических изменений. В конце 80-х гг. XX века R. Ross обосновал
значение воспаления при атеросклерозе.
В последние годы широко обсуждается концепция атеротромбоза, суть
которой заключается в следующем. Во-первых, атеросклеротический процесс всегда
характеризуется распространенностью поражения, и при наличии клиники
ишемического повреждения одного органа всегда следует ожидать скорого вовлечения
в процесс и других органов. Во-вторых, главной опасностью для жизни человека
является не сам атеросклероз, обычно протекающий со слабой клинической
симптоматикой, а наслаивающийся на него тромбоз артерий, приводящий к острой
ишемии жизненно важных органов и часто заканчивающийся летально.
Концепция атеротромбоза представляет в новом свете роль воспалительного
компонента в прогрессировании атеросклеротического процесса. Именно
воспалительные изменения в сосудистой стенке обусловливают повышенную склонность
атеросклеротических бляшек к изъязвлению с последующей эмболизацией артериальных
стволов продуктами распада бляшек, армированных агрегатами тромбоцитов и
лейкоцитов. Эта концепция позволяет видеть не только отдельный пораженный орган,
но и организм пациента в целом, а также акцентирует внимание на феномене
тромбообразования, который подлежит и профилактике и лечению.
По современным представлениям, в основе развития атеросклероза лежит
последовательное взаимодействие многих патогенетических факторов, ведущее
в конечном счете к образованию фиброзной бляшки (неосложненной и осложненной).
Различают три основные стадии формирования атеросклеротической бляшки (атерогенез):
образование липидных пятен и полосок (стадия липоидоза); образование фиброзной
бляшки (стадия липосклероза); формирование осложненной атеросклеротической
бляшки. Начальная стадия атеросклероза характеризуется появлением в интиме
артерий пятен и полосок, содержащих липиды. Липидные пятна представляют
собой небольших размеров (до 1-1,5 мм) участки на поверхности аорты или крупных
артерий, которые имеют желтоватый цвет. Липидные пятна состоят, главным образом,
из пенистых клеток, содержащих большое количество липидов, и Т-лимфоцитов.
В меньшем количестве в них присутствуют также макрофаги и гладкомышечные клетки.
Со временем липидные пятна увеличиваются в размерах, сливаются друг с другом
и образуют так называемые липидные полоски, слегка возвышающиеся над
поверхностью эндотелия. Они также состоят из макрофагов, лимфоцитов,
гладкомышечных и пенистых клеток, содержащих липиды. На этой стадии развития
атеросклероза ХС расположен преимущественно внутриклеточно и лишь небольшое его
количество находится вне клеток.
Липидные пятна и полоски образуются в результате отложения липидов в интиме
артерий. Первым звеном этого процесса является повреждение эндотелия
и возникновение эндотелиальной дисфункции, сопровождающейся повышением
проницаемости этого барьера. Причинами первоначального повреждения эндотелия
могут служить несколько факторов: механическое воздействие на эндотелий
турбулентного потока крови, особенно в местах разветвления артерий; артериальная
гипертензия, увеличивающая напряжение сдвига; увеличение в крови атерогенных ЛНП
и ЛП (α), особенно их модифицированных форм, образующихся в результате
перекисного окисления липидов или их гликозилирования (при сахарном диабете)
и обладающих выраженным цитотоксическим действием; увеличение активности САС
и РАС, сопровождающееся цитотоксическим действием катехоламинов и ангиотензина
II на сосудистый эндотелий; хроническая гипоксия и гипоксемия любого
происхождения; курение; повышение в крови уровня гомоцистеина при дефиците
витамина В6, В12 и фолиевой кислоты; вирусная и хламидийная
инфекция, сопровождающаяся развитием хронического воспаления в стенке артерии.
В результате повреждения эндотелия формируется эндотелиальная дисфункция,
проявляющаяся снижением продукции вазодилатирующих факторов (простациклин, окись
азота) и увеличением образования вазоконстрикторных веществ (эндотелинов, АII,
тромбоксана А2), еще больше повреждающих эндотелий и повышающих его
проницаемость. Модифицированные ЛНП, ЛП (α) и некоторые клеточные элементы крови
(моноциты, лимфоциты) проникают в интиму артерий и подвергаются окислению или
гликозилированию (модификации), что способствует еще большему повреждению
эндотелия и облегчает миграцию из кровотока в интиму артерий этих клеточных
элементов.
Моноциты, проникшие в интиму, трансформируются в макрофаги, которые с помощью
так называемых скэвенджер-рецепторов (“рецепторов-мусорщиков”) поглощают
модифицированные ЛНП (в меньшей степени - остатки ХМ и ЛОНП) и накапливают
свободный и эстерифицированный ХС. Перегруженные липидами макрофаги превращаются
в пенистые клетки, которые наряду с тромбоцитами, проникающими в интиму артерий
из крови, секретируют факторы роста и митогены, воздействующие на гладкомышечные
клетки, расположенные в средней оболочке артерий (медии). Под действием факторов
роста и митогенов гладкомышечные клетки мигрируют в интиму и начинают
пролиферировать. Находясь в интиме, они захватывают и накапливают
модифицированные ЛНП, также превращаясь в своеобразные пенистые клетки.
Гладкомышечные клетки приобретают способность сами продуцировать элементы
соединительной ткани (коллаген, эластин, гликозаминогликаны), которые
в дальнейшем используются для построения фиброзного каркаса атеросклеротической
бляшки. Со временем пенистые клетки подвергаются апоптозу - запрограммированной
гибели клеток и разрушению клеточной оболочки, вследствие чего липиды попадают
во внеклеточное пространство.
Описанные процессы лежат в основе первой стадии формирования
атеросклеротической бляшки - образования липидных пятен и полосок. Липидные
пятна появляются в артериях с раннего детства. В первом полугодии жизни они
обнаруживаются в некоторых секционных случаях. У детей старшего возраста
липоидоз встречается чаще и становится более интенсивным и распространенным. В
возрасте 10 лет липидные пятна занимают около 10% поверхности аорты, а к 25
годам - от 30% до 50% поверхности. В венечных артериях сердца липоидоз
встречается с 10-15 лет, а в артериях мозга - в конце третьего десятилетия жизни
(к 35-45 г).
По мере прогрессирования патологического процесса в участках отложения
липидов разрастается молодая соединительная ткань, что ведет к образованию
фиброзных бляшек, в центре которых формируется так называемое липидное ядро.
Этому способствует увеличение количества липидов, высвобождающихся в результате
апоптоза гладкомышечных клеток, макрофагов и пенистых клеток, перегруженных
липидами. Экстрацеллюлярно расположенные липиды пропитывают интиму, образуя
липидное ядро, которое представляет собой скопление атероматозных масс
(липидно-белкового детрита). Вокруг липидного ядра возникает зона соединительной
ткани, вначале богатой клеточными элементами (макрофагами, пенистыми
и гладкомышечными клетками, Т-лимфоцитами), коллагеном и эластическими
волокнами. Одновременно происходит васкуляризация очага атеросклеротического
поражения. Вновь образующиеся сосуды отличаются повышенной проницаемостью
и склонностью к образованию микротромбов и разрывам сосудистой стенки. По мере
созревания соединительной ткани количество клеточных элементов уменьшается, а коллагеновые
волокна утолщаются, формируя соединительнотканный каркас атеросклеротической
бляшки, который отделяет липидное ядро от просвета сосуда (“покрышка”).
Образуется типичная фиброзная бляшка, выступающая в просвет сосуда и нарушающая
кровоток в нем.
Клиническое и прогностическое значение атеросклеротической бляшки во многом
зависит от структуры ее фиброзной покрышки и размеров липидного ядра. На ранних
стадиях формирования бляшки ее липидное ядро хорошо выражено,
а соединительнотканная капсула сравнительно тонкая и может легко повреждаться
под действием высокого АД, ускорения кровотока в артерии и других факторов.
Такие мягкие и эластичные бляшки иногда называют “желтыми бляшками”. Они мало
суживают просвет сосуда, но ассоциируются с высоким риском повреждений
и разрывов фиброзной капсулы с формированием “осложненной” атеросклеротической
бляшки.
В других случаях фиброзная покрышка плотная и меньше подвержена повреждениям
и разрывам. Такие бляшки называют “белыми”. Они нередко значительно выступают
в просвет артерии и вызывают гемодинамически значимое ее сужение, которое
в некоторых случаях может осложняться возникновением пристеночного тромба.
Прогрессирование атероматозного процесса приводит к формированию “осложненной”
атеросклеротической бляшки. Эта стадия атероматоза характеризуется значительным
увеличением липидного ядра (до 30% и более от общего объема бляшки),
возникновением кровоизлияний в бляшку, истончением ее фиброзной капсулы и
разрушением покрышки с образованием трещин, разрывов и атероматозных язв.
Выпадающий в просвет сосудов детрит может стать источником эмболии, а сама
атероматозная язва - служить основой для образования тромбов. Завершающей
стадией атеросклероза является атерокальциноз - отложение солей кальция в
атероматозные массы, межуточное вещество и фиброзную ткань.
Истончение фиброзной покрышки атеросклеротической бляшки и склонность ее
к разрывам связаны с действием протеолитических ферментов - металлопротеиназ (коллагеназы,
желатиназы, стромелизина), которые разрушают соединительнотканный каркас бляшки.
Имеет значение продолжающаяся инфильтрация бляшки макрофагами, что поддерживает
активность асептического воспалительного процесса и способствует повреждению ее
фиброзной капсулы. Главным следствием формирования “осложненной”
атеросклеротической бляшки является образование пристеночного тромба, который
внезапно и резко ограничивает кровоток в артерии. В большинстве случаев именно
в этот период возникают клинические проявления обострения заболевания,
соответствующие локализации атеросклеротической бляшки (нестабильная
стенокардия, инфаркт миокарда, ишемический инсульт).
Тромбогенность атеросклеротической бляшки определяется содержанием в ней
большого количества тканевого фактора, особенно в богатых липидами зонах. При
экспонировании накопленного в бляшке тканевого фактора начинается процесс
тромбообразования по внешнему пути свертывания крови. Стимулирующее влияние на
активность тканевого фактора оказывает тромбин, являющийся продуктом каскада
реакций, запускаемых тканевым фактором. Таким образом, инициируется механизм
положительной обратной связи, при котором тромбин, генерируемый при активации
тканевого фактора, способствует сохранению прокоагулянтного состояния,
стимулируя дальнейший синтез тканевого фактора и принимая активное участие в
атерогенезе.
Внутри бляшки обнаруживаются также фибрин-мономеры и фибрин-полимеры. В
стенках артерий основными источниками тканевого фактора являются макрофаги,
эндотелиоциты, пенистые и гладкомышечные клетки. Нарушение целостности
атеросклеротической бляшки является основной причиной острого артериального
тромбоза. Быстрое увеличение синтеза тканевого фактора и его накопление в
неоинтиме наблюдаются после баллонного повреждения сосудов, в этом случае
основным источником тканевого фактора являются гладкомышечные клетки.
Повреждение фиброзной покрышки атеросклеротической бляшки сопровождается
контактом липидного ядра с кровью, в результате чего запускается первая стадия
формирования тромба, который первоначально состоит из тромбоцитов и
располагается внутри бляшки. В следующей стадии структура тромба изменяется, в
его состав входят не только тромбоциты, но и фибрин. Тромб выходит в просвет
сосуда, однако еще не перекрывает его. В дальнейшем происходит увеличение
количества фибрина, захват эритроцитов, что сопровождается ростом тромба,
который может перекрывать просвет сосуда.
Тромботические массы, закрывшие просвет артерии, могут подвергаться
естественному лизису при условии достаточной активности фибринолитической
системы. При этом внутри бляшки лизис обычно не происходит и оставшиеся там
тромботические массы вызывают активную пролиферацию гладкомышечных клеток. В
результате этого процесса просвет сосуда существенно сужается, причем зачастую в
значительно большей степени, чем до повреждения. В тромбированных артериях, не
подвергшихся лизису, может начаться процесс реканализации, продолжающийся от
нескольких недель до нескольких месяцев.
Таким образом, развитие атеросклероза сопровождается значительным повышением
функциональной активности тромбоцитов, нарушением функции сосудистой стенки,
увеличением продукции тромбина, фибриногена, фактора Виллебранда, фактора
свертывания крови VII, а также снижением активности
антисвертывающей и фибринолитической систем организма. Следовательно, в
патологический процесс вовлекаются все компоненты системы гемостаза, что
сопровождается постоянным гиперкоагуляционным состоянием, предрасполагающим к
развитию на фоне атеросклероза тромботических осложнений.
Перечисленные выше нарушения со стороны системы гемостаза характерны и для
ИБС. Многочисленные исследования, посвященные изучению состояния компонентов
системы гемостаза у больных ИБС, установили нарушение реологических свойств
крови, выраженную активацию тромбоцитарного звена системы гемостаза, проявления
дисфункции эндотелия, повышение активности калликреин-кининовой системы и
факторов протромбинового комплекса, гиперфибриногенемию, нарушение полимеризации
мономеров фибрина с образованием продуктов паракоагуляции, снижение активности
естественных антикоагулянтов и фибринолитической системы. Эти нарушения
формируют патогенетическую основу для непрерывного латентного микросвертывания
крови и разрушения фибриногена в организме, то есть для развития хронически
существующей гиперкоагуляционной фазы ДВС-синдрома.
На базе Самарского областного клинического кардиологического диспансера в
2006 году проведено исследование основных гемостазиологических показателей,
уровней гомоцистеина (ГЦ) и СR-протеина (CRP)
у 143 больных ИБС стабильного течения (стенокардия напряжения 2, 3
функциональных классов). Активность тромбоцитов и их способность образовывать
агрегаты определялись с использованием метода морфо-функциональной оценки
внутрисосудистой активации, в основе которого лежит немедленная фиксация
венозной крови раствором антикоагулянта с последующим микроскопическим
исследованием кровяных пластинок под фазово-контрастным микроскопом. Этот метод
позволил сохранять внутрисосудистую морфологию тромбоцитов и отражает их
функциональное состояние в кровотоке.
В сосудистом русле при отсутствии патологических активирующих влияний
подавляющее большинство тромбоцитов интактны, имеют характерную дискоидную
форму, практически гладкую поверхность. При воздействии факторов активации
происходит изменение формы тромбоцитов, отражающее процессы их внутренней
ультраструктурной и биохимической перестройки. При этом развивается типичная
последовательность изменений: от формы интактного тромбоцита – дискоцита (Д) к
активированным клеткам – дискоэхиноциту (ДЭ), то есть дискоциту, у которого на
поверхности появляются отростки, далее к сфероциту (С), имеющего форму шара, и
сфероэхиноциту (СЭ), у которого не только форма становится сферичной, но и
возрастает число отростков.
Метод морфофункциональной оценки повышенной внутрисосудистой активации
тромбоцитов позволяет не только дифференцировать различную активность кровяных
пластинок, но и определять относительное количество малых и больших агрегатов
(МА и БА), а также число тромбоцитов, вовлеченных в них (ТрА). Данный метод
оказался наиболее чувствительным для диагностики гиперкоагуляционного состояния
тромбоцитарного звена системы гемостаза в патологических условиях и оценки
адекватности проводимой дезагрегантной терапии.
Все пациенты в течение 10 дней до момента исследования не принимали
дезагреганты. В то же время базисная антиангинальная терапия (β-адреноблокаторы,
антагонисты кальция, нитраты) не прерывалась. Сравнение проводилось с группой
здоровых лиц (37 человек). Средние значения изученных нами показателей
представлены в таблице 1.
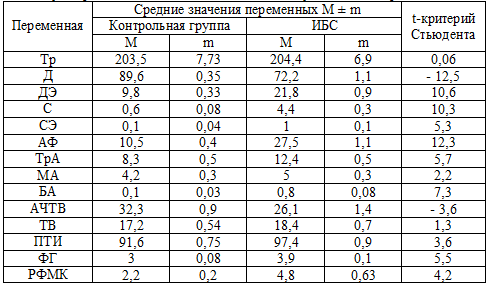
Таблица 1. Сравнение гемостазиологических параметров у здоровых людей и больных ИБС, не получавших дезагреганты
Примечание: критическое значение t-критерия Стьюдента принято равным 1,96; Тр
– тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ -
сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА
- малые агрегаты, БА – большие агрегаты, АЧТВ – активированное частичное
тромбиновое время, ПТИ - протромбиновый индекс.
Базисное лечение ИБС оказывает ингибирующее влияние на агрегацию тромбоцитов,
реакцию высвобождения и продукцию ТхА2, а также стимулирует
образование PgI2. Однако наше исследование
показало значительную внутрисосудистую активацию тромбоцитов у пациентов со
стабильным течением ИБС, лечившихся по «классической» схеме, без одновременного
приема дезагрегантов, в сравнении с контрольной группой.
При анализе полученных данных выявлено, что только средний уровень общего
числа тромбоцитов примерно одинаков у здоровых лиц и у лиц, страдающих ИБС.
Показатели, характеризующие внутрисосудистую активацию тромбоцитов, значительно
различаются в сравниваемых группах, причем эти различия высоко достоверны (р <
0,001). Суммарное количество активных форм тромбоцитов (АФ) превышает
аналогичный показатель у здоровых людей в 2,8 раза, число интактных форм (Д)
снижено более чем на 20%. Отмечается увеличение числа агрегатов и,
соответственно, тромбоцитов, вовлеченных в них. Обращает на себя внимание
восьмикратное повышение числа больших агрегатов тромбоцитов (БА) у больных с
ИБС.
У больных ИБС выявлена значительная внутрисосудистая активация тромбоцитов,
проявляющаяся в изменении их морфофункционального состояния. Такие изменения
являются закономерными и совпадают с данными других авторов о функциональных
свойствах тромбоцитов у пациентов, страдающих ИБС. Следовательно, результаты
нашего исследования не только подтверждают необходимость применения
дезагрегантов у больных ИБС стабильного течения, но и показывают степень
зависимости различных параметров тромбоцитарной активности от этого заболевания.
Анализ показателей скрининговой коагулограммы у больных ИБС стабильного
течения выявил значительную активацию плазменного звена гемостаза. У
обследованных лиц при сравнении с контрольной группой отмечены достоверные
различия таких показателей как ПТИ, АПТВ, содержание фибриногена. Повышение
уровня РФМК у пациентов с ИБС свидетельствует о наличии постоянного
внутрисосудистого свертывания крови, а значительное увеличение среднего
содержания СРБ – о системной воспалительной реакции.
Результаты проведенного исследования совпадают с данными других авторов,
свидетельствующих об изменениях в функционировании свертывающей системы крови у
пациентов с ИБС стабильного течения, характерных для гиперкоагуляционной фазы
ДВС-синдрома, а также о присутствии воспалительного компонента при развитии
атеросклеротического процесса. С целью выявления взаимосвязей между
показателями, характеризующими состояние свертывающей системы крови, использован
корреляционный анализ (рисунок ). Изучена корреляция параметров тромбоцитарной
активности между собой, а также с другими гемостазиологическими,
гематологическими, липидными показателями.
Выявлена выраженная корреляция между всеми параметрами внутрисосудистой
активности тромбоцитов. Интактные тромбоциты (Д) связаны обратной корреляционной
связью с ДЭ (r = - 0,8; p =
0,0001), С (r = - 0,3;
p = 0,01), СЭ (r = -0,5;
p = 0,0001), АФ (r = - 0,9;
p = 0,0001), ТрА (r = - 0,3; р =
0,01) и БА (r = -0,4; р = 0,005).
Нарастание уровня активности кровяных пластинок и их способности образовывать
агрегаты сопровождаются снижением числа Д и, наоборот, – уменьшение активности
тромбоцитов сопряжено с увеличением числа интактных форм. Прямая корреляционная
связь выявлена между ДЭ и общим числом АФ (r = 0,8;
p = 0,0001), при этом возрастает и способность
тромбоцитов образовывать агрегаты (рисунок 1).
Достоверная прямая корреляционная связь выявлена между ДЭ и числом ТрА (r
= 0,3; р = 0,01), что свидетельствует об их активном участии в
агрегатообразовании. В то же время ДЭ не связаны достоверно с числом С (r
= 0,09; р = 0,5) и СЭ (r = 0,2; р = 0,1).
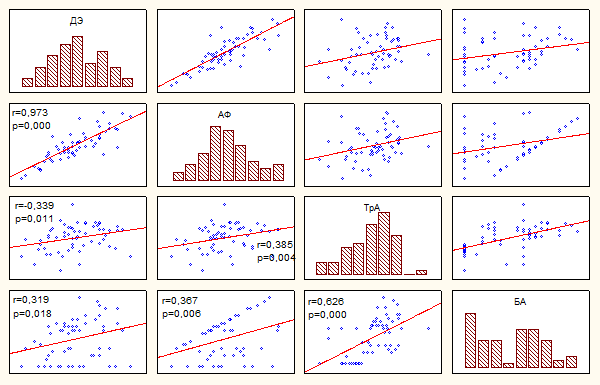
Рисунок 1. Корреляционные зависимости показателей активности тромбоцитов.
Между собой тесно коррелирует С и СЭ (r = 0,3; р =
0,01). Также выявлена прямая корреляционная связь этих параметров с числом АФ (r
= 0,3 и r = 0,6 соответственно; р < 0,01). В то же
время, число С достоверно не связано с числом ТрА (r =
0,1; р = 0,37) в отличие от числа СЭ, связь которых с этим показателем
статистически достоверна (r = 0,3; р = 0,02). Число ТрА
положительно и достоверно связано со всеми показателями, характеризующими
внутрисосудистую активацию тромбоцитов, кроме С (r = 0,1;
р = 0,37), и отрицательно – с числом Д (r = - 0,39; р = 0,003).
Помимо анализа связей показателей тромбоцитарной активности, проведен анализ
их корреляции с гематологическими параметрами, показателями плазменного
гемостаза, липидного профиля. Число Д коррелирует с уровнем гемоглобина (r
= - 0,27; р = 0,047); С – с ПТИ (r = - 0,39; р = 0,016);
СЭ – с концентрацией гемоглобина (r = 0,35; р = 0,008),
ЛВП (r = - 0,5; р = 0,0001) и коэффициентом атерогенности
(r = 0,42; р = 0,03); ТрА – с числом лейкоцитов (r
= - 0,3; р = 0,03) и B-ЛП (r = -
0,53; р = 0,0001); МА – с АЧТВ (r = -0,38; р = 0,0001) и
ТВ (r = - 0,34; р = 0,04); БА – с уровнем фибриногена (r
= - 0,34; р = 0,04), лейкоцитов (r = - 0,28; р = 0,04), и
ЛВП (r = - 0,46; р = 0,02).
По мере нарастания способности тромбоцитов образовывать агрегаты снижалось
число свободно циркулирующих лейкоцитов. Это может быть связано с потреблением
последних в тромбоцитарно-лейкоцитарные агрегаты, формирующиеся при
прогрессировании ИБС (рисунок 2).
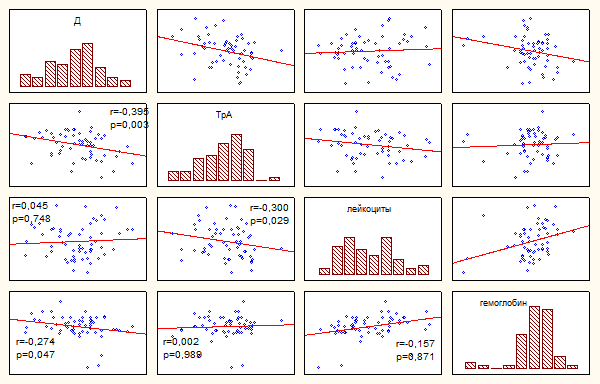
Рисунок 2. Корреляционные зависимости показателей активности тромбоцитов,
лейкоцитов, гемоглобина.
Как видно из представленных данных, с увеличением активности кровяных
пластинок нарастает уровень B-ЛП, коэффициент атерогенности. При этом уровень ЛВП снижается, что может свидетельствовать о
связи тромбоцитарного звена системы гемостаза и процессов атерогенеза. Между
компонентами свертывающей системы, гематологическими характеристиками и
показателями липидного обмена существуют сложные разнонаправленные взаимосвязи,
обусловливающие при нарушении функции одного из звеньев формирование цепи
патологических реакций, способствующих прогрессированию атеросклероза и ИБС.
Таким образом, повышенная активность тромбоцитов и дисфункция эндотелия
играют ведущую роль в формировании атеросклеротических изменений сосудов.
Активное участие в атерогенезе принимают и плазменные компоненты гемостаза,
способствуя развитию гиперкоагуляционного состояния, которое зачастую
трансформируется в тромбоз. Наиболее опасными и частыми для больных являются
тромбозы коронарных, церебральных, периферических артерий.
В этой связи сотрудничество врачей различных специальностей, занимающихся
лечением атеросклероза в разных сосудистых бассейнах, позволит оптимизировать
лечение и профилактику тромбообразования. Лечение острого тромбоза наиболее
эффективно при применении тромболитических и противотромботических препаратов –
антикоагулянтов и антиагрегантов, к которым может быть добавлена
внутриартериальная дилатационная ангиопластика или кардиохирургическая операция
по показаниям. Очевидно, что профилактика атеротромбоза должна воздействовать на
все составляющие его патогенеза и обязательно включать здоровый образ жизни,
борьбу с факторами риска атеросклероза, контроль состояния системы гемостаза,
прием лекарственных препаратов. |