
5.4. КОНСЕРВАТИВНОЕ ЛЕЧЕНИЕ
Лечение больных со стабильной стенокардией напряжения должно быть направлено
на устранение или уменьшение симптомов заболевания (в первую очередь – приступов
стенокардии), повышение толерантности к физической нагрузке, улучшение прогноза
заболевания и предупреждение возникновения нестабильной стенокардии, ИМ и
внезапной смерти.
Для достижения этих целей применяется комплекс лечебно-профилактических
мероприятий (немедикаментозное, медикаментозное и, при необходимости,
хирургическое лечение) и предусматривающий активное воздействие на основные
звенья патогенеза ИБС: антитромбоцитарная терапия (профилактика агрегации
тромбоцитов и пристеночного тромбообразования); антиангинальные (антиишемические)
ЛС (нитраты и молсидомин, β-адреноблокаторы, блокаторы медленных кальциевых
каналов); применение цитопротекторов; лечение и профилактика прогрессирования
дисфункции ЛЖ; медикаментозная и немедикаментозная коррекция основных ФР ИБС (ГЛП,
АГ, курения, ожирения, нарушений углеводного обмена); при необходимости -
лечение и профилактика нарушений ритма и проводимости; радикальное хирургическое
устранение обструкции КА (реваскуляризация миокарда). В настоящее время доказано
положительное влияние большинства из перечисленных направлений и способов
лечения на прогноз ИБС и частоту возникновения нестабильной стенокардии, ИМ и
внезапной смерти.
Антитромбоцитарная терапия
Проводится для профилактики “обострений” ИБС, возникновения нестабильной
стенокардии и ИМ. Она направлена на предотвращение пристеночного
тромбообразования и, в известной степени, на сохранение целостности фиброзной
оболочки атеросклеротической бляшки. Выше неоднократно упоминалось о том, что
в основе “обострений” ИБС и возникновения нестабильной стенокардии (НС) или ИМ
лежит разрыв атеросклеротической бляшки в КА с формированием на ее поверхности
вначале тромбоцитарного (“белого”), а затем фибринового (“красного”)
пристеночного тромба.
В результате разрыва атеросклеротической бляшки обнажаются субэндотелиальные
тканевые структуры и липидное ядро бляшек, содержимое которого попадает на
поверхность разрыва и в просвет сосуда. Обнажившиеся компоненты
соединительнотканного матрикса (коллаген, фактор Виллебранда, фибронектин,
лиминин, витронектин), а также детрит липидного ядра, содержащий тканевой
тромбопластин, активируют тромбоциты.
Последние с помощью гликопротеидных рецепторов (Iа, Ib), расположенных на
поверхности тромбоцитов, и фактора Виллебранда прилипают (адгезируют)
к поверхности поврежденной бляшки, образуя здесь монослой тромбоцитов, рыхло
связанных с поврежденным эндотелием. Активированные и изменившие свою форму
тромбоциты высвобождают индукторы последующей взрывной самоускоряющейся
агрегации: АДФ, серотонин, фактор 3 и фактор 4 тромбоцитов, тромбоксан,
адреналин (“реакция высвобождения”). Одновременно активируется метаболизм
арахидоновой кислоты и при участии ферментов циклооксигеназы и тромбоксансинтетазы
образуется тромбоксан А2, который также обладает мощным агрегирующим,
а также вазоконстрикторным действием.
В результате возникает вторая волна агрегации тромбоцитов и образуется
тромбоцитарный агрегат (“белый” тромб). В процессе этой стадии агрегации
тромбоциты плотно связываются друг с другом с помощью молекул фибриногена,
которые, взаимодействуя с рецепторами IIb/IIIа тромбоцитов, плотно “сшивают”
кровяные пластинки между собой. Одновременно с помощью фактора Виллебранда
тромбоциты прикрепляются к подлежащему субэндотелию.
В дальнейшем активируется система коагуляции гемостаза и образуется
фибриновый тромб. Адгезия и агрегация тромбоцитов - это первый начальный этап
тромбообразования, важнейшими звеньями которого являются: функционирование
специфических рецепторов тромбоцитов (Iа, Ib, IIb/IIIа ), обеспечивающих адгезию
и окончательную агрегацию кровяных пластинок, и активация метаболизма
арахидоновой кислоты.
Действие тромбоксана А2 (ТхА2) и простациклина на
агрегацию тромбоцитов реализуется благодаря их различному влиянию на
аденилатциклазу, под действием которой АТФ превращается в цАМФ: тромбоксан А2
ингибирует это превращение, а простациклин - активирует. Высокие концентрации
цАМФ угнетают агрегацию тромбоцитов, тогда как уменьшение концентрации,
наоборот, способствует агрегации. Именно поэтому простациклин, активирующий
аденилатциклазу и увеличивающий содержание цАМФ, ингибирует адгезию, агрегацию и
реакцию высвобождения тромбоцитов, а тромбоксан А2, наоборот, угнетая
аденилатциклазу, замедляет переход АТФ в цАМФ. В результате уменьшается
концентрация цАМФ, что способствует усилению адгезии и агрегации тромбоцитов.
Большое значение имеют дальнейшие превращения цАМФ и АТФ: цАМФ инактивируется
(уменьшая свою концентрацию в клетке) адениловой фосфодиэстеразой. АТФ
“распадается” под действием АТФ-азы на фосфорную кислоту и аденозин, инактивация
которых осуществляется под действием аденозиндезаминазы.
При увеличении активности адениловой фосфодиэстеразы уменьшается концентрация
цАМФ, что способствует агрегации тромбоцитов. Активация аденозиндезаминазы
приводит к снижению концентрации аденозина и преобладанию вазоконстрикторных
эффектов. Описанные схемы тромбоцитарно-сосудистого гемостаза, а также
метаболизма арахидоновой кислоты следует учитывать при назначении тех или иных
ЛС, обладающих антитромбоцитарным эффектом.
В настоящее время наиболее широкое распространение в клинической практике
получили следующие антитромбоцитарные препараты: аспирин (ацетилсалициловая
кислота); тиклопидин (тиклид); клопидогрель; курантил (дипиридамол).
Ацетилсалициловая кислота
В 1899 году F. Hoffmann и
A. Bayer из фармацевтической
компании «Bayer» синтезировали ацетилсалициловую кислоту
(АСК) и назвали ее аспирином. Первые сообщения о возможности применения АСК при
ССЗ стали публиковаться в 50-х годах XX века.
L. Craven отметил геморрагические
проявления после применения ASA и использовал эффект
снижения свертываемости крови для профилактики ИМ у 8000 пациентов, получив
успешные результаты.
Антитромбоцитарное действие аспирина было установлено H.J.
Weiss, L.M.
Aledort в 1967 году. Спустя четыре года J.R.
Vane выявил способность АСК ингибировать синтез
простациклина. В 1975 году G.J.
Roth и P.W.
Majerus установили присущее АСК свойство ацетилировать
циклооксигеназу.
Ингибирование циклооксигеназы тромбоцитов сопровождается уменьшением
образования тромбоксана А2 и, следовательно, уменьшением агрегации
тромбоцитов и вазоконстрикторного действия тромбоксана. Угнетение
циклооксигеназы сосудистого эндотелия приводит к уменьшению образования
простациклина. Это способствует уменьшению его вазодилатирующего и
антиагрегантного действия (рисунок 8).
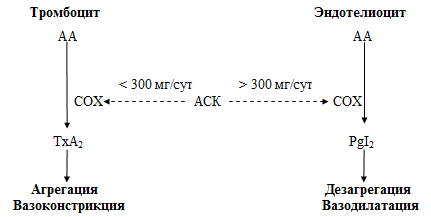
Рисунок 8. Механизм действия ацетилсалициловой кислоты трансформация, ингибиция
Циклооксигеназа тромбоцитов чувствительна даже к малым дозам аспирина (75–160
мг в сутки), тогда как нежелательное угнетение образования простациклина
происходит только при сравнительно высоких суточных дозах этого ЛС. Поэтому
больным ИБС рекомендуют обычно прием малых доз препарата, не превышающих 75–160
мг в сутки.
Действие аспирина на циклооксигеназу тромбоцитов необратимо и эффект
препарата сохраняется на протяжении всей жизни тромбоцита, в течение 8–10 дней.
По данным международного многоцентрового широкомасштабного исследования (Second
International Study of Infarct Survival, ISIS-2, 1990), применение аспирина
снижало летальность больных от сердечно-сосудистых причин на 23% по сравнению
с плацебо.
Согласно Рекомендациям VII конференции Американской
коллегии торакальных врачей по антитромботической и тромболитической терапии
(2004) достаточной для длительного применения у пациентов высокого риска
развития сосудистых осложнений признана доза АСК 75-100 мг/сутки (таблица 20).
Применение АСК в низких дозах обеспечивает выраженный противотромботический
эффект и позволяет свести к минимуму риск побочных реакций.
При неотложных клинических состояниях, таких как острый коронарный синдром (ОКС)
или острый ишемический инсульт, когда необходимо быстрое и полное ингибирование
ТхА2-зависимой агрегации тромбоцитов, показано использование
нагрузочной дозы АСК (≥ 160 мг).
Таблица 20. Сердечно-сосудистые заболевания, при которых установлена эффективность аспирина и его минимальная эффективная доза
| Состояния |
Минимальная эффективная доза, мг/сутки |
| Острый инфаркт миокарда |
160 |
| Острый ишемический инсульт * |
160 |
| Мужчины группы высокого риска ССЗ |
75 |
| Артериальная гипертензия |
75 |
| Стабильная стенокардия |
75 |
| Нестабильная стенокардия * |
75 |
| Транзиторная ишемическая атака или ишемический
инсульт * |
50 |
| Выраженный стеноз сонных артерий * |
75 |
Примечание: * - назначение большей дозы не обеспечивало снижения риска.
Применение аспирина у больных ИБС и АГ уменьшало частоту летальных и нелетальных
ИМ на 36%, а летальность от коронарных осложнений - на 15% (Hypertension Optimal
Treatment, HOT, включившее 26000 пациентов). Эффективность малых (менее 160 мг
в сутки), средних (160–325 мг в сутки) и высоких (500–1500 мг в сутки) доз
аспирина оказалась примерно одинаковой. Это позволяет рекомендовать аспирин
в суточной дозе 50-160 мг в сутки для длительного лечения больных ИБС. Обычно
используют дозы 75-150 мг в сутки. Лечение аспирином должно проводиться
в течение всей жизни больного.
При использовании малых доз препарата серьезные побочные эффекты, требующие
отмены препарата, развиваются сравнительно редко. Следует учитывать возможность
возникновения следующих нежелательных явлений: небольшие болевые ощущения в эпигастрии
(20–30%); диспептические явления: тошнота, диарея, изредка рвота;
желудочно-кишечные и другие кровотечения (5–8%); бронхоспазм;
гиперчувствительность к препарату. Риск возникновения побочных эффектов при
приеме аспирина можно уменьшить, если использовать минимальные дозы препарата
или его новые лекарственные формы (аспирин-кардио).
Назначение АСК противопоказано в следующих случаях: при обострении язвенной
болезни желудка и двенадцатиперстной кишки; при геморрагическом диатезе; в
возрасте до 12 лет; при беременности (последний триместр); при повышенной
чувствительности к салицилатам. Надо с осторожностью применять аспирин
у больных, страдающих бронхиальной астмой, при неконтролируемой АГ, при
одновременной терапии антикоагулянтами, наличии язвенной болезни желудка
и двенадцатиперстной кишки в анамнезе, в первом и втором триместрах
беременности.
У отдельных лиц отмечается резистентность к АСК, встречающаяся в 15-45%
случаев. Этот эффект отмечается исходно или через несколько месяцев лечения АСК.
С клинической точки зрения под резистентностью к АСК подразумевается развитие
тромботических осложнений на фоне регулярного ее приема. Возможными механизмами
устойчивости к АСК могут быть: низкая приверженность к лечению (non-compliance),
неадекватная доза препарата, низкая абсорбция препарата (АСК в энтеральной
оболочке), усиленное образование тромбоцитов, повышенная чувствительность
кровяных пластинок к АДФ и коллагену, неполное подавление образования ТхА2,
полиморфизмы генов рецепторов GPIIb-IIIa,
COX-1, COX-2, ТхА2,
стресс-индуцированная экспрессия COX-2 в тромбоцитах,
курение, гиперлипидемия, физическая нагрузка, стресс.
Осуществляются попытки оценивать эффективность АСК и прогнозировать ее
клиническую активность с использованием лабораторных методов. Контроль
чувствительности к АСК можно проводить с помощью агрегометров по динамике
снижения функциональной активности тромбоцитов на фоне приема препарата.
Критерием эффективности считается снижение показателей агрегатограммы в 3-4 раза
от исходного уровня. В последние годы для оценки чувствительности к
антитромбоцитарному действию АСК используют определение концентрации в моче
11-дегидротромбоксана (В2-метаболита ТхА2).
При достаточной чувствительности к АСК количество 11-дегидротромбоксана В2
в моче снижается. По данным рандомизированного исследования НОРЕ (2001) у
АСК-резистентных больных его содержание увеличено в 1,8 раза. Однако ни один из
этих методов в настоящее время не рекомендован Европейским обществом кардиологов
для оценки эффекта АСК.
С целью мониторирования эффективности АСК-терапии успешно применяется метод
оценки внутрисосудистой активации тромбоцитов (ВАТ), характеризующий их
внутрисосудистую активацию и агрегацию. Это позволяет оценивать чувствительность
к АСК и индивидуально подбирать эффективную дозу препарата. Метод показал
большую специфичность в выявлении функциональной активности тромбоцитов по
сравнению с фотометрическим методом регистрации индуцированной агрегации
кровяных пластинок и методом визуальной оценки агрегации ex
vivo.
В нашем исследовании использовалась оценка АТ в контроле эффективности
дезагрегантной терапии. Для определения эффекта медикаментозной терапии с
применением ацетилсалициловой кислоты проведено сравнение параметров активности
тромбоцитов у 89 больных ИБС, не принимавших АСК и у 54 больных ИБС, принимающих
кардиомагнил по 75 мг/сутки (таблица 21).
Из полученных данных следует, что значения большинства показателей
различаются. На фоне приема АСК параметры активности тромбоцитов достоверно
ниже, чем без ее приема. Исключением является показатель МА, который даже
несколько выше, чем у лиц, не принимавших АСК. Однако это отличие не достоверно.
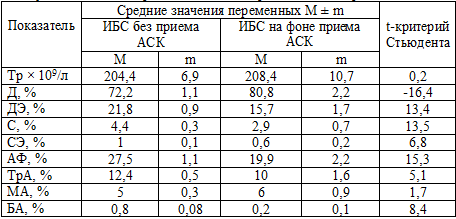
Таблица 21. Сравнение параметров активности тромбоцитов у больных ИБС, принимавших и не принимавших кардиомагнил
Примечание: критическое значение t-критерия Стьюдента принято равным 1,96; Тр
– тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ -
сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА
- малые агрегаты, БА – большие агрегаты.
Наименьшее влияние прием кардиомагнила оказывал на МА. Показатель МА
увеличивался на фоне лечения, а число БА и интегральный показатель
агрегатообразования (ТрА) уменьшался (рисунок 9). Вследствие воздействия
кардиомагнила происходило снижение способности тромбоцитов образовывать
агрегаты, в первую очередь, за счет уменьшения числа БА.
Эти изменения являлись признаками эффективности проводимого лечения. Однако
вследствие сохраняющейся активации, кровяные пластинки продолжали агрегировать.
Образующиеся малые агрегаты не объединялись в большие агрегаты. Этим обусловлено
повышение числа МА на фоне лечения кардиомагнилом.
Обращает на себя внимание значительное увеличение на фоне применения АСК
дисперсии всех показателей, характеризующей размах отклонений от среднего. Этот
факт свидетельствует о том, что при общем уменьшении активности тромбоцитов у
части пациентов сохранялись высокие ее показатели.
Отмечалась разная чувствительность больных к проводимому лечению, что,
вероятно, обусловлено резистентностью отдельных лиц к АСК. Для определения
частоты встречаемости этого состояния среди наших пациентов проведено сравнение
степеней активности изучаемых показателей до применения АСК и на фоне ее приема.
Доля больных ИБС, устойчивых к проводимому лечению, составила 33,3%.
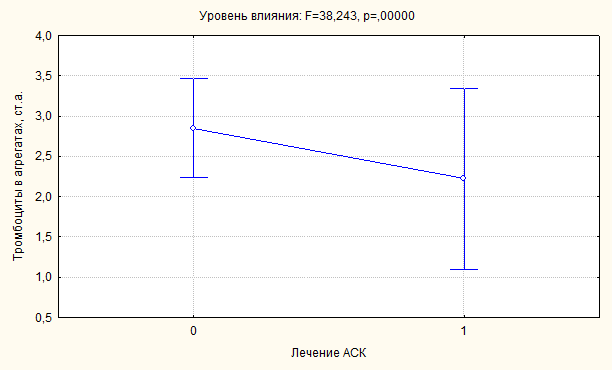
Рисунок 9. Влияние лечения кардиомагнилом на дисперсию тромбоцитов в
агрегатах.
Тиклопидин
Тиклопидин (тиклид) является производным тиенопиридина и обладает отчетливыми
антитромбоцитарными свойствами. Под действием тиклопидина блокируются
АДФ-рецепторы тромбоцитов, подавляется адгезия кровяных пластинок, а также
уменьшается связывание фибриногена с IIb/IIIа рецепторами тромбоцитов на
заключительном этапе агрегации. Хотя эффект тиклопидина сопоставим с таковым
аспирина, а по некоторым данным (исследования CATS, TASS) превышает его, он
редко применяется для длительного лечения больных ИБС в связи с возможными
побочными явлениями в виде развития нейтропении, панцитопении и повышения
содержания ЛНП, ЛОНП.
Тиклопидин используют в кардиохирургической практике в виде коротких (1–2
месяца) курсов антитромбоцитарной терапии после операции аортокоронарного
шунтирования или чрескожной транслюминальной баллонной ангиопластики. Препарат
назначают в дозе 500 мг в сутки в 2 приема. Терапевтический эффект наступает
только через 3–5 дней после начала лечения и сохраняется в течение10 дней после
отмены препарата. Необходим контроль анализа крови каждые 2 недели, по крайней
мере, в течение первых 3-х месяцев лечения.
Побочные эффекты при приеме тиклопидина: диспептические расстройства;
крапивница; эритематозные сыпи; геморрагические осложнения; лейкопения,
агранулоцитоз, панцитопения; повышение содержания ЛНП и ЛОНП. Прием тиклопидина
противопоказан в следующих клинических ситуациях: геморрагические диатезы, в том
числе геморрагические инсульты; язвенная болезнь желудка и двенадцатиперстной
кишки; лейкопения, тромбоцитопения, агранулоцитоз в анамнезе; тяжелые поражения
печени; гиперчувствительность к препарату; беременность и кормление грудью.
Клопидогрель
Клопидогрель также является производным тиенопиридина и по механизму действия
мало отличается от тиклопидина. Его эффективность выше, а риск возникновения
нейтропении, тромбоцитопении, панцитопении, геморрагий и диспептических
расстройств меньше. Препарат принимают однократно в дозе 75 мг в сутки. Побочные
эффекты и противопоказания к применению те же, что и у тиклопидина.
In vivo клопидогрель трансформируется печенью в
ингибитор тромбоцитов, вызывающий дефект в их белковых структурах. Этот дефект
можно устранен после полной замены кровяных пластинок, что обосновывает
однократный прием препарата, несмотря на короткий период полувыведения. При
ежедневном приеме 50-100 мг клопидогреля угнетение агрегации происходит на 2-й
день и достигает устойчивого уровня после 4-7 дней лечения. Наши исследования
также подтверждают эти данные.
Согласно данным З.С. Баркагана с соавт. (2005) при длительном использовании
клопидогреля с антиагрегантной целью у большинства больных ИБС возможно
применение половинной и четвертной суточной дозы препарата. Это обусловлено
увеличением активности в плазме физиологического антикоагулянта АТIII,
которое связывают с противовоспалительным действием клопидогреля и его
способностью устранять проявления эндотелиоза. Есть данные о снижении
чувствительности тромбоцитов к клопидогрелю при сочетанном лечении с
гиполипидемическими препаратами.
Учитывая разные механизмы антитромбоцитарного действия клопидогреля и АСК,
возможно комбинированное применение этих препаратов. Исследование CURE (2001)
показало, что использование комбинации клопидогреля с АСК рекомендовано всем
больным с острым коронарным синдромом (ОКС) без подъема сегмента
ST на ЭКГ как в случае проведения чрескожного вмешательства на коронарных
артериях (ЧТКА), так и без планируемой реваскуляризации миокарда.
При этом доза АСК в комбинации с клопидогрелем не должна превышать
100 мг/сутки. Длительное применение клопидогреля и АСК (до 1 года) приводит к
значительному снижению риска неблагоприятных сердечно-сосудистых исходов после
коронарной ангиопластики. Однако на фоне комбинированной терапии частота
серьезных кровотечений возрастает и четко зависит от дозы АСК.
Малочувствительным к действию АСК больным (9 человек) назначен плавикс (75
мг/сутки), препарат из группы тиенопиридинов. Для оценки влияния
антитромбоцитарной терапии с использованием клопидогреля на показатели
тромбоцитарной активности, применялся дисперсионный анализ. На рисунке 10
представлена динамика средних значений и размах отклонений интегрального
показателя агрегатообразования (ТрА).
Отмечается выраженное снижение среднего значения этого параметра. Однако
размах отклонений увеличивается, что свидетельствует о наличии у больных ИБС,
устойчивых к проведению антитромбоцитарной терапии. Подобная динамика
зарегистрирована на графиках, описывающих все параметры тромбоцитарной
активности.
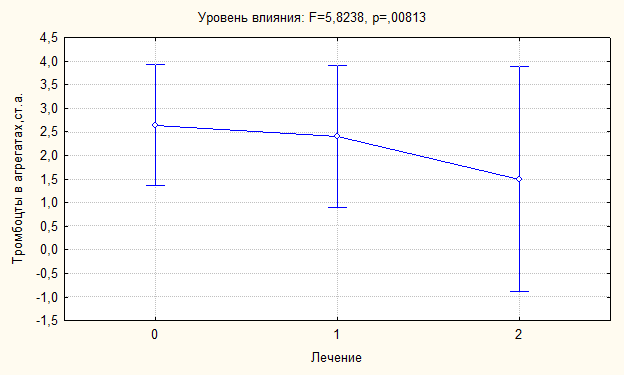
Рисунок 10. Влияние лечения антитромбоцитарными препаратами на дисперсию
числа тромбоцитов в агрегатах.
Примечание: 0 – без лечения, 1 – на фоне лечения АСК, 2 – на фоне лечения клопидогрелем.
По нашим данным 10-25% больных ИБС, принимающих клопидогрель, были устойчивы
к его действию. У одного пациента на фоне приема клопидогреля значения изучаемых
показателей тромбоцитарной активности оставались значительно выше нормальных.
Именно эти «выскакивающие» величины и давали выраженную дисперсию,
зафиксированную на графиках, описывающих результаты дисперсионного анализа.
Таким образом, устойчивость к антитромбоцитарному действию клопидогреля была
выявлена у одного пациента, что составило 11%. Учитывая малое число наблюдений,
делать статистически значимые выводы не представляется возможным и требует
проведения дополнительных клинических исследований.
Применение ASA у больных ИБС
Назначение антитромбоцитарных препаратов в терапии клинических проявлений
атеротромбоза является общепризнанным. В качестве основных лекарственных средств
используют ацетилсалициловую кислоту, тиенопиридины, блокаторы рецепторов
GPIIb-IIIa. Последние редко
применяются вследствие своей дороговизны. Наиболее доступным и широко
применяемым антитромбоцитарным препаратом является ASA.
По данным метаанализа около 100 рандомизированных клинических исследований,
проведенных у больных групп высокого риска, терапия ASA
приводит к снижению риска сосудистой смертности примерно на 15% и нефатальных
сосудистых осложнений на 30%.
В настоящее время доминирует точка зрения, согласно которой все больные ИБС
независимо от наличия в анамнезе инфаркта миокарда (ИМ) должны принимать
ASA с целью профилактики развития сердечно-сосудистых
осложнений при отсутствии противопоказаний (Аронов Д.М., Лупанов В.П., 2004). В
литературе нет данных исследований, оценивающих параметры внутрисосудистой
активации тромбоцитов у пациентов, перенесших инфаркт миокарда, в сравнении с
больными ИБС, не отмечавших его в анамнезе.
Мы изучили показатели функциональной активности тромбоцитов у пациентов этих
двух групп в сравнительном аспекте для определения необходимости проведения
дезагрегантной терапии в зависимости от наличия в анамнезе указаний на
перенесенный ИМ. В зависимости от кардиологического анамнеза пациентов было две
группы больных. Пациенты, входящие в первую группу, указывали на перенесенный ИМ
в анамнезе.
Длительность ИБС у них составляла 5,3 ± 0,2 года. Пациенты второй группы
отрицали наличие ИМ в анамнезе. Длительность заболевания в этой группе больных
составляла 4,8 ± 0,47 года. Все пациенты в течение 10 дней до исследования
параметров внутрисосудистой активности кровяных пластинок не принимали
антитромбоцитарные препараты. Результаты сравнения функциональной активности
тромбоцитов в этих двух группах представлены в таблице 22.
Показатели тромбоцитарной активности у пациентов сравниваемых групп
практически не различались. С целью выявления сложных нелинейных взаимосвязей
между изучаемыми параметрами, характеризующими функциональную активность
тромбоцитов и фактом перенесенного ИМ, использовали дисперсионный анализ. Однако
этот вариант анализа с высокой достоверностью показал отсутствие различий в
сравниваемых группах (р < 0,001).
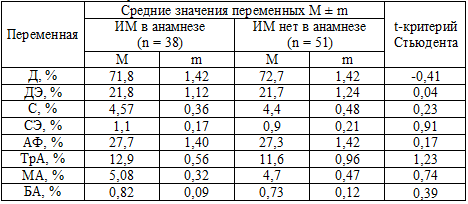
Таблица 22. Сравнение показателей активности тромбоцитов у больных ИМ и без ИМ в анамнезе
Примечание: критическое значение t-критерия Стьюдента принято равным
1,96; Тр – тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ -
сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА
- малые агрегаты, БА – большие агрегаты.
В качестве примера приводим графическое изображение результатов
однофакторного дисперсионного анализа по интегральному показателю тромбоцитарной
активности – общему числу активных форм тромбоцитов АФ (рисунок 11), на котором
четко видно отсутствие различий средних значений изученных показателей.
Однако дисперсия этого показателя при наличии в анамнезе ИМ имеет меньший
размах, что указывает на более плотное распределение значений и меньшую их
вариативность у пациентов, перенесших ИМ. Этот факт свидетельствует о
стабилизации повышенного уровня тромбоцитарной активности и минимальном
«разбросе» значений вокруг среднего, то есть о формировании устойчивой
гиперреактивности кровяных пластинок после перенесенного ИМ.
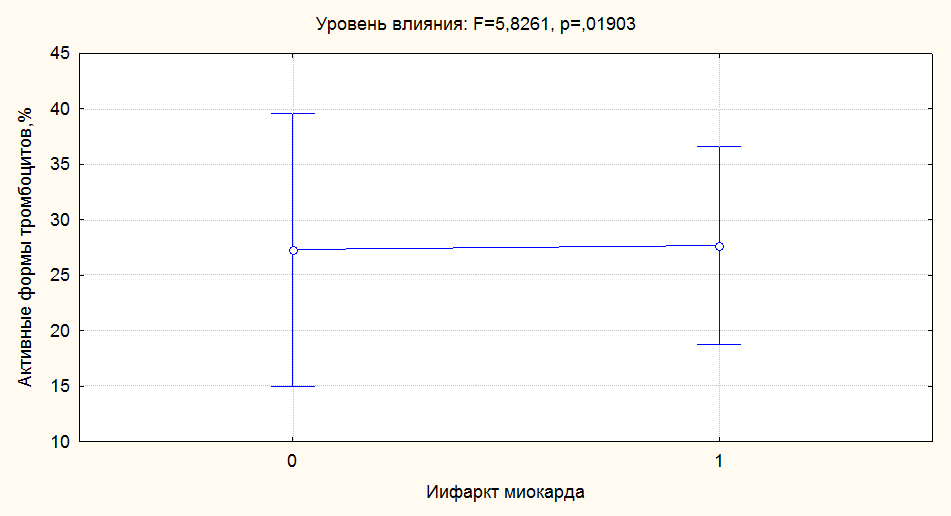
Рисунок 11. Влияние фактора перенесенного ИМ на дисперсию активных форм
тромбоцитов.
Примечание: 0 –ИМ в анамнезе нет, 1 – ИМ в анамнезе
Таким образом, отсутствие у пациента в анамнезе перенесенного ИМ не может
являться основанием для отсутствия в схеме лечения ИБС препаратов
антитромбоцитарного действия, что согласуется с современными тенденциями в
лечении CCЗ, связанных с атеросклерозом.
Курантил
Курантил (дипиридамол) является высокоэффективным антитромбоцитарным
препаратом, обладающим выраженными вазодилатирующими свойствами. Его эффект
связан с конкурентным ингибированием адениловой фосфодиэстеразы и с повышением
содержания цАМФ в тромбоцитах, что способствует снижению их способности
к агрегации. Препарат угнетает активность аденозиндезаминазы, что приводит
к увеличению содержания аденозина - эффективного вазодилатирующего
биологического агента. Это объясняет наличие выраженного вазодилатирующего
эффекта, проявляющегося преимущественно на уровне резистивных сосудов (артериол).
Имеются данные о положительном влиянии курантила на эндотелиальную функцию.
Такое сочетание делает препарат незаменимым при длительном лечении больных со
стабильной стенокардией. С этой целью курантил назначают в дозе 225 мг в сутки
(75 мг 3 раза в день). Теофиллин и некоторые пищевые продукты, содержащие
производные ксантинов (кофе, крепкий чай), являясь антагонистами курантила,
значительно снижают его эффективность. По данным масштабных
плацебо-контролируемых исследований длительный прием курантила в дозе 225
мг/сутки позволяет снизить число ИМ и внезапной сердечной смерти на 24–30%,
смертность от сердечно-сосудистых заболеваний - на 15%. Терапевтический эффект
курантила сопоставим с эффектом аспирина, но число геморрагических осложнений
существенно меньше.
Нежелательные эффекты при длительном приеме курантила встречаются
относительно редко, в основном при назначении дозы препарата, превышающей 200 мг
в сутки. Они связаны с вазодилатирующим эффектом курантила: головные боли,
головокружения, шум в ушах, гиперемия кожи лица, небольшая тахикардия. Возможны
также диспептические явления (тошнота, диарея, боли в эпигастральной области).
Противопоказания: острый ИМ или нестабильная стенокардия; стабильная стенокардия
IV ФК; субаортальный стеноз; тяжелая почечная и сердечная недостаточность;
выраженные нарушения сердечного ритма; выраженный геморрагический синдром;
повышенная чувствительность к препарату.
Антиангинальные средства
Антиангинальные ЛС - препараты, обладающие свойством предупреждать или
купировать приступы стенокардии и уменьшать другие проявления преходящей ишемии
миокарда. Это основная группа ЛС, которые используются для лечения больных
ИБС со стабильной стенокардией напряжения. Действие всех антиангинальных ЛС при
ИБС основано на гемодинамической разгрузке миокарда и изменении соотношения
потребления миокардом кислорода и реальным коронарным кровообращением.
В клинической практике обычно используют 3 группы антиангинальных ЛС: 1. Нитраты
и молсидомин. 2. β-адреноблокаторы. 3. Блокаторы медленных кальциевых каналов
(антагонисты кальция).
Нитраты и молсидомин
Нитраты являются в настоящее время основными ЛС, которые используются для
купирования и профилактики приступов стенокардии. Впервые эта уникальная
способность нитроглицерина была продемонстрирована W. Murrel (1879). Механизм
действия нитратов на гладкомышечные клетки сосудистой стенки тесно связан
с функцией эндотелия. В сосудах здорового человека любое воздействие на
эндотелий вызывает эндотелийзависимую релаксацию сосуда, в основе которой лежит
усиленная продукция расслабляющих факторов, в первую очередь, оксида азота (NO).
Последний не только предотвращает сосудистый спазм, но и вместе с простациклином
ингибирует процесс адгезии и агрегации тромбоцитов, выполняя важную защитную
роль и участвуя в регуляции местного сосудистого тонуса, пристеночной агрегации
тромбоцитов.
У больных ИБС резко снижена продукция эндотелиального расслабляющего фактора
(NО) и других дилатирующих факторов и, наоборот, повышена продукция
вазоконстрикторных субстанций. Это один из главных факторов, способствующих
нарушению коронарного кровотока и прогрессированию заболевания. Органические
нитраты (эфиры фосфорной кислоты) при парентеральном введении или сублингвальном
применении быстро проникают внутрь сосудистого эндотелия и гладкомышечной
клетки, являясь источником экзогенного оксида азота (NО). Включаясь в клеточный
метаболизм, они обеспечивают релаксацию сосудов и в известной степени угнетают
процесс агрегации тромбоцитов. Для внутриклеточного превращения органических
нитратов в оксид азота (NО) требуются соединения, содержащие сульфгидрильные (SH)
группы (цистеин).
Под действием нитратов происходит умеренная дилатация артерий и артериол,
снижение ОПСС, постнагрузки. Однако этот эффект достигается при более высоких
концентрациях нитратов, чем при венодилатирующем эффекте: максимальное
расширение вен происходит уже после сублингвального применения 0,1–0,2 мг
нитроглицерина, тогда как расширение артериол - при приеме 0,4–0,6 мг
нитроглицерина. Непосредственное коронарорасширяющее действие нитратов в дозах,
используемых в клинике, выражено незначительно и не имеет определяющего значения
в формировании антиангинального действия.
Прием нитратов сопровождается увеличением коронарного кровотока за счет
уменьшения КДО и КДД ЛЖ, что сопровождается уменьшением диастолического
напряжения стенки желудочка, увеличением градиента давления, величины
коронарного кровотока. Когда имеется выраженное повышение тонуса КА (спазм),
нитроглицерин и другие нитраты способны активно воздействовать на стенку крупной
КА в месте ее сужения. Этот эффект приобретает особенно важное значение
у больных вазоспастической стенокардией Принцметала. Нитраты обладают умеренно
выраженным антитромбоцитарным действием.
Для лечения больных ИБС широко используются три группы нитратов:
нитроглицерин, изосорбида динитрата, изосорбида 5-мононитрат. С практической
точки зрения целесообразно условное деление всех нитратов и их лекарственных
форм в зависимости от продолжительности их действия: 1. Нитраты короткого
действия (длительность эффекта до 1 часа). 2. Нитраты умеренно пролонгированного
действия (длительность эффекта от 1 ч до 6 ч). 3. Нитраты значительно
пролонгированного действия (длительность эффекта от 6 ч до 24 ч).
Механизм действия всех нитратов практически одинаков. Они отличаются
в основном по своим фармакокинетическим свойствам и по биодоступности, величине
и скорости наступления антиангинального эффекта, продолжительности действия
и некоторым другим параметрам (таблица 23).
Таблица 23. Антиангинальное действие нитратов и молсидомина
| Путь введения |
Лекарственные формы |
Начало действия |
Время наступления макс. эффекта |
Продолжительность действия |
| Нитроглицерин (НГ) |
| Сублингвально |
Табл., 0,5 мг |
1–3 мин |
5–6 мин |
10–20 мин |
| Перорально |
Аэрозоль |
1–2 мин |
3–5 мин |
20 мин |
| Буккально |
Полимерные пленки |
2–3 мин |
30–60 мин |
3–5 ч |
| Трансдермально |
Мази |
15–60 мин |
1–2 ч |
3–4 ч (до 6 ч) |
| Пластырь |
ТТС |
30 мин |
3–4 ч |
7–8 ч (до 20 ч) |
| Внутрь |
Табл.депо-НГ, 6,4 мг |
20–30 мин |
1 ч |
3–4 ч |
| Изосорбида динитрат (ИДН) |
| Перорально |
Аэрозоль |
1–2 мин |
2–5 мин |
1 ч |
| Сублингвал. |
Табл., 10 мг |
2,5–10 мин |
20–40 мин |
1–2 ч |
| Внутрь |
Табл., 10 мг, 20 мг |
20–40 мин |
1 ч |
3–4 ч |
| Внутрь |
Табл.-ретард, 20мг, 40мг |
30–40 мин |
2–3 ч |
4–6 ч (до 7–8 ч) |
| Внутрь |
Табл.-ретард, 60 мг, 120 мг |
30–50 мин |
3–5 ч |
12–15 ч |
| Изосорбид-5-мононитрат (ИМН) |
| Внутрь |
Табл., 20 мг |
30–50 мин |
2–3 ч |
4–6 ч |
| Внутрь |
Табл., 40 мг |
30–50 мин |
2–3 ч |
6–8 ч |
| Внутрь |
Табл.-ретард, 50–100 мг |
30–50 мин |
2–3 ч |
8–12 ч (до 24 ч) |
| Молсидомин |
| Внутрь |
Табл. 2 мг, 4 мг, 8 мг |
20 мин |
30–60 мин |
4–6 ч |
Таблетки депо-нитроглицерина, содержащие микрокапсулы с активным веществом,
постепенно растворяющиеся в кишечнике (сустак-форте, нитронг-форте), отличаются
весьма умеренным антиангинальным эффектом. Это связано с тем, что большая часть
нитроглицерина при энтеральном способе введения (около 80–90%) инактивируется
ферментными системами печени и в системный кровоток попадает лишь малая часть
принятой внутрь дозы препарата. Антиангинальное действие препаратов
депо-нитроглицерина, содержащих от 2,5 мг до 5 мг активного вещества (сустак-мите,
нитронг-мите), не отличается от эффекта плацебо. Поэтому эти препараты не должны
использоваться в лечении больных ИБС.
Препараты изосорбида динитрата (ИДН) являются одними из самых
распространенных антиангинальных ЛС (нитросорбид, изо мак, изодинит, изокет,
кардикет). При приеме внутрь они практически полностью абсорбируются
в кишечнике, однако в системный кровоток попадает всего 10–20%. Остальная часть
элиминируется в печени. При деградации изосорбида динитрата образуются его
активные метаболиты, в том числе изосорбид-5-мононитрат, который обладает
самостоятельными вазодилатирующими свойствами.
Лечение препаратами изосорбида динитрата рекомендуют начинать с разовой дозы
10 мг, которая по эффективности сопоставима с действием сустака-форте или
нитронга-форте. Поэтому после некоторого периода применения препарата в дозе
10 мг следует перевести больного на прием более эффективных разовых доз ИДН по
20 мг или ИДН-ретард по 40 мг. Продолжительность действия этих ЛС колеблется от
3–4 ч (разовая доза 10 мг) до 4–6 ч (ретардные таблетки 40 мг). В последние годы
используются две ретардные формы изосорбида динитрата, которые содержат 60 мг
и 120 мг активного вещества. Продолжительность их антиангинального эффекта
достигает 12–15 ч. Препараты изосорбида-5-мононитрата (имдур, оликард,
эфокс-лонг), синтезированные в последние годы, находят все большее
распространение в клинической практике. Они отличаются существенными
преимуществами, особенно заметными при лечении тяжелых больных со стенокардией
напряжения III–IV ФК.
Препараты изосорбида 5-мононитрата (ИМН) не подвергаются разрушению в печени
и, следовательно, отличаются высокой биоусвояемостью (около 90%)
и продолжительным действием Эффект этих препаратов является более стабильным
и предсказуемым, чем изосорбида динитрата. Продолжительность антиангинального
действия обычных таблеток изосорбида-5-мононитрата (10 мг, 20 мг и 40 мг) на
1,5–2 ч больше, чем у аналогичных препаратов изосорбида динитрата, а у ретардных
форм (50–100 мг) достигает 10–12 ч и даже 24 ч. Препараты особенно хорошо
переносятся больными, редко приводя к побочным явлениям. Благодаря своим
положительным свойствам, препараты изосорбида 5-мононитрата с успехом
применяются в лечении больных со стенокардией III–IV ФК.
Молсидомин почти полностью идентичен нитратам по механизму антиангинального
действия. В печени молсидомин трансформируется в активный метаболит SIN–1А,
который выделяет оксид азота (NО), что сопровождается отчетливым
вазодилатирующим и умеренным антиагрегантным эффектом. В отличие от органических
нитратов, молсидомин стимулирует образование оксида азота без участия SH-групп.
Это объясняет, по-видимому, тот факт, что при лечении молсидомином гораздо реже,
чем при применении нитратов, развивается толерантность. Препараты молсидомина (корватон
и сиднофарм) отличаются умеренно пролонгированным действием (около 4–6 ч)
и поэтому могут использоваться для профилактики приступов стенокардии.
Абсолютными противопоказаниями к использованию нитратов являются:
артериальная гипотензия (АД ниже 100/60 мм рт. ст.); гиповолемия (ЦВД ниже 4 мм
рт. ст.); шок; тампонада сердца; ИМ правого желудочка; левожелудочковая
недостаточность с низким давлением наполнения; гиперчувствительность к нитратам.
Относительные противопоказания: повышенное внутричерепное давление;
гипертрофическая кардиомиопатия (ГКМП); выраженный стеноз устья аорты
и митральный стеноз; склонность к ортостатической артериальной гипотензии;
закрытоугольная глаукома.
Тактика лечения нитратами, молсидомином
Купирование приступа стенокардии. Для купирования приступа стенокардии обычно
используют короткодействующие лекарственные формы нитроглицерина и изосорбида
динитрата. Наиболее популярным способом купирования стенокардии является
сублингвальный прием таблетки нитроглицерина (0,5 мг). Его купирующий эффект
наступает в течение 1–3 мин, естественно, при условии прекращения действия любых
факторов, спровоцировавших приступ стенокардии. Максимальный эффект наступает
через 5–6 мин, а общая продолжительность действия при таком способе применения
нитроглицерина не превышает 10–20 мин. При отсутствии эффекта через 5 мин можно
повторить прием препарата. Сублингвальное применение нитроглицерина приводит
к быстрому всасыванию активного вещества через слизистую полости рта.
Отсутствует феномен первого прохождения через печень, препарат попадает
в системный кровоток.
При первом применении нитроглицерина, развиваются побочные эффекты,
обусловленные выраженной дилатацией интракраниальных вен и затруднением оттока
крови от головного мозга. В результате повышается внутричерепное давление
и появляются “пульсирующие” головные боли, ощущение распирания в голове, шум
в ушах, покраснение лица, тахикардия. Последний симптом связан с рефлекторной
активацией САС в ответ на чрезмерное снижение ударного объема. Эти явления
обычно быстро проходят, как только заканчивается действие
нитроглицерина. В более редких случаях может развиться артериальная гипотензия,
ортостатический коллапс, которым обычно предшествует выраженная тахикардия.
В связи с возможностью резкого снижения АД рекомендуют в течение 15 мин не
принимать больше 2 таблеток нитроглицерина. Если приступ не купируется в течение
15–20 мин после повторного приема препарата, возрастает вероятность развития
острого коронарного синдрома (нестабильной стенокардии или ИМ), что может
потребовать срочной госпитализации больного и проведения соответствующих
неотложных мероприятий.
Ингаляционные лекарственные формы нитратов (аэрозоли) отличаются еще более
быстрым и выраженным купирующим эффектом. Выпускаемые промышленностью дозируемые
аэрозоли нитроглицерина и изосорбида динитрата более удобны в применении и,
в отличие от таблеток нитроглицерина, сохраняют свою активность в течение
длительного времени. Для купирования приступа аэрозоль распыляют в полости рта.
Для получения быстрого эффекта обычно достаточно 1–2-х доз аэрозоля, каждая из
которых содержит от 0,2 мг до 0,4 мг нитрата.
Буккальные формы нитроглицерина также с успехом могут использоваться для
купирования стенокардии. Это лекарственная форма нитроглицерина в виде тонких
полимерных биорастворимых пластинок, которые содержат различные дозы препарата
(1 мг, 2 мг, 4 мг). Пластины накладывают на верхнюю десну. Эффект наступает
обычно через 2–3 мин и продолжается в течение 3–5 ч. Это свойство буккальных
форм нитроглицерина позволяет использовать пластинки тринитролонга не только для
купирования, но и для профилактики приступов стенокардии. С этой целью пластинки
тринитролонга обычно применяют непосредственно перед предстоящей физической или
эмоциональной нагрузкой. |