
8.9. ОСЛОЖНЕНИЯ ИНФАРТКА МИОКАРДА
Прогноз больных ИМ определяется осложнениями, которые развиваются на ранних и
поздних этапах течения заболевания. Ранние осложнения развиваются в остерейшем и
остром периоде ИМ. К поздним осложнениям обычно относят осложнения,
развивающиеся в подостром и постинфарктном периодах течения заболевания. К
ранним осложнениям ИМ относятся:
острая сердечная недостаточность;
нарушения ритма и проводимости сердца;
ранняя постинфарктная стенокардия;
рецидив ИМ;
острая аневризма сердца;
разрыв миокарда;
фибринозный (эпистенокардитический) перикардит;
тромбоэмболические осложнения;
острые эрозии и язвы желудочно-кишечного тракта;
ишемический инсульт (первые 48 ч после ТЛТ).
Поздние осложнения ИМ развиваются в подострый и постинфарктный период:
хроническая сердечная недостаточность;
нарушения ритма сердца;
хроническая аневризма сердца;
тромбоз левого желудочка;
тромбоэндокардит (в первые 10 сут);
тромбоэмболические осложнения (ТЭЛА, тромбозы глубоких вен);
постинфарктный синдром (синдром Дресслера);
психические нарушения и т.д.
ОСТРАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
ОСН является наиболее частой причиной смерти больных ИМ с зубцом Q. Чаще
всего речь идет об острой левожелудочковой недостаточности. Острая
правожелудочковая недостаточность встречается значительно реже - при вовлечении
в патологический процесс правого желудочка (ПЖ). Острая левожелудочковая
недостаточность обычно развивается в первые часы или дни ИМ, что связано
с внезапным уменьшением массы сократительного миокарда.
Факторами, способствующими возникновению острой левожелудочковой
недостаточности являются: 1. Значительная величина зоны некроза (более 25-30% от
общей массы желудочка). 2. Выраженные нарушения сократимости миокарда ЛЖ в так
называемой периинфарктной зоне - области, непосредственно граничащей с очагом
некроза и также находящейся в состоянии хронической ишемии (гибернирующий
миокард). 3. Снижение сократимости интактного миокарда, обусловленное
уменьшением его коронарной перфузии (при многососудистом поражении коронарной
системы), наличием в нем рубцов, гипертрофией миокарда, нарушениями метаболизма
кардиомиоцитов. 4. Ремоделирование ЛЖ, в том числе его дилатация, асинергия
сокращения, наличие аневризмы ЛЖ. 5. Внезапное развитие относительной митральной
недостаточности вследствие дисфункции папиллярных мышц (ишемия, некроз, отрыв
папиллярной мышцы). 6. Внезапный разрыв МЖП. 7. Подъем уровня АД (увеличение
постнагрузки). 8. Возникновение аритмий.
В результате воздействия этих факторов происходит критическое падение
систолической функции ЛЖ, величины сердечного выброса и возрастает КДД в ЛЖ.
Повышается давление наполнения ЛЖ, среднее давление в ЛП и венах малого круга
кровообращения. Это затрудняет венозный кровоток в малом круге и приводит
к застою крови в легких. Высокое давление в легочных венах гидравлически
передается на капилляры и легочную артерию. Развивается “пассивная” венозная
легочная гипертензия. Если давление в ЛП и легочных венах превышает 25-30 мм рт.
ст., возникает рефлекторный спазм легочных артериол (рефлекс Китаева),
в результате которого, хотя и уменьшается приток крови к легочным капиллярам из
ПЖ, но одновременно резко возрастает давление в легочной артерии, развивается
“активная” легочная артериальная гипертензия. Переполнение кровью легочных
капилляров и повышение давления в них выше коллоидно-осмотического давления
плазмы сопровождается нарушением проницаемости сосудистой стенки и приводит к пропотеванию
плазмы вначале в интерстициальное пространство, а затем в просвет альвеол.
Сопутствующая гипертрофия миокарда ЛЖ и/или нарушения диастолического
расслабления ишемизированного и некротизированного миокарда (диастолическая
дисфункция), резкое увеличение пред- или постнагрузки или увеличение размеров
полости ЛЖ также способствуют росту КДД в ЛЖ и давления наполнения ЛЖ, повышая
риск возникновения отека легких. Количественная оценка давления наполнения ЛЖ,
МО, СИ и некоторых других гемодинамических параметров лежит в основе
дифференцированного подхода к лечению ИМ, осложненного левожелудочковой
недостаточностью.
Клиническая картина
Острая левожелудочковая недостаточность у больных ИМ может протекать в виде
трех клинических вариантов: 1. Сердечная астма возникает в результате
интерстициального отека легких, не сопровождающегося значительным выходом
транссудата в просвет альвеол. 2. Альвеолярный отек легких характеризуется не
только гемодинамическим отеком паренхимы легких, но и выходом плазмы
и эритроцитов в просвет альвеол, а затем - дыхательных путей. 3. Кардиогенный
шок - крайняя степень левожелудочковой недостаточности, когда внезапное резкое
снижение сердечного выброса сопровождается выраженным и часто необратимым
нарушением периферического кровообращения и прогрессирующим снижением АД.
Кардиогенный шок нередко сочетается с альвеолярным отеком легких.
Сердечная астма
Приступ сердечной астмы начинается внезапно с ощущения нехватки воздуха,
одышки, которая быстро переходит в удушье. Больной возбужден, стремится занять
возвышенное сидячее положение в постели (ортопноэ), что несколько облегчает его
состояние, создавая условия для уменьшения притока крови к правому сердцу
и некоторой разгрузке малого круга кровообращения. При осмотре отмечается
испуганное, страдальческое выражение лица. Кожные покровы влажные. Быстро
нарастает цианоз, приобретающий своеобразный сероватый оттенок, характерный для
прогрессирующей дыхательной недостаточности. Слизистые оболочки также синюшны.
Дыхание учащенное, с несколько затрудненным вдохом (преимущественно
инспираторная одышка). Иногда можно заметить участие в акте дыхания
вспомогательной мускулатуры, выраженное втяжение межреберных промежутков
и надключичных ямок во время вдоха. В легких на фоне ослабленного везикулярного
или жесткого дыхания могут выслушиваються влажные мелкопузырчатые незвучные
хрипы в нижних отделах легких. Часто выслушиваются сухие хрипы. Определяется
усиление и раздвоение II тона над легочной артерией.
При перкуссии нередко можно выявить умеренное смещение влево левой границы
относительной тупости сердца, обусловленное дилатацией ЛЖ. Тоны сердца глухие,
иногда ЧСС увеличена до 100-110 ударов в минуту. На верхушке часто определяется
протодиастолический ритм галопа. Артериальное давление чаще имеет тенденцию
к снижению, хотя возможен и подъем уровня АД. Продолжительность приступа от
получаса до нескольких часов.
Альвеолярный отек легких
При альвеолярном отеке легких присоединяется шумное частое дыхание, слышимые
на расстоянии влажные крупнопузырчатые хрипы (клокочущее дыхание). У больного
появляется кашель с отделением жидкой пенистой (серозной) мокроты розоватового
цвета за счет начавшегося пропотевания эритроцитов в просвет альвеол. В легких
на фоне ослабленного везикулярного дыхания быстро нарастает количество влажных
хрипов мелко- и среднепузырчатых, а затем и крупнопузырчатых.
Хрипы вначале выслушиваются в задненижних отделах легких, постепенно
распространяясь по всей поверхности легких сзади и спереди. Тоны сердца
становятся еще более глухими. На верхушке выслушивается протодиастолический или
пресистолический ритмы галопа. АД продолжает снижаться. Пульс на лучевой артерии
учащенный, иногда аритмичный, малого наполнения и напряжения. Рентгенологически
выявляются симметричное гомогенное затенение в центральных отделах полей - типа
"крылья бабочки"; ограниченные или сливные затемнения округлой формы в долях
легкого, нередко двусторонние различной интенсивности диффузные тени (рисунок
19).
Рисунок 19. Отек легких у больного Н., 54 лет с диагнозом распространенный
трансмуральный инфаркт миокарда (М.А. Качковский).
Нередко клиническая картина не позволяет строго разграничить приступ
сердечной астмы и начинающийся альвеолярный отек легких, хотя относительно
быстрое прекращение удушья после купирования болевого синдрома, приема
нескольких таблеток нитроглицерина говорит в пользу диагностики сердечной астмы.
Продолжительность отека легких от нескольких часов до нескольких суток.
Pентгенологические изменения могут сохpаняться даже спустя 24- 48 часов и более
после купиpования клинических признаков отека легких.
Кардиогенный шок
Тяжелое фатальное осложнение ИМ (65-90%). В большинстве случаев кардиогенный
шок развивается в первые часы или в первые 1-2 суток от начала ИМ, когда
критически снижается насосная функция ЛЖ. Частота этого осложнения в настоящее
время составляет 5-8% от всех случаев ИМ с зубцом Q. Факторами риска
кардиогенного шока являются: 1. Распространенный ИМ передней стенки с массой
некротизированного миокарда ЛЖ более 40%. 2. Выраженные ишемические изменения
миокарда, окружающего зону некроза. 3. Наличие старых рубцов после перенесенного
ИМ. Величина “свежего” ИМ может не достигать 40% от общей массы ЛЖ. 4. Снижение
ФВ ЛЖ ниже 40%. 5. Пожилой и старческий возраст больного. 6. Разрыв МЖП. 7.
Дисфункция или разрыв папиллярных мышц, вовлеченных в некротический процесс, что
способствует развитию острой недостаточности митрального клапана и внезапному
падению УО и МО. 8. Наличие сопутствующего сахарного диабета; 9. Инфаркт
миокарда ПЖ.
Патогенез кардиогенного шока, обусловленного острой левожелудочковой
недостаточностью, представляется следующим образом. В результате значительного
уменьшения насосной функции ЛЖ и падения АД компенсаторно повышается общее
периферическое сопротивление и возникает резко выраженный спазм артериол,
вызывающий гипоперфузию внутренних органов. На этом фоне достаточно быстро
развивается тканевая гипоксия, метаболический ацидоз. Последние способствуют
дилатации артериол, в то время как менее чувствительные к этим воздействиям
венулы остаются в спазмированном состоянии.
Происходит переполнение периферических капилляров кровью, и часть жидкой
части крови перемещается в тканевые интерстициальные пространства. В капиллярном
русле периферических органов возникает стаз крови, образуются микротромбы, чему
способствует повышение агрегации тромбоцитов, свертываемости и вязкости крови,
свойственное для больных ИМ и кардиогенным шоком. Это еще больше нарушает
циркуляцию крови по микрососудам.
В результате уменьшается приток крови к сердцу, снижаются сердечный выброс,
АД и перфузия внутренних органов, существенно нарушается их функция. Снижаются
перфузия почек и уровень АД (ниже 100 мм рт. ст.), что приводит к ишемии почек,
нарушению клубочковой фильтрации, некрозу канальцев и развитию острой почечной
недостаточности. Происходит поражение ЦНС, что сопровождается признаками
дисциркуляторной энцефалопатии. Снижение кровообращения в печени ведет
к нарушению ее функции. В желудочно-кишечном тракте образуются острые
трофические расстройства вплоть до образования язв слизистой.
При кардиогенном шоке одновременно со снижением сердечного выброса, уровня АД
и перфузии периферических органов и тканей наблюдается рост давления наполнения
ЛЖ выше 20 мм. рт. ст., что способствует венозному застою крови в малом круге
кровообращения и возникновению отека легких. Исключение составляет так
называемая гиповолемическая форма кардиогенного шока, при которой наблюдается
снижение ОЦК за счет депонирования крови в периферических сосудах и перехода
части плазмы в интерстициальное пространство. Отмечают снижение сердечного
выброса, КДД в ЛЖ и давления наполнения ЛЖ.
Клиническая картина
Жалобы больных с кардиогенным шоком неспецифичны и связаны с основным
заболеванием (загрудинная боль, перебои, сердцебиения), с застоем крови в малом
круге кровообращения (одышка, удушье), со снижением АД и нарушением функции
внутренних органов (слабость, головокружение, выраженная потливость, похолодание
конечностей, олигурия или анурия).
При осмотре обращает на себя внимание тяжелое состояние больного. В самом
начале развития кардиогенного шока возможно кратковременное психомоторное
возбуждение (эректильная фаза шока). Однако вскоре больной становится вялым,
адинамичным, почти не реагирует на окружающее, что указывает на быстрое
прогрессирование гипоксии, ацидоза, снижение мозгового кровотока (торпидная
фаза). Сознание в это время может быть угнетено, вплоть до комы. Кожные покровы
бледные с выраженным цианотическим оттенком. Отмечается профузный пот,
конечности холодные на ощупь. Пульс на лучевых артериях малого наполнения
и напряжения, нитевидный (pulsus filiformis), иногда вообще отсутствует.
Артериальное давление резко снижено, систолическое АД меньше 80 мм рт. ст., хотя
кардиогенный шок может развиться и при более высоком АД (90-100 мм рт. ст.),
если у больного в прошлом имела место АГ. Для кардиогенного шока типично резкое
уменьшение уровня пульсового АД (менее 30 мм рт. ст., в редких случаях - менее
10 мм рт.ст.). При определении АД слышны очень глухие тоны. В тяжелых случаях
тоны Короткова исчезают, АД не определяется аускультативным методом.
При исследовании легких выявляется частое поверхностное дыхание, а в терминутуальной
стадии - апериодическое дыхание Чейна-Стокса. В легких выслушиваются влажные
хрипы, что указывает на признаки застоя крови в малом круге кровообращения
и развивающийся отек легких. При аускультации тоны сердца глухие, часто
аритмичные, может выслушиваться протодиастолический ритм галопа, систолический
шум. Одним из наиболее надежных клинических признаков кардиогенного шока
является олиго- и анурия (диурез меньше 20 мл/ч), свидетельствующая о
гипоперфузии почек, которая является весьма неблагоприятным прогностическим
признаком. Довольно часто терминуту “кардиогенный шок” используют для
обозначения еще двух патологических состояний, сопровождающихся снижением
сердечного выброса и уровня АД, но существенно отличающихся от истинного
кардиогенного шока по механизмам развития и прогнозу.
1. Рефлекторная форма шока (болевой рефлекторный шок) является формой
острой сосудистой недостаточности, которая в большинстве случаев развивается на
высоте болевого приступа. Рефлекторная форма шока обусловлена внезапным
уменьшением тонуса вен и депонированием значительной части крови в венах органов
брюшной полости и скелетных мышц. Значительно уменьшается приток крови к сердцу,
снижается сердечный выброс, происходит кратковременное нарушение перфузии
головного мозга. Это определяет клиническую картину рефлекторного шока
(коллапса). Болевой рефлекторный коллапс обычно продолжается недолго, легко
купируется самостоятельно или после применения сосудистых препаратов, быстро
повышающих венозный тонус и восстанавливающих исходную гемодинамику.
Рефлекторный коллапс наблюдается у многих больных ИМ с зубцом Q в самом начале
заболевания и практически не оказывает влияния на прогноз ИМ. Развитие
рефлекторной формы шока свидетельствует о тяжести и стойкости нарушений и
требует энергичного проведения противошоковых мероприятий.
2. Аритмический шок обусловлен резким падением насосной функции ЛЖ
и АД в результате возникновения пароксизмальной тахикардии или полной АВ-блокады.
Купирование пароксизма тахикардии или применение электрокардиостимуляции сердца
при АВ-блокаде приводит обычно к быстрому восстановлению сердечного выброса
и нормализации АД. Наличие у больного клинической картины шока и тяжелых
нарушений ритма и проводимости еще не означает, что речь идет именно об
аритмическом шоке, поскольку истинный кардиогенный шок также может
сопровождаться тяжелыми аритмиями. Окончательное суждение о генезе шока можно
сделать только после купирования нарушений ритма и проводимости: при истинном
кардиогенном шоке устранение аритмии не оказывает влияния на насосную функцию ЛЖ,
и клинические признаки шока сохраняются.
3. Кардиогенный шок с низким ОЦК возникает при выраженной вазодилатации.
Его весьма сложно диагностировать. Наблюдаются запавшие черты лица. Эффект от
проводимой иноторопной поддержки недостаточный, более значимый при проведении
инфузионной терапии. Рекомендуется провеедние инфузионной терапии при ЦВД ниже 5
см водного ст. или ДЗЛА ниже 12 мм рт.ст.
4. Истинный кардиогенный шок является наиболее тяжелой формой шока при
ИМ. Характеризуется резким падением сократительной функции сердца. Падение
минутуутного объема достигает критически низких значений и не компенсируется
повышением периферического сосудистого сопротивления (Мартынов И.В., Груздев
А.К., 2003).
Для клинической оценки выраженности острой левожелудочковой недостаточности у
больных ИМ используют классификацию Т. Killip и J. Kimβall (1969), основанную на
количественной характеристике некоторых клинических проявлений сердечной
недостаточности (таблица 37). Наличие у больного клинической картины шока и
тяжелых нарушений ритма и проводимости еще не означает, что речь идет именно об
аритмическом шоке, поскольку истинный кардиогенный шок может сопровождаться
тяжелыми аритмиями.
Окончательное суждение о генезе шока можно сделать только после купирования
нарушений ритма и проводимости. При истинном кардиогенном шоке устранение
аритмии не оказывает влияния на насосную функцию ЛЖ, и клинические признаки шока
сохраняются.
Таблица 37. Классификация острой левожелудочковой недостаточности
| Класс |
Клинические критерии |
Удельный вес больных среди поступающих в ОРИТ,
% |
Госпитальная летальность, % |
| I |
Отсутствие влажных хрипов в легких и
патологического III тона |
30-40 |
8 |
| II |
Застойные влажные хрипы на площади менее 50%
легочных полей и/или патологический III тон |
30-50 |
30 |
| III |
Влажные хрипы на площади более 50% легочных
полей в сочетании с патологическим III тоном |
5-10 |
44 |
| IV |
Признаки кардиогенного шока |
10 |
80-100 |
Для количественной и качественной оценки гемодинамических нарушений, лежащих
в основе острой левожелудочковой недостаточности и кардиогенного шока у больных
ИМ, используются: 1. Рентгенография органов грудной клетки. 2. Катетеризация
левых и правых отделов сердца с измерением давления в камерах сердца и легочной
артерии. 3. Прямые методы определения сердечного выброса. 4. Радионуклидная
вентрикулография. 5. Коронароангиография с левой вентрикулографией. 6.
Эхокардиография. Рентгенография органов грудной клетки позволяет
объективизировать признаки венозного застоя крови в малом круге кровообращения,
а катетеризация полостей сердца и легочной артерии - оценить уровень КДД в ЛЖ,
давление наполнения ЛЖ, центральное венозное давление (ЦВД), УО, МО, СИ.
Рентгенография органов грудной клетки
Является доступным методом исследования, который позволяет оценить у больных
ИМ кровообращение в малом круге и выявить признаки развивающегося отека легких,
причем до появления отчетливых клинических проявлений этого осложнения. При
рентгенографии венозный застой крови в легких характеризуется затемнением корней
и периферических отделов легких, значительным расширением легочных вен. На
начальной стадии гемодинамических нарушений наблюдается снижение пульсации
корней легких, выявляемой при рентгеноскопии, и отсутствие расширения легочной
артерии, ее крупных ветвей.
При присоединении к венозному застою признаков легочной артериальной
гипертензии, обусловленной рефлекторным спазмом легочных артериол и мелких
артерий (рефлекс Китаева) в ответ на повышение давления в левом предсердии выше
18 мм. рт. ст., выявляются следующие рентгенологические признаки: 1. Интенсивное
гомогенное затемнение корней легких и их значительное расширение и нерезкость
очертаний. 2. Обеднение легочного сосудистого рисунка на периферии обоих легких
за счет выраженного сужения мелких артерий, дистальные отделы которых как бы
“обрываются”. Это один из наиболее характерных рентгенологических признаков
сочетания венозного полнокровия и легочной артериальной гипертензии, которое
лежит в основе возникновения клинической картины гемодинамического отека легких.
3. Появление на рентгенограммах легких “перегородочных” линий Керли типа В,
образующихся вследствие накопления жидкости в междольковых прегородках. 4.
Расширение и усиленная пульсация ствола легочной артерии (рентгенологический
признак легочной артериальной гипертензии). Перечисленные рентгенологические
признаки интерстициального отека у половины больных появляются раньше, чем
описанные выше клинические симптомы острой левожелудочковой недостаточности.
Гемодинамический мониторинг
Всем больным ИМ с признаками острой СН показана оценка в динамике пяти
гемодинамических показателей: сердечного индекса (СИ); фракции выброса ЛЖ (ФВ);
центрального венозного давления (ЦВД); давления заклинивания легочной артерии (ДЗЛА);
уровня систолического и диастолического АД. Сведения о динамике этих показателей
необходимы для объективной оценки типа гемодинамических нарушений, выбора
оптимальной тактики ведения больных и контроля за лечением. Для определения этих
показателей используют инвазивные методы исследования: катетеризацию правых
отделов сердца (определение ДЗЛА, ЦВД) и метод термодилюции (УО, МО, УИ, СИ, ФВ).
Для оценки СИ и ФВ можно использовать эхокардиографию. Во всех случаях необходим
контроль диуреза, причем при кардиогенном шоке - почасовой контроль с помощью
постоянного мочевого катетера.
Катетеризация сердца и сосудов
Катетеризацию правых и левых камер сердца и магистральных сосудов должен
выполнять высококвалифицированный медицинский персонал в отделениях реанимации
и интенсивной терапии, специализированных ангиографических отделениях. Для
проведения катетеризации правых отделов сердца пунктируют бедренную вену,
основную вену плеча или подключичную вену. Чаще используют последний доступ.
Больного укладывают на операционный стол на спину.
Пациент занимает положение с низким изголовьем; между лопатками кладут валик.
Кожу правой подключичной области обрабатывают антисептическими средствами,
а саму область отграничивают стерильными салфетками. Иглой диаметром около 0,5
мм в области, расположенной примерно на 2 см латеральнее большого пальца и чуть
ниже ключицы, делают прокол и вводят 1% раствор лидокаина, осуществляя анестезию
кожи, подкожной клетчатки, надкостницы ключицы. После того как подключичная
область инфильтрирована анестетиком, ее пунктируют иглой Сельдингера,
подсоединенной к стерильному шприцу.
Игла располагается почти горизонтально и медленно продвигается под ключицу по
направлению к указательному пальцу оператора. Срез иглы должен быть повернут
вниз. Если в шприце появилась темная венозная кровь, это указывает на то, что
игла вошла в вену. Шприц отсоединяют и в просвет иглы вводят проводник,
удерживая иглу в том же положении. После того как проводник попал в просвет
вены, иглу извлекают, а на проводник надевают жесткий дилататор и вводят его по
проводнику на 3-4 см. Он используется для расширения подкожных тканей. Затем
расширитель удаляют и в проводник вводят центральный венозный катетер - на 15 см
вглубь.
После этого проводник удаляют, аспирируют кровь из катетера и начинают
струйное введение стерильного изотонического раствора натрия хлорида. Катетер
фиксируют к коже швами. Часто при зондировании правых отделов сердца используют
доступ через бедренную вену. Техника пункции вены и введения катетера
соотвествует при подключичном доступе. Пунктируют бедренную вену медиальнее
области, в которой была обнаружена пульсация бедренной артерии.
Помимо описанного чрескожного введения центрального катетера используют
венесекцию. В зависимости от цели исследования используют различные виды
катетеров. Для контроля центральной гемодинамики применяют “плавающий” катетер
Свана-Ганца, на конце которого расположен небольшой баллончик, раздуваемый
газом. Катетер медленно вводят примерно до уровня правого предсердия, после чего
баллончик раздувают. Катетер с раздутым баллончиком приобретает повышенную
“плавучесть” и практически не оказывает механического воздействия на внутреннюю
поверхность правых отделов сердца, что предупреждает возникновение нарушений
сердечного ритма. Катетер вводят в правое предсердие, правый желудочек и в
легочную артерию, регистрируя кривые давления в этих отделах сердца.
Затем газ из баллончика эвакуируют и продвигают конец катетера в одно из
разветвлений легочной артерии второго и третьего порядка. После этого вновь
раздувают баллончик, который обтурирует (“заклинивает”) сосуд, что позволяет
зарегистрировать так называемое легочно-капиллярное давление или, точнее,
передаточное давление из ЛП, называемое “давлением заклинивания легочной
артерии” (ДЗЛА). На рисунке видно, что в момент “заклинивания” легочной артерии
характер кривой давления резко меняется.
Для катетеризации левых отделов сердца и аорты чаще используют ретроградную
артериальную катетеризацию аорты и левого желудочка и транссептальный доступ.
Чаще применяют ретроградный артериальный доступ. В этом случае специальный
катетер вводят чрескожно в бедренную артерию или через небольшой разрез в
плечевую артерию.
Введение катетера в аорту и затем в левый желудочек контролируют с помощью
рентгенотелеустановки. Транссептальный доступ обычно используют в тех случаях,
когда по каким-то причинам ретроградная артериальная катетеризация оказывается
технически сложной из-за выраженного сужения кольца аортального клапана, наличия
гипертрофической кардиомиопатии или механического протеза клапана. Катетер
вводят в правую бедренную вену и продвигают его в направлении сердца.
Когда катетер достигает правого предсердия, через него вводят длинную иглу
с закругленным концом, пунктируют ею межпредсердную перегородку в области
овального отверстия. После этого катетер вводят по игле в левое предсердие,
затем в левый желудочек и, при необходимости, в аорту и регистрируют кривые
давления.
Катетеризация правых и левых отделов сердца позволяет получить информацию о
динамике внутрижелудочкового и внутрипредсердного давления и давления в крупных
магистральных сосудах (аорте и легочной артерии). Нормальные величины давления
в полостях сердца и магистральных сосудах представлены в таблице 38.
Таблица 38. Нормальное давление в полостях сердца, магистральных сосудах
| Камеры сердца и магистральные сосуды |
Максимальное систолическое давление, мм. рт.
ст. |
Конечно-диастолическое давление, мм. рт. ст |
Среднее давление, мм. рт. ст. |
| Правое предсердие |
- |
- |
4-5 |
| Правый желудочек |
25-30 |
4-6 |
- |
| Легочная артерия |
25-30 |
10-12 |
- |
| Левое предсердие |
- |
- |
8-12 |
| Левый желудочек |
120-145 |
10-12 |
- |
| Аорта |
120-145 |
70 |
- |
Практическое значение имеет определение конечно-диастолического давления
в левом желудочке (КДДЛЖ), величина которого используется для оценки
функции левого желудочка. Данные о величине КДДЛЖ можно получить при
катетеризации левых отделов сердца. На практике КДДЛЖ чаще оценивают
по величине “давления заклинивания” легочной артерии (ДЗЛА), что существенно
упрощает процедуру исследования. В большинстве случаев ДЗЛА и КДДЛЖ
почти совпадают.
Повышение КДД в левом желудочке является одним из важнейших признаков
снижения сократительной способности сердца - левожелудочковой сердечной
недостаточности. Нередко этот признак появляется задолго до уменьшения величины
сердечного выброса (МО). При нарушении систолической функции повышение КДД
сочетается с компенсаторным увеличением конечно-диастолического объема ЛЖ и его
дилатацией. Другой важный механизм повышения КДД - увеличение жесткости стенки
ЛЖ, что чаще наблюдается у больных с выраженной гипертрофией миокарда,
кардиосклерозом, распространенной ишемией или острым ИМ.
Снижение КДД в левом желудочке у больных ИМ является указанием на наличие
гиповолемии, сопровождающейся уменьшением конечно-диастолического объема левого
желудочка (гиповолемический кардиогенный шок, длительный пароксизм
наджелудочковой или желудочковой тахикардии). Сердечный выброс - это количество
крови, выбрасываемой правым и левым желудочком в единицу времени (1 минуту).
Наиболее точными методами определения сердечного выброса (или минутуутного
объема крови - МО) являются прямые методы Фика и методы разведения.
Прямой метод Фика является наиболее точным методом определения сердечного
выброса. Несмотря на необходимость проведения пункции или катетеризации
артериального участка системы кровообращения, метод в последние годы достаточно
широко применяется в кардиологической практике, преимущественно у больных
осложненным острым ИМ.
Методы разведения индикаторов являются своеобразной модификацией метода Фика
и основаны на быстром одномоментном введении непосредственно в кровеносное русло
определенного количества какого-либо индикатора (красителя, радиоактивного
вещества, охлажденной жидкости). Концентрацию индикатора определяют в пробах
крови, взятых из участков, расположенных ниже по ходу кровотока (С1).
Кровь извлекают из артерии (аорты) с постоянной скоростью с помощью
автоматических насосов. Для определения концентрации индикатора чаще используют
специальные проточные (кюветные) денситометры, через которые пропускают
артериальную кровь. Денситометры снабжены источником света и фотоэлектрическим
датчиком, измеряющим интенсивность светового потока, проходящего через
исследуемую кровь
Кривая изменения концентрации индикатора во времени регистрируется ниже места
его введения в артериальной системе. Через некоторое время (Т) после
одномоментного (болюсом) введения индикатора в локтевую вену или правое
предсердие его концентрация в месте забора крови начинает повышаться, достигает
первого максимума (пика), а затем начинает экспоненциально падать. Нисходящая
часть кривой первой (основной) волны обычно деформирована дополнительными
волнами рециркуляции (повторного поступления индикатора из различных сосудистых
областей). Для определения так называемой первичной кривой разведения, лишенной
пиков рециркуляции, необходимо экстраполировать ее нисходящую часть, изобразив
ее в логарифмическом масштабе.
Нисходящая часть превращается в прямую линию. Продолжая ее до пересечения
с осью абсцисс, получают первичную кривую, кривую, которая была бы записана
в отсутствии рециркуляции. Время от начала кривой разведения до этой точки
соответствует общему времени пассажа индикатора (Т). Площадь под первичной
кривой разведения (S) отражает суммарную концентрацию красителя,
зарегистрированную в артерии (аорте) во время первого пассажа индикатора. Для
определения этой площади необходимо знать калибровочный индекс (К), зависимость
между концентрацией индикатора в мг/л и показаниями денситометра в миллиметрах.
Простым и распространенным способом определения цены деления записывающего
устройства денситометра является способ Y.W. Nicholson, основанный на
пропускании через денситометр нескольких проб крови обследуемого с известной
концентрацией индикатора.
При определении сердечного выброса в качестве индикатора может быть
использован метод термодилюции охлажденным изотоническим раствором натрия
хлорида или 5% раствором глюкозы. Стандартное количество охлажденной жидкости
вводят в правое предсердие и с помощью термистора, расположенного в легочной
артерии, регистрируют кривую снижения температуры крови. В современных системах
для этой цели используют многопросветные баллонные катетеры. Через один просвет
катетера с отверстием на уровне правого предсердия вводят термоиндикатор; через
другой - провод термистора, находящегося в легочной артерии. Для вычисления
МО определяют площадь под кривой разведения в градусах и разность температуры
индикатора и крови. Формула расчета МО:
МО = -V (t1 - t2) х 60 х 1,08 / S,
где V - объем введенного индикатора; t1 - температура крови; t2
- температура индикатора; 1,08 - коэффициент, учитывающий удельную плотность
и теплоемкость крови и индикатора; S - площадь под кривой разведения. Метод
термодилюции отличается рядом преимуществ: отсутствует необходимость применения
артериального катетера; существует возможность многократного повторного
определения сердечного выброса (до 2-3 раз в минуту); на кривой разведения
отсутствуют волны рециркуляции, что упрощает исследование; сердечный выброс (МО)
определяется с высокой точностью. Помимо МО крови в клинической практике
рассчитывают и другие показатели, являющиеся производными МО:
1. Ударный объем (УО):
УО = МО/ ЧСС (л).
2. Сердечный индекс (СИ), который представляет собой отношение МО крови
к площади поверхности тела (S, м2). СИ вычисляют по формуле:
СИ = МО/ S (л/минуту/м2).
Площадь поверхности тела (S) определяют по специальной номограмме или
рассчитывают по формулам.
3. Ударный индекс (УИ) - отношение ударного объема к площади поверхности тела
(S, м2). УИ вычисляют по формуле:
УИ = УО/ S (л/м2).
4. Фракция выброса - отношение УО к величине КДО ЛЖ.
Селективная ангиокардиография левого желудочка (левая вентрикулография) имеет
особое значение в диагностике органических и функциональных нарушений левого
желудочка у больных ИМ. В этих случаях левая вентрикулография позволяет
обнаружить регионарные нарушения функции левого желудочка в виде локальных
ограниченных участков акинезии, гипокинезии и дискинезии; диагностировать
аневризму левого желудочка и оценить ее локализацию и размеры; рассчитать важные
и информативные показатели гемодинамики (КСО, КДО, УО, МО, СИ, УИ, ФВ, среднюю
скорость кругового укорочения волокон). Для расчета гемодинамических показателей
проводят количественную обработку изображений полости левого желудочка,
зарегистрированных в одной из проекций в конце систолы и диастолы. Вначале
планиметрически определяют площадь полости левого желудочка (S) и длину его
большой оси (L), соединяющей основание и верхушку. Расчетный диаметр по малой
оси полости желудочка (D) определяются по формуле:
D = 4S / π х L,
после чего рассчитывают объем левого желудочка (V), используя геометрическую
модель эллипсоида:
V = π х D2 х L / 6,
где V - объем левого желудочка; D - расчетный диаметр по малой оси; L - длина
большой оси. Зная конечно-диастолический (КДО) и конечно-систолический (КСО)
объемы левого желудочка, легко можно рассчитать его ударный объем (УО):
УО = КДО - КСО.
Фракцию выброса (ФВ), отражающую процент укорочения миокарда левого желудочка
во время его сокращения, вычисляют следующим образом:
ФВ = УО / КДО х 100%,
где: ФВ - фракция выброса; УО - ударный объем; КДО - конечно-диастолический
объем желудочка.
Другой информативный показатель сократительной способности миокарда левого
желудочка - среднюю скорость кругового укорочения волокон - вычисляют,
рассчитывая величину диаметра по малой оси желудочка (D) в конце систолы
и диастолы (конечно-систолический и конечно-диастолический размеры левого
желудочка, КСР и КДР), общую продолжительность изгнания крови (Т):
Vср = КДР - КСР / КДР х Т,
где: КДР и КСР - конечно-диастолический и конечно-систолический
размеры (диаметры) левого желудочка; Т - время изгнания. Некоторые параметры
гемодинамики могут быть определены с помощью эхокардиографии. В этих случаях
целесообразно использовать метод дисков (по Simpson), метод “площадь-длина” или
допплер-эхокардиографическое определение параметров гемодинамики. Для
характеристики нарушений кровообращения при ИМ используют 4 гемодинамических
показателя: ДЗЛА, ЦВД, СИ и АД. Давление заклинивания легочной артерии (ДЗЛА).
Основным гемодинамическим параметром, определяющим возникновение застоя крови
в малом круге кровообращения, является давление заклинивания легочной артерии (ДЗЛА),
которое в большинстве случаев соответствует давлению наполнения ЛЖ. Чем выше
ДЗЛА, тем больше выражен застой крови в легких.
Центральное венозное давление (ЦВД) зависит от величины венозного притока
крови к правому сердцу, диастолического давления в ПЖ. Диастолическое давление
в ПЖ может увеличиваться при легочной артериальной гипертензии; при поражении ПЖ.
Повышение ЦВД (давления в ПП) у больных ИМ может наблюдаться как при застое
крови в легких, вызванном острой левожелудочковой недостаточностью, так и при
инфаркте самого ПЖ. Уменьшение ЦВД связано с ограничением венозного притока
крови к сердцу, наблюдается при коллапсе и шоке, приеме нитратов, гиповолемии.
Сердечный индекс (СИ) - это третий гемодинамический показатель, используемый
для характеристики нарушений кровообращения при ИМ. Он характеризует насосную
функцию сердца. Величина СИ является главным показателем тяжести состояния
больных ИМ: при снижении СИ с 2,7 л/минуту/м2 (при неосложненном
течении инфаркта) до 1,6 л/минуту/м2 (при отеке легких и кардиогенном
шоке) госпитальная летальность увеличивается с 2,2% до 55,5%.
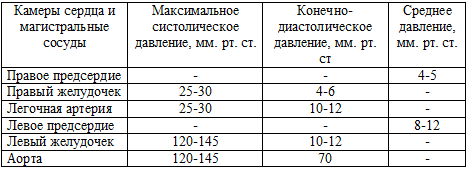
Таблица 38. Типы гемодинамики у больных ИМ
В таблице 38 представленны пять типов изменений гемодинамики при ИМ. Три из
них характерны для острой левожелудочковой недостаточности и кардиогенного шока:
застойный, гипокинетический, гиповолемический. Застойный тип гемодинамики
характеризуется повышением ДЗЛА больше 18 мм рт. ст. и ЦВД при почти нормальных
значениях СИ. Нередко застойный тип гемодинамики предшествует появлению
клинических признаков острой левожелудочковой недостаточности (сердечной астмы
и альвеолярного отека легких). Этот тип гемодинамических нарушений
свидетельствует о наличии венозного застоя в легких, что обычно подтверждается
при проведении рентгенографии органов грудной клетки. Отсутствие в этих случаях
существенного уменьшения СИ обеспечивается в основном компенсаторным механизмом
Старлинга: увеличением силы сокращения неповрежденных кардиомиоцитов
в результате их умеренного растяжения за счет дилатации ЛЖ. Обнаружение
застойного типа гемодинамики при ИМ является показанием для терапии диуретиками
и венозными вазодилататорами.
Гипокинетический тип гемодинамики при ИМ характеризуется повышением ДЗЛА
(выше 20-22 мм. рт. ст.) и ЦВД, снижением СИ (меньше 2 л/минуту/м2).
Этот тип гемодинамики свидетельствует о критическом падении насосной функции ЛЖ
и усугублении венозного застоя в легких, требует применения препаратов
инотропного действия. Гиповолемический тип обусловлен значительным нарушением
венозного возврата крови к сердцу, что сопровождается резким снижением ЦВД
(меньше 5 мм рт. ст.), ДЗЛА и диастолического давления в легочной артерии
(меньше 9 мм рт. ст.) и СИ (ниже 1,8-2 л/минуту/м2), а также
систолического АД (меньше 90 мм рт. ст.) и пульсового давления (меньше 30 мм рт. ст.).
Гиповолемический шок может быть обусловлен повторной рвотой, выраженной
потливостью, лихорадкой, избыточным приемом мочегонных средств и усугубляется
при введении растворов натрия нитропруссида и применении наркотических
анальгетиков или β-адреноблокаторов.
У части больных ИМ в острейшем периоде величина сердечного выброса
сохраняется на должном уровне благодаря действию нескольких компенсаторных
механизмов, в том числе умеренному повышению давления наполнения ЛЖ до 15-18 мм
рт. ст. (норма 5-12 мм рт. ст.). Это обеспечивает достаточное диастолическое
наполнение ЛЖ, стенка которого благодаря выраженному и распространенному
ишемическому повреждению становится упругой и малорастяжимой (“жесткой”).
Может наблюдаться умеренная дилатация ЛЖ, которая по механизму Старлинга
сопровождается увеличением силы сокращения кардиомиоцитов и поддержанием
сердечного выброса на относительно нормальных значениях СИ. Ограничение
венозного притока крови к сердцу и снижение величины ДЗЛА приводят
к значительному уменьшению заполнения ЛЖ кровью во время диастолы и падению
сердечного выброса.
Лечение острой левожелудочковой недостаточности, кардиогенного шока
Лечение больных ИМ, осложненным острой левожелудочковой недостаточностью,
должно проводиться под постоянным контролем клинических, лабораторных,
электрокардиографических данных, показателей гемодинамики. Интенсивная терапия
этих больных требует проведения максимально полного гемодинамического
мониторинга с определением ДЗЛА, ЦВД, СИ, АД, ФВ. С этой целью может быть
использована катетеризация правых отделов сердца катетером Свана-Ганца. При
стойкой артериальной гипотензии показана установка артериального катетера. При
отсутствии такой возможности приходится ориентироваться на тяжесть состояния
больного, ЧДД, ЧСС, аускультативные признаки застоя крови в легких и проявления
периферической гипоперфузии; величину системного АД; значения ЦВД; результаты
динамического эхокардиографического исследования; значения почасового диуреза.
Лечение отека легких
Лечение больных с отеком легких должно быть направлено на коррекцию ДЗЛА,
признаков застоя крови в малом круге кровообращения и нормализацию сердечного
индекса. Выбор тактики лечения зависит от гемодинамического типа острой
левожелудочковой недостаточности.
Если у больного с острой левожелудочковой недостаточностью систолическое АД
нормально или умеренно снижено (выше 100-110 мм. рт. ст.), диастолическое
давление в легочной артерии (или ДЗЛА) составляет 18-20 мм. рт. ст. (норма 8-12
мм. рт. ст.), наблюдается удушье и влажные хрипы в легких, а СИ и ЦВД
практически не изменены и отсутствуют признаки периферической гипоперфузии,
показано применение следующих лечебных мероприятий.
Фуросемид (лазикс) вводят внутривенно в дозе 40-80 мг однократно или
несколько раз в день. При необходимости разовые дозы введения препарата могут
быть увеличены (максимальная суточная доза - 2000 мг). Фуросемид, обладающий
мощным диуретическим действием, уменьшает ОЦК, АД, величину постнагрузки и преднагрузки,
а также ДЗЛА, что сопровождается уменьшением или исчезновением одышки и влажных
хрипов в легких. Гемодинамическая разгрузка малого круга кровообращения
начинается уже через несколько минутуут после введения препарата, задолго до
начала его диуретического действия (около 30 минуту). Внутривенное введение
фуросемида целесообразно продолжать еще в течение 2-3 дней, а затем при
необходимости перейти на пероральный прием препарата по 40-80 мг в сутки
(однократно). При лечении фуросемидом возможно нежелательное снижение
систолического АД ниже 90 мм рт. ст. и уменьшение СИ, что сопровождается
уменьшением коронарной перфузии и расширением зоны некроза, а также развитием
гипокалиемии (угроза появления аритмий). Поэтому лечение требует постоянного
гемодинамического контроля за эффектами препарата.
Вазодилататоры (нитроглицерин) являются основными лекарственными средствами,
которые используют для лечения отека легких у больных ИМ (при условии
систолического АД не ниже 90 мм рт. ст.). Нитроглицерин обладает выраженными
венодилатирующими свойствами, что позволяет значительно и быстро уменьшить
приток крови к сердцу, величину преднагрузки и давление наполнения ЛЖ и признаки
застоя в малом круге кровообращения. Нитроглицерин, снижая тонус артериолярных
сосудов, способствует уменьшению ОПСС, величины постнагрузки на ЛЖ и увеличению
коронарной перфузии. Натрия нитропруссид в большей степени, чем нитроглицерин,
оказывает влияние на артериолы. Поэтому у больных ИМ, осложненном отеком легких
с сопутствующей АГ, более целесообразно назначение натрия нитропруссида.
Нитроглицерин (1% спиртовой раствор) вводят внутривенно капельно на 0,9%
растворе натрия хлорида, начиная с 5-10 мг в минуту с постепенным увеличением
скорости каждые 10 минуту. Инфузию нитроглицерина прекращают: при достижении
желаемого гемодинамического эффекта - уменьшении диастолического давления
в легочной артерии (или ДЗЛА) до 15-17 мм. рт. ст. или при снижении
систолического АД на 10-15% (но не ниже 90 мм. рт. ст.) или при появления
побочных эффектов. В дальнейшем в течение 24-72 ч проводят “поддерживающие”
инфузии раствора нитроглицерина, обеспечивающие оптимальный уровень давления
заклинивая (ДЗЛА), и затем переходят к пероральному приему нитратов в обычных
дозах (изосорбида динитрат, изосорбида мононитрат).
У больных АГ и отеком легких необходимо проведение внутривенных инфузий
натрия нитропруссида, что обеспечивает снижение ДЗЛА и системного АД. Морфин
подавляет избыточную активность дыхательного центра, устраняя тахипноэ. Морфин
обладает периферическим вазодилатирующим действием, способствующим уменьшению
венозного возврата крови к сердцу, снижению ДЗЛА и величины преднагрузки. Морфин
вводят внутривенно струйно в дозе 2-5 мг. Оксигенотерапия показана практически
во всех случаях отека легких. Использование ингаляций увлажняющего кислорода
через носовые катетеры или подача 100% кислорода с помощью маски со скоростью
6-12 л/минуту позволяет уменьшить признаки гипоксии ЦНС и метаболического
ацидоза, улучшить механические свойства самих легких. Повышение концентрации
кислорода приводит к снижению афферентной импульсации с синокаротидных и других
хеморецепторов и уменьшению тахипноэ.
Эффективными мерами, направленными на ограничение преднагрузки, могут быть
введение моpфина гидpохлоpид 1 % 1 мл подкожно, внутримышечно или внутривенно,
его аналогов (фентанил от 1-2 до 10 мл 0,005 %). Действенной мерой при
проведении интенсивной терапии у данной категории больных является введение
дpопеpидола в дозе 2-4 мл 0,25 % раствора.
При альвеолярном отеке легких необходимо использование пеногасителей (паров
спирта). Наличие выраженных клинических признаков отека легких, соответствующих
III классу по Т. Killip и J. Kimβall (1986), быстрое прогрессирование
дыхательной недостаточности (спутанное сознание, выраженный цианозо или
землистый цвет кожи, изменение величины зрачков, активное участие в дыхании
вспомогательной мускулатуры на фоне выраженной одышки) являются показанием для
интубации трахеи и проведения аппаратной искусственной вентиляции легких (ИВЛ)
с положительным давлением в конце выдоха.
Более высокое внутриальвеолярное и внутрибронхиальное давление, создаваемое
ИВЛ, способствует увеличению растяжимости легких, расправлению ателектазов и
улучшению вентиляционно-перфузионных соотношений и газообмена. Повышенное
внутригрудное давление нарушает венозный возврат крови к сердцу и способствует
снижению ДЗЛА и разгрузке малого круга кровообращения. Гипокинетический тип
гемодинамики. Если у больного с клинической картиной отека легких имеет место не
только значительное повышение ДЗЛА (выше 20 мм. рт. ст.) и ЦВД, но и снижение
СИ (меньше 2 л/минуту/м2) и систолического АД, речь идет о выраженном
нарушении насосной функции ЛЖ, которое нередко сочетается с признаками
периферической гипоперфузии (олигурия, похолодание конечностей, артериальная
гипотония), с начальными проявлениями кардиогенного шока. В этих случаях
активное воздействие на ДЗЛА и застой крови в легких с использованием
вазодилататоров должно сочетаться с обязательным применением препаратов,
обладающих инотропным действием.
Добутамин (добутрекс) является селективным стимулятором β1-адренергических
рецепторов с выраженным инотропным действием. Он мало влияет на ЧСС, снижает
ОПСС и легочное сосудистое сопротивление, давление наполнения ЛЖ (ДЗЛА).
Системное АД практически не изменяется. Добутамин вводят внутривенно капельно со
скоростью 2,5-10 мкг/кг/минуту. Допамин является агонистом допаминовых
рецепторов и в относительно высоких дозах вызывает возбуждение α- и
β-адренорецепторов, усиливая выделение норадреналина в синаптическую щель.
Допамин увеличивает сократительную способность миокарда, сердечный выброс
и оказывает заметное хронотропное действие на сердце, увеличивая ЧСС. В отличие
от добутамина, допамин оказывает влияние на сосудистый тонус
(α-адренорецепторы), повышает ОПСС и АД. Допамин применяют при тяжелой
левожелудочковой недостаточности, сочетающейся с артериальной гипотензией.
Препарат вводится внутривенно капельно со скоростью 5-10 мкг/кг/минуту. При
отсутствии эффекта проводят инфузию допамина и добутамина в максимально
переносимых дозировках.
Применение любых симпатомиметиков, обладающих мощным кардиостимулирующим
действием, сопровождается увеличением потребности миокарда в кислороде. Поэтому
при их передозировке у больных ИМ может усугубляться ишемия миокарда.
В результате еще больше снижается сердечный выброс, повышается ДЗЛА, увеличиваются
признаки застоя в легких. В связи с этим введение этих лекарственных средств
больным ИМ должно проводиться под строгим контролем гемодинамических
показателей. Норадреналин - адреномиметик, действующий преимущественно на α1-
и α2-адренорецепторы и, в меньшей степени, на β1-адренорецепторы.
Норадреналин обладает наиболее выраженным прессорным эффектом, существенно
повышает ОПСС и системное АД, увеличивая риск возникновения аритмий. Эти
свойства норадреналина делают его малопригодным для лечения острой
левожелудочковой недостаточности у больных ИМ, поскольку при его применении
может усугубляться ишемия миокарда и возрастает риск возникновения аритмий.
Монотерапия норадреналином рассматривается в настоящее время как вынужденная
мера при отсутствии других симпатомиметиков. Применение в качестве инотропного
ЛС дигоксина не показано у больных ИМ, поскольку часто сопровождается
возникновением гликозидной интоксикации. При стабилизации состояния больных и
нормализации АД переходят к инфузии вазодилататоров. Нередко введение
нитроглицерина и симпатомиметиков осуществляют параллельно. Для коррекции
микроциркуляторных нарушений и предотвращения дальнейшего тромбозирования
коронарных сосудов у больных с тяжелыми проявлениями отека легких особенно
целесообразно применение гепаринов и антиагрегантов (клопидогрель, блокаторы
IIβ/IIIа рецепторов тромбоцитов, аспирина).
Лечение кардиогенного шока
Начиная терапию кардиогенного шока, следует определить форму этого
осложнения. К числу таких патологических состояний относятся: 1. Рефлекторный
(болевой) шок. 2. Аритмический шок. 3. Гиповолемия, вызванная обезвоживанием
организма и уменьшением венозного притока крови к сердцу. 4. Истинный
кардиогенный шок. Рефлекторный шок легко поддается лечению препаратами,
купирующими болевой ангинозный приступ. Изредка требуется введение
симпатомиметических аминутуов, которые быстро нормализуют системное АД.
Аритмический шок. Клинические проявления аритмического шока, вызванного
падением сердечного выброса в результате возникновения тяжелых нарушений
сердечного ритма и проводимости (пароксизмальная ЖТ, фибрилляция желудочков,
АВ-блокады II-III степени), также сравнительно быстро купируются, если удается
восстановить сердечный ритм с помощью электроимпульсной терапии (ЭИТ), ЭКС или
антиаритмических средств. Гиповолемический шок. Лечение больных с гиповолемическим
шоком имеет некоторые особенности. По понятным причинам, у этих больных, по
крайней мере, на начальном этапе лечения не должны использоваться вазодилататоры
(нитроглицерин и натрия нитропруссид), мочегонные средства, наркотические
анальгетики.
Введение симпатомиметиков (добутаминуту, допаминуту, норадреналин) также
противопоказано больным с выраженной гиповолемией. Лечение больных с гиповолемическим
шоком должно быть направлено, прежде всего, на увеличение венозного возврата
к сердцу, достижение оптимального уровня ДЗЛА (15-18 мм рт. ст.)
и восстановление насосной функции ЛЖ преимущественно за счет увеличение
преднагрузки и включения механизма Старлинга.
С этой целью больным с гиповолемией назначают инфузии 0,9% раствора натрия
хлорида или низкомолекулярных декстранов реополиглюкина или декстрана 40.
Последние не только эффективно возмещают внутрисосудистый объем крови, но и
улучшают реологические свойства крови и микроциркуляцию. Лечение проводят под
контролем ЦВД, ДЗЛА, СИ и АД. Введение жидкости прекращают при повышении
систолического АД до 100 мм. рт. ст. и выше и/или при повышении ДЗЛА (или
диастолического давления в легочной артерии) до 18-20 мм. рт. ст., при появлении
одышки и влажных хрипов в легких, повышении ЦВД.
После прекращения введения жидкости оценивают все гемодинамические
показатели. При необходимости переходят к лечению острой левожелудочковой
недостаточности. Введение симпатомиметиков, вазодилататоров, наркотических
анальгетиков проводят с особой осторожностью под гемодинамическим контролем.
Истинный кардиогенный шок. Лечение истинного кардиогенного шока до сих пор
представляет чрезвычайно сложную задачу, летальность достигает 65-90%.
Смертность от кардиогенного шока удается снизить до 30-40% при своевременном
кардиохирургическом вмешательстве, направленном на восстановление коронарного
кровообращения в инфарктсвязанной КА (ЧТКА, АКШ).
Лечение кардиогенного шока включает: 1.Общие мероприятия: обезболивание;
оксигенотерапию; тромболитическую терапию; гемодинамический мониторинг. 2.
Внутривенное введение жидкости (при отсутствии противопоказаний). 3. Применение
периферических вазодилататоров. 4. Применение инотропных средств. 5. Применение
ЭИТ или ЭКС (при возникновении сердечных аритмий или нарушений проводимости). 6.
Внутриаортальная баллонная контрпульсация. 7. Хирургическое лечение: БКА экстренная;
КШ экстренная; оперативное лечение острого разрыва МЖП, разрыва или дисфункции
папиллярных мышц.
После катетеризации правых отделов сердца и установки плавающего катетера
Свана-Ганца в легочной артерии оценивают показатели центральной гемодинамики,
клинические данные.
1. Если значения СИ ниже 2,2 л/минуту/м2, величина диастолического
давления в легочной артерии (или ДЗЛА) меньше 15 мм рт. ст.,
а рентгенологические и клинические признаки застоя крови в легких отсутствуют,
лечение целесообразно начать с внутривенного введения 0,9% раствора натрия
хлорида или реополиглюкина. Введение жидкости продолжают до тех пор, пока ДЗЛА не
достигнет 18-20 мм рт. ст., а ЦВД - 15-20 мм рт. ст. При этих значения ДЗЛА и ЦВД
дальнейшее введение жидкости противопоказано
2. Если диастолическое давление в легочной артерии (или ДЗЛА) изначально
находится в пределах 18-20 мм рт. ст. и имеются признаки умеренного застоя крови
в легких (влажные хрипы), лечение начинают с симпатомиметиков - добутаминутуа
или/и допаминутуа.
3. Если ДЗЛА превышает 20 мм рт. ст. и имеются признаки легочного застоя
и проявления отека легких, лечение инотропными средствами (добутаминуту или/и
допаминуту) обязательно сочетают с внутривенным капельным введением раствора
нитроглицерина или натрия нитропруссида. Проводится коррекция микроциркуляторных
нарушений (гепарин, трентал, аспирин в обычных дозах), а также метаболического
ацидоза и нарушений электролитного баланса.
4. При отсутствии эффекта и сохранении артериальной гипотонии показано
проведение внутриаортальной баллонной контрпульсации. Используя артериальный
доступ, в грудной отдел аорты вводят баллон, соединенный со специальным
устройством, которое позволяет синхронизировать раздувание баллона с фазами
сердечной деятельности: в систолу он спадается, а в диастолу - раздувается.
Раздувание внутриаортального баллона в диастолу сопровождается увеличением
диастолического давления в аорте. В результате возрастает перфузионное давление
в коронарных сосудах, кровоток по которым осуществляется в диастолу,
увеличивается кровоснабжение неповрежденного миокарда. Во время проведения
внутриаортальной баллонной контрпульсации сердечный выброс увеличивается
в среднем на 40%, а КДД в ЛЖ снижается примерно на 20%, что нередко значительно
улучшает перфузию периферических органов и тканей и состояние больного. После
прекращения процедуры контрпульсации этот эффект полностью исчезает. Поэтому
внутриаортальная контрпульсация у больных ИМ и кардиогенным шоком
используетсядля того, чтобы выиграть время для проведения КАГ и подготовки
к экстренному хирургическому вмешательству с целью ранней реваскуляризации ИМ.
Экстренная чрескожная транслюминутуальная ангиопластика и аорто-коронарное
шунтирование - наиболее распространенные оперативные вмешательства, направленные
на реваскуляризацию миокарда у больных ИМ. Показаниями к экстренным
хирургическим вмешательствам при ИМ являются: кардиогенный шок (не позже чем
12-18 ч от начала осложнения); тяжелая левожелудочковая недостаточность,
обусловленная разрывом МЖП или острой митральной недостаточностью. В этих
случаях АКШ сочетают с протезированием митрального клапана или закрытием дефекта
МЖП. Повторные эпизоды жизнеопасных желудочковых аритмий (ЖТ, ФЖ), рефрактерных
к ЭИТ и медикаментозной терапии. В этих случаях АКЩ сочетают с иссечением зоны
инфаркта или аневризмэктомией.
НАРУШЕНИЯ РИТМА И ПРОВОДИМОСТИ
Разнообразные аритмии являются самыми частыми осложнениями ИМ. В первые часы
и дни от начала заболевания они выявляются при мониторном ЭКГ-наблюдении у
90-95% больных ИМ. Некоторые из аритмий могут быть причиной тяжелых расстройств
гемодинамики и летальных исходов. Причем 2/3 случаев аритмической смерти
приходятся на первые 6 ч после развития ИМ. По своему прогностическому значению
все аритмии, встречающиеся при ИМ, делят на 4 группы (Сыркин А.Л., 2005): 1.
Жизнеопасные аритмии - аритмии, являющиеся непосредственными причинами смерти:
фибрилляция желудочков (ФЖ); асистолия; желудочковые тахикардии (ЖТ); АВ-блокада
III степени (полная). 2. Аритмии, усугубляющие сердечную недостаточность и
гипоперфузию жизненно важных органов: выраженная брадикардия любого
происхождения (ЧСС < 50); выраженная синусовая тахикардия (ЧСС > 100 в минуту);
пароксизмы трепетания и фибрилляции предсердий; пароксизмы наджелудочковой
тахикардии. 3. Аритмии - предвестники жизнеопасных нарушений сердечного ритма:
короткие пароксизмы (“пробежки”) желудочковой тахикардии; АВ-блокада II степени
II типа по Мобитцу; прогрессирующие внутрижелудочковые блокады; частые, парные,
ранние, полиморфные (политопные) ЖЭ. 4. Аритмии - “спутники” острого ИМ:
умеренная синусовая тахикардия; наджелудочковые ЭС; редкие ЖЭ; медленный
и ускоренный узловой ритм; АВ-блокады I и II степени (I типа по Мобитцу).
Все жизнеопасные аритмии (1-я группа) требуют проведения экстренных лечебных
мероприятий, направленных на их купирование. Тактика ведения больных
с аритмиями, относящимися ко 2-й и 3-й группам, должна быть чрезвычайно
взвешенной и учитывать индивидуальный характер и тяжесть аритмий, их воздействие
на гемодинамику и перфузию миокарда, возможность самостоятельного купирования
аритмий при лечении основного заболевания, возможные неблагоприятные последствия
противоаритмической терапии. Аритмии, относящиеся к IV группе, не требуют
специального противоаритмического лечения.
Патогенез аритмий при инфаркте миокарда
Электрофизиологические механизмы возникновения аритмий у больных острым ИМ:
патологический автоматизм и триггерная активность ишемизированных, но не
подвергшихся некрозу субэндокардиальных волокон Пуркинье и кардиомиоцитов;
формирование повторного входа (re-entry) и патологическая циркуляция волны
возбуждения; нарушение функции проводимости; снижение функции автоматизма
СА-узла. Основными факторами, способствующими формированию этих механизмов
аритмий, являются локальное очаговое замедление и фрагментация волны
возбуждения, распространяющейся в электрически неоднородной среде, отдельные
участки которой отличаются различной длительностью ПД и рефрактерных периодов,
скоростью спонтанной диастолической деполяризации. Большое значение имеет также
механическое растяжение волокон миокарда в результате дилатации камер сердца,
наличие гипертрофии сердечной мышцы, а также нарушения нейрогуморальной
регуляции сердечного ритма, электролитного обмена, кислотно-основного состояния,
гиперкатехоламинутуемия.
Синусовые нарушения ритма
Синусовая брадикардия - урежение сердечных сокращений (< 60 в минуту)
вследствие снижения автоматизма СА-узла. Синусовая брадикардия возникает при
инфарктах заднедиафрагмальной области, поскольку именно в этих случаях
происходит тромбоз ПКА, участвующей в кровоснабжении СА-узла. Нередко синусовая
брадикардия у больных с нижним ИМ может явиться следствием ваготонической
реакции по типу рефлекса Бецольда-Яриша, так как в заднедиафрагмальной (нижней)
стенке ЛЖ богато представлены афферентные рецепторы n. vagi. В этих случаях
синусовая брадикардия часто сочетается с выраженной артериальной гипотонией,
болями в эпигастральной области (в первые часы ИМ), тошнотой и рвотой.
Для купирования брадикардии внутривенно струйно вводят 0,5-1,0 мг атропина
сульфата. Если ЧСС не увеличивается, через несколько минутуут атропин вводят
повторно в тех же дозах. Если эффект все же отсутствует и ЧСС не превышает
40-50 ударов в минуту, сохраняется низкое АД, падает СИ и появляются признаки
периферической гипоперфузии тканей и органов, показана временная ЭКС. Синусовая
брадикардия, не сопровождающаяся ухудшением состояния больного, специального
лечения не требует. Синусовая тахикардия - увеличение ЧСС > 100 ударов
встречается у 1/4 - 1/3 больных ИМ, чаще передней локализации. Наиболее частыми
причинами синусовой тахикардии у больных ИМ являются: активация САС
и гиперкатехоламинутуемия (стресс, боль, страх смерти в первые часы
заболевания); острая сердечная недостаточность; гиповолемия; сопутствующий
перикардит; лихорадка; застойная сердечная недостаточность (в поздние сроки ИМ);
острые желудочно-кишечные кровотечения и другие причины. Хотя синусовая
тахикардия ведет к увеличению потребности миокарда в кислороде и в условиях
острого тромбоза КА может способствовать расширению зоны некроза, в большинстве
случаев она не требует специального лечения, поскольку при устранении указанных
причин аритмии купируется и сама синусовая тахикардия. Когда ЧСС превышает
110-120 ударов, показано дополнительное назначение малых доз β-адреноблокаторов.
Наджелудочковые нарушения ритма
Наджелудочковая экстрасистолия (предсердная, узловая) регистрируется у 20-25%
больных ИМ. В большинстве случаев ее появление не требует специального
противоаритмического лечения. Фибрилляция предсердий встречается примерно
у 10-15% больных ИМ, в том числе у больных ИМ правого желудочка. Ее
возникновение связано, в первую очередь, с растяжением стенок предсердия при
повышении в нем давления при острой сердечной недостаточности или
с распространением ишемического повреждения на миокард предсердий. Возникновение
тахисистолической формы фибрилляции предсердий может способствовать нарушению
перфузии миокарда и усугублению признаков сердечной недостаточности. Решение
вопроса о необходимости экстренного купирования пароксизма мерцательной аритмии
у больных ИМ должно быть взвешенным. При нормосистолической или
брадисистолической форме мерцательной аритмии лечения не требуется, так как
у многих больных ИМ через несколько дней синусовый ритм восстанавливается
самостоятельно.
Тахисистолическая форма фибрилляции предсердий при плохой ее переносимости
больным и/или при нарастании признаков сердечной недостаточности требует
купирования пароксизма. С этой целью лучше использовать амиодарон (300-450 мг
внутривенно капельно) или ЭИТ. Предварительно необходимо оценить, насколько
эффективным может оказаться купирование пароксизма мерцательной
аритмии, насколько высока вероятность рецидива фибрилляции предсердий.
Пароксизмальная наджелудочковая тахикардия (предсердная или из АВ-соединения)
характеризуется очень высоким ритмом желудочков (до 120-250 в минуту), что,
несомненно, оказывает выраженное отрицательное влияние на функциональное
состояние ЛЖ и перфузию миокарда. Купирование пароксизма наджелудочковой
тахикардии целесообразно начинать сбыстрого болюсного внутривенного введения
6-12 мг аденозина (АТФ). При отсутствии эффекта введение АТФ повторяют или
вводят новокаинамид, аймалин или другой противоаритмический препарат.
Желудочковые нарушения ритма
Желудочковую экстрасистолию (ЖЭ) обнаруживают почти у всех больных ИМ. Сами
по себе ЖЭ не оказывают сколько-нибудь существенного влияния на гемодинамику
и перфузию миокарда. Некоторые из них свидетельствуют о наличии выраженной
негомогенности миокарда ЛЖ, которая может являться причиной других,
жизнеопасных, аритмий: желудочковой тахикардии (ЖТ) и фибрилляции желудочков
(ФЖ). К прогностически неблагоприятным ЖЭ, которые ассоциируются с высоким
риском возникновения ЖТ и ФЖ, традиционно относят: частые ЖЭ (более 30 в час);
политопные и полиморфные ЖЭ; ранние ЖЭ (типа “R на Т”); парные ЖЭ; групповые
и “залповые” ЖЭ. Эти виды ЖЭ расцениваются как своеобразные предвестники ЖТ
и ФЖ.
В последние годы убедительно показано, что и другие виды ЖЭ (поздние ЖЭ)
нередко предшествуют ФЖ. Перечисленные виды “угрожающих” ЖЭ иногда выявляются
у молодых здоровых лиц. Это свидетельствует о том, что вопрос о прогностическом
значении желудочковой экстрасистолии у больных ИМ далек от своего разрешения.
Появление любой желудочковой эктопической активности у больного ИМ, особенно
в первые часы заболевания, должно служить поводом для особой настороженности
врача в отношении возможности ФЖ. ЖЭ не является поводом для немедленного
профилактического назначения антиаритмических препаратов (лидокаина), как это
считалось совсем недавно, поскольку неоправданное применение этих препаратов
у больных ИМ повышает риск развития асистолии желудочков и внезапной сердечной
смерти. С профилактической целью могут использоваться β-адреноблокаторы.
Короткие эпизоды (“пробежки”) желудочковой тахикардии (ЖТ), состоящие из
нескольких следующих друг за другом ЖЭ, не оказывают влияния на гемодинамику,
уровень АД и коронарный кровоток и нередко остаются незамеченными больными. Как
правило, они выявляются при мониторном наблюдении ЭКГ и не требуют специального
антиаритмического лечения, за исключением возможного назначения
β-адреноблокаторов. Стойкая ЖТ с частотой ритма 160-220 в минуту может приводить
к расширению зоны некроза и ишемии миокарда, снижению насосной функции сердца и
периферической гипоперфузии. Неблагоприятными исходами такой формы ЖТ являются:
отек легких; аритмический шок; развитие ФЖ; синкопальные состояния (обмороки)
вплоть до возникновения типичных приступов Морганьи-Адамса-Стокса с потерей
сознания и судорогами. При стойкой ЖТ необходимо экстренное купирование
пароксизма.
Можно использовать следующую последовательность лечебных мероприятий: 1. Удар
кулаком в грудь. Этот прием нередко позволяет прервать патологическую циркуляцию
волны возбуждения. 2. Медикаментозное купирование пароксизма. Лидокаин вводят
внутривенно струйно в дозе 50 мг. При отсутствии эффекта через 2 минуту возможно
повторное введение препарата в той же дозе. После купирования пароксизма ЖТ
назначают внутривенно медленно инфузию лидокаина в дозе 100-150 мг. 3. При
отсутствии эффeкта от введения лидокаина проводят электрическую кардиоверсию.
Иногда приступы ЖТ можно купировать с помощью учащающей программированной
электрической стимуляции сердца.
Фибрилляция желудочков (ФЖ) характеризуется внезапной потерей сознания,
отсутствием тонов сердца и артериального пульса, АД не определяется. Возникает
агональное дыхание, которое вскоре прекращается совсем (клиническая смерть).
Различают первичную фибрилляцию, которая развивается в первые минутууты и часы
ИМ. На долю первичной ФЖ приходится около 80% всех случаев этого осложнения.
Вторичную ФЖ, которая возникает через несколько дней от начала ИМ и сочетается
с острой левожелудочковой недостаточностью и/или кардиогенным шоком; позднюю ФЖ,
которая развивается на 2-6-й неделе заболевания. Наиболее неблагоприятной
в прогностическом отношении является вторичная ФЖ. Риск рецидива ФЖ и внезапной
смерти у больных, перенесших кардиоверсию, чрезвычайно велик.
Нарушения АВ-проводимости
АВ-блокада I степени не требует специального лечения, хотя при ее
возникновении необходимо отменить β-адреноблокаторы. АВ-бокада II степени I типа
Мобитца характеризуется постепенным удлинением интервала Р-Q(R) с периодическим
выпадением желудочкового комплекса QRST. Этот вид АВ-блокады обычно носит
преходящий характер и сохраняется в течение первых 3-х дней от начала ИМ.
Блокада вызвана обычно ишемией АВ-узла, связанной с окклюзией ПКА при
заднедиафрагмальном ИМ. В возникновении этого типа блокады нередко имеет
значение рефлекторное повышение тонуса блуждающего нерва. Лечение включает
атропин подкожно 0,5-1 мг или в вену - 0,3-0,5 мг 2-3 раза в сутки. Общая
суточная доза не должна превышать 3 мл 0,1% раствора атропина. При падении АД,
показателей гемодинамики или кардиогенном шоке целесообразно применение ЭКС.
АВ-блокада II степени II типа Мобитца на ЭКГ представлена постоянным (нормальным
или удлиненным) интервалом Р-Q(R) и периодическими выпадениями желудочкового
комплекса. Этот тип блокады обусловлен необратимым проведением возбуждения
в нижней части пучка Гиса, нередко в сочетании с блокадой левой передней, левой
задней или правой ветви пучка Гиса.
АВ-блокада II степени II типа Мобитца при ИМ имеет весьма неблагоприятный
прогноз, нередко внезапно переходит в АВ-блокаду III степени (полную). Поэтому
во всех случаях АВ-блокады II степени II типа целесообразно применение временной
ЭКС. АВ-блокада III степени (полная) может развиться в первые часы и дни ИМ.
В целом это нарушение предсердно-желудочкового проведения имеет неблагоприятный
прогноз, хотя многое зависит от локализации нарушенного проведения и характера
замещающего ритма. При проксимальной АВ-блокаде III степени эктопический
водитель ритма располагается обычно в АВ-соединении ниже места блокады. На ЭКГ
регистрируют полное разобщение предсердного и желудочкового ритмов,
ЧСС превышает 40 ударов в минуту, а желудочковые комплексы QRS не изменены
(“узкие”). Подобная блокада часто сочетается с заднедиафрагмальным ИМ и высоким
тонусом блуждающего нерва. В большинстве случаев она исчезает через несколько
дней от начала заболевания, мало осложняя прогноз ИМ.
АНЕВРИЗМА ЛЕВОГО ЖЕЛУДОЧКА
Аневризма левого желудочка - это ограниченное выбухание истонченного и не
сокращающегося участка стенки ЛЖ, состоящего из некротизированной или рубцовой
ткани. Аневризма развивается при обширных трансмуральных ИМ, преимущественно
в области верхушки и передней стенки ЛЖ. Аневризма ПЖ встречается крайне редко.
Ограниченное выпячивание некротизированной стенки желудочка во время его систолы
(дискинезия) наблюдается в остром периоде заболевания практически у всех больных
ИМ с зубцом Q. Это динамическая аневризма ЛЖ - важный признак трансмурального
ИМ. Со временем в этой области происходит формирование полноценного плотного
рубца, локальное систолическое выпячивание стенки желудочка (дискинезия)
у большинства больных исчезает, и в этой зоне остаются лишь эхокардиографические
признаки локальной акинезии (отсутствия движения стенки желудочка). В 15-20%
случаев трансмурального ИМ аневризма сохраняется. Основными факторами,
способствующими образованию истинной аневризмы ЛЖ, являются: обширное
трансмуральное поражение ЛЖ; сопутствующая АГ; повышение внутрижелудочкового
давления любого генеза; повышенная физическая активность больного в острой
и подострой стадиях ИМ, нарушения постельного режима; нарушения процесса
консолидации (уплотнения) рубца.
Формирование аневризмы ЛЖ может иметь ряд неблагоприятных последствий: 1.
Увеличение и деформация полости ЛЖ, согласно закону Лапласа, сопровождаются
ростом внутримиокардиального напряжения неповрежденных участков сердечной мышцы,
увеличивая тем самым общую потребность миокарда в кислороде и способствуя
возрастанию признаков коронарной недостаточности. 2. При аневризме еще больше
усугубляются систолическая и диастолическая дисфункции ЛЖ, снижается сердечный
выброс, возрастает КДД ЛЖ и давление наполнения желудочка. Это повышает риск
возникновения застоя крови в малом круге кровообращения и других признаков
сердечной недостаточности. 3. В области аневризмы формируется пристеночный
тромб, что может приводить к развитию тромбоэмболических осложнений. Наличие
аневризмы способствует формированию повторного входа и патологической циркуляции
волны возбуждения (macro-re-entry) с развитием жизнеопасных желудочковых
нарушений ритма (пароксизмальной ЖТ и ФЖ). Летальность больных трансмуральным
ИМ, осложненным аневризмой ЛЖ, в 4-5 раз выше, чем больных без аневризмы.
Диагностика
Диагностика аневризмы ЛЖ основывается на выявлении следующих клинических
и инструментальных признаков: 1. Отмечается прогрессирующая сердечная
недостаточность, рефрактерная к медикаментозной терапии. Обнаружение при
пальпации сердца отчетливой локальной прекардиальной пульсации в III-IV
межреберье слева от грудины или появление ранее отсутствовавшей пульсации
в области верхушечного толчка. В этом последнем случае (аневризма верхушки)
часто пальпируется так называемый “двойной” верхушечный толчок, отражающий
пассивное движение тонкой аневризматической стенки во время систолы желудочка,
в период систолы левого предсердия. Это бывает хорошо видно на кривой
верхушечной кардиограммы (апекскардиограммы), отражающей механическое движение
верхушки сердца во время сердечного цикла. I тон над верхушкой ослаблен. Часто
выслушиваются добавочные III или IV тоны. При аускультации сердца в этих случаях
часто определяется ритм галопа. Характерны систолический и др. шумы над
верхушкой ввидузавихрения крови в аневризматическом мешке, недостаточности
митрального клапана. Нередко определяется симптом Казем-Бека - верхушечный
толчок усилен (пульсация аневризмы), а пульс слабого наполнения и напряжения.
2. Отсутствие типичной динамики ЭКГ в остром, подостром и
постинфарктном периодах (“застывшая” ЭКГ). На ЭКГ выявляются признаки обширного
трансмурального ИМ (патологический QS или Qr) с подъемом сегмента RS-Т,
сохраняющимся более 2-3 недель от начала заболевания. Последний признак является
наиболее надежным для диагностики аневризмы, свидетельствуя о наличии вокруг
аневризмы обширной зоны повреждения тканей, вызванного постоянным механическим
растяжением этих участков миокарда, возникающим при каждом сокращении сердца
и выбухании стенки аневризмы.
3. Эхокардиографические признаки локального ограниченного выбухания
(дискинезии) и истончения стенки ЛЖ. При двухмерной ЭхоКГ у больных
с трансмуральным ИМ динамическая аневризма ЛЖ проявляется дискинезией миокарда
в виде локальной деформации (выбухания) внутреннего контура ЛЖ только во время
систолы желудочка. В отличие от этого истинная аневризма ЛЖ проявляется стойкой
систолической и диастолической деформацией внутреннего контура и наличием резко
выраженной демаркационной линии на границе с интактными сегментами (рисунок 20).
Рисунок 20. Острая аневризма левого желудочка у больного П., 66 лет с
повтоным обширным трансмуральным инфарктом миокарда, формированием
внутрисердечного тромба (Г.А. Пичко).
4. Рентгенологически можно обнаружить лишь обширные аневризмы,
захватывающие верхушку и переднебоковую стенку ЛЖ. В зависимости от периода ИМ,
в котором обнаруживаются перечисленные признаки, различают острую и хроническую
аневризму ЛЖ.
Лечение
Эффективное лечение аневризмы ЛЖ заключается в иссечении аневризматического
мешка. Аневризмэктомия показана при быстром прогрессировании сердечной
недостаточности, возникновении тяжелых повторных желудочковых нарушений ритма,
рефрактерных к консервативной терапии, при повторных тромбоэмболиях из
пристеночного тромба, располагающегося в области аневризмы. Консервативная
терапия заключается в лечении ХСН и использовании антиагрегантов для
профилактики развития внутрисердечного тромбоза.
РАЗРЫВ СЕРДЦА
Разрывы сердца относятся к ранним, фатальным осложнениям трансмурального ИМ.
В большинстве случаев происходят в первые 3-5 дней от начала заболевания. После
2-х недель инфаркта разрывы встречаются очень редко, поскольку к этому времени
в области инфаркта начинает формироваться плотный рубец, препятствующий
возникновению разрывов. Различают внешние и внутренние разрывы сердца. При
внешних разрывах кровь из полости ЛЖ быстро проникает в полость перикарда
и развивается тампонада сердца, ведущая к его остановке. К внутренним разрывам
относят разрывы МЖП и сосочковых мышц, что также приводит к тяжелым
гемодинамическим нарушениям, резко ухудшающим прогноз ИМ. По данным Американской
ассоциации сердца (2004) разрывы стенки желудочка осложняют течение ИМ с зубцом
Q в 3-6% случаев и наблюдаются преимущественно при передней локализации ИМ,
у больных старше 50-60 лет, у женщин, особенно при наличии сопутствующей АГ, а
также использование глюкокортикостероидов или нестероидных противовоспалительных
препаратов. Преобладают внешние разрывы ЛЖ. Разрывы ПЖ встречаются крайне редко.
Внешние разрывы
Разрыв свободной стенки ЛЖ часто протекает молниеносно. Кровь из полости ЛЖ
изливается в полость перикарда и возникает гемотампонада, приводящая к остановке
сердца и мгновенной смерти. В других случаях быстро нарастающие клинические
проявления разрыва сердца можно наблюдать в течение нескольких минутуут, реже
часов. У больного внезапно появляются интенсивные упорные боли за грудиной,
в области сердца, не купирующиеся наркотическими анальгетиками. Определяется
острое расширение границ сердца АД резко снижается или вовсе не определяется.
Развивается кардиогенный шок. Артериальный пульс становится нитевидным
и исчезает совсем. Больной теряет сознание. С трудом прослушиваются тоны сердца.
Появляется выраженный цианоз, быстро набухают шейные вены. Возникающая
брадикардия позволяет заподозрить развитие тампонады сердца. Отмечается
рефрактерность к реанимационным мероприятиям.
На ЭКГ-мониторе в течение короткого времени продолжает определяться синусовый
или эктопический ритм. Сердце сокращается, но кровь в аорту практически не
поступает, а попадает в полость перикарда. Подобное несоответствие между
продолжающейся электрической активностью сердца и отсутствием насосной функции
получило название “электромеханическая диссоциация”. При развитии тампонады
сердца она очень быстро переходит в асистолию желудочков. В еще более редких
случаях наблюдается подострый разрыв свободной стенки ЛЖ. Размеры такого надрыва
стенки не столь велики, и он может даже частично тромбироваться. Поэтому кровь
сравнительно медленно заполняет полость перикарда, и клиническая картина
гемотампонады нарастает постепенно. Часто при таком варианте развития тампонады
на первый план выступает болевой синдром, возникающий за часы до развития
тампонады, связанный с постепенно распространяющимся в толще миокарда надрывом
стенки сердца и пропитыванием ее кровью.
Интенсивная боль за грудиной, быстрое падение АД, вновь выявляемый подъем
сегмента RS-Т в нескольких отведениях ЭКГ очень напоминутуают клинику
рецидивирующего ИМ, осложненного кардиогенным шоком. В этих условиях по понятным
причинам очень опасно применение антикоагулянтов, тромболитической терапии или
инотропных средств. Поэтому столь важна своевременная диагностика гемотампонады.
Она может быть основана на данных экстренной ЭхоКГ (выявление жидкости в полости
перикарда) и результатах гемодинамического мониторинга (быстрое повышение ЦВД
при сниженных величинах ДЗЛА). В этих случаях иногда удается направить больного
на экстренную кардиохирургическую операцию.
Разрыв межжелудочковой перегородки
Разрыв МЖП также возникает в течение первых 7 дней, редко - на протяжении 2-х
недель от начала ИМ. При перфорации МЖП часть ударного объема ЛЖ выбрасывается
в ПЖ, что приводит к значительным гемодинамическим нарушениям. Объемная
перегрузка ПЖ может сопровождаться признаками быстро нарастающей
правожелудочковой недостаточности. Увеличение нагрузки на ЛЖ и снижение
эффективного сердечного выброса в аорту сопровождаются усугублением признаков
левожелудочковой недостаточности - отека легких и кардиогенного шока. Если не
проводится хирургическая коррекция дефекта, более половины больных с разрывом
МЖП умирают в течение ближайшей недели.
Клиническая картина разрыва МЖП складывается из нескольких признаков:
1.Внезапное ухудшение состояния больных: появление и быстрое нарастание
признаков правожелудочковой недостаточности (цианоз, отеки, увеличение печени,
набухание шейных вен, рост ЦВД); усугубление признаков острой левожелудочковой
недостаточности и отека легких (одышка и удушье, влажные хрипы в легких, рост
ДЗЛА); появление признаков кардиогенного шока (СИ < 1,8-2,0 л/минуту/м2,
систолическое АД < 90 мм. рт. ст., признаки периферической гипоперфузии,
олигурия). 2. Внезапное появление над всей прекардиальной областью грубого
пансистолического шума с максимумом в III-IV межреберье по левому краю грудины.
Шум может проводиться в межлопаточное пространство и часто сопровождается
признаками дилатации ПЖ. Внезапное появление прекардиального систолического
дрожания, выявляемого при пальпации области сердца
Для верификации разрыва МЖП чаще всего используют два инструментальных метода
исследования: 1. Катетеризация правых отделов сердца и легочной артерии
с определением концентрации кислорода в правых камерах сердца. В норме
содержание кислорода в ПП и ПЖ примерно одинаковое, тогда как при перфорации МЖП
часть артериальной крови с богатым содержанием кислорода попадает в ПЖ. Поэтому
РО2 в ПЖ оказывается существенно выше, чем в ПП, что подтверждает
диагноз разрыва МЖП. 2. Метод допплер-ЭхоКГ, который позволяет обнаружить
систолический поток крови из ЛЖ в ПЖ через дефект МЖП. При подтверждении
диагноза разрыва МЖП больной должен быть направлен на экстренное хирургическое
лечение, которое является единственным способом лечения таких больных.
Целесообразна предварительная стабилизация нарушенной гемодинамики
с использованием внутриаортальной баллонной контрпульсации и внутривенного
капельного введения растворов нитроглицерина и натрия нитропруссида.
Разрыв сосочковых мышц
Разрыв сосочковых мышц осложняет течение трансмурального ИМ в 1% случаев.
Чаще поражается задняя сосочковая мышца в связи с тем, что она кровоснабжается
хуже, чем переднебоковая. В результате нарушается функция митрального клапана:
во время систолы желудочка одна из створок провисает в полость ЛП. Несмыкание
створок митрального клапана приводит к тяжелой относительной митральной
недостаточности, острое возникновение которой способствует резкой объемной
перегрузке ЛЖ и ЛП. В результате быстро развивается тяжелая левожелудочковая
недостаточность и отек легких. Клиническими признаками разрыва сосочковой мышцы
являются: 1. Внезапное развитие острой левожелудочковой недостаточности (отека
легких). 2. Систолический шум на верхушке, проводящийся в левую подмышечную
область. Шум нередко сопровождается дилатацией ЛП и ЛЖ (по данным перкуссии
сердца и ЭхоКГ - исследования), а также ослаблением I тона на верхушке. 3.
Главным признаком разрыва сосочковой мышцы является “молотящая” створка
митрального клапана (по данным двухмерной ЭхоКГ), которая провисает во время
систолы желудочков в полость ЛП. 4. При допплеровском режиме исследования
обнаруживается эксцентрически расположенная струя регургитации,
распространяющаяся в левое предсердие в сторону от пораженной створки. При
разрыве передней папиллярной мышцы струя направлена в сторону заднебоковой
стенки ЛП, а при разрыве задней сосочковой мышцы - в сторону МЖП.
Лечение разрывов сосочковой мышцы только хирургическое. Перед операцией
необходима стабилизация гемодинамики и состояния больного, в связи с чем
используют внутривенные инфузии нитроглицерина и натрия нитропруссида, а также
внутриаортальную баллонную контрпульсацию. Если эти предварительные лечебные
мероприятия имеют успех, целесообразно отложить проведение радикальной операции
на 4-6 недель после инфаркта. Если же состояние больного не улучшается, показано
экстренное оперативное вмешательство.
Относительная недостаточность митрального клапана у больных ИМ может
развиться не только в результате разрыва сосочковой мышцы, но и при их
выраженной дисфункции, которая наблюдается у большинства больных ИМ с зубцом Q
в течение 1-й недели заболевания. Дисфункция сосочковых мышц в этих случаях
обусловлена их ишемией или вовлечением в некротический процесс. Определенное
значение может иметь изменение размеров и формы ЛЖ, обусловленное его
ремоделированием и снижением сократимости. Клинически определяется систолический
шум на верхушке, проводящийся в левую подмышечную область, признаки
систолической регургитации крови в ЛП при допплер-ЭхоКГ. Однако в этих случаях
отсутствует основной признак разрыва сосочковой мышцы - “молотящая” створка
митрального клапана и выявляется лишь небольшое пролабирование одной из створок
клапана. Дисфункция сосочковой мышцы не требует специального лечения:
в большинстве случаев на фоне интенсивной терапии ИМ признаки дисфункции
уменьшаются.
Проведение тромболитической терапии и других методов ранней реваскуляризации
миокарда позволяет уменьшить зону некроза, существенно снизить риск формрования
разрыва миокарда. Большое внимание необходимо уделять соблюдению строгого
постельного режима в первые несколько дней от развития ИМ. Развивающийся у
некоторых больных ИМ запор также может расцениваться фактором риска развития
разрыва миокарда. Приводим наблюдение. Больная Б., 62 лет на третьи сутки ИМ
была переведена из отделения реанимации в палату кардиологического отделения.
Пошла в сопровождении родственницы в туалет, где внезапно потеряла сознание.
Проведение реанимационных мероприятий было безуспешным. На вскрытии подтверждено
развитие внешнего разрыва сердца.
ПЕРИКАРДИТ
У большинства больных трансмуральным ИМ на 2-4-е сутки болезни может
развиться реактивный фибринозный или серозно-фибринозный перикардит с небольшим
объемом выпота в перикарде. В клинической практике перикардит обнаруживают
только у 5-10% больных ИМ, что связано со сложностями его диагностики.
Клиническая картина
Перикардит у больного ИМ с зубцом Q можно заподозрить по следующим
клинико-инструментальным признакам. Необъяснимое возобновление болей в области
сердца на 2-4-й день болезни, которое нередко трактуют как рецидив ИМ,
расширение зоны некроза. Однако боль в области сердца при перикардите отличается
от типичного ангинозного приступа, характерного для ИМ. Она носит постоянный,
тупой характер, интенсивность боли усиливается при глубоком дыхании, кашле,
глотании. Интенсивность боли меняется в зависимости от положения тела больного,
чаще усиливаясь в положении лежа на спине и уменьшаясь - в положении сидя.
2. Шум трения перикарда выслушивается при сухом перикардите, но только при
поражении передней стенки ЛЖ и верхушки сердца. Шум трения выслушивается на
ограниченном участке, обычно в области верхушки или абсолютной тупости сердца,
лучше - в положении сидя. Шум сохраняется очень непродолжительное время (от
нескольких часов до 2-3 суток). При появлении выпота в полости перикарда шум
трения исчезает.
3. Развитие перикардита может сопровождаться повышением температуры тела до
субфебрильных цифр.
4. Инструментальная диагностика перикардита нередко затруднена. Типичные
ЭКГ-признаки перикардита (снижение вольтажа желудочкового комплекса,
однонаправленный конкордантный подъем сегмента RS-Т в нескольких отведениях)
часто нивелируются на фоне выраженных инфарктных изменений комплекса QRSТ. К
характерным признакам перикардита перикардита относят депрессия сегмента
PR, элевацию точки J с вогнутой
вниз косовосходящей элевацией ST.
5. Эхокардиография может оказать существенную помощь в диагностике только при
выпотных перикардитах. В этих случаях на ЭхоКГ выявляется сепарация
париетального и висцерального листков перикарда. При незначительном количестве
жидкости расхождение листов перикарда выявляется только за задней стенкой ЛЖ в
систолу и немного диастолу.
Лечение
В большинстве случаев специального лечения эпистенокардического перикардита
не требуется. При появлении отчетливых признаков острого перикардита (упорные
боли в области сердца, шум трения перикарда) назначают ацетилсалициловую кислоту
(150-350 мг 4 раза в сутки) или другие НПВС (ортофен, ибупрофен, диклофенак,
мовалис) в обычных терапевтических дозах. В отдельных случаях возможно
парентеральное назначение глюкокортикоидов (преднизолон, метипред).
ТРОМБОЭМБОЛИИ
Тромбоэмболические осложнения существенно ухудшают прогноз больных ИМ.
В связи с широким внедрением в лечении ИМ тромболитических препаратов,
антикоагулянтов и дезагрегантов частота тромбоэмболических осложнений ИМ
снизилась до 5-10%. Источником тромбоэмболий артерий являются: пристеночные
тромбы в полости ЛЖ и тромбы в левом предсердии, формирующиеся при фибрилляции
предсердий. Особенно большую опасность представляют подвижные тромбы. Отрываясь
от места их образования, тромбы или их частицы окклюзируют артериальное
сосудистое русло, вызывая ишемию и некроз органов.
Тромбоэмболия сосудов головного мозга сопровождается внезапно возникающей
неврологической симптоматикой, чаще всего - признаками нарушения мозгового
кровообращения (гемипарез, гемиплегия, дизартрия, потеря сознания, расстройства
функции тазовых органов). Тромбоэмболия мезентериальных артерий является
причиной некроза кишечника и развития перитонита. Внезапно у больных появляются
очень интенсивные и быстро нарастающие жгучие и нестерпимые боли в животе,
которые не купируются ни спазмолитиками, ни наркотическими анальгетиками. Быстро
развивается парез кишечника и появляются симптомы острого перитонита
и нарастающей интоксикации. В крови определяется выраженный лейкоцитоз
и значительный сдвиг лейкоцитарной формулы влево. Тромбоэмболия артерий
конечностей проявляется несколькими внезапно наступающими симптомами: резкой
нестерпимой болью в конечности; побледнением и похолоданием конечности;
отсутствием артериального пульса ниже места окклюзии.
Быстро развиваются трофические изменения и гангрена конечности. Тромбоэмболия
почечной артерии приводит к развитию инфаркта почек. Внезапно появляются боли
в поясничной области и в левом или в правом подреберье, гематурия, олигурия.
Обычно отмечается подъем АД, обусловленный ишемией почки. Тромбоэмболия легочной
артерии (ТЭЛА) развивается гораздо чаще, чем эмболии артерий большого круга
кровообращения, Источником ТЭЛА в большинстве случаев являются тромбы в глубоких
венах нижних конечностей.
Профилактика тромбоэмболических осложнений включает: 1. Своевременную
диагностику внутрисердечных тромбов и тромбов в глубоких венах нижних
конечностей у всех больных трансмуральным ИМ. Наилучшим способом неинвазивной
диагностики служит эхокардиография и дуплексное ультразвуковое исследование вен
нижних конечностей. 2. При обнаружении подвижных тромбов в полости ЛЖ
целесообразно назначение антикоагулянтов: нефракционированного или
низкомолекулярных гепаринов с последующим переводом больных на прием непрямых
антикоагулянтов (варфарин, фенилин) в течение длительного времени (3-6 месяцев).
3. Для профилактики тромбоза глубоких вен ног рекомендуется ранняя активизация
больных, занятия лечебной физкультурой.
СИНДРОМ ДРЕССЛЕРА
Постинфарктный синдром - это аутоиммунное поражение перикарда, плевры
и легких, возникающее обычно на 2-6-й неделе от начала ИМ. Типичная триада,
характерная для постинфарктного синдрома (перикардит, плеврит, пневмонит),
иногда сочетается с аутоиммунным поражением синовиальных оболочек суставов.
Постинфарктный синдром связывают с обнаружением в организме больных ИМ
аутоантител к миокардиальным и перикардиальным антигенам.
Клиническая картина постинфарктного синдрома различается у разных больных
в зависимости от преимущественного поражения перечисленных серозных оболочек
и легких. Однако обязательным является асептический аутоиммунный процесс
в перикарде - перикардит. Перикардит при синдроме Дресслера обычно протекает
нетяжело. На 2-6-й неделе заболевания появляются боли в области сердца, которые
носят постоянный, неострый характер и не купируются нитроглицерином. Их
продолжительность достигает 30-40 минуту и больше. Одновременно повышается
температура тела до субфебрильных цифр, появляется слабость. Болевой синдром
и лихорадка исчезают через несколько дней. Количество экссудата,
накапливающегося в полости перикарда, невелико и не приводит к нарушениям
гемодинамики. Изменения ЭКГ обычно мало выражены. При двухмерной ЭхоКГ можно
обнаружить уплотнение листков перикарда и их небольшую сепарацию.
Плеврит при постинфарктном синдроме может быть как односторонним, так
и двусторонним. В начале заболевания появляются боли в грудной клетке,
усиливающиеся при дыхании, выслушивается шум трения плевры. Когда в плевральной
полости накапливается экссудат, боли прекращаются, и шум трения не
выслушивается. При объективном исследовании обнаруживают небольшое притупление
перкуторного звука и ослабление дыхания на стороне поражения. При развитии
междолевого плеврита физикальные изменения в легких могут быть очень скудными.
Диагноз подтверждается только при рентгенологическом исследовании. Аутоиммунный
пневмонит при постинфарктном синдроме выявляется несколько реже, чем перикардит
и плеврит. Субъективно пневмонит проявляется усугублением одышки, что нередко
расценивается как признак левожелудочковой недостаточности.
Однако назначение диуретиков или инотропных лекарственных средств не приносит
облегчения. При объективном исследовании в легких выявляется ограниченный
участок, в котором на фоне несколько ослабленного дыхания на высоте вдоха
выслушивается крепитация. Иногда могут появляться мелкопузырчатые влажные хрипы.
Лишь изредка, если очаг иммунного воспаления достаточно велик, можно выявить
небольшое притупление перкуторного звука. В остальных случаях над легкими
определяется ясный легочный звук.
Лечение постинфарктного синдрома заключается в назначении нестероидных
противовоспалительных средств, а в более тяжелых случаях - глюкокортикоидов.
Глюкокортикоиды оказывают выраженный и быстрый эффект в связи с аутоиммунным
генезом данного осложнения. Преднизолон назначают внутрь в дозе 20-30 мг
в сутки, постепенно снижая дозу, примерно на 2,5-5 мг в неделю. При
рецидивирующем течении постинфарктного синдрома лечение продолжают в течение
нескольких недель. НПВС достаточно эффективны при постинфарктном синдроме,
особенно при нетяжелых клинических проявлениях синдрома Дресслера.
Назначают ацетилсалициловую кислоту, индометацин, ибупрофен, диклофенак,
мовалис в обычных терапевтических дозах. При назначении глюкокортикоидов и НПВС
в остром и подостром периодах ИМ следует учитывать, что эти препараты могут
нарушать процессы рубцевания инфаркта, повышая риск разрывов сердца. При
синдроме Дресслера антикоагулянты должны быть отменены. |