
13.7. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Технологический прогресс, а с ним и развитие кардиохирургии привели к
появлению инвазивных методик, позволяющих оказать помощь сложной категории
пациентов с хронической сердечной недостаточностью. Следует помнить об основных
возможных причинах сердечной недостаточности у пациентов с ИБС: 1. Сопутствующее
поражение клапанов сердца, возможностей хирургического лечения которого мы
коснулись в предыдущем разделе. 2. Нарушения сердечного ритма, обусловленные
кардиосклерозом. В арсенале кардиохирургов-аритмологов имеется достаточно
широкий спектр хирургических и малоинвазивных методик, позволяющих
воздействовать на различные формы брадиаритмий (постоянная
электрокардиостимуляция), мерцательную аритмию (радиочастотная деструкция),
желудочковый асинхронизм (имплантация ресинхронизирующих устройств) и
желудочковые нарушения ритма (имплантация кардиовертеров-дефибрилляторов). 3.
Постинфарктная аневризма левого желудочка, на хирургическом лечении которой мы
останавливались ранее. 4. Ишемическая кардиомиопатия (ИКМП).
ИКМП – вариант осложненного течения ИБС, характеризующаяся множественным
поражением коронарных артерий, распространенным диффузным кардиофиброзом,
вторичной дилатацией полостей сердца, снижением сократительной способности
миокарда, нарушением внутрисердечной гемодинамики и симптомами прогрессирующей
застойной сердечной недостаточности. Ввиду необратимого естественного течения
заболевания, такие пациенты характеризуются частой нетрудоспособностью и
социальной дезадаптацией, низкой продолжительностью жизни и недостаточной
эффективностью консервативного лечения. К настоящему времени в клинической
практике используются 3 основных взаимодополняющих направления хирургического
лечения ИКМП:
Коронарное шунтирование. Целесообразность коронарного шунтирования при ИКМП
обусловлена наличием гибернированного миокарда, вызывающего дисфункцию левого
желудочка. При этом адекватная реваскуляризация может привести к существенному
улучшению сократительной способности миокарда и регрессу сердечной
недостаточности, имеющим зачастую не только временный (т.н. «мост к
трансплантации сердца»), но и стойкий характер («мост к выздоровлению»).
В определении показаний к хирургической реваскуляризации зачастую требуется
объективизация наличия гибернированного миокарда посредством перфузионной
сцинтиграфии, поскольку имеющиеся у пациента симптомы сердечной недостаточности
могут маскировать явления стенокардии.
При этом отсутствие достаточного объема гибернированного миокарда и диффузное
поражение венечных артерий пораженного бассейна являются противопоказаниями к
коронарному шунтированию. Госпитальная летальность у пациентов с ИКМП варьирует
от 3 до 12% и зависит от степени снижения фракции выброса левого желудочка,
возраста больных и имеющихся в анамнезе нарушений ритма. Отдаленная
выживаемость, в зависимости от степени нарушения сократительной способности
миокарда, варьирует от 62 до 73%, в то время как при консервативном лечении –
43%.
Трансплантация сердца (ТС) является признанным радикальным методом лечения
терминальной сердечной недостаточности у пациентов с ИКМП. Методом выбора
является ортотопическая ТС – замена сердца реципиента сердцем донора.
Гетеротопическая ТС (подсадка аллотрансплантата к сердцу реципиента)
используется редко – как правило, при несоответствии размеров сердец донора и
реципиента.
Достижения в иммуносупрессии, антимикробной профилактике, антигенном
типировании органов, технологии хирургического вмешательства и организации
донорства позволили этому методу войти в широкую практику – к настоящему времени
в мире выполнено более 30 000 ТС с госпитальной летальностью около 5-10% и
годичной выживаемостью около 80%.
К сожалению, следует констатировать, что, по совокупности ряда
организационных и финансовых трудностей, в России этот метод пока не получил
заслуженного клинического применения. Поиски альтернативных вариантов лечения
терминальной сердечной недостаточности, а также сложности в обеспечении
донорскими органами всех нуждающихся, обусловили развитие такого метода, как
имплантация устройств длительной механической поддержки кровообращения (МПК).
В общей классификации этих систем можно указать деление на экстра- (с
расположением насоса вне организма) и интракорпоральные (с насосом,
имплантированным в организм реципиента), по числу контуров – на моно- и
бивентрикулярные, по типу кровотока – на устройства с пульсирующим и непрерывным
кровотоком, обеспечиваемым мембранным и турбинным насосами, соответственно
(рисунок).
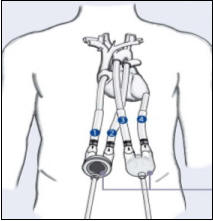
Рисунок 58. Схема экстракорпоральной бивентрикулярной системы МПК с
пульсирующим кровотоком EXCOR ф. Berlin Heart (Германия).
Условные обозначения: 1 и 4 – отточные сегменты из правого предсердия и
левого желудочка, 2 и 3 – приточные канюли к легочной артерии и аорты (Хубулава
Г.Г., Пайвин А.А., Юрченко Д.Л.)
Показаниями к использованию устройств МПК являются: терминальная сердечная
недостаточность (NYHA III или IV ФК) при неэффективности медикаментозной
терапии, необходимость поддержания средней или долговременной продолжительности
жизни пациента. Задачами, возлагаемыми на устройства МПК, являются
кратковременное («мост к трансплантации», либо в сочетании с коронарным
шунтированием – как «мост к выздоровлению») либо длительное поддержание
сердечной деятельности (как конечный результат лечения).
Необходимыми условиями успешной работы систем МПК являются поддержание
достаточного объема циркулирующей крови и гипокоагуляции, обеспечиваемой
комбинацией современных антикоагулянтных и антиагрегантных препаратов.
Продолжительность жизни пациентов с МПК может варьировать от нескольких месяцев
до нескольких лет (рисунок).
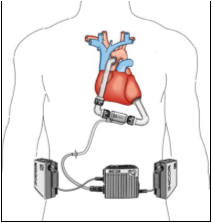
Рисунок 59. Схема интракорпоральной левожелудочковой
системы МПК с непрерывным кровотоком INCOR ф. BerlinHeart (Германия). Включает в
себя две части – имплантируемую (насос с приточным и отточным сегментами) и
наружную (контроллер и аккумуляторные батареи), соединенные между собой при
помощи кабеля, проведенного чрескожно в правом подреберье (Хубулава Г.Г., Пайвин
А.А., Юрченко Д.Л.)
Рисунок 60. Пациент Д., 68 лет через 8 месяцев после имплантации системы
INCOR в 1 клинике хирургии (усовершенствования врачей) Военно-медицинской
академии имени С.М. Кирова. В сумке – контроллер для управления функциями насоса
и аккумуляторные батареи. На заднем плане – лэптоп для коррекции параметров
работы насоса и зарядное устройство (Хубулава Г.Г., Пайвин А.А., Юрченко Д.Л.).
Результаты хирургического ремоделирования стенки левого желудочка, а также
использования наружных поддерживающих устройств к настоящему времени не
оправдали возлагавшихся надежд и, по-видимому, требуют дальнейшего
совершенствования перед внедрением в клиническую практику.
|