
Глава 6. ОТДАЛЕННЫЕ ПОСЛЕДСТВИЯ БОЕВОЙ ТРАВМЫ ГОЛОВНОГО МОЗГА
И ПОСТТРАВМАТИЧЕСКАЯ ХРОНИЧЕСКАЯ АЛКОГОЛЬНАЯ ЗАВИСИМОСТЬ
В предыдущих главах были показаны особенности формирования травматической
болезни головного мозга на основе получения современной боевой ЧМТ в условиях
ХПЭС боевой обстановки. Было показано также, что при развитии на этом фоне
известного ПТСР у пострадавших наблюдаются не только различного рода
психопатологические симптомы и синдромы, но и разнообразная соматическая,
сомато-неврологическая патология. Данный комплекс взаимосвязанных и
взаимозависимых между собой патологических процессов, естественно способствует
активизации ускоренного, патологического старения участников боевых действий (Боровкова
Т.А. 1999; Мякотных В.С., 1994; Мякотных В.С., Ямпольская В.В., 2006; Алишев
Н.В. с соавт., 2006; Царегородцева С.А., 2007; Beckcham
J.C. et
al., 1997). И не последнюю роль в этом процессе
ускоренного старения и формирования полипатологических комплексов сыграла, на
наш взгляд, сформировавшаяся после получения боевой ЧМТ и сопутствующего ей ХПЭС
хроническая алкогольная зависимость, количество пациентов с которой непрерывно
растет именно среди участников современных боевых действий. Число пациентов
нашей клиники, Свердловского областного клинического психоневрологического
госпиталя для ветеранов войн, например, с сочетанием последствий боевой закрытой
ЧМТ, полученной в современных вооруженных конфликтах, и хронической алкогольной
зависимости выросло за последние 7 – 8 лет на 77,42%.
Мы убеждены в том, что процессы ускоренного, патологического старения связаны
с последствиями боевых ЧМТ, ХПЭС, хронической алкогольной зависимостью не
напрямую, а через нарастающие нарушения вегетативной, нейрогуморальной регуляции
деятельности различных систем организма, в первую очередь, сердечно–сосудистой
системы. И оснований для подобного рода утверждения достаточно. Хорошо известно,
например, что получение даже легкой боевой травмы головного мозга приводит к
появлению стойких посттравматических изменений (Одинак М.М. с соавт., 1996;
Мякотных В.С. с соавт., 2002), в том числе выраженных вегетативных расстройств,
развитию раннего атеросклероза, артериальной гипертонии (АГ) недостаточности
мозгового кровообращения (Боровкова Т.А., 1999; Альтман Д.Ш., 2006). Природа
вегетативных нарушений, возможности их терапевтической коррекции являются одной
из актуальных проблем современной послевоенной медицины (Шерман М.А., 2000,
2004; Шерман М.А., Шутов А.А., 2003).
Хроническая алкогольная зависимость в сочетании с последствиями боевой ЧМТ и
ускоренным старением не могут не сказаться на изменениях, происходящих в
системах перекисного окисления липидов (ПОЛ) и антиокислительной защиты
организма (АОЗ), тем более, что указанные системы уже достаточно давно признаны
ответственными за процессы старения в целом, в том числе патологического,
связанного с развитием и накоплением многих заболеваний (Ястребова А.П.,
Мещанинов В.Н., 2005; Harman D.,
1995). И провести сравнительное изучение показателей ПОЛ и АОЗ у лиц, перенесших
боевые ЧМТ и либо страдающих, либо не страдающих хронической алкогольной
зависимостью показалось нам достаточно интересным, тем более, что такого рода
исследований ранее практически не проводилось. Надо сказать, что и в целом
исследований по проблеме клинических и патогенетических взаимоотношений
последствий ЧМТ и хронической алкогольной зависимости, а тем более
сформировавшейся после получения травмы, немного, но данная проблема существует,
и тенденция к увеличению количества такого рода больных налицо.
В связи с обозначенной проблемой хотелось бы вначале хотя бы кратко
остановиться на вопросах хронической алкогольной зависимости и ее
взаимоотношений с полученными ЧМТ.
6.1. Некоторые вопросы хронической алкогольной зависимости
Комитет экспертов ВОЗ по лекарственной зависимости включил этиловый спирт в
число веществ алкогольно–барбитурового ряда, вызывающих зависимость, болезненное
пристрастие (Энтин Г.М. с соавт., 2002).
К свойствам этилового спирта, ставящим его в один ряд с наркотическими
веществами, относятся следующие.
1. Способность при длительном употреблении вызывать болезненное влечение,
т.е. потребность в приеме опьяняющих доз алкоголя с целью достижения эйфории с
последующей аналгезией.
2. Нарастание толерантности к алкоголю при длительном его употреблении и
потребности его употребления во все возрастающих дозах, вызывающих тот же эффект
опьянения.
3. Возникновение и становление алкогольного абстинентного синдрома,
проявляющегося в соматоневрологических и психических нарушениях при выходе
алкоголя из организма и снимаемых или облегчаемых приемом определенной дозы
спиртных напитков.
4. Способность вызывать острые, подострые, затяжные и хронические алкогольные
психозы, а также нарушение поведения и специфические изменения личности.
5. Выраженное общетоксическое действие, проявляющееся сначала в
функциональных, а затем в органических поражениях внутренних органов и нервной
системы.
Алкоголизм – это процесс, имеющий свое начало, свои этапы, свой финал и
протекающий с той или иной скоростью. По своей болезненной сути алкоголизм – это
психическая болезнь, и решающим аргументом в пользу отнесения алкоголизма к
психическим заболеваниям служит патологическое влечение к алкоголю (Иванец Н.Н.,
2002). В принципе, головной мозг является органом–мишенью для этилового спирта (Шорманов
С.В., Шорманова Н.С., 2006).
Все клинические синдромы хронического алкоголизма, и неврастеноподобный на 1–й
стадии, и абстинентный на 2–й, и деградация личности на 3–й, сформировались по
одной схеме – они образованы патологическим влечением к алкоголю в «обрамлении»
различных постинтоксикационных расстройств. Именно различия в тяжести и
устойчивости последствий алкогольной интоксикации лежат в основе стадийности
алкоголизма, составляя суть качественных особенностей отдельных стадий. С целью
преодоления искусственного разрыва сплошного процесса Н.Н. Иванец (2002) в 1988
году предложил внести в клинический обиход две переходные стадии алкогольной
зависимости – I–II и
II–III. Традиционные же три стадии
отмечены соответственно тремя кардинальными клиническими синдромами алкоголизма
– патологическим влечением к алкоголю, алкогольным абстинентным синдромом,
алкогольной деградацией, – которые последовательно дополняют собой картину
болезни по мере ее развития. Динамика алкоголизма характеризуется, помимо
изменяющейся симптоматики, также и скоростью этих изменений. Соответственно
этому, выделяются высокий, средний и низкий темпы прогредиентности алкоголизма,
каждый из которых, как правило, изначально присущ тому или иному конкретному
больному.
Имеет значение также тип злоупотребления алкоголем – постоянный,
периодический (истинные и ложные запои), смешанный (перемежающие).
Влияние алкоголя на организм человека, его жизнедеятельность и функции
проявляется в 3–х различных направлениях (Иванец Н.Н., 2002).
1–е. Алкоголь специфически влияет на определенные системы и структуры мозга,
вызывая развитие синдрома зависимости. Именно этот синдром является ведущим в
клинической картине заболевания.
2–е. Алкоголь обладает токсическим воздействием практически на все внутренние
органы и системы организма. Токсическое поражение различных органов не связано
напрямую с проявлением синдрома зависимости, но временная нетрудоспособность,
инвалидизация, смертность больных чаще всего обусловлены именно последствиями и
осложнениями токсического эффекта алкоголя.
3–е. Сегодня уже несомненно влияние наркологической патологии родителей на
потомство. У детей алкоголиков существенно повышен риск развития этого
заболевания. У большинства из них выступают различные характерологические,
поведенческие расстройства: повышенная возбудимость, агрессивность, склонность к
риску, депрессии.
Нейрофизиологические механизмы развития зависимости от алкоголя базируются в
стволовых и лимбических структурах мозга, в тех его областях, где располагается
так называемая система подкрепления. Она участвует в обеспечении регуляции
эмоционального состояния, настроения, мотивационной сферы, психофизического
тонуса, поведения человека в целом, его адаптации к окружающей среде.
Воздействие алкоголя приводит к интенсивному выбросу из депо в лимбических
структурах мозга нейромедиаторов из группы катехоламитнов, в первую очередь
дофамина, и как следствие – к значительно более сильному возбуждению системы
подкрепления. Такое возбуждение нередко сопровождается положительно окрашенными
эмоциональными переживаниями. При длительном употреблении алкоголя может
развиться дефицит нейромедиаторов, причем угрожающий жизнедеятельности организма
в целом. В качестве механизма компенсации этого явления выступают усиленный
синтез катехоламинов и подавление активности ферментов их метаболизма, в первую
очередь моноаминоксидазы и дофамин–бета-гидроксилазы, контролирующей превращение
дофамина в норадреналин. Таким образом, стимулируемый очередным приемом алкоголя
выброс катехоламинов и их ускоренное разрушение сочетаются с компенсаторно
усиленным синтезом этих медиаторов. Происходит формирование ускоренного
кругооборота катехоламинов. При прекращении приема алкоголя остается ускоренный
синтез катехоламинов, изменяется активность ферментов, и в мозге накапливается
дофамин. Именно этот процесс обусловливает развитие основных клинических
признаков абстинентного синдрома – тревожности, напряженности, возбуждения,
подъема АД, ускорения пульса, появления вегетативных расстройств, нарушений сна,
возникновения психотических состояний. Эти изменения нейрохимических функций
мозга являются основой формирования уже физической зависимости от психоактивных
препаратов.
Интересны механизмы взаимодействия депрессивных состояний и злоупотребления
алкоголем (Иванец Н.Н., 2002; Энтин Г.М. с соавт., 2002).
Патогенетической основой различных типов депрессий является недостаточность
катехоламинов и серотониновой нейромедиации именно в мезолимибических структурах
мозга. Механизмы этого дефицита могут быть различными, но приводят к одному
результату – ослаблению моноаминергических нейромедиаторных процессов в
мезолимбических структурах мозга, что является патогенетической основой
депрессий.
Интересными представляются исследования биоэлектрической активности головного
мозга у больных хронической алкогольной зависимостью (Виленский О.Г., 1960;
Колупаев Н.Л., Яковлев В.А., 1997). Констатировано наличие у большого числа
больных алкоголизмом ЭЭГ с усиленным бета–ритмом, что связывается с
патологически усиленным возбуждением в дофамин–мезолимбических структурах мозга,
что делает эти структуры гиперреактивными, а вследствие гиперреактивности данных
структур, относящихся к восходящей активирующей системе мозга, происходит
усиленное генерирование частот бета–диапазона. Степень изменений ЭЭГ, как
правило, коррелирует с глубиной алкогольной деградации; отсутствие нормального
альфа–ритма и наличие патологических медленных волн отмечается обычно у больных
с наиболее выраженным снижением интеллекта. С другой стороны, отмечается группа
изменений, носящих функциональный характер, достигающих наибольшей глубины в
состоянии абстиненции и исчезающих или ослабевающих после окончания периода
абстиненции, что можно, по мнению авторов, использовать в прогнозе и при оценке
эффективности лечения.
Для хронической алкогольной зависимости как хронически протекающего
заболевания можно выделить 4 основных типа течения (Энтин Г.М. с соавт., 2002):
1) прогредиентный, 2) стационарный, 3) ремитирующий, 4) регредиентный. В первом
типе выделяется, кроме того, а) злокачественный или высокопрогридиентный тип
течения, б) прогредиентный с быстрым течением, в) малопрогредиентный тип
течения.
При отсутствии лечения и соответствующего социального воздействия,
направленного на пресечение дальнейшего пьянства, прогноз при алкогольной
зависимости остается неблагоприятным. При изучении причин смертности больных
выявлено, что средний возраст умерших – 51,8 лет, средняя продолжительность
жизни после первого обращения к врачу – 3 года. Причины смерти: заболевания
внутренних органов – 18,7%, заболевания сердечно–сосудистой системы – 15,3%,
новообразования – 12,7%, поражения ЦНС – 6%, суициды – 8%, несчастные случаи –
10,7%, насильственная смерть – 7,3%.. В то же время, прогноз при алкогольной
зависимости в значительно большей степени, чем при других заболеваниях, зависит
от системы лечебно–реабилитационных мероприятий и от общегосударственных
социальных и административно–правовых мер профилактики пьянства и алкоголизма
(Иванец Н.Н., 2002; Энтин Г.М. с соавт., 2002). С другой стороны, имеются
работы, в которых показано неблагоприятное, отягощающее прогноз заболевания и
вызывающее негативную динамику неврологического статуса, побочное действие ряда
препаратов, используемых при лечении хронического алкоголизма, в частности
нейролептиков (Москвичева-Арсентьева А.В., 2006); и это тоже проблема.
6.2. Взаимоотношения ЧМТ и хронической алкогольной зависимости
Еще в 60–80 годах прошлого века (Воловик В.М., 1964; Скугаревская Е.И., 1968;
Акимов Г.А., Комисаренко А.А., 1976; Корнилов А.А., 1981; Кокорина Н.П., 1988)
было отмечено, что многие обследованные вскоре после ЧМТ начали употреблять
алкоголь, стремясь купировать возникшие астено–невротические проявления. У этих
пациентов быстро, в среднем через 2–3 года, формировался абстинентный
алкогольный синдром, даже вне похмельных явлений были выражены аффективные
нарушения, в особенности в виде частых дисфорий на общем сниженном фоне
настроения. Биохимическое исследование в период абстинентного синдрома выявило
дисфункцию обоих отделов вегетативной нервной системы. На фоне резкого истощения
трофотропной системы (о чем можно судить по содержанию серотонина и его
метаболита в биологических жидкостях) наблюдались очень высокие показатели,
характеризующие активность симпато–адреналовой системы с преобладанием ее
медиаторного звена. Такое «напряжение» эрготропной системы говорит о
предъявлении к организму максимальных требований под влиянием комплекса
вредностей, что вызывает истощение механизмов нейрогуморальной регуляции.
Послезапойные астенические состояния у алкоголиков–травматиков бывают более
длительными (до месяца и более) по сравнению с алкоголиками, не имевшими травм
головного мозга (Акимов Г.А. с соавт., 1976).
В.В. Дегтяр с соавт. (1989) показано, что ЧМТ способствует как развитию
алкоголизма, так и более злокачественному его течению. После ЧМТ у 70%
исследуемых больных алкоголизм развивался в течение первых 3–х лет после травмы.
Именно этот период авторы считают наиболее опасным в плане возможности развития
патологического пристрастия к алкоголю. Сочетание последствий ЧМТ и алкоголизма,
как правило приводит к развитию энцефалопатии с более выраженной и стойкой
психопатизацией личности. Прием алкоголя, субъективно облегчающий состояние
больных, ведет к более выраженным нарушениям социальной адаптации и
компенсаторных возможностей организма.
А.К. Жуковский с соавт. (1989) констатировали, что основными особенностями
отдаленного периода ЧМТ у страдающих хронической алкогольной зависимостью были
переход от типичного прогредиентного течения алкоголизма к злокачественному
прогредиентному, быстрое нарастание тяжести психопатологической и
неврологической симптоматики. При этом неврологическая симптоматика алкогольного
абстинентного синдрома была более выраженной у тех больных, которые перенесли
две и более ЧМТ. Вследствие развития сочетанной травматически–алкогольной
энцефалопатии синдром психического снижения становится особенно ярким, на первый
план выступают грубые личностно–эмоциональные нарушения.
В отдаленном периоде закрытой ЧМТ терапия только алкогольной зависимости мало
эффективна, необходима разработка специальной системы лечебных мероприятий,
направленных одновременно и на лечение отдаленных последствий закрытых ЧМТ
(Акимов Г.Д. с соавт., 1989). И это утверждение тем более верно в связи с тем,
что травматическая болезнь головного мозга имеет при сочетании ее с хроническим
алкоголизмом отчетливо прогредиентное течение (Турова З.Г., Филипских В.Е.,
1987; Лукачер Г.Я., Махова Т.А., 1989; Сосин И.К. с соавт., 1989; Сергеев В.А.,
2000). Под воздействием хронической алкогольной интоксикации происходит усиление
патологических характерологических особенностей, при этом в клиническую картину
вплетаются компоненты церебрально–органического поражения (возбудимость,
снижение интеллектуальной продуктивности, дисфории, вегетативно–сосудистые и
церебрастенические расстройства). Отмечаются нарушения мышления и эмоциональной
сферы органического круга: инертность, обстоятельность, конкретность, бурные
аффективные реакции, возникающие по незначительному поводу, взрывообразные
эпизоды злобы и недовольства, часто сочетающиеся с яркими истерическими
реакциями, застревание на отрицательно окрашенных переживаниях, склонность к
самовзвинчиванию. Частая алкоголизация, свойственная этим больным, приводит к
снижению интеллектуально–волевых задержек, актуализации отрицательно окрашенных
переживаний, брутальному проявлению психопатоподобных нарушений.
6.3. Клинические особенности последствий боевой ЧМТ, сочетающихся с
хронической алкогольной зависимостью
В своих исследованиях мы попытались детально проанализировать целый ряд
особенностей травматической болезни головного мозга, инициированной боевой ЧМТ,
полученной в условиях боевого ХПЭС, при сочетании указанной патологии с
развившейся в посттравматическом периоде хронической алкогольной зависимостью.
Проводилось сравнение двух групп больных: 1) с последствиями закрытой боевой ЧМТ
и алкогольной зависимостью (n=105); 2) с последствиями
аналогичной травмы, но без признаков хронической алкогольной зависимости (n=48).
Классификационно травма во всех случаях относилась к категории легкой,
хроническая алкогольная зависимость была 2-й стадии.
В данном разделе отдельно представлены полученные сведения о клинических
особенностях неврологической и психопатологической симптоматики, в том числе
результаты психологических исследований, проведенных с привлечением специалистов
– психологов.
6.3.1. Особенности неврологической симптоматики
Результаты сравнительного анализа основных жалоб больных представлены в
таблице 6.1 и на рис. 6.1.
Таблица 6.1. Результаты сравнительного анализа основных жалоб больных
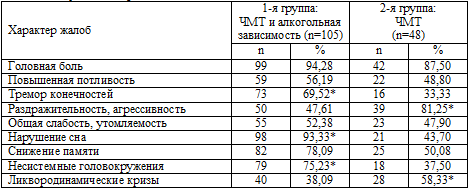
Примечание: * – р<0,05.
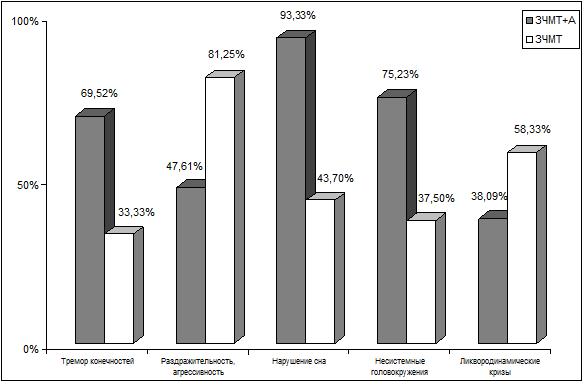
Рис. 6.1. Графические показатели наиболее отчетливых
различий в субъективных проявлениях церебральной патологии у больных 2–х групп.
Наиболее частой жалобой у пациентов обеих групп была головная
боль. При этом у пациентов с последствиями ЧМТ и сформированной алкогольной
зависимостью головная боль встречалась несколько чаще – у 99 (94,28%), чем среди
перенесших ЧМТ, но без присоединившихся затем явлений хронической алкогольной
зависимости – 42 (87,50%).
У 40 (38,09%) больных с наличием алкогольной зависимости головные боли представлялись
гипертензионными, ликвородинамическими, но среди пациентов только с последствиями ЧМТ, но не страдавших алкогольной
зависимостью, такой характер головных болей встречался
чаще (р<0,05) – у 28 (58,33%) больных.
Повышенная потливость также несколько чаще встречалась у больных с
сочетанной патологией – у 59 (56,19%), чем у пациентов с только ЧМТ в анамнезе – у 22 (48,80%).
Жалобы на тремор конечностей оказались отчетливо
(р<0,05) более характерными для пациентов с сочетанной алкогольно-травматической патологией и отмечались в
73 (69,52%) наблюдениях против 16 (33,33%) среди пациентов без алкогольной
зависимости. Это скорее всего обусловлено тем, что данный симптом встречается
практически облигатно в структуре алкогольного абстинентного
синдрома.
Диссомнические расстройства являлись самой частой жалобой
после головной боли у пациентов с сочетанной алкогольно-травматической патологией, они
отмечались у 98 (93,33%) пациентов. Это достоверно (р<0,01) чаще, чем у
пациентов с только ЧМТ в анамнезе – 21 (43,70%). Были представлены расстройства
сна в виде нарушения засыпания, поверхностного малоэффективного сна, а также
различных парасомний – сноговорений, стереотипных кошмарных сновидений, в том
числе связанных с пережитой боевой обстановкой.
Пациенты с только ЧМТ в анамнезе, без признаков хронической
алкогольной зависимости, жаловались на повышенную раздражительность,
агрессивность достоверно (р<0,05) чаще (39 больных; 81,25%), чем пациенты с
сочетанной патологией – 50 (47,61%) больных. Возможно, это объясняется тем, что
частая и массивная алкоголизация у значительного числа больных вызывает «притупление»
эмоций. При
этом сами пациенты нередко заявляли о том, что очередной прием алкоголя был им
необходим именно с целью снятия начинающегося раздражения, «чтобы успокоиться».
Снижение памяти, особенно по типу фиксационной гипомнезии,
отмечалось больными достаточно часто. Эта жалоба предъявлялась при сочетанной
патологии 82 (78,09%) пациентами, при только последствиях ЧМТ – 25 (50,08%).
Высказано предположение о том, что мнестические расстройства происходят
вследствие нарастания корковых и внутренних атрофий головного мозга, диффузного
аксонального повреждения и стойкого нарушения таламо–кортикальных связей,
запущенных травмой, но хронический алкоголизм несомненно «помогает» развитию
данного патологического процесса и способствует дальнейшему развитию нарушений
памяти.
То же самое можно сказать и о головокружениях несистемного
характера. Данную жалобу пациенты с сочетанной патологией предъявляли примерно в
2 раза чаще (р<0,05), чем пациенты только с последствиями ЧМТ. Вероятно, на фоне
хронического алкоголизма происходит нарастание запущенных травмой типичных
расстройств кровообращения в вертебрально–базиллярном сосудистом бассейне (Альтман Д.Ш., 2006;
Пелин А.И. с соавт., 2006).
В таблице 6.2 и на рис. 6.2 представлены основные клинические
характеристики объективного неврологического статуса у наблюдаемых групп.
Таблица 6.2. Характеристика неврологического статуса
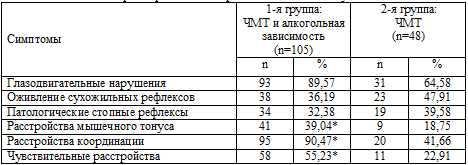
Примечание: * – р<0,05.
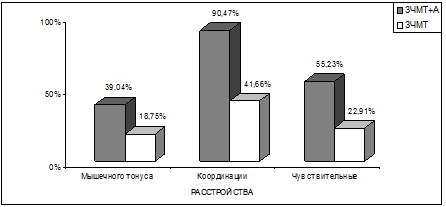
Рис. 6.2. Графические показатели наиболее отчетливых различий
в объек-тивной неврологической симптоматике у больных 2–х групп.
Преобладали в разном сочетании микросимптомы органического
поражения мозга, преимущественно стволового уровня: горизонтальный
мелкоразмашистый нистагм, расстройства конвергенции глазных яблок, недоведение
их до наружных углов глазниц, снижение роговичных рефлексов, асимметрия лицевой
мускулатуры, девиация языка, легкие нарушения координации, кистевые и стопные
пирамидные симптомы Бехтерева и Россолимо, рефлексы орального автоматизма,
отсутствие брюшных рефлексов. Различные сочетания органической симптоматики
выявлялись у 100% больных обеих групп. При этом глазодвигательные расстройства
отчетливо чаще встречались у больных с сочетанной,
алкогольно–травматической патологией, оживление сухожильных рефлексов и наличие
патологических стопных знаков чаще встречалось в группе пациентов с
только последствиями ЧМТ. Это свидетельствует об отсутствии полного
выздоровления даже после сотрясения и так называемой легкой контузии головного
мозга, что позволяет судить о пролонгации посттравматического церебрального
патологического процесса. Можно также предположить, что базальные
отделы головного мозга при легкой ЧМТ страдают больше, чем конвекситальные, что согласуется с данными других
исследований (Павловичев
С.А., 1991; Uzzell
B.P. et al.,
1990; Wong P.P.
et al., 1993).
Расстройства мышечного тонуса достоверно (р<0,05) чаще (n=41;
39,04%) встречались у пациентов с
сочетанной патологией о сравнению с пациентами с исключительно последствиями ЧМТ (n=9;
18,75%). Почти у всех пациентов с
сочетанной алкогольно–травматической патологией (у 95 – 90,47%) наблюдались
расстройства координации, что также достоверно (р<0,01) чаще, чем у лиц только
с последствиями ЧМТ (20 – 41,66%).
Чувствительные нарушения, обычно в форме поверхностной
гипестезии различной локализации, также достоверно (р<0,01) чаще встречались у
пациентов с сочетанной алкогольно-травматической патологией (n=58;
55,23%), чем у больных только с последствиями ЧМТ (n=11;
22,91%). При этом у 19 из 105
(18,1%) больных, страдавших хронической алкогольной зависимостью, имели место
незначительно выраженные чувствительные нарушения полиневритического характера
по типу гипестезии, но с характерным субъективным ощущением «жжения»,
преимущественно на уровне дистальных отделов нижних конечностей, которые
сочетались с чувствительными же расстройствами церебрального генеза. Указанная
симптоматика подтверждалась и результатами проведенных
электронейромиографических исследований. Это свидетельствует о том,
что у больных с последствиями ЧМТ при развитии у них хронической алкогольной
зависимости типичные сенсорные феномены периферического уровня могут развиваться
достаточно рано, во 2–й стадии хронического алкоголизма и при относительно
небольшом его стаже.
Обычно у одного больного отмечалось несколько синдромов в
клинической картине последствий ЧМТ. Ведущим считался тот синдром, клинические
проявления которого, как субъективные, так и объективные, были наиболее
клинически выраженными и в значительной степени послужили поводом для обращения
больного к врачу. Структура выделенных нами ведущих неврологических синдромов
представлена
на рис. 6.3.
Обнаружились отчетливые различия между пациентами,
перенесшими боевую ЧМТ и страдающими хронической алкогольной зависимостью и
пациентами также с последствиями ЧМТ, но не страдающими хроническим алкоголизмом.
У больных с последствиями ЧМТ, не сопровождавшимися
хронической алкогольной зависимостью, достоверно (р<0,05) чаще, чем при
сочетанной алкогольно-травматической патологии, встречался и выступал в качестве
преобладающего в клинической картине заболевания гипертензионный синдром (соответственно
в 68,75% и 36,19%). У пациентов же с сочетанной алкогольно–травматической
патологией также достоверно (р<0,05) чаще, чем при исключительно последствиях
боевой ЧМТ, оказался представленным в клинической картине заболевания
эпилептический синдром, то есть симптоматическая эпилепсия (соответственно в
46,66% и 20,83%). Это может свидетельствовать о том, что злоупотребление
алкоголем может провоцировать и способствовать развитию эпилептического процесса,
имеющего изначально посттравматическую природу, что согласуется с давно
существующим мнением о существовании даже специфической алкогольной эпилепсии (Гасто А.,
1975; Болдырев А.И., 1984; Карлов В.А., 1990; Мякотных В.С., 1993, 1994). Что касается гипертензионного
синдрома, клинически представленного в основном специфическими для него
головными болями, то последние на фоне массивной и хронической алкоголизации
становятся не столь ярко выраженными. Сам пациент нередко связывает употребление
алкоголя именно с его якобы лечебным воздействием в плане уменьшения
выраженности головных болей. Поэтому субъективно головные боли реже представлены
у лиц, страдающих хронической алкогольной зависимостью, в качестве клинического отражения
внутричерепной гипертензии. Но при рентгенологическом и нейровизуализационном (МРТ)
исследованиях гипертензионные изменения выявляются уже значительно чаще, чем
исключительно клинически.
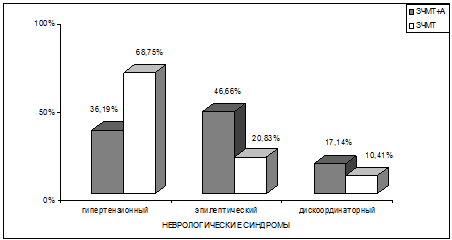
Рис. 6.3. Результаты сравнительного анализа ведущих
неврологических синдромов у пациентов 2–х групп наблюдения.
Дискоординаторный синдром представлен в обеих группах, но несколько чаще - у
пациентов с сочетанной алкогольно–травматической патологией. Это не согласуется
с нашими данными о сравнительной частоте несистемных головокружений (таблица
6.1, рис. 6.1) и может объясняться тем, что исследование состояния
координаторных функций у наблюдавшихся больных проводилось в большинстве случаев
вне периодов приступообразных головокружений, которые часто были связаны именно
с приемом алкоголя и состоянием похмелья.
Приведем пример.
Больной Д., 1963 г.р. Наблюдается около 10 лет с диагнозом: последствия
боевой закрытой ЧМТ, хронический гипертензионно–гидороцефальный синдром,
выраженный церебрастенический синдром; хронический алкоголизм 2–й ст., форма
запойного пьянства, абстинентный синдром; хронический бронхит; хронический
токсический гепатит в активной фазе; вегетативно–сосудистая дистония по
смешанному типу.
В Афганистане служил с 1982 по 1984 гг., получил контузию головного мозга с
потерей сознания на примерно 50 – 60 сек., лечился в медсанчасти. С момента
получения контузии беспокоят головные боли, преимущественно в затылочной
области, которые временами сопровождаются головокружениями
несистематизированного характера, чувством «закладывания» в ушах, иррадиацией
боли в глазные яблоки, иногда тошнотой. С 1994 г. - учащение приступов головных
болей и усиление их интенсивности на фоне психофизических нагрузок. Употреблял
анальгетики, состояние улучшалось ненадолго. Также с 1994 г. начал массивно
алкоголизироваться с целью облегчения своего состояния.
После первого курса стационарного лечения в 1998 г. в течение почти года
состояние здоровья было стабильным. Затем наступило ухудшение: участились
головные боли, наросли нервозность и раздражительность, участились колебания
настроения, стали развиваться и нарастать утомляемость, обидчивость,
мнительность, рассеянность, нарушения сна (не мог долго заснуть, отсутствовало
чувства отдыха после сна). Вновь стал злоупотреблять алкоголем.
Следующая госпитализация – в 2000 г., уже для прерывания запоя. Ведущий
диагноз: алкогольная зависимость 2–й ст., рецидив, абстинентный синдром.
Сопутствующий диагноз: последствия закрытой боевой ЧМТ. Выявлен сформированный
абстинентный синдром, представленный жалобами на резкую слабость, вялость,
диффузную головную боль, головокружение, потливость, тошноту, рвоту, отсутствие
аппетита, сухость во рту, жажду, дрожь в теле, бессонницу, пугливость, кошмарные
сновидения, самобичевание, чувство вины, неодолимое влечение к алкоголю.
Пьянство носит запойный характер, длительность запоев до 3–х недель, ремиссии
спонтанные длительностью до 2 – 4 месяцев. Суточная толерантность – до 1,0 литра
водки. В опьянении отмечается потеря ситуационного и количественного контроля,
конфликтность, агрессивность, амнестические формы опьянения.
С тех пор госпитализировался в наркологическое отделение Свердловского
областного клинического психоневрологического госпиталя для ветеранов войн 5
раз, из них 4 - для прерывания запоя.
Неврологически: зрачки обычных размеров, вялые зрачковые реакции,
болезненность глазных яблок при их крайних отведениях, лицо симметричное; язык
по средней линии, дизартрии нет; мышечная сила в норме, легкая гипотония в
стопах; поверхностная и глубокая чувствительность не нарушены; вялые брюшные
рефлексы; пошатывание в позе Ромберга; легкая интенция и мимопопадание при
выполнении пальце–носовой пробы с обеих сторон.
Психический статус: сознание ясное, все виды ориентировки сохранены;
напряжен, тревожен, неусидчив; внимание неустойчивое; доступен продуктивному
контакту; ответы односложные, по существу; речь правильная, последовательная;
дизартрии нет; настроение снижено по состоянию; суицидальные мысли отрицает;
эмоционально лабилен; жалуется на плохое самочувствие, просит о помощи; бредовых
высказываний и обманов восприятия не выявлено; интеллект соответствует
образованию и жизненному опыту; грубых нарушений памяти не выявлено; критика к
заболеванию алкоголизмом формальная; внимание неустойчивое, истощаем.
Окулист: ангиопатия сетчатки.
ЭхоЭС: сдвига срединных структур нет; ширина 3–го желудочка – 6 мм.
ЭЭГ (рис. 6.4): общемозговые изменения по органическому типу; дисфункция
срединно–стволовых структур; снижение порога судорожной готовности; очаг
патологической медленноволновой активности в правой височной области; в целом –
дезорганизованный тип ЭЭГ с преобладанием альфа– и тета–активности (4–й – 5–й
тип ЭЭГ по Е.А. Жирмунской) .
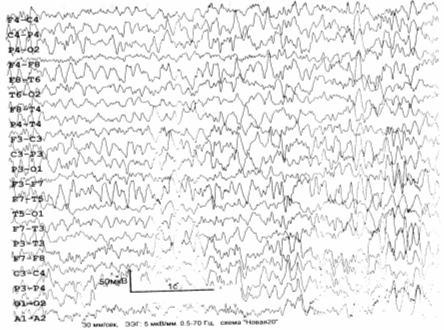
Рис. 6.4. ЭЭГ больного Д., 1963 г. рожд. Пояснения – в
тексте.
МРТ головного мозга: признаки легко выраженной симметричной гидроцефалии.
Проводилось лечение: детоксикация с использованием сернокислой магнезии,
тиосульфата натрия, дегидратация, общеукрепляющая терапия, сосудорасширяющие,
метаболические средства, витамины, мексидол, транквилизаторы, нейролептики,
антидепрессанты, физиотерапия, психотерапия (поведенческие методики). Получал
курсы сенсибилизации к алкоголю (колме). На фоне лечения состояние значительно
улучшалось.
Приведенное наблюдение хорошо иллюстрирует динамику развития сочетанной
алкогольно–травматической патологии у ветерана боевых действий в Афганистане.
Начало злоупотребления алкоголем сам больной связывает с его анальгетическим
действием по поводу посттравматических головных болей, что вполне типично.
Неврологическая симптоматика, как субъективная, так и объективная, имеет
откровенно сочетанный алкогольно–травматический генез, и ее полиморфизм нарастал
параллельно развитию хронического алкоголизма. Наличие умеренных внутричерепных
гидроцефально–гипертензионных проявлений подтверждено ЭхоЭС и МРТ
исследованиями. Психопатологические изменения также достаточно характерны для
сочетаний последствий ЧМТ и хронической алкогольной зависимости у больного с
ПТСР. Комбинированное лечение по поводу сочетанной патологии возымело ожидаемый
эффект, что свидетельствует в пользу правильности избранной тактики ведения
больного.
6.3.2. Особенности психопатологической симптоматики
Характер психопатологических синдромов и в целом психических отклонений
прослежен со времени первого обращения больных за медицинской помощью в клинику
Свердловского областного клинического психоневрологического госпиталя для
ветеранов войн.
Данные о наличии у наблюдавшихся нами больных различных вариантов
психопатологических расстройств представлены в таблице 6.3 и на рис. 6.5.
Частота встречаемости и клинические варианты психоорганического синдрома
распределились по двум группам наблюдавшихся пациентов неоднозначно, что
свидетельствует о том, что выявленные изменения не могут иметь исключительно
травматический генез, а обусловлены в значительной степени присутствием
хронической алкогольной зависимости.
Таблица 6.3. Варианты психопатологических расстройств
| Варианты синдромов |
1-я группа: ЧМТ и алкогольная
зависимость (n=105) |
2-я группа: ЧМТ
(n=48) |
| Психоорганический |
77 (73,33%)* |
13 (27,08%) |
| Астено-невротический |
6 (5,71%) |
4 (8,33%) |
| Астенический |
22 (20,95%) |
31 (64,58%)* |
Примечание: * – р<0,05 – 0,01.
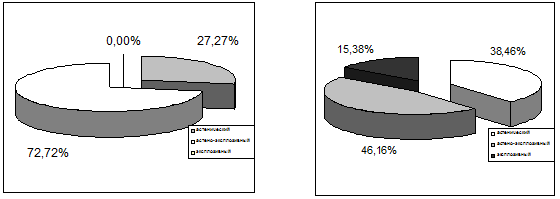
Рис. 6.5. Сравнительная характеристика основных вариантов
психоорганического (астенического, астено–эксплозивного, эксплозивного) синдрома
по группам наблюдений (слева – больные с алкогольно-травматической патологией,
справа – с исключительно травматической).
Среди пациентов с сочетанной алкогольно–травматической патологией достоверно
(р<0,01) чаще диагностировался психоорганический синдром, реже (р<0,05) –
астенический при одинаковой частоте встречаемости астено–невротических
расстройств.
Среди основных вариантов психоорганического синдрома также отмечены
отчетливые различия по группам наблюдений. У пациентов с сочетанной алкогольно–травматической
патологией астенический вариант присутствовал у 21 человека (27,27%) из 77, и
астено–эксплозивный – у 56 человек (72,72%) из 77; эксплозивного варианта
психопатологических расстройств у представителей этой группы не выявлено. У
пациентов же 2–й группы наблюдений с только последствиями ЧМТ астенический
вариант психоорганического синдрома присутствовал у 5 (38,46%) больных из 13,
астено–эксплозивный – у 6 (46,15%) из 13. Наконец, 2 (15,38%) пациента страдали
эксплозивным вариантом психоорганического синдрома. Отчетливая статистическая
достоверность различий в распределении вариантов психоорганического синдрома по
группам наблюдений не подтверждается (р>0,05), но тенденции несомненны, в
частности в плане преобладания астено–эксплозивных расстройств у больных с
сочетанной алкогольно–травматической патологией.
Таким образом, формирование стойких психопатологических расстройств, в
частности в форме различных клинических вариантов психоорганического синдрома,
достоверно чаще наблюдается у лиц, получивших боевую ЧМТ и имеющих
сформированную алкогольную зависимость по сравнению с пациентами, перенесшими
аналогичную ЧМТ, но не страдающих патологическим пристрастием к алкоголю. И
наоборот, сугубо астенические расстройства разной степени выраженности
достоверно чаще представлены у пациентов с последствиями ЧМТ без признаков
алкогольной зависимости, что, возможно, указывает на стабилизирующее, даже
облегчающее действие алкоголя в плане формирования и развития астенических
проявлений травматического генеза. Больные, подавляя у себя посттравматическую
астению, приходят постепенно к развитию гораздо более негативных и
прогностически менее благоприятных психопатологических проявлений
психоорганического синдрома.
Приведем пример.
Больной Ф., 1959 г.р., наблюдается в течение 18 лет. С 1989 г. больному
ставился диагноз: последствия закрытой боевой ЧМТ, хронический гипертензионно–гидроцефальный
и выраженный церебрастенический синдромы. В 1993 г. был установлен диагноз:
органическое заболевание ЦНС сложного генеза (посттравматического,
интоксикационного алкогольного), психоорганический синдром, астено–эксплозивный
вариант; хронический гепатит смешанной этиологии (поствирусный и токсический).
Принимал участие в боевых действиях на территории Афганистана с 1979 по 1981 гг.
Перенес контузию головного мозга с потерей сознания в течение примерно 25 – 35
минут, перенес также вирусный гепатит, малярию, лечился в госпитале. Со времени
контузии беспокоят частые, интенсивные головные боли, в течение последних 6 – 7
лет присоединились головокружения несистематизированного характера, чувство
тошноты, зависимость самочувствия от погоды, ухудшился сон, резко снизилась
память. Сразу после демобилизации не мог спокойно спать, видел во сне лица
погибших товарищей, «воевал», кричал. Впоследствии появилась раздражительность,
начались проблемы в семье и на работе из–за нетерпимости, вспышек ярости, с
которыми не мог справиться самостоятельно. Для «облегчения состояния и лучшей
адаптации» начал массивно алкоголизироваться. Вначале употребление алкоголя
помогало снять головные боли и психоэмоциональное напряжение, но очень быстро
утратился количественный и ситуационный контроль над выпитым, а также защитный
рвотный рефлекс, появились амнестические формы опьянения, и как итог
сформировался алкогольный абстинентный синдром. Диагностирована 2–я ст.
алкогольной зависимости. С 1993 г. по 2 – 3 раза в год проходит курсы
стационарного лечения по поводу прерывания запоя или в ремиссии – по поводу
ухудшения состояния в рамках психоорганического синдрома и его декомпенсации.
Неврологически: вялые зрачковые реакции, болезненность глазных яблок в их
крайних отведениях, болезненность верхних тригеминальных точек с 2–х сторон,
асимметрия носогубных складок, девиация языка влево, горизонтальный нистагм,
вялые брюшные рефлексы, пошатывание в позе Ромберга, интенция и мимопопадание
при выполнении пальце–носовой пробы с 2-х сторон.
Сознание ясное, все виды ориентировки сохранены. Контакту доступен, при
беседе напряжен, недоверчив. На вопросы отвечает после паузы, односложно. Фон
настроения снижен, эмоционально лабилен, склонен к аффективным вспышкам. С
трудом может пользоваться общественным транспортом, не выносит очередей, так как
«это раздражает». Внимание неустойчивое, истощаем. Выявляется психическая
астения, увеличивается латентный период при ответах на задаваемые вопросы.
Память снижена на текущие и прошлые события, допускает грубые ошибки при счете
по Крепелину. Не может назвать даты рождения своих детей. Забывает перенесенные
заболевания, не всегда датирует события своей жизни. Психическая деятельность
замедленна. Настроение депрессивное. Отчетливой психопродуктивной симтоматики не
выявляется. Критика к своему состоянию и к болезни формальная. Интеллект
невысок.
Окулист: пресбиопия; ангиопатия сетчатки по гипертензивному типу.
ЭхоЭС: сдвига срединных структур нет; ширина 3–го желудочка 6 мм.
ЭЭГ (рис. 6.6): доминирует полиморфная дезорганизованная альфа–тета
активность; зональные различия отсутствуют; реакция активации не выражена; При
гипервентиляции регистрируются билатерально синхронные вспышки альфа–тета
активности, а также комплексы «острая–медленная волна» в левой височной области.
Заключение: общемозговые изменения по органическому типу; дисфункция срединно–стволовых
структур; снижение порога судорожной готовности; очаг эпилептогенеза в левой
височной области.
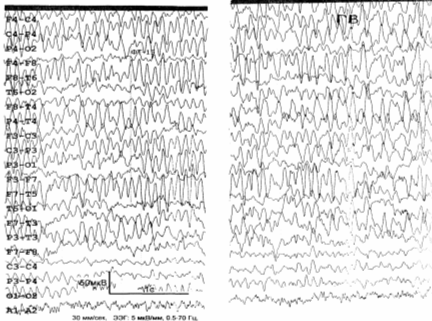
Рис. 6.6. ЭЭГ больного Ф., 1959 г. рожд. Пояснения – в
тексте.
Проводились курсы медикаментозной терапии: реланиум в/м, сернокислая магнезия
и хлористый калий в/в капельно, феназепам в таблетках, дегидратация,
вазоактивные средства, витамины; физиотерапия, массаж; курс индивидуальной
психотерапии с поведенческими методиками; курс семейной психотерапии; курс
противорецидивной терапии по поводу алкогольной зависимости. В результате
повторного лечения уменьшались интенсивность головных болей, раздражительность и
аффективность, улучшался сон.
Таким образом, у больного после перенесенной боевой ЧМТ и выхода из зоны
боевых действий сформировалось отчетливое ПТСР, клинические проявления которого
пациент пытался снять массивной алкоголизацией, что, в свою очередь, привело к
формированию хронической алкогольной зависимости. При этом на фоне присутствия
рассеянной неврологической микросимптоматики, гипертензионного синдрома,
признаков судорожной готовности на ЭЭГ выявляются выраженные проявления
психоорганического синдрома, преимущественно астено–эксплозивного типа,
сопровождающиеся депрессивными, когнитивными расстройствами. Проводимая терапия
сочетанного действия как на последствия ЧМТ, так и на алкогольную зависимость в
рамках ПТСР имеет отчетливый эффект, отражающий адекватность лечения.
Распределение депрессивных расстройств в клинической картине заболевания у
наблюдавшихся пациентов представлено в таблице 6.4. Наиболее информативными и
соответствующими клинической ситуации оказались результаты, полученные с помощью
самооценки по Цунгу.
Таблица 6.4. Сравнительные уровни депрессивных расстройств
| Уровень депрессивного состояния
(по Цунгу) |
1-я группа: ЗЧМТ и алкогольная зависимость (n=105) |
2-я группа: ЗЧМТ
(n=48) |
| Состояние без депрессии ( менее 50 у.д.) |
10 (9,52%) |
8 (16,66%) |
| Легкая депрессия ситуативного или невротического генеза (
50–59 у.д.) |
71 (67,61%)* |
13 (27,08%) |
| Субдепрессивное состояние или маскированная депрессия
(60–69 у.д.) |
20 (19,04%) |
23 (47,93%)* |
| Истинное депрессивное состояние
( более 70 у.д.) |
4 (3,83%) |
4 (8,33%)* |
Примечание: * – р<0,05 – 0,01.
Той или иной степени выраженности депрессивные расстройства выявлялись у
большинства пациентов обеих групп: у 95 (90,48%) с сочетанием последствий боевой
ЧМТ и алкогольной зависимости, и у 40 (83,33%) с наличием исключительно
последствий боевой ЧМТ. Столь частое присутствие депрессивных расстройств в
клинике последствий ЧМТ характерно именно для последствий боевой ЧМТ, полученной
в условиях ХПЭС боевой обстановки при формировании в дальнейшем ПТСР (Мякотных
В.С., 1994; Таланкина Н.З., 2001; Шерман М.А., 2003; Альтман Д.Ш., 2006).
Что же касается уровня, выраженности депрессивных расстройств, то данные
показатели существенно различаются по выделенным группам наблюдений (рис. 6.7),
что указывает на существенное влияние хронической алкогольной зависимости даже
при условии ее развития в рамках ПТСР.
Состояние легкой депрессии выявилось в достоверно (р<0,05) большем числе
случаев среди 95 пациентов с сочетанной патологией (71 наблюдение; 74,74%), чем
среди 40 пациентов с последствиями боевой ЧМТ, но не страдавших хроническим
алкоголизмом (13 наблюдений; 32,50%). Маскированная депрессия, субдепрессивные
состояния, наоборот, встречались отчетливо (р<0,01) чаще у пациентов с только
последствиями боевой ЧМТ (57,50%), чем у лиц с сочетанной алкогольно–травматической
патологией (21,05%). Также чаще среди пациентов с исключительно последствиями
ЧМТ, по сравнению с лицами с сочетанной алкогольно–травматической патологией,
отмечалось истинное депрессивное состояние – соответственно в 10,0% и в 4,21%
наблюдений. Указанные различия могут свидетельствовать о том, что хроническое и
массивное употребление алкоголя, увеличивая в целом частоту депрессивных
расстройств, возникающих у больных с последствиями боевой ЧМТ и на фоне ПТСР,
способствует уменьшению степени выраженности депрессии, с одной стороны, и более
отчетливой ее клинике с подавлением маскированности, с другой. Возможно, что
данные факторы в определенной степени и заставляют наших пациентов раз за разом
обращаться к алкоголю.
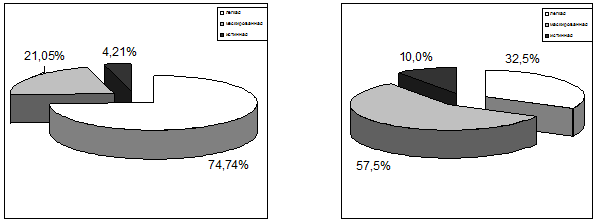
Рис. 6.7. Уровни депрессивных расстройств у пациентов обеих
групп (слева – больные с алкогольно-травматической патологией, справа – с
исключительно травматической).
Таким образом, хроническая алкогольная зависимость вносит отчетливый вклад в
формирование неврологической и психопатологической симптоматики, первично
связанной с перенесенной боевой ЧМТ и ХПЭС боевой обстановки.
У больных, страдающих хронической алкогольной зависимостью, развившейся в
резидуальном периоде боевой ЧМТ, определенно чаще, чем при исключительно
последствиях аналогичной травмы, наблюдается тремор конечностей, диссомнические
расстройства и парасомнии, несистемные головокружения и расстройства
координации, нарушения мышечного тонуса, чувствительные расстройства,
эпилептические припадки, снижение памяти. При этом головные боли нередко не
достигают той степени выраженности и не проявляются тяжелыми гипертензионными,
ликвородинамическими кризами, как это бывает при исключительно травматическом их
генезе. Психоорганический синдром также значительно чаще наблюдается на фоне
хронического алкоголизма, нежели при исключительно последствиях боевой ЧМТ, где
преобладают астенические расстройства. При этом астено–эксплозивные проявления
психоорганического синдрома также более характерны для лиц с сформированной
алкогольной зависимостью. У этих больных также чаще диагностируются легкие
депрессивные расстройства, тогда как более тяжелые формы депрессии определяются
у лиц, не злоупотребляющих алкоголем.
В целом складывается впечатление о том, что лица, перенесшие легкие боевые
ЧМТ в ситуации ХПЭС боевой обстановки, часто обращаются к алкоголю, как к
средству, облегчающему ряд симптомов, возникающих на данном травматическом,
психоэмоциональном фоне – головных болей, повышенной раздражительности, астении,
сниженному фону настроения и др. При этом достигается временный позитивный
эффект, но, с другой стороны, под влиянием хронического и неумеренного
употребления алкоголя происходит нарастание корковых и внутренних атрофий
головного мозга, возникает и прогрессирует диффузное аксональное повреждение и
стойкое, запущенное травмой нарушение таламо–кортикальных связей, инициируется
развитие эпилептического процесса. В итоге формируется новый, устойчивый тип
сочетанной органической церебральной патологии, характеризующийся значительно
более выраженными и тяжелыми неврологическими и психопатологическими
клиническими проявлениями, функциональными расстройствами, чем те, которые
наблюдаются при исключительно травматическом генезе заболевания даже при условии
получения ЧМТ в боевой обстановке, в присутствии ХПЭС.
6.4. Ускоренное старение и состояние системы перекисного окисления липидов у
больных с последствиями боевой ЧМТ и алкогольной зависимостью
Проведенные нами исследования заставили предположить определенную роль
последствий боевой ЧМТ в сочетании с хронической алкогольной зависимостью в
развитии различной патологии, в первую очередь сердечно–сосудистой, и связанного
с этим раннего патологического старения у ветеранов современных вооруженных
конфликтов. В связи с этим, для уточнения некоторых звеньев патогенеза данного
сложного патологического процесса было проведено представленное исследование.
Предполагалось на основе изучения изменений, происходящих в системах ПОЛ, АОЗ,
вегетативного регулирования деятельности сердечно–сосудистой системы,
представить концепцию раннего старения ветеранов современных вооруженных
конфликтов, перенесших боевые ЧМТ и страдающих посттравматической алкогольной
зависимостью.
6.4.1. Биологический возраст как показатель ускоренного старения
Показатели биологического возраста (БВ) рассчитывались по методике,
используемой в течение многих лет в нашей клинике (Мещанинов В.Н., Гаврилов
И.В., 1995; Ястребов А.П., Мещанинов В.Н., 2005).
На первом этапе исследований были рассмотрены средние значения показателей БВ
и календарного возраста (КВ). Последние в нашем случае приближались к
показателям должного БВ, рассчитываемого нами по формуле ДБВ=0,863хКВ+6,85
(Ястребов А.П., Мещанинов В.Н., 2005), поэтому должный БВ можно было исключить
из проводимого анализа. Кроме того, боевые действия в Афганистане и Чечне велись
в разные годы. Поэтому, в силу закономерных различий в показателях среднего КВ у
участников афганских и чеченских событий БВ этих двух контингентов ветеранов
боевых действий рассматривался отдельно.
Общие результаты определения БВ у исследуемых групп пациентов выглядели
следующим образом: в группе лиц, страдающих хронической алкогольной
зависимостью, средний показатель БВ оказался равным 55,13±7,71 годам при КВ –
37,81±6,03 лет, в группе перенесших боевую ЧМТ, но не страдавших патологическим
влечением к алкоголю – 42,17±6,98 годам при КВ – 35,55±5,21 лет. Налицо
отчетливое увеличение показателей БВ по сравнению с КВ, что наиболее заметно у
лиц с посттравматической алкогольной зависимостью, где различия между
усредненными показателями КВ и БВ достигают 17,32±3,67 лет (р<0,01), т.е. 5–го,
наиболее неблагоприятного функционального класса процесса старения (Мещанинов
В.Н., Гаврилов И.В., 1995; Ястребов А.П., Мещанинов В.Н., 2005). Уже только на
основании представленных данных можно утверждать, что получение ЧМТ в условиях
военных действий и ХПЭС боевой обстановки может явиться фактором риска раннего
старения, а присоединение в дальнейшем хронического алкоголизма в значительной
степени усугубляет данный патологический феномен.
В таблице 6.5 и на рис. 6.8, кроме того, представлены результаты сравнения КВ
и БВ у двух различных по КВ категорий обследованных – участников афганских
(«афганцы») и чеченских («чеченцы») событий. Таковых было соответственно среди
больных, страдавших алкогольной зависимостью 58 и 40 человек, среди не
страдавших указанной патологией – 27 и 21. Участники боевых действий в других
«горячих точках» (Таджикистан, Дагестан) не учитывались из–за малого числа
наблюдений (n=7).
Таблица 6.5. Сравнительные результаты определения БВ у
участников боевых действий в Афганистане и Чечне
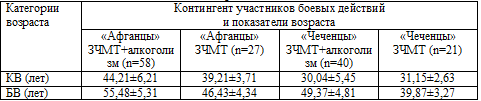
Как видно из представленных таблицы и рисунка, у пациентов, проходивших
службу в Чечне и имеющих сформированную алкогольную зависимость, показатели БВ
абсолютно достоверно (Р<0,05) увеличиваются по сравнению с таковыми же
пациентами, также перенесшими боевую ЧМТ в операциях на территории Чечни, но не
имеющих алкогольной зависимости. При этом БВ «чеченцев», страдающих хроническим
алкоголизмом, оказался даже более высоким, чем у значительно старших их по КВ
«афганцев», не страдающих алкогольной зависимостью. Это свидетельствует о том,
что сочетающаяся с последствиями боевой ЧМТ и ХПЭС алкогольная зависимость уже в
самом молодом возрасте вызывает формирование и развитие ускоренного старения,
значительно более выраженного, чем у лиц – участников современных боевых
действий, но не страдающих хроническим алкоголизмом.
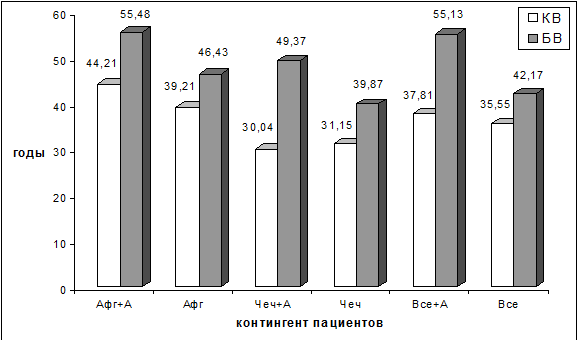
Рис. 6.8. Усредненные показатели КВ и БВ у различных
контингентов участников боевых действий.
6.4.2. Особенности перекисного окисления липидов и антиокислительной защиты
С учетом факта того, что процессы патологического старения, как и любые
патологические процессы, в том числе травматическая болезнь мозга, хроническая
алкогольная зависимость, могут быть связаны с изменениями, происходящими в
системе ПОЛ и в значительной степени обусловлены ими, было проведено
сравнительное определение показателей ПОЛ и АОЗ у выделенных групп больных,
страдающих и не страдающих алкогольной зависимостью.
При определении состояния системы ПОЛ и АОЗ проводились исследование
светосуммы хемилюминесценции (ХЛ) и диеновой конъюгации (ДК) как показателей
активности ПОЛ; определялся уровень ферментов каталазы и пероксидазы как
показателей активности АОЗ; производилось исследование показателей перекисной (ПРЭ)
и осмотической (ОРЭ) резистентности эритроцитов, определяющих способность
эритроцитов к гемолизу и косвенно подтверждающих активность ПОЛ. Исследовались
также содержание общих липидов и общего белка сыворотки крови. Дополнительно
определялось содержание среднемолекулярных пептидов (СМП) как ориентировочного
признака эндогенной интоксикации организма; причем, с учетом того, что уровень
СМП зависит не только от присутствующего в организме патологического процесса,
но и от поступления в организм химических веществ, которые также являются
эндотоксинами.
Полученные показатели представлены в таблице 6.6.
Таблица 6.6. Сравнительные показатели ПОЛ и АОЗ
|
Показатели |
Последствия ЧМТ в сочетании с алкогольной зависимостью (n=105) |
Последствия ЧМТ, не сочетающиеся с алкогольной
зависимостью (n=48) |
| СМП (отн. ед.) |
0,329±0,11 |
0,319±0,09 |
| Общий белок (г/л) |
68,6±4,86 |
69,03±4,43 |
| Общие липиды (г/л) |
0,448±0,09 |
0,511±0,19 |
| Каталаза (мкКат/г) |
2,71±0,19 |
2,43±0,21 |
| Пероксидаза (мкКат/г) |
19,08±1,73* |
35,27±3,41 |
| ПРЭ (отн. ед.) |
2,83±0,21* |
1,13±0,06 |
| ОРЭ (отн. ед.) |
2,97±0,34** |
8,28±0,54 |
| ДК (отн. ед.) |
2,602±0,25* |
1,344±0,08 |
| Светосумма ХЛ (отн. ед.) |
8989,45±472,31* |
5872,87±281,23 |
Примечание: * – Р<0,05; ** – Р<0,01.
Как следует из таблицы 6.6, средние показатели содержания, активности СМП,
каталазы, общего белка, общих липидов различались по выделенным группам больных
недостоверно (Р>0,05). В то же время, в группе пациентов с последствиями ЧМТ и
сформированной хронической алкогольной зависимостью произошло достоверное (Р<0,05)
возрастание средних показателей ДК, уменьшение активности пероксидазы,
увеличение показателя светосуммы ХЛ. Данные изменения несомненно свидетельствуют
об активации процессов ПОЛ на фоне ослабления активности системы АОЗ. Также в
группе пациентов с сочетанной алкогольно-травматической патологией произошло
достоверное повышение ПРЭ и снижение ОРЭ. Высокая ОРЭ с показателем процента
гемолиза эритроцитов 8,28% у травматиков против 2,97% у таковых же, но
страдающих дополнительно хронической алкогольной зависимостью, свидетельствует
об истощении процессов резистентности на фоне хронического алкоголизма (Andersen
H.R. et
al., 1997). ОРЭ у лиц, страдающих посттравматической
алкогольной зависимостью, находится как бы в противофазе ПОЛ и снижается вместе
и параллельно с антиокислительной активностью.
Обращаясь к литературе, следует упомянуть о том, что по данным Д.Д. Гендлина
(1988), одним из ведущих механизмов токсисческого эффекта этанола является его
влияние на структурное и функциональное состояние мембран. Все клинические
проявления алкоголизма могут быть следствием сдвигов, развивающихся в мембранных
структурах. Под влиянием этанола по мнению автора, изменяется «текучесть»
мембран, что обусловлено нарушениями их липидных компонентов. Хроническое
введение этанола уменьшает «текучесть» мембран и способствует увеличению их
микровязкости, что связывается с изменениями в составе остатков жирных кислот в
липидах мембран. Усиление ПОЛ, таким образом, сопряжено с токсическим эффектом
этанола. Усиление ПОЛ наблюдается уже на 1–й стадии алкоголизма, во 2–й стадии
показано увеличение содержания промежуточных и конечных продуктов ПОЛ (диеновых
конъюгатов, шиффовых оснований), выявлен также исходно пониженный уровень АОЗ.
Предполагается, что интенсификация ПОЛ под влиянием этанола является одним из
ведущих механизмов токсического влияния этанола и развития клинических
проявлений алкоголизма. С другой стороны, усиление процессов ПОЛ у больных
алкоголизмом 2–й стадии наиболее выражено, особенно для ДК, у лиц с начальной
формой алкогольной дистрофии миокарда, но динамика параметров
супероксиддисмутазы указывает на положительные сдвиги в состоянии
антиоксидантной системы больных под влиянием противоалкогольной терапии (Золотая
Р.Н. с соавт., 1987). Считается, поэтому, целесообразным включить в комплексную
противоалкогольную терапию препараты с антиоксидантным действием.
К числу возможных причин активации ПОЛ при патологических состояниях или
интоксикациях, в том числе при хроническом алкоголизме, ЧМТ, относят (Овчинникова
Л.Н., Горкин В.З., 1989): а) стимуляцию активности ферментных систем, при
функционировании которых образуются активные формы кислорода, что приводит к
повышению их концентрации в клетке; б) повышение концентрации и переход из
связанного состояния в свободное металлов с переменной валентностью (железо,
медь), оказывающих прооксидантное действие; в) повышение доступности высших
непредельных жирных кислот воздействию активных форм кислорода и прооксидантов;
г) снижение содержания в клетке природных антиоксидантов; д) снижение активности
антиокислительных ферментов – каталазы, супероксиддисмутазы,
глутатионпероксидазы, глутатионредуктазы.
Увеличение показателей БВ в группе больных с наличием алкогольной зависимости
по сравнению с пациентами, страдающими только последствиями боевой ЧМТ,
дополнительно подтверждает гиперактивность процессов патологического старения.
Напрашивается вывод о том, что при наличии алкогольной зависимости происходит
неспецифическая активация системы ПОЛ и процессов патологического старения, в
том числе старения головного мозга (Бейн Б.Н., 2003). Лечение подобного
контингента больных должно быть, кроме всего прочего, направлено и на снижение
активности процессов ПОЛ, то есть на профилактику раннего старения.
Также, как и в случае определения БВ, были отдельно проанализированы
показатели ПОЛ и АОЗ у различающихся по КВ представителей разных военных
конфликтов – в Афганистане и Чеченской республике (таблица 6.7).
Судя по результатам, представленным в таблице 6.7, не выявлено существенных
различий между сравниваемыми лицами. Различия касались только варианта
церебральной патологии – сочетанной или исключительно травматической.
Таким образом, выявлено отчетливое увеличение БВ по сравнению с КВ у
ветеранов современных военных конфликтов, получивших легкую боевую ЧМТ. Наиболее
заметно увеличение показателей БВ у лиц с посттравматической алкогольной
зависимостью, где различия между усредненными показателями КВ и БВ достигают
17,32±3,67 лет (р<0,01).
Таблица 6.7. Сравнительные показатели ПОЛ и АОЗ у
участников разных вооруженных конфликтов при разных вариантах патологии
| Показатели |
1-я группа: ЗЧМТ и алкогольная зависимость (n=105) |
2-я группа: ЗЧМТ
(n=48) |
| СМП (отн. ед.) |
0,325±0,12 0,341±0,07 |
0,302±0,04 0,334±0,08 |
| Общий белок (г/л) |
69,81±4,84 66,35±4,35 |
71,69±4,31 66,78±3,78 |
| Общие липиды (г/л) |
0,501±0,11 0,395±0,07 |
0,476±0,17 0,563±0,13 |
| Каталаза (мкКат/г) |
2,81±0,17 2,72±0,11 |
2,26±0,34 2,59±0,41 |
| Пероксидаза (мкКат/г) |
21,98±2,34 20,62±2,41 |
32,34±2,75 38,02±3,21 |
| ПРЭ (отн. ед.) |
1,98±0,08 2,04±0,19 |
1,29±0,07 1,01±0,02 |
| ОРЭ (отн. ед.) |
3,45±0,21 2,12±0,08 |
8,69±0,78 7,78±0,65 |
| ДК (отн. ед.) |
2,878±0,37 2,497±0,85 |
1,375±0,09 1,298±0,03 |
| Светосумма ХЛ (отн. ед.) |
8747,34±321,21 8616,61±387,42 |
6331,41±298,35 5272,42±234,71 |
Примечание: в верхнем ряду каждой строки – показатели участников войны в
Афганистане (n=58 и 27 по группам наблюдений), в нижнем –
боевых действий в Чечне (n=40 и 21 по группам
наблюдений).
Можно утверждать, что получение ЧМТ в условиях военных действий и ХПЭС
является фактором риска раннего старения, а присоединение в дальнейшем
хронической алкогольной зависимости усугубляет данный патологический феномен.
Формирование и развитие ускоренного старения при создавшихся условиях возможно
уже в самом молодом возрасте, о чем свидетельствуют показатели, выявленные у
самых молодых участников боевых действий в Чеченской республике. При этом
происходит неспецифическая активация не только процессов патологического
старения как таковых, но и системы ПОЛ на фоне ослабления активности АОЗ.
Вероятно, поэтому, что лечение подобных больных должно быть, кроме всего
прочего, направлено и на снижение активности процессов ПОЛ и профилактику
раннего старения, причем вне зависимости от КВ пациентов.
6.5. Особенности функционального состояния вегетативной нервной системы
Как уже говорилось, процессы ускоренного, патологического старения связаны,
по нашему мнению, с последствиями боевой закрытой ЧМТ, ХПЭС, хронической
алкогольной зависимостью не напрямую, а через нарастающие нарушения
вегетативной, нейрогуморальной регуляции деятельности, в первую очередь,
сердечно–сосудистой системы. И оснований для подобного рода утверждения
достаточно. Хорошо известно, например, что получение даже легкой боевой травмы
головного мозга приводит к появлению стойких посттравматических изменений (Одинак
М.М. с соавт., 1996; Мякотных В.С. с соавт., 2002), в том числе выраженных
вегетативных расстройств. Природа вегетативных нарушений, возможности их
терапевтической коррекции являются одной из актуальных проблем современной
послевоенной медицины (Вейн А.М., 1998; Шерман М.А., Шутов А.А., 2003;
Царегородцева С.А., 2007). Указанные моменты явились основанием для проведения
представленного исследования.
Анализ деятельности вегетативной нервной системы (ВНС) проводился у 69
пациентов. Для указанного исследования с целью исключения иных возможных влияний
на состояние ВНС, кроме последствий закрытой ЧМТ и алкогольной зависимости,
отбирались лица, имевшие минимальную отягощенность различного рода соматической
патологией других нозологических категорий. В итоге сформировались группы
наблюдений: 1-я (n=48; средний возраст 37,96±2,95 лет) – пациенты, имеющие
клинику последствий боевой закрытой ЧМТ в сочетании с 2–й стадией алкогольной
зависимости, сформировавшейся после перенесенной ЧМТ; 2-я (n=21; средний возраст
36,44±2,65 лет) – пациенты, имеющие клинические проявления только последствий
боевой закрытой ЧМТ, но не страдающие алкогольной зависимостью. Исследование
функционального состояния ВНС проводилось при помощи аппаратов фирмы «НейроСофт»
– «ВНС–Спектр» и «ВНС–Микро», программа анализа «Поли–Спектр». Исследовался
тонус, реактивность и уровень поражения вегетативной нервной системы при помощи
методики одновременной регистрации и анализа 8–ми каналов вызванных кожных
потенциалов.
Исследование вегетативного тонуса производилось на основе изучения
вариабельности сердечного ритма. Вариабельность ритма сердца является, как
известно, одним из наиболее важных маркеров активности ВНС, оценки уровня
адаптации (Веневцева Ю.Л. с соавт., 2000). Имеются два подхода к изучению
вариабельности ритма сердца: а) временной анализ (Баевский Р.М. с соавт., 1984),
б) спектральный анализ (Харкевич А.А., 1957; Баевский Р.М. с соавт., 1995). Нами
использовались оба варианта исследования.
При проведении временного анализа вариабельность ритма сердца исследовалась
при помощи кардиоинтервалографии (КИГ) по Р.М. Баевскому (1984, 1995) с
последующим расчетом показателей:
– мода (Мо) – наиболее часто встречающееся значение R–R, указывающее на
доминирующий уровень функционирования синусового узла сердца;
– амплитуда моды (АМо) – отражает меру мобилизирующего влияния симпатического
отдела ВНС;
– вариационный размах (ВР) – означает степень вариабельности кардиоинтервалов
и рассматривается в качестве показателя функционирования парасимпатического
звена ВНС;
– индекс напряжения регуляторных систем (ИН) – определяет степень
централизации управления и состояние симпатического отдела ВНС.
.Спектральный анализ позволяет оценивать функционирование центральных
осциллятов, симпатическую и вагусную активность и влияние гуморальных факторов.
Для спектрального анализа вариабельности ритма сердца применялись следующие
показатели:
– HF (High Frequency) – колебания частоты сердечных сокращений (ЧСС) при
высоких частотах (0,15 – 0,40 Гц), отражают активность парасимпатического отдела
ВНС;
– LF (Low Frequency) – низкочастотная часть спектра (0,04 – 0.15 Гц), имеет
смешанное происхождение и связана преимущественно с колебанием активности
симпатического отдела ВНС;
– LF/HF – значение свидетельствует о балансе симпатических и
парасимпатических влияний.
Термином вегетативной реактивности обозначают вегетативные реакции,
возникающие в ответ на внешние и внутренние раздражители. Основные методы
исследования вегетативной реактивности заключаются в проведении различных
функциональных проб, в частности, клино–ортостатической. Изменение ЧСС при
вставании позволяет выявить недостаточность вагусных влияний на сердце, уточнить
генез тахикардии при вегетативных кризах, которая не всегда имеет симпатическое
происхождение. Для количественной оценки этого измерения используется
коэффициент 30:15.
Количественный анализ данных КИГ показал (таблица 6.8) значимое увеличение
АМо в фоновой пробе у пациентов, страдающих хронической алкогольной
зависимостью, и незначимое увеличение АМо – в ортостатической.
Таблица 6.8. Сравнительный количественный анализ
результатов КИГ
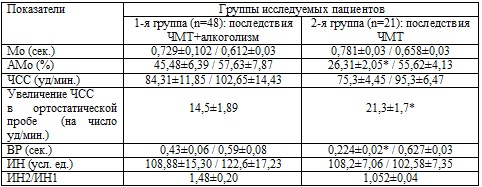
Примечания: а) * – Р<0,05; б) через знак «/» обозначены показатели: фоновые /
при проведении ортостатической пробы.
Отмечается незначимое уменьшение Мо у пациентов с алкогольной зависимостью в
фоновой и ортостатической пробах. ВР достоверно увеличен в этой группе в фоновой
и ортостатической пробах. Величина ИН находится в пределах нормы у пациентов
обеих групп в фоновой и ортостатической пробах, причем у пациентов 1-й группы
индекс напряжения несколько ниже, чем у пациентов 2-й. Анализ данных показателей
свидетельствует об усилении процессов централизации управления ритмом сердца за
счет преобладания симпатических влияний и о функционировании регуляторных систем
в условиях определенного напряжения.
Что касается увеличения ЧСС в ортостатической пробе, то отмечено значимое
увеличение ЧСС у пациентов, не страдающих алкогольной зависимостью (20,6±1,5 при
норме 10–15 уд/мин.). У пациентов же - представителей 1-й группы увеличение ЧСС
в ортостатической пробе – в пределах нормы (13,96±1,02).
В результате проведенного исследования ритмограммы и типа регуляции
синусового ритма всех пациентов (69 человек) выделено 2 основных варианта
изменений – А и Б.
А) Данный вариант ритмограммы и структура вариабельности сердечного ритма
указывают на стабилизацию регуляции сердечного ритма с переходом его регуляции с
рефлекторного вегетативного уровня руководства на более низкий – гуморально–метаболический,
который не способен быстро обеспечивать гомеостаз. Функциональные возможности
сердца снижены.
Б) Ритмограмма вариабельности ритма сердца характеризуется хорошо выраженными
волнами короткого, длинного и очень длинного периода. При этом моделирующее
симпато–парасимпатическое воздействие преобладает над гуморально–метаболическими
и центральными эрготропными влияниями. Наибольший вклад в регуляцию сердечного
ритма вносит парасимпатическая нервная система (фоновая ваготония покоя). Данный
вариант регуляции ритма сердца, вероятнее всего, отражает хорошее физическое
состояние, высокие адаптационные возможности и высокую стрессовую устойчивость
организма.
Среди пациентов, страдающих хронической алкогольной зависимостью, варианты
ритмограммы А выявлены у 21 (45%), Б – у 27 (55%). Среди пациентов, не имеющих
патологического пристрастия к алкоголю, варианты ритмограммы А определены у 17
(80,95%), Б – всего у 4 (19,05%). Можно предположить, таким образом, что у лиц с
сочетанием последствий боевой закрытой ЧМТ и сформированной алкогольной
зависимостью в значительном числе случаев (до 55%) встречается достаточно
высокий уровень адаптационных возможностей и стрессовой устойчивости организма.
При этом у пациентов только с последствиями ЧМТ, не страдающих алкогольной
зависимостью, высокий уровень адаптации встречается реже. В определенной степени
это можно объяснить адаптогенными свойствами алкоголя, которые могут проявляться
именно во 2–й стадии хронической алкогольной зависимости.
Сравнительные результаты спектрального анализа вариабельности ритма сердца
представлены в таблице 6.9.
Таблица 6.9. Результаты спектрального анализа
вариабельности сердечного ритма

Примечания: а) * – Р<0,05; б) через знак «/» обозначены показатели: фоновые /
при проведении ортостатической пробы.
Отмечается, что у пациентов, страдающих хронической алкогольной зависимостью,
соотношение HF и LF и в фоновой, и в ортостатической пробе примерно равно, что
говорит о сбалансированности симпатического и парасимпатического отделов ВНС в
регуляции ритма сердца. В то же время у пациентов, не имеющих патологического
пристрастия к алкоголю, наблюдается достоверное увеличение симпатических влияний
в регуляции ритма сердца, преобладает низкочастотная часть спектра (LF).
Исследования вегетативной реактивности парасимпатического отдела ВНС и
вегетативного обеспечения деятельности по результатам ортостатической пробы
выглядят следующим образом.
1-я группа (n=48): реактивность парасимпатического звена снижена у 29
(60,41%) больных, в пределах условной нормы находится у 5 (10,41%), высокая – у
14 (29,18%). Вегетативное обеспечение деятельности характеризуется сниженной
активацией симпатического отдела ВНС у 39 (81,25%) пациентов.
2-я группа (n=21): реактивность парасимпатического звена снижена у
большинства пациентов – у 18 (85,71%). Вегетативное обеспечение деятельности
характеризуется активацией симпатического отдела ВНС.
Таким образом, у пациентов с исключительно последствиями боевой закрытой ЧМТ
определяется отчетливая дисфункция неспецифических систем головного мозга с
тенденцией к симпатикотонии при недостаточности защитно–приспособительных
механизмов. У пациентов же с сочетанием последствий боевой закрытой ЧМТ и
алкогольной зависимости в большинстве случаев, наоборот, выявлен повышенный
тонус парасимпатической нервной системы, что подтверждается последними данными о
преобладании вазадилататорного компонента в ограничении цереброваскулярной
реактивности при хроническом алкоголизме (Артемьева Н.П. с соавт., 2006).
Выявлены также более высокие адаптационные возможности и хорошая стрессовая
устойчивость организма, что скорее всего объясняется адаптогенным действием
алкоголя. В определенной степени данный феномен является временно позитивным. Но
затем, указанный позитив сменяется тяжелыми негативными влияниями алкогольной
зависимости с формированием интоксикационно–травматической энцефалопатии. Это
перекликается с работами известного психотерапевта, основоположника
онтопсихологии А.. Менегетти (2005), который в рамках своей теории указывал на
важнейший вклад ВНС в процесс нейрофизиологического обеспечения психической
деятельности человека. Но, с другой стороны, даже имеющее место повышение
адаптационных возможностей и стрессоустойчивости организма под влиянием алкоголя
не может позитивно повлиять на процессы ускоренного старения и связанных с ним
нарушений в системе ПОЛ и АОЗ, что было показано нами. Данное противоречие
свидетельствует о временном и чисто субъективном характере улучшения в состоянии
пациента, быстро продвигающегося по пути ускоренного старения и связанного с ним
накопления целого «букета» патологических процессов.
6.6. Особенности биоэлектрической активности головного мозга
При анализе фоновой и реактивной биоэлектрической активности нами
использована классическая визуальная методика (Жирмунская Е.А., 1991, 1997;
Жирмунская Е.А., Лосев В.С., 1984; Зенков Л.Р., Ронкин М.А., 1991; Зенков Л.Р.,
1996). В процессе анализа выделялись следующие ЭЭГ феномены:
1) организованные (моноритмические) паттерны, отличающиеся превалированием
какого–то основного ритма, которые, в свою очередь, подразделялись на: 1а –
гиперсинхронизированный вариант, при котором увеличивается индекс и амплитуда
колебаний какого–либо диапазона частот с генерализацией их по всем областям
мозга; 1б – десинхронизированный вариант, который характеризуется нарушением
ритмических, медленных волновых компонентов, их заменой на более быстрые
колебания с меньшей амплитудой.
2) дезорганизованные паттерны, в которых выражена нерегулярная активность,
состоящая из множества беспорядочно перемешанных компонентов.
Известно, что формирование паттернов ЭЭГ зависит от влияния на кору со
стороны целого ряда регулирующих систем головного мозга (Жирмунская Е.А., 1991,
1997; Жирмунская Е.А., Лосев В.С., 1984):
– ретикулярной формации головного мозга, поддерживающей состояние
бодрствования, что на ЭЭГ проявляется десинхронизацией биопотенциалов;
– неспецифических ядер таламуса (заднее дорзальное и переднее вентральное),
участвующих в обеспечении бодрствования путем создания баланса между
активирующими и дезактивирующими импульсами, посылаемыми в кору мозга;
– взаимодействия целого ряда структур лимбико–ретикулярного комплекса
(ретикулярных структур продолговатого мозга, понто–мезенцефальной покрышки,
некоторых ядер таламуса, области заднего гипоталамуса, некоторых структур
обонятельного мозга, базальных ганглиев, в частности хвостатого ядра, некоторых
ассоциативных зон лобной коры мозга).
Показано также, что принципиально синхронизация ритмов ЭЭГ отражает не
возбудимость как таковую, а состояние функциональных связей между различными
областями мозга (Жирмунская Е.А., 1997), что с нашей точки зрения исключительно
важно, так как именно под влиянием хронического и неумеренного употребления
алкоголя происходит нарастание корковых и внутренних атрофий головного мозга,
возникает и прогрессирует диффузное аксональное повреждение и стойкое нарушение
таламо–кортикальных связей. А это обязательно должно найти свое отражение в
особенностях изменений биоэлектрической активности головного мозга у больных,
страдающих хронической алкогольной зависимостью, сформировавшейся на фоне
травматической болезни мозга.
В таблице 6.10 представлены варианты диффузных изменений биоэлектрической
активности головного мозга в зависимости от вида церебральной патологии –
алкогольно–травматической или исключительно травматической.
Таблица 6.10. Сравнительные варианты диффузных изменений
биоэлектрической активности головного мозга
| Варианты изменений на ЭЭГ |
Больные с последствиями ЧМТ и алкогольной зависимостью (n=105) |
Больные с последствиями ЧМТ, но без алкогольной
зависимости (n=48) |
| Общемозговые по органическому типу с эпилептиформной,
ирритативной или очаговой активностью |
56 (53,4%) |
11 (23,3%) |
| Гиперсинхронный вариант ЭЭГ |
22 (21%) |
13 (26,7%) |
| Десинхронный вариант ЭЭГ |
40 (38,1%) |
10 (20,8%) |
| Дезорганизованный вариант ЭЭГ |
15 (14,1%) |
5 (11,1%) |
Варианты нормальной ЭЭГ практически не встречались ни среди пациентов,
страдающих алкогольной зависимостью, ни среди больных, не имеющих
патологического влечения к алкоголю. В отдельных случаях фоновая ЭЭГ
представлялась нормальной, но под влиянием нагрузочных проб (гипервентиляция,
фотостимуляция, депривация сна) отчетливо проявлялись различного характера и
степени выраженности патологические изменения. В то же время довольно редко и
практически с одинаковой частотой по группам наблюдений (14,1 и 11,1%)
определялся отчетливо дезорганизованный вариант ЭЭГ. Существенные, достоверные (р<0,05
– 0,01) различия выявлены при сравнении числа больных с общемозговыми
изменениями по органическому типу с наличием эпилептиформной, ирритативной,
очаговой патологической активности и при сравнении частоты встречаемости
десинхронизированного варианта организованной активности. И в том, и в другом
случае указанные ЭЭГ феномены встречались достоверно чаще среди больных с
сочетанной церебральной алкогольно–травматической патологией. Десинхронизация
альфа–активности сопровождалась у этих больных доминированием по всем областям
мозга бета–активности высокой частоты и малой амплитуды, что согласуется с
данными некоторых авторов о характере ЭЭГ изменений при хроническом алкоголизме
(Виленский О.Г., 1960; Колупаев Н.Л., Яковлев В.А., 1997). В принципе механизм
формирования данного ЭЭГ синдрома связан с угнетением активности неспецифических
ядер зрительного бугра, усилением деятельности ретикулярной формации ствола и
заднего гипоталамуса, со спокойным состоянием переднего гипоталамуса и
хвостатого ядра (Жирмунская Е.А., 1997). Но при наличии алкогольной зависимости
усиление бета–активности может быть связано с патологически усиленным
возбуждением в дофамин–мезолимбических структурах мозга, что делает эти
структуры гиперреактивными, а вследствие гиперреактивности данных структур,
относящихся к восходящей активирующей системе мозга, происходит усиленное
генерирование частот бета–диапазона (Колупаев Н.Л., Яковлев В.А., 1997).
Механизм формирования синдрома дезорганизации основной активности связан с
состоянием раздражения неспецифических и ассоциативных ядер таламуса, угнетением
ретикулярной формации и заднего гипоталамуса; передний гипоталамус и хвостатое
ядро находятся при этом в состоянии покоя (Жирмунская Е.А., 1991, 1997;
Жирмунская Е.А., Лосев В.С., 1984). В нашем случае это согласуется с
преимущественно травматическим генезом данного варианта изменений, достаточно
характерного для отдаленных последствий боевой ЧМТ, полученной на фоне ХПЭС
боевой обстановки (Таланкина Н.З., 2001).
Синдром гиперсинхронизации характеризуется усилением альфа–активности по
индексу и амплитуде, сглаживанием зональных различий с возникновением на этом
фоне коротких вспышек дельта–активности, чаще в лобных и височных областях,
усиливающихся после нагрузочных проб. Синдром формируется при угнетении
активности ретикулярной формации ствола мозга и заднего гипоталамуса, при
усилении деятельности неспецифического таламуса за счет освобождения от
тормозных влияний со стороны ретикулярной формации мозга, при спокойном
состоянии переднего гипоталамуса, ассоциативных ядер таламуса (Жирмунская Е.А.,
1997). Применительно к нашим наблюдениям рассматриваемый феномен также имеет
преимущественно травматический генез, так как встречается даже несколько чаще у
больных с исключительно травматическим церебральным патологическим процессом при
отсутствии признаков хронической алкогольной зависимости.
С учетом возможной локализации функциональных нарушений в различных
структурах головного мозга нами были выделены три основных и ведущих уровня
дисфункции срединно–стволовых структур, которые отображены в таблице 6.11. В
данном случае, разумеется, трудно претендовать на абсолютную достоверность
выделенных нами локализаций, но, учитывая полную однородность критериев для
обеих сравниваемых групп наблюдений, вполне можно судить о предпочтительных
тенденциях в расстройствах функций тех или иных церебральных структур при разных
рассматриваемых вариантах патологии – сочетанной алкогольно–травматической, либо
же только травматической.
Таблица 6.11. Уровень дисфункции срединно–стволовых
структур мозга.
| Уровень |
Последствия ЧМТ и алкогольная зависимость (n=105) |
Исключительно
последствия ЧМТ
(n=48) |
| Каудальный уровень (ретикулярная формация ствола, область
IV желудочка, мост) |
12 (11,3%) |
22 (46,7%)
|
| Верхне–стволовой и мезенцефальный уровень (θ–волны) |
29 (27,3%) |
12 (23,3%) |
| Диэнцефальный уровень (признаки ликвородинамических
нарушений, b –волны, в том числе
раздражение медио–базальных отделов височных областей) |
64 (61,4%) |
14 (30%) |
Оказалось, что для сочетанного, алкогольно-травматического варианта
церебральной патологии более характерным (р<0,05), нежели для исключительно
травматического, оказался диэнцефальный уровень дисфункции. И это, несмотря на
то, что, как показано в предыдущем разделе данной главы, для лиц,
злоупотребляющих алкоголем, характерны более высокие адаптационные возможности и
хорошая стрессовая устойчивость организма, что скорее всего объясняется
адаптогенным действием алкоголя. Данные ЭЭГ исследования подтвердили тот факт,
что данный феномен является лишь временно позитивным, и в состоянии абстиненции,
например, дисфункция диэнцефального уровня несомненно проявит себя клинически.
Каудальный уровень дисфункции, наоборот, имеет скорее исключительно
травматический генез (р<0,01), а при присоединении обусловленных хронической
алкогольной зависимостью изменений биоэлектрической активности частота
проявлений данного каудального уровня дисфункции снижается в 4 раза, уступая
первенство функциональным расстройствам на диэнцефальном уровне.
Отдельно были рассмотрены варианты пароксизмальной активности, так как именно
последствия ЧМТ, а тем более последствия ЧМТ, сопровождающиеся сформированной
алкогольной зависимостью могут стать фоном для развития симптоматической
эпилепсии, которая с течением времени становится ведущим клиническим синдромом
сочетанной алкогольно–травматической церебральной патологии, что и имело место у
49 (46,67%) из 105 наблюдавшихся нами больных. При этом именно пароксизмальная
активность (Болдырев А.И., 1984; Карлов В.А., 1990; Мякотных В.С., 1993, 1994;
Шершевер А.С., 2005), может пролить свет на причины формирования эпилептического
процесса.
В таблице 6.12 представлены варианты пароксизмальной активности на ЭЭГ,
выявленной у пациентов с сочетанной алкогольно–травматической патологией, в
зависимости от выделенного ведущего неврологического синдрома – гипертензионного,
эпилептического, дискоординаторного.
Таблица 6.12. Варианты пароксизмальной активности в
зависимости от ведущего неврологического синдрома у пациентов с
алкогольно-травматической патологией
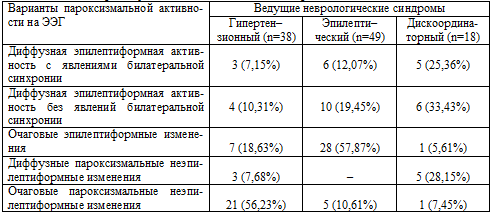
Та или иная пароксизмальная, преимущественно эпилептиформная активность была
обнаружена у 70 (66,67%) из 105 больных, преимущественно неэпилептиформная – у
35 (33,33%). У ряда пациентов имели место оба варианта пароксизмальной
активности, отсюда и введение понятия «преимущественно эпилептиформная»,
«преимущественно неэпилептиформная», что определялось преобладанием того или
иного варианта активности в течение времени проведения ЭЭГ исследования.
Явное (р<0,01) преобладание наблюдений с наличием эпилептиформной активности
на ЭЭГ отмечено у больных с эпилептическим синдромом (симптоматической
эпилепсией) в качестве ведущего в клинической картине сочетанной алкогольно–травматической
церебральной патологии – у 44 (89,8%) из 49. Среди больных с ведущими
гипертензионным и дискоординаторным синдромами в неврологической картине
заболевания указанные показатели составили соответственно 14 (36,84) из 38 и 12
(66,67%) из 18 больных. При этом у некоторых больных с пароксизмальными
дискоординаторными расстройствами последние предположительно также могут быть
эпилептического генеза, проявляясь в качестве простых парциальных вестибулярных
эпилептических припадков (Гасто А., 1975), что и сочетается с преимущественно
генерализованной, диффузной эпилептиформной активностью, регистрируемой на ЭЭГ.
Приведем пример.
Больной Ф., 1963 г.р. Наблюдается с 1994 г. с диагнозом: посттравматическая
энцефалопатия, прогредиентное течение, астено–эксплозивный вариант
психоорганического синдрома, симптоматическая эпилепсия; хронический холецистит;
хронический гепатит; алкогольная зависимость 2–й ст. В Афганистане служил в 1982
– 84 гг, получил контузию головного мозга с потерей сознания на примерно 45
минут, перенес вирусный гепатит, лечился в госпитале. После контузии беспокоят
частые головные боли, в течение последних 10 лет к ним присоединились отчетливо
пароксизмальные несистематизированные головокружения. Также после демобилизации
беспокоили частые стереотипные кошмарные сновидения, через год появились
«судороги» во время сна, о чем больному сказала жена. С этого же времени –
непроизвольные стереотипные «жевания», иногда несколько раз в сутки. В 1993
году, через 9 лет после демобилизации впервые, после алкоголизации развился
генерализованный судорожный припадок, затем припадки в течение года возникали с
частотой до 4–х раз в месяц, и до 1998 г. были связаны только с приемом
алкоголя. С 1998 г. генерализованные судорожные эпилептические припадки
возникали независимо от приема алкоголя, сопровождаясь эпигастрально–абдоминальной
аурой, и больному была впервые назначена противосудорожная терапия (финлепсин по
200 мг 3 раза в день), но регулярно пациент не лечился. Также в течение
последних 7 – 8 лет в вечернее время возникали ежедневные пароксизмальные
эпизоды «уже виденного», и до 5 раз в год вторично генерализованные судорожные
эпилептические припадки начинались именно с этих ощущений. В 2001 и 2003 гг.
зафиксирован эпилептический статус генерализованных судорожных припадков.
Массивно алкоголизируется с 1985 г. Сформировался абстинентный синдром, в
структуре которого вначале появились типичные проявления вегетативно–сосудистой
дистонии, нарушения сна, дисфории, а с 2001 г. в структуре абстинентного
синдрома периодически возникал вербальный галлюциноз.
Неврологически: вялые зрачковые реакции, болезненность глазных яблок при их
крайних отведениях, асимметрия носогубных складок, девиация языка влево,
горизонтальный нистагм, симптом Маринеску с 2-х сторон, вялые брюшные рефлексы,
пошатывается в позе Ромберга, интенция и мимопопадание при выполнении
пальце–носовой пробы слева.
Психический статус: сознание ясное, все виды ориентировки сохранены,
контактен; фон настроения снижен; не пользуется общественным транспортом, не
выносит очередей – «это раздражает»; внимание неустойчивое, истощаем, отвечает
на вопросы после длительной задержки, нарастает количество ошибок при счетных
операциях; память снижена на текущие и прошлые события, не может назвать даты
рождения своих детей, забывает перенесенные заболевания, не всегда датирует
события своей жизни; психическая деятельность замедлена, вял, пассивен;
настроение депрессивное, хотя считает, что «всегда был пессимистом»; аффективно
неустойчив, раздражителен, интеллект невысок.
Окулист: ангиоспазм сетчатки.
ЭхоЭС: сдвига срединных структур нет; ширина 3–го желудочка 7 мм.
При неоднократно проведенных ЭЭГ исследованиях выявляется дезорганизованный
тип ЭЭГ с преобладанием альфа– тета–активности – 4 и 5 тип по Е.А. Жирмунской,
миграция очага эпилептической активности по височным областям при разных
исследованиях, и во всех случаях – генерализация пароксизмальной эпилептиформной
активности при нагрузках (гипервентиляции). В процессе последней госпитализации
(2006 г.) проведено ЭЭГ исследование в динамике: на первой записи обнаружен
дезорганизованный тип ЭЭГ с преобладанием альфа– и тета–активности – 4–5 тип по
Е.А. Жирмунской, с наличием очаговых эпилептических изменений в левой височной
области (рис. 6.9). При повторной ЭЭГ на фоне сохраняющейся дезорганизации
основной активности выявлено преобладание очаговых эпилептиформных изменений в
правой височной области (рис. 6.10).
МРТ головного мозга в динамике: признаки открытой наружно–внутренней
гидроцефалии с нарастанием ширины третьего желудочка при повторном исследовании
на 1,5 мм, и ширины сильвиевой борозды – на 1,2 мм.
Люмбальная пункция: ликвор – под повышенным давлением; белок– 0,15 г/л, цитоз
– 7/3.
При последней госпитализации проведен курс массивной медикаментозной терапии:
диазепам в/в капельно, сернокислая магнезия с глюкозой, амиксид, депакин–хроно,
вазоактивные средства, дегидратация, витамины, биостимуляторы, курсы
индивидуальной, семейной и групповой психотерапии. Выписан с улучшением в виде
значительного уменьшения головных болей, раздражительности и аффективности в
поведении. На фоне лечения несколько реже стали возникать все виды
эпилептических припадков. Рекомендован постоянный прием депакина.
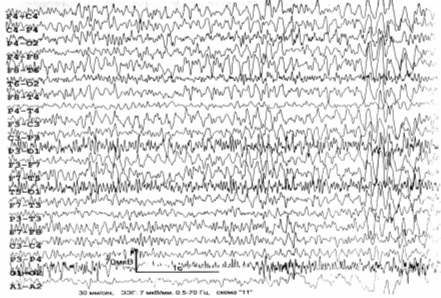
Рис. 6.9. Первичная ЭЭГ больного Ф., 1963 г. рожд.
Пояснения – в тексте.
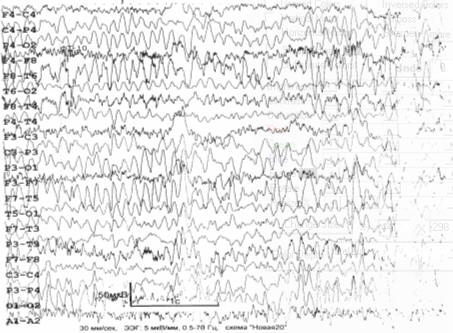
Рис. 6.10. Повторная ЭЭГ больного Ф., 1963 г. рожд.
Таким образом, у больного с последствиями боевой ЧМТ и алкогольной
зависимостью происходит прогредиентное развитие эпилептического процесса с
нарастанием полиморфизма, генерализации припадков, изменений личности. Этому
сопутствуют эпилептического типа мультифокальные изменения на ЭЭГ и признаки
нарастающей атрофии мозга, гидроцефалии по данным повторных МРТ. Лечение
недостаточно эффективно, и больной не осознает необходимости его постоянного
применения.
При сравнении частоты встречаемости эпилептиформных и неэпилептиформных
пароксизмальных проявлений на ЭЭГ среди больных двух наблюдавшихся групп также
определились некоторые закономерности (таблица 6.13).
Таблица 6.13. Сгруппированные варианты пароксизмальных
изменений на ЭЭГ
| Варианты пароксизмальных изменений |
1-я группа: ЗЧМТ и алкогольная зависимость (n=105) |
2-я группа: ЗЧМТ
(n=48) |
| Эпилептиформные |
70 (66,67%) |
20 (42,13%) |
| Неэпилептиформные |
35 (33,33%) |
28 (57,87%) |
Эпилептиформные пароксизмальные изменения на ЭЭГ существенно преобладают
среди больных с сочетанной алкогольно–травматической церебральной патологией,
неэпилептиформные, наоборот,– среди лиц с исключительно травматическим генезом
церебрального дефекта. Это вполне согласуется с полученными нами данными о
большей частоте развития симптоматической эпилепсии именно у лиц с сочетанной
церебральной патологий о провоцирующем действии алкоголя в плане клинической
манифестации эпилептического процесса, что было показано на клиническом примере
и согласуется с данными литературы (Болдырев А.И., 1984; Карлов В.А., 1990;
Мякотных В.С., 1993, 1994).
Таким образом, нарушения функциональной активности и интегративной
деятельности головного мозга при сочетанной алкогольно–травматической патологии
находят свое отражение в наиболее выраженных расстройствах биоэлектрической
активности на ЭЭГ. Отмечено отчетливое преобладание общемозговых изменений
органического типа с наличием эпилептиформной, ирритативной, очаговой
патологической активности. Десинхронизация альфа–активности сопровождается
диффузным доминированием бета–активности высокой частоты и малой амплитуды, что
может быть связано с угнетением активности неспецифических ядер зрительного
бугра, усилением деятельности ретикулярной формации ствола и заднего
гипоталамуса, со спокойным состоянием переднего гипоталамуса и хвостатого ядра,
а также с патологически усиленным возбуждением в дофамин–мезолимбических
структурах мозга, что делает эти структуры гиперреактивными, а вследствие
гиперреактивности данных структур, относящихся к восходящей активирующей системе
мозга, происходит усиленное генерирование частот бета–диапазона. При этом менее
характерными становятся дезорганизованные и гиперсинхронные варианты ЭЭГ, чаще
регистрируемые у пациентов с последствиями боевой ЧМТ, но без явлений
алкогольной зависимости. В целом для сочетанной алкогольно–травматической
церебральной патологии наиболее характерны ЭЭГ признаки диэнцефального уровня
дисфункции, что клинически проявляет себя в состоянии абстиненции и сводит на
нет временное адаптационное действие алкоголя. Наконец, эпилептиформные
пароксизмальные изменения на ЭЭГ также чаще встречаются среди больных с
сочетанной алкогольно–травматической церебральной патологией, чем исключительно
травматической, что согласуется с клиническими данными о более высокой частоте
развития симптоматической эпилепсии именно у лиц с сочетанной церебральной
патологий и о провоцирующем действии алкоголя в плане клинической манифестации
эпилептического процесса.
Резюме
Таким образом, неврологические симптомы и синдромы, нейропсихологические
проявления у больных с последствиями боевой ЧМТ и с последствиями же аналогичной
ЧМТ, но в сочетании с посттравматической алкогольной зависимостью отчетливо
различаются. У страдающих алкогольной зависимостью преобладает безкризовое
течение головных болей, очень часто определяются тремор конечностей,
диссомнические, мнестические, чувствительные, вестибулярные расстройства,
нарушения мышечного тонуса, эпилептические припадки, отчетливые признаки
психоорганического синдрома с преимущественно астено-эксплозивными проявлениями
на фоне легко выраженной депрессии. Для лиц с последствиями боевой ЧМТ, но не
страдающих алкогольной зависимостью, более характерны выраженные головные боли с
развитием ликвородинамических кризов, сочетание раздражительности с
агрессивностью в рамках астенического синдрома при наличии более выраженных, чем
у лиц с алкогольной зависимостью, субдепрессивных и маскировано-депрессивных
нарушений, хотя психоорганический синдром может проявляться эксплозивными
формами.
Получение ЧМТ в условиях боевых действий и ХПЭС само по себе является
фактором риска раннего старения, а присоединение в дальнейшем хронической
алкогольной зависимости значительно усугубляет данный патологический феномен.
При этом происходит выраженная активизация системы ПОЛ на фоне ослабления
активности АОЗ, что указывает на постепенное истощение резистентности организма
именно вследствие алкогольной зависимости, так как при исключительно
травматической церебральной патологии указанные сдвиги представляются отчетливо
менее выраженными. С другой стороны, последствия ЧМТ провоцируют нарушения в
деятельности ВНС с тенденцией к симпатикотонии при недостаточности
защитно-приспособительных механизмов, а алкогольная зависимость, наоборот, -
тенденцию к парасимпатикотонии при повышении адаптационных возможностей и
стрессовой устойчивости, что может быть связано с временным адаптогенным
действием алкоголя. Характерные для последствий ЧМТ дезорганизованные и
гиперсинхронные варианты ЭЭГ при преимущественно каудальном уровне дисфункции
уступают место при присоединении хронической алкогольной зависимости
общемозговым изменениям органического типа с наличием патологической
эпилептиформной, ирритативной, очаговой активности на фоне десинхронизации
альфа-ритма, доминировании бета-активности высокой частоты и малой амплитуды при
преимущественно диэнцефальном уровне дисфункции.
В целом можно утверждать, что лица, перенесшие боевые ЧМТ и ХПЭС боевой
обстановки, часто обращаются к алкоголю, как к средству, облегчающему ряд
симптомов, но при этом алкоголь способствует нарастанию корковых и
внутренних атрофий головного мозга, возникновению и прогрессированию диффузного
аксонального повреждения и нарушений таламо-кортикальных связей, запущенных
травмой. В итоге формируется новый, устойчивый тип сочетанной органической
церебральной патологии, характеризующийся специфическими клиническими
проявлениями, функциональными и патогенетическими расстройствами. |