
Глава 8. ПОСЛЕДСТВИЯ ТРАВМ СПИННОГО МОЗГА
Больные с травматическим повреждением спинного мозга представляют собой
наиболее тяжелый контингент реабилитационных учреждений. Закрытая
позвоночно-спинномозговая травма (ПСМТ) составляет 1-4% от общего числа больных
с различными видами травмы. Травма спинного мозга приводит к мало обратимым
двигательным и чувствительным нарушениям, сопровождается вегетативными
расстройствами, ее последствия требуют длительного и дорогостоящего
восстановительного лечения (Шевелев И.Н. с соавт., 2000; Полищук Н.Е. с соавт.,
2001; Петров К.Б., Иванчин Д.М., 2005; Blumer
C.E., Qine
S., 1995; Bregman
B.S., 1995). При этом, к сожалению, главным в
реабилитации больных с травматическим повреждением спинного мозга на сегодняшний
день является обучение пользованию сохранившимися функциями, а не восстановление
утраченных. В США, например, до сего времени наиболее приоритетным направлением
является социальная реабилитация. Для человека, который практически в ста
процентах становится инвалидом, создаются все условия, чтобы облегчить его
существование. В США и Великобритании на реабилитацию одного такого больного
ежегодно тратится до полутора миллионов долларов (Шевелев И.Н. с соавт., 2000;
Петров К.Б., Иванчин Д.М., 2005).
В патогенезе травматического повреждения спинного мозга рассматриваются два
основных взаимосвязанных механизма гибели клеток - некроз и апоптоз. С некрозом
связывают первичное повреждение тканей в момент травмы, на основе которого
формируется глиально-соединительнотканный рубец. Апоптоз – программированная
клеточная смерть является вторичным механизмом повреждения клеток. Развитие
апоптоза связано с действием возбуждающих аминокислот (глутамат), ионов Са2+,
медиаторов воспаления, ишемии и т.д. Происходит гибель нейронов микро- и
олигодендроглии, олигодендроцитов. Все это приводит к восходящей и нисходящей
дегенерации и демиелинизации нервных проводников, гибели части аксонов и глии (Борщенко
И.А. с соавт., 2000; Шевелев И.Н. с соавт., 2000; Петров К.Б., Иванчин Д.М.,
2005).
Тем не менее, сохранение лишь 10% аксонов способно обеспечить существенное
функциональное восстановление. Это связывают с процессом спраутинга -
образования новых отростков. Данные отростки образуют синапсы с клетками,
которые до травмы были связаны с поврежденными аксонами длинных трактов. Такие
связи способны обеспечить уменьшение неврологического дефицита на 1-2 сегмента.
Даже при полном разрыве спинного мозга передача импульсов от центра на периферию
в принципе возможна по экстрамедуллярным связям. От каждого спинномозгового
корешка отходит ветвь (r. Meningeus, или возвратный нерв Люшка) к твердой
мозговой оболочке, содержащая симпатические волокна. Соединяясь с такими же
ветвями возвратных нервов нижележащих корешков, она образует переднее и заднее
сплетения твердой мозговой оболочки (plexus meningeus) (Петров К.Б., Иванчин
Д.М., 2005). Кроме этого, в спинномозговой корешок входят волокна
паравертебральных симпатических ганглиев. Мышцы получают двигательную и
чувствительную иннервацию из 2-3 соседних сегментов, что является предпосылкой
для проведения нервного импульса в обход пораженных сегментов (Качесов В.А.,
2002, 2005; Петров К.Б., Иванчин Д.М., 2005; Davies
S. et al.,
1995; Schwab M.E.,
Bartholdi D., 1996). И здесь
важным достижением стало осознание роли феномена «learned non-use» («разучился
использовать»). Термин имеет отношение к анатомически сохранным нервным цепям,
выключающимся после длительного периода бездействия. Подобно мышцам, которые
атрофируются, если не используются, нервные цепи также могут потерять свои
функции. Исследования показали, что феномен «learned non-use» при
соответствующих адекватных усилиях можно сделать обратимым интенсивными
упражнениями даже после десятилетий паралича (Петров К.Б., Иванчин Д.М., 2005).
В Российской Федерации существуют несколько специализированных центров, где
длительное время и по индивидуальным программам проходят восстановительное
лечение больные с последствиями травмы спинного мозга. На базе Свердловского
областного клинического психоневрологического госпиталя для ветеранов войн также
создано специализированное отделение активной реабилитации, в котором по 2-3
раза в год в течение многих лет проходят курсы восстановительного лечения
спинальные больные. Для каждого пациента составляется индивидуальная программа
реабилитации, включающая медикаментозное лечение, лечебную физкультуру (ЛФК),
физиотерапию, массаж, психотерапию.
Анализ литературных данных и многолетнего собственного опыта, основанного на
длительном наблюдении свыше 300 больных, позволяет выделить следующие
особенности последствий спинальной травмы:
1) 95% пострадавших - носители урологической инфекции;
2) до 70% больных имеют трофические нарушения;
3) более 60% пациентов имеют ортопедическую патологию нижних конечностей,
которая не позволяет ходить даже при восстановлении функций спинного мозга.
С другой стороны, по нашим данным, до 70% пациентов с травмой спинного мозга
на нижне-грудном и поясничном уровнях могут самостоятельно передвигаться с
дополнительной опорой даже при полном перерыве спинного мозга (Леспух Н.И. с
соавт., 1996) и эту возможность необходимо использовать. Мы четко представляем
себе клинику поражения в зависимости от его локализации, но, к сожалению, еще
мало знаем о возможностях восстановления утраченных функций при той или иной
локализации повреждения спинного мозга. Может быть поэтому остается
распространенной высокая степень пессимизма в отношении прогноза состояния
больных с последствиями тяжелых спинальных повреждений. Данный пессимизм
хотелось бы хотя бы частично развеять.
8.1. Механизмы, классификации и клинические характеристики
позвоночно-спинномозговой травмы
Под позвоночно-спинномозговой травмой (ПСМТ) понимают механическое
повреждение позвоночника и/или содержимого позвоночного канала (спинного мозга,
его оболочек и сосудов, спинномозговых нервов).
Выделяют четыре механизма травматизации спинного мозга и корешков (Мартуза Р,
Проктор М., 1997):
1) сдавление костными фрагментами, связками, межпозвонковым диском, инородным
телом, гематомой;
2) растяжение - происходит в результате сильного сгибания, «перегиба»
позвоночника и спинного мозга;
3) отек - появляется сразу же после получения травмы и способствует
дальнейшему нарушению микроциркуляции;
4) нарушение кровообращения - чаще всего возникает в результате сдавления
костными структурами передних или задних артерий спинного мозга.
По так называемому типу ПСМТ выделяют (Коновалов А.Н. с соавт., 1994).:
- сочетанную (сопровождающуюся повреждением внутренних органов, переломом
костей);
- комбинированную (сочетающуюся с термическим, химическим, радиационным
поражением организма).
По уровню травмы спинного мозга различают:
- повреждение шейного отдела;
- грудного отдела;
- пояснично-крестцового отдела и корешков конского хвоста спинного мозга.
В зависимости от целостности кожных покровов на уровне травмы все ПСМТ делят
на закрытые и открытые (Бабиченко Е.И., 1994; Белова А.Н., 2000).
При закрытых ПСМТ степень тяжести повреждения позвоночника и спинного мозга
могут не соответствовать друг другу. Может быть изолированное повреждение
спинного мозга с тяжелым неврологическим дефектом, но без нарушения целостности
костных структур и связочного аппараты. В свою очередь, травма позвоночника
может сопровождаться, либо не сопровождаться повреждением спинного мозга и его
корешков (Белова А.Н., 2000).
Повреждение позвоночника на уровне шейного, верхне-грудного, средне-грудного
отделов практически всегда сопровождается повреждением спинного мозга. Травма на
грудо-поясничном, поясничном уровнях сочетается с повреждением спинного мозга
реже - в 30-70% случаев (Амелина О.А., 1998).
Среди закрытых повреждений позвоночника выделяют следующие (Бабиченко Е.И.,
1994):
1) повреждение связочного аппарата, дисков (растяжение, разрыв);
2) перелом тел позвонков (линейный, компрессионный, оскольчатый,
компрессионно-оскольчатый);
3) перелом заднего полукольца позвонков (дужек, суставных, поперечных или
остистых отростков);
4) переломо-вывихи и вывихи позвонков, сопровождающиеся их смещением и
деформацией позвоночного канала;
5) множественные повреждения позвоночника, сочетающиеся друг с другом.
Все закрытые повреждения позвоночника делятся на стабильные и нестабильные
(Соленый В.И., 1994). Стабильность обеспечивается целостностью дисков, костных и
связочных структур позвоночника. При нестабильной травме в результате нарушения
целостности опорных структур (передний и задний опорные комплексы) может
возникать смещение позвонков по отношению друг к другу, что в свою очередь может
приводить к сдавлению спинного мозга и его магистральных сосудов (Луцик А.А.,
1994; Белова А.Н., 2000).
Закрытые травмы спинного мозга подразделяют также на: а) сотрясение; б) ушиб;
в) сдавление.
При сотрясении спинного мозга возникают обратимые сегментарные и легкие
проводниковые нарушения, которые самостоятельно или после лечения полностью или
почти полностью регрессируют в течении 5-7 суток. Ушиб спинного мозга
характеризуется возникновением обратимых, либо необратимых изменений.
Морфологически при ушибе спинного мозга может возникать его перерыв -
анатомический, с расхождением концов, и аксональный, когда при внешней
анатомической сохранности спинного мозга происходит разрушение его проводящих
путей. Клинически ушиб спинного мозга проявляется синдромами полного или
частичного нарушения проводимости.
Некоторые авторы выделяют несколько степеней тяжести ушиба спинного мозга (Амелина
О.А., 1998):
1) ушиб спинного мозга легкой степени тяжести характеризуется синдромом
частичного нарушения проводимости; почти полное восстановление функций
происходит в течение месяца;
2) ушиб средней степени тяжести характеризуется синдромом частичного или
полного нарушения проводимости с неполным восстановлением функций в течение 2-3
месяцев;
3) ушиб тяжелой степени характеризуется сохранением синдрома полного
нарушения проводимости, либо незначительным восстановлением функций.
Сдавление спинного мозга костными отломками позвонков, фрагментами
дисков и связок, гематомами, отеком приводит к возникновению в веществе спинного
мозга очагов некроза. По локализации сдавление спинного мозга может быть: а)
заднее (сломанная дужка позвонка или разорванная желтая связка); б) переднее (сдавление
телом сломанного или вывихнутого позвонка, выпавшим межпозвонковым диском); в)
внутреннее (сдавление внутримозговой гематомой). Клинически сдавление спинного
мозга проявляется синдромами полного или частичного нарушения проводимости (Бабиченко
Е.И., 1994).
По степени повреждения спинного мозга, закрытые позвоночно-спинномозговые
травмы делят на:
- частичное повреждение спинного мозга;
- полное повреждение спинного мозга, или морфологический перерыв
(анатомический, аксональный).
Степень повреждения спинного мозга определяет в дальнейшем возможность
восстановления функций. При этом степень обратимости патологических изменений
определяют после прохождения явлений спинального шока, так как считается, что
при спинальном шоке утрачиваются возбуждающие супраспинальные влияния на
мотонейроны, тормозные интернейронные внутриспинальные системы начинают
доминировать над процессами возбуждения.
Выделяют следующие стадии спинального шока:
1) стадия арефлексии - клинически в начальной стадии спинального шока
возникает атония, арефлексия, отсутствие всех видов чувствительности ниже уровня
поражения, а в некоторых случаях и на 2-3 сегмента выше, нарушение функции
тазовых органов, трофические расстройства;
2) стадия гиперрефлексии – развивается гиперрефлексия и мышечный гипертонус
вследствие восстановления возбудимости мотонейронов.
Для спинального шока характерна обратимость нарушений в остром и раннем
периодах травмы, а сам спинальный шок поддерживается, если имеется сдавление
спинного мозга, нестабильность позвоночника, воспалительные осложнения со
стороны мочевыводящих путей, легких, нарушения гемодинамики (Белова А.Н., 2000).
Синдром частичного нарушения проводимости проявляется в виде пареза или
плегии мышц, тазовыми и чувствительными расстройствами, но при этом сохранены
движения и чувствительность ниже уровня поражения спинного мозга. При синдроме
полного нарушения проводимости чувствительность и движения ниже уровня поражения
спинного мозга отсутствуют. По мнению ряда иностранных авторов (Waters
R.L. et
al., 1993), наиболее точным признаком полного повреждения
спинного мозга является отсутствие чувствительных и двигательных функций в
сакральных сегментах; в других случаях нарушение проводимости является
частичным.
Американская Ассоциация Спинальной Травмы (1992) разработала шкалу
повреждения спинного мозга, обозначаемую рангами (Белова А.Н., 2000;
Yankoni G., Chen
D., 1996):
ранг «А» (полное нарушение проводимости) - отсутствие чувствительных и
двигательных функций в сегментах S4-S5;
ранг «B» (неполное нарушение) - наличие
чувствительности ниже уровня поражения при отсутствии движений;
ранг «C» (неполное нарушение проводимости) - наличие
ниже уровня поражения движений при силе ключевых мышц менее 3-х баллов;
ранг «D» (неполное нарушение проводимости) - наличие
ниже уровня поражения движений при силе ключевых мышц 3 балла и более;
ранг «E» (норма) - полная сохранность двигательных и
чувствительных функций.
Уровень травмы спинного мозга определяет клинические проявления, возможность
восстановления функций, способность пациента к самообслуживанию. Повреждение
спинного мозга происходит не только в месте травмы, но может и распространятся в
результате нарушения кровообращения, лимфообращения, развития миелита. Обычно
выделяют неврологический уровень поражения – наиболее каудальный сегмент
спинного мозга, который обеспечивает нормальную двигательную и чувствительную
иннервацию обеих сторон тела.
Открытые (огнестрельные и неогнестрельные) спинномозговые травмы в
зависимости от целостности твердой мозговой оболочки делят на проникающие и
непроникающие. Проникающие сопровождаются высоким риском развития
инфекционно-воспалительных осложнений со стороны центральной нервной системы.
Проникающие ранения диагностируют по наличию ликвореи или же во время
хирургического вмешательства (Бабиченко Е.И., 1994).
Все открытые ПСМТ могут приводить к повреждению спинного мозга различной
степени тяжести и клинически проявляются синдромом полного или частичного
нарушения проводимости. Как уже указывалось, травмы позвоночника на шейном,
верхне- и средне-грудном уровнях практически всегда сопровождаются повреждением
спинного мозга, а травмы на грудо-поясничном, поясничном уровнях сопровождаются
повреждением спинного мозга в 30-70% случаев (Амелина О.А., 1998; Белова А.Н.,
2000).
Повреждение спинного мозга на уровне шейных позвонков в 30-75% приводит к
летальному исходу (Луцик А.А., 1994) и характеризуется тяжелыми видами
повреждения - ушиб, сдавление, гематомиелия.
При разрушении спинного мозга на шейном уровне развивается следующая
клиническая картина:
- спастическая тетраплегия за счет двустороннего поражения нисходящих
моторных трактов; двусторонний периферический паралич мышц соответствующего
миотома за счет поражения периферических мотонейронов передних рогов; вялый
паралич грудино-ключично-сосцевидных мышц, верхних отделов трапециевидных мышц
вследствие повреждения спинальной части ядра n.
Accesorius; двусторонний периферический паралич диафрагмы
с развитием острой дыхательной недостаточности за счет повреждения
периферических мотонейронов передних рогов спинного мозга на уровне С3-С4,
аксоны которых формируют диафрагмальный нерв;
- утрата всех видов чувствительности по проводниковому типу;
- тазовые нарушения по центральному типу, которые проявляются острой
задержкой мочи, кала, либо их периодическим недержанием; это происходит за счет
утраты влияния центральных нейронов прецентральной извилины, располженных на
медиальной поверхности лобной доли, в парацентральной дольке, а периферическая
соматическая регуляция органов малого таза происходит на уровне
S2-S5 спинного мозга, где в передних рогах серого
вещества располагаются мотонейроны, иннервирующие поперечно-полосатую
мускулатуру органов малого таза;
- вегетативные нарушения сосудисто-трофического характера.
Повреждение грудного отдела спинного мозга характеризуется развитием
следующих клинических проявлений:
- формированием спастического паралича нижних конечностей (поражаются аксоны
центральных мотонейронов кортикоспинального тракта), периферических параличей
соответствующих миотомов за счет поражения передних рогов спинного мозга, в
результате чего развивается дыхательная недостаточность (Th2,
Th10-12), расстройства сердечной деятельности (Th3-5);
- двусторонней утратой всех видов чувствительности по проводниковому типу
ниже уровня поражения и по сегментарному в соответствующих дерматомах;
- расстройствами функций тазовых органов по центральному типу;
- грубыми сосудисто-дистрофическими нарушениями в соответствующем сегменте и
ниже.
Повреждение поясничного отдела спинного мозга также имеет свою, определенную
клинику:
- периферический (вялый) паралич нижних конечностей в результате поражения
передних рогов L1-S2, из которых
происходит периферическая иннервация нижних конечностей;
- тазовые нарушения по центральному типу;
- вегетативные сосудисто-трофические нарушения в зоне соответствующих
сегментов спинного мозга и ниже.
Повреждение конуса спинного мозга проявляется:
- нарушением функций тазовых органов по периферическому типу в виде истинного
недержания мочи, кала;
- анестезией по сегментарному типу в аногенитальной зоне;
- сосудисто-трофическими нарушениями в крестцовой области.
8.2. Периоды и некоторые вопросы патогенеза спинальной травмы
В развитии ПСМТ выделяют несколько периодов, которые отражают динамику
процессов, происходящих в спинном мозге в результате травмы (Раздольский И.Я.,
1963; Кривицкая Г.Н., 1994; Белова А.Н., 2000)
Острый период - первые 2-3 суток; происходят некротические изменения в
веществе спинного мозга в результате непосредственного повреждения, отека
спинного мозга, нарушения крово- и лимфообращения. Клинически наблюдается
картина спинального шока, синдрома полного нарушения проводимости.
Ранний период - 2-3 недели; происходит очищение очагов первичного
травматического некроза, развиваются дегенеративные изменения в нервных
волокнах, появляются первые признаки репаративных процессов. Клинически -
синдром полного или частичного нарушения проводимости.
Промежуточный период - 3-4 месяца; происходит формирование
соединительнотканного рубца, кист; исчезают явления спинального шока,
проявляется симптоматика истинного поражения спинного мозга.
Поздний период - с 3-4 месяцев и неопределенно долго; происходит частичное
восстановление утраченных функций за счет сохранившихся клеток и волокон,
автоматизации функционирования ряда отделов спинного мозга.
О.А. Амелина и А.Ю. Макаров (1995), в отличие от предыдущих авторов, в
развитии позвоночно-спинномозговой травмы выделяют только три периода:
- острый период- от нескольких дней до 3-4 месяцев (постепенно происходит
уменьшение отека и выявление истинного повреждения спинного мозга);
- промежуточный, или восстановительный период - длится 1-2 года (проявляется
репаративными процессами и различной степенью восстановления нарушенных
функций);
- поздний – длится неопределенно долгое время (наряду со стабилизацией
процесса при полном или частичном восстановлении функций возможно прогредиентное
течение травматической болезни спинного мозга).
Повреждение спинного мозга запускает ряд реакций, приводящих к вторичной
гибели неповрежденных нейронов и глии. Вторичные патологические изменения
включают петехиальные кровоизлияния - до геморрагического некроза, усиление
процессов свободнорадикального окисления липидов, увеличение протеазной
активности, воспалительный нейрофагоцитоз, тканевую ишемию, накопление
возбуждающих аминокислот, кининов, серотонина, высвобождение ионов кальция (Nashimi
R. et al.,
1997). В результате формируется восходящая и нисходящая дегенерация и
демиелинизация проводящих путей. Это, в свою очередь, приводит к образованию
более обширного очага повреждения, в том числе и с вовлечением структур
головного мозга, периферической и вегетативной нервной систем (Гретен А.Г.,
1982; Викторов И.В., 1984; Георгиева С.В. с соавт., 1993; Гайдар Б.В. с соавт.,
1996; Борщенко И.А. с соавт., 2000; Rawe
S.E. et al.,
1989).
В момент действия травматической силы происходит первичное повреждение
мозговой ткани, но одновременно запускаются механизмы вторичного повреждения с
развитием воспалительных и глиальных реакций, формированием некротических
очагов, которые впоследствии преобразуются в глиально-соединительнотканные
рубцы.
Хотя апоптоз представляет собой механизм отсроченного, вторичного повреждения
клеток, обозначающего физиологическую гибель клеток, в норме необходимую для
обновления и дифференцировки тканей (Lockshin
R.A., Zaken-Milovanovic
Z., 1984), но процессы, связанные с апоптозом,
наблюдаются уже через 6 часов после травмы. Происходит гибель нейронов вблизи
очага («пик» гибели - 4-8 часов), гибель микроглии, в меньшей степени
олигодендроглии («пик» гибели - через 3 суток). К концу второй недели после
травмы развивается апоптоз олигодендроцитов (Басанкьян А.Г. с соавт., 2000;
Cassam A.K.
et al., 1995; Yong
C. et al.,
1998).. Причины развития апоптоза при спинальной травме связаны с воздействием
на геном клетки целого ряда образований, в том числе нейромедиаторов (глутамат,
аспартат), медиаторов воспаления, избытка внеклеточного Ca2+,
ишемии. Апоптоз нейронов ведет к снижению числа активных клеток, гибель глии
нарушает процесс прорастания оставшихся волокон.
Важным компонентом травматического повреждения спинного мозга является
ишемия. Сдавление сосудов спинного мозга без их более грубого травматического
повреждения ведет к развитию ишемического некроза, воспаления и опять же
запускает апоптоз. Компрессия сосудов в течение 3-х часов вызывает полностью
необратимые изменения нейронов (Carlson G.D.,
1997).
Очень важным является то, что при повреждении спинного мозга в течение первых
15 минут повреждается серое вещество, в течение последующих 4-х часов - белое.
Достаточно медленное повреждение белого вещества определяет некоторое
терапевтическое «окно» для воздействия на патологический процесс (Басков А.В. с
соавт., 2000; Шевелев И.Н. с соавт., 2000; Baldwin
S.A. et
al, 1996; Shuman S.L.
et al., 1997; Yam
P.S. et
al., 1997).
8.3. Осложнения позвоночно-спинномозговой травмы
Нарушения деятельности органов и систем, не пострадавших непосредственно в
результате травмы, но развивающиеся вследствие данной травмы, создают новые
патологические проявления. В денервированных тканях повышается чувствительность
к ацетилхолину, адреналину, норадреналину и другим медиаторам, возрастает
рецепторная возбудимость, снижается порог мембранного потенциала, понижается
содержание АТФ, гликогена. В паретичных мышцах развивается нарушение липидного,
углеводного обмена, что приводит к нарушению их растяжимости, сократимости,
способствует нарастанию ригидности. Нарушение минерального обмена приводит к
формированию остеопороза, образованию параоссальных и периартикулярных
оссификатов, оссифицируюшего миозита (Окс С., 1969; Парфенов А.П., 1994; Адо
А.Д. с соавт., 2000). Все это может стать причиной развития осложнений, которые
подразделяют следующим образом (Бабиченко Е.И., 1994; Соленый В.И., 1994; Белова
А.Н., 2000; Романенков В.М., Самощенков А.Г., 2001; Yarkony
G., Chen D.,
1996):
- инфекционно-воспалительные (инфекции дыхательной, мочевыводящей систем,
гнойный эпидурит, менинго-миелит, абсцесс спинного мозга, остеомиелит);
- сосудисто-трофические нарушения (пролежни, трофические язвы; твердые отеки
нижних конечностей, тромбозы глубоких вен, тромбоэмболия легочной артерии,
нарушение вегетативной иннервации внутренних органов);
- ортопедические нарушения (кифозы, сколиозы, вывихи, дегенеративные
изменения суставов и связок);
- нарушения деятельности тазовых органов (расстройства мочеиспускания и
дефекации).
Говоря об осложнениях, нужно сказать о так называемой вегетативной
дизрефлексии. Вегетативная дизрефлексия проявляется развитием спазма
периферических сосудов и сосудов, кровоснабжающих внутренние органы, что
приводит к резкому подъему артериального давления (АД). Нескоррегированная
гипертензия может привести к развитию внутримозгового кровоизлияния, острой
сердечной недостаточности, потере сознания. Вегетативная дизрефлексия - это
мощная симпатическая реакция, возникающая в ответ на различные стимулы, чаще
болевые, у больных с уровнем поражения выше Th6, то есть
выше отхождения ветвей поясничной части симпатического ствола). Причиной данного
феномена является болевая или проприоцептивная импульсация. В норме болевые или
проприоцептивные импульсы следуют к коре головного мозга по задним столбам
спинного мозга и по спино-таламическому пути. Возможно, что при нарушении этих
путей импульсация циркулирует на уровне спинного мозга, вызывая возбуждение
симпатических нейронов, усиливая симпатическую активность; при этом нисходящие
супраспинальные ингибирующие сигналы не оказывают необходимого тормозного
влияния (Белова А.Н., 2000; Erickson R.,
1980; Lindan R. et
al., 1980).
8.4. Возможности восстановления нарушенных функций при травматических
повреждениях спинного мозга
Основными задачами реабилитации у больных с повреждениями спинного мозга
являются:
1) создание максимальных условий для регенеративных процессов в спинном
мозге;
2) предупреждение и лечение осложнений, вызванных травмой, в том числе: а)
инфекционно-воспалительных; б) трофических; в) нарушений функций тазовых
органов; г) деформаций опорно-двигательного аппарата;
3) обучение навыкам самообслуживания, передвижения;
4) профессиональное переобучение, трудоустройство.
Во многом успех проводимого лечения и реабилитации зависит от типа и
характера травмы, от уровня и степени повреждения спинного мозга, от
стабильности повреждения позвоночника, от периода течения ПСМТ, от того,
насколько быстро было начато лечение (Савченко А.Ю., 1994; Валеев К.Г., 1995).
В последние 15-20 лет достигнут определенный прогресс в понимании механизмов,
регулирующих репаративную активность центральной нервной системы. Имеющиеся
данные указывают на два подхода. Первый основан на создании условий,
благоприятствующих росту аксонов; второй связан с замещением разрушенных клеток
новыми, функционально полноценными (Викторов И.В., 1984; Зяблов В.И., 1986;
Карлсон Б.М., 1986; Лившиц А.В., 1990; Tetzlav
W., 1994; Tasynski
M.H., Gage
F.H., 1995).
В экспериментах на животных доказана возможность восстановления утраченных в
результате травмы функций спинного мозга. Аксоны центральной нервной системы у
низших млекопитающих способны регенерировать. У высших млекопитающих эта
способность подавляется генетически, но зато высшие млекопитающие имеют
избыточное количество аксонов, что позволяет компенсировать, восстанавливать
часть утраченных функций (Шевелев И.Н. с соавт., 2000; Windle
W.F., 1981). Восстановление
нервной ткани взрослого человека проявляется регенерацией периферических нервных
волокон, в нейронах же возможна лишь внутриклеточная регенерация. Человеческий
спинной мозг способен к восстановлению даже после повреждения до 90% его объема
(Kakulas B.A.,
1984; Feringa E.R.
et al., 1985;
Dunnet S.B.,
Bjoklund A., 1987;
Francel et al., 1993).
Под регенерацией аксонов понимают их рост в длину, установление синаптических
связей с мотонейронами поврежденного участка нервной ткани. При обычном течении
травматического процесса происходит образование новых отростков - спраутинг (Карлсон
Б.М., 1986; Котляр Б.И., 1986; Шеперд Г., 1987; Шевелев И.Н. с соавт., 2000;
Cajal S.R.,
1959; Kieman I.A.,
1979; Frank E., 1982;
Faden A., 1993;
Schwab M.E.,
Bartholdi D., 1996). Источником
названных отростков являются клетки собственных проводящих путей спинного мозга,
клетки чувствительных ганглиев (Викторов И.В., 1984; Шеперд Г., 1987). Эти
неповрежденные клетки дают отростки и образуют синапсы с клетками, которые до
травмы были связаны с поврежденными аксонами длинных трактов. Такие процессы
являются по существу компенсаторной перестройкой межклеточных связей. И при
благоприятных условиях (при отсутствии компрессии спинного мозга, свободном
ликворотоке, достаточном кровообращении) они способны обеспечить уменьшение
неврологического дефицита на 1-2 сегмента (Гретен А.Г., 1982; Георгиева С.В. с
соавт., 1993; Шевелев И.Н. с соавт., 2000; Bedbrook
G., 1980; Nicholls
J.C., 1982).
Среди причин, затрудняющих рост аксонов, теоретически выделяют: а) слабую
потенциальную способность аксонов к регенерации и б) тормозящие влияния на рост
аксонов клеточного окружения - астроцитов, олигодендроцитов, микроглии (Marx
J.L., 1980; Rawe
S.E. et
al., 1989; Berry M.
et al., 1996). Говоря о клеточном
окружении, нужно сказать о соединительнотканном рубце, возникающем в результате
воспалительных глиальных реакций. Грубые соединительнотканные волокна являются
механическим препятствием для прорастания аксонов (Tobin
G.R. et
al., 1980; Davies
S. et al., 1995), но в то
же время клеточные глиальные элементы, в частности астроциты, могут выделять ряд
факторов, стимулирующих регенерацию (Котляр Б.И., 1986; Шевелев И.Н. с соавт.,
2000; Reier P.J.
et al., 1988; Yao
D.L. et
al., 1995).
В ходе экспериментов доказано влияние микроглии на процессы регенерации; она
может выделять различные токсины, которые повреждают нейроны и аксоны.
M.E. Schwab
a. D. Bartholdi
(1996) применили антитела (моноклональные антитела IN-1)
к миелинсвязанным тормозным молекулам (NI 250). В
условиях эксперимента у крыс, получивших IN-1, часть
кортико-спинальных аксонов регенерировали на расстоянии 1 см с восстановлением
функций конечностей.
Наиболее успешными оказались методики имплантации к месту травмы отрезков
периферических нервов, оболочечных клеток обонятельных трактов, культур
шванновских клеток. В результате был отмечен рост аксонов на определенное
расстояние с восстановлением значительного числа функций спинного мозга (Willson
D.Z., Perry
G.W., 1990; Bunge
M.B., 1994; Li
Y., Raisman G.,
1994; Davies S. et
al., 1995; Li Y.
et al., 1997).
Успешной оказалась пересадка эмбриональной ткани, а также культивирование
нейрофибробластов (Reier P.J.
et al., 1988). Пересаженные
эмбриобласты обладают высоким потенциалом роста и в некоторых случаях приводят к
восстановлению утраченных функций. Растущие аксоны длинных трактов регенерируют
в эмбриональный трансплантат и формируют с ним связи, но они не прорастают
сквозь эмбриональные клетки в дистальный отрезок спинного мозга (Шевелев И.Н. с
соавт., 2000). При этом отмечается улучшение некоторых функций. Вероятнее всего,
это происходит за счет того, что эмбриональный трансплантат действует как
промежуточный коллектор: аксоны «хозяина» устанавливают связи с нейронами
трансплантата, а те, в свою очередь, на некотором расстоянии формируют новые
синапсы (Bregman B.S.,
1993).
Также определенную роль в действии трансплантата на мозг реципиента оказывает
выделение нейротрофических ростковых факторов. К пептидным нейротрофическим
факторам относят фактор роста нервов, основной фактор роста фибробластов,
цилиарный и глиальный нейротрофические факторы, нейротрофический фактор
головного мозга, инсулиноподобный фактор роста, нейротрпин-3 (Карлсон Б.М.,
1986; Котляр Б.И., 1986; Шеперд Г., 1987; Шевелев И.Н. с соавт., 2000; Петров
К.Б., Иванчин Д.М., 2005; Kreuz M.R.
et al., 1995;
Beagles K.E.
et al., 1998). Ростковые факторы
стимулируют регенерацию нейронов и пролиферацию глиальных клеток. Почти все
клетки спинного мозга имеют рецепторы к факторам роста. Первоначально травма
увеличивает число факторов роста, но затем происходит их истощение (Mofohashi
O. et al.,
1997). Это дает основание стимулировать аксональный рост путем медикаментозного
введения этих факторов (Mautes A.
et al., 1996). Активация процессов
регенерации в области травматического повреждения спинного мозга возможна при
пересадке в нее эмбриональной ткани, где имеется весь набор факторов роста.
Нужно отметить, что факторы роста могут быть причиной даже избыточного
спраутинга, который приводит к гиперрефлексии и спастичности (Шевелев И.Н. с
соавт., 2000).
Как уже говорилось, от спинномозгового нерва отходит ветвь к твердой мозговой
оболочке (возвратный нерв Люшка, r.
meningeus), в состав которого входят симпатические волокна. В позвоночный
канал возвратный нерв входит через межпозвоночное отверстие, где делится на две
ветви - более крупную - восходящую и более мелкую - нисходящую. В результате
соединения с такими же ветвями нижележащих спинномозговых нервов образуются
переднее и заднее сплетения твердой мозговой оболочки. Ганглии симпатической
нервной системы формируют паравертебральную цепочку. Их волокна в составе
спинномозговых нервов входят в боковые рога спинного мозга и в состав
возвратного нерва. Это объясняет возможность передачи нервного импульса в обход
пораженного сегмента. Мышцы получают двигательную и чувствительную иннервацию из
2-3 соседних сегментов. При проведении интенсивной реабилитации в первые дни
наблюдается потепление конечностей и тела ниже места повреждения спинного мозга,
появление пульсации крупных артерий, гипергидроз, красный стойкий дермографизм.
Эти проявления свидетельствуют о восстановлении функций вегетативной нервной
системы ниже места повреждения спинного мозга. С этого момента становится
возможным восстановление проводимости за счет компенсаторных механизмов в обход
пораженного участка спинного мозга (Качесов В.А., 2005).
По мнению В.А. Качесова (2005), приступать к восстановлению функций
поперечно-полосатой мускулатуры нельзя без присутствия признаков восстановления
деятельности вегетативной нервной системы, так как это может привести к усилению
дистрофических процессов.
Иннервация поперечно-полосатой мускулатуры, имеющей две и более точки
фиксации, осуществляется из различных сегментов спинного мозга. Повреждение
какого-либо сегмента может привести к развитию паралича. При спинальной травме,
после исчезновения клиники спинального шока восстанавливается спинальный
автоматизм, что свидетельствует о сохранении сухожильных рецепторов, рецепторов
реагирующих на изменение длины и напряжения мышц, мышечных веретен. Такой вид
рецепции может принимать участие в передаче импульса при поражении сегментов.
Рефлекторная дуга замыкается на уровне одного сегмента. Сухожильные рецепторы
будут возбуждаться при сокращении мышц, имеющих те же точки фиксации, но
получающих иннервацию из неповрежденных сегментов. При натяжении сухожилий
непарализованных мышц будут натягиваться сухожилия парализованной мускулатуры.
Импульсы будут поступать по чувствительным нервным волокнам в межпозвоночные
отверстия ниже места поражения через сплетения твердой мозговой оболочки;
импульсы при этом будут как бы «перескакивать» через пораженные сегменты
спинного мозга. Примером такой передачи является восстановление движений верхних
конечностей при травме шейного отдела позвоночника.
Р. Шмидт и Г. Тевс (1996), В.А. Качесов (2005) указывают на то, что передача
нервного импульса возможна посредством эфаптической передачи («короткого
замыкания») в демиелинизированных волокнах. Импульсы, проходящие по волокнам и
сегментам ниже места перерыва, индуцируют возбуждение мембран других волокон,
расположенных параллельно, к сегментам выше места перерыва. Указывается также на
то, что спинномозговая, цереброспинальная жидкость является электролитом и
проводником немодулированных электрических сигналов от сегментов ниже места
поражения спинного мозга к сегментам выше места поражения. Восстановление
нормальной циркуляции ликвора обеспечивает возможность проведения
немодулированной информации к дистальным отделам спинного мозга и от них - к
мышцам туловища и соответствующим нижним конечностям. Передача импульса от
центральных отделов нервной системы через ликвор в дистальные отделы спинного
мозга может даже вызвать сокращение крупных мышц, сгибание в коленном и
тазобедренном суставах.
Возможность восстановления функций зависит от характера и глубины процессов,
поддерживающих имеющийся дефект. К примеру, если нарушение проводимости связано
с травматическим отеком или нарушением кровообращения, то восстановление
происходит довольно быстро, как только спадает отечность и улучшается
микроциркуляция в пораженном участке. Если причиной торможения центральной
нервной системы являются постоянно действующие патологические раздражители
(рубец, киста, костный фрагмент и т.п.), то угнетение функции будет длится до
того момента, пока не будет удален патологический раздражитель.
Восстановительные реституционные механизмы реализуются в значительной степени
за счет восстановления проницаемости клеточных мембран, нормализации
окислительно-восстановительных процессов в клетке, активации ферментативных
систем. На этом этапе важную роль играют следующие воздействия
лечебно-восстановительного плана.
1. Медикаментозное лечение (десенсибилизирующие препараты, средства,
улучшающие микроциркуляцию, ноотропы, витамины, ангиопротекторы, глюкокортикоиды,
и др.), наиболее эффективное в первые часы и дни после травмы спинного мозга.
Имеются сведения о том, что введение метилпреднизолона в первые 8 часов
существенно подавляет апоптоз ( Басанкьян А.Г. с соавт., 2000; Петров К.Б.,
Иванчин Д.М., 2005 ).
2. Операции по стабилизации позвоночника и декомпрессии спинного мозга (Меломуд
Э.Е., 1994; Берснев В.П. с соавт., 1998; Полищук Н.Е. с соавт., 2001).
3. Активация морфологически сохранных структур методами кинезиотерапии,
лечебных физических факторов. При занятиях ЛФК возникают мощные афферентные и
эфферентные стимулы, способствующие растормаживанию нейронов в зоне
функциональной асинапсии и формированию новых путей передачи нервных импульсов (Карепов
Г.В., 1991, 1996; Царфис П.Г., Френкель И.Д., 1991; Каптелина А.Ф., 1995;
Потехин Л.Д., 2002).
На этапе регенерации, т.е. структурно-функционального восстановления органов
и тканей, в лечении больных большое значение имеют следующие методы воздействия.
1. Стимулирование процессов роста аксонов путем введения нейротрофических
факторов роста, изменения клеточного окружения, тормозящего рост аксонов,
использования антител, трансплантационных методик.
2. Использование лечебных физических факторов для стимуляции регенераторного
потенциала. Имеются данные о том, что некоторые физические факторы способны
влиять на рост и даже на направление роста аксонов. Так, проводимость улучшается
под действием электрофореза антихолинэстеразных средств, нейростимуляторов (прозерина,
галантамина, алоэ, тиамина бромида и др.). Постоянный ток также положительно
влияет на процесс регенерации нервных волокон, гальванизация позвоночника
вызывает ионное возбуждение, схожее с процессом распространения нервного
импульса; при этом повышается концентрация биологически активных веществ,
усиливается биосинтез (Боголюбов В.М., Пономаренко Г.Н., 1997).
3. Занятия ЛФК приводят к активации гормонов, ферментов, вызывают
возникновение афферентных и эфферентных нервных импульсов, что способствует
регенерации в зоне поражения (Мошков В.Н., 1995).
Завершает восстановительные механизмы компенсация - процесс, объединяющий
реакции по функциональному замещению или возмещению утраченных функций. Выделяют
три основных компонента, обеспечивающих компенсацию функций (Коган О.Г., Найдин
В.Л., 1988): а) сохранившиеся элементы поврежденной структуры; б) структуры,
близкие в функциональном отношении к поврежденным; в) дополнительные структуры и
механизмы.
На этапе компенсации медикаментозное лечение второстепенно; важное значение
приобретают ортопедическая и физическая реабилитация (физиотерапевтические
процедуры, методы кинезиотерапии, реконструктивные операции).
8.5. Клинико-электронейромиографические сопоставления у больных с
последствиями травмы спинного мозга на разных уровнях
В процессе планирования представленных исследований мы исходили из того, что
разные уровни повреждения спинного мозга должны отражаться не только на
особенностях клинической картины, но и на степени выраженности нейронального и
аксонального повреждений, вегетативных нарушений и т.д. Отсюда – разные
прогностические критерии и разные возможности восстановительного лечения
пострадавших. Особенно актуальным это становится на этапах отдаленных
последствий травм спинного мозга, когда, казалось бы, все возможности
восстановительного лечения уже исчерпаны, и актуальными остаются лишь социальные
составляющие процесса реабилитации.
Нами наблюдались 74 больных в возрасте от 18 до 75 лет с последствиями
тяжелого травматического повреждения спинного мозга на разных уровнях: шейный
уровень (С2 - С6) – 22 (29,7%) больных, грудной (Th3 -
Th11) – 33 (44,6%), поясничный (Th12
- S1) – 19 (25,7%). Давность получения травмы - от 3
месяцев до 27 лет. Свыше половины больных были травмированы при непосредственном
участии в боевых операциях современных вооруженных конфликтов. У 43 (58,1%)
пациентов ПСМТ была сочетанной, то есть сопровождавшейся повреждениями
внутренних органов, переломами костей. Клинический диагноз верифицировался с
помощью методов нейровизуализации и в необходимых случаях - в процессе
проведения хирургического вмешательства. Во всех случаях травматическое
повреждение спинного мозга представлялось тяжелым, с практически полным
перерывом вещества мозга, с классической клинической картиной, соответствующей
топике повреждения. Все больные, за исключением одного, были «колясочными».
ЭНМГ проводилась всем пациентам с помощью многофункционального компьютерного
комплекса «Нейро МВП» (г. Иваново) с использованием накожных электродов.
Определялись скорость распространения возбуждения (СРВ), амплитуда М-ответа.
Исследование соматосенсорных вызванных потенциалов (ССВП) проводилось с шейного
уровня, при стимуляции большеберцовых нервов. Оценивалась латентность пика
N30.
Вегетотестирование было проведено 46 пациентам, из них 12 (26,1%) – с
повреждением спинного мозга на шейном уровне, 23 (50%) - грудном, 11 (23,9%) -
поясничном. При отборе больных для проведения данного исследования предпочтение
отдавалось тем пациентам, у которых практически отсутствовала какая-либо
соматическая отягощенность, не связанная с бывшей ПСМТ. Вегетотестирование
проводилось с помощью аппарата «Вегетотестер» (г. Иваново). Анализировались
влияния вегетативной нервной системы (ВНС) на вариабельность сердечного ритма.
Оценивались: а) общая мощность спектра нейрогуморальной модуляции; б) тип
вегетативной модуляции сердечного ритма; в) реактивность парасимпатической
системы, г) активность симпатической нервной системы в процессе проведения
нагрузочной ортостатической пробы.
8.5.1. Сравнительные результаты исследования скорости распространения
возбуждения и М-ответа
Полученные результаты имели определенные различия в зависимости от уровня
повреждения спинного мозга и выглядели следующим образом.
При шейном уровне повреждения.
М-ответ и СРВ определялись у 21 (95,5%) пациента из 22. По правому
большеберцовому нерву СРВ в среднем равнялась 37,29±2,24 мс, по левому -
37,5±2,25 мс. М-ответ с правого большеберцового нерва - 5,4±0,32 мВт, с левого
- 4,76±0,28 мВт. По правому малоберцовому нерву СРВ в среднем 36.98±2,22 мс, по
левому - 35,83±2,15 мс. М-ответ с правого малоберцового нерва - 1,27±0,07 мВт,
с левого - 1,78±0,11 мВт.
При грудном уровне повреждения.
М-ответ и СРВ определялись у 25 (75,8%) пациентов из 33. По правому
большеберцовому нерву СРВ в среднем равнялась 43,26±2,25 мс, по левому -
45,04±2,34 мс. М-ответ с правого большеберцового нерва - 5,49±0,28 мВт, с
левого - 8,01±0,42 мВт. По правому малоберцовому нерву СРВ в среднем равнялась
43,29±2,25 мс, по левому - 46.31±2,41 мс. М-ответ с правого малоберцового
нерва - 1,46±0,07 мВт, с левого - 1,71±0,08 мВт.
При поясничном уровне повреждения.
По правому большеберцовому нерву СРВ определялась у 4 (21,1%) из 19 пациентов
и в среднем составила 35,97±10,10 мс. М-ответ определен у 6 (31,6%) из 19
больных. и в среднем составил 3,27±0,58 мВт. СРВ по левому большеберцовому нерву
определялась у 5 (26.3%) из 19 пациентов, в среднем составив 44,46±9,55 мс.
М-ответ определен у 8 (42,1%) больных, его среднее значение -1,97±0,26 мВт. СРВ
по правому малоберцовому нерву определялась у 4 (21,1%) из 19 пациентов и в
среднем составила 42,2±11,86 мс. М-ответ определен у 6 (31,6%) больных из 19, в
среднем его значение - 0,65±0,12 мВт. СРВ по левому малоберцовому нерву
определялась у 4 (21,1%) пациентов из 19, в среднем она составила 40,2±11,29
мс. М-ответ определен у 6 (31,6%) пациентов, его среднее значение - 0,65±0,12
мВт.
Сводные данные приведены на рис. 8.1 и 8.2. Прослеживаются отчетливые
различия полученных усредненных показателей в зависимости от уровня
травматического повреждения спинного мозга.
Наиболее высокой СРВ оказалась у пациентов с грудной локализацией повреждения
спинного мозга, причем в отдельных случаях, например, по отношению к СРВ по
левым большеберцовому и малоберцовому нервам при шейной локализации травмы
различия практически достигают уровня статистической достоверности (р<0,05).
Также наиболее значимым и статистически достоверным (р<0,05 - 0,01) в случаях
грудной локализации повреждения спинного мозга оказывается М-ответ. Особенно
заметны различия с аналогичными показателями, полученными при исследовании
больных с поясничным уровнем повреждения спинного мозга, например, при сравнении
М-ответа, полученного с левых большеберцового и малоберцового нервов (р<0,001).

Рис. 8.1. Средние значения СРВ по уровням травматического
повреждения спинного мозга.

Рис. 8.2. Средние значения М-ответа по уровням
травматического повреждения спинного мозга.
Приведем примеры.
Больной А., 1965 года рожд. Последний раз обследован и пролечен в стационаре
с 30.01.2006 по 13.03.2006 г. До этого проходил обследование и лечение ежегодно.
Диагноз: последствия закрытого компрессионного перелома C5-C6
позвонков с повреждением спинного мозга; верхний вялый - спастический парапарез,
нижняя спастическая параплегия; нейрогенный мочевой пузырь; хронический цистит;
хронический пиелонефрит ХПН-0; дискинезия толстой кишки по гипотоническому типу;
трофическая язва крестцово-копчиковой области.
В августе 1995 года, находясь в «горячей точке», в автодорожной аварии
получил компрессионный перелом C5-C6
позвонков. Движения в нижних конечностях исчезли сразу, наступила задержка мочи.
Движения в верхних конечностях были сохранены, но появилась нарастающая их
слабость, в течении 3 дней развилась плегия. Декомпрессивная ламинэктомия и
межтеловой спондилодез выполнены через неделю после травмы, но после операции
восстановления движений не произошло. В 1996 году произведена повторная операция
- резекция тела C7, ревизия спинного мозга, иссечение
спаек, межтеловой корпородез аутокостью. В послеоперационном периоде проводился
курс восстановительной терапии. Произошло восстановление движений в локтевых,
плечевых суставах, появился эквивалент позыва к мочеиспусканию. После нескольких
курсов восстановительного лечения научился обслуживать себя во время еды,
самостоятельно умываться, передвигаться в кресле-коляске. Восстановления
движений и чувствительности в нижних конечностях не произошло. Недержание мочи,
пользуется мочеприемником. Опорожнение кишечника - после очистительных клизм.
Ежегодное восстановительное лечение включает курсы сосудистой, метаболической
терапии, физиотерапевтические процедуры, массаж, ЛФК. После курсов лечения
отмечает улучшение общего самочувствия.
Неврологически: мышечная сила снижена в руках до 1-2 баллов, в ногах - 0
баллов, мышечный тонус повышен в кистях и в нижних конечностях по пирамидному
типу, чувствительность снижена с уровня C6 по
проводниковому типу, сухожильные рефлексы с двуглавой, трехглавой мышц вялые,
периостальные - высокие; с нижних конечностей сухожильные рефлексы высокие.
Неоднократно проводилось ЭНМГ обследование. Результаты и заключение
представлены в приведенном ниже протоколе.
Проба 1. Стимуляционная миография. СРВ моторная
1к: s, Abductor
hallucis, Ischiadicus, L4-S2

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
предплюсна |
2,27 |
5,4 |
3,21 |
7,77 |
50 |
58 |
| 2 |
головка малоберцовой кости |
11,9 |
8,75 |
0,0477 |
0,603 |
550 |
58 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
| 1-2 |
предплюсна - головка малоберцовой кости |
500 |
9,61 |
52 |
Примечание: Амплитуда измеряется от изолинии до негативного пика.
Проба 2. Стимуляционная миография. СРВ моторная
1к: s, Extensor
digitorum brevis, Peroneus,
l4 L5 S1

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Норма ампл., мВ |
Откл. ампл., % |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
предплюсна |
3,13 |
4,64 |
0,17 |
4 |
-95,8 |
0,338 |
50 |
96 |
| 2 |
головка малоберцовой кости |
15,3 |
3,13 |
0,182 |
4 |
-95,4 |
0,345 |
550 |
96 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
Норма скор., м/с |
Откл. скор., % |
| 1-2 |
предплюсна-головка малоберцовой кости |
500 |
12,2 |
41 |
50 |
(N) |
Проба 3. Стимуляционная миография. СРВ моторная
1к: d, Abductor hallucis, Ischiadicus, L4-S2

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
предплюсна |
2,48 |
5,83 |
1,11 |
2,61 |
50 |
100 |
| 2 |
головка малоберцовой кости |
14,7 |
5,62 |
1,31 |
3,47 |
550 |
100 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
| 1-2 |
предплюсна-головка малоберцовой кости |
500 |
12,2 |
41 |
Проба 4. Стимуляционная миография. СРВ моторная
1к: d, Extensor digitorum brevis, Peroneus, l4 L5 S1

Параметры М-ответа
| N |
Точка стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Норма ампл., мВ |
Откл. ампл., % |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
предплюсна |
3,56 |
4,75 |
0,0772 |
4 |
-98,1 |
0,153 |
50 |
100 |
| 2 |
головка малоберцовой кости |
15,1 |
4,43 |
2,64 |
4 |
-34 |
5,86 |
550 |
100 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
Норма скор., м/с |
Откл. скор., % |
| 1-2 |
предплюсна-головка малоберцовой кости |
500 |
11,6 |
43,3 |
50 |
(N) |
Проба 5. Стимуляционная миография. СРВ моторная
1к: d, Abductor pollicis brevis, Medianus, c6-t1

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Норма ампл., мВ |
Откл. ампл., % |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
запястье |
3,35 |
5,18 |
8,76 |
5,75 |
+52,4 |
25,2 |
50 |
50 |
| 2 |
локтевой сгиб |
9,07 |
2,7 |
0,276 |
5,75 |
-95,2 |
0,453 |
350 |
50 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
Норма скор., м/с |
Откл. скор., % |
| 1-2 |
запястье-локтевой сгиб |
300 |
5,72 |
52,4 |
60 |
(N) |
Проба 6. Стимуляционная миография. СРВ моторная
1к: d, Lumbricodeus, Ulnaris, c7 C8 T1

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
запястье |
2,48 |
13 |
0,276 |
2,31 |
50 |
68 |
| 2 |
локтевой сгиб |
10 |
10,2 |
0,115 |
0,515 |
350 |
100 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
| 1-2 |
запястье-локтевой сгиб |
300 |
7,56 |
39,7 |
Проба 7. Стимуляционная миография. СРВ моторная
1к: s, Abductor pollicis brevis, Medianus, c6-t1

Параметры М-ответа
| N |
Точки стимуляции |
Лат, м/с |
Длит., м/с |
Ампл., мВ |
Норма ампл., мВ |
Откл. ампл., % |
Площ., мВ*м/с |
Рас., мм |
Стим., мА |
| 1 |
запястье |
3,46 |
6,05 |
11,6 |
5,75 |
+102 |
40,7 |
50 |
50 |
| 2 |
локтевой сгиб |
10,7 |
6,91 |
0,00668 |
5,75 |
-99,9 |
0,107 |
350 |
28 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
Норма скор., м/с |
Откл. скор., % |
| 1-2 |
запястье-локтевой сгиб |
300 |
7,24 |
41,5 |
60 |
-30,9 |
Проба 8. Стимуляционная миография. СРВ моторная
1к: s, Lumbricodeus, Ulnaris, c7 C8 T1

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
запястье |
7,34 |
5,72 |
0,486 |
1,22 |
50 |
48 |
| 2 |
локтевой сгиб |
14,6 |
2,81 |
0,24 |
0,38 |
350 |
52 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
| 1-2 |
запястье-локтевой сгиб |
300 |
7,24 |
41,5 |
Заключение:
При исследовании мышц верхних и нижних конечностей методом поверхностной и
стимуляционной ЭМГ – сохранность проведения импульса по нервам нижних
конечностей составляла примерно 10% от нормы. В верхних конечностях проводимость
по срединному нерву с 2-х сторон – в пределах нормы, локтевого нерва – до 10% от
нормы.
Больной Г., 1978 г. рожд. Последний раз обследован и пролечен в стационаре с
20.02.2006 по 03.03. 2006 г. До этого обследовался и лечился в реабилитационном
отделении ежегодно.
Диагноз: последствия компрессионного перелома L2-L3
позвонков с повреждением конуса и корешков конского хвоста спинного мозга;
нижний вялый парапарез; нейрогенный мочевой пузырь; хронический цистит;
хронический пиелонефрит, ХПН-0; желчно-каменная болезнь,
постхолецистэктомический синдром; хронический панкреатит.
В 1997 году при падении с высоты получил компрессионный перелом
L2-L3 позвонков, тупую травму
живота. Движения в ногах исчезли сразу, появилось чувство сильного жжения в
нижних кончностях. Через 10 дней выполнена декомпрессивная ламинэктомия
L2-L3 позвонков, удаление костных
фрагментов, задний спондилодез стяжкой Ткаченко. В течение 6 месяцев после
операции восстановились движения в тазобедренных и коленных суставах. Частично
восстановилась чувствительность. Научился передвигаться на костылях. В 1998 году
- удаление стяжки, резекция суставных отростков L2-L3
позвонков, спондилодез аутокостью. Ежегодно проводимое стационарное лечение
включает курсы сосудистой, метаболической терапии, физиотерапевтические
процедуры, массаж, ЛФК. После лечения отмечает улучшение общего самочувствия.
Неврологически: мышечный тонус и сила в руках не изменены; в ногах мышечный
тонус снижен, сила в проксимальных отделах снижена до 3 баллов, в дистальных -
также до 3 баллов. Чувствительность снижена по проводниковому типу с уровня
L3. Сухожильные рефлексы с рук D=S;
с нижних конечностей не вызываются.
Протокол ЭНМГ исследования представлен ниже.
Проба 1. Стимуляционная миография. СРВ моторная
1к: d, Vastus
medialis, Femoralis, L2-L4

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
головка малоберцовой кости |
2,59 |
9,61 |
4,25 |
22,4 |
10 |
100 |
| 2 |
подколенная ямка |
5,72 |
8,96 |
4,16 |
25,1 |
230 |
100 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
| 1-2 |
головка малоберцовой кости – подколенная ямка |
220 |
3,13 |
70,2 |
Резидуальная латентность и ПДК
| Канал |
Рез. лат., м/с |
| 1 |
2,45 |
Примечание: Амплитуда измеряется от изолинии до негативного пика.
Проба 2. Стимуляционная миография. СРВ моторная
1к: s, Vastus
medialis, Femoralis, L2-L4

Параметры М-ответа
| N |
Точки стимуляции |
Лат., м/с |
Длит., м/с |
Ампл., мВ |
Площ., мВ*м/с |
Расст., мм |
Стим., мА |
| 1 |
головка малоберцовой кости |
2,38 |
3,24 |
2,47 |
2,65 |
50 |
100 |
| 2 |
подколенная ямка |
5,29 |
2,38 |
2,53 |
2,92 |
260 |
100 |
СРВ моторная по сегментам
| N-N |
Точки стимуляции |
Расст., мм |
Время, м/с |
Скор., м/с |
| 1-2 |
головка малоберцовой кости - подколенная ямка |
210 |
2,92 |
72 |
Резидуальная латентность и ПДК
| Канал |
Рез. лат., м/с |
| 1 |
1,68 |
Заключение:
При исследовании мышц верхних и нижних конечностей методом поверхностной и
стимуляционной ЭМГ – сохранность проведения по бедренным нервам – 80% от нормы,
проводимость же по седалищному нерву не определялась.
В приведенных клинических примерах налицо различия в характере и степени
выраженности ЭНМГ изменений, как СРВ, так и М-ответа, в зависимости от уровня
травматического повреждения спинного мозга, а также от степени восстановления
нарушенных функций в результате лечения.
Таким образом, показатели, полученные у пациентов с повреждением спинного
мозга на грудном уровне, отчетливо и достоверно, хотя и не всегда, выделяются из
всего массива результатов исследований. Это можно в определенной степени
объяснить с точки зрения локализации поражения и относительной сохранности
функции проводимости спинного мозга, а также бедренного нерва, например, при
грудном уровне повреждения. При повреждении же на уровне шейного отдела спинного
мозга подобного рода компенсации не происходит, возможно, за счет более
распространенного поражения спинальных трактов, а также выраженных диффузных
вегетативно-трофических расстройств. При поясничном же уровне повреждения
бедренный и седалищный нервы оказываются изолированными от центра, в связи с чем
грубо нарушены движения и трофика тканей нижних конечностей на всем протяжении.
Кроме того, относительное число больных, которым оказалось возможным
определить значения СРВ и М-ответа отчетливо различались в соответствии с
уровнем травматического повреждения спинного мозга (рис. 8.3). Показатели были
почти стопроцентными у пациентов с локализацией повреждения на шейном уровне, и
снижались более, чем в два раза (р<0,01), при исследовании больных с поясничной
локализацией травматического поражения.
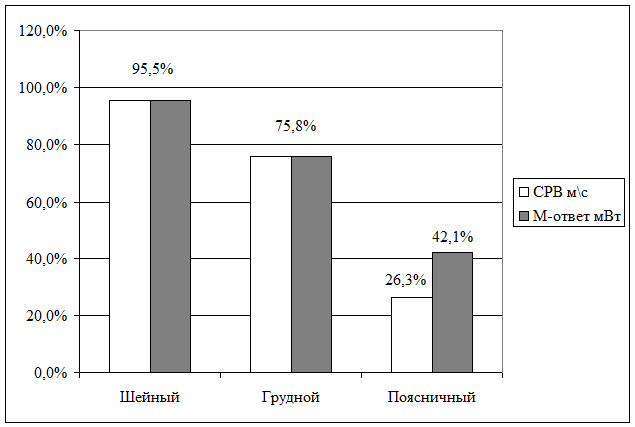
Рис. 8.3. Максимальное относительное число больных с
определяемыми показателями СРВ и М-ответа по уровням травматического повреждения
спинного мозга
Данные расхождения также можно объяснить анатомо-физиологическими
особенностями различных отделов спинного мозга. При более высоком уровне
повреждения сохранность передачи импульса по периферическим нервам активней,
нежели при повреждении ниже расположенных структур.
8.5.2. Сравнительные результаты исследования соматосенсорных вызванных
потенциалов
При локализации травматического повреждения спинного мозга в его шейном
отделе исследование проведено у 8 пациентов, в грудном - у 12, в поясничном - у
13.
Латентность пика N30 при стимуляции правого и левого
большеберцовых нервов определялась у разного относительного числа обследованных
больных по отношению к различным вариантам локализации травматического
повреждения, что наглядно представлено на рис. 8.4 и 8.5.
Средняя величина латентности пика N30 при стимуляции
правого большеберцового нерва составила у больных с повреждением спинного мозга
на шейном его уровне 35,3±4,69 мсек., на грудном - 35,1±3,23 мсек., на
поясничном - 35,6±3,1 мсек. Средняя величина латентности пика N30
при стимуляции правого большеберцового нерва у больных с повреждением спинного
мозга на шейном его уровне 34,8±4,63 мсек., на грудном - 35,2±3,24 мсек., на
поясничном - 37,2±3,24 мсек. Графически результаты представлены на рис. 8.6.

Рис. 8.4. Число больных с различными вариантами латентности
пика N30, полученными при стимуляции правого
большеберцового нерва
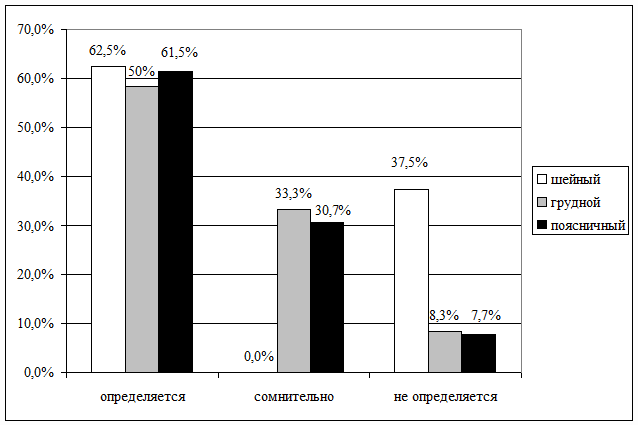
Рис. 8.5. Число больных с различными вариантами латентности
пика N30, полученными при стимуляции левого
большеберцового нерва

Рис. 8.6. Средняя величина латентности пика
N30 при стимуляции правого и левого большеберцовых нервов (сравнительные
данные).
Вероятнее всего, полученные результаты являются косвенным подтверждением
того, что передача нервного импульса осуществляется, кроме основных проводящих
путей, также за счет экстрамедуллярных связей (переднее и заднее сплетения
мозговой оболочки, волокна паравертебральных симпатических ганглиев, ликвор).
При условном сложении возможностей определения соматосенсорных вызванных
потенциалов и средних величин латентности пика N30 в
менее «выгодных» условиях оказываются пациенты с поясничной локализацией
повреждения спинного мозга, при которой дистанция разрыва между стволовыми
структурами и наносимым сенсорным стимулом оказывается наибольшей. В наиболее
«выгодных» условиях предстают больные с грудным уровнем повреждения. В целом
можно предположить, что повреждение спинного мозга на поясничном уровне наиболее
значительно уменьшает возможность коллатерального, экстрамедуллярного проведения
наносимого стимула.
8.6. Особенности нейрогуморальной регуляции у больных с последствиями
травматического повреждения спинного мозга на разных уровнях
По мнению Г.Н. Крыжановского (1980), универсальной патогенетической основой
различных нейропатологических синдромов является патологическая система, которая
возникает на базе физиологической системы, но отличается тем, что результат ее
деятельности имеет не адаптивное, а дезадаптивное и даже патогенное значение. В
этом плане травматическое повреждение спинного мозга, вероятно, не является
исключением, так как с точки зрения детерминантности запускает целый каскад
патологических реакций, в том числе и на уровне сердечно-сосудистой системы
(Говоров Б.М., 1994). Эти вторичные по отношению к спинальной травме
патологические реакции сердечно-сосудистой системы при их участии в процессах
реабилитации могут оказывать неоднозначные влияния. С одной стороны, являясь
адаптивными, они могут стимулировать процессы восстановления нарушенных функций,
с другой, вызывать неадекватные применяемым физическим нагрузкам патологические
сдвиги в системе кровообращения, что является далеко не безопасным в витальном
плане.
При прочих равных условиях можно считать, что любому заданному уровню
функционирования целостного организма соответствует эквивалентный уровень
функционирования аппарата кровообращения. Подобную зависимость можно объяснить с
позиций трехуровневой модели управления в организме, предложенной С.Н. Брайнесом
и соавт. (1974). В системах управления выделяют три звена - управляющее,
согласующее и управляемое. Согласующее звено решает задачу поиска оптимального
режима внутренней среды в соответствии с критерием, заданным управляющим звеном.
Результатом деятельности согласующего звена являются требуемые значения
физиологических параметров, которые служат исходными, заданными для работ систем
гомеостаза. К управляющему звену следует отнести центральную нервную и
вегетативную нервную системы, гуморально-гормональные подсистемы.
Гуморально-гормональный механизм регуляции, конечным результатом которого
является активация гипофиз-надпочечниковой системы, является стратегическим, так
как гормоны коры надпочечников влияют на метаболические процессы во всех тканях,
повышая резистентность и защитные силы целостного организма. Текущая оперативная
регуляция функций осуществляется через вегетативную нервную систему. Все
висцеральные системы, включая и систему кровообращения, составляют согласующее
звено Особенно велика роль системы кровообращения, которая благодаря тонким и
чувствительным аппаратам саморегуляции активно участвует во всех проявлениях
жизнедеятельности. Система кровообращения с ее нейрогуморальным аппаратом
управления и саморегуляцией реагирует на малейшие изменения потребности
отдельных органов и систем и обеспечивает согласование кровотока в них с
гемодинамическими параметрами на организменном уровне. Все это дает основание
рассматривать систему кровообращения в качестве универсального индикатора
адаптационной деятельности целостного организма. Последнее обстоятельство может
играть немаловажную роль именно в процессе жизнедеятельности лиц с глубоко
нарушенными в результате спинальной травмы функциями. И при работе с такого рода
больными, в процессе их восстановительного лечения врач просто обязан, на наш
взгляд, знать и прогнозировать те возможные сдвиги нейрогуморальной регуляции,
которые могут оказать как позитивное, так и негативное влияние в процессе
реабилитации.
Общепринятым является рассмотрение вегетативной регуляции различных функций
организма с точки зрения так называемого вегетативного равновесия двух отделов -
симпатической и парасимпатической систем. Такое разделение на нижних этажах
нервной регуляции становится затруднительным по мере восхождения к корковым
отделам центральной нервной системы и подкорковым образованиям. В связи с этим
были предложены более интегральные понятия указанных процессов - эрготропные и
трофотропные функции организма. Эрготропные функции в организме определяются
уровнем катехоламинов и их предшественников. Содержание адреналина в крови и
моче отражает состояние гормонального звена симпатоадреналовой системы, а
содержание норадреналина и дофамина - медиаторного. К эрготропным системам
некоторые относят также систему гипотоламус-гипофиз-кора надпочечников.
Трофотропные функции организма определяются, в первую очередь, системой
ацетилхолина. Работами Г.Н. Кассиля с соавт. (1976) установлено, что у человека
соотношение компонентов, формирующих систему ацетилхолина, различно в
артериальной и венозной крови, легочной артерии и локтевой вене, а также в
крови, оттекающей от печени, правого и левого полушарий конечного мозга.
Трофотропные функции организма определяются также системами гистамина и
серотонина. В зависимости от исходного состояния организма и соотношения эрго- и
трофотропных функций отмечаются различные колебания биологической активности
крови (Кассиль Г.Н. с соавт., 1976; Вейн А.М., 2000). Между эрго- и
трофотропными системами возникают реципрокные взаимоотношения, то есть
нарастание эрготропной активности вызывает повышенное образование трофотропных
метаболитов и наоборот.
В данном издании представлены результаты исследования основных составляющих
спектра нейрогуморальной регуляции, а именно - общей мощности спектра, состояния
вегетативного баланса, вегетативного обеспечения. Полученные данные, на наш
взгляд, могут в достаточной степени свидетельствовать о тех возможных сдвигах
нейрогуморальной регуляции, которые следовало бы учитывать при назначении
больному тех или иных реабилитационных нагрузок, и быть полезными в
прогнозировании эффективности восстановительного лечения.
8.6.1. Общая мощность спектра нейрогуморальной регуляции
Общая мощность спектра нейрогуморальной регуляции выходила за пределы
условной нормы у большинства пациентов: с поражением шейного отдела спинного
мозга - у 11 (91,6%) из 12, грудного - у 14 (60,8%) из 23, поясничного - у 6
(54,5%) из 11 ( таблица 8.1, рис. 8.7). При этом вариант нормы достоверно (р<0,001)
реже встречался у пациентов с поражением шейного отдела спинного мозга. Это
свидетельствует о более выраженном напряжении нейрогуморальных механизмов
регуляции у пациентов с шейным уровнем повреждения, фактически полностью
обездвиженных. Для поддержания хотя бы минимальной жизненной активности этим
больным требуется наибольший расход энергии.
Таблица 8.1. Общая мощность спектра нейрогуморальной
регуляции


Рис. 8.7. Общая мощность спектра нейрогуморальной регуляции
в зависимости от уровня поражения спинного мозга. Наглядно представлены
достоверные различия.
8.6.2. Состояние вегетативного баланса
При локализации травматического повреждения в шейном и грудном отделах
спинного мозга в вегетативной модуляции сердечного ритма преобладает
сбалансированный тип - соответственно у 8 (66,6%) и у 17 (73,9%) больных. Менее
сбалансированной (р<0,05) оказалась вегетативная модуляция у пациентов с
травматическим повреждением спинного мозга на поясничном уровне. (таблица 8.2,
рис. 8.8). Здесь же преобладают пациенты с относительной симпатикотонией. Это в
значительной степени объясняется локализацией повреждения, при которой
оказываются разобщенными два основных парасимпатических центра, а сакральный
зачастую оказывается полностью «выключенным» из всей системы регуляции.
Таблица 8.2. Вегетативная модуляция сердечного ритма

Примечание: ПсНС – парасимптическая нервная система: СНС - симпатическая
нервная система; знаком «>» обозначается преобладание либо симпатических, либо
парасимпатических влияний.

Рис. 8.8. Состояние вегетативного баланса в зависимости от
уровня повреждения спинного мозга. Наглядно представлены достоверные различия.
8.6.3. Изменения вегетативного обеспечения
При оценке результатов ортостатической пробы реактивность парасимпатической
системы в пределах нормы определялась у 6 (13%) пациентов из 46. Из них 2
пациента - с поражением шейного уровня, 1 пациент - грудного, и 3 - поясничного.
При повреждении спинного мозга на грудном уровне у 2 (8,7%) пациентов
зарегистрирована парадоксальная реакция. Снижение реактивности парасимпатической
системы наблюдалось у 5 (41,6%) пациентов из 12 с шейной локализацией
повреждения, с грудной локализацией - у 14 (60,9%) из 23, с поясничной - у 6
(54,5%) из 11. Высокая реактивность парасимпатической системы наблюдалась у 5
(41,6%) пациентов из 12 с шейной локализацией повреждения, с грудной
локализацией - у 6 (26,1%) из 23, с поясничной - у 3 (27,3%) из 11 (таблица 8.3;
рис. 8.9)
Таблица 8.3. Реактивность парасимпатической нервной системы


Рис. 8.9. Относительное число больных с разными вариантами
реактивности парасимпатической нервной системы в ответ на ортостатическую
нагрузку.
Вегетативное обеспечение ортостатической пробы характеризовалось адекватной
активацией симпатической нервной системы у 6 (13,04%) из 46 пациентов. У
остальных активация симпатической нервной системы была снижена независимо от
уровня поражения спинного мозга (рис. 8.10); р<0,001. Это может быть объяснимо с
точки зрения постоянного, хронического напряжения симпато-адреналовой системы в
состоянии покоя и, соответственно, быстрого истощения симпатического звена при
нагрузке.

Рис. 8.10. Относительное число больных с разными вариантами
активации симпатической нервной системы под влиянием ортостатической нагрузки.
Налицо достоверное преобладание сниженной активации при любой локализации
травматического повреждения спинного мозга.
Таким образом, у всех пациентов с травматическим повреждением спинного мозга,
независимо от локализации поражения, отмечаются вегетативные нарушения,
вызванные травмой. В то же время имеются различия в характере и степени
выраженности патологических сдвигов в зависимости от локализации поражения, что
представлено наглядно в приводимых ниже примерах.
Больная К., 1977 г. рожд. Диагноз: последствия закрытого компрессионного
перелома Th3-Th4 позвонков,
синдром полного поперечного повреждения спинного мозга; нижняя спастическая
параплегия; нейрогенный мочевой пузырь; трофическая язва левой ягодичной
области; хронический остеомиелит левого седалищного бугра; дискинезия толстой
кишки по гипотоническому типу; хронический цистит; хронический пиелонефрит,
ХПН-0; контрактуры коленных, голеностопных суставов.
Исследование проводилось в положении лежа. Продолжительность записи
сердечного ритма 5 мин. Зарегистрировано 365 комплексов QRS при средней частоте
сердечного ритма 73 уд./мин..


Структура спектра: VLF - 79,1%, LF - 14,3%, HF - 6,6%.
Ритмограмма вариабельности ритма сердца соответствует 5-му классу (по Д.
Жемайтите). Данный вариант ритмограммы и структура вариабельности сердечного
ритма указывают на стабилизацию регуляции сердечного ритма с переходом его
регуляции с рефлекторного вегетативного уровня руководства на более низкий -
гуморально-метаболический, который не способен быстро обеспечивать гомеостазис.
Функциональные возможности сердца снижены.
Общая мощность спектра нейрогуморальной модуляции резко снижена.
Состояние нейрогуморальной регуляции характеризуется низким уровнем вагальных,
симпатических и гуморально-метаболических (церебральных эрготропных) влияний в
модуляции сердечного ритма.
Баланс отделов вегетативной нервной системы характеризуется смешанным
(сбалансированным) типом вегетативной модуляции сердечного ритма.
Ортостатическая проба
Продолжительность записи сердечного ритма 6 мин.
Зарегистрировано 453 комплекса QRS. Средняя ЧСС: 76 уд./мин.

| Показатели временного анализа |
Показатели спектрального анализа |
| Параметр |
Значение |
Параметр |
Значение |
| R-R min,
мс |
205 |
TP,
мс^2 |
2298 |
| R-R max,
мс |
815 |
VLF,
мс^2 |
502 |
| RRNN,
мс |
793 |
LF,
мс^2 |
1104 |
| SDNN,
мс |
44 |
HF,
мс^2 |
693 |
| RMSSD,
мс |
31 |
LF norm,
n.u. |
61,4 |
| pNN50, % |
0,885 |
HF norm,
n.u. |
8,6 |
| CV, % |
5,52 |
LF/HF |
1,59 |
Кардиоинтервалография по Р.М. Баевскому
| Параметр |
Фоновая |
Ортостатическая |
| Длина записи, с |
300 |
360 |
| Число кардиоциклов |
364 |
452 |
| ЧСС, уд./мин. |
73 |
76 |
| М, с |
0,819 |
0,793 |
| СК, с^ 2 |
0,0113 |
0,0438 |
| Мо, с |
0,818 |
0,785 |
| АМо, % |
43,1 |
99,1 |
| Ме, с |
0,819 |
0,793 |
| ВР, с |
0,065 |
0,61 |
| ИВР, у.е. |
664 |
162 |
| ПАПР, у.е. |
52,7 |
126 |
| ВПР, у.е. |
18,8 |
2,09 |
| ИН, у.е. |
406 |
104 |
Структура спектра:
VLF - 21,8%, LF - 48%, HF - 30,1%.
Соотношение индексов напряженности (ИН2/ИН1) - 0,255.
Прирост ЧСС в ортостатической пробе - 4,31%.
Заключение по результатам ортостатической пробы:
реактивность парасимпатического отдела вегетативной нервной системы при
проведении ортостатической пробы снижена; вегетативное обеспечение
характеризуется сниженной активацией симпатического отдела вегетативной нервной
системы.
Больной Г.,
1978 г. рожд. Диагноз: последствия компрессионного перелома L2-L3
позвонков с повреждением конуса и корешков конского хвоста спинного мозга;
нижний вялый парапарез; нейрогенный мочевой пузырь; хронический цистит;
хронический пиелонефрит, ХПН-0.
Исследование проводилось в положении лежа. Продолжительность записи
сердечного ритма 5 мин.
Зарегистрировано 345 комплексов QRS. Средняя ЧСС - 69 уд./мин.

| Показатели временного анализа |
Показатели спектрального анализа |
| Параметр |
Значение |
Параметр |
Значение |
| R-R min,
мс |
770 |
TP,
мс^2 |
2027 |
| R-R max,
мс |
1550 |
VLF,
мс^2 |
472 |
| RRNN,
мс |
865 |
LF,
мс^2 |
659 |
| SDNN,
мс |
48 |
HF,
мс^2 |
896 |
| RMSSD,
мс |
59 |
LF norm,
n.u. |
42,4 |
| pNN50, % |
2,03 |
HF norm,
n.u. |
57,6 |
| CV, % |
5,5 |
LF/HF |
0,736 |
Структура спектра:
VLF - 23,3%, LF - 32,5%, HF - 44,2%.
Оценка спектрограммы и показателей спектрального анализа:
общая мощность спектра нейрогуморальной модуляции - в пределах условной нормы;
состояние нейро-гуморальной регуляции - развитая, при умеренном уровне вагальных,
симпатических и гуморально-метаболических (церебральных эрготропных) влияний в
модуляции сердечного ритма; баланс отделов вегетативной нервной системы
характеризуется смешанным (сбалансированным) типом вегетативной модуляции
сердечного ритма.
Ортостатическая проба
Продолжительность записи
сердечного ритма 6 мин.; зарегистрировано 442 комплекса QRS; средняя ЧСС - 74
уд./мин.

| Показатели временного анализа |
Показатели спектрального анализа |
| Параметр |
Значение |
Параметр |
Значение |
| R-R min,
мс |
200 |
TP,
мс^2 |
18441 |
| R-R max,
мс |
1755 |
VLF,
мс^2 |
8393 |
| RRNN,
мс |
813 |
LF,
мс^2 |
6918 |
| SDNN,
мс |
129 |
HF,
мс^2 |
3129 |
| RMSSD,
мс |
95 |
LF norm,
n.u. |
68,9 |
| pNN50, % |
12,2 |
HF norm,
n.u. |
31,1 |
| CV, % |
15,9 |
LF/HF |
2,21 |
Кардиоинтервалография по Р.М. Баевскому
| Параметр |
Фоновая |
Ортостатическая |
| Длина записи, с |
300 |
360 |
| Число кардиоциклов |
344 |
441 |
| ЧСС, уд./мин. |
69 |
77 |
| М, с |
0,865 |
0,813 |
| СК, с^ 2 |
0,0476 |
0,129 |
| Мо, с |
0,887 |
0,9 |
| АМо, % |
70,6 |
56,2 |
| Ме, с |
0,865 |
0,813 |
| ВР, с |
0,78 |
1,55 |
| ИВР, у.е. |
90,6 |
36,2 |
| ПАПР, у.е. |
79,6 |
62,5 |
| ВПР, у.е. |
1,45 |
0,715 |
| ИН, у.е. |
51,1 |
20,1 |
Структура спектра: VLF - 45,5%, LF - 37,5%, HF – 17%.
Соотношение индексов напряженности (ИН2/ИН1) -
0,394
Прирост
ЧСС в ортостатической пробе - 11,4%.
Заключение по результатам ортостатической пробы: реактивность
парасимпатического отдела вегетативной нервной системы при проведении
ортостатической пробы снижена; вегетативное обеспечение деятельности при
проведении ортостатической пробы характеризуется сниженной активацией
симпатического отдела вегетативной нервной системы.
Больная П.,
1971 г. рожд. Диагноз: последствия компрессионного перелома L1-L2
позвонков с полным повреждением спинного мозга; нижняя вялая параплегия;
нейрогенный мочевой пузырь; хронический цистит.
Исследование проводилось в положении лежа. Продолжительность записи
сердечного ритма 5 мин. Зарегистрировано 392 комплекса QRS. Средняя ЧСС - 79
уд./мин.

| Показатели временного анализа |
Показатели спектрального анализа |
| Параметр |
Значение |
Параметр |
Значение |
| R-R min,
мс |
240 |
TP,
мс^2 |
1723 |
| R-R max,
мс |
835 |
VLF,
мс^2 |
425 |
| RRNN,
мс |
763 |
LF,
мс^2 |
582 |
| SDNN,
мс |
38 |
HF,
мс^2 |
716 |
| RMSSD,
мс |
35 |
LF
norm, n.u. |
44,8 |
| pNN50, % |
1,02 |
HF
norm, n.u. |
55,2 |
| CV, % |
4,99 |
LF/HF |
0,813 |
Структура спектра:
VLF - 24,6%, LF - 33,8%, HF - 41,6%.
Оценка спектрограммы и показателей спектрального анализа:
общая мощность спектра нейрогуморальной модуляции - в пределах условной нормы;
состояние нейро-гуморальной регуляции - развитая, при умеренном уровне вагальных,
симпатических и гуморально-метаболических (церебральных эрготропных) влияний в
модуляции сердечного ритма; баланс отделов вегетативной нервной системы
характеризуется смешанным (сбалансированным) типом вегетативной модуляции
сердечного ритма.
Ортостатическая проба
Продолжительность записи сердечного ритма 6 мин.
Зарегистрировано 623 комплекса QRS. Средняя ЧСС - 104 уд./мин.

| Показатели временного анализа |
Показатели спектрального анализа |
| Параметр |
Значение |
Параметр |
Значение |
| R-R min,
мс |
205 |
TP,
мс^2 |
3157 |
| R-R max,
мс |
740 |
VLF,
мс^2 |
1534 |
| RRNN,
мс |
577 |
LF,
мс^2 |
478 |
| SDNN,
мс |
51 |
HF,
мс^2 |
1145 |
| RMSSD,
мс |
44 |
LF norm,
n.u. |
29,5 |
| pNN50, % |
4,02 |
HF norm,
n.u. |
70,5 |
| CV, % |
8,9 |
LF/HF |
0,418 |
Кардиоинтервалография по Р.М. Баевскому
| Параметр |
Фоновая |
Ортостатическая |
| Длина записи, с |
300 |
360 |
| Число кардиоциклов |
391 |
622 |
| ЧСС, уд./мин. |
79 |
106 |
| М, с |
0,763 |
0,577 |
| СК, с^ 2 |
0,0381 |
0,0513 |
| Мо, с |
0,746 |
0,606 |
| АМо, % |
67,3 |
61,6 |
| Ме, с |
0,761 |
0,577 |
| ВР, с |
0,595 |
0,535 |
| ИВР, у.е. |
113 |
115 |
| ПАПР, у.е. |
90,2 |
102 |
| ВПР, у.е. |
2,25 |
3,08 |
| ИН, у.е. |
75,8 |
94,9 |
Структура спектра:
VLF - 48,6%, LF - 15,2%, HF - 36,3%.
Соотношение индексов напряженности (ИН2/ИН1) - 1,25.
Прирост ЧСС в ортостатической пробе - 33,5%.
Заключение по результатам ортостатической пробы:
реактивность парасимпатического отдела вегетативной нервной системы при
проведении ортостатической пробы высокая; вегетативное обеспечение деятельности
при проведении ортостатической пробы характеризуется сниженной активацией
симпатического отдела вегетативной нервной системы.
Данные клинические примеры указывают на достаточно стереотипные изменения
вегетативного статуса у больных с последствиями повреждения спинного мозга. Это
заключается в хроническом перенапряжении симпато-адреналовой системы при ее
быстром истощении в процессе
выполнения даже самых минимальных нагрузок. Это может иметь значение при выборе
нагрузочных методик ЛФК и физиотерапевтических процедур.
Резюме
В результате проведенных исследований выяснилось, что от уровня
травматического повреждения позвоночника и спинного мозга прямо зависит
не только вариант клинической картины, но и возможность определения значений СРВ
и М-ответа, и указанная возможность снижается боле, чем в два раза, по мере
снижения уровня спинального поражения - от шейного к поясничному. С другой
стороны, среди больных с определяемыми значениями СРВ и М-ответа наиболее
высокой СРВ оказалась при грудной локализацией повреждения спинного мозга,
наиболее низкой - при шейной. Наиболее высокие показатели М-ответа также
зарегистрированы у больных с повреждением спинного мозга на грудном уровне,
наиболее низкие - при поясничной локализации травмы. Подобные различия можно
объяснить с точки зрения относительной сохранности функций проводимости как
спинного мозга, так и периферических нервов нижних конечностей при грудном
уровне повреждения. При повреждении шейного отдела спинного мозга указанной
компенсации не происходит, вероятно, за счет более распространенного поражения
спинальных трактов, а также выраженных диффузных вегетативно-трофических
расстройств. При поясничном уровне повреждения спинного мозга крупные
периферические нервы практически полностью изолируются от центра, в связи с чем
возникают грубые двигательные и трофические расстройства нижележащих отделов, в
основном нижних конечностей. Результаты исследования ССВП, с одной стороны,
подтверждают это, с другой, свидетельствуют о том, что передача нервного
импульса осуществляется, кроме основных проводящих путей, также за счет
сформировавшихся экстрамедуллярных, коллатеральных связей. Опять же в худших
условиях оказываются пациенты с поясничной локализацией травмы, при которой
дистанция разрыва между стволовыми структурами и наносимым при исследовании
раздражением наибольшая, в лучших - больные с грудной локализацией повреждения.
Также у всех пациентов с
травматическим повреждением спинного мозга отмечаются вегетативные нарушения,
вызванные травмой. Общая мощность спектра нейрогуморальной регуляции выходит за
пределы нормы у большинства пациентов, но при этом нормальные показатели
достоверно реже отмечаются при поражении шейного отдела спинного мозга, что
согласуется с высочайшим напряжением нейрогуморальных механизмов регуляции
именно при данной локализации травмы, при которой пациенты почти полностью
обездвижены и для поддержания минимальной жизненной активности им требуется
белее высокий расход энергии. В то же время отчетливо менее сбалансированной с
преобладанием относительной симпатикотонии оказывается вегетативная модуляция
при повреждении спинного мозга на поясничном уровне, что может объясняться
фактической разобщенностью двух основных парасимпатических центров, когда
сакральный нередко оказывается полностью «выключенным» из всей системы
регуляции. Нормальные, адекватные показатели реактивности как парасимпатической,
так и симпатической нервной системы в ответ на функциональную нагрузку
определяются редко; повышенная реактивность парасимпатического звена оказывается
несколько более характерной для шейной и поясничной локализации повреждения
спинного мозга, а активация симпатической нервной системы снижается у
большинства больных независимо от уровня повреждения, что в целом объяснимо с
точки зрения хронического напряжения симпато-адреналовой системы в состоянии
покоя и, соответственно, быстрого истощения симпатического звена при даже
минимальной нагрузке. Последнее обстоятельство может иметь значение при выборе
методик ЛФК и физиотерапевтических процедур, используемых в восстановительной
терапии. В целом результаты описанных исследований могут иметь прогностическое
значение. |