Респираторная поддержка, связанная с транспортировкой новорожденных из одного
стационара в другой, является, с одной стороны, частью большого
раздела неонатальной интенсивной терапии – вентиляции и лечения синдрома
дыхательной недостаточности. С другой стороны, детальное изложение всех основных
моментов патофизиологии газообмена в легких, современных режимов
вспомогательной вентиляции, их влияния на состояние легочной ткани, особенностей
использования контроля давления, объема и потока, характеристик работы триггерных устройств и т.д., на взгляд авторов, не вполне уместно в монографии,
посвященной транспортной медицине.
Существует обширный выбор руководств и фундаментальных работ по вентиляции новорожденных, где и сведущий, и неискушенный читатель могут найти
детальное изложение существующих взглядов как отечественных, так и зарубежных
исследователей на суть респираторной терапии в неонатологии. Врач, занятый в
транспортной медицине новорожденных, как правило, не является молодым доктором,
только что окончившим интернатуру. Он имеет определенный опыт и знания по своей
специальности, и, как правило, является либо детским анестезиологом, либо
продвинутым неонатологом. Административное привлечение к транспортировке
новорожденных начинающих докторов, врачей смежных специальностей (участковых
педиатров, хирургов, акушеров-гинекологов), оказавшихся не в то время не в том
месте, к сожалению, практикуется на сегодняшнем постсоветском пространстве
довольно широко. В любом из представленных вариантов читателю потребуется не
пространное изложение тонкостей длительной вентиляции младенцев при различных
патологических состояниях, а сжатое руководство, которое позволит опытному
специалисту освежить в памяти главные вопросы подготовки ребенка и дальнейшего
проведения вентиляции во время транспортировки, а человеку, мало знакомому с
неонатологией вообще и интенсивной терапией новорожденных в частности, поможет
не заблудиться в описаниях различных режимов респираторной терапии, но даст
четкие и относительно простые рекомендации, которые, возможно, сохранят ребенку жизнь, а врачу – рабочее место.
Как известно, в неонатальной ургентной медицине, в отличие от больных более
старшего возраста, дыхательная недостаточность является одним из основных
синдромов, осложняющих большинство заболеваний, и поэтому составляет
одну из основных проблем неонатальной реанимации и интенсивной терапии.
Обусловлено это тем, что любая тяжелая патология приводит к нарушению
дыхательных и важнейших недыхательных функций легких.
В настоящее время дыхание рассматривается не только как легочное
дыхание и газообмен, а как совокупность физиологических процессов,
обеспечивающих поступление кислорода в легкие, доставку его к клеткам и
тканям, использование его в биохимических реакциях и эвакуацию из тканей
образовавшегося углекислого газа.
Поэтому в широком понимании ДН у новорожденных – это не только
расстройство газообмена в легких, но прежде всего тканевая гипоксия,
приводящая к нарушениям энергогенеза из-за перехода клетки на анаэробный
гликолиз с образованием большого количества лактата и малым образованием АТФ.
Установлено, что поступление кислорода в ткани зависит от
особенностей строения капиллярной сети, ее плотности, диффузионых свойств
самого кислорода в конкретных тканях, активности кислородутилизирующих
ферментов.
Транспорт кислорода в тканях описан в модели Крога, предложенной в
1919 г. (см. рисунок 69): «Согласно этой модели, каждый капилляр снабжает
цилиндрический объем ткани. По мере продвижения крови вдоль капилляра
происходит прогрессирующее снижение капиллярного РаО . В результате РаО в зоне тканей, прилегающих к артериальному концу капилляра, бывает выше, чем РаО
в соответствующих участках тканей у его венозного кон ца. Наименьшее напряжение кислорода в пределах
одного тканевого цилиндра наблюдается в дистальном конце капилляра вблизи венулы.
Эту зону иногда называют смертельным углом. Thews G. (1960) показал, что именно
в ней при максимальном снижении РаО в венозном конце капилляра градиент по
кислороду между кровью и тканями может быть настолько мал, что диффузия
кислорода в ткани становится практически невозможной. В этом и заключается механизм развития тканевой гипоксии. По данным Chance B. (1959), внутриклеточное
РаО в подобной ситуации может снижаться до 1 мм рт.ст., что несовместимо не
только с нормальной функцией клетки, но и с ее жизнью» (Рябов Г.А., 1988).
Хорошо известно, что имеются механизмы, регулирующие доставку
кислорода в ткани, и тонус мышц сосудистых стенок тесно коррелирует с
потребностью тканей в кислороде.
Объем поступающего в ткани кислорода в целом зависит от площади
диффузии или от суммы площадей открытых капилляров, а также от тканевых
факторов (температура, рН и т.д.), определяющих величину градиента РаО между кровью и тканями. В связи с этим даже при разных уровнях РаО капиллярной крови может быть достигнуто одинаковое обеспечение
тканей кислородом (Шик Л.Л., 1966). Возможности
подобного пути компенсации достаточно велики, поскольку в тканях одновременно
функционируют в покое 20-35% капилляров. Это справедливо при одновременном
увеличении минутного выброса сердца, т.к. дополнительные капилляры могут
адекватно функционировать лишь при обеспечении их дополнительным объемом
крови. Если не происходит увеличения объемного кровотока, то капиллярный
кровоток замедляется, вследствие чего увеличивается объем экстракции кислорода
из крови. В результате РаО в венозном конце капилляра резко снижается.
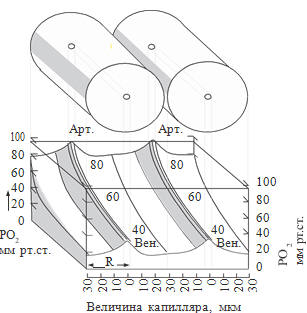
Рисунок 69. Модель транспорта кислорода в тканях (цилиндр Крога)
(G. Thews, 1960)
Таким образом, парциальное напряжение кислорода в венозной крови может
служить критерием соответствия объемного кровотока потребностям тканей в
кислороде. Для такого утверждения есть все основания, поскольку величина
сердечного выброса у человека регулируется согласно кислородным запросам
организма (Шик Л.Л., 1970; Рашмер Р., 1981).
Увеличение кровотока по капиллярам поддерживает тот
уровень РаО в дистальном конце капилляра, который будет оптимальным для экстракции кислорода из
крови тканями и адекватен уровню метаболизма. Если возможности ССС по увеличению
объемного кровотока ограничены, и РО в венозной крови становится ниже определенного критического уровня, то потребление кислорода начинает снижаться, например, при
постгипоксическом отеке-набухании головного мозга. Для ткани мозга у взрослого
человека критический уровень РаО венозной крови составляет 19-39 мм рт.ст., для мышц – 20-25 мм
рт.ст., для печени – 15-20 мм рт.ст. Нормальные показатели газов крови у
новорожденных представлены в таблице 128. Как видно из таблицы 130, нормальные
показатели газов крови, особенно венозной, у новорожденных отличаются от
взрослых. Связано это с рядом обстоятельств, например наличием фетального
гемоглобина, что определяет сдвиг кривой диссоциации оксигемоглобина влево и
т.д.
В современных представлениях о завершающих фазах патогенеза
критических состояний ведущее место отводится гипоксическим нарушениям
метаболизма клетки. Крайним проявлениям этих расстройств приписывают главную
роль в формировании необратимости некоторых патологических процессов.
Таблица 130. Нормальные показатели газов крови у новорожденного при
дыхании воздухом (Гомелла Т.Л., 1995)
|
Уровень измерения
|
pН
|
РаСО (мм рт.ст.)
|
РаО (мм рт.ст.)
|
|
Артериальная кровь |
7,35-7,45
|
35-45
|
55-65
|
|
Капиллярная кровь |
7,3-7,35
|
40-45
|
40-60
|
|
Венозная кровь |
7,25-7,30
|
45-50
|
30-45
|
РаО в капиллярной крови хорошо коррелирует с артериальным РаО (обычно
капиллярное РаО меньше на 10 мм рт.ст.) в том случае, если
участок, из которого берется анализ крови, был предварительно согрет при
температуре 40 °С. Кроме того, на степень корреляции pН, РаСО , РаО в артериальной и капиллярной крови влияют: артериальная гипотензия,
снижение периферического кровотока, полицитемия, РаО > 80 мм рт.ст., длительность хранения (пробы крови могут храниться без значительного влияния на
результаты исследования при комнатной температуре 10-15 минут, а при t = 4 °С –
1 час). В некоторых случаях при проведении ИВЛ допустимы другие показатели
газов крови (см. таблицу 131).

Таблица 131. Допустимые показатели газов крови у различных групп
детей (Любименко В.А. и др., 2002, с изменениями)
В настоящее время большинство исследователей считают, что при
некоторых заболеваниях периода новорожденности можно допускать более низкие
величины рН (около 7,2) и более высокие величины РаСО (более 60-80 мм рт.ст.), чем в норме. Прежде всего это положение относится к двум группам детей: с гестационным возрастом менее 28
недель и детям с хроническими неспецифическими заболеваниями легких (БЛД),
находящихся в состоянии клинической компенсации. Это связано с тем, что
возможные отрицательные последствия отдельных видов терапии (интубации, ИВЛ и
т.д.) могут быть больше, чем негативное влияние компенсированного дыхательного
ацидоза.
С другой стороны, высокие значения РаСО (≥ 60-65 мм рт.ст.) в острый период любого заболевания у недоношенных крайне опасны, так как в несколько раз
увеличивают частоту развития ВЖК.
Хотелось бы обратить внимание читателей на то,
что низкие показатели РаСО (менее 20 мм рт.ст.) при высоких PaO (более 65 мм рт.ст.)
не менее опасны, чем высокие, и могут вызвать выраженный спазм сосудов, в том
числе головного мозга, почек и т.д., с развитием органных нарушений (гипероксическая
гипоксия согласно патофизиологической классификации). К сожалению, иногда при
проведении кислородотерапии этот факт, на наш взгляд, недооценивается, а
вызванные повреждения связывают с другими причинами, например перенесенной
гипоксией другого генеза (например, гипоксической).
Таким образом, у любого ребенка с дыхательной недостаточностью
независимо от вида дыхательной поддержки должен проводиться респираторный
мониторинг.
Респираторный мониторинг
В идеале у детей, готовящихся к транспортировке, должен быть оценен
респираторный статус инвазивным методом (анализ газового
состава артериальной крови из нисходящей аорты при катетеризации пупочной
артерии или предуктально из правой лучевой артерии), а также проводиться
непрерывный неинвазивный мониторинг оксигенации и контроль вентиляции
(элиминации СО ) (см. таблицу 132).
Таблица. 132. Основные параметры респираторного мониторинга у
новорожденных
|
Уровень О2
|
|
Газы артериальной крови: РаО2
Транскутанная оксиметрия
Пульсоксиметрия
Сатурация смешанной венозной крови
Параинфракрасная церебральная оксиметрия |
|
Уровень СО2
|
|
Газы артериальной крови: РаСО2
Транскутанное определение СО2
Капнометрия, выдыхаемого СО2
|
Следует контролировать как гипоксемию, так и гипероксию,
ориентируясь на приемлемые уровни сатурации 90-95% (таблица 133).
Таблица 133. SaO как производная PaO и рН*
|
рН РаО |
7,30
|
7,35
|
7,40
|
7,45
|
7,50
|
|
120
|
98
|
98
|
98
|
98
|
99
|
|
100
|
97
|
97
|
97
|
98
|
98
|
|
90
|
96
|
96
|
97
|
97
|
97
|
|
80
|
95
|
95
|
96
|
96
|
97
|
|
70
|
92
|
93
|
94
|
95
|
95
|
|
65
|
91
|
92
|
93
|
94
|
94
|
|
60
|
88
|
90
|
91
|
92
|
93
|
Окончание таблицы 133
|
рН РаО |
7,30
|
7,35
|
7,40
|
7,45
|
7,50
|
|
55
|
85
|
87
|
89
|
90
|
91
|
|
50
|
81
|
83
|
85
|
87
|
88
|
|
45
|
76
|
78
|
80
|
83
|
85
|
|
40
|
69
|
71
|
74
|
77
|
79
|
|
35
|
61
|
63
|
66
|
69
|
72
|
|
30
|
51
|
54
|
57
|
60
|
62
|
|
20
|
29
|
32
|
34
|
36
|
39
|
|
10
|
7
|
8
|
9
|
10
|
11
|
Примечание. * – соответствие соблюдается
при температуре тела 370С, нормальном уровне 2,3 ДФГ, РаСО 40 мм рт.ст. и
гемоглобине взрослого типа (HbA).
Современные подходы к проведению респираторной поддержки основаны
на четырех основных положениях (Artigas A. et al., 1998):
1) уменьшение избыточной работы дыхательной мускулатуры;
2) предупреждение вентилятор – индуцированных повреждений
легких;
3) обеспечение оксигенации;
4) поддержание вентиляции (выведение диоксида углерода).
В ракурсе транспортной медицины способы решения этих задач могут
отличаться от рекомендуемых большинством авторов при проведении продленной
вентиляции у новорожденных. В частности, уменьшение избыточной работы дыхания,
на которую может расходоваться до 50% всей кислородной емкости крови, в
отделениях интенсивной терапии достигается подбором триггерированных
вспомогательных режимов, использованием сочетания контроля давления и потока,
когда реаниматолог может в течение нескольких часов добиваться адаптации
младенца к респиратору, преследуя основную цель сохранения максимальной доли
спонтанного дыхания. На этапе подготовки к транспортировке и в дальнейшем в
автомобиле или вертолете врач находится в состоянии постоянного цейтнота,
стремясь минимизировать сроки доставки в специализированное отделение. В этой
связи времени на подбор режима адаптированной респираторной поддержки, как
правило, просто нет. Поэтому как для снижения работы дыхания, так и для
уменьшения вероятности баротравмы или волюмотравмы у новорожденного,
«борющегося» с вентилятором, целесообразно использовать глубокую седацию, а
возможно, и миоплегию. С этой целью применяется морфин в нагрузочной дозе 100-150 мкг/кг в/в в течение первого часа с последующим переходом
на поддерживающую дозу10-20 мкг/кг/ч в непрерывной инфузии; для миоплегии:
недеполяризующие релаксанты средней продолжительности – атракуриум 0,5-0,6
мг/кг/ч, цисатракуриум 0,12-0,15 мг/кг/ч; или длительного действия – рокурониум
0,3-0,6 мг/кг/ч, векурониум 0,02-0,03 мг/кг/ч.
Вентилятор-индуцированное поражение легких само по себе является
многофакторным. Используются различные комментарии для описания отдельных
компонентов такого поражения, которые могут быть взаимосвязаны и действовать
синергично. Волюмотравма связана с повреждением, вызываемым перерастяжением
легких из-за доставки слишком большого количества газа. Баротравма, или
избыточное давление, может повреждать эпителий дыхательных путей и разрывать
альвеолы. Ателектотравма связана с повреждением, обусловленным открытием и
закрытием (цикл мобилизации и последующей демобилизации) легочных единиц. Биотравма является собирательным термином, описывающим повреждающие эффекты
инфекции и воспаления (и оксидантного стресса) на развивающиеся легкие.
Реотравма относится к повреждениям, вызываемым неадекватным потоком в
дыхательных путях.
На этапе транспортировки для профилактики повреждения легких
возможно использовать так называемые мягкие режимы вентиляции, ориентированные
не на достижение абсолютно нормальных показателей газового состава крови, а на
стресс-нормы, включающие в себя нижнюю границу оксигенации 50-60 мм рт.ст. (SaO 86-88%) и верхнюю границу пермиссивной гиперкапнии 60-80 мм рт.ст. (некоторые авторы считают
позволительной гиперкапнию до 100 мм рт.ст. при условии поддержания рН не менее 7,2).
Справедливости ради нужно заметить, что, однако, указанные величины ни в коем
случае не являются целевыми уровнями, а являются меньшим злом, призванным
предотвратить большее в виде синдромов утечки воздуха. Кроме того, недопустимо
применять подобную тактику у доношенных новорожденных, перенесших тяжелую
асфиксию, или у новорожденных с пороками сердца с обеднением системного кровотока, поскольку это может критически влиять на кислородный транспорт и состояние
перфузии головного мозга.
Реверсирование гипоксемии, особенно, например, при персистирующей
легочной гипертензии, является облигатным. В разрезе особенностей транспортной
вентиляции, возможно использование высоких концентраций кислорода до
80-100% в связи с кратковременностью его воздействия на легочную ткань и
опасностями манипуляции средним давлением в дыхательных путях в условиях
постоянно меняющейся ситуации в легких во время транспортировки, а также большей
опасностью гипоксии, чем гипероксии у новорожденных со склонностью к ацидозу,
обеднению периферического кровообращения и нестабильностью центральной
гемодинамики.
Оксигенация. Первичные показания к
оксигенотерапии клинически базируются на наличии (или отсутствии) центрального
цианоза. Акроцианоз в отсутствие центрального цианоза не является показанием к
использованию кислорода. Окончательное решение должно приниматься на основании
данных пульсоксиметрии, транскутанной, церебральной оксиметрии или уровня РаО .
Применение кислорода требует обязательного контроля его
концентрации, влажности и температуры. Регуляция концентрации О
от 21 до 100% возможна при наличии источников
кислорода и воздуха, подающихся в специальный смеситель (блендер)
под равным давлением, или использовании турбинных респираторов. В условиях
периферийных лечебных учреждений иногда допустимо получение заданной
кислородовоздушной смеси с использованием ротаметров наркозных аппаратов
(воздух может быть подключен к порту закиси азота) и расчетом объемных долей.
Например, для получения 8 л/мин ~50% кислорода необходимо подать ребенку 3 л/мин 100% О и 5 л/мин воздуха (21% О ). Согревание и увлажнение смеси может
быть
активным (автоматические увлажнители барботажного типа или камеры с
испарением воды с поверхности пористой ткани, а также небулайзеры)
или пассивным (тепловлагообменные фильтры). Последний вариант наиболее
приемлем для транспортной медицины, поскольку уменьшает аппаратную нагрузку
реанимобиля, при этом выполняя также бактериостатическую роль. Для новорожденных может быть рекомендовано использование фильтров Humid-Vent (Gibek
Respiration Inc., Швеция), полностью повторяющих форму коннектора интубационной
трубки, что не влияет на увеличение объема мертвого пространства в отличие от
других типов конструкций.
Если для мониторинга функции вентиляции
(элиминация СО ) на этапе подготовки младенца к переводу в другой стационар можно
использовать инвазивное измерение РаСО или траскутанное определение PtcCO , то во время
транспортировки единственным доступным методом будет измерение конечно-выдыхаемого etCO с помощью капнометрии. В капнометрах используется параинфракрасная или
масс-спектроскопия выдыхаемого газа для измерения содержания в нем СО .
Приборы, измеряющие и отображающие на дисплее количество СО от выдоха к выдоху в
числовом выражении, называются капнометрами. Те, которые также выводят на экран кривую содержания СО на протяжении всего дыхательного цикла, носят название капнографов.
Существует два типа мониторов: прямого и бокового потоков. Капнометр бокового потока постоянно
аспирирует небольшую порцию выдыхаемого газа в измерительную камеру монитора.
Парциальное напряжение углекислого газа определяется сравнением степени
абсорбции инфракрасных лучей в камере с образцом и в камере, свободной от CO .
Монитор прямого потока используется в педиатрической интенсивной терапии наиболее широко, поскольку его датчик встраивается в проксимальный конец
дыхательного контура сразу перед эндотрахеальной трубкой и измеряет степень
абсорбции инфракрасных лучей в процессе прохождения потока газа. Однако одними
из основных ограничений применения капнометрии у новорожденных являются
невозможность ее использования при проведении высокочастотной вентиляции и
существенное увеличение объема мертвого пространства датчиком прямого потока у новорожденных с экстремально
низкой массой тела.
Кислородотерапия
Как мы указывали выше, кислородотерапия является одним из основных
методов лечения дыхательной недостаточности у новорожденных. Суть ее состоит в
коррекции артериальной гипоксемии с помощью увеличении концентрации вдыхаемого
кислорода. Таким образом, показанием для ее проведения будет являться
снижение РаО в артериальной крови менее 50 мм рт.ст. при дыхании воздухом (гипоксемия). Как известно,
дотация кислорода новорожденному ребенку может проводиться различными
способами (см. таблицу 133).
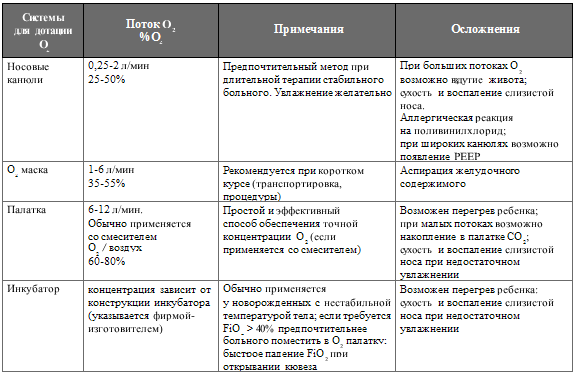
Таблица 133. Основные системы для дотации О (Фомичев М.В., 2000, с изменениями)
Следующим, более инвазивным методом респираторной терапии является
использование спонтанного дыхания с постоянным положительным давлением в
дыхательных путях (СРАР). Это такой режим дыхательной поддержки, при котором
больной дышит самостоятельно, и заданное положительное давление в дыхательных
путях поддерживается во время вдоха и выдоха. Показания для применения СРАР,
по нашему мнению, можно разделить на абсолютные и относительные. Абсолютные
основаны на лабораторных данных, а относительные – на клинических.
Абсолютным показанием для проведения СРАР является:
|
– артериальная гипоксемия (РаО2 |
менее 50 мм рт.ст.) при FiO2 |
во вдыхаемой смеси бо- |
|
лее 0,6-0,7 и РаСО2 |
менее 50-55 мм рт.ст., рН ≥ 7,25. |
Относительные показания:
– западение податливых мест грудной клетки, тахипноэ;
– прекращение ИВЛ.
NB. Если младенец находится на СРАР менее 24 часов, необходимо
интубировать его перед транспортировкой и вентилировать во время нее.
Если младенец находится на СРАР более 24 часов,
не зависит от кислорода (FiO < 40%) и стабилен – можно обойтись без интубации.
В клинической практике существуют несколько способов создания СРАР:
через носовые катетеры; назофарингеальные катетеры; с помощью маски; через
интубационную трубку.
Все методы проведения СРАР требуют увлажнения и нагрева дыхательной смеси,
декомпрессии желудка. Величина СРАР зависит от формы патологии и
гестационного возраста и может варьировать от 2 до 10 см вод.ст. У доношенных
детей обычно начинают проведение СРАР с 4-5 м вод.ст.
Пошаговая стратегия включает изменение параметров
СРАР на 1-2 см вод.ст. за 15-20 минут. Нижняя граница СРАР составляет 2 см вод.
ст., так как в норме меньше этой величины СРАР, создаваемое голосовыми связками
на выдохе, обычно не снижается. Пошаговая стратегия включает также изменения FiO
на 5% за 15-20 минут.
NB. Параметры не должны меняться одновременно, так как в конечном
итоге понять, что же «помогло» больному, будет невозможно.
Противопоказанием для использования СРАР (Фомичев М.В., 2002, с
изменениями) будут следующие состояния:
|
– тяжелая сердечно-сосудистая недостаточность; |
|
– рН меньше 7,25 и РаСО2 |
более 55-60 мм рт.ст.; |
|
– частые эпизоды апноэ (более 2 раз за 3-6 часов), если они
сопровождаются брадикар-
дией и снижением сатурации;
– атрезия хоан, диафрагмальная грыжа, трахеопищеводный свищ. |
Как известно, любое терапевтическое воздействие требует контроля
и оценки эффектив-
ности, не является исключением и СРАР.
К методам контроля за этим видом респираторной поддержки можно
отнести следующие
(Фомичев М.В., 2002, с изменениями):
|
– показатели КОС в артериальной, капиллярной или венозной
крови; |
|
– сатурация или транскутанное определение PaО2 |
; |
|
– ЧСС и АД; |
|
– FiO2 |
во вдыхаемой кислородно-воздушной смеси; |
|
– температура и влажность кислородно-воздушной смеси;
– цвет кожных покровов;
– аускультативная картина легких. |
Рентгенограмма органов грудной полости:
– должна быть проведена перед приездом транспортной бригады;
– цели исследования:
• положение ЭТТ в трахее;
• прозрачность легочных полей, наличие пневмоторакса;
• положение желудочного зонда;
• положение центральных венозных катетеров, в т.ч. пупочного;
• при клиническом ухудшении или подозрении на смещение ЭТТ
необходимо повторить рентгенограмму до начала транспортировки.
В зависимости от степени пневматизации легких уровень СРАР снижают
при перераздувании или повышают при ателектазировании участков легких. Купол
диафрагмы должен быть расположен между 8 и 9 ребром, но этот уровень может
варьировать у разных больных, что зависит от индивидуальных особенностей
конкретного пациента. Например, при БЛД у больного может иметься постоянная
легочная эмфизема.
К оценке эффективности выбранных параметров СРАР относятся:
|
– РаО2 |
= 50-70 мм рт.ст. (сатурация 90-94%) при FiO2 |
≤ 0,7; РаСО2 |
≤ 55-60 мм рт.ст.; рН ≥ 7,25; |
|
– уменьшение работы дыхания (снижение частоты дыхания на 20-40%,
уменьшение ретракции податливых мест грудной клетки);
|
– улучшение рентгенологической картины легких (оценить
пневматизацию);
– изменение гемодинамического статуса больного будет зависеть от
величины СРАР, ОЦК, легочной растяжимости. Возможные осложнения и побочные
эффекты СРАР (Фомичев М.В., 2002, с изменениями):
– повышение ВЧД;
– снижение диуреза;
– баротравма легких;
– повышение легочного сосудистого сопротивления;
– возможно увеличение шунтирования крови экстрапульмонального и
внутрилегочного;
– снижение перфузии мозга;
– повышение работы дыхания. Что касается назогастрального зонда,
то необходимо помнить, что:
– обязателен на протяжении всей транспортировки;
– должен быть все время в открытом состоянии;
– регулярная аспирация предупреждает растяжение желудка воздухом
и регургитацию патологического застойного отделяемого. Следующий по
значимости, но также по агрессивности и инвазивности метод респираторной терапии – ИВЛ.
К сожалению, в настоящее время в доступной литературе нам не
встретилось общепринятых абсолютных клинических и лабораторных критериев для
перевода ребенка на ИВЛ. Разные авторы (Любименко В.А., 1995; Фомичев М.В.,
2000; Шабалов Н.П. и соавт., 2006; Goldsmith J.P., Karotkin E.H., 1988; Avery G.
et al., 2005) указывают неодинаковые сочетания показателей, которые они
используют как показания для начала проведения ИВЛ. Более однообразное мнение
существует по поводу лабораторных показателей. Вероятно, именно их можно
использовать в качестве абсолютных критериев, как это чаще всего и происходит в
клинической практике, правда, при наличии возможности определения КОС, а в
России эта возможность есть не везде:
– рН менее 7,20 (независимо от формы патологии);
|
– РаСО2 |
более 55-60 мм рт.ст., рН ≤ 7,25 при содержании кислорода во
вдыхаемой смеси |
|
более 70% и РаО2 |
(арт.) менее 50 мм рт.ст. |
К относительным критериям большинство авторов относят:
– неэффективность СРАР по поддержанию оксигенации;
– рецедивирующие апноэ (если консервативные методы не дают
эффекта);
– клиническая картина шока. Lough M.D. et al. (1979) (цит. по
Зильберу А.П., 1988) указывают, что в некоторых случаях они использует для
определения показаний для начала проведения ИВЛ следующую таблицу (см. таблицу 134).
Таблица 134. Показания для проведения ИВЛ (Lough M.D., 1979, с
изменениями)

Примечание.* – хотя бы два эпизода апноэ продолжительностью
более 45 секунд.
Естественно, для проведения ИВЛ необходимым условием является
интубация трахеи. По многочисленным наблюдениям, абсолютные показания к
интубации у новорожденных перед транспортировкой следующие:
– инспираторная одышка с участием вспомогательной мускулатуры и
втяжением грудины и/или межреберных промежутков;
– SaO2 < 90% при FiO2 > 50%;
– РаО2 < 60 мм рт.ст.;
– РаСО2 > 65 мм рт.ст.;
– рН < 7,2;
– повторные апноэ;
– среднее АД < [гестационный возраст в неделях] мм рт.ст.;
– брадикардия < 100 уд. в 1 мин.
Общепринятым в реаниматологии является проведение рентгенологического
контроля положения интубационной трубки после интубации,
так как расстояния в воздухоносных путях могут значительно различаться. Как
известно, они зависят от массы тела, гестационного возраста, длины тела и т.д.
(см. рисунки 70-71). На данных рисунках показана зависимость длины верхних
дыхательных путей новорожденного ребенка от длины тела, массы, окружности
головы. Вероятно, у некоторых больных при интубации трахеи целесообразно
ориентироваться не только на массу тела, как обычно принято в России, но и на
другие антропометрические показатели.
В ДГБ № 1 г. Санкт-Петербурга на отделении реанимации принято в
отдельном документе, зафиксированном на аппарате ИВЛ, указывать дату интубации
данной трубкой, ее тип и размеры, глубину стояния у линии губ (например,
10.05.08; Portex; ∅ = 4,0; у губ 10,0 см). На наш взгляд, данная методика
позволяет избежать значимого изменения положения интубационной трубки в
процессе ухода за больным. Как известно, в практической работе необходимо
учитывать соответствие размеров и глубины введения интубационной трубки в
дыхательные пути ребенка (см. таблицу 135).
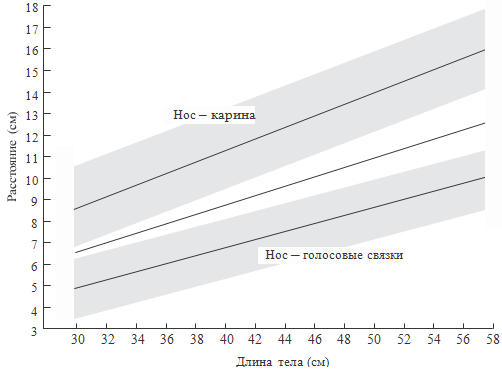
Рисунок 70. Зависимость длины верхних дыхательный путей от длины
тела (Coldiran J.S., 1968)
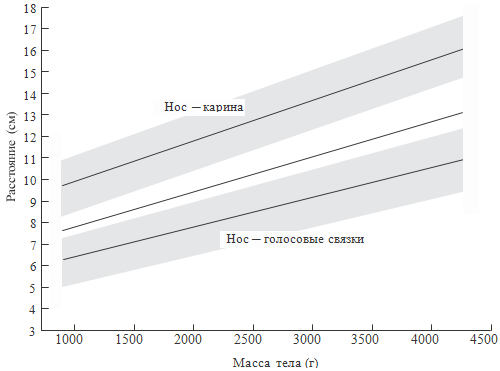
Рисунок 71. Зависимость длины верхних дыхательных путей от массы
тела (Coldiran J.S., 1968)
При несоблюдении размеров интубационной трубки или катетера для
санации возможно развитие осложнений в виде развитие пролежней трахеи, сброса
потока газа помимо интубационной трубки, значительно затрудняющих подбор
параметров ИВЛ. Если же у больного нарушена глубина постановки ЭТТ, то возможно
перераздувание одного легкого с риском развития синдромов утечки воздуха и ателектазирование другого.
Таблица 135. Рекомендуемые размеры интубационных трубок и глубина
введения от линии губ, размеры катетеров для санации в зависимости от массы тела
|
Срок гестации
(недель)
|
Масса тела
(г)
|
Внутренний диаметр (мм)
|
Глубина через нос (см)
|
Глубина через рот (см)
|
Размер катетера для санации (Fr)
|
|
23-24
|
600
|
2,5
|
7,0
|
6,0
|
5
|
|
25-26
|
750
|
2,5
|
7,5
|
6,5
|
|
27-29
|
1000
|
2,5
|
8,0
|
7,0
|
|
30-31
|
1500
|
2,5
|
8,5
|
7,5
|
5,5
|
|
32-33
|
1700
|
3,0
|
9,0
|
8,0
|
6,5
|
|
34-35
|
2000
|
3,0
|
9,5
|
8,0
|
|
36-37
|
2500
|
3,0-3,5
|
10
|
8,5
|
6,5
|
|
38-39
|
3000
|
3,0-3,5
|
11
|
9,0
|
|
40
|
3500-4000 |
3,5-4,0
|
12
|
9,5
|
8,0
|
Диаметр ЭТТ: не меньше 2,5 мм, поскольку через меньший
просвет будет невозможно провести аспирацию трахеального содержимого.
Длина ЭТТ: указаны приблизительные величины глубины интубации
– провести билатеральную аускультацию и подтвердить положение ЭТТ в трахее
рентгенологически.
Фиксация ЭТТ: убедитесь, что трубка надежно фиксирована и
ребенок не экстубируется во время транспортировки.
Хотелось бы обратить внимание, что при проведении ИВЛ по системе
Айра даже опытным реаниматологом при отсутствии клапана «безопасности» пиковое
давление на вдохе может достигать 45-50 см вод.ст. Это может приводить к
развитию тяжелой баротравмы
легких. Для обеспечения безопасности больного можно рекомендовать
использование мешков Амбу с установленными клапанами «сброса избыточного
давления на вдохе» или при использовании системы Айра ограничение
выставленного потока газа (см. таблицу 136).
Таблица 136. Рекомендуемые «безопасные» потоки газа, установленные
при дыхании по системе Айра (Любименко В.А., 1995)
|
Вес ребенка (г)
|
Поток, устанавливаемый на системе
Айра, л/мин
|
Давление (см вод.ст.)
|
|
Менее 1000
|
4-5 (max 6)
|
15-20
|
|
1000-2000
|
6 (max 10)
|
20-30
|
|
2000-3000
|
8 (max 12)
|
25-35
|
|
>3000
|
8-10 (max 12)
|
30-35
|
Чаще всего в неонатальных респираторах изменяемыми параметрами
являются давление вдоха и выдоха, время вдоха, соотношение вдоха к выдоху,
частота дыхания, процент кислорода во вдыхаемой смеси. Реже используют
«объемную» вентиляцию и регуляцию потока. К сожалению, в настоящее время не
существует общепринятых оптимальных режимов и параметров ИВЛ при различных видах
легочной патологии. Правда, различия касаются прежде всего времени вдоха и
соотношения вдоха к выдоху. В зарубежных руководствах (Goldsmith J.P., Karotkin
E.H.,
1988; Гомелла Т.Л., 1998) рекомендуют устанавливать следующие
инициальные параметры ИВЛ: Tвд/Tвыд = 1:1; Tвд до 0,5 с. В таблице 137
представлены предполагаемые стратегии вентиляции при характерных неонатальных
респираторных расстройствах.
Кроме того, хотелось бы обратить внимание на тот факт, что в
некоторых российских руководствах последних лет по респираторной терапии,
например Мостового А.В. и др. (2002), имеются рекомендации, касающиеся раннего
применения высокочастотной вентиляции и сурфактанта. Как показывает клиническая
практика, да и большинство зарубежных рекомендаций, касающихся данного
вопроса, применение высокочастотной вентиляции как инициальной респираторной
терапии в первые 3 часа жизни или до применения методов традиционной ИВЛ не
только невозможно, но и не нужно. На наш взгляд, не являются показаниями для
применения ВчИВЛ, как показывает опыт, большинство случаев сепсиса, пневмоний,
СДР I типа. Также, по нашему мнению, профилактическое введение сурфактанта
показано не всем недоношенным детям, как указывают авторы, а только детям с
низкой массой тела, угрожаемым по развитию СДР I типа, но на этом мы несколько
подробнее остановимся ниже.
Таблица 137. Предполагаемые стратегии вентиляции при характерных
неонатальных респираторных расстройствах

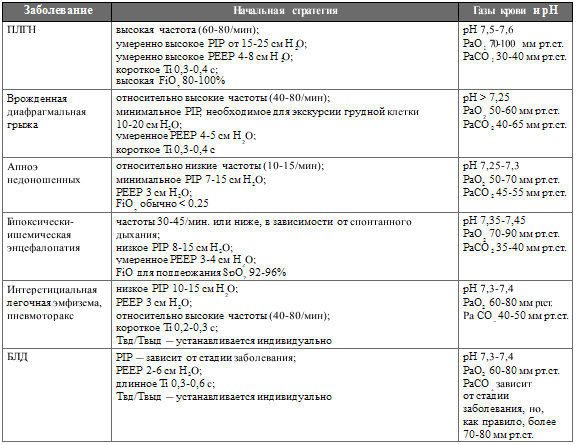
Критерием адекватности подобранных параметров может служить
уменьшение клинических проявлений дыхательной недостаточности, возможность
поддерживать у пациента рН свыше 7,25, РаО , ≥ 50 мм рт.ст. SatО ≥ 88%, РаСО ≤ 55-60 мм рт.ст., видимое улучшение экскурсий грудной клетки, отсутствие беспокойства пациента и
синхронность дыхания пациента и респиратора. В случае беспокойства больного необходимо
исключить возможные недыхательные причины, прежде всего болевой синдром, а
также вздутие живота, резкий шум, в том числе и транспортного средства, свет и
т.д.
Считаем важным отметить, что оксигенация больного может существенно зависеть
от положения тела. Так, хорошо известно, что при положении ребенка на
животе уровень оксигенации выше, чем при положении на спине. Связано это с
физиологическими особенностями гравитационного распределения по зонам легких
вентиляции и кровотока (см. рисунок 72).
Следует заметить, что при подборе параметров ИВЛ у больного
врач-реаниматолог РКЦН ориентируется на параметры ИВЛ, к которым ребенок был
адаптирован до начала транспортировки, то есть существует преемственность в
подборе параметров ИВЛ.
Обычно новорожденный синхронизирован с аппаратом ИВЛ при адекватно
подобранных параметрах. Еще раз отметим, что при «травматичных» параметрах или
поражении ЦНС может требоваться дополнительная седатация для синхронизации с
аппаратурой ИВЛ. Обычно используются препараты группы бензодиазепинов (разовая
доза 0,2-0,5 мг/кг
0,5% раствора сибазона или 0,5% раствора реланиума), ГОМК (50-200
мг/кг 20% раствора), реже группа наркотических анальгетиков в возрастных
дозировках (фентанил микроструйно
0,5-1,0 мкг/кг/час; морфин в дозе 0,1 мг/кг или микроструйно для
недоношенных новорожденных от 2 до 10 мкг/кг/час, а для доношенных – от 5 до
20 мкг/кг/час) (Yaster M. et al., 1997).
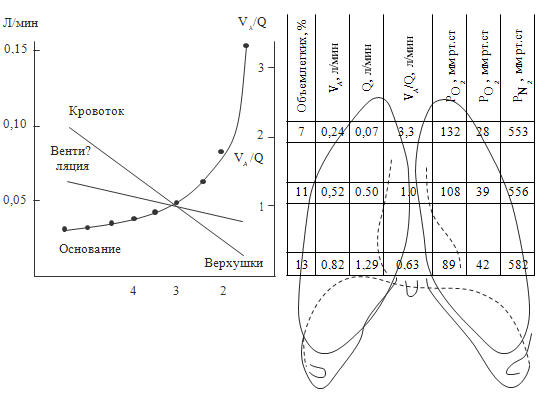
Рисунок 72. Распределение вентиляции и кровотока по зонам легких (West
J.B., 1970)
Одним из общепринятых критериев тяжести поражения легких при
различных заболеваниях является индекс оксигенации. Кроме того, он косвенно
дает представление о методе дыхательной поддержки, в которой нуждается
конкретный больной. Как известно, он вычисляется по следующей формуле:
Oi = (MAP x FiO x 100%) : РаО ,
где Oi – индекс оксигенации;
MАР – среднее давление в дыхательных путях; FiO –
фракция вдыхаемого кислорода;
РаО – парциальное напряжение кислорода в
артериальной крови, измеренной постдуктально. Существует 3 степени изменения
указанного индекса:
Oi – более 12 – свидетельствует о проявлении тяжелой ДН,
нуждающейся в респираторной поддержке;
Oi = 25-35 – у больного имеется дыхательная недостаточность,
требующая экстремальной дыхательной поддержки;
Oi более 40 – показание для проведения ЭКМО, риск летального исхода
возрастает до 80%.
Еще раз обратим внимание, что прежде всего необходимо помнить о наиважнейшем
постулате неонатальной транспортной медицины. Любая
транспортировка может ухудшить состояние пациента. А поскольку ребенок,
нуждающийся в межбольничном переводе, находится, как правило, в тяжелом
состоянии, то найти показания к интубации трахеи и вентиляции или хотя бы СРАР
можно всегда.
Транспортировка сама по себе является показанием к
проведению у новорожденного респираторной поддержки.
Специальные показания для проведения
респираторной поддержки во время транспортировки:
1) пневмоторакс и другие синдромы утечки воздуха;
2) врожденная диафрагмальная грыжа;
3) атрезия пищевода / трахеопищеводный свищ;
4) персистирующая легочная гипертензия новорожденных;
5) синдром аспирации мекония;
6) билатеральная атрезия хоан;
7) синдром Пьера–Робена.
Пневмоторакс / пневмомедиастинум
Пневмоторакс у новорожденных может протекать бессимптомно и не
требовать активного лечения. Если у младенца развился значительный
респираторный дистресс, пневмоторакс должен быть аспирирован пункционно, при
персистирующей утечке – дренирован с возможным подсоединением к системе
активной аспирации.
Признаки и симптомы:
1) респираторный дистресс;
2) внезапное ухудшение состояния у стабильного младенца.
Диагноз:
1) аускультативно: ослабление дыхания или отсутствие
дыхательных шумов на стороне поражения;
2) рентгенограмма органов грудной полости;
3) положительная трансиллюминация.
Стабилизация пациента:
1) присоединить шприц, заполненный 0,9% NaCl, через 3-ходовой кран к
«бабочке» размером 21-23 G;
2) положение ребенка – с приподнятым головным концом;
3) ввести иглу во 2-3 межреберье по среднеключичной линии по верхнему
краю нижележащего ребра, постоянно проводя аспирацию. При наличии газа в
плевральной полости возникает ощущение утраты сопротивления и в шприце
появится воздух (рисунок 73);
4) эвакуировать газ с помощью шприца до появления сопротивления аспирации
и отсутствия воздуха в шприце;
5) при отсутствии бронхоплеврального свища состояние ребенка
должно тут же улучшиться.
6) Если газ в плевральной полости постоянно накапливается,
необходимо дренировать
плевральную полости через этот же доступ (рисунок 74).
Противопоказанием является врожденная диафрагмальная грыжа.
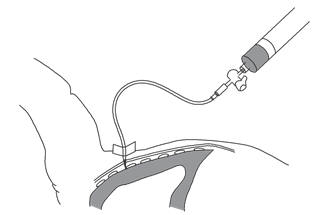
Рисунок 73. Пункция плевральной полости

4. Положить младенца на пораженную сторону, чтобы уменьшить
смещение средостения и улучшить вентиляцию здорового легкого.
5. Поддержание температурного гомеостаза. Переохлаждение может
вызвать спазм легочных артерий и развитие гипертензии малого круга, что еще
больше усугубит гипоксию.
6. Использовать «мягкие» низкообъемные режимы вентиляции с
невысоким пиковым давлением. При наличии аппаратного обеспечения показана ВЧ и ВЛ.
7. Во время транспортировки младенец должен быть глубоко
седирован и плегирован.
Внезапное ухудшение на фоне вспомогательной вентиляции обычно
свидетельствует о возникновении пневмоторакса на непораженной стороне!
Немедленная декомпрессия!
Задачи механической вентиляции при врожденной диафрагмальной
грыже должны быть направлены на достижение достаточной оксигенации (РаО 50-60 мм рт.ст.) и рН более чем 7,25. Очень низкие значения рН (< 7,2) могут
повысить легочное сосудистое сопротивление. Обычно достаточно достижения РаСО
в пределах 40-65 мм рт.ст., если наличие легочной гипертензии не требует
достижения более низких значений (30-40 мм рт.ст.). Относительно высокие частоты
вентиляции (40-80/мин) с небольшими пиковыми давлениями, достаточными для
достижения экскурсии грудной клетки (10-20 см Н О), короткие значения Ti
(0,3-0,4 с) и умеренное РЕЕР (4-5 см Н О) в сочетании с легкой седацией обычно
приемлемы у новорожденных с диафрагмальной грыжей.
Атрезия пищевода / трахеопищеводный свищ
Существует три варианта врожденной атрезии пищевода: без
трахеопищеводного свища, с верхним свищом (трахея – проксимальный отрезок
пищевода) и нижним свищом (трахея – дистальный отрезок пищевода, встречается
наиболее часто) (рисунок 75).
Признаки и симптомы:
1) полигидрамнион (многоводие);
2) регургитация слюны в ротовую полость и нос новорожденного;
3) поперхивание или позывы на рвоту;
4) вздутие живота (при нижнем трахеопищеводном свище);
5) респираторный дистресс.
Диагноз:
1. Проведение пробы Элефанта – после введения желудочного зонда вводится 10 мл воздуха, с
одновременной аускультацией желудка.
2. Невозможность провести в желудок катетер 10 Fr. Мягкие катетеры меньшего диаметра могут
сворачиваться в проксимальном пищеводном кармане, приводя к ошибочному
впечатлению прохождения в желудок. Использовать рентген-контрастный катетер
для последующего рентгенологического подтверждения!
3. При проведении рентгеноскопии ввести в катетер 10 мл воздуха, что позволит контурировать
проксимальный пищеводный карман. Нет необходимости во введении бария или
других контрастов, кроме того это увеличивает риск аспирации!
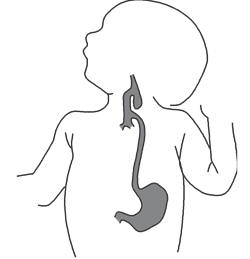
Рисунок 75. Трахеопищеводные фистулы при атрезии пищевода
Стабилизация пациента:
1. Аккуратно ввести катетер 10 Fr в проксимальный пищеводный
карман и подсоединить к постоянной аспирации (или отсасывать содержимое шприцем
каждые 5 мин). Если проксимальный отрезок пищевода не опорожнять регулярно,
это приведет к аспирации секрета в легкие.
2. Положение пациента с приподнятым на 300 головным концом.
3. Необходимо не давать младенцу плакать, т.к. во время крика в желудок
будет поступать воздух (через нижний свищ), что приведет к
рефлюксу желудочного содержимого в легкие. При необходимости седировать
ребенка.
4. Поддержание температурного гомеостаза.
5. Обеспечить венозный доступ и адекватное восполнение жидкости
и электролитов.
6. При наличии респираторного дистресса – интубация и
вспомогательная вентиляция под контролем SaO2 и газов крови.
Сразу после доставки ребенка в специализированный стационар и
стабилизации его состояния показано хирургическое вмешательство как
минимум с наложением гастростомы и перевязкой трахеопищеводной фистулы.
Персистирующая легочная гипертензия новорожденных (PPHN)
Персистирующая легочная гипертензия новорожденных (PPHN, Persistent
Pulmonary Hypertension of Newborns) характеризуется тяжелой гипоксемией, которая
по тяжести не соответствует клиническим проявлениям легочного заболевания.
Повышенное легочное артериальное давление вследствие повышенного легочного
сосудистого сопротивления превышает системное артериальное давление и приводит к
развитию легочного системного шунта через функционирующий артериальный проток
или право-левому шунтированию на предсердном уровне в структурно нормальном
сердце.
Гипоксемия может быть предотвращена путем
поддержания артериального РО в пределах 80-100 мм рт.ст. Показана алкализация путем гипервентиляции
(для поддержания РаСО в пределах 30-40 мм рт.ст.) и инфузии натрия бикарбоната (0,25-1,0
ммоль/кг/час) для поддержания рН в пределах 7,5-7,6. Необходимо
введение инотропов, понижающих периферическое сосудистое сопротивление:
добутамин в дозе 5-15 мкг/кг/мин и простагландин Е1 (алпростадил) 0,1
мкг/кг/мин. Следует ограничить скорость инфузии до 0,5-1 мл/кг/час, полезный
эффект оказывает использование фуросемида 1-2 мг/кг, инфузия 8% MgSO 25-50
мг/кг/час. Важно также, чтобы ребенок с PPHN был достаточно хорошо седирован, а
при необходимости и плегирован. Отсутствие эффекта в течение 1-2 часов является
показанием к использованию ингаляционного оксида азота (iNO) 5-20 ppm. После
стабилизации состояния младенца продолжить вентиляцию и iNO на протяжении всего
времени транспортировки (Kinsella J.P. et al., 2003). При отсутствии
ингаляционного оксида азота показано применение микроструйного внутривенного
введения нитратов: нитроглицерина, перлинганита и нанипруса.
Синдром аспирации мекония
Обструкция дыхательных путей, пневмонит, инактивация сурфактанта и
повышенное легочное сосудистое сопротивление характеризуют синдром аспирации
мекония (MAS). Меконий вызывает частичную обструкцию дыхательных путей, приводя
к формированию клапанного шарикового феномена. Этот феномен обусловливает
развитие газовой ловушки и расширение дыхательных путей, повышая риск
возникновения пневмоторакса.
Новорожденные с наличием мекония в околоплодных
водах и гипоксемией (РаО
<50ммрт.ст.),гиперкапнией(РаСО >60ммрт.ст.) и/или
ацидозом (рН < 7,2) при FiO > 0,8 должны транспортироваться на фоне
механической вентиляции. У новорожденных с синдромом мекониальной аспирации без
сопутствующей PPHN достаточно поддерживать рН 7,3-7,4 с РаО 60-80 мм рт.ст. и РаСО 40-50 мм рт.ст., относительно высокие частоты дыхания (40-60 в мин),
минимальное эффективное PIP для экскурсии грудной клетки. Низкое среднее РЕЕР
(4-5 см Н О) и адекватное Теx (обычно 0,5-0,7 с) необходимы для предотвращения образования газовой
ловушки и синдромов утечки воздуха.
Обструкция
Атрезия хоан
Билатеральная атрезия хоан должна выявляться сразу после рождения
(рисунок 76).
Признаки включают в себя цианоз и инспираторную одышку в покое, в
то время как при крике ребенок розовеет.
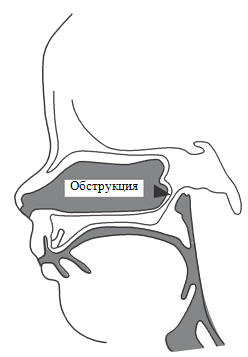
Рисунок 76. Атрезия хоан
Невозможность провести через носовые ходы в гортань катетер 3 Fr
подтверждает диагноз. Проблема заключается в том, что новорожденный обычно дышат
только через нос. Односторонняя атрезия может быть бессимптомной, но при
подозрении на нее может быть легко выявлена. Признаком является цианоз (снижение
сатурации) при закрытии рта и здоровой ноздри. Диагноз устанавливается также при
невозможности провести через носовые ходы катетера малого диаметра (3 Fr).
Стабилизация пациента заключается во введении воздуховода (размера
0 или 00) или ларингомаски. Показано ургентное оперативное лечение сразу по
стабилизации состояния.
Синдром Пьера Робена
• При значительном нарушении дыхания использовать
орофарингеальный воздуховод, ларингеальную маску или назофарингеальное СРАР.
• При необходимости интубации трахеи проводить ее под
поверхностной седацией с сохранением спонтанного дыхания и без использования
миорелаксантов в связи с частыми техническими сложностями выполнения.
• Транспортировать новорожденного в положении на животе, обычно
это улучшает проходимость верхних дыхательных путей у неинтубированных детей с
такой патологией.