
ГЛАВА 13. НАРУШЕНИЯ ОБМЕНА ГЛЮКОЗЫ
Как мы уже указывали, новорожденный ребенок не готов к
транспортировке, если у него не корригирован уровень глюкозы, и вроде бы здесь
все понятно: если глюкоза крови менее 2,2 ммоль/л (в России), то необходимо...
Но позволим себе цитату из работы признанного авторитета в данной области,
американского педиатра Marvin Cornblath (2000): «Определение клинической
значимости гипогликемии остается одной из наиболее запутанных и спорных проблем
в современной неонатологии».
На наш взгляд, прежде чем излагать отдельные проблемы нарушения
обмена глюкозы у новорожденных, необходимо коротко остановиться на постановке
проблемы в целом, на тех общих принципах, лежащих в основе ее разработки.
В настоящее время хорошо известно, что практически любое
критическое состояние, особенно развившееся остро, на каком-то этапе своего
развития сопровождается развитием инсулиновой резистентности, нарушением
толерантности к глюкозе, гипергликемией. Достаточно часто это состояние в
литературе называют «диабетом повреждения или травмы» (Thorell A. et al., 1999;
McCowen K.C. et al., 2001). Критическое состояние приводит к увеличению
продукции печенью (путем глюконеогенеза) глюкозы, несмотря на гипергликемию и
высокий уровень инсулина. Резистентность гепатоцитов к инсулину связана с
высокими концентрациями IGF-bindin protein-1 (инсулин подобного фактора-1).
Глюкоза крови является одним из компонентов внутренней среды
организма и концентрация ее в крови поддерживается на относительно постоянном
уровне. Из этого совершенно ясно, что обсуждаемая проблема неразрывно связана с
учением о постоянстве внутренней среды организма. Мы считаем долгом в своей
книге, упомянуть об ученом, так много сделавшим для изучения постоянства
внутренней среды, потому что нам кажется, что любой врач обязательно должен
помнить и почитать основоположников медицины, так как без прошлого нет будущего.
Как известно, основоположником учения о постоянстве внутренней
среды организма является Клод Бернар. В наиболее четком и ясном виде положения
своего учения он сформулировал в 1878 году. И вот уже более 130 лет различные
научные школы разрабатывают проблемы, впервые сформулированные эти великим
физиологом. Вот некоторые из них:
1. Бернар К. впервые установил происхождение глюкозы крови. Он
доказал, что глюкоза крови происходит из печени.
2. Он установил, что в печени глюкоза скапливается и превращается в
гликоген, а при недостаточном содержании сахара в крови гликоген печени снова
превращается в глюкозу.
3. Он впервые высказал мысль о ферментативном характере
расщепления углеводов, о наличии фермента, быстро разрушающего сахар крови и молочную
кислоту, о том, что этот фермент встречается в мышцах, в печени, особенно же
много его в эмбриональной ткани.
4. Бернар К. впервые описал развитие гипергликемии у больного с
постгеморрагическим шоком.
В настоящее время гипергликемия рассматривается как маркер остро
развившегося критического состояния, зачастую отражающего его тяжесть и
инсулиновую резистентность. Не последнюю роль в ее развитии играют
контринсулярные гормоны, обеспечивающие регуляцию гомеостаза в норме и в
условиях критического состояния. При нарушении данных нейрогуморальных
механизмов может развиваться иной серьезный вариант постагрессивного синдрома –
гипогликемия. Разумеется, достаточно часто, не скомпенсировав декомпенсацию
гомеостаза, приступать к дальнейшим каким-либо действиям с больным
нецелесообразно.
Хотелось бы обратить внимание, что в отличие от гипотермии
доказанный повреждающий эффект гипогликемии известен давно (Hartmann F.F. и
Jaudon J.C., 1937; Miller H.C. и
Ross R.A., 1940). Это тем более удивительно, что имеется
много противоречий, касающихся определения и лечения неонатальных гипогликемий.
Правда, вначале гипогликемия была описана у детей, рожденных от матерей с
сахарным диабетом.
В 1959 году Корнблат М. описал 8 детей, рожденных от матерей с
гестозами, у которых клинические признаки (апноэ, цианоз, кома, судороги) были
связаны с уменьшением концентрации глюкозы и были купированы внутривенной ее
инфузией. Кроме того, впоследствии у двух детей из этой группы развились тяжелые
неврологические нарушения, а один ребенок погиб. Эти наблюдения послужили
толчком к многочисленным исследованиям, целью которых являлось выявление
критического уровня глюкозы и частоты гипогликемий у новорожденных.
Определение
Гипогликемия
В доступных литературных источникам встречаются разночтения,
касающиеся прежде всего вопроса, что считать гипогликемией. Так, например, в
наиболее полном и популярном руководстве в России «Неонатология» Шабалова Н.П.
(2006) критерием гипогликемии у новорожденных считается уровень глюкозы менее
2,2 ммоль/л в любые сутки жизни.
Нам не встретилось результатов значительных исследований в нашей
стране, посвященных данному вопросу. Хотя в зарубежных источниках, прежде всего
в обзорах литературы и монографиях, также имеются указания на разные
концентрации глюкозы крови у новорожденных, которые разные авторы считают
гипогликемией, но, в отличие от России, приводятся и проводятся значительные
исследования по этому вопросу.
Мы при изложении данного вопроса будем опираться на критерии
гипогликемии, предложенные экспертами ВОЗ в 1997 году. И вот почему.
Противоречивость мнений, касающихся вопроса об уровне нормогликемии связана, на
наш взгляд, с использованием различных методов для определения «безопасного»
уровня глюкозы. В основном указываются 4 метода, использованные разными
исследователями: статистические, метаболические, нейрофизиологические и
катамнестическая оценка нервнопсихического развития.
Большинство исследователей указывают, что на уровень гликемии
значительно влияют тип вскармливания, время прикладывания к груди, срок гестации
и т.д.
До 80-х гг. критерием гипогликемии служили данные, полученные
Cornblath М. и Reisner S.H., и опубликованные в 1965 году. Они предложили
считать гипогликемией уровень глюкозы у доношенных менее 1,67 ммоль/л (30 мг%) в
первые 72 часа, а затем 2,2 ммоль/л (40 мг%), а у недоношенных детей при
рождении – 1,1 ммоль/л (20 мг%). Затем, в серединеконце 80-х, основываясь на
данных Lucas A. et al. (1981), Srinivasan G. et al. (1986), Heck L.J. и Erenburg
A. (1987) гипогликемией стали считать уровень глюкозы менее 2,2 ммоль/л.
Это произошло в силу целого ряда обстоятельств, в частности, в
связи с использованием «бумажных полос» для определения концентрации глюкозы крови. «Порог
чувствительности» указанных тестов начинается именно с концентрации 2,2 ммоль/л.
Примерно в то же время некоторые исследователи (Hawdon J.M. et al.,
1992; Hawdon J.M. et al., 1995) предлагали определять гипогликемию, основываясь
на метаболических показателях. Они исходили из того положения, что если
рассматривать глюкозу как «первичный» метаболический субстрат, то за уровень
гипогликемии необходимо принимать такую концентрацию глюкозы, при которой в
крови начинает увеличиваться концентрация альтернативных источников энергии
(кетоновых тел, лактата и т.д.). Концентрации глюкозы, предложенные эти
авторами, близки к тем, которые предлагали Cornblath М. и Reisner S.H. в 1965
году.
Следующие методы (нейрофизиологический и катамнестического
неврологического исследования) начали использовать с конца 80-х гг. Наиболее
крупные исследования провели Lucas A. et al. в 1988 г. Исследование охватило 661
новорожденного ребенка. Дети наблюдались до 18 месяцев жизни. Произведена
обширная статистическая обработка. В результате работы авторы пришли к мысли,
что безопасным уровнем глюкозы у новорожденных детей необходимо считать уровень
более 2,6 ммоль/л.
Комментируя эту работу и в целом соглашаясь с выводами авторов,
эксперты ВОЗ (1997) резюмируют: «Имеются недостаточные данные для того, чтобы
определить безопасные уровни глюкозы для доношенных детей, находящихся на
грудном вскармливании. Даже если пороговый уровень глюкозы будет установлен, то
это не будет являться показанием для начала лечения детей с бессимптомной
гипогликемией, так как неизвестны уровни альтернативных источников энергии
(кетоновых тел, лактата, жирных кислот) для мозга. В случае симптоматической
гипогликемии у новорожденных и уровне глюкозы менее 2,6 ммоль/л лечение должно
быть начато как можно быстрее, так как этот уровень коррелирует с возникновением
неврологических нарушений».
В 2000 году была создана группа экспертов во главе с Cornblath M.,
попытавшаяся в очередной раз определить безопасный уровень глюкозы в раннем
неонатальном периоде. На наш взгляд, данная группа экспертов пришла к достаточно
интересным выводам. Они указывают, что в настоящее время «значительная
гипогликемия не может определяться каким-либо показателем, применимым к отдельно
взятому больному. Скорее, это показатель, являющийся уникальным у каждого
индивидуума, который определяется состоянием его физиологической зрелости, ее
изменением и влиянием патологии. Исходя из этого, гипогликемия может быть
определена как та концентрация глюкозы в плазме крови, при которой больной
демонстрирует уникальную патологическую реакцию, вызванную неадекватной
доставкой глюкозы к органам, например, ЦНС. В настоящее время не существует
простых методов, позволяющих оценить адекватность доставки глюкозы отдельно
взятым органам. Кроме того, не существует данных, позволяющих определить ту
концентрацию глюкозы и продолжительность гипогликемии, влекущие за собой
поражение функций ЦНС». Тем не менее в заключении они указывают, что безопасный
уровень глюкозы в ранний неонатальный период вне зависимости от срока гестации
составляет 2,5 ммоль/л. Иными словами, гипогликемия с клиническими проявлениями
характеризует неспособность организма на фоне патологии сохранять гомеостаз и
обеспечить сохранение обмена в жизненно важных функциональных системах
организма.
Hoseth E. et al. (2000) определи уровень глюкозы у 223 здоровых
доношенных детей в тече-
ние первых 96 часов жизни. Результаты их исследования представлены
на рисунке 77.
Как видно из рисунка 77, средняя концентрация глюкозы крови в
первые сутки составила 3,1 ммоль/л. Авторы не обнаружили достоверной разницы
между мальчиками и девочкам, детьми, рожденными вагинально и путем операции
кесарева сечения и т.д. Всего два ребенка из обследованных имели однократное
снижение глюкозы менее 2,0 ммоль/л. Примерно такие же концентрации глюкозы крови
получили Diwakar K.K., Sasidhar М.V. в 2002 году (см. таблицу 138), обследовав
200 здоровых доношенных детей.
Таблица 138. Концентрации глюкозы (ммоль/л) у
здоровых доношенных детей (Diwakar K.K., Sasidhar М.V.,
2002)
|
Часы жизни
|
M±m
|
Медиана
|
Диапазон колебаний
|
|
3
|
3,0±1,05
|
2,8
|
1,4-8,3
|
|
6
|
2,95±0,75
|
2,8
|
1,6-5,4
|
|
24
|
2,89±0,79
|
2,9
|
1,3-7,6
|
|
72
|
3,0±0,79
|
2,8
|
1,4-7,1
|
Частота встречаемости гипогликемии, определенной как уровень
глюкозы менее 2,6 ммоль/л, у детей с различной патологией представлена в таблице
139.
Таблица 139. Частота гипогликемий у
новорожденных при различной патологии (Graham J. Reynolds, 2000)
|
Группы
|
n
|
Средний уровень глюкозы (ммоль/л) |
Медиана
(ммоль/л) |
Диапазон колебаний
|
Количество детей с уровнем глюкозы < 2,6 ммоль/л
|
|
1
|
76
|
3,07 (0,51)
|
2,90
|
1,7-4,4
|
9 (11,8%)
|
|
2
|
15
|
3,13 (0,47)
|
3,1
|
2,5-4,2
|
1 (6,6%)
|
|
3
|
4
|
2,82 (0,5)
|
2,85
|
2,3-3,9
|
0
|
|
4
|
2
|
3,0
|
3,0
|
2,9-3,1
|
0
|
|
5
|
15
|
2,88 (1,7-3,5)
|
2,8
|
1,7-3,5
|
3 (20%)
|
Примечание. Группа 1 – дети, перенесшие
асфиксию; группа 2 – дети с сепсисом; группа 3 – дети с родовой травмой;
группа 4 – дети с полицитемическим синдромом; группа 5 – рожденные от матерей
с сахарным диабетом.
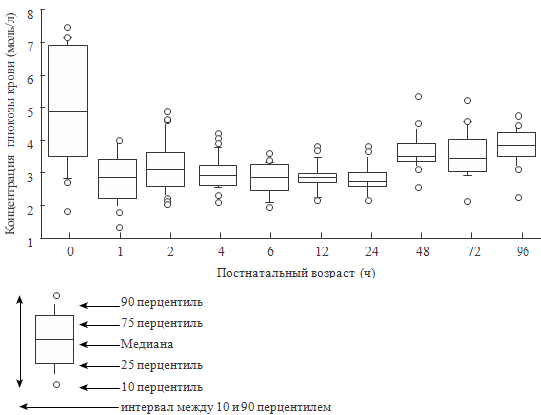
Рисунок 77. Концентрация глюкозы крови у здоровых доношенных детей
(Hoseth E. et al., 2000)
При интерпретации полученных данных необходимо учитывать некоторые
моменты, которые могут искажать истинный уровень глюкозы: метод определения,
место забора крови и сопутствующие состояния.
Например, показано (Overfield C.V. et al., 1972), что если цельная
кровь, взятая для анализа, хранится при комнатной температуре, то концентрация
глюкозы снижается на 7% в час, поэтому эритроциты должны быть максимально быстро
отделены от сыворотки (центрифугирование).
Установлено, что артериальная кровь имеет более высокие
концентрации глюкозы, чем венозная. Если имеются нарушения микроциркуляции, то
концентрация глюкозы в капиллярной крови может быть существенно изменена.
Известно, что уровень глюкозы в плазме крови в среднем на 18% выше,
чем в цельной крови, поэтому величина гематокрита существенно влияет на этот
показатель. Особенно это актуально для новорожденных, учитывая их склонность к
полицитемии (Aynsley-Green А., 1991).
Гипербилирубинемия, повышение уровня мочевой кислоты и гемолиз
также приводят к ложному занижению концентрации глюкозы, особенно если
используются бумажные тесты (Fox R.E., Redstone D., 1976), поэтому считают, что
при их использовании имеется только
75-85% достоверных результатов и предпочтительнее использовать
биохимические методы.
Имеются данные, подтверждаемые не всеми исследователями, что дети,
находящиеся на грудном вскармливании, имеют более низкие концентрации глюкозы (в
среднем 3,6 ммоль/л, диапазон колебаний 1,5-5,3 ммоль/л) по сравнению с
новорожденными, находящимися на искусственном вскармливании (в среднем 4,0 ммоль/л,
диапазон колебания 2,5-6,2) (Nicholl R., 2003). С другой стороны, у детей, находящихся
на грудном вскармливании, более высокие концентрации кетоновых тел (Hawdon J.M.
et al., 1992).
Кроме того, по мнению Pal D.K. et al. (2000), на концентрацию
глюкозы крови влияет время кормления. По их данным, если ребенок не получает
адекватное энтеральное питание в первые 24 часа жизни, то «лабораторная»
гипогликемия отмечается у 43% новорожденных.
×àñòîòà
Корблант М., определявший гипогликемию как концентрацию глюкозы
крови менее 30 мг% (1,67 ммоль/л) в первые 72 часа жизни, обнаружил ее у 4,4‰
всех живорожденных.
В 1971 году Lubchenco L.O. и Bard H., используя критерии Корбланта
М., выявили гипогликемии у новорожденных с большей частотой. Так, они
обнаружили, что если скрининг проводился в первые 6 часов жизни, то гипогликемия
выявлялась у 11,4% всех живорожденных новорожденных. У недоношенных – еще чаще
(20,3%).
Что касается работ последних десятилетий, то, взяв за критерий
уровень глюкозы 2,6 ммоль/л в первые 50 часов жизни, Anderson D.M. et al. (1993)
обнаружили гипогликемию у 38% всех новорожденных. Особенно часто отмечена
гипогликемия у охлажденных детей. Показано, что если ректальная температура у
новорожденных ниже 35 °С, то гипогликемия встречается у 57% детей. На наш
взгляд, это очень важное исследование, показывающие, что гипогликемия, как
правило, вторична, т.е. сначала нарушается способность поддерживать
температурный баланс и лишь потом способность сохранять нормогликемию.
В 2000 году Pal D.К. et al. опубликовали данные, полученные при
обследовании 578 новорожденных детей в Непале. По их данным, гипогликемия
встречается не менее чем у 40% детей (см. таблицу 140).
Таблица. 140. Частота гипогликемии у новорожденных в Непале (Pal
D.К. et al., 2000)
|
Часы жизни
|
Кол-во обследованных (n) |
Концентрация глюкозы
|
|
≤ 2,6 ммоль/л
|
≤ 2,0 ммоль/л
|
|
количество детей = n (%)
|
|
0-6
|
73
|
35 (48)
|
12 (16)
|
|
6-12
|
97
|
53 (55)
|
13 (13)
|
|
12-18
|
72
|
25 (35)
|
8 (11)
|
Окончание таблицы 140
|
Часы жизни
|
Кол-во обследованных (n) |
Концентрация глюкозы
|
|
≤ 2,6 ммоль/л
|
≤ 2,0 ммоль/л
|
|
количество детей = n (%)
|
|
18-24
|
106
|
50 (47)
|
11 (10)
|
|
24-30
|
85
|
34 (40)
|
13 (15)
|
|
30-36
|
58
|
22 (38)
|
4 (7)
|
|
36-42
|
42
|
11 (26)
|
3 (7)
|
|
42-48
|
45
|
8 (18)
|
2 (4)
|
|
0-48
|
578
|
238 (41)
|
66 (11)
|
Мы (Иванов Д.О., 2003) исследовали частоту гипогликемий у
новорожденных с инфекционными заболеваниями (см. таблицу 141), исходя из
критериев, используемых Шабаловым Н.П. (2000). Как видно из таблицы 141, она
чаще встречается у недоношенных детей с гиперэргическим вариантом сепсиса.
Таблица 141. Частота нарушений обмена глюкозы у детей с
инфекционной патологией
|
Признак
|
Сепсис
|
Пневмония |
|
срок гестации ≥ 32 недель
|
|
доношенные
|
масса 1500-2500 г
|
|
А*
|
Б*
|
А*
|
Б*
|
|
n = 31
|
n = 55
|
n = 22
|
n = 29
|
n = 62
|
|
% детей, имеющих данный признак
|
|
Гипергликемия > 6,5 ммоль/л |
1001, 2
|
79,23
|
96,62
|
78,23
|
8,0
|
|
Гипогликемия < 2,2 ммоль/л |
0,0
|
10,83
|
4,61
|
17,03
|
0,0
|
Примечание: А* – гипоэргический вариант сепсиса. Б* –
гиперэргический вариант сепсиса. 1 – р <0,05 – между вариантом А и вариантом
Б; 2 – р <0,05 между вариантом А сепсиса и пневмонией; 3 – р <0,05 между
вариантом Б и пневмонией.
Особенности обмена глюкозы у новорожденных
Хорошо известно, что у плода примерно 50% всей энергетической
потребности организма обеспечивает глюкоза. Еще половину – аминокислоты и лактат.
Глюкоза трансплацентарно попадает к плоду по градиенту концентрации, поэтому
уровень глюкозы в плазме крови плода в норме составляет примерно 70-80% от
концентрации глюкозы в плазме матери.
Потребление глюкозы плодом достаточно высокое и составляет
приблизительно 7 граммов на 1 килограмм веса в сутки, или 5 мг/кг в минуту.
Интересно, что указанная величина примерно равна эндогенному образованию глюкозы
после рождения. Установлено, что ферментативные системы, участвующие в
глюконеогенезе и гликогенолизе, имеются в печени плода, но остаются в
эмбриональный период неактивными, если не оказывают действие дополнительные
факторы, например, голодание матери. Хотя печень плода содержит в 3 раза больше
гликогена, чем печень взрослого человека, при рождении печеночный гликоген
составляет примерно всего 1% общих запасов энергии. Таким образом, плод
практически целиком зависит от уровня глюкозы в крови матери, так как сам
активно ее образовывать не может.
Инсулин не проходит трансплацентарно, и поэтому его уровень у плода
не зависит от уровня у матери. β-клетки поджелудочной железы плода только в
последний триместр беременности становятся чувствительными к концентрации
глюкозы. Именно в этот момент они заметно увеличиваются в объеме.
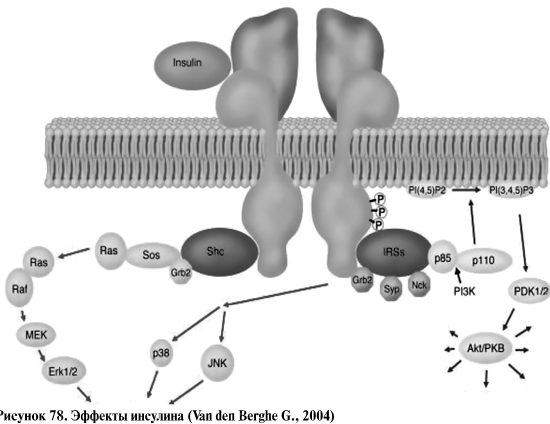

является основным местом синтеза эндогенной глюкозы, хотя при
длительном голодании до 10% общей глюкозы могут образовываться в почках. Глюкоза
в организме может образовываться двумя путями: во-первых, из гликогена (гликогенолиз),
а во-вторых, синтезироваться из глицерола, лактата, пирувата, аминокислот,
основной из которых в количественном отношении для синтеза глюкозы является
аланин.
Гликоген также может синтезироваться двумя путями: из глюкозы или
из других предшественников (лактата, пирувата, глицерола). Баланс между
гликонеогенезом и гликогенолизом поддерживается с помощью ферментов:
гликогенсинтетазы и фосфорилазы соответственно. Протеинкиназы, активируя
повышение цАМФ в гепатоците, стимулируют активность печеночной фосфорилазы и
инактивируют гликогенсинтетазу. Таким образом, повышение уровня цАМФ в
гепатоците стимулирует гликогенолиз, а снижение – гликонеогенез.
Изменение уровня цАМФ в гепатоцитах зависит от гормонов,
регулирующих метаболизм глюкозы. Это инсулин и так называемые контринсулярные (противорегулирующие)
гормоны (глюкагон, соматотропный гормон, катехоламины, кортизол). Основными
контриинсулярными гормонами являются глюкагон и адреналин. Адреналин стимулирует
выброс из клеток лактата и аланина, стимулируя периферические β-рецепторы.
Другие гормоны действуют пермиссивно, а кортизол имеет очень кратковременный
эффект на концентрацию глюкозы крови.
Выработку инсулина стимулирует повышение глюкозы крови. Уровень
цАМФ в гепатоците снижается в присутствии инсулина, таким образом стимулируя
синтез гликогена.
В большинство тканей, в том числе и в мозг, глюкоза поступает по
градиенту концентрации, но мышечные, жировые клетки, а также гепатоциты являются
инсулинзависимыми. Внутриклеточная глюкоза фосфорилирована. Когда в клетках
происходит окисление жирных кислот цитоплазматической глюкозо-6-фосфотазой, ее
концентрации возрастают, ингибируя активность гексокиназы, и уменьшается
способность клетки фосфорилировать глюкозу. В целом, окисление жира в клетках
снижает образование глюкозы в них и стимулирует гликонеогенез в печени.
Таким образом, в организме поддерживается баланс между образованием
глюкозы и ее использованием. В последние 30 лет появилась возможность, используя
глюкозу, меченную радиоактивными изотопами, оценить продукцию глюкозы у
новорожденных. Так, Kalhan S.C. et al. (1976), исследуя образование глюкозы у
детей, начиная со вторых суток жизни, получили величины 4,3-8,5 мг/кг·мин.
Другие исследователи приводят меньшие значения глюкогенеза (3,8-4,9 мг/кг·мин).
Доказано (Sunehag A. et al., 1994), что инфузия глюкозы у взрослых
подавляет эндогенное образование глюкозы за счет увеличения синтеза инсулина.
Такое же явление доказано у здоровых новорожденных, а у больных указанный эффект
менее выражен, особенно у глубоконедоношенных детей. Эти исследования доказывают
вариабельность контррегулирующего ответа у больных и недоношенных новорожденных.
Еще один интересный факт, доказанный в последнее десятилетие (Bracero
L.A. et al., 1998): высокое потребление глюкозы в третьем триместре беременности
беременной женщиной приводит к развитию гипокальциемии. Этот эффект связывают со
стимуляцией глюкозой синтеза энтероглюкагона и гастрина, приводящих к высокой
продукции кальцитонина с последующим снижением концентрации кальция в крови.
Согласно этим же наблюдениям прием глюкозы не влияет на концентрацию магния в
крови.
При рождении у новорожденного должно произойти достаточно резкое
переключение на самостоятельное образование глюкозы. Создание нормогликемии
зависит от достаточного количества гликогена, зрелости механизмов гликонеогенеза
и гликогенолиза, а также интегрированного эндокринного ответа.
Как известно (Ktorza A. et al., 1985), эндокринологическая
перестройка первых часов жизни приводит к увеличению уровня глюкозы и
мобилизации жира из жировых тканей за счет высокого уровня адреналина и быстрого
снижения отношения инсулин/глюкагон. На вопрос, снижается ли концентрация инсулина фактически, однозначного ответа
нет. Так, Hawdon J.M. et al. (1992) не подтвердили этого факта относительно как
доношенных, так и недоношенных детей. Hawdon J.M. et al. (1995) обнаружили, что
концентрация как инсулина, так и глюкозы остается высокой у недоношенных.
Что касается данных относительно концентрации других
метаболических субстратов, то в обзоре литературы, опубликованном ВОЗ (1997), обращается
внимание, что таких исследований относительно немного, и сделаны они в то время,
когда у новорожденных детей соблюдалась «голодная пауза» и начало грудного
вскармливания было отложено на несколько часов. Результаты этих исследований
показали, что снижение концентрации глюкозы, во-первых, зависит от
продолжительности голодания, а во-вторых, что концентрация других энергетических
метаболитов (свободных жирных кислот, кетоновых тел, глицерина) повышается.
Например, Beard A.G. et al.(1966) изучали две группы доношенных и
недоношенных детей. Детей первой группы прикладывали к груди в первые 6 часов
жизни, а детей второй группы – через 72 часа после рождения. Оказалось, что у
доношенных детей первой группы средняя концентрация глюкозы была 3,8 ммоль/л, а
у детей второй группы 2,2 ммоль/л. У 58% недоношенных детей второй группы
концентрация глюкозы была менее 1,4 ммоль/л, в то время как в первой группе
таких детей было всего 4%. Кроме того, у голодающих младенцев повысилась
концентрация жирных кислот, у 50% из них зарегистрирована кетонурия. Самые
высокие значения указанных метаболитов отмечены у детей с самыми низкими
концентрациями глюкозы. Необходимо отметить, что, несмотря на низкие
концентрации глюкозы, у детей не отмечено клинической симптоматики гипогликемии.
Как справедливо отмечают эксперты ВОЗ в уже упоминавшемся обзоре, также
цитирующие эту статью, нельзя сравнивать детей тридцатилетней давности с
сегодняшними новорожденными. Вполне возможно, что тогда новорожденные, даже
недоношенные, были более «зрелые», чем сегодня, и их адаптивные возможности были
лучше развиты.
Таким образом, упомянутые исследования показали, что недоношенные
дети имеют более низкие концентрации глюкозы, чем доношенные. Правда, в те годы
этот факт рассматривался как «физиологическое явление», хотя не имелось никаких
доказательств, что недоношенные более стойки к гипогликемии, чем доношенные. Как
известно, недоношенные дети имеют многочисленные причины для развития
гипогликемии.
Во-первых, у них меньше энергетические запасы (гликоген печени и
жир). Во-вторых, они имеют более высокие концентрации инсулина. В-третьих, у
недоношенных новорожденных гораздо хуже развиты механизмы глюконеогенеза.
Например, Hume R. и Burchell A. (1993) установили низкую концентрацию
микросомальной глюкозо-6-фосфатазы в печени у детей, родившихся на сроке
гестации 24-36 недель. Интересно, что низкие концентрации указанного фермента
сохранялись до 1 года жизни.
Кроме того, у недоношенных снижены концентрации других
метаболических субстратов (жирных кислот) (Hawdon J.M. et al., 1993), а
некоторые исследователи обнаружили у недоношенных детей низкие концентрации
глюкагона (Mehta A., 1991). Вышеуказанные изменения еще более характерны для
детей, «незрелых к сроку гестации» (Kalhan S.S. et al., 1986; Hawdon J.M. et al.,
1993; Hawdon J.M. et al., 1995).Кроме недоношенности и незрелости к сроку
гестации, имеется еще достаточно большое количество состояний неонатального
периода, сопровождающихся гипогликемией. Наиболее частые причины – перенесенная
асфиксия, сепсис, гипотермия, полицитемия, наличие сахарного диабета у матери и
т.д.
Влияние гипогликемии на нервно-психическое развитие
В настоящее время существуют определенные противоречия, касающиеся
влияния гипогликемии на возникновение отдаленных психоневрологических
расстройств, особенно это касается «бессимптомной гипогликемии», то есть не имеющей выраженных
клинических проявлений.
Уже в ранних работах (Haworth J.C. и McRae K.N., 1965) указывалось,
что неврологические проблемы возникают у 35% детей, имеющих клинические
признаки, и у 20% новорожденных с бессимптомной гипогликемией. Хотя другие исследователи как в
60-70-е гг. (Griffiths A.D. и Bryant G.M., 1971), так и позже не обнаружили
таких закономерностей.
Koivisto M. et al. (1972) ретроспективно исследовали 151 ребенка в
возрасте 4 лет, перенесших неонатальную гипогликемию (которую определяли как
снижение уровня глюкозы менее 1,67 ммоль/л). Группу контроля составили 56 детей, не имевших
лабораторных или клинических признаков неонатальной гипогликемии. Оказалось, что
94% из 66 детей, имевших бессимптомную гипогликемию, и 95% из группы контроля к
4 годам имели нормальное неврологическое развитие. Среди 85 детей, имевших
клинические признаки гипогликемии, ситуация была иной. У 50% детей, развивших
судорожный синдром, отмечены отдаленные неврологические расстройства. Если же
гипогликемических судорог не было, то нормальное развитие к 4 годам отмечено у
88% пациентов. В заключении работы авторы отметили несущественное влияние
бессимптомной гипогликемии на возникновении неврологических нарушений. Подобные
заключения были сделаны Singh M. et al. (1991) после исследования, охватившего 107 детей, перенесших неонатальную гипогликемию.
Все эти наблюдения привели к тому, что в литературном обзоре,
посвященном неонатальным гипогликемиям, Cornblath M. et al. (1990) пришли к
убеждению: в настоящее время нет исследований, демонстрирующих «категорическую»
связь между наличием гипогликемии и последующим нервно-психическим развитием.
Авторы отмечают, что необходимы дальнейшие рандомизированные исследования на
этот счет, и подчеркивают, что создание единой строгой классификации
неонатальных гипогликемий, включающей бессимптомные и клинически значимые формы,
крайне затруднительно. В первом издании данной монографии мы указывали, что к
2003 году в доступной нам литературе результатов исследований, позволяющих
сделать другие заключения, мы не нашли.
В июне 2006 года в журнале «Pediatrics» Boluyt N. et al. из
Нидерландов опубликовали обзорную работу, посвященную нервнопсихическому
развитию детей, перенесших неонатальную гипогликемию. Они проанализировали все
опубликованные работы, посвященные данной проблеме с 1966 по 2006 гг. Из 5200
публикаций независимые эксперты согласно общепринятым критериям достоверности
(наличия группы сравнения, долговременного катамнеза и т.д.) отобрали всего 18
работ, охвативших 1583 ребенка, перенесших гипогликемию в неонатальный период.
Анализируя данные работы, авторы приходят к заключению, что некоторые
исследователи не обнаружили никаких различий между детьми, перенесшими
неонатальную гипогликемию и не перенесшими, некоторые обнаружили эти различия
(см. таблицу 143). Более того, неизвестна продолжительность гипогликемии,
влияющей на нервнопсихическое развитие, а также ее глубина. В заключение авторы
указывают, что анализ данных работ не позволяет сделать каких-либо определенных
клинических рекомендаций и необходимы дальнейшие масштабные исследования на эту
тему. Опять, казалось бы, такой простой вопрос, но как непросто он решается.
Таблица 143. Влияние неонатальной гипогликемии на нервнопсихическое
развитие (суммарные литературные данные) (Boluyt N. et al., 2006, c изменениями)
|
Автор, год
|
Основные результаты
|
|
Доношенные, крупные к сроку гестации
|
|
Brand P.L. (2004) |
Гипогликемия у 60 (80%). Нет достоверных различий между детьми,
перенесшими гипогликемию и без нее при оценке интеллекта, шкале Demos и
шкале детского поведения (CBCL). IQ статистически достоверно ниже у детей,
перенесших гипогликемию:
107,6 (15,0) и 116,9 (16,1); нет достоверной корреляции между
наименьшим уровнем глюкозы и IQ |
|
Доношенные, нормальные и с ЗВУР
|
|
Gentz J. et al. (1969) |
2 (17%) из 12 новорожденных, у которых отмечалась клиническая
симптоматика, имели серьезные поражения мозга (не определенные), 1 ребенок
(8%) из 12 имел пограничное психическое развитие и легкий мышечный
гипертонус, 9 детей (75%) из 12 – нормальные.
6 из 6 перенесших бессимптомную гипогликемию имели нормальные
показатели всех тестов |
Окончание таблицы 143
|
Автор, год
|
Основные результаты
|
|
Kinnala A. et al. (1999) |
МРТ, УЗИ: RR 3.7 (90% CI: 1.11 к 12.28) без каких-либо
изменений в мозге; хорошая тенденция к выздоровлению (5 из 7); 17 (94%) из
18 детей имели нормально психическое развитие |
|
Только недоношенные
|
|
Lucas A. et al. (1988) |
Максимальные статистически достоверные различия выявлены: при
оценке моторного и умственного развития при использовании порогового уровня
глюкозы = 2,5 ммоль/л; ДЦП и задержка психомоторного развития у детей,
перенесших гипогликемию, выявлена в 5 раз чаще, чем у детей без гипогликемии |
|
Доношенные и недоношенные
|
|
Creery R.D. (1966) |
5 (23%) из 22 умерли, 7 (32%) из 22 имели поражения мозга
(5-первичную родовую травму,
2 инфантильные судороги), 10 (45%) из 22 были нормальными |
|
Haworth J.C., McRae K.N. (1967) |
Из 17 детей с симптоматической гипогликемией: у 12
идиопатическая (быстрое исчезновение симптомов после введения глюкозы);
гипогликемия – 3 (25%) из 12 имели умственную отсталость; у 2 – вторичная по
отношению к заболеваниям мозга:
1 из 2 имели умственную отсталость; 3 –инсулинзависимый СД: 2
(67%) из 3 имели умственную отсталость.
Из 15 детей 2 (13%) с асимптомной гипогликемией, возможно,
имели задержку развития |
|
Griffiths A.D., Bryant G.M. (1971) |
Поражение мозга: 6 (14,6%) из 41 детей, 5 (12,2%) из 41 в
контрольной группе.
IQ: 99,8 ± 10,2 и 100,4 ± 11,9 в контроле; локомоторные
нарушения: 102,6±8,1 и 102,3 ± 9,3 в контроле |
|
Kumari S. et al. (1971) |
4 (21%) из 19 умерли, 1 (5%) из 19 имел неврологические
нарушения, 11 (55%)
из 19 нормальные, 3 (16%) из 19 не были обследованы |
|
Koivisto M. et al. (1972) |
Симптоматическая (судороги): 4 (50%) из 8 поражены (2
инфантильные судороги,
1 серьезное моторное отставание, 1 развитие идиопатической
гипогликемии
в последующей жизни). Симптоматическая (но без судорог): 9
(12%) из 77 с отклонениями. Асимптоматическая: 4 (6%) из 66 с отклонениями.
Контроль: 3 (5%) из 56 с отклонениями |
|
Pildes R.S. et al. (1974) |
После двух лет у 22 из 27 новорожденных, перенесших
гипогликемию, и у 15 из 29 в группе контроля имелись отклонения, выявленные
при неврологическом обследовании. Нет достоверной разницы в отклонениях,
выявленных на ЭЭГ. В 1-4 года нет разницы в уровне IQ, с 5 до 7 лет 13 из 26
с гипогликемией и 6 из 27 контроля имели IQ меньше 86 |
|
Fluge G. (1975) |
Бессимптомная: 1 (14%) из 7 имел ММД. Проходящая симптоматика:
3 (33%) из 9 имели
ММД или серьезную задержку. Вторичная: 4 (19%) из 21 имели ММД
или задержку ПМР |
|
Abel H.T. et al. (1987) |
45% новорожденных, перенесших гипогликемию, имели задержку
психомоторного развития |
|
Singh M. et al. (1991) |
С клиническими проявлениями: MDI (индекс умственного развития)
76,6 ± 10,3; PDI (индекс психомоторного развития) = 74,5 ± 13,1. Без
клинических проявлений: MDI = 93,2±5,7, PDI = 94,0±5,5; контроль: MDI =
92,2±6,2; PDI = 91,1± 6,1. Длительность гипогликемии коррелировала с
неврологическими результатами |
|
Yamaguchi K. et al
(1997) |
15 (11%) из 135 детей имели серьезные неврологические
последствия. DQ (коэффициент развития) в 2 и 5 лет: 103,8±24,2 при
гипогликемии и 116,8±20,7 в контроле; IQ в 6 лет:
97,9± 22,2 и 106,6 ± 20,7 соответственно. Выявленные различия
были статистически недостоверны |
|
Дети от матерей с сахарным диабетом
|
|
Haworth J.C. et al. (1976) |
Гипогликемия: 7 (28%) из 25 имели неврологические нарушения; DQ
= 94 ± 2. У детей без гипогликемии: 4 (33%) из 12 имели неврологические
нарушения, DQ = 98 ± 3 |
|
Persson B., Gentz J. (1984) |
18 новорожденных с глюкозой менее 1,7 ммоль/л: у всех
нормальный IQ. Нет связи между уровнем сахара через 2-4 часа после рождения
и IQ в дальнейшем |
|
Персистирующая гиперинсулинемическая гипогликемия
|
|
Cresto J.C. et al. (1998) |
10 из 26 детей имели неврологические нарушения: 4 – поражение
мозга, 4 – судороги,
2 – легкие моторные нарушения, 4 – IQ < 60 |
|
Dacou-Voutetakis C. et al. (1998) |
13 (100%) из 13 детей имели нормальное психомоторное развитие |
Примечание. В исследовании Kumari S. et al. (1971), на наш
взгляд, неврологический дефицит должен быть определен по отношению к 15, а не
19 детям (4 ведь умерли). Но поскольку авторы рассчитали все показатели на 19
детей, то мы оставили авторскую редакцию и не стали пересчитывать.
Несмотря на недостаточность клинических доказательств того, что
гипогликемия приводит к неврологическим нарушениям, экспериментальных работ,
указывающих, что выраженная и/или длительная гипогликемия коррелирует с
неврологическими повреждениями,
достаточно много. Например, в литературном обзоре Auer R.N. и
Siesjo B. (1993) указывается, что кора головного мозга, гиппокамп и хвостатое
ядро – те области, на которые преимущественно влияет экспериментальная
гипогликемия. Эти авторы указывают на специфичность поражения при этом процессе,
так как при ишемии мозга повреждение будет локализоваться в других областях. С
помощью электронной микроскопии доказано, что поражение нейронов – результат не
просто метаболического истощения, но активного повреждения.
Конечно, у конкретного ребенка, особенно с бессимптомной
гипогликемией, достаточно сложно с большой уверенностью утверждать о повреждении
мозга, тем более что установлены компенсаторные механизмы, препятствующие
развитию повреждений ткани ЦНС. Считают, что прежде всего к этим механизмам
относится использование альтернативных субстратов энергии.
Hernandez M.J. et al. еще в 1980 продемонстрировали, что при
экспериментальной гипогликемии у новорожденных собак утилизация лактата тканями
ЦНС увеличилась на 50%. Исследования Amiel S.A. (1994) показали, что, как и у
взрослых, у новорожденных при гипогликемической коме мозг в повышенном
количестве потребляет лактат. Интересно, что при некоторых вариантах
гипогликемии развившийся лактат-ацидоз является протективным для нейронов. По
крайней мере такой факт доказан для I типа гликогеновой болезни (дефицит
глюкозо-6-фосфатазы) (Fernandes J. et al., 1984).
Таблица 144. Метаболический статус у новорожденных в первые 48
часов жизни (de L Costello M.A. et al., 2000).
|
Показатель
|
0-48 часов (n = 558)
|
0-12 часов (n =162)
|
12-48 часов (n = 396)
|
|
среднее геометрическое (SD) |
диапазон колебаний |
среднее геометрическое (SD) |
диапазон колебаний |
среднее геометрическое (SD) |
диапазон колебаний |
|
Сахар крови
(ммоль/л) |
2,69 (1,47)
|
0,1-5,8
|
2,47 (1,62)
|
0,1-5,8
|
2,79 (1,39)
|
0,1-5,7
|
|
Гидроксибутират
(нмоль/л) |
110 (3,5)
|
2-1338
|
41 (3,5)
|
2-379
|
165 (2,8)
|
2-1338
|
|
Лактат (ммоль/л) |
2,40 (1,50)
|
0,3-12,7
|
2,39 (1,63)
|
0,3-12,7
|
2,4 (1,45)
|
0,7-7,14
|
|
Пируват (нмоль/л) |
136 (1,5)
|
14-322
|
119 (1,6)
|
14-268
|
144 (1,4)
|
43-322
|
|
Глицерол (нмоль/л) |
380 (1,9)
|
35-2313
|
395 (1,8)
|
76-2313
|
374 (1,9)
|
35-1620
|
|
Свободные жирные кислоты (ммоль/л) |
1,03 (1,77)
|
0,1-2,9
|
1,07 (1,98)
|
0,1-2,87
|
1,02 (1,68)
|
0,1-2,85
|
|
ТТГ (mU/l) |
19,3 (2,0)
|
1,4-170
|
31,9 (1,74)
|
7,2-170
|
15,7 (1,9)
|
1,4-55,6
|
|
Свободный Т4 (пмоль/л) |
27,8 (1,4)
|
11-70
|
21,1 (1,32)
|
11-46,4
|
31,1 (1,3)
|
11,9-70
|
|
Инсулин (пмоль/л) |
1,03 (2,5)
|
0,1-7
|
1,17 (2,1)
|
0,1-4,5
|
1,03 (2,7)
|
0,1-7
|
Имеется также достаточно большое количество исследований,
продемонстрировавших (Levitsky L.L. et al., 1977; Dombrowski G.L. et al., 1989;
Nehlig A. et al., 1993), что мозг новорожденного лучше, чем мозг взрослого
(достаточно быстро и в большом количестве) может усваивать кетоновые тела.
Кетоновые тела могут обеспечивать до 10% энергетических потребностей мозга
новорожденного. Некоторые исследователи даже считают, что в отличие от взрослых,
именно кетоновые тела и прежде всего гидроксибутират, а не лактат, являются для
мозга новорожденного ребенка основным альтернативным источником энергии.
Например, продемонстрировано, что при голодании уже в первые сутки жизни
организм доношенного новорожденного увеличивает образование кетоновых тел до 17
нмоль/кг·мин.
Такое высокое образование кетоновых тел возможно у взрослых после
длительного периода голодания. Обнаружена высокая корреляция между уровнем
кетоновых тел и концентрацией свободных жирных кислот у новорожденных. Kalhan
S.C., Saker F. (1997) указывают, что при гиперинсулинизме нейроны ЦНС
новорожденного увеличивают утилизацию жирных кислот на 50%. Таким образом,
данные литературы позволяют сделать вывод о том, что организм новорожденного
ребенка при недостатке глюкозы может мобилизовать жирные кислоты, а также
формировать и утилизировать кетоновые тела. Возможно, что при гипогликемии
задействованы и другие механизмы. Например, Persson B. et al. (1972) и Vannucci
R.C. et al. (1982) доказали, что нейроны ЦНС новорожденного могут окислять и
аминокислоты. Вышесказанное хорошо подтверждают результаты исследования англичан
de L Costello M.A. et al. (2000), проведенного в Непале (см. таблицы 144-145).
Из таблицы 144 видно, что у новорожденных детей в первые 48 часов жизни
достаточно высоки концентрации альтернативных источников энергии. Кроме того, в
этом диапазоне происходит их смена: снижается концентрация лактата, но зато
увеличивается пируват. Другая картина при низкой концентрации глюкозы (см.
таблицу 145). Все альтернативные источники энергии кроме свободных жирных кислот
низки. Вероятно, они интенсивно потребляются.
Таблица 145. Метаболический статус у новорожденных с гипогликемиями (de L Costello M.A. et al. 2000)
|
Источник энергии
|
Среднее геометрическое в 95% доверительном интервале
|
t
|
p
|
|
глюкоза крови < 2,0 (ммоль/л)
n = 66
|
глюкоза крови ≥ 2,0 (ммоль/л)
n = 492
|
|
|
|
Лактат (ммоль/л) |
2,01 (1,76-2,29)
|
2,46 (2,38-2,54)
|
3,86 |
< 0,001 |
|
Пируват (нмоль/л) |
111 (98-126)
|
140 (135-145)
|
4,44 |
< 0,001 |
|
Глицерол (нмоль/л) |
314 (265-373)
|
390 (370-411)
|
2,69 |
0,007 |
|
Гидроксибутират (нмоль/л) |
63 (43-93)
|
118 (106-131)
|
3,80 |
< 0,001 |
|
Свободные жирные кислоты (ммоль/л) |
1,11 (0,97-1,28)
|
1,02 (0,97-1,07)
|
1,07 |
0,28
|
К защитным механизмам при гипогликемиях также относят увеличение
объемной скорости мозгового кровотока. Особенно значительно она увеличивается у
недоношенных при концентрации глюкозы менее 1,7 ммоль/л (Skov L., Pryds O.,
1992).
Классификация неонатальных гипогликемий
Как известно (Шабалов Н.П., 2006), существуют две классификации
неонатальных гипогликемий: клиническая и патогенетическая. Обе они приводятся в
указанном руководстве. Мы приведем только клиническую классификацию,
предложенную Корнблат М. и Швартц Р. в 1976 поскольку в 1993 году они внесли в
нее некоторые изменения, которые не отражены в учебнике Шабалова Н.П. (2006).
Клиническая классификация неонатальных гипогликемий (Cornblath & Schwartz, 1993)
1. Ранняя неонатальная гипогликемия (первые 6-12 часов
жизни). Группа риска: дети с ЗВУР, от матерей с сахарным диабетом, тяжелой ГБН или
асфиксией.
2. Классическая транзиторная гипогликемия (12-48 часов
жизни). Группа риска: недоношенные, дети с ЗВУР, близнецы, полицитемия.
3. Вторичная гипогликемия (независимо от возраста). Группа
риска: сепсис, нарушения температурного режима, внезапное прекращение инфузий глюкозы,
кровоизлияния в надпочечники, поражения нервной системы, у детей, матери
которых перед родами принимали антидиабетические препараты, глюкокортикоиды,
салицилаты.
4. Персистирующая гипогликемия (после 7 суток жизни).
Причины:
а) дефицит гормонов:
– гипопитуитаризм;
– дефицит глюкагона;
– дефицит гормона роста;
– дефицит кортизола;
– сниженная чувствительность к АКТГ;
б) гиперинсулинизм:
– синдром Беквита–Видемана;
– гиперплазия или аденома клеток островков;
– синдром «дизрегуляции» β-клеток (низидиобластоз);
в) болезни, связанные с нарушением синтеза аминокислот:
– болезнь кленового сиропа;
– метилмалоновая ацидемия;
– пропионовая ацидемия;
– тирозинемия;
г) болезни, связанные с нарушением окисления жирных кислот:
– дефицит дегидрогеназы ацетилкоэнзима А длиннои
короткоцепочечных жирных кислот;
д) болезни, связанные с нарушением образования глюкозы печенью:
– I тип гликогенной болезни (дефицит глюкозо-6-фосфатазы)
– галактоземия;
– дефицит гликогенсинтетазы;
– дефицит фруктозо-1,6-дифосфатазы.
Клиника
Известно, что концентрация глюкозы у новорожденного в крови вены
пуповины составляет от 60 до 80% от концентрации в венозной крови матери. Сразу
же после рождения ее концентрация снижается, а через 2-3 часа после рождения
начинает повышаться и стабилизироваться. Это повышение обусловлено «выбросом»
глюкозы печенью и составляет 4-6 мг/кг·мин. Доказано, что у новорожденного
ребенка активируется не только гликогенолиз, но и глюконеогенез. Известно, что
многие патологические процессы могут нарушать механизмы адаптации
новорожденного, и поэтому как и при развитии других форм патологии, при
неонатальной гипогликемии принято выделять факторы риска (см. таблицу 146).
Соответственно, у детей из этих групп необходимо мониторировать концентрацию
глюкозы крови.
Таблица 146. Группы высокого риска новорожденных по развитию
гипогликемии (Cornblath М. et al., 2000)
|
Ассоциированные с изменением метаболизма у матери
|
|
1
|
Введение глюкозы в родах
|
|
2
|
Лекарственные препараты
|
|
А |
тербуталин, ритодрин, пропранолол |
|
В |
оральные противогликемические препараты |
|
3
|
Диабет во время беременности
|
|
Ассоциированные с нарушениями у новорожденного
|
|
1
|
Нарушения адаптации
|
|
2
|
Асфиксия новорожденного
|
|
3
|
Гипотермия
|
|
4
|
Повышение вязкости крови
|
|
5
|
Полицетемический синдром
|
|
6
|
Инфекционный процесс
|
Окончание таблицы 146
|
7
|
Другие
|
|
А |
иатрогенные |
|
В |
врожденные пороки сердца |
|
8
|
Нарушения развития плода
|
|
9
|
Гиперинсулинизм
|
|
10
|
Эндокринные заболевания
|
|
11
|
Нарушения метаболизма
|
К сожалению, каких-либо специфических симптомов гипогликемии не
существует, и поскольку ее клинические проявления могут встречаться при других
заболеваниях периода новорожденности, таких как асфиксия, сепсис, другие
метаболические нарушения, то за рубежом для постановки диагноза «неонатальная
гипогликемия» используют так называемую триаду Whipple's:
1) наличие характерных клинических проявлений гипогликемии;
2) клинические проявления совпадают с низкими концентрациями
глюкозы крови, определенными достоверными и точными методами;
3) клинические проявления исчезают через какое-то время (от нескольких
минут до нескольких часов) после достижения нормогликемии. Считают (Cornblath
М. et al., 2000), что только если имеются все три признака, можно быть
уверенным насчет данного диагноза.
К наиболее частым клиническим симптомам при гипогликемии относят:
– jitteriness (ритмический тремор постоянной амплитуды вокруг
фиксированной оси, часто сочетающийся с повышением мышечного тонуса и периостальных
рефлексов и стойкими рефлексами новорожденных);
– тремор, подергивания;
– раздражительность, повышенный рефлекс Моро, пронзительный
крик (синдром гипервозбудимости);
– судороги;
– апноэ;
– слабость, срыгивания, анорексия;
– цианоз;
– нестабильность температуры;
– кома;
– тахикардия, тахипноэ;
– артериальная гипотензия;
– повышенное потоотделение.
Диагноз
Общепринятым мнением является, что у детей из групп риска первое
определение глюкозы в крови должно быть сделано через 30 минут после рождения, а
далее каждые 3 часа в течение первых двух суток. В последующие трое суток каждые
6 часов, а начиная с 5 суток жизни –
2 раза в сутки. Связано это с тем, что чаще всего низкие
концентрации глюкозы наблюдаются в первые 3 суток (таблица 147).
Таблица 147. Время выявления гипогликемий у новорожденных (Alet H.
еt al., 1987)
|
Дни жизни
|
Число детей
|
% детей с выявленной гипогликемией от общего числа детей
|
|
1
|
81
|
47,6
|
|
2
|
21
|
12,3
|
|
3
|
23
|
13,5
|
|
4
|
25
|
14,6
|
Окончание таблицы 147
|
Дни жизни
|
Число детей
|
% детей с выявленной гипогликемией от общего числа детей
|
|
5
|
11
|
6,5
|
|
6
|
4
|
3,6
|
|
7
|
3
|
2,4
|
|
8-9
|
-
|
-
|
|
10
|
2
|
1,2
|
|
Всего
|
170
|
100%
|
Лечение
Как указывают эксперты ВОЗ (1997), для новорожденных, не имеющих
клинических признаков гипогликемии (бессимптомное течение), концентрация глюкозы
крови должна поддерживаться более 2,6 ммоль/л. Если концентрация глюкозы крови
ниже 2,6 ммоль/л, то:
– новорожденный должен получать питание. Если же он не может
находиться на грудном вскармливании, то ему можно давать молоко (смесь) из
бутылочки или через зонд;
– измерение глюкозы крови должно быть повторено через 1 час и
перед следующим кормлением (через 3 часа). Если концентрация глюкозы менее 2,6
ммоль/л, то надо рассматривать вопрос о внутривенном введении глюкозы;
– если средства для внутривенного введения глюкозы отсутствуют
или недоступны, то дополнительное питание нужно дать через зонд;
– грудное вскармливание должно продолжаться. Имеются разные точки
зрения на то, при каком уровне глюкозы крови должно быть начато парентеральное
введение растворов глюкозы. В нашей стране (Шабалов Н.П., 2006) парентеральное
введение растворов глюкозы начинают при ее концентрации в крови менее 2,2 ммоль/л (за рубежом 2,6 ммоль/л). Хотелось бы отметить, что в
большинстве стран мира применяют растворы декстрозы (с буфером, нейтрализующим
соляную кислоту (стабилизатор)) из-за низкого рН растворов глюкозы (около 3,0).
Иначе это может способствовать прогрессированию метаболического ацидоза,
особенно у больных детей.
Раствор глюкозы начинают вводить из расчета 0,4-0,8 г/кг (2-4 мл
20% раствора глюкозы на кг массы тела) со скоростью не более 1,0 мл в минуту.
Затем переходят на постоянную внутривенную инфузию глюкозы со скоростью 2,4-4,6
мл/кг·час (4-8 мг/кг·мин) 10% раствором глюкозы. При этом нужно учитывать, что
новорожденные с различной патологией имеют неодинаковые потребности в экзогенной
глюкозе (см. таблицу 148). Концентрация глюкозы крови должна быть определена
через 30 минут после начала терапии. Если гипогликемия сохраняется, то скорость
инфузии может быть увеличена до 10 мл/кг·час (15 мг/кг·мин) 10% раствора
глюкозы. У ребенка, получающего вышеуказанную терапию, должна мониторироваться
глюкоза крови, так как возможно развитие гипергликемий (см. ниже).
Таблица 148. Потребности в глюкозе у различных групп новорожденных
|
Группы детей
|
Скорость инфузии глюкозы (мг/кг·мин)
|
|
Доношенные |
3-5
|
|
Недоношенные |
4-6
|
|
«Незрелые» к сроку гестации |
6-8
|
Если для создания или поддержания нормогликемии требуется инфузия
глюкозы более 15 мг/кг·мин, то дальнейшее увеличение скорости и концентрации
вводимой глюкозы нежелательно. В этом случае ребенку должны вводится
контринсулярные препараты, способствующие увеличению концентрации глюкозы крови.
Среди них следующие:
– глюкагон (0,1-0,5 мг/кг внутримышечно 2 раза в сутки).
Побочные эффекты глюкагона: рвота, диарея, гипокалиемия. В высоких дозах стимулирует
выработку инсулина;
– гидрокортизон (5-10 мг/кг в сутки) или преднизолон (2-3 мг/кг
в сутки);
– диазоксид (суточная доза 5-15 мг/кг с возможным увеличением
до 20-25 мг/кг внутрь 3 раза в сутки);
– соматостатин (2-8 мкг/кг·мин внутривенно капельно).
Если у новорожденного отмечается персистирующая гипогликемия,
необходимо установить причину данного состояния. Прежде всего необходима
консультация хирурга по поводу возможного низидиобластоза (необходимость
тотальной или субтотальной резекции поджелудочной железы) или обследование на
врожденные наследственные дефекты метаболизма. В последние десятилетие описано
несколько форм генетически обусловленного гиперинсулинизма (Hawdon J.M. et al.,
1999).
В приложении 14 мы привели данные, опубликованные экспертами ВОЗ,
касающиеся лечения и профилактики неонатальных гипогликемий.
Гипергликемия
Установлено, что гипергликемии у новорожденных встречаются чаще,
чем гипогликемии. Pildes R.S. в 1986 году сообщил, что гипергликемия
выявляется у 20-80% глубоконедоношенных детей.
Испанские исследователи Ruiz M.P. et al. в 1999 году, обследовав
360 новорожденных, находившихся в отделении реанимации, обнаружили гипергликемию
у 51,9% детей. Она отмечена гораздо чаще других метаболических расстройств.
Авторы подчеркивают, что не обнаружили значимых корреляционных связей между
частотой гипергликемий и нозологическими формами, но зато отметили, что
гипергликемия является прогностически неблагоприятным признаком, и концентрация
глюкозы гораздо чаще повышена у детей, впоследствии погибших. На наш взгляд, эти
данные представляют значительный интерес, так как, во-первых, научных
исследований, посвященных гипергликемиям, судя по литературе, гораздо меньше,
чем гипогликемиям, а во-вторых, в клинической практике, по нашему опыту, к
данному виду метаболических расстройств относятся достаточно терпимо. Видимо,
эта практика не совсем правильна в силу ряда причин.
В 2001 году индийские исследователи Pati N.K. et al. обследовали
1179 новорожденных детей, поступивших в детскую больницу г. Дели. Гипергликемия
зарегистрирована у 0,94% новорожденных (11 человек). Вроде бы нечасто, но при
анализе нозологических форм оказалось, что ее имели 2,9% новорожденных с очень
низкой массой тела при рождении, при сепсисе она зарегистрирована у 45% детей,
при рождении в тяжелой асфиксии – у 18% и у 27% новорожденных, перенесших СДР 1
типа.
Beardsall K. et al. (2007) выявили гипергликемию (сахар крови более
10 ммоль/л) у 38% недоношенных детей, обычно на 2-3 сутки жизни.
Критерии
Гипергликемией считают уровень глюкозы более 6,5 ммоль/л натощак и
более 8,9 ммоль/л в любое время.
Что касается этиологии, то Шабалов Н.П. (2006) в своем
руководстве отмечает, что наиболее частая причина неонатальных гипергликемий –
иатрогенная (избыточные вливания концентрированных растворов глюкозы, особенно
струйные). Его мнение согласуется с результатами других исследователей. Так,
Digiacomo J.E. et al. (1992), Pildes R.S., Lilien L.D. et al. (1992) указывают,
что гипергликемия встречается у 5% всех новорожденных, получавших внутривенную
инфузионную терапию, и у 20-40% новорожденных с экстремально низкой массой тела
при рождении, получавших инфузию. Американские исследователи Hays S.P. et al.
(2006) выявили гипергликемию у 50% новорожденных с экстремально низкой массой
тела при рождении.
Согласно их данным, гипергликемия увеличивает не только летальность
среди данной группы пациентов, но и потребность в более жестких параметрах ИВЛ,
а также частоту ретинопатии.
Вероятно, на втором месте среди причин гипергликемий – инфекционный
процесс различной локализации. Считают (Pildes R.S., Lilien L.D. et al., 1992),
что это обусловлено катехоламинами, кортикостероидами, цитокинами, приводящими к
неадекватной секреции инсулина. Мы, обследуя больных с сепсисом, обнаружили
гипергликемию в разгар септического процесса у 100% доношенных детей с
гипоэргическим вариантом и у 79,2% больных с гиперэргическим. Интересно, что
гипогликемия встречалась гораздо реже (0% – при гипоэргическом и 10,8% – при
гиперэргическом), что подтверждает вышеприведенные данные (см. таблицу 141).
Также известно, что гипергликемии достаточно часто встречаются у недоношенных и
«стрессированных» (перенесших асфиксию, синдром дыхательных расстройств и т.д.)
детей. Кроме того, гипергликемии могут быть проявлением транзиторного
неонатального сахарного диабета, хотя он и встречается относительно редко.
Главным негативным последствием повышения концентрации глюкозы
будет изменение осмолярности (гиперосмия) плазмы крови. Повышение концентрации
глюкозы на 18 мг% (1 ммоль/л) увеличивает осмолярность на 1 мосм/л. Считаем
необходимым напомнить, что осмолярность – одна из жестко поддерживаемых констант
организма (все жидкие среды организма, кроме мочи, являются изоосмолярными) (см.
главу 14). Поэтому повышение осмолярности и, как следствие, увеличение
проницаемости гистогематических барьеров и будет определять клиническую картину
гипергликемии, как у детей, так и у взрослых.
Как известно, у детей более старшего возраста и у взрослых при
сахарном диабете может быть гиперосмолярная кома, то есть повышение осмолярности
более 310-320 мосмоль/л приводит к выраженной неврологической симптоматике. У
новорожденных повышение осмолярности приводит не только к выраженному синдрому
угнетения ЦНС, обусловленному отеком мозга, но и к развитию ВЖК со всеми
вытекающими отсюда последствиями (нарушению гемодинамики, дыхательной
недостаточности, судорогам, апноэ и т.д). Заметим (Сурков Д.Н.,
2008), что, строго говоря, повышение осмолярности приводит к
нарушению трансмембранного транспорта и вследствие этого – клеточной дисфункции,
а также вообще к задержке жидкости, но не специфически в головном мозге. Кроме
того, доказано, что отек мозга – это отек глии, астроцитов, и на функцию ЦНС
влияет только опосредованно, через снижение церебральной перфузии по закону
Монро–Келли. Отек нейроцитов – это, собственно, то, что ранее трактовалось как
«отек-набухание» мозга, наступает позднее, и для него нужны веские причины типа
нейротравмы, нейроинфекции или ишемии-аноксии. Особенно это опасно для детей с
гипербилирубинемиями, так как повышение проницаемости гематоэнцефалического
барьера увеличивает нейротоксичность непрямого билирубина. Гипергликемия также
приводит к осмотическому диурезу и, как следствие, к обезвоживанию ребенка и
нарушениям электролитного баланса. Эти факты известны уже около 30 лет (Lilien
L.D., et al.,
1979; Louik C. et al., 1985; Cowett A.A. et al., 1997).
К сожалению, на наш взгляд, повышение осмолярности и негативные
последствия гиперосмии недооцениваются в лечебной практике. Чаще всего
неврологическую симптоматику у ребенка связывают с другими причинами, назначая
не вполне обоснованное лечение. Кроме того, в некоторых стационарах нашей страны
до сих пор широко используют струйные введения лекарственных препаратов, и не
только глюкозы, но и других, подчас забывая о том, что большинство из них
являются осмотически активными веществами. В приложении 15 мы приводим данные
Дюкова Э.В., изучавшего осмолярность некоторых лекарственных препаратов, широко
применяемых в неонатологии.
В 1996-1997 гг. мы изучали влияние инфузионной терапии на
осмотическое давление плазмы при тяжелой перинатальной патологии. Результаты
работы показали, что осмолярность растворов, применяемых для инфузионной терапии
у новорожденных в отделении реанимации, колебалась от 330 до 780 мосмл/л, то
есть все растворы, используемые для стандартной
инфузионной терапии у новорожденных, являются гиперосмолярными. При
неонатальном сепсисе у детей выявлены различия в зависимости от
клинико-лабораторного варианта, выделенного нами (Шабалов Н.П., Иванов Д.О.).
При гипоэргическом варианте осмоляльность плазмы была 309-312 мОсм/кг, а при
гиперэргическом – 298-303 мОсм/кг. При неблагоприятном течении основного
заболевания, прогрессировании сепсиса, ухудшении функции печени и почек
осмотическое давление плазмы значительно возрастало, что сопровождалось
развитием комы, гипербилирубинемии, тяжелым метаболическим ацидозом, повышением
концентрации мочевины и глюкозы крови, появлением микроцитоза. На наш взгляд,
что подтверждается данными литературы (Зильбер А.П., 1984), у реанимационных
больных, в том числе и новорожденных с тяжелой перинатальной патологией,
необходим не только мониторинг концентрации глюкозы крови, но и осмолярности
плазмы, и контроль осмолярности вводимых растворов для оптимизации терапии и
профилактики возможных осложнений.
Лечение
В доступной литературе имеются указания на различные концентрации
глюкозы, требующие назначения инсулина. Наверное, здесь необходимо коснуться
данного вопроса более подробно, поскольку с данным препаратом связывались
определенные надежды в практике интенсивной терапии. Дело в том, что в последнее
десятилетие многие научные исследования были связаны с попытками разработки
стратегий, позволяющих предотвращать или купировать развитие полиорганной
недостаточности, в том числе при тяжелом сепсисе и септическом шоке. Одна из
этих стратегий – так называемая интенсивная терапия инсулином. К сожалению,
большинство из них не показало положительных результатов. Что касается
стратегии, связанной с лечением инсулином, на наш взгляд, она тоже уходит в
прошлое, но об этом судить читателю, мы приведем только факты.
До 2001 года гипергликемию у больных, находящихся в критическом
состоянии, рассматривали как компенсаторную реакцию, связанную с усиленным
поступлением глюкозы в инсулиннезависимые ткани, и прежде всего ЦНС. Кроме того,
умеренная гипергликемия рассматривалась как буфер против гипогликемии,
повреждающей нейроны. В 2001 году появилась большое, рандомизированное,
знаменитое исследование Van den Berghe G. et al., показавших, что предотвращение
даже умеренной гипергликемии в течение развития критического состояния
существенно улучшает результат. Кроме снижения летальности в 2 раза у больных в
ОРИТ интенсивная терапия инсулином даже незначительной гипергликемии, по
результатам многочисленных исследований (Van den Berghe G. et al. 2001; Mizock
B.A., 2001; Weekers F. et al., 2002; Krinsley J.S., 2004; Mesotten D. et al.,
2004; Vanhorebeek I. et al., 2004), снижала частоту тяжелых госпитальных
инфекций, ОПН, дисфункции печени и т.д.
Приведем более подробно результаты только одного исследования,
выполненного коллективом исследователей под руководством Van den Berghe G.
(2001). Они показали, что в хирургических отделениях интенсивной терапии
применение инсулина снижает летальность в 2 раза (см. рисунок 79). Особенно
существенно снижается летальность при сепсисе. Кроме того, внутрибольничная
летальность снижается на 34%, частота ОПН, требующая проведения гемодиализа или
гемофильтрации – на 41%, частота переливания эритромассы – на 50%. Исследование
было проспективным, рандомизированным и включало 1548 больных.
Чтобы не утомлять читателя (а при желании найти работы на эту тему
не составляет труда), мы не будем приводить других данных. Укажем только на то,
что за 6-7 лет были уточнены и открыты многочисленные эффекты инсулина
(некоторые мы описали выше): нейропротективный, устранение дислипопротеинемии,
анаболический, антивоспалительный, предотвращение эндотелиальной дисфункции и
гиперкоагуляции, антиапоптический и т.д. Казалось, что в результате всех этих
исследований родилась новая стратегия, которая позволит, регулируя
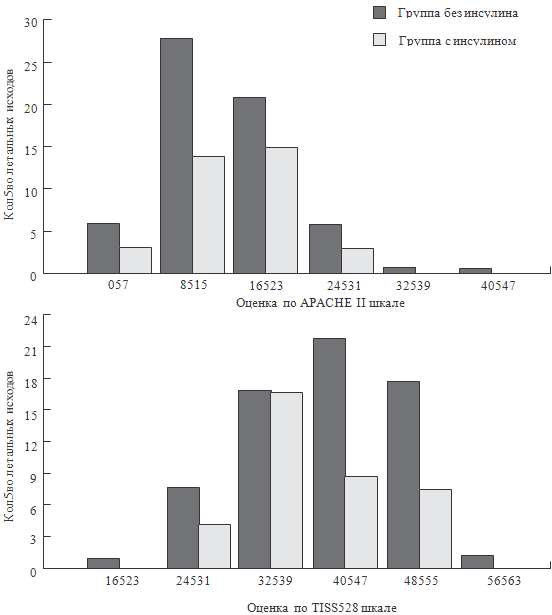
Рисунок 79. Летальность больных в ОРИТ при лечении инсулином (Van
den Berghe G. et al., 2001)
метаболизм у больных, находящихся в критическом состоянии, снизить
летальность прежде всего за счет профилактики развития ПОН. Но...
В 2006 году указанные авторы провели еще одно проспективное,
рандомизированное исследование, включившее более 1600 больных с гипергликемией,
находящихся в ОРИТ. Было выделено две группы больных: первая – использование
инсулина начиналось при концентрации глюкозы крови = 4,4-6,1 ммоль/л (группа
интенсивной инсулинотерапии»; вторая – использование инсулина начиналось при
концентрации глюкозы крови более 12 ммоль/л. Оказалось, что «интенсивная
инсулинотерапия» приводит к нормогликемии, уменьшает длительность ИВЛ,
пребывание больного в ОРИТ и в стационаре, частоту ОПН, но никак не влияет на
летальность. Так, внутрибольничная летальность была 37,7% во второй группе и
40,0% – в первой.
Таким образом, указанные авторы в двух полностью сравнимых по
дизайну исследованиях получили достаточно противоречивые результаты. Конечно,
публикация данных 2006 года говорит об их высокой научной честности и мужестве,
но служит еще одним предупреждением о необходимости многократной проверки новых
методов лечения. Ярким примером этого положения является еще одна значительная
работа, касающаяся данного вопроса.
В 2008 году были опубликованы результаты исследования, проведенного
Brunkhorst F.M. et al. по применению инсулина у больных с гипергликемией в
структуре сепсиса. Исследование было многоцентровым, «двойным слепым»,
рандомизированным, включало 537 больных. Оказалось, что хоть применение инсулина
и приводит к нормогликемии, но не влияет на летальность и частоту развития
синдрома полиорганной недостаточности. Более того, применение «интенсивной
терапии инсулином» приводит к длительному пребыванию больных в ОРИТ, что привело
к необходимости досрочного прерывания исследования. С другой стороны, применение
инсулина более чем в 4 раза учащает развитие тяжелой гипогликемии. Именно с
эффектами гипогликемии (ухудшением функции ЦНС и сердца) авторы связывают
увеличение длительности пребывания больных в ОРИТ. Они также указывают, что
заранее спрогнозировать развитие гипогликемии у конкретного больного невозможно.
Может быть, развитие гипогликемии является маркером тяжелого течения основного
заболевания, а не только результатом инсулинотерапии. Интересно, что кроме
оценки терапии инсулином, авторы сравнили влияние низкомолекулярного раствора
гидроксиэтилкрахмала и раствора Рингера. Оказалось, что терапия
гидроксиэтилкрахмалом достоверно чаще вызывала развитие ОПН и необходимость
замещения почечных функций. С увеличением количества доз токсичность
гидроксиэтилкрахмалов увеличивается (см. рисунок 80), то есть у него отмечается
явно выраженный кумулятивный эффект.
Нам представляется, что эти данные должны иметь для российских
врачей определенный интерес, поскольку ГЭК широко представлен в наших
стационарах, а вот, к сожалению, крупных и тщательно спланированных исследований
в нашей стране по изучению их влияния проведено явно недостаточно.
Мы не призываем не применять данную группу препаратов, но данные
Brunkhorst F.M. et al. (2008) диктуют необходимость определиться, когда, где, у
кого, и не на основе «личного мнения» пусть даже авторитетных врачей в России и
за рубежом, а на основе тщательно спланированных научных исследований.
Что касается новорожденных, то установлено (см. таблицу 149), что
назначение инсулина детям, родившимся с экстремально низкой массой тела, с
гипергликемией приводит к нормогликемии, улучшению прибавок веса. Нет корректных
исследований, позволяющих сделать такие же выводы, касающиеся детей с массой
тела более 1000 г и нет работ по «интенсивной терапии инсулином» у новорожденных
детей. Данные большинства исследований (доступных нам), посвященных применению
инсулина у новорожденных детей представлены в таблице 149.
Когда все же необходимо назначать инсулин при гипергликемии
новорожденных? В большинстве зарубежных руководств, переведенных на русский
язык, присутствуют указания на концентрацию глюкозы более 12-13 ммоль/л. Hey E.
(2005) считает, что у глубоконедоношенных детей концентрация глюкозы крови,
требующая коррекции инсулином, 15 ммоль/л, потому что именно при такой
концентрации в крови концентрация в моче глюкозы составляет
2%. Это приводит к «осмотическому» диурезу и дегидратации. При
указанном уровне глюкозы после уменьшения скорости введения и концентрации
вводимой глюкозы, назначается инсулин в дозе с 0,05-0,1 ЕД/кг·час с увеличением
при необходимости. Необходимо помнить о том, что назначение инсулина требует
мониторирования уровня глюкозы крови. Первый анализ должен быть произведен не
более чем через 30-40 минут после начала введения инсулина.
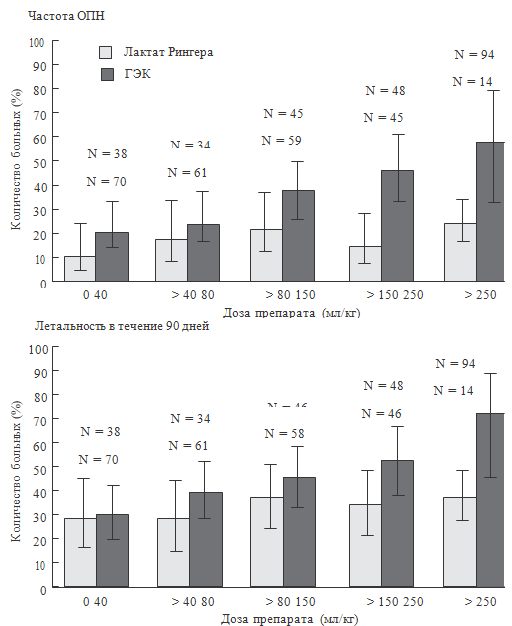
Рисунок 80. Влияние гидроксиэтилкрахмала на частоту ОПН и
летальность у септических больных (Brunkhorst F.M. et al., 2008)
NB. Подчеркнем, что поскольку инсулин далеко не безобидный
препарат, то лучше не доводить больного до состояния гипергликемии, что, к
сожалению, нередко случается в повседневной практике, а для этого необходимо
тщательно рассчитывать углеводные нагрузки, получаемые ребенком.
В заключение указываем калорийность и осмолярность различных
растворов глюкозы:
1 мл 5 % р-ра глюкозы = 0,17 ккал, 278 мосм/л;
1 мл 10% р-ра глюкозы = 0,34 ккал, 523 мосм/л;
1 мл 15% р-ра глюкозы = 0,51 ккал, 801 мосм/л;
1 мл 20% р-ра глюкозы = 0,68 ккал, 1079 мосм/л;
1 мл 40% р-ра глюкозы = 1,36 ккал, 2158 мосм/л.
Таблица 149. Сводные литературные данные и
основные результаты применения инсулина у новорожденных детей
|
Авторы, страна |
Исследуемая группа
|
Тип исследования (уровень доказательности)
|
Итог
|
Основные результаты
|
Комментарии
|
|
Meetze et al. (1998), США |
Дети с ЭНМТ на 2-й день жизни (n = 56). Уровень глюкозы
венозной крови возрастал максимум на 12 мг/кг/мин.
Дети с гипергликемией разделены на 2 группы: получавшие инсулин
(n = 12) и отмена глюкозы (n = 11). Контрольная группа – дети
с нормогликемией (n=33). Гипергликемией считалось однократное
определение
сахара больше 13,3 ммоль/л или повторное определение больше
8,8 ммоль/л (по крайней мере за 4 часа) |
Рандомизированное контролируемое исследование (1b) |
Уровень сахара |
Нормогликемия: 14/14
в группе с инсулином и 9/11 в группе с отменой глюкозы.
Гипогликемии (менее 3,3
не было ни в одной из групп) |
Маленькое количество детей. Процедура рандомизации
не объяснена. Анализ
не основан на цели лечения (2 ребенка с отменой глюкозы попали
в группу
с инсулином). Неясно, почему дети с инсулином потребляли меньше
калорий, белков и жиров, чем дети
в контрольной группе. Энтеральное питание не контролировалось
протоколом исследования. Не сравнивались весовые прибавки в
различных группах |
|
День достижения
60 ккал/кг/сут (небелковой энергии) |
Группа с инсулином: 5,5±0,6 дней, с отменой глюкозы:
8,6±1,3 дней; контрольная группа: 4,1±0,2 дней (p < 0,01) |
|
Collins et al. (1991), США |
Дети с ЭНМТ (n = 24)
с гиперлипидемией были разделены на группы: получавшие инсулин
на фоне полного парентерального питания (n = 12) и контрольная группа (n =
12), получавшая стандартный уход. Стремились достичь потребления
120 ккал/кг/сут. Плохая толерантность к глюкозе в контрольной
группе
корригировалась снижением количества внутривенно вводимой
глюкозы до уровня сахара крови < 9,9 ммоль/л без глюкозурии.
Гипергликемией считался уровень сахара > 9,9 ммоль/л с
глюкозурией |
Рандомизированное контролируемое исследование (1b) |
Уровень глюкозы |
Нормогликемия
(3,9-7,7 ммоль/л) была достигнута в обеих группах. Эпизоды
гипогликемии
(< 2,2 ммоль/л) отмечались
в 4 из 1848 (0,2%) измерениях |
Маленькое количество детей. Скорость введения глюкозы была
выше, чем обычно используется в клинич. практике. Частота сепсиса
в контрольной группе была достоверно выше (p < 0,05) |
|
Калораж (небелковая энергия) |
Группа с инсулином:
124,7±18,0 ккал/кг·сутки. Контрольная группа: 86,0±6,0 ккал/кг·сут
(p < 0,01) |
|
Прибавки массы |
Группа с инсулином:
20,1±12,1. Контрольная группа:7,8±5,1 г/кг/день (p < 0,01) |
Окончание таблицы 149
|
Авторы, страна |
Исследуемая группа
|
Тип исследования (уровень доказательности)
|
Итог
|
Основные результаты
|
Комментарии
|
|
Binder et al. (1989), США |
Ретроспективное изучение
76 детей с ЭНМТ, имевших гипергликемию, 34 из которых получали
инсулин, а 42 – нет. Гипергликемией считался уровень сахара крови, при
котором отмечалась глюкозурия
0,5% |
Серия случаев (4) |
Уровень глюкозы |
Гипогликемия (сахар крови
< 2,2 ммоль/л) 26/7368 (0,5%)
измерений |
Ретроспективный обзор нескольких случаев. В группе с инсулином
был достоверно более низкий гестационный возраст и вес при рождении.
Несмотря на более низкий
вес при рождении в группе с инсулином, потеря веса
в этой группе была больше |
|
День достижения калоража
100 ккал/кг·сут. |
Группа с инсулином: 15±8 дней, без инсулина: 17±11 дней
(p = 0,21) |
|
День достижения веса при рождении |
Группа с инсулином: 12±6 дней, без инсулина 13±6 (p = 0,34) |
|
Heron
и Bourchier (1988), Новая Зеландия |
Дети с массой < 1250 г (n = 15)
с гипергликемией, получавшие инсулин |
Серия случаев (4) |
Уровень сахара |
Гипогликемия (сахар
<2 ммоль/л): 28/998 (2,8%)
измерений |
Мало детей, неконтролируемое исследование. Верхняя граница
гипогликемии ниже, чем общепринятая (2,2 ммоль/л) |
|
Калораж |
Увеличился после инфузии инсулина с 60,8±25,1
до 79,9±24,5 ккал/кг·сут. (p < 0,001) |
|
Ostertag et al. (1986), США |
Дети с ЭНМТ (n = 10)
с гипергликемией, получавшие инсулин |
Серия случаев (4) |
Уровень глюкозы |
Гипогликемии (≤ 1,4 ммоль/л)
не было |
Мало детей, неконтролируемое исследование. Верхняя граница
гипогликемии ниже, чем общепринятая (2,2 ммоль/л) |
|
Калораж |
Увеличился после введения инсулина с 49,5±32
до 70,4±21 ккал/кг·сут. (p < 0,01) |
|
Прибавки веса |
С –23±39 увеличился до +13±34 г/сут.
(p < 0,01) |
|
Vaucher et al. (1982), США |
Дети с ЭНМТ (n = 10)
с гипергликемией, получавшие инсулин |
Серия случаев (4) |
Уровень глюкозы |
Гипогликемия (< 1,4 ммоль/л):
< 1% от всех измерений |
Мало детей, неконтролируемое исследование. Верхняя граница
гипогликемии ниже, чем общепринятая (2,2 ммоль/л) |
|
Каллораж |
Увеличился после введения инсулина с 29до 56 ккал/кг·сут. |
|
Прибавки веса |
Прибавка веса у 8 из 10 |
НЕОНАТАЛЬНЫЙ САХАРНЫЙ ДИАБЕТ
Неонатальный диабет редкое (частота 1:300 000 – 1:400 000
новорожденных) заболевание, характеризующиеся гипергликемией и низкими
концентрациями инсулина. По клиническим признакам, а в настоящее время и по
этиологии (см. ниже) выделяют два типа (формы) неонатального диабета:
транзиторный и перманентный. Транзиторный неонатальный сахарный диабет –
заболевание, связанное с нарушением активности β-клеток поджелудочной железы. Он
составляет 50-60% случаев от неонатального диабета. Нет клинических признаков,
позволяющих предсказать, будет ли неонатальный диабет транзиторным или
перманентным. В последние десятилетия были сделаны исследования, позволяющие
понять молекулярные механизмы развития поджелудочной железы и дифференцировать
два типа неонатального диабета. Polak M., Cav Н. (2007) читают, что расшифровка
этиологии и патогенеза этого заболевания приведет к разработке
дифференцированной терапии – инъекции инсулина или пероральных
гипогликемизирующих препаратов (даже у новорожденных детей).
Как мы уже отмечали, по этиологии (см. таблицу 149а) различают два
типа (формы) неонатального диабета: транзиторный и перманентный.
Таблица 149а. Этиология двух форм неонатального диабета (Polak M.,
Cav Н., 2007).
Мутации в гене ABCC8 (SUR1) и реже KCNJ11 (Kir6.2)
Клиническая картина
Для неонатального диабета характерна стойкая гипергликемия,
отсутствие или плохие прибавки массы тела, у некоторых детей отмечается
выраженное обезвоживание, кетоацидоз с выраженностью до комы. Характерны низкие
концентрации инсулина в крови. При транзиторном сахарном диабете, в отличие от
перманентного, дети чаще рождаются с задержкой физического развития (см. таблицу
149б). Задержка физического развития у плодов особенно выражена в последний
триместр беременности.
Таблица 149б. Клинические особенности при транзиторном (ТСДН) и
перманентном (ПСДН) сахарном диабете новорожденных (Brunkow M.E. et al., 2001)
|
Клинический признак
|
ТСДН (n = 29)
|
ПСДН (n = 21)
|
Р
|
|
Срок гестации (нед.) |
38,2 ± 2,2
|
39,2 ± 1,6
|
P = 0,15
|
|
Вес при рождении (г) |
1987 ± 510
|
2497 ± 690
|
P < 0,006
|
|
Рост при рождении (см) |
44,3 ± 3,4
|
47,5 ± 2,4
|
P < 0,006
|
|
Окружность головы (см) |
31,5 ± 1,8
|
33 ± 1,9
|
P < 0,02
|
|
ЗВУР |
74%
|
36%
|
P < 0,03
|
|
Средний возраст постановки диагноза (диапазон)* |
6 (1-81)
|
27 (1-127)
|
P < 0,01
|
|
Начальная доза инсулина (ЕД/кг/сутки) |
0,6 ± 0,25
|
1,4 ± 1,2
|
P < 0,006
|
Примечание. * – учитывая негауссовское распределение детей,
исследуемых групп, по возрасту использовался непараметрический U-тест Mann–Whitney,
чтобы сравнить возраст в этих двух группах.
При дополнительном лабораторном обследовании у детей с транзиторным
диабетом не обнаруживают антител к β-клеткам поджелудочной железы и гаплотипам 2
класса HLA, ассоциированных с диабетом 1 типа. Экзокринная недостаточность
поджелудочной железы нарушена не у всех детей. Однако клеточный дефект при ТСДН
в настоящее время не установлен. Большинство больных поправляются в течение
года, но некоторые имеют персистирующие нарушения толерантности к глюкозе или
развивают в более старшем возрасте сахарный диабет. Не совсем ясен у данной
категории больных патогенез диабета: дефицит инсулина и/или резестентность к
нему. В более старшем возрасте постоянная гипергликемия, требующая терапии
инсулином, развивается у большинства больных. Так, Metz C. et al. (2002),
показали, что сахарный диабет развился у 5 из 7 больных, перенесших ТСДН, в
возрасте старше 8 лет. В 2000 году Temple I.K. et al. продемонстрировали, что
сахарный диабет развился у 11 из 18 больных, имевших транзиторный неонатальный
диабет, после 4 лет жизни. Анализируя представленные в указанных работах данные,
Polak M., Cav Н. (2007) приходят к заключению, что транзиторный неонатальный
диабет является постоянным дефектом клеток поджелудочной железы с переменной
экспрессией в течение роста и развития.
Хотя при обеих формах неонатального диабета достаточно часто
встречаются пороки развития, но фенотипически дети отличаются (см. таблицу
149в).
Таблица 149в. Фенотипические особенности детей при двух формах
неонатального диабета (Marquis Е. et al., 2002).
|
Транзиторный
|
Перманентный
|
|
Недостаточность митрального клапана, гипотериоз,
β-талассемия |
Дисплазия легких, высокое кровяное давление |
|
Каортация аорты, эпифезарная дисплазия, высокое кровяное
давление |
Гипоганадизм |
|
Множественные эпифизарные дисплазии |
Агенезия щитовидной железы, дисплазия поджелудочной железы,
повреждение почек и печени |
|
Агенезия левой почки, атрофия вещества мозга |
Транспозиция магистральных сосудов, стеноз пульмональной
артерии |
|
Макроглосия, пупочная крыжа |
Миопия |
|
Кардиомегалия |
Врожденный стридор |
|
Нарушения роста |
|
Гипоплазия мозжечка |
Что касается, перманентного сахарного диабета, то в исследовании,
проведенным Iafusco D. et al. (2002) было продемонстрировано, что дети
заболевшие в первое полугодие жизни в 6 раз чаще имели «защитные» аллели HLA
системы против классического диабета 1 типа, по сравнению с детьми, заболевшими
во втором полугодии. Кроме того, у детей, заболевших рано, в 5 раз реже
встречались аутоиммунные маркеры.
Транзиторный сахарный диабет обычно развивается спорадически, хотя
треть больных имеют установленную генетическую предрасположенность по линии
отца. При этом не все отцы больны диабетом (von Muhlendahl K.E. et al., 1995).
Некоторые больные имеют частичное удвоение длинного плеча 6 отцовской хромосомы
(6q24). В этой области находятся два гена (Arima T. et al., 2001). Один
кодирующий фактор транскрипции ZAC, регулирующий деление клетки и апоптоз, а
также гипофизарную аденилатциклазу, активирующую полипептидный рецептор 1 и
являющуюся мощным активатором секреции инсулина. Второй ген – HYMAI, функция
которого в настоящее время неизвестна. В 2002 году было произведено
экспериментальное моделирование ТСДН (Ma D. et al.). В геном мыши был внедрен
локус 6q24. У мышат развилось состояние, клинически очень сходное с транзиторным
сахарным диабетом новорожденных, хотя и имевших особенности.
Отцовская передача данного локуса приводила к развитию
гипергликемии и увеличению риска развития диабета у мышат. Интересно, что данный
эксперимент установил уменьшение
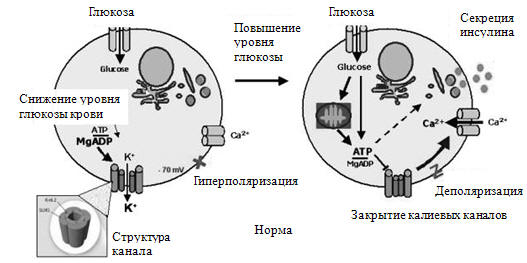
Рисунок 80а. Механизм секреция инсулина у здоровых людей (Polak M.,
Cav Н., 2007)
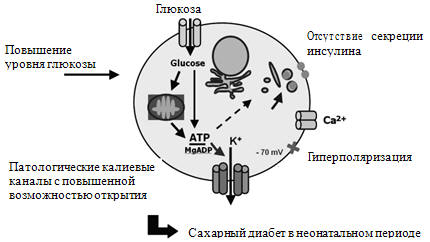
Рисунок 80б. Изменение секреции инсулина при генетически измененном
калиевом канале (Polak M., Cav Н., 2007)
экспрессии ключевого фактора транскрипции PDX-1 в эмбриональной
поджелудочной железе мышей. Однако конкретный клеточный дефект, приводящий к
нарушению синтеза инсулина, остается неизвестным.
При перманентном сахарном диабете по крайнем мере у 50% больных
установлена мутация в гене, кодируещего субъединицу АТФ-чувствительных калиевых
каналов, находящихся в β-клетках поджелудочной железы. Наличие этой мутации
приводит к тому, что канал находится постоянно в открытом состоянии, что делает
невозможным выделение инсулина (см. рисунки 80а, 80б). В настоящее время описано
9 мутаций в указанном гене. Некоторые из этих мутаций встречаются и при
транзиторном сахарном диабете и диабете 2 типа у более старших детей, что
заставляет предполагать их генетическую общность (Gloyn A.L. et al., 2005;
Babenko A.P. et al., 2006).
В настоящее время выделяют многочисленные наследственные синдромы,
ассоциированные с перманентным сахарным диабетом новорожденных.
Агенезия поджелудочной железы и промотер-фактор 1 инсулина (IPF1).
Впервые ребенок с установленным нарушением гена, кодирующего промотер-фактор
1 инсулина, и агенезией поджелудочной железы был описан Jonsson J. et al. в 1994 году.
Ребенок был гомозиготен по делеции единственного нуклиотида в 63 кодоне. Данный
фактор регулирует эндокринное и экзокринное развитие поджелудочной железы. В
2000 году Vaulont S. et al. показали, что он является регулятором инсулина и
экспрессии гена самотостатина. Позже Stoffers D.A. et al. (1998) была описана
семья, имевшая в 6 поколениях 8 больных с ранним началом диабета 2 типа. Они
были индентифицированы как гетерозиготы по той же мутации. Исследования,
проведенные в последнее десятилетия, показали, что 6% больных диабетом 2 типа во
Франции имеют мутации в гене, кодирующем промотер-фактор 1 инсулина.
Гомозиготные аномалии в гене, кодирующем глюкокиназу. Мутации в
указанном гене обычно приводят к умерено выраженной гипергликемии (Velho G.,
Froguel P., 1998). Глюкокиназа является регулятором метаболизма в β-клетках
поджелудочной железы, контролирует уровень секреции инсулина. Njolstad P.R. et
al. в 2001 году описали две семьи (норвежскую и итальянскую), имевших больных
различными типа диабета. В этих семьях родились дети, у которых в первый день
жизни манифестировал классический перманентный сахарный диабет. При анализе
оказалось, что они являются гомозиготами по мутации в гене, кодирующем
глюкокиназу. Их родители были гетерозиготами по той же мутации и обладали
пониженной толерантностью к глюкозе. Polak M., Cav Н. (2007) считают, что если
оба родители имеют пониженную толерантность к глюкозе, то они должны быть
обследованы на наличие мутаций в указанном гене.
Иммунная дизрегуляция, полиэндокринопатия, энтеропатия, Х-связанная
– IPEXсиндром. В 1996 году Peake J.E. et al. сообщили об мутации Х
хромосомы, сопровождающейся эксфолиативным дерматитом, диареей, гемолитической
анемией, аутоиммунным поражением щитовидной железы и неонатальным диабетом. Дети
умирают на первом году жизни от сепсиса. У некоторых детей описана агенезия
островков Лангерганса. Аутоиммунная природа этого синдрома подтверждалась
успешной терапией цитостатиками (Satake N. et al., 1993; Baud O. et al., 2001).
Позже у больных были индентифицированы антитела к глутаминовой декарбоксилазе.
Применение имуносупрессивной терапии как этапа подготовки к трансплантации
костного мозга приводило к купированию сахарного диабета, а затем диарее и
дерматита. Установлено, что данная мутация приводит к усиленной пролиферации CD4
+/CD8-T-лимфоцитов с мультиорганной инфильтрацией. В результате этого
развивается гемофагоцитический синдром и мальчики без лечения погибают на 15-25
день после рождения (Brunkow M.E. et al., 2001).
Синдром Wolcott–Rallison. Это аутосомно рецессивное
заболевание, характеризующиеся ранним началом сахарного диабета, обычно в
неонатальный период, и спондилоэпифезарными нарушениями роста. У больных часто
отмечается гепатомегалия, задержка умственного развития, почечная
недостаточность, ранняя смерть. В 2000 году Delepine M. et al. описали двух
подобных детей в разных семьях, имеющих мутацию 2р12. В данном локусе находится
ген, являющийся регулятором синтеза инсулина и белков в β-клетках поджелудочной
железы.
Christen H.J. et al. в 1992 году описали двух мальчиков с
Х-связанной высокой активностью фосфорибозил-АТФ пирофосфотазой, развивших
перманентный сахарный диабет в первый день жизни. Нарушенная толерантность к
глюкозе сохранилась в течение жизни, хотя бывали периоды ремиссии и больные не
нуждались в инсулине. Оба ребенка кроме сахарного диабета имели задержку
психического развития, атаксию и прогрессивную аксональную невропатию. Матери
мальчиков страдали падагрой и гестационным диабетом.
Yorifuji T. et al. в 1994 году опубликовали клиническое описание
новорожденных детей с перманентным сахарным диабетом ассоциированным с
выраженной гипоплазией поджелудочной железы (головки и хвоста), врожденным
«синим» пороком сердца. Не все дети в описанной семье имели манифестирование
сахарного диабета в неонатальный период. Клинические проявления и манифест
диабета зависели от степени гипоплазии.
В 1999 году была описана семья, имевшая 3 детей с перманентным
сахарным диабетом новорожденных и гипоплазией мозжечка (Hoveyda N. et al.,
1999). Установлен аутосомнорецессивный тип наследования. Все дети не дожили до 1
года и погибли от метаболических расстройств, дыхательной недостаточности,
сепсиса. Позже Sellick G.S. et al. (2004) было установлено, что есть много
специфических активаторов транскрипции, регулирующих экспрессию генов в
β-клетках поджелудочной железы и нейронов. Данный синдром связан с мутацией
PTF1A фактора транскрипции, регулирующий развитие поджелудочной железы, а также
экспрессированный в мозжечке.
Недавно, в 2006 году, мутации, описанные Senee V. et al., в другом
гене транскрипции (Glis3) объяснили синдром, имеющий комплекс признаков:
сахарный диабет новорожденных, гипотиреоз, врожденную глаукому, кисты в почках,
фиброз печени.
Имеются единичные описания (Otonkoski T. et al., 2000),
указывающие, что инфицирование энтеровирусом (ECHO вирус 6) беременной
женщины в конце первого триместра беременности приводит к развитию аутоиммунных
реакций с развитием сахарного диабета у новорожденного и присутствием
антиинсулиновых антител, а также антител к карбоксилазе глутаминовой кислоты при
рождении или сразу после рождения. У больной девочки, описанной в указанном
исследовании, имелась гипоплазия поджелудочной железы, возможно, вызванная
действием вируса или указанных антител.
Наконец, перманентный неонатальный сахарный диабет может входить в
структуру митохондриальных болезней (Metz C. et al., 2002).
Терапия. Основным лекарственным препаратом для лечения данного
заболевания является инсулин. Не существует единого мнения о пути введения и
дозе инсулина. Например, французские педиатры (Polak M., Cav Н., 2007)
рекомендуют его вводить микроструйно подкожно, хотя в клиниках нашей страны чаще
используют инъекции под кожу или внутривенно. Рекомендуемая доза инсулина –
0,1-1,0 ЕД/кг/сутки (у Шабалова Н.П. (2006) – 0,04-0,1 ЕД/кг/час), разведенного
в минимальном количестве изотонического хлорида натрия (4-10 ЕД в 1,0 мл).
Именно на такой дозе Polak M., Cav Н. (2007) удалось достичь длительной
нормогликемии у детей с неонатальным сахарным диабетом. Кроме того, авторы
подчеркивают, что, по их данным, микроструйное подкожное введение инсулина
гораздо менее травматично и опасно, чем его иньекции. Конечно, при терапии
инсулином должен определяться уровень глюкозы крови каждые 3-4 часа. Кроме того,
считают (Шабалов Н.П., 2006), что должен мониторироваться уровень натрия, калия,
кальция и КОС.
Прогноз должен формулироваться крайне осторожно, только после
обсуждения с эндокринологом и генетиком, установления типа диабета, наличия или
отсутствия генетического синдрома и наследственной предрасположенности. |