
Глава 4. НЕКОТОРЫЕ ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ РАЗВИТИЯ
СТРЕСС-ИНДУЦИРОВАННОЙ ПАТОЛОГИИ
В предыдущих главах уже рассматривались вопросы патогенеза ряда
патологических процессов, формирующихся и развивающихся на основе последствий
стрессового воздействия, в частности боевого стресса. В настоящей главе
поднимаются вопросы единства многих клинических вариантов патологии, имеющих
общее этиопатогенетическое начало, а именно воздействие стресс-фактора с
формированием в дальнейшем на его основе ПТСР. Эти вопросы представляются весьма
сложными и в значительной степени спорными, и сегодня отсутствует единая
концепция развития так называемой стресс-индуцированной патологии, в том числе
на основе боевого стресса и его ближайших последствий. Поэтому, на наш взгляд,
при рассмотрении вопросов патогенеза стресс-индуцированной патологии, в том
числе у ветеранов боевых действий, страдающих ПТСР, необходимо бывает
акцентировать внимание на двух аспектах: 1) на возможности рассмотрения
стресс-индуцированной патологии и «фонового» для нее ПТСР в качестве единого
патологического процесса, возможно, одной, но клинически полиморфной нозологии
(как эпилепсия, например); 2) на подразделении стресс-индуцированной патологии
на множество клинических вариантов, нозологий, включая сюда и ПТСР, но при
единых или взаимосвязанных механизмах патогенеза указанных нозологий. И тот, и
другой варианты, по нашему мнению, не противоречат друг другу, но предполагают
ряд различий в проведении профилактических, лечебных мероприятий и в
прогнозировании, в том числе долгосрочном, связанном не только с предполагаемыми
исходами некоторых заболеваний у лиц, непосредственно подвергшихся стрессовому
воздействию, но и у членов их семей, у детей.
В начале данной главы хотелось бы вновь охарактеризовать некоторые основные
принципы так называемой дизрегуляционной патологии нервной системы, являющейся,
с одной стороны, непосредственным следствием воздействия стресс-фактора, с
другой, первичным звеном сложной взаимоподдерживающейся патологической системы,
о которой было сказано в предыдущей главе. Патогенетическим принципом так
называемой дизрегуляционной патологии нервной системы, как известно, является
нарушение соотношения систем ее химической регуляции, другими словами -
соразмерности этих систем. Система регуляции - многоуровневая и включает
низкомолекулярные регуляторы (ацетилхолин, допамин, норадреналин, адреналин,
серотонин, глутамат, ГАМК, оксид азота), регуляторные пептиды (эндокринные,
иммунные, опиоидные, кортикотропин-релизинг фактор, адрено-кортико-тропный
гормон, соматотропный гормон и др.), систему нейротрофических ростовых факторов
- NGF, BDNF, TNF, VEGF, Ig (Гомазков О.А., 2009). При этом преобладание одних и
недостаточность других регуляторов являются не только следствием воздействия
ряда внутренних и внешних факторов, но и может быть наследственно
детерминировано.
Непосредственно стрессовая реакция характеризуется увеличением выделения
кортизола, катехоламинов, и при развитии ПТСР эта реакция приобретает более
интенсивный характер вследствие изменения функций стресс-лимитирующей системы,
и, как показано в ряде исследований (Mason J.W., Giller E.L., Kosten T.R., et al.,
1988; Yehuda R., Halligan S.L., Grossman R. et al., 2002), при ПТСР может
наблюдаться пониженное содержание кортизола в крови, изменение его циркадного
ритма секреции. Нарушения адаптации организма к повторным стрессам, которые
присутствуют при ПТСР, заключаются в длительной гормональной нагрузке и
неспособности «выключить» стресс-ответ. Таким образом, если при
непродолжительном стрессовом воздействии кортизол и катехоламины проявляют свои
защитные и адаптивные функции, то при повторных, хронических стрессах, при
дизрегуляции нейрогормонального ответа на стресс включается уже патогенетическое
действие названных биохимических агентов (McEven B., 2009). Изменения
затрагивают и рецепторный аппарат. Происходит уменьшение альфа-2-адренэргических
рецепторов и снижение содержания моноаминоксидазы, увеличение числа рецепторов к
кортизолу в гиппокампе (Yehuda R., 2005; Bedi U.S., Arora R., 2007; Ursano R.J.,
Zhang L., 2009), уменьшение объема гиппокампа и префронтальной коры (Bedi U.S.,
Arora R., 2007). Дисбаланс наблюдается в нейротрансмиттерных системах,
ответственных за лимитирующие функции в реализации стресс-реакции. Если в
состоянии покоя дисбаланс проявляется коморбидными ПТСР синдромами, то в
состоянии стресса происходит патологическая стрессовая реакция с изменением
нейрогенных механизмов. Данный многоуровневый процесс Д.С. Эверли и Р.
Розенфельд (1985) определили в качестве реакции через прямую нейронную
иннервацию «концевых» органов, реакцию «борьбы и бегства» через нейроэндокринные
механизмы, реализующиеся, в свою очередь, через общий адаптационный синдром с
вовлечением гипоталамо-гипофизарно-надпочечниковой и симпатоадреналовой систем.
С течением времени формируются дегенеративные изменения в ЦНС, которые
определяют клинические проявления ПТСР, причем каждые группы симптомов ПТСР
характеризуются определенными поведенческими нарушениями и психопатологическими
состояниями, которые сопровождаются и/или являются следствием дисбаланса
нейротрансмиттерных систем. Так, недостаточность ГАМК, опиоидных пептидов
приводит к хроническим болям, тревожности, агрессивности; повышение
норадреналина и адреналина проявляется ощущениями страха, кошмарными
сновидениям, повышением АД, сердцебиением, патологией со стороны желудка;
снижение серотонина приводит к депрессии, хроническим болям; снижение допамина -
к постепенной потере уровня мотиваций, двигательной активности, к когнитивным
нарушениям, хроническим болям, к слабости верхнего сфинктера желудка. Частое
сопровождение ПТСР чрезмерным употреблением алкоголя на начальном этапе связано
с пониженным содержанием эндогенных опиоидных пептидов, ГАМК, допамина и
повышенной реактивностью симпатоадреналовой системы (Воробьева О.В., Русая В.В.,
2010). Коморбидные состояния ПТСР в каждом случае представлены сочетанием
психопатологических симптомов при различной степени их выраженности.
На основании сказанного можно думать о том, что на начальном этапе развития
патологии у ветеранов боевых действий происходит формирование изменений в
системе нейромедиаторов ЦНС. При хроническом же или интенсивном стрессе
возникает усиленная секреция кортизола и адреналина, которая выражается как в
увеличении выделяемого количества этих веществ в единицу времени, так и в
продолжительности секреции надпочечниками. Ограничения этого процесса при ПТСР
не происходит в результате изменений стресс-лимитирующей системы, а именно
дисбаланса ее нейротрансмиттерной составляющей на уровне ГАМК, серотонина,
допамина, норадреналина, а также эндогенных опиоидных пептидов. В состоянии
покоя данные изменения проявляются, в первую очередь, психопатологическими
нарушениями, формированием нейродегенеративных изменений, которые усиливаются
постконтузионными. При стрессе возникает плохо контролируемая нейроэндокринная
реакция организма, выражающаяся, прежде всего, в интенсивности реакции на
внешние воздействия. Простой пример - резкое вздрагивание на внезапный шум, т.е.
повышенная, неадекватная реакция на раздражитель. Такой гиперинтенсивный тип
реагирования в нашем исследовании отметили 61 (37,9%) ветеран, и он коррелировал
с интенсивностью ПТСР (r=0,61; р=0,001). Так, интенсивность ПТСР при резком
вздрагивании была 73,5±1,4 балла, а при отсутствии такого гиперинтенсивного типа
реагирования – 56,3±1,4 балла (F=64,9; р=0,001). Немедленная гиперинтенсивная
стрессовая реакция на звук, естественно, сопровождается выбросом норадреналина
на фоне гиперактивности симпатоадреналовой системы. Особенностью подобного рода
реакции является также закрепление в памяти пациентов на рефлекторном уровне
ситуаций, напоминающих пережитый боевой стресс.
Основу интегративной функции мозга составляют три системы – вегетативная,
нейроэндокринная и иммунная (Lane R.D., Waldstein S.R., Critchley H.D. et al.,
2009). Взаимосвязь этих систем определяет адаптивные возможности организма,
содержание его гомеостатических реакций при различных стрессовых факторах.
Изучение соматической патологии у ветеранов с ПТСР выявило определенную
этапность ее развития, связанную в основном с тремя моментами: а) возрастом
ветеранов; б) периодом, прошедшим после окончания боевых действий; в) процессами
ускоренного старения ветеранов. В табл. 61 представлены данные о клинических
вариантах манифестации ряда заболеваний в зависимости от периода, прошедшего
после окончания боевых действий.
Таблица 61. Варианты клинической манифестации заболеваний в
разные периоды после окончания участия в боевых действиях (n-%)
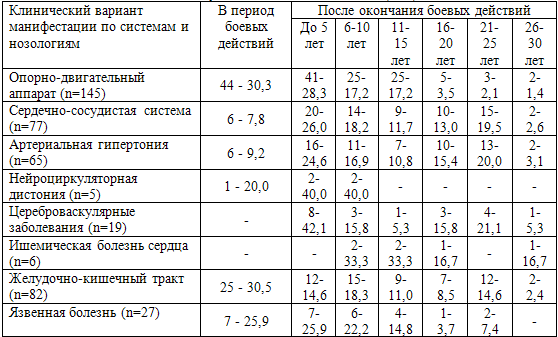
Раннее развитие патологии опорно-двигательного аппарата является, по нашему
мнению, следствием чрезмерной физической нагрузки в период боевых действий.
Именно в период боевых действий у 44 (30,3%) ветеранов произошла клиническая
манифестация заболеваний опорно-двигательного аппарата. При рентгенологическом
обследовании позвоночника у всех 100% пациентов определялась патология в виде
врожденных, посттравматических и дегенеративных изменений, у 27,8% ветеранов
сформировались хронические боли в нижней части спины. Вероятно, немаловажным
фактором, который приводит к хроническим болям в нижней части спины, является
лечение данной группы пациентов без учета последствий боевого стресса. Наше
исследование убедительно показало, что данный вид хронических болей был связан с
ПТСР (р=0,003) и его выраженностью (р=0,038). Изменения в ЦНС при ПТСР приводят
к снижению антиноцицептивного контроля и, как следствие, к усилению центральной
сенситизации боли и нейрогенному воспалению. Формирование хронической боли в
мышцах часто связано с двигательной дисфункцией и патологией
опорно-двигательного аппарата, хроническим стрессом и связанным с ним изменением
интегративного контроля ЦНС. Таким образом, хроническая боль в нижней части
спины у пациентов с ПТСР является результатом как дезадаптивных
нейропластических процессов в ЦНС (Niddam D.M., Hsieh J.-C., 2009), так и
дегенеративных изменений опорно-двигательного аппарата, которые формируются не
только в период нахождения в зоне боевых действий, но и часто выступают в
качестве врожденной патологии.
Клиническая манифестация заболеваний сердечно-сосудистой системы в основном
происходила в первые 10 лет после участия в боевых действиях, и чаще всего
диагностировалась артериальная гипертония. Возрастной фактор имел важное
значение в развитии цереброваскулярной патологии, но клиническая манифестация
цереброваскулярных болезней происходила чаще в первые 5 послевоенных лет, что
подтверждает роль боевого стресса и его последствий в развитии более ранних
атеросклеротических изменений сосудов. В этот период возраст ветеранов боевых
действий был также значительно моложе (р=0,006).
Гиперфункция симпатоадреналовой системы способствует развитию
сердечно-сосудистой патологии посредством действия катехоламинов на сердце,
сосуды и функции тромбоцита. Наше исследование показало этапность развития
сердечно-сосудистой патологии у пациентов с ПТСР. Формирование ее происходит
очень постепенно, в течение 15-25 лет. Вначале основную роль здесь играют
изменения, связанные с последствиями боевого стресса, но в дальнейшем патология
развивается в соответствии с возрастными закономерностями. Имеются данные о том,
что изменения функциональной активности префронтальной коры при хроническом
стрессе могут быть связаны с контролем уровня АД, а повышение активности
миндалин приводит к развитию атеросклероза (McEvan B., 2009; Roy M., Shohamy D.,
Wager T.D., 2012). Степень выраженности ПТСР может постепенно снижаться по мере
увеличения послевоенного периода аналогично тому, что было отмечено у бывших
участников Великой Отечественной войны (Мякотных В.С., Боровкова Т.А., 2009).
При этом запущенный боевым стрессом и следующим за ним ПТСР ускоренный процесс
формирования и развития сердечно-сосудистой патологии, в том числе на основе
атеросклероза и связанной с ним гиперлипидемии, переходит в новую,
возрастзависимую стадию и становится неразрывно связанным уже более с процессом
старения организма в целом, чем с воздействием ПТСР.
Нарушения липидного обмена могут проявляться под воздействием стресс-факторов
и даже без формирования ПТСР. А вот само ПТСР, развивающееся уже в
постстрессовом периоде, в силу принципиально различных по отношению к стрессу
патогенетических механизмов уже не способствует ускоренному развитию
гиперлипидемии, а следовательно, и атеросклероза, что и показано в наших
наблюдениях. Выявляемая у ветеранов современных боевых действий гиперлипидемия
не находится в прямой зависимости от выраженности ПТСР, а связана более с
увеличением возраста. С увеличением периода времени, прошедшего после участия в
боевых действиях, и при параллельном снижении выраженности ПТСР
сердечно-сосудистая патология, связанная с атеросклерозом и нарастающими
расстройствами обмена липидов, наоборот, становится клинически более выраженной.
Таким образом, с годами развитие атеросклероза становится в значительной степени
более зависимым не столько от ПТСР, сколько от процесса старения, который
формируется у ветеранов боевых действий ускоренными темпами. Кроме того, в
сложную палитру биохимических процессов человеческого организма включен
холестерол, участвующий в синтезе кортизола в надпочечниках (Северин Е.С.,
2003). Возможно, это не столь большая составляющая холестеринового обмена в
целом, но у ветеранов боевых действий, страдающих ПТСР, на фоне частого
пристрастия к алкоголю и последствий перенесенных инфекционных заболеваний она
играет немаловажную роль, в особенности на начальном этапе развития
сердечно-сосудистой патологии. Таким образом, последствия боевого стресса в
сочетании с особыми условиями ведения боевых действий (территориальными,
эпидемическими, психологическими и т.д.), рассматриваемыми в нашей стране в
качестве афгано-чеченского синдрома или синдрома современных локальных войн,
могут приводить к ПТСР и, как следствие, к дизрегуляции
гипоталамо-гипофизарно-надпочечниковой системы, нарушениям липидного обмена и в
принципе к отчетливым нарушениям гомеостаза. Об этом свидетельствует
полиорганный характер заболеваний, в первую очередь сердечно-сосудистых.
Происходит замыкание патогенетической цепи в кольцо, в так называемый
патогенетический порочный круг. Именно данный порочный круг на начальных этапах
формирования и развития сердечно-сосудистых заболеваний, до 40-45-летнего
возраста, и является сложным, многозвенным триггером, «запускающим» все новые и
новые очаги-мишени сердечно-сосудистой патологии. Затем, на фоне старения, пусть
и в ускоренном патологическом режиме, дальнейшее развитие сердечно-сосудистой
патологии подчиняется более законам именно данного процесса старения согласно
популяционным закономерностям. Воздействие целого ряда социальных,
экономических, материальных и других факторов мирного времени становится более
значимым, чем ПТСР, но, тем не менее, ПТСР и запущенные им звенья описанного
порочного круга не утрачивают полностью своей роли в дальнейшем патогенезе
сердечно-сосудистой патологии.
Изучение патологии желудочно-кишечного тракта участников современных боевых
действий также выявило ряд особенностей, имеющих важное значение в патогенезе
некоторых заболеваний. Например, язвенная болезнь желудка и 12-перстной кишки
диагностировалась в первые 10 лет после участия в боевых действиях. Пациенты в
этот период реадаптировались к мирной жизни, и этот процесс реадаптации нередко
сопровождался стрессами этой мирной жизни, которые, конечно же, отягощали
последствия боевого стресса. Нарушение адаптации и острые стрессовые реакции
этого уже мирного периода являлись, пожалуй, основным патогенетическим моментом
формирования и развития патологии желудочно-кишечного тракта. Кислотозависимая
патология желудка и 12-перстной кишки оказалась характерной именно для более
позднего периода по отношению к срокам окончания боевых действий, а
диагностированные гастриты относились к В и С типу. Но особенно часто у
пациентов выявлялась гастроэзофагеальная рефлюксная болезнь.
Уровень патогенности воздействия хеликобактера (Hp) на слизистую желудка и
12-перстной кишки зависел, как правило, от психопатологического состояния
пациента. У ветеранов боевых действий Hp чаще сочетался с выраженными ПТСР (F=7,5;
р=0,016): при положительных пробах на Нр выраженность ПТСР среди пациентов,
страдающих заболеваниями желудочно-кишечного тракта, была 66,2±2,2 балла, при
отрицательных пробах – на уровне 53,7±4,47 баллов (р=0,04).
Обсемененность Нр оказалась отчетливо связанной с длительностью периода,
прошедшего после участия в боевых действиях. В период первых 15 послевоенных лет
обсемененность Нр встречалась у 80% обследованных, в период же от 20 до 30 лет –
у 57,1% (p<0,001). Полученные данные подтверждаются результатами исследований
других авторов, свидетельствующих о том, что постстрессовые нейроэндокринные
нарушения приводят к нарушениям не только моторной функции желудочно-кишечного
тракта, но и к изменению иммунного ответа организма. При этом изменение
иммунитета у ветеранов боевых действий с ПТСР имеет свои закономерности и
определяется как вторичное иммунодефицитное состояние нейрогенной природы (Mayer
E.A., 2000). Стресс в сочетании с наследственной предрасположенностью
обусловливает дезинтеграцию неспецифических систем мозга, расстройства адаптации
в форме эмоциональных, эндокринных и иммунных сдвигов (Гусев Е.И., Скворцова
В.И., 2002; Mayer E.A., 2000), и в конечном итоге ослабленный иммунитет
способствует обсемененности Нр.
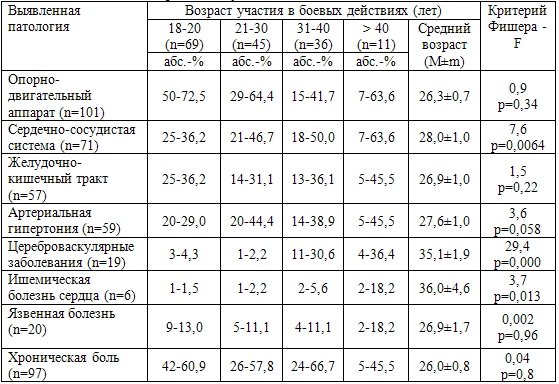
Имел значение возраст участников боевых действий в период их участия в
военных конфликтах (табл. 62). В возрасте до 20 лет системой-мишенью в первую
очередь является опорно-двигательный аппарат. Физиологически в этот период
завершается его рост и формирование, а выраженные физические нагрузки в период
боевых действий на фоне боевого стресса и травм приводят к развитию заболеваний
позвоночника и суставов. Патология сердечно-сосудистой системы, особенно
развитие атеросклеротического процесса, чаще развивается у ветеранов,
принимавших участие в боевых действиях в возрасте старше 30 лет (р=0,0064).
Возрастной зависимости патологии желудочно-кишечного тракта не выявлено.
Развитие данной патологии, особенно язвенной болезни, имело многофакторный
характер. Таким образом, боевой стресс и ПТСР в разном возрасте «выбирают»
разные органы-мишени и системы-мишени.
Таблица 62. Выявленная соматическая патология и возраст, а
котором пострадавшие принимали участие в боевых действиях
Отчетливая связь хронического болевого синдрома с ПТСР может
свидетельствовать об общей сущности патологического процесса, заключающегося в
изменении прежде всего лимитирующих антисистем. Большая распространенность ПТСР
в структуре хронических болей (свыше 90%) показывает, что изменения происходят
не только в ноцицептивной системе ЦНС, но и затрагивают центры, включающиеся в
ограничение и контроль стрессовой реакции. Среди хронических болей в нашем
исследовании преобладали хронические головные боли и хронические боли в нижней
части спины, хотя хронические головные боли имели связь не только с ПТСР, но и с
перенесенными черепно-мозговыми травмами, особенно повторными. В качестве
причинных факторов развития хронических головных болей пациенты чаще всего
отмечали стрессы, отрицательные эмоции. Формирование хронической боли в нижней
части спины, как уже отмечено, также было связано не только с ПТСР, но и с
дегенеративными изменениями в опорно-двигательном аппарате. Обращает на себя
внимание двунаправленность хронических болей. С одной стороны, формирование
изменений в ЦНС у лиц, страдающих ПТСР, формирует основу развития хронической
боли, с другой, патологические изменения внутренних органов, проявляющиеся
болевым синдромом, являются источником ноцицепции; происходит усиление
афферентной периферической импульсации, приводящей к центральной сенситизации.
Подобным образом при нарушенных лимитирующих системах формируется хроническая
боль.
Исследователей в области так называемой послевоенной медицины продолжают
занимать вопросы алкогольной и наркотической зависимости бывших участников
боевых действий, их ускоренного старения, возможных генетических изменений,
возникающих в ответ на воздействие полученных боевых травм в сочетании с боевым
же стрессом и ПТСР. Интерес к результатам таких исследований достаточно высок
еще и потому, что их можно в определенной степени экстраполировать и на другие,
более широкие категории лиц, подвергавшихся стрессовому воздействию, например,
жертвам преступных нападений, терроризма, тяжелых транспортных и техногенных
катастроф и т.д.
При развитии ПТСР в сочетании с последствиями ранений и травм у пострадавших
наблюдаются различного рода психопатологические симптомы и синдромы,
разнообразная соматическая, сомато-неврологическая патология. Данный комплекс
взаимосвязанных и взаимозависимых между собой патологических процессов,
естественно способствует активизации ускоренного, патологического старения
участников боевых действий (Мякотных В.С., Ямпольская В.В., Самойлова В.Н. и
др., 2007; Мякотных В.С., 2009). На наш взгляд, не последнюю роль в этом
процессе ускоренного старения и формирования полипатологических комплексов
играет сформировавшаяся после получения боевой черепно-мозговой травмы и боевого
же стресса алкогольная зависимость, получившая, по нашим данным (Мякотных В.С.,
2009), широкое распространение среди участников современных боевых действий - до
77,42%.
Думается, что процессы ускоренного, патологического старения связаны с
последствиями боевых травм, стрессами, алкогольной зависимостью не напрямую, а
через нарастающие нарушения вегетативной, нейрогуморальной регуляции
деятельности различных систем организма, в первую очередь, сердечно–сосудистой
системы. И оснований для подобного рода утверждения достаточно. Хорошо известно,
например, что получение даже легкой боевой травмы головного мозга приводит к
появлению стойких посттравматических изменений (Мякотных В.С., 1994, 2009), в
том числе выраженных вегетативных расстройств, развитию раннего атеросклероза,
артериальной гипертонии, недостаточности мозгового кровообращения (Шутов А.А.,
Шерман М.А., 2003; Мякотных В.С., Боровкова Т.А., 2009). При этом развивающаяся
алкогольная зависимость в сочетании с последствиями боевой черепно-мозговой
травмы и ускоренным старением не могут не сказаться на изменениях, происходящих
в системах перекисного окисления липидов (ПОЛ) и антиокислительной защиты
организма (АОЗ), тем более, что указанные системы уже достаточно давно признаны
ответственными за процессы старения в целом, в том числе патологического,
связанного с развитием и накоплением многих заболеваний (Ястребов А.П.,
Мещанинов В.Н., 2005).
Тем не менее, проблема алкогольной зависимости на сегодня остается достаточно
сложной и весьма далекой от своего решения, в том числе и среди лиц,
подвергшихся стрессовому воздействию.
Комитет экспертов ВОЗ по лекарственной зависимости включил этиловый спирт в
число веществ алкогольно–барбитурового ряда, вызывающих болезненное пристрастие
и, в конечном счете, зависимость, (Энтин Г.М. и др., 2002). К свойствам
этилового спирта, ставящим его в один ряд с наркотическими веществами, относятся
следующие.
1. Способность при длительном употреблении вызывать болезненное влечение,
т.е. потребность в приеме опьяняющих доз алкоголя с целью достижения эйфории с
последующей аналгезией.
2. Нарастание толерантности к алкоголю при длительном его употреблении и
потребности его употребления во все возрастающих дозах, вызывающих тот же эффект
опьянения.
3. Возникновение и становление алкогольного абстинентного синдрома,
проявляющегося в соматоневрологических и психических нарушениях при выходе
алкоголя из организма и снимаемых или облегчаемых приемом определенной дозы
спиртных напитков.
4. Способность вызывать острые, подострые, затяжные и хронические алкогольные
психозы, а также нарушение поведения и специфические изменения личности.
5. Выраженное общетоксическое действие, проявляющееся сначала в
функциональных, а затем в органических поражениях внутренних органов и нервной
системы.
Алкогольная зависимость – это процесс, имеющий свое начало, свои этапы, свой
финал и протекающий с той или иной скоростью. По своей болезненной сути это
психическая болезнь, и решающим аргументом в пользу отнесения алкогольной
зависимости к психическим заболеваниям служит патологическое влечение к
алкоголю, а головной мозг является органом–мишенью для воздействия этилового
спирта.
Все клинические синдромы алкогольной зависимости, и неврастеноподобный на 1–й
стадии, и абстинентный на 2–й, и деградация личности на 3–й, сформировались по
одной схеме – они образованы патологическим влечением к алкоголю в «обрамлении»
различных постинтоксикационных расстройств. Именно различия в тяжести и
устойчивости последствий алкогольной интоксикации лежат в основе стадийности
алкогольной зависимости, составляя суть качественных особенностей отдельных
стадий. С целью преодоления искусственного разрыва сплошного процесса в 1988
году предложено внести в клинический обиход две переходные стадии алкогольной
зависимости – I–II и II–III. Традиционные же три стадии отмечены соответственно
тремя кардинальными клиническими синдромами алкогольной зависимости –
патологическим влечением к алкоголю, алкогольным абстинентным синдромом,
алкогольной деградацией, которые последовательно дополняют собой картину болезни
по мере ее развития. Динамика алкогольной зависимости характеризуется, помимо
изменяющейся симптоматики, также и скоростью этих изменений. Соответственно
этому, выделяются высокий, средний и низкий темпы прогредиентности заболевания,
каждый из которых, как правило, изначально присущ тому или иному конкретному
больному.
Имеет значение также тип злоупотребления алкоголем – постоянный,
периодический (истинные и ложные запои), смешанный (перемежающие).
Влияние алкоголя на организм человека, его жизнедеятельность и функции
проявляется в 3–х различных направлениях (Иванец Н.Н., 2002).
1–е. Алкоголь специфически влияет на определенные системы и структуры мозга,
вызывая развитие синдрома зависимости. Именно этот синдром является ведущим в
клинической картине заболевания.
2–е. Алкоголь обладает токсическим воздействием практически на все внутренние
органы и системы организма. Токсическое поражение различных органов не связано
напрямую с проявлением синдрома зависимости, но временная нетрудоспособность,
инвалидизация, смертность больных чаще всего обусловлены именно последствиями и
осложнениями токсического эффекта алкоголя.
3–е. Сегодня уже несомненно влияние наркологической патологии родителей на
потомство. У детей алкоголиков существенно повышен риск развития этого
заболевания. У большинства из них выступают различные характерологические,
поведенческие расстройства: повышенная возбудимость, агрессивность, склонность к
риску, депрессии.
Нейрофизиологические механизмы развития зависимости от алкоголя базируются в
стволовых и лимбических структурах мозга, в тех его областях, где располагается
так называемая система подкрепления. Она участвует в обеспечении регуляции
эмоционального состояния, настроения, мотивационной сферы, психофизического
тонуса, поведения человека в целом, его адаптации к окружающей среде.
Воздействие алкоголя приводит к интенсивному выбросу из депо в лимбических
структурах мозга нейромедиаторов из группы катехоламинов, в первую очередь
дофамина, и как следствие – к значительно более сильному возбуждению системы
подкрепления. Такое возбуждение нередко сопровождается положительно окрашенными
эмоциональными переживаниями. При длительном употреблении алкоголя может
развиться дефицит нейромедиаторов, причем угрожающий жизнедеятельности организма
в целом. В качестве механизма компенсации этого явления выступают усиленный
синтез катехоламинов и подавление активности ферментов их метаболизма, в первую
очередь моноаминоксидазы и дофамин–бета-гидроксилазы, контролирующей превращение
дофамина в норадреналин. Таким образом, стимулируемый очередным приемом алкоголя
выброс катехоламинов и их ускоренное разрушение сочетаются с компенсаторно
усиленным синтезом этих медиаторов. Происходит формирование ускоренного
кругооборота катехоламинов. При прекращении приема алкоголя остается ускоренный
синтез катехоламинов, изменяется активность ферментов, и в мозге накапливается
дофамин. Именно этот процесс обусловливает развитие основных клинических
признаков абстинентного синдрома – тревожности, напряженности, возбуждения,
подъема АД, ускорения пульса, появления вегетативных расстройств, нарушений сна,
возникновения психотических состояний. Эти изменения нейрохимических функций
мозга являются основой формирования уже физической зависимости от психоактивных
препаратов.
Для алкогольной зависимости как хронически протекающего заболевания можно
выделить 4 основных типа течения (Энтин Г.М. и др., 2002): 1) прогредиентный, 2)
стационарный, 3) ремитирующий, 4) регредиентный. В первом типе выделяется, кроме
того, а) злокачественный или высокопрогридиентный тип течения, б) прогредиентный
с быстрым течением, в) малопрогредиентный тип течения.
При отсутствии лечения и соответствующего социального воздействия,
направленного на пресечение дальнейшего пьянства, прогноз при алкогольной
зависимости остается неблагоприятным. При изучении причин смертности больных
выявлено, что средний возраст умерших – 51,8 лет, средняя продолжительность
жизни после первого обращения к врачу – 3 года. Причины смерти: заболевания
внутренних органов – 18,7%, заболевания сердечно–сосудистой системы – 15,3%,
новообразования – 12,7%, поражения ЦНС – 6%, суициды – 8%, несчастные случаи –
10,7%, насильственная смерть – 7,3%. (Иванец Н.Н., 2002; Энтин Г.М. и др.,
2002). С другой стороны, имеются работы, в которых показано неблагоприятное,
отягощающее прогноз заболевания и вызывающее негативную динамику
неврологического статуса, побочное действие ряда препаратов, используемых при
лечении хронического алкоголизма, в частности нейролептиков (Мякотных В.С.,
2009); и это тоже проблема.
Сейчас уже общеизвестно, что многие лица, перенесшие черепно-мозговые травмы,
в том числе боевые, начинали употреблять алкоголь, стремясь купировать возникшие
астено–невротические проявления. У этих пациентов быстро, в среднем через 2–3
года, формировался абстинентный алкогольный синдром, даже вне похмельных явлений
были выражены аффективные нарушения, в особенности в виде частых дисфорий на
общем сниженном фоне настроения (Мякотных В.С., 2009).
В своих исследованиях мы попытались детально проанализировать целый ряд
особенностей травматической болезни головного мозга, инициированной боевой
травмой, при сочетании указанной патологии с развившейся в посттравматическом
периоде алкогольной зависимостью. Проводилось сравнение двух групп больных: 1) с
последствиями закрытой боевой травмой головного мозга и алкогольной зависимостью
(n=105); 2) с последствиями аналогичной травмы, но без признаков алкогольной
зависимости (n=48). Классификационно травма во всех случаях относилась к
категории легкой, хроническая алкогольная зависимость была 2-й стадии.
Уже при первых сравнениях субъективных проявлений патологии определяются
отчетливые различия по группам наблюдений (рис. 17).
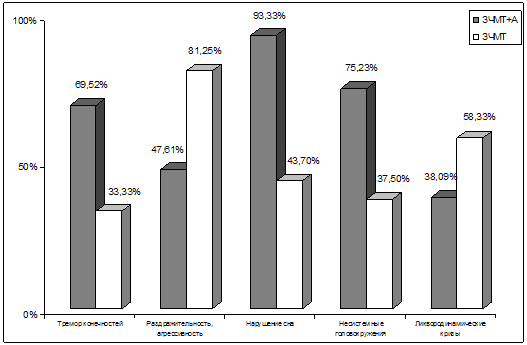
Рис. 17. Графические показатели наиболее отчетливых
различий в субъективных проявлениях церебральной патологии у больных 2–х групп.
Примечание: ЗЧМТ – закрытая черепно-мозговая травма; А – алкогольная
зависимость
Наиболее частой жалобой у пациентов обеих групп была головная боль. При этом
у пациентов с алкогольной зависимостью головные боли встречались несколько чаще
(94,28%), чем среди лиц без таковой (87,50%), и имели характер гипертензионных,
ликвородинамических (р<0,05). Также чаще при алкогольной зависимости пациенты
предъявляли жалобы на повышенную потливость, тремор конечностей (р<0,05).
Последнее скорее всего обусловлено тем, что данный симптом встречается
практически облигатно в структуре алкогольного абстинентного синдрома.
Самой частой жалобой после головной боли у пациентов с сочетанной
алкогольно-травматической патологией были диссомнические расстройства (n=98;
93,33%), которые встречались достоверно чаще (р<0,01), чем только при
последствиях боевой черепно-мозговой травмы (n=21; 43,70%). Преимущественно
отмечались нарушения засыпания, поверхностный малоэффективный сон, а также
различные парасомнии – сноговорения, стереотипные кошмарные сновидения, в том
числе связанные с пережитой боевой обстановкой.
Пациенты без признаков алкогольной зависимости жаловались на
повышенную раздражительность, агрессивность достоверно (р<0,05) чаще (n=39;
81,25%), чем пациенты с сочетанной травматически-алкогольной патологией (n=50;
47,61%). Возможно, это объясняется тем, что частая и массивная алкоголизация
вызывает «притупление» эмоций. При этом сами пациенты нередко заявляли о том,
что очередной прием алкоголя был им необходим именно с целью снятия
начинающегося раздражения.
Также значительно чаще при алкогольной зависимости страдала память, нарушения
которой проявлялись преимущественно фиксационной гипомнезии. Высказано
предположение о том, что мнестические расстройства происходят вследствие
нарастания корковых и внутренних атрофий головного мозга, диффузного
аксонального повреждения и стойкого нарушения таламо–кортикальных связей,
запущенных травмой, но хронический алкоголизм несомненно «помогает» развитию
данного патологического процесса и способствует дальнейшему развитию нарушений
памяти.
То же самое можно сказать и о головокружениях несистемного характера, на
которые пациенты с алкогольной зависимостью жаловались в 2 раза чаще (р<0,05),
чем пациенты только с последствиями боевой черепно-мозговой травмы. Вероятно, на
фоне алкогольной зависимости происходит нарастание запущенных травмой типичных
расстройств кровообращения в вертебрально–базиллярном сосудистом бассейне.
Различия в состоянии объективного неврологического статуса касались в
основном нарушений мышечного тонуса, координации и чувствительных нарушений
(рис. 18). Чувствительные нарушения выявлялись обычно в форме поверхностной
гипестезии различной локализации. При этом у 19 из 105 (18,1%) больных,
страдавших алкогольной зависимостью, имели место незначительно выраженные
чувствительные нарушения полиневритического характера по типу гипестезии, но с
характерным субъективным ощущением «жжения», преимущественно на уровне
дистальных отделов нижних конечностей, которые сочетались с чувствительными же
расстройствами церебрального генеза. Указанная симптоматика подтверждалась и
результатами проведенных электронейромиографических исследований. Это
свидетельствует о том, что у больных с последствиями черепно-мозговых травм при
развитии у них хронической алкогольной зависимости типичные сенсорные феномены
периферического уровня могут развиваться достаточно рано, во 2–й стадии
хронического алкоголизма и при относительно небольшом его стаже.
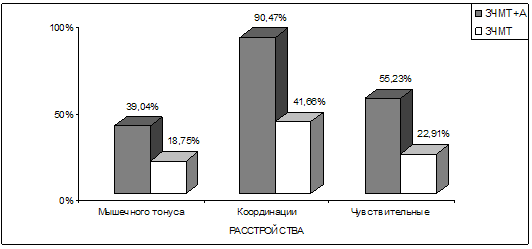
Рис. 18. Графические показатели наиболее отчетливых
различий в объективной неврологической симптоматике у больных 2–х групп.
Примечание: ЗЧМТ – закрытая черепно-мозговая травма; А – алкогольная
зависимость
Имели место отчетливые различия и в структуре выделенных нами ведущих
неврологических синдромов (рис. 19).
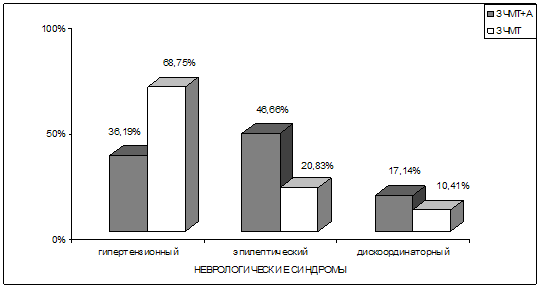
Рис. 19. Результаты сравнительного анализа ведущих
неврологических синдромов у пациентов 2–х групп наблюдения.
Примечание: ЗЧМТ – закрытая черепно-мозговая травма; А – алкогольная
зависимость
У больных с последствиями черепно-мозговой травмы, не сопровождавшимися
хронической алкогольной зависимостью, достоверно (р<0,05) чаще, чем при
сочетанной алкогольно-травматической патологии, встречался и выступал в качестве
преобладающего в клинической картине заболевания гипертензионный синдром
(соответственно в 68,75% и 36,19%). У пациентов же с сочетанной алкогольно–травматической
патологией также достоверно (р<0,05) чаще, чем при исключительно последствиях
боевой травмы мозга, оказался представленным в клинической картине заболевания
эпилептический синдром, то есть симптоматическая эпилепсия (соответственно в
46,66% и 20,83%). Это согласуется с тем, что злоупотребление алкоголем может
провоцировать и способствовать развитию эпилептического процесса (Мякотных В.С.,
1994, 2009). Что касается гипертензионного синдрома, клинически представленного
в основном специфическими для него головными болями, то последние на фоне
массивной алкоголизации становятся не столь ярко выраженными. Сам пациент
нередко связывает употребление алкоголя именно с его якобы лечебным воздействием
в плане уменьшения выраженности головных болей.
Имели место отчетливые различия в плане психопатологических расстройств у
пациентов только с последствиями боевой черепно-мозговой травмы и при их
сочетании с алкогольной зависимостью (табл. 63).
Таблица 63. Сравнительная характеристика
психопатологических расстройств

Заметно отчетливое преобладание (р<0,01) пациентов с психоорганическим
синдромом в группе лиц, страдавших алкогольной зависимостью. Создается
впечатление о том, что в формировании и развитии данного синдрома имеет большее
значение именно алкогольная зависимость, чем предшествовавшая ей боевая травма
головного мозга. А если алкогольную зависимость рассматривать, как это принято,
в качестве очень частой, если не облигатной, составляющей ПТСР, то можно
считать, что именно ПТСР с характерной для него алкогольной зависимостью как раз
и в наибольшей степени «повинно» в формировании психоорганического синдрома. А
вот астенический синдром как раз значительно реже (р<0,01) встречался среди
пациентов с алкогольной зависимостью, чем среди перенесших боевые
черепно-мозговые травмы, но не страдавших алкоголизмом. Это согласуется с нашими
данными о том, что алкоголь бывшими участниками боевых действий, пережившими
боевой стресс и страдающими ПТСР, принимается часто «с лечебной целью, для
поднятия настроения и выхода из психологического тупика».
Частота встречаемости и клинические варианты психоорганического синдрома
распределились по двум группам наблюдавшихся пациентов также неоднозначно (рис.
20). Это свидетельствует о том, что выявленные изменения не могут иметь
исключительно травматический генез, а обусловлены в значительной степени
присутствием алкогольной зависимости на фоне имеющегося ПТСР.
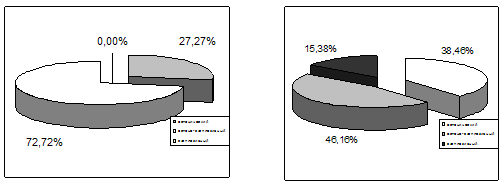
Рис. 20. Сравнительная характеристика основных вариантов
психоорганического (астенического, астено–эксплозивного, эксплозивного) синдрома
по группам наблюдений (слева – больные с алкогольно-травматической патологией,
справа – с исключительно травматической).
Среди пациентов с алкогольной зависимостью астенический вариант
психоорганического синдрома присутствовал у 21 (27,27%) из 77, астено–эксплозивный
– у 56 (72,72%); эксплозивного варианта психопатологических расстройств у
представителей этой группы не выявлено. У пациентов же с только последствиями
боевой черепно-мозговой травмы астенический вариант психоорганического синдрома
присутствовал у 5 (38,46%) из 13, астено–эксплозивный – у 6 (46,15%), а 2
(15,38%) пациента страдали эксплозивным вариантом психоорганического синдрома.
Таким образом, формирование стойких психопатологических расстройств, в
частности в форме различных вариантов психоорганического синдрома, достоверно
чаще наблюдается у лиц, получивших не только боевую травму головного мозга, но и
имеющих сформированную алкогольную зависимость. И наоборот, сугубо астенические
расстройства разной степени выраженности достоверно чаще представлены у
пациентов с исключительно последствиями боевой черепно-мозговой травмы.
Той или иной степени выраженности депрессивные расстройства выявлялись у
большинства пациентов обеих групп: у 95 (90,48%) с сочетанием последствий боевой
черепно-мозговой травмы и алкогольной зависимости, и у 40 (83,33%) с наличием
исключительно последствий боевой черепно-мозговой травмы. Столь частое
присутствие депрессивных расстройств характерно именно для последствий боевой
травмы мозга, полученной в условиях воздействия боевого стресса при формировании
в дальнейшем ПТСР (Мякотных В.С., 1994, 2009). Что же касается уровня,
выраженности депрессивных расстройств, то данные показатели также существенно
различались по выделенным группам наблюдений (табл. 64), что указывает на
существенное влияние хронической алкогольной зависимости в структуре ПТСР.
Таблица 64. Сравнительная характеристика депрессивных
расстройств
| Уровень депрессивного состояния
(по Цунгу) |
1-я группа: ЗЧМТ и алкогольная зависимость
(n=105) |
2-я группа: ЗЧМТ
(n=48) |
| Состояние без депрессии ( менее 50 у.д.) |
10 (9,52%) |
8 (16,66%) |
| Легкая депрессия ситуативного или
невротического генеза ( 50–59 у.д.) |
71 (67,61%)* |
13 (27,08%) |
| Субдепрессивное состояние или
маскированная депрессия (60–69 у.д.) |
20 (19,04%) |
23 (47,93%)* |
| Истинное депрессивное состояние
( более 70 у.д.) |
4 (3,83%) |
4 (8,33%)* |
Примечание: ЗЧМТ – закрытая черепно-мозговая травма; * – р<0,05 – 0,01.
Маскированная депрессия, субдепрессивные состояния встречались отчетливо (р<0,01)
чаще у пациентов с только последствиями боевой черепно-мозговой травмы (57,50%),
чем у лиц с сочетанной алкогольно–травматической патологией (21,05%). Также чаще
среди пациентов с исключительно последствиями травмы мозга отмечалось истинное
депрессивное состояние. Указанные различия могут свидетельствовать о том, что
хроническое и массивное употребление алкоголя, увеличивая в целом частоту
депрессивных расстройств, возникающих у больных с последствиями боевой травмы и
на фоне ПТСР, способствует уменьшению степени выраженности депрессии, в то же
время в некоторой степени подавляя ее маскированность.
Весьма интересными оказались результаты сравнительного изучения показателей
биологического возраста и перекисного окисления липидов сыворотки крови у двух
категорий пациентов, участников боевых действий – с присутствием алкогольной
зависимости и без таковой.
Показатели биологического возраста рассчитывались по методике, используемой в
течение многих лет в клинике Свердловского областного клинического
психоневрологического госпиталя для ветеранов войн (Ястребов А.П., Мещанинов
В.Н., 2005). При этом полученные показатели биологического возраста сравнивались
с значениями календарного возраста пациентов. Показатели так называемого
должного биологического возраста при расчетах не учитывались, т.к. они были
полностью сопоставимы с показателями календарного возраста исследуемого
контингента.
В группе лиц, страдающих хронической алкогольной зависимостью, средний
показатель биологического возраста оказался равным 55,13±7,71 годам при среднем
же календарном возрасте 37,81±6,03 лет. В группе лиц, перенесших боевую
черепно-мозговую травму, но не страдавших патологическим влечением к алкоголю,
средний биологический возраст оказался равным 42,17±6,98 годам при среднем
календарном возрасте 35,55±5,21 лет. Таким образом, именно у лиц с
посттравматической алкогольной зависимостью различия между усредненными
показателями календарного и биологического возраста достигают 17,32±3,67 лет (р<0,01),
т.е. 5–го, наиболее неблагоприятного функционального класса процесса старения
(Ястребов А.П., Мещанинов В.Н., 2005; Мякотных В.С., 2009). При условии того,
что алкогольная зависимость является, по существу, почти облигатной частью ПТСР
у ветеранов боевых действий, можно предположить, что отнюдь не черепно-мозговая
травма, даже боевая, а именно боевой стресс и следующее за ним ПТСР являются
особыми факторами риска ускоренного старения.
В табл. 65 представлены результаты сравнения календарного и биологического
возраста у двух различных по календарному возрасту категорий обследованных –
участников боевых действий в Афганистане и на Северном Кавказе.
Таблица 65. Сравнительные результаты определения
биологического возраста у участников боевых действий в Афганистане и на Северном
Кавказе
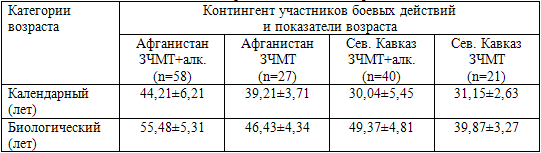
Примечание: ЗЧМТ – закрытая черепно-мозговая травма; алк. – алкогольная
зависимость
Как видно из представленных в табл. 65 данных, у пациентов, проходивших
службу на Северном Кавказе и имеющих сформированную алкогольную зависимость,
показатели биологического возраста абсолютно достоверно (Р<0,05) увеличиваются
по сравнению с таковыми же пациентами, также перенесшими боевую травму головного
мозга в операциях на территории Северного Кавказа, но не имеющих алкогольной
зависимости. При этом биологический возраст участников боев на Северном Кавказе,
страдающих алкогольной зависимостью, оказался даже более высоким, чем у
значительно старших их по календарному возрасту участников боевых действий в
Афганистане, не страдающих алкогольной зависимостью. Это свидетельствует о том,
что алкогольная зависимость, сформировавшаяся на фоне последствий боевых
физической и психологической травм и ПТСР уже в самом молодом возрасте приводит
к ситуации ускоренного старения.
С учетом факта того, что процессы патологического старения, как и любые
патологические процессы, в том числе травматическая болезнь мозга, ПТСР,
алкогольная зависимость, могут быть связаны с изменениями, происходящими в
системе ПОЛ и в значительной степени обусловлены ими, было проведено
сравнительное определение показателей ПОЛ и АОЗ у выделенных групп пациентов.
При определении состояния системы ПОЛ и АОЗ проводились исследование
светосуммы хемилюминесценции (ХЛ) и диеновой конъюгации (ДК) как показателей
активности ПОЛ; определялся уровень ферментов каталазы и пероксидазы как
показателей активности АОЗ; производилось исследование показателей перекисной
резистентности эритроцитов (ПРЭ), определяющей способность эритроцитов к
гемолизу и косвенно подтверждающих активность ПОЛ. Исследовались также
содержание общих липидов и общего белка сыворотки крови, осмотическая
резистентность эритроцитов (ОРЭ), а также содержание среднемолекулярных пептидов
(СМП) как ориентировочного признака эндогенной интоксикации организма.
Полученные показатели представлены в табл. 66.
Таблица 66. Сравнительные показатели ПОЛ и АОЗ
|
Показатели |
Лица с алкогольной зависимостью (n=105) |
Лица без алкогольной зависимости
(n=48) |
| СМП (отн. ед.) |
0,329±0,11 |
0,319±0,09 |
| Общий белок (г/л) |
68,6±4,86 |
69,03±4,43 |
| Общие липиды (г/л) |
0,448±0,09 |
0,511±0,19 |
| Каталаза (мкКат/г) |
2,71±0,19 |
2,43±0,21 |
| Пероксидаза (мкКат/г) |
19,08±1,73* |
35,27±3,41 |
| ПРЭ (отн. ед.) |
2,83±0,21* |
1,13±0,06 |
| ОРЭ (отн. ед.) |
2,97±0,34** |
8,28±0,54 |
| ДК (отн. ед.) |
2,602±0,25* |
1,344±0,08 |
| Светосумма ХЛ (отн. ед.) |
8989,45±472,31* |
5872,87±281,23 |
Примечание: * – Р<0,05; ** – Р<0,01.
Обращает на себя внимание, что в группе пациентов с алкогольной зависимостью
произошло достоверное (Р<0,05) возрастание средних показателей ДК, уменьшение
активности пероксидазы, увеличение показателя светосуммы ХЛ. Данные изменения
несомненно свидетельствуют об активации процессов ПОЛ на фоне ослабления
активности системы АОЗ. Также в группе пациентов с сочетанной
алкогольно-травматической патологией произошло достоверное повышение ПРЭ и
снижение ОРЭ. Высокая ОРЭ с показателем процента гемолиза эритроцитов 8,28% у
травматиков против 2,97% у таковых же, но страдающих дополнительно хронической
алкогольной зависимостью, свидетельствует об истощении процессов резистентности
на фоне хронического алкоголизма. ОРЭ у лиц, страдающих посттравматической
алкогольной зависимостью, находится как бы в противофазе ПОЛ и снижается вместе
и параллельно с антиокислительной активностью.
Действительно, давно известно, что одним из ведущих механизмов токсического
эффекта этанола является его влияние на структурное и функциональное состояние
мембран (Гендлин Д.Д., 1988), и клинические проявления алкоголизма могут быть
следствием сдвигов, развивающихся в мембранных структурах. Хроническое введение
этанола уменьшает «текучесть» мембран и способствует увеличению их микровязкости,
что связывается с изменениями в составе остатков жирных кислот в липидах
мембран. Усиление ПОЛ, таким образом, сопряжено с токсическим эффектом этанола и
наблюдается уже на 1–й стадии алкогольной зависимости, во 2–й стадии показано
увеличение содержания промежуточных и конечных продуктов ПОЛ (ДК, шиффовых
оснований), выявлен также исходно пониженный уровень АОЗ. С другой стороны,
усиление процессов ПОЛ во 2–й стадии алкогольной зависимости наиболее выражено,
особенно для ДК, у лиц с начальной формой алкогольной дистрофии миокарда, но
динамика параметров супероксиддисмутазы, например, указывает на положительные
сдвиги в состоянии антиоксидантной системы больных под влиянием
противоалкогольной терапии (Золотая Р.Н., Варфоломеев В.Н., Евсеенко Л.С. 1987).
С учетом полученных нами данных напрашивается вывод о том, что при наличии
алкогольной зависимости происходит неспецифическая активация системы ПОЛ и
процессов патологического старения, в том числе старения головного мозга. Можно
утверждать также, что боевая травма мозга и боевой стресс в сочетании с
последующим ПТСР являются факторами риска раннего, ускоренного старения, а
присоединение алкогольной зависимости усугубляет данный патологический феномен.
Формирование и развитие ускоренного старения при создавшихся условиях возможно
уже в самом молодом возрасте, о чем свидетельствуют показатели, выявленные у
самых молодых участников боевых действий на Северном Кавказе. При этом
происходит неспецифическая активация не только процессов патологического
старения как таковых, но и системы ПОЛ на фоне ослабления активности АОЗ.
Вероятно, поэтому, что лечение подобных больных должно быть, кроме всего
прочего, направлено и на снижение активности процессов ПОЛ и профилактику
раннего старения, причем вне зависимости от календарного возраста пациентов.
Наконец, хотелось бы сказать о частоте возникновения алкогольной зависимости
среди участников боевых действий, не получавших физических ранений и травм, в
частности черепно-мозговых. Мы попытались сравнить некоторые данные. По
результатам одного нашего исследования (Ямпольская В.В., 2007) оказалось, что
среди 153 получивших боевые травмы мозга у 105 (68,6%) сформировалась
алкогольная зависимость 2-й ст. По результатам другого нашего исследования (Бальберт
А.А., 2010) та или иная степень алкогольной зависимости присутствовала почти в
100% среди бывших участников боевых действий (у 198 из 202), перенесших боевые
травмы головного мозга. В случае же отсутствия в анамнезе боевых
черепно-мозговых травм, но при наличии факторов боевого стресса и
диагностированного ПТСР, частота алкогольной зависимости разной степени
выраженности составила 89,2% (в 58 из 65 наблюдений). Конечно же, можно
предположить, что часть ветеранов боевых действий, не страдавших какой-либо
связанной с участием в военных кампаниях патологией, просто не обращалась за
медицинской помощью в соответствующие госпитали для ветеранов войн и поэтому не
вошла в статистическую разработку. Но, как показывает практика, таких очень
немного, поэтому статистические погрешности не велики. Но, с другой стороны, еще
в 2001 г. нашим сотрудником Н.З. Таланкиной было показано, что клиническое
течение отдаленных последствий легкой боевой черепно-мозговой травмы и боевого
стресса вне последствий такой травмы достаточно похожи между собой, в том числе
и в плане формирования ПТСР, а следовательно, и посттравматической алкогольной
зависимости. Можно предположить, поэтому, что алкогольная зависимость
формируется не столько как следствие физической травмы головного мозга, сколько
как составляющая ПТСР, связанного, в свою очередь, с воздействием боевого
стресса, т.е. с психологической травмой.
Весьма спорным является вопрос о возможности сильнейшего стресса, в частности
боевого, и ПТСР в сочетании с последствиями боевой черепно-мозговой травмы
инициировать определенного рода генетические сдвиги. На мысль о возможности
такого рода воздействия нас навели результаты обследования детей бывших
участников современных вооруженных конфликтов, в частности ветеранов Афганистана
(Таланкина Н.З., 2001; Мякотных В.С., 2009). Приступая к данному исследованию,
мы вначале исходили из того, что вследствие тех или иных психопатологических
расстройств, характерных для лиц, перенесших боевую травму головного мозга в
условиях боевого стресса, можно предположить, что бывшие участники войн могут
невротизировать членов своих семей, создавая своим поведением в семье
хронический психотравмирующий фактор, оказывающий негативное воздействие на
формирование нервно-психической сферы детей, которые воспитываются в данной
семье. Но полученные нами результаты не смогли полностью ни подтвердить, ни
опровергнуть такого рода предположение, а в определенной степени
свидетельствовали об ином, более широком и многоаспектном механизме влияний
последствий боевого стресса и боевой черепно-мозговой травмы на потомство.
Были обследованы 50 детей, отцы которых перенесли боевую черепно-мозговую
травму в Афганистане. Все дети были зачаты и родились в течение ближайших 5 - 8
лет поле получения их отцами травмы. Состояние здоровья детей изучалось на
основании данных амбулаторных карт, отражающих перинатальный анамнез, результаты
клинического обследования с учетом показателей физического и нервно-психического
развития в различные возрастные периоды. Всем детям проведено углубленное
исследование неврологического статуса, выполнены ЭЭГ исследования, выборочно -
краниография, исследование состояния глазного дна, МРТ головы. Для оценки уровня
развития когнитивных функций детям 6 – 15-летнего возраста проводилось
нейропсихологическое тестирование по стандартизованной схеме общественного
госпиталя Монро (США). Группа сравнения состояла также из 50 детей, сопоставимых
с основной группой наблюдений по возрасту и полу, проживающих в социально
неблагополучных районах г. Екатеринбурга, но отцы этих детей не получали боевую
черепно-мозговую травму и не страдали ПТСР.
У отцов, перенесших боевую черепно-мозговую травму и, соответственно, боевой
стресс, ведущие неврологические синдромы распределились следующим образом:
гипертензионно-гидроцефальный - 12 (24%) наблюдений, эпилептиформный - 22 (44%),
психовегетативный – 6 (12%), дискоординаторный – 10 (20%). Среди отцов,
страдавших посттравматической эпилепсией, больные с простыми парциальными
«височными» припадками составили 14 (63,6%) наблюдений,
вторично-генерализованными – 8 (36,4%). Припадки дебютировали в течение первого
года после получения боевой травмы мозга у 8 (36,4%) больных, через 1-5 лет – у
11 (50%), спустя 5 и более лет – у 3 (13,6%). В структуре ПТСР,
диагностированного у всех бывших участников боевых действий, у 45 (90%) имел
место психоорганический синдром в форме астено-эксплозивного (19 больных, 38%) и
эксплозивного (26 больных, 52%) вариантов; у остальных 5 (10%) выявлены
умеренные астено-невротические расстройства.
При изучении пренатального, натального и раннего постнатального анамнеза
патогенные факторы зарегистрированы у всех (100%) детей из обеих групп. Факторы
риска формирования нервно-психической и соматической патологии наблюдавшихся
нами детей приведены в табл. 67.
Таблица 67. Факторы риска формирования
нервно-психической и соматической патологии детей
| Факторы риска |
Основная группа (n=50) |
Группа сравнения (n=50) |
| Наследственно-семейный анамнез
(хронические и гинекологические заболевания матери, профессиональные
вредности у родителей, злоупотребление алкоголем в семье, невынашиваемость
в анамнезе матери, длительное бесплодие в анамнезе матери, возраст матери
старше 30 лет) |
44
(88%) |
48
(96%) |
| Антенатальный период развития
ребенка (обострение хронических заболеваний матери во время беременности,
анемия, экзогенные интоксикации, гестоз, вирусные инфекции, угрожающий
выкидыш) |
49
(98%) |
47
(94%) |
| Интранатальный период развития
ребенка: А) Осложнения со стороны матери (слабость родовой деятельности,
несвоевременное излитие околоплодных вод, нефропатия, применение
родостимулирующей терапии)
Б) Осложнения со стороны плода (преждевременные роды,
неправильное предлежание плода, применение общей анестезии в родах,
применение оперативных вмешательств и пособий, патология пуповины) |
43
(86%)
|
45
(90%) |
| Неонатальный период развития
ребенка (асфиксия при рождении, обнаружение неврологических нарушений при
оценке статуса новорожденного, задержка внутриутробного развития или
признаки недоношенности, наличие родовой травмы) |
43
(86%) |
42
(84%) |
Как видно из представленных в табл. 67 данных, частота нарушений течения
беременности и родов, отклонений в состоянии периода новорожденности, а также
неврологические расстройства на первом-втором годах жизни являлись
распространенной патологией и одинаково часто диагностировались как у детей
бывших участников боевых действий, так и у детей группы сравнения. На первом и
втором году жизни наблюдались неврологом по поводу последствий перинатального
поражения ЦНС в форме гипертензионно-гидроцефального синдрома 8 (16%) детей
основной группы и 7 (14%) детей группы сравнения; с задержкой психомоторного
развития наблюдались по 5 (10%) детей из обеих групп; с миатоническим синдромом
на фоне пирамидной недостаточности вследствие натальной травмы шейного отдела
позвоночника – 14 (28%) детей основной группы и 17 (34%) группы сравнения. Кроме
того, у 14 (28%) детей основной группы выявлены аномалии развития, такие как
аномальная хорда левого желудочка – 5 детей, дисплазия тазобедренного сустава -
2 детей, дистопия и патология чашечно-лоханочной системы почек - 8 детей,
короткая уздечка языка - 3 детей. Аналогичные аномалии развития выявлены у 10
(20%) детей группы сравнения.
Среди соматической патологии преобладали частые заболевания верхних
дыхательных путей - 29 (58%) детей основной группы и 30 (60%) детей группы
сравнения; ларингиты со стенозом гортани - соответственно 4 (8%) и 6 (12%)
детей; пневмонии - по 6 человек (12%) из обеих групп; патология
желудочно-кишечного тракта - дисбактериоз кишечника, гастродуоденит,
энтероколит, дискинезии желчевыводящих путей - по 41 (82%) ребенку из обеих
групп; пиелонефриты - 6 (12%) и 7(14%) детей соответственно; аллергодерматозы (стрептодермии)
- 10 (20%) и 12 (24%) детей соответственно. У 23 (46%) и 21 (42%) детей обеих
наблюдавшихся групп выявлены нарушения осанки, у 5 (10%) и 7 (14%)
соответственно - плоскостопие.
Указания на эпилептиформные пароксизмы в раннем детстве (до трехлетнего
возраста) в виде расстройств сна, тиков, заикания отмечались у 17 (34%) детей
основной группы и 15 (30%) группы сравнения (р>0,05). В школьном же возрасте
(данную возрастную категорию представлял 31 ребенок из каждой группы наблюдения)
пароксизмальные расстройства сна, энурез, тики, заикание, абсансоподобные
состояния диагностированы уже у 19 (38%) детей основной группы и всего у 9 (18%)
группы сравнения (р<0,05). Трудности адаптации ребенка к детским дошкольным
учреждениям отмечали 30 (60%) родителей детей основной группы и только 18 (36%)
- родителей детей группы сравнения (р<0,05), к школе - соответственно 27 (54%) и
14 (28%) родителей детей обеих групп (р<0,05). Конфликтность, агрессивность в
поведении, гипервозбудимость, повышенная эмоциональная лабильность выявлены у 39
(78%) детей основной группы и у 20 (40%) - группы сравнения (р<0,05).
Неврологическое исследование выявило у всех детей основной группы рассеянную
микросимтоматику, представленную в различных сочетаниях наличием пирамидных
знаков – у 41 (82%) ребенка, легкого верхнего парапареза – у 24 (48%), умеренно
выраженной статико-моторной недостаточности – у 18 (36%), гиперчувствительности
и гипервозбудимости – у 40 (80%), а также задержкой созревания высших корковых
функций головного мозга - у 32 (64%). В группе сравнения пирамидные знаки
выявлены у 38 (76%) детей, клинические проявления легко выраженного верхнего
парапареза – у 24 (48%), статико-моторной недостаточности – у 10 (20%),
гипервозбудимости и гиперчувствительности - у 20 (40%). Задержка созревания
высших корковых функций головного мозга диагностирована всего у 5 (10%) человек
(р<0,05 по сравнению с основной группой наблюдавшихся детей). Проведенные
параклинические исследования подтвердили наличие признаков хронической
внутричерепной гипертензии у 8 (16%) детей основной группы и у 7 (14%) группы
сравнения.
Нейропсихологическое обследование по стандартизированной методике
общественного госпиталя Монро (США), проведенное детям основной группы 6 –
15-летнего возраста (31 человек), выявило: нарушение ориентировки – у 31 (100%),
снижение наблюдательности – у 27 (87%), снижение внимания и отвлекаемость – у 30
(97%), снижение возможности воспроизведения - у 8 (26%). Это подтвердило
задержку созревания высших корковых функций головного мозга при сохранности
интеллекта
В табл. 68 представлены сравнительные данные о встречаемости тех видов
патологии у детей двух рассматриваемых групп, которые достоверно (р<0,05–0,01)
различались между собой. Диагноз неврозоподобных расстройств, в том числе
синдрома вегетативной дисфункции, был выставлен 28 (56%) детям основной группы и
10 (20%) - группы сравнения (р<0,01). При этом пик заболеваемости
представленными вариантами патологии у детей основной группы приходился на
дошкольный и ранний пубертатный периоды – 6 - 7 и 11 - 12 лет.
Таблица 68. Основные варианты нервно-психической патологии
детей
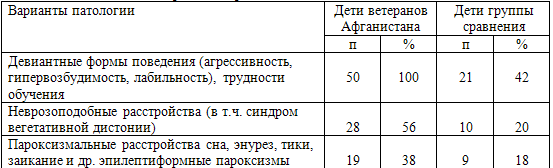
Таким образом, для детей, зачатых после получения отцами боевой
черепно-мозговой травмы в условиях боевого стресса при последующем развитии ПТСР,
характерна повышенная частота развития неврозоподобных расстройств и девиантных
форм поведения с «пиковыми» периодами в 6-7 и 11-12-летнем возрасте, вследствие
чего эти дети представляют собой группу риска по развитию пограничной
нервно-психической патологии.
Результаты проведенного ЭЭГ исследования подтвердили полученные нами
клинические различия. Так, ЭЭГ признаки функциональной незрелости нейронов
головного мозга выявлены у 18 (36%) детей основной группы и у 8 (16%) детей
группы сравнения (р<0,01), общее снижение порога судорожной готовности -
соответственно у 17 (34%) и 10 (20%) детей (p>0,05), очаги эпилептиформной
активности - у 5 (10%) и 2 (4%) (р<0,05).
При проведенном сравнительном ЭЭГ исследовании детей ветеранов войны в
Афганистане и самих участников этой войны - их отцов также наблюдалась
определенная зависимость: чем ярче были эпилептиформные проявления на ЭЭГ отцов,
тем более выраженной представлялась пароксизмальная активность, определяемая на
ЭЭГ у детей (Мякотных В.С., 2009).
Конечно же, для получения доказательств генетической предрасположенности
детей бывших участников боевых действий к тому или иному варианту соматической,
психоневрологической патологии необходимы повторные динамические генетические
исследования, проводимые в разные периоды жизни как самих участников боевых
действий (до военной службы, после военной службы; до получения травмы, после
получения травмы и т.д.), так и их детей, причем зачатых как до участия в боевых
действиях, так и после. Необходим, кроме этого, эксперимент на достаточно
высокоорганизованных животных, подвергшихся как травме, так и значительному
стрессовому воздействию. Такого рода исследования представляются невероятно
трудоемкими и дорогостоящими, и маловероятно, что они в обозримом будущем будут
в полной мере проведены. Тем не менее, в процессе наблюдения за детьми, зачатыми
ветеранами боевых действий уже в послевоенном периоде, мысль о некоей
генетической детерминированности ряда вариантов детской патологии все же не
оставляет исследователей, и этот факт также необходимо, вероятно, принимать во
внимание при решении вопросов планирования семьи, рождения и воспитания детей.
Поводя итог сказанному, можно утверждать, что основным пусковым механизмом
многих заболеваний участников современных боевых действий являются последствия
боевого стресса в виде ПТСР, которые в последующем, с возрастом, в определенной
степени утрачивают свое значение, и в патогенезе патологических процессов более
значимую роль начинают играть возрастные изменения организма. Частые
злоупотребления алкоголем, курение усиливают морфологические органные изменения.
Неудовлетворительные социальные и материальные условия являются дополнительным
дестабилизирующим фактором. В целом можно представить, что заболевания лиц,
страдающих ПТСР, формируются в двух основных направлениях. Первое направление -
это развитие патологических процессов в результате дизрегуляции ЦНС с
образованием многоуровневой патологической системы с первичным звеном в ЦНС и
вторичным - в органах и целых системах-мишенях. Именно при таком варианте
развития формируется хроническая боль. Второе направление – формирование
патологии, которая связанна с возрастными изменениями организма, но проявляется
в более раннем возрасте, чем это описано для популяционных стандартов. Сюда
относятся патология сердечно-сосудистой системы, нарушения липидного обмена,
язвенная болезнь желудка и 12-перстной кишки, хеликобактерная (Hb) инфекция, а
также дегенеративные изменения опорно-двигательного аппарата, сопровождаемые
хронической болью. В отдельное направление, сочетающее в себе патогенетические
механизмы первого и второго, можно выделить также заболевания и так называемые
вредные привычки, которые связанны, в том числе и с образом жизни, нарушением
иммунитета, аддиктивными наклонностями. Эти факторы, наряду с другими, также
провоцируют артериальную гипертензию, формирование патологии желудочно-кишечного
тракта и т.д. Выявленные особенности патогенеза, формирования и развития
множественной патологии, «запущенной» стрессом, или стресс-индуцированной,
необходимо учитывать при разработке конкретных схем патогенетического лечения.
Конечно же, стресс-индуцированная патология в клиническом множестве ее
вариантов и ПТСР – не единая нозология, требующая единых подходов к диагностике
и лечению. Но, тем не менее, видится патогенетическое единство и общность
формирования и развития целого ряда клинических феноменов разных заболеваний,
симптомов и синдромов. С течением времени, при увеличении возраста пациентов и
удлинении периода, прошедшего с момента их участия в боевых действиях,
патогенетические взаимоотношения боевого стресса, физических боевых травм, ПТСР
и целого каскада стресс-индуцированных заболеваний меняются. Совершенно
закономерно на первый план выходят возрастные изменения и провоцируемые ими
возрастзависимые варианты патологии. Также совершенно закономерно становятся
иными патологические воздействия ПТСР, теряются многие детали воспоминаний о
боевых действиях, сглаживается восприятие утрат. Возможно, именно поэтому у
бывших участников современных, да и не только современных, боевых действий
постепенно исчезает, а не нарастает, бывшая ранее агрессивность, чувство
несправедливости, непонимания, значительно снижается стремление к
корпоративности, социальному выделению и даже отчуждению от других
представителей общества. Но, тем не менее, особенно важно не упустить тот
момент, когда боевой стресс и следующее за ним ПТСР являются определяющими в
формировании и развитии целого множества патологических процессов
психосоматического содержания. Именно понимание боевой травмы, боевого стресса,
ПТСР и стресс-индуцированной патологии в патогенетическом их единстве при
сохранении нозологической самостоятельности может помочь в решении вопросов
профилактики и лечения на самых ранних этапах манифестации ряда заболеваний.
Разумеется, существует много спорных, пока недостаточно изученных моментов
как патогенетического единства, так и нозологической самостоятельности
рассматриваемых патологических процессов. Весьма неоднозначным представляется,
например, суждение об алкогольной зависимости как о стресс-индуцированном
состоянии. Если это суждение представляется довольно убедительным по отношению к
бывшим участникам боевых событий, пережившим тяжелый боевой стресс и страдающим
ПТСР, то по отношению к иным категориям населения подобное представляется
некорректным и требующим дальнейшего пристального изучения. То же самое можно
сказать и об атеросклерозе, в том числе раннем, об артериальной гипертонии, да и
о многих других видах патологии. Тем более спорно наше предположение о возможном
негативном воздействии последствий боевого стресса, ПТСР, боевых травматических
повреждений головного мозга на генетические структуры, некоторым образом
«ответственные» за развитие той или иной патологии, в частности
психоневрологического круга, у детей бывших военнослужащих – участников боевых
действий.
Наконец, одной из проблем остается вероятность и возможность развития
подобной описываемой нами стресс-индуцированной патологии не только у ветеранов
войн и вооруженных конфликтов, но и у иных категорий лиц, также подвергшихся
стрессовому воздействию. Конечно же, участие в боевых действиях, тем более
достаточно продолжительное, на протяжении месяцев и даже лет, нередко
сопровождается так называемым хроническим стрессом, который трудно сравнивать с
единичным, кратковременным стрессовым воздействием, пусть даже тяжелым. Но мы
видим, что не так уже редко даже непродолжительное участие в военных действиях
приводит к тяжелым травмам, ранениям, увечьям, инвалидности. И последствия при
этом бывают аналогичными таковым, сформировавшимся после длительного участия в
вооруженных конфликтах. Поэтому нам кажется, что любой достаточно интенсивный,
тяжелый для отдельной личности стресс-фактор может оказаться решающим и даже
катастрофичным в плане возможного развития стресс-индуцировнной патологии; и
применительно к этому мы рассматриваем боевой стресс скорее как удачную модель,
но не как единственную возможность формирования и развития целого каскада
патологических процессов. |