
4.1.Классификация неблагоприятных реакций на применение лекарственных средств
Каждый практикующий врач при назначении лекарственных препаратов конкретному
пациенту при наличии конкретного заболевания или патологического синдрома, кроме
особенностей биологической системы пациента должен представлять себе
неопровержимые факты в виде того, что научно-технический прогресс в целом и
развитие современной медицины в частности ведут к росту числа, разнообразия и
тяжести ятрогенных патологических процессов. Как клиницисты, так патологоанатом
и судмедэксперты отмечают, что осложнения фармакотерапии («болезни связанные с
прогрессом фармакологии») приняли характер эпидемии. На сегодняшний день не
существует абсолютно безопасных для пациента ЛС, а растущий арсенал методов
лечения становится всё более «агрессивным».
На фоне инновационных технологий производства лекарственных препаратов в
настоящее время почти половина, из них являются не жизненно важными и/или
дублирующими друг друга. Кроме того, ряд ЛС, обладая определенным
терапевтическим эффектом, представляют опасность для пациента в связи с высоким
риском развития предсказуемых побочных эффектов (Ashton C. H., Young A. H.,
1998). Значительная часть новых лекарственных препаратов отличается лишь
оригинальным названием фирмы-производителя и более высокой ценой. В то же время
доля расходов на лекарственные средства в национальных бюджетах здравоохранения
варьирует в пределах от 10 до 40% (ВОЗ, 2006) на фоне реализации глобальной
политики в целях внедрения принципов рационального использования ЛС, которая
означает, что пациенты получают лекарственные препараты, по возможности имеющие
низкую стоимость (как для самих пациентов, так и для общества), согласно
клиническим показаниям, в дозах, отвечающих их индивидуальным потребностям, на
протяжении необходимого времени (WHO., 2010).
Помимо этого, организация индивидуальной фармакотерапии испытывает на себе
влияние неправильного (ошибочного) применения ЛС, которые зависят от многих
факторов и условно могут быть разделены на 3 основных группы.
Первая группа - ошибки провизоров:
ошибки при приготовлении растворов, расфасовке лекарств и т.д.;
неадекватная замена лекарственных препаратов.
Вторая группа – ошибки врачей:
при определении тактики лечения;
при назначении конкретных лекарственных препаратов.
Третья группа - ошибки среднего медицинского персонала:
при чтении назначений врача;
при подборе препаратов для выполнения назначения;
при составлении инъекционных смесей;
при раскладке лекарств и выдачи их каждому пациенту;
при введении инъекционных препаратов.
К сожалению, оценить реальные масштабы данной проблемы в отечественной
системе производства медицинских услуг не представляется возможным, т.к.
распознавание и мониторинг такого рода ошибок пока ведется в минимальном объеме.
Немалую проблему представляет низкая эффективность лекарственной терапии. С
одной стороны, нередко назначаются малоэффективные, устаревшие препараты, а с
другой, ̶ практикующие врачи назначают дорогостоящие «модные», «агрессивно»
рекламируемые лекарственные препараты, терапевтическая ценность которых нередко
не только не превышает менее дорогостоящие аналоги, но и значительно ниже. В
дополнение к этому, не всегда учитывается возможность полипрагмазии, риск
развития осложнений при наличии у больного нескольких сопутствующих или не
связанных между собой патологических состояний. Кроме того, расходы на закупку
лекарственных препаратов составляют существенную часть бюджетов медицинских
учреждений и систем здравоохранения субъектов РФ. Следовательно, проведение
исследований посвященных причинно-следственным связям развития НПР и анализ
сложившейся ситуации позволит вплотную подойти к внедрению системы управления
качеством индивидуальной фармакотерапии, что отнюдь немаловажно в условиях роста
расходов на производство медицинских услуг населению.
Анализ полученных результатов позволяет говорить о том, что недооценка и
запоздалое решение проблемы роста неблагоприятных чреваты развитием самых
серьезных последствий как для отдельного пациента, так и для населения в целом (Chetly
A., Gilbert D., 1986; Seeger J.D., Kong S.X., Schumock G. T., 1998; Quality of
Health Care in America Committee. 2000). В специально исследованиях проведенных
в конце ХХ века было показано, что тяжелые, подчас необратимые осложнения в
результате лекарственной терапии развиваются у миллионов людей. Количество
летальных исходов, связанных с применением лекарств, исчисляется сотнями тысяч.
Только в США ежегодно госпитализируется от 3,5 до 8,8 млн. больных и погибает
100-200 тыс. пациентов вследствие развития неблагоприятных побочных реакций,
связанных с применением лекарств (Johnson J.A., Bootman J.L., 1995). Что же
относительно России, то регистрация и анализ причинно-следственных связей НПР
еще не стали приоритетом для управляющих структур отрасли здравоохранения.
Побочные эффекты и неблагоприятные побочные реакции. Большой опыт
человечества по использованию лекарственных средств свидетельствует о том, что
практически не бывает совершенно безвредных и безопасных лекарств. Хотя мы
классифицируем лекарства в соответствии с их принципиальным действием, очевидно,
что ни одно лекарственное средство не вызывает только один специфический эффект.
Это связано, прежде всего, с тем, что лекарства не обладают абсолютной
избирательностью действия: маловероятно, что молекула лекарственного вещества
может связаться только с одним типом рецепторов, поскольку число потенциальных
рецепторов у человека велико. Попадая в «мишень», лекарственные средства
одновременно могут влиять и на другие органы и системы организма, вызывая
нежелательные побочные эффекты и неблагоприятные побочные реакции (Хапалюк
А.В., 2007).
Отечественный и зарубежный опыт изучения проблемы побочного действия лекарств
свидетельствует о том, что многие осложнения фармакотерапии являются следствием
профессиональных ошибок медицинских работников. В то же время неблагоприятные
побочные реакции лекарственных препаратов вследствие нерационального применения
и врачебных ошибок - это только один из наиболее часто встречающихся видов
медицинских ошибок. По мнению В.К. Лепахина (2002) косвенными причинами
нерационального применения ЛС и ошибкам следует относить также:
неправильную постановку диагноза, приведшую к неверному выбору препарата
для лечения;
неиспользование предписанного диагностического обследования;
неверную интерпретацию результатов обследования;
непринятие мер после получения результатов, отклоняющихся от нормы;
использование неисправного медицинского оборудования;
осложнения при переливании крови;
невыполнение других медицинских предписаний.
В этой связи следует отметить, что проблема ошибок применения ЛС не нова,
однако в прошлом на нее не обращали должного внимания, хотя о причинах их
возникновения, об их многообразии существовало значительное число сообщений. Эти
причины отличаются фармакологическими и патогенетическими механизмами развития в
эпидемиологическом и юридическом отношении, а также могут иметь различные
последствия. Развитая система фармаконадзора заинтересована в изучении
неблагоприятных побочных эффектов и лекарственных взаимодействий как проблем,
касающихся неэффективности лекарств, их фальсификации, развития пристрастия или
передозировки, так и нерационального использования. В России система
фармаконадзора только формируется. В этих условиях чрезвычайно актуальным
является использование рациональных методологических приемов и классификаций при
оценке побочных эффектов.
О значительном масштабе проблемы возникновения побочных реакций
свидетельствуют статистические данные (Давыдов Ю. В., Файзуллина Е. В., 2012).
Установлено, что в среднем побочные реакции возникают у 10- 20%
госпитализированных больных, в развивающихся странах этот показатель равен 30-
40%. Неблагоприятные побочные реакции как причина госпитализации составляют до
10% во Франции и до 6% в США. От побочного действия лекарств в США ежегодно
умирает около 200 000 человек.
В настоящее время существует большое разнообразие классификаций
неблагоприятных побочных реакций, учитывающих различные признаки и факторы (Inmann
W., 1986; Davis D.M., 1998; Elder NC, Dovey SM., 2002). Каждая из этих
классификаций уникальна и может применяться наиболее эффективно при
использовании определенного метода мониторинга побочных реакций лекарств. Одни
из этих классификаций учитывают только один признак (например, только поражение
системы органов), другие учитывают несколько признаков (например, тяжесть
течения и серьезность последствий для пациента). Одной из основополагающих
классификаций, используемой в системе фармаконадзора, является разделение
побочных реакций по механизму развития. Наибольшее распространение получила
классификация, предложенная Grahame Smith D.G. и Aronson K.K.( Grahame
Smith D.G., Aronson K.K.,1992), которая включает всемирно принятую систему,
предложенную Rawlins M.D. и Thomson J.W. в 1997 г. (разделение всех типов
неблагоприятных побочных реакций на А и В) (Rawlins M.D., Thomson J.W., 1977).
Эта классификация была модифицирована Rene J. Royer и предусматривала
разделение побочных реакций на четыре типа: А, В, С, D (Rene J. Royer., 1997).
Практически все проблемы, возникающие при использовании лекарственных
препаратов, могут быть объединены в эту классификацию (Meyboom R.H.B. et al.,
2000). Данная система позволяет дифференцировать рациональное и нерациональное
использование препаратов, дозозависимые и дозонезависимые побочные реакции
(такие как тип А – дозозависимые реакции, тип В – индивидуальные реакции
пациента в ответ на применение лекарства, тип С – статистические нежелательные
эффекты) (рис. 4.2).
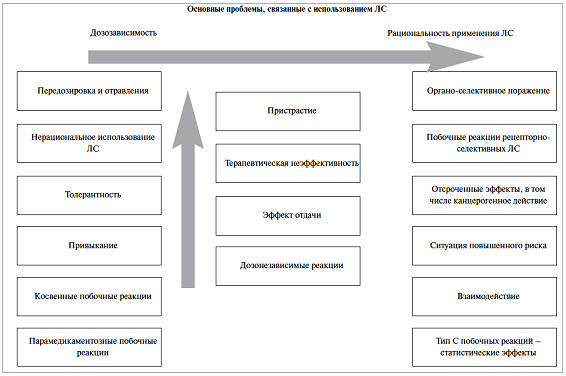
Рис. 4.2. Основные проблемы, связанные с использованием
лекарственных средств (Овчинникова Е.А, Овчинникова Л.К., 2004)
Указанная классификация может использоваться для оценки данных различных
исследований с изучением безопасности ЛС, а также расцениваться как
образовательная, поскольку показательно демонстрирует виды и особенности НПР
лекарственных веществ. ВОЗ рекомендует использование данной классификации для
работы федеральных и региональных центров фармаконадзора, а также для контроля
безопасности лекарств на базе отдельных медицинских учреждений.
Распространенность и разнообразие побочных реакций вследствие применения ЛС
зависит от многих факторов: количественного роста и расширения ассортимента
фармакологического рынка, контингента больных (пол, возраст, сопутствующие
заболевания, профессия, характер питания и пр.), особенностей их лечения
(характер препаратов, их активность, количество, совместимость), сенсибилизации
населения к биологическим и химическим веществам, ошибок медицинского персонала
и провизоров, появления большого количества генерических лекарственных средств с
недостаточно изученными свойствами и недоказательной эквивалентностью
оригинальным препаратам, широкой и часто некорректной рекламы лекарств,
применения некачественных и фальсифицированных препаратов, состояния окружающей
среды, отсутствия должной системы фармаконадзора (Колхир П. В.,
2010; Ландышев Ю. С., Доровских В. А., 2010).
Побочное действие ЛС проявляются различного рода патологическими симптомами и
синдромами и крайне варьируют по патогенезу, клиническим проявлениям и частоте
возникновения (Астахова А.В., Лепахин В.К. , 2004, 2008). Информация о побочном
действии ЛС обязательно предоставляется в типовой клинико-фармакологической
статье и инструкции по применению лекарственного препарата. Во многих странах
периодически выпускают издания, касающиеся сводной информации о побочных
действиях (ПД) ЛС. В Российской Федерации выпускается единственное официальное
издание – бюллетень Департамента государственного контроля качества,
эффективности и безопасности ЛС и медицинской техники Министерства
здравоохранения Российской Федерации «Безопасность лекарств;
экспресс-информация». Кроме того, информация о побочном действии ЛС публикуется
в различного рода научных журналах.
Среди типов врачебных ошибок в реальной медицинской практике лидирующее место
занимают ошибки выбора лекарственного средства и его дозы (Brennan
T.A.,
Leape L.L.,
Laird N.
et al., 1991; Dunn
E.B.,
Wolfe J.J., 1998;
Kohn L.T.,
Corrigan J.M.,
Donaldson M.S.
eds., 1999; Haig
K., 2003), которые составили более 50% по данным,
полученным при активном мониторинге стационара (Classen DC. еt
al., 1991, 1992), второе место заняли ошибки
лечения, связанные с некорректной длительностью лечения и изменением дозы — 34%
(Tissot E,. еt
al., 1999). В литературных источниках
неблагоприятные побочные реакции ЛС разделяют на 4 класса (A,
B, C и D)
согласно определенным характеристикам (табл. 4.1).
Тип А — реакции, которые являются результатом фармакологического действия
лекарственного средства. Реакции типа А возникают довольно часто, зависят от
дозы (частота и тяжесть увеличиваются при повышении дозы).
Этих реакций часто можно избежать путем подбора индивидуальной дозы для
больного. Такие реакции обычно воспроизводятся и изучаются в условиях
эксперимента, и они обычно известны до поступления препарата в практику.
Летальность от реакций типа А относительно низка. И, если случаи «дозазависимых»
НПР встречаются в клинической практике достаточно часто и выявляются без
особенного труда, то развитие НПР, связанных с взаимодействием ЛС, случаи
достаточно редкие.
Таблица 4.1.Неблагоприятные побочные
реакции (A, B, C и D)
| Класс |
Характеристика |
Соответствие
патогенетическому
виду побочного действия |
| А |
- относительно часты (обычно более 1 на 100);
- дозозависимы (с увеличением дозы увеличивается частота и тяжесть
ПД);
- связь со временем приема ЛС обычно прослеживается;
- обычно специфичны;
- могут изучаться экспериментальным и клиническим методами;
- предсказуемы.
|
Фармакодинамические ПД |
| В |
- относительно редки (обычно менее 1 на 1000);
- связь со временем приема ЛС обычно прослеживается;
- часто имеют место предрасполагающие факторы;
- низкая базовая (спонтанная) частота;
- обычно специфичны;
- часто являются тяжелыми ПД.
|
Иммунные и аллергические ПД;
фармакогенетические
ПД |
| С |
- относительно редки;
- возникают после длительного приема препарата;
- не всегда ясно определяется интервал между началом лечения и
развитием ПД;
- низкая базовая (спонтанная) частота;
- обычно специфичны;
- часто являются тяжелыми и малообратимыми ПД;
- трудны для диагностики.
|
Лекарственная устойчивость и толерантность;
лекарственная зависимость (синдром абстиненции); синдром отмены;
токсические ПД |
| D |
- относительно редки;
- развиваются отсроченно (через месяцы, годы);
- часто являются тяжелыми и малообратимыми ПД;
- крайне трудны для диагностики;
- требуют особых методов выявления.
|
Особые виды токсичности (мутагенность,
онкогенность, эмбриотоксичность, тератогенность, фетотоксичность) |
В качестве примера регистрации НПР реакции типа А, приводим выписку из
истории болезни № 399. Больной 73 года, находился на лечении с 13.01.2013 по
28.01.13. с диагнозом: ИБС, прогрессирующая стенокардия, ХСН, ФК II. Постоянная
форма фибриляции предсердий, нормовариант. Гипертоническая болезнь III стадии,
артериальная гипертензия III степени, риск 4. ЦВЗ. Энцефалопатия сочетанного
генеза. Выписан из отделения с рекомендациями: эналаприл 10 мг. 2 раза в день,
индап 1 табл. 1 раз в день утром, дигоксин Ѕ табл. 1 раз в день, нипертен 5мг. 1
раз в день, варфарин 5 мг. 1 раз в день, пирацетам по 1 табл. 3 раза в день.
Через один месяц после выписки пациент стал жаловаться на изжогу и редкие
голодные боли в эпигастральной области, по поводу чего ему назначен омепразол 20
мг. 1 раз в день, альмагель по 1 мерной ложке 4 раза в день, домперидон по 10
мг. 3 раза в день. Через 2 недели больной был вновь госпитализирован в стационар
с клинической картиной кровотечения (кровотечения из десен, наличие «черного»
стула), МНО 4,2 , гемоглобин 83 г/л, эритроциты 3,1 х 10 12/л, по
данным ФГДС в пилорическом отделе желудка эрозивное поражение слизистой с
геморрагическим пропитыванием.
В экспертном заключении по данному случаю отмечено, что участковый терапевт
назначил лечение без учета критериев безопасности проводимой фармакотерапии -
назначение омепразола и домперидона повлекло торможение метаболизма варфарина. В
результате у пациента развилась НПР, он был госпитализирован в круглосуточный
стационар с диагнозом: «Серьезная нежелательная побочная реакция тип А, на прием
варфарина (желудочно-кишечное кровотечение, кровотечение из десен)».
В реальной клинической практике НПР типа А наблюдаются достаточно часто,
хотя, уровень их регистрации по нашему мнению пока недостаточен, особенно при
назначении ЛС в амбулаторных условиях, поскольку отсутствует заинтересованность
лечащих врачей и должностных лиц медицинских учреждений в анализе
причинно-следственных связей ятрогенных осложнений фармакотерапии. Тем не менее,
реализация приказа Росздравнадзора от 26.10.2007 № 3439-Пр/07 «О создании
Федерального центра по мониторингу безопасности лекарственных средств» сдвинула
проблему с «мертвой» точки.
Больной 41 год, наблюдался участковым врачом с диагнозом: «Бронхиальная
астма, средне тяжелого течения. Межприступный период». Из анамнеза известно, у
больного преимущественно ночные приступы бронхиальной астмы, которые
провоцируются, как правило, эпизодами острых респираторных инфекций. Получает
базисную терапию серетид (125мкг. флутиказона) по 1 ингаляции 2 раза в день,
теопэк 300мг. на ночь, беродуал по требованию.
В феврале 2013 года пациент перенес ОРИ, течение которой осложнилось
левосторонним синуситом. Больному в амбулаторных условиях отолярингологом было
назначено лечение: супрастин по 1 таб. 2 раза в день, фромилид по 500 мг. 2 раза
в день, спрей-тизин по одной дозе в каждый носовой ход 3 раза в день. Начиная с
первого дня фармакотерапии у пациента появилась бессонница и тошнота. На
четвертые сутки лечения присоединились рвота до 5 раз в сутки, диарейный синдром
(стул до 8 раз в сутки без патологических примесей), боли в животе, гипотензия
(АД 90/60), тахикардия до 120 в мин., тремор верхних конечностей. По экстренным
показаниям пациент после осмотра врачом бригады скорой медицинской помощи,
пациент был госпитализирован в инфекционное отделение с подозрением на кишечную
инфекцию.
В экспертном заключении по данному случаю отмечено, что врачами поликлиники
была назначена фармакотерапия без учета критериев безопасности: назначение
фромилида повлекло торможение метаболизма теофеллина, в результате развилась НПР,
которая потребовала госпитализации. Диагноз: «Серьезная нежелательная побочная
реакция тип А, на прием теопека (признаки передозировки теофеллина).
Тип В — реакции, возникающие у относительно небольшого числа больных, не
зависят (или почти не зависят) от дозы препарата, возникают редко,
непредсказуемы, часто относятся к числу серьезных и сложны для изучения, так как
трудно воспроизводимы в условиях эксперимента. Реакции типа В могут быть
иммунологической и генетической природы и возникают у больных с наличием
предрасполагающих факторов (но часто о них бывает ничего не известно). К
реакциям иммунологического характера относятся сыпь, анафилаксия, васкулиты,
воспалительные повреждения органов, специфические аутоиммунные синдромы. Реакции
типа В генетически обусловленной природы могут быть связаны с врожденными
нарушениями метаболизма, дефицитом определенных ферментов, приводящим к
нарушениям биотрансформации или кумуляции их токсических метаболитов. Реакции
типа В выявляются на этапе широкого применения лекарственного средства, для них
характерна относительно высокая летальность.
Особое место среди побочных реакций на лекарственные препараты занимает
лекарственная аллергия. Так, она встречается в стационарах различного профиля
(терапевтического, хирургического, гинекологического) и составляет более 50%
всех случаев лекарственной непереносимости. Аллергические реакции на лекарства
выявляли у 15% больных терапевтического профиля. Развитие сывороточной болезни
после профилактических прививок отмечено у 13% вакцинированных (Ecolano
F., Bisbe
E., Castillo J. et
al., 1998). Около 25% вызовов бригад скорой
медицинской помощи выполняется к больным лекарственной аллергией.
Анафилактический шок встречается в 1 случае на 50 тыс. больных, применявших
лекарства. Ежегодно в Москве регистрируется более 50 случаев смерти от
анафилактического шока на пенициллин (Скепьян Н. А., 2000;
Пухлик Б. М., Викторов А. П., Зайков С. В., 2008; Classen DC. ,
2003). В Германии развитие лекарственной аллергии отмечено у 5% больных, в
Англии количество их в стационаре колеблется от 4% до 15%. В качестве примера
НПР тип В приводим случай из педиатрической практики.
Ребенку 2,5 года (масса 12 кг.) в 2013 году по поводу острой респираторной
вирусной инфекции (острый бронхит) назначен супракс в возрастной дозировке.
После приема первой дозы супракса отмечается появление по всей поверхности
туловища, рук, ног обильная пятнисто-папулезная сыпь, сливного характера, с
выраженным кожным зудом, лицо пастозное. Видимые слизистые оболочки чистые,
розовые, блестящие. Голос осиплый. Вдох затруднен. При дыхании втяжение яремной
ямки. При аускультации дыхание жесткое, хрипов нет, ЧД=38 движений в минуту,
пульс=120 ударов в минуту, удовлетворительных наполнения. Живот мягкий,
безболезненный. Размеры печени и селезенки не увеличены. Стул не изменен.
Мочится редко.
У ребенка была диагностирована серьезная нежелательная побочная реакция тип
В, на прием супракса (острая аллергическая реакция по типу крапивницы,
осложненная стенозом гортани). После отмены препарата и проведения посиндромной
терапии НПР была купирована.
Тип С — реакции, которые возникают при длительном использовании
лекарственного средства. Часто они проявляются развитием толерантности,
лекарственной зависимости, эффектом отмены. Примерами таких реакций являются
тахикардия после резкого прекращения приема бета-адреноблокаторов, острая
надпочечниковая недостаточность после быстрой отмены глюкокортикостероидов,
фиброз легких - вызванный длительным приемом амиодарона. В качестве примера
приводим НПР в виде «синдрома отмены».
Больная в возрасте 63 лет, наблюдалась участковым терапевтом по поводу ИБС,
стенокардии напряжения, ФК II. Гипертонической болезни II стадии, артериальной
гипертензии II степени, риск 3. Сахарный диабет II типа, компенсированный.
Получала терапию: метопролол 50 мг. 2 раза в день, аспирин ј табл. 1 раз в день,
гидрохлортиазид 12,5мг. 1 раз в день, аторис 20 мг. 1 раз день, пектрол 40 мг. 1
раз день, манинил 3,5 мг. 2 раза в день. На фоне проводимой терапии отмечаются
редкие приступы стенокардии (купируемые нитроглицерином сублингвально), а на
изменение погоды - гипертонические кризы (купируемые каптоприлом сублингвально).
Последняя госпитализация с целью обследования проводилась в 2012 году. В связи с
изменением места жительства обратилась к новому участковому терапевту, который
высказал пациентке мнение о том, что «получаемая терапия опасна для жизни,
поскольку так лечили 20 лет назад», в связи с чем была проведена коррекция
фармакотерапии. Были назначены лориста 12,5 мг. 1 раз день, индап 2,5 мг. 1 раз
в день, зилт 75 мг. 1 раз в день, аторис 20 мг. 1 раз день, моночинкве 40мг. 1
раз в день, манинил 3,5 мг. 2 раза в день.
После изменения лекарственных назначений у пациентки на пятые сутки
развивается клиника не стабильной стенокардии, гипертонический криз (АД 180 / 95
мм. рт. ст., ЧСС 110), который не купировался каптоприлом 50 мг. и
нитроглицерином сублингвально. Развилось острое нарушение мозгового
кровообращения, в результате больная по экстренным показаниям была
госпитализирована в специализированный стационар.
В экспертном заключении по данному случаю отмечено, что участковый врач
поликлиники назначил фармакотерапию без учета критериев безопасности. По мнению
экспертов в данном случае имела место серьезная нежелательная побочная реакция
тип С (синдром отмены метопролола).
Тип D — это отсроченные неблагоприятные
реакции. В их основе лежит канцерогенность, нарушения репродуктивной функции,
тератогенность, обусловленные предшествующим во времени приемом лекарственных
средств. Примерами таких реакций является аденокарцинома у дочерей женщин,
принимавших во время беременности стильбэстрол, лимфоцитарная лейкемия при
длительном использовании иммуносупрессантов, синдром Крейцфельда-Якоба,
проявляющийся многие годы спустя после инъекций гормона роста.
Современные неблагоприятные побочные реакции (тип D)
являются неизбежным следствием непримиримой и организованной борьбы с болезнью
– неограниченного использования новейших биотехнологий, мощного арсенала
лекарственных средств и конвейера узкой врачебной специализации. Об этом
свидетельствует широкое распространение такой ятрогении, как «лекарственная
импотенция» и «вторичное бесплодие» (Дьяченко В.Г. с соавт., 2014). В этой связи
следует отметить неизбежное и широкое распространение этого патологического
синдрома, которое объясняется тем, что:
- большинство препаратов, назначаемых при лечении гипертонической
болезни и сердечнососудистых заболеваний, при постоянном и длительном
приеме ухудшают мужскую потенцию;
- многие препараты, использующиеся при лечении язвенной болезни и
других желудочно-кишечных заболеваний, подавляют выработку мужских половых
гормонов – андрогенов и вызывают сексуальные дисфункции;
- прием психотропных препаратов – снотворных, транквилизаторов,
антидепрессантов, нейролептиков – вызывает задержку эякуляции у мужчин и
аноргазмию у женщин, а при длительном применении оборачивается
исчезновением сексуального влечения, импотенцией и фригидностью;
- сексуальные дисфункции могут вызываться сосудосуживающими
антигистаминными препаратами, побочным эффектом которых является сухость
влагалища у женщин и ослабление эрекции у мужчин;
- лечение детей и подростков гормональными препаратами, например,
препаратами половых гормонов или гормона роста, может привести в
дальнейшем к импотенции у юношей и бесплодию и фригидности у девушек.
Для современной России в связи с критической демографической ситуацией,
предметом беспокойства многих специалистов является некачественная информация о
влиянии фармакотерапии на женщин. Метаболизм лекарств у женщин происходит иначе,
чем у мужчин. Частично это объясняется различиями в массе тела у мужчин и
женщин, и частично - гормональными различиями (Grossman, W., 1993).
В сообщении Главного финансового управления США ещё в 1992 г. содержался
призыв включать больше женщин в клинические испытания лекарств и более глубоко
подходить к анализу потенциальных гендерных различий в области безопасности и
эффективности лекарств. В последние годы только 12% лекарств, получивших
разрешение на применение в клинической практике в США, имели результаты
специальных исследований в области гормональных взаимодействий или
взаимодействий с оральными контрацептивными средствами. Данные по безопасности
лекарств анализировались на гендерные отличия только для 54%, а эффективность по
гендерному признаку - только для 43% лекарств (Anon., 1992).
Частота развития неблагоприятных побочных реакций. Большинство
специалистов считает, что 2-3% в общей популяции людей страдают от побочных
эффектов лекарств (Shear N.H., Del Rosso J.Q., Phillips E., Sullivan J.R.,
Wolverton S.E., 2000). И, поскольку, система учета ятрогений и их последствий
налажена в США, то по данным статистики этой страны, за один 1997 год от 770
тыс. до 2 млн. госпитализированных пациентов пострадали в связи с развитием
побочных эффектов лекарств (The Institute for Healthcare Improvement, 1997;
Classen DC, Pestotnik SL, Evans RS, Lloyd JF, Burke JP., 1997; Bates D.W.,
Cullen D.J., Laird N. et al., 1995). В северном соседе США - Канаде за 1994 год
побочные реакции развились более чем у 33 млн. госпитализированных пациентов (Lazarou
J., Pomeranz BH., Corey P.N. , 1998; Lepori V., Perren A., Marone C.,
1999). Многие из зарубежных специалистов по управлению здравоохранением считают,
что побочные реакции являются причиной госпитализации или продления ее сроков у
10% больных в США (Bates D.W., Spell N., Cullen D.J. et al. , 1997;
Lindquist R., Gersema L.M., 1998), 2,5% – Великобритании (Naisbitt D.J., Gordon
S.F., Pirmohamed M., Park B.K., 2000; Green C.F., Mottram D.R., Rowe P.H.,
Pirmohamed M., 2000), 7,8% – Германии (Schoenemann J., Munter KH.,
Enayati_Kashani S., 1998).
По данным Великобритании, доля неблагоприятных побочных реакций лекарственных
препаратов среди госпитализированных пациентов составляет 3,7% (Leape L.,
Brennan Т., Laird N. et al., 1991). В США в связи с лекарственными осложнениями
госпитализируются 15-30% больных (Shear N.H., Del Rosso J.Q., Phillips E.,
Sullivan J.R., Wolverton S.E., 2000). Только в США побочные реакции
рассматриваются как единственная причина 0,31% всех посещений поликлиник, что
составляет 2,73 млн. посещений ежегодно. 88% от этого количества обращений за
медицинской помощью заканчиваются оформлением временной нетрудоспособности,
остальные требуют обращения в стационар (Aparasu R.R., Helgeland D.L., 2000). В
результате развития осложнений лекарственной терапии выписывается 76,3 млн.
дополнительных рецептов для проведения корректирующей терапии (Астахова А.В.,
Лепахин В.К.,1997).
Дети и пожилые пациенты являются теми группами населения, которые наиболее
часто страдают от лекарственных осложнений (Cooper J.W., 1996, 1999; Gupta A.,
Waldhauser L.K., 1997; Marshall J.D., Kearns G.L., 1999; Dyer K.S,, Woolf A.D.,
1999). Проведенные эпидемиологические исследования в Шотландии среди
госпитализированных пациентов определили уровень частоты встречаемости
лекарственных осложнений среди геронтологических больных как 14,2% (Cunningham
G., Dodd T.R., Grant D.J., McMurdo M.E., Richards R.M., 1997). Исследования в
Нидерландах также подтвердили повышенный риск их развития у пациентов старших
возрастных групп (Mannesse C.K., Derkx F.H., de Ridder M.A., Man in’t Veld A.J.,
van der Cammen T.J., 2000).
Исследования среди пациентов педиатрических клиник в США показали, что
побочные эффекты лекарственных средств у данной категории больных развиваются
чаще, чем у взрослых, приблизительно в 12,7% случаев, причем в 29,2% ̶ у детей в
возрасте до 3 лет (Cutroneo P.M. et al., 1998). Около 23% общего количества
госпитализированных детей страдают от лекарственных осложнений (Easton K.L.,
Parsons B.J., Starr M., Brien J.E, 1998). Исследования, проведенные в Австралии,
выявили, что побочные реакции являлись единственной причиной госпитализации у
детей в 3,4% случаях, для взрослых больных эти показатели составляют 2,4% (Easton
K.L., Parsons B.J., Starr M., Brien J.E., 1998). Исследования среди
госпитализированных больных, проведенные в Италии, продемонстрировали, что 12,7%
всех выявленных случаев осложнений лекарственной терапии были у детей, при этом
половина случаев развития лекарственных осложнений потребовала прекращения
терапии, а треть – медикаментозной коррекции.
Результаты мета-анализа 39 перспективных исследований, проведенных в США в
период с 1966 по 1996 гг., показали, что серьезные неблагоприятные побочные
реакции возникали в среднем в 6,7% случаев, а летальные осложнения имели место у
0,32% всех госпитализированных больных. Осложнения лекарственной терапии заняли
4-6-е место среди причин смертности после сердечно-сосудистых, онкологических,
бронхо-легочных заболеваний и травм (Johnson J.A., Bootman J.L., 1995).
Подобное положение отмечается и в других развитых странах. Так, во Франции в
1997 г. около 10% всех госпитализированных составляли больные с побочными
реакциями. Осложнения лекарственной терапии возникли у 1317650 пациентов, из них
в 33% случаев - серьезные и в 1,4% - летальные (Imbs J.L., Pouyanne P.,
Haramburu F. et al., 1999). Неблагоприятные побочные реакции явились причиной
госпитализации 5,8% больных в Германии (Muehlberger N., Schneeweis S., Hasford
J., 1997). Согласно данным Pirmohamed и et аl.(1998), 5% госпитализаций связаны
с лекарственными осложнениями, неблагоприятные побочные реакции возникают у
10-20% госпитализированных больных, осложнения лекарственного генеза стали
причиной летальных исходов в 0,1% случаев (для сравнения: летальные исходы в
результате хирургических вмешательств наблюдаются в 0,01% случаев).
Вполне понятны некоторые причины формирования ошибок индивидуальной
формакотерпии, поскольку большинство из них не подвергаются анализу в силу
откровенного нежелания административных структур отрасли «замечать» последние.
Известный австрийский (немецкий) хирург Теодор Бильрот более ста лет назад
говорил об этом явлении следующее: «Только слабые духом, хвастливые болтуны и
утомлённые жизнью боятся открыто высказаться о своих ошибках. Кто чувствует в
себе силу сделать лучше, тот не будет иметь страха перед сознанием своей
ошибки». А ведь в условиях, когда экономика России испытывает очередное давление
извне (экономические и политические санкции США и Евросоюза 2014 г.) следует
концентрировать усилия на повышении показателей эффективности производства в
любой отрасли.
В контексте выше сказанного следует понимать, что неблагоприятные побочные
реакции на ЛС - это не только серьезная медицинская, социальная, но и в первую
очередь экономическая проблема. Почему-то в отечественной медицине этому вопросу
не уделяется должного внимания, нет реального учета НПР, практически отсутствуют
работы по анализу экономических затрат на предотвращение и оказание медицинской
помощи при ятрогенных осложнениях фармакотерапии. А между тем экономические
затраты, связанные с лекарственными осложнениями, составляют в США около 76,6
млрд. долл. в год, а общие годовые затраты только на лечение предотвратимых
осложнений фармакотерапии колеблются от 17 до 29 млн. долл. (Johnson J.A.,
Bootman J.L., 1995). В Великобритании ежегодно расходуется около 4 млрд. долл. в
связи с увеличением продолжительности пребывания в стационарах больных из-за
возникших неблагоприятных побочных эффектов лекарств. По данным исследования
Moore et аl. (1998), затраты, связанные с побочными реакциями, составляют в
разных странах от 5,5 до 17% общего бюджета больниц.
Рост степени риска НПР. Бурное развитие фармакологии в последние
десятилетия и появление большого количества новых лекарств не только расширили
возможности лечения, но и повысили риск причинить вред пациенту. Любое вещество,
которое способно оказать терапевтическое действие, может также вызывать
неблагоприятные реакции. Риск таких эффектов варьирует от нулевого (например,
нистатин и гидроксикобаламин) до высокого (например, иммуносупрессивные или
противоопухолевые лекарства). К сожалению, точный подсчет неблагоприятных
реакций лекарств затруднен, так как большинство из них остается
незарегистрированными (Edwards I.R.,
et al., 1994; Elder NC,
Dovey SM., 2002; WHO., 2003).
Временная связь, тип заболевания, результаты исследований и повторное
провоцирование появления побочного эффекта могут помочь установить причинную
связь подозреваемой неблагоприятной реакции на лекарственное средство. Ведение
неблагоприятной реакции включает отмену лекарственного средства, если возможно,
и специфическое лечение его эффектов. О заподозренных неблагоприятных реакциях
лекарственного средства следует сообщить в Федеральный центр по побочным
действиям лекарственных средств. С помощью различных методов наблюдения можно
обнаружить реакции и подтвердить причинно-следственную связь.
Рискуя быть обвиненными в пристрастности, все-таки выскажем мнение о том, что
производство лекарственных средств ̶ это всего лишь бизнес, несмотря на то, что
производителями декларируются принципы общечеловеческих ценностей. А рынок ЛС ̶
это поле жестокой борьбы между производителями, продавцами и потребителями, где
общечеловеческие ценности уходят на второй план, а доминируют принципы получения
максимальной прибыли любым способом. В связи с этим хотелось бы отметить, что
абсолютное большинство из так называемых новых лекарственных средств,
поступающих на рынок, на самом деле таковыми не являлись и не являются до сих
пор. Свидетельством тому могут стать данные исследования американского FDA
(Управление контроля качества пищевых продуктов и лекарств), проведенного ещё в
80-х годах прошлого века. На момент выведения на рынок 348 новых лекарств,
созданных в 25 крупнейших фармацевтических компаниях США в 1981-1988 гг., FDA
заявило о них следующее: — 3% (12 лекарств) внесли важный потенциальный вклад в
современную фармакотерапию; — 13% внесли скромный вклад; — оставшиеся 84%
лекарств внесли небольшой или не внесли никакого вклада.
Достаточно давно американский исследователь Э. Четли (E.
Chetley) в книге «Проблемные лекарства» привел
документально подтвержденные свидетельства того, что: — четыре из каждых пяти
противодиарейных продуктов на рынке не имеют никакой ценности при лечении острой
диареи; — почти 50% всех противодиарейных продуктов на рынке содержат ненужное
противомикробное лекарство; — более 80% всех препаратов от кашля и насморка
содержат неэффективные ингредиенты, тогда как более 50% содержат ингредиенты,
способные вызвать вредные побочные эффекты; — 1 из каждых 3 анальгетиков
является комбинированным продуктом, что может вызвать почечную недостаточность,
а 1 из каждых 5 содержит потенциально вредные ингредиенты (Chetley
E., Gilbert
D., 1986).
В особо сложном положении с точки зрения формирования высокой степени риска
развития НПР являются дети. «Проблемы детского организма отличны от проблем
взрослых, и метаболизм организма ребенка также отличен. Медикаменты должны быть
приспособлены специально для него», — пояснял комиссар по Предприятиям и
Информационному сообществу ЕС Эркки Ликанен. В то же время в реальной жизни,
довольно часто занимаясь самолечением, любое распространенное заболевание у
ребенка (ОРИ, диарею, аллергию и т.п.) родители лечат так, как им рекомендовал
участковый терапевт или рекламный ролик, которые заполонили практически все
государственные каналы отечественного TV, те же
лекарства, только в меньшей дозе. Такой подход влечет за собой, как правило,
развитие ятрогений, порой с трагическим исходом. С точки зрения получения
максимальной прибыли вполне обоснована стратегия фирм – производителей ЛС, и в
особенности отечественные, зачем стремиться к интенсивному выпуску
специализированных препаратов для детей - это дорого и невыгодно. Поэтому капли,
сиропы, порошки, предназначенные для детей, в большинстве производятся за
рубежом. И, как следствие, стоимость таких препаратов «зашкаливает», хотя и в
определенной мере снижается степень риска их применения у детей.
С точки зрения возраста ребенка и формирования риска лечения, то
лекарственные средства могут оказывать свое вредоносное действие уже на плод,
когда беременная женщина получает те или иные ЛС. Примеров этому масса, начиная
с трагедии с талидомидом, кончая случаев применения синэстрола, когда дочери
матерей, принимавших этот препарат, заболевали раком генитальной сферы в
пубертатном возрасте. У новорожденных и детей раннего возраста процессы
метаболизма отличаются от таковых у взрослых, поэтому высок риск передозировки
лекарственных средств. Однако основной причиной НПР в педиатрической практике
является полипрагмазия. Часто при не осложненных ОРИ ребенку одновременно
назначают и антибиотики, и жаропонижающие, и антигистаминные препараты, дополняя
их иногда иммуностимуляторами. При этом, если лечение проводится в условиях
стационара, путь введения ЛС, как правило, парентеральный.
Широкое применение жаропонижающих препаратов у детей - еще одна область
повышенного риска нежелательных побочных эффектов. ВОЗ разработаны показания для
этой группы лекарственных средств. При лихорадке менее 39°С, как правило, нет
необходимости в их применении. Анализ применения жаропонижающих средств показал,
что при респираторно-вирусных инфекциях они были назначены более чем в 90%
случаев. Не все практикующие врачи информированы о том, что, например, аспирин
не следует назначать детям с вирусной инфекцией или подозрением на нес в связи с
возможным развитием синдрома Рея, а анальгин, известный в мире как метамизол,
может вызвать негативные реакции со стороны органов кроветворения, в связи, с
чем его применение либо ограничено, либо запрещено во многих странах мира.
На этом фоне свертывание федеральной программы «Детские лекарственные формы»
и сокращение финансирования программы «Здоровый ребенок» вызывает недоумение.
Ведь наболевшей проблемой для педиатров мира является катастрофическая нехватка
детских лекарственных форм. По данным европейской комиссии, недостаточное число
и структура фармацевтических средств, используемых в педиатрии, увеличивает риск
ятрогений за счет неадекватного дозирования ЛС у детей из применения «взрослых»
форм.
Сегодня становится очевидным фактом, что внедрение подходов индивидуальной
фармакотерапии в повседневную практику производства медицинских услуг возможно
только при тесном взаимодействии практикующих врачей, генетиков, биохимиков и
фармакологов. Использование высокотехнологичных, инновационных методов
индивидуальной фармакотерапии вместе с достижениями доказательной медицины
позволит снизить частоту нежелательных побочных реакций. Именно на современном
этапе модернизации отечественной медицины становится понятным, что путь к
повышению доступности, качества и безопасности медицинской помощи лежит через
совершенствование и широкое внедрение методов выявления, регистрации и
системного анализа причинно-следственных связей неблагоприятных побочных реакций
на применение лекарственных средств с помощью объединения усилий практикующих
врачей и специалистов фармаконадзора.
|