
4.3. Активный мониторинг неблагоприятных реакций на ЛС, как основа разработки мер по их предотвращению
Проблема выявления, учета и анализа неблагоприятных побочных реакций при
применении лекарственных средств в отечественной медицине в сложившейся ситуации
весьма неоднозначна. С одной стороны, попытки создания и реформирования системы
обратной связи в плане обеспечения безопасности применения ЛС предпринимались
общественными организациями неоднократно без какого-либо успеха, с другой
стороны отдельные проекты возникали и в недрах ряда государственных организаций,
но, как любая чиновничья инициатива, редко доводились до логического завершения
и формирования приемлемого результата.
В конечном итоге, осознание важности проблемы ятрогений и необходимости
контроля безопасности ЛС пришло к медицинской общественности, а не к
представителям государственных контрольно-разрешительных органов. Медицинские
ассоциации и научные медицинские общества были инициаторами создания различные
структур для мониторинга лекарственных препаратов, прежде всего, в экономически
развитых странах в начале 60-х годов ХХ века.
История создания службы контроля безопасности ЛС. В 1968 г. 10
стран из Европы, Северной Америки, а также Австралии договорились объединить все
сообщения и сформировать национальный Центр мониторинга использования
лекарственных средств в рамках ВОЗ, спонсируемого национального проекта
мониторинга препаратов. Его основными задачами было выявление частоты наиболее
серьезных реакций и их раннее предупреждение. Эта схема ВОЗ была утверждена на
съезде в Женеве в 1970 г. Экономические и организационные возможности Центра ВОЗ
были сосредоточены в Швеции в 1978 г. Формально руководство и координацию
программы продолжало осуществлять центральное представительство ВОЗ в Женеве.
Сегодня 56 стран участвуют в программе как полноценные члены и 67 - как
временные.
История службы фармаконадзора на территории России начинается с организации
Минздравом СССР отдела учета, систематизации и экспресс-информации о побочном
действии лекарственных средств в 1969 г. В 1973 г. он был утвержден в качестве
Всесоюзного организационно-методического центра по изучению побочных действий
лекарственных средств (ВЦПДЛС). В соответствии с приказом №333 Министрам
здравоохранения союзных республик предписывалось обязать
лечебно-профилактические учреждения регистрировать выявляемые побочные реакции и
немедленно информировать о них по установленной форме в Управление по внедрению
новых лекарственных средств и медицинской техники. Клиническим базам
Фармакологического комитета было поручено при проведении исследований новых
лекарственных препаратов особое внимание уделить регистрации осложнений лекарств
и своевременно сообщать о них Фармакологическому комитету и ВЦПДЛС.
Всесоюзным центром по изучению нежелательных лекарственных реакций за 10-
летний период (1970-1980гг.) зарегистрировано 13238 случаев побочного действия
ЛС, из них 9406 (71,05%) аллергического генеза, 520 случаев лекарственного
анафилактического шока (3,9%), 48- фатальных (0,3%) Лекарственный
анафилактический шок развивался в 1: 4,4 млн в популяции (Лопатин А.С., 1983).
Однако в конце 1991 г. вместе с распадом СССР был ликвидирован ВЦПДЛС, что
приостановило решение проблем, связанных с безопасностью применения
лекарственных препаратов в России на долгие годы.
Медицинские работники и население лишились возможности получать достоверную и
всестороннюю информацию о безопасности лекарств. Одновременно средства массовой
информации начали довольно агрессивную рекламную кампанию многих, далеко
небезопасных лекарств, ничего не сообщая о возможных побочных реакциях. Политика
«открытых дверей» и свободного фармацевтического рынка привела к регистрации в
России большого количества лекарств без достаточных клинических испытаний и
контроля (Фитилев С.Б., 1998). И только в 1997 г. Минздрав РФ 14.04.97
приказом № 114 от 14 апреля 1997 г. создает Федеральный центр по изучению
побочных действий лекарств Министерства здравоохранения РФ (ФЦ ПДЛС), который
через небольшой промежуток времени направил сообщения о побочных реакциях
лекарственных средств в Сотрудничающий Центр ВОЗ по мониторингу лекарств (г.
Уппсала, Швеция) Именно Сотрудничающий центр рекомендовал штаб-квартире принять
РФ в международную программу ВОЗ по мониторингу лекарств. Официальное принятие
России 48-м членом указанной программы состоялось 2 декабря 1997 г.
В настоящее время Центр ВОЗ сотрудничает с Национальными центрами в 52
странах мира. В банке данных Центра ВОЗ ассоциировано более 2,0 млн. сообщений о
нежелательных реакциях лекарств, куда ежегодно поступает более 200 тыс.
сообщений о побочных реакциях лекарств, причем с каждым годом объем информации о
НПР увеличивается (Edwards I.R.,
1995; Olsson S., 1998)
.
Служба фармаконадзора. С июля 1999 года в РФ создан и функционирует
Федеральный центр по контролю побочных действий лекарств Министерства
здравоохранения РФ на базе Отдела токсикологии и изучения побочного действия
лекарств Института доклинической и клинической экспертизы лекарств Научного
центра экспертизы и государственного контроля ЛС МЗ РФ. Федеральный центр по
контролю побочных действий лекарств был создан для выполнения мероприятий по
выявлению, учету и анализу данных об осложнениях лекарственной терапии, а также
для разработки предложений по их профилактике и лечению.
Параллельно были предприняты усилия по созданию сети аналогичных Региональных
центров. Стратегия сотрудничества продвинула вперед работу по организации службы
контроля безопасности ЛС, однако далеко не все проблемы близки к своему
совершению. Самой сложной задачей, которую должна решать сеть центров разного
уровня, является обеспечение получения от практикующих врачей информации обо
всех регистрируемых ими через систему учета, начиная с уровня практикующего
врача, кончая уровнем Международного комитета по мониторингу НПР и Базой данных
ВОЗ (рис.4.4).
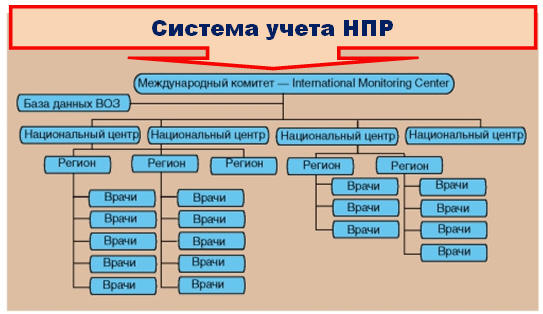
Рис.4.4. Система учета неблагоприятных (побочных) реакций при
применении лекарственных средств (приведено по «Петров В.И. Клиническая
фармакология и фармакотерапия в реальной врачебной практике. - 2011. - 880 с.»)
Многие врачи не принимают участие в работе по выявлению и регистрации НПР,
поскольку не всегда уверены в наличии причинно-следственной связи приема ЛС с
развитием НПР. Кроме того, они полагают, что формируемые НПР могут быть связаны
с их некомпетентностью, сознательным отклонением от стандартных технологий
производства медицинских услуг, что повлечет юридическую ответственность
(Моисеев В.С., 1996). В то же время следует понимать, что причинами
необходимости контроля НПР ЛС не вызывает сомнений, поскольку в конечном итоге
она кроется в значительных экономических потерях отрасли здравоохранения РФ,
поскольку они могут приводить к:
возникновению временной или стойкой нетрудоспособности;
госпитализации или продлению ее сроков;
необходимости дополнительной фармакотерапии;
росту материальных затрат на лечение;
гибели пациента.
Кроме того, данных самых скрупулезно выполненных клинических исследований
эффективности ЛС недостаточно, чтобы оценить безопасность назначенного
препарата. С печальной регулярностью серьезные и редкие нежелательные реакции
многих медикаментов, внедряемых в клиническую практику, выявляют только после их
широкого и длительного применения (Петров В.И., 2012). В этой связи следует
понимать, что абсолютно безопасными на сегодняшний день могут быть только
абсолютно неэффективные ЛС. Если учесть неблагоприятные (побочные) реакции,
которые дают пациенты на применение плацебо, таких лекарств вообще просто не
может быть.
Основными задачами центров по изучению побочных действий ЛС являются:
организация работы по выявлению и учету неблагоприятных побочных
реакций;
анализ, систематизация, верификация сообщений о побочных явлениях на
лекарства;
выявление факторов риска в развитии неблагоприятных побочных реакций;
выявление увеличения частоты возникновения известных лекарственных
осложнений;
информирование медицинской общественности о побочных реакциях на
медикаменты и о других проблемах, связанных с лекарственными осложнениями;
организация специальных исследований с целью получения дополнительной
информации, если это необходимо (например, выявление частоты возникновения
каких-либо видов осложнения лекарственной терапии - агранулоцитозов,
тератогенных эффектов, соотношения пользы/риска и др.);
оказание помощи медицинским работникам в анализе, верификации и
интерпретации неблагоприятных побочных реакций;
подготовка и предоставление Министерству здравоохранения страны
обобщенных данных о неблагоприятных побочных реакциях лекарственных
средств и предложений по принятию необходимых административных и других
мер (внесение изменений в инструкции по применению лекарств, ограничение
области применения лекарств, запрещение применения лекарственных
препаратов в медицинской практике);
формирование базы данных неблагоприятных побочных реакций;
участие в международном сотрудничестве в сфере лекарственной
безопасности.
Каждое сообщение о НПР должно иметь, как минимум, следующую информацию:
- Больной: возраст, пол, диагноз.
- Неблагоприятная побочная реакция: описание, результаты обследования
(если таковые имеются), время появления, курс лечения и исход.
- Подозреваемое лекарство (лекарства): название, производитель (по
возможности), доза, способ введения, сроки применения.
- Все другие принимаемые препараты, включая препараты для самолечения:
название, доза, пути введения, начало/конец тарапии.
- Факторы риска: например, нарушение функции почек, применение
подозреваемого препарата в прошлом, наличие аллергии, применение
наркотиков или алкоголя, сопутствующая патология, беременность и др.
- Четкое указание источника информации (название медицинского
учреждения, города). Эта информация нужна на случай необходимости
уточнения и верификации сообщения. Конфиденциальность поступающей в Центр
информации гарантирована.
Карта-извещение предназначена для регистрации побочных реакций на препараты,
находящиеся как на стадии клинического изучения, так и на стадии широкого
применения. При регистрации неблагоприятных побочных реакций на новый препарат
следует исходить из необходимости информировать обо всех подозреваемых реакциях
- от легких до тяжелых.
Препарат, применяемый в широкой лечебной практике, в течение первых пяти лет
после разрешения медицинского применения, относят к числу новых лекарств. Дата
регистрации ЛС имеется в справочной литературе («Энциклопедия лекарств»,
«Справочник VIDAL» и др.). В Великобритании информация на такие препараты
помечается черным треугольником в «Британском формуляре» и во всех
информационных и рекламных материалах. В Дании и Швеции в медицинских журналах
приводится перечень препаратов, которые должны быть предметом особого внимания
врачей. Есть страны, в которых предлагаются общие рекомендации относительно
того, о каких новых препаратах следует информировать Национальные центры
фармаконадзора.
Для всех других препаратов в первую очередь необходима регистрация:
- серьезных побочных реакций, включающих летальные исходы,
жизнеугрожающие реакции, влекущие за собой инвалидизацию больного, потерю
трудоспособности, требующие госпитализации или назначения дополнительной
терапии;
- отклонений в данных лабораторных исследований;
- врожденных аномалий;
- злокачественных опухолей;
- о неизвестных и неожиданных эффектах "старых препаратов";
- обязательной регистрации подлежат случаи влияния препаратов на плод и
новорожденных в период беременности и лактации.
Представляют интерес все виды неблагоприятных побочных реакций, в том числе и
те, в возникновении которых врач только подозревает этиологическую роль
лекарственного средства, но не уверен в этом.
Карта-извещение включает перечень вопросов, позволяющих провести
ориентировочное определение степени достоверности причинно-следственной связи и
необходимое кодирование.
Если сообщение касается лекарственного средства, которое принимала беременная
женщина, а побочная реакция возникла у плода, то все данные, за исключением
побочной реакции, приводятся о матери.
Кроме НПР на лекарства, рекомендуется регистрировать и информировать
Региональный центр о неблагоприятных побочных реакциях на травы, пищевые
добавки, о случаях злоупотребления лекарствами, о недостаточной эффективности
лекарств, о формировании резистентности к лекарствам (напр., антибиотикам), а
также побочных реакциях на косметические средства (особенно те, которые содержат
устаревшие, запрещенные или токсические компоненты, например, ртуть или
кортикоиды в кремах).
Отчасти искусственным является разграничение между побочной реакцией и
отравлением, и случаи, связанные с передозировкой (случайной или намеренной),
могут быть источником дополнительной информации о безопасности лекарств. Поэтому
такие случаи являются также предметом рассмотрения Региональным центром по
контролю побочных действий лекарств.
Проблемы активного осуществления мониторинга НПР. Итак, служба
фармаконадзора предусматривает, наряду с федеральным центром мониторинга
НПР, организацию региональных центров во всех субъектах Федерации и организацию
соответствующих работ на уровне медицинского учреждения. Руководителям органов
здравоохранения субъектов РФ было поручено организовать учреждения,
ответственные за сбор информации о побочных эффектах ЛС и за подготовку
соответствующих рекомендаций. Однако на местах у многих руководителей еще нет
понимания важности поставленной задачи, что умножает уровень сложности проблем
по выявлению и регистрации НПР. Это снижает эффективность работы службы
фармаконадзора, особенно в условиях несоблюдения или условного соблюдения
этических критериев ВОЗ фирмами-производителями, тратящими огромные финансовые
ресурсы на продвижение своих товаров на рынок (Shashindran C.H., Sethuraman
K.R., 1995; Wilkes M.S., Bell R.A., Kravitz R.L., 2000).
Подобная стратегия приводит к предоставлению не вполне объективной информации
о лекарственных средствах практическим врачам и пациентам (Хайде Б. ван дер.,
1995; Zuger A., 1999). По данным специалистов в США, около 28% врачебных ошибок,
в результате которых развиваются НПР, непосредственно связаны с неадекватным
распространением информации о препарате фирмами-производителями, более половины
из которых являются серьезными (Leape L.L., Bates DW, Cullen D.J., et al.,
1995). По результатам исследований, проведенных в Голландии, 42% из 161
препарата были признаны проблематичными из-за несоответствий стандартам
инструкций по медицинскому применению в следующих разделах: побочные эффекты,
противопоказания и предупреждения (Van Maaren P.J.M., 1994).
Другой проблемой, также вносящей вклад в формирование уровня НПР, является
фальсификация лекарств. По имеющейся информации ВОЗ, 30% обращаемых в мире
лекарственных средств — фальсифицированные (Чекалаева И.И., 2001). На территории
России в 1997 г. из общего числа лекарственных средств, прошедших
государственный контроль качества, брак отечественных препаратов составил 9,1%,
препаратов СНГ — 8,6, импортируемых из стран дальнего зарубежья — 8,4%. В
последнее время отмечается рост фальсификаций лекарственных препаратов на
территории РФ (Овчинникова Е.А., 2003).
Кроме того, фактором, в большой степени затрудняющим ориентацию врачей и
фармацевтов в существующем многообразии лекарств, является существование на
фармацевтическом рынке огромного количества препаратов-аналогов, выпускаемых
различными фармацевтическими фирмами под разными коммерческими названиями. Так,
диклофенак представлен на российском рынке под 128 различными торговыми
наименованиями, нифедипин — 66, парацетамол — 88 и т.д. Опыт США показал, что
после фармакокинетических исследований из почти 30 торговых наименований
дигоксина, имевшихся в продаже, лишь 6 были признаны биоэквивалентными (Викулова
С., 1999).
При возникновении у пациента, получающего фармакотерапию, клинических,
лабораторных и инструментальных данных всегда возникает вопрос: не вызваны ли
данные изменения применением ЛС? В этой ситуации важным является доказательство
достоверности причинно-следственной связи «лекарственное средство- НПР». Для
реализации данной методики необходимо, что бы система выявлении и регистрации
НПР работала эффективно.
Пока же система фармаконадзора в РФ только частично адаптирована и связана с
международной системой мониторинга НПР. Кроме того, эта работа ведется без
достаточного финансирования, что блокирует проведение независимых
фармакоэпидемиологических исследований. По мнению главного клинического
фармаколога МЗ РФ, академика РАН В.И. Петрова (2011) слабые звенья отечественной
системы регистрации НПР, так или иначе, проявляются на всех уровнях:
федеральном, региональном, медицинского учреждения и лечащего врача (рис. 4.5).

Рис. 4.5. Слабые звенья отечественной системы регистрации НПР
Мировой опыт выявления и оценки НПР показывает, что на этапе доклинического и
клинического исследования ЛС невозможно обнаружить и убедительно доказать
наличие всех потенциально возможных побочных реакций. Жесткие критерии
проведения мониторинга существуют во многих странах мира, при этом
фармацевтические фирмы осуществляют тщательное наблюдение за своими ЛС и
регулярно сообщают в экспертные органы данные об эффективности (постмаркетинговые
исследования, наблюдения врачей, научные статьи) и переносимости (частота и
характер обнаруженных побочных реакций). Большое значение придается клиническим
исследованиям ЛС IV фазы. В США по требованию FDA должны предоставляться
результаты постмаркетинговых исследований по следующим разделам: клиническая
безопасность, клиническая эффективность, клиническая фармакология
(фармакокинетические и фармакодинамические исследования), неклинические
(токсикологические) исследования, эпидемиологические исследования.
Реализация мер по предупреждению НПР. Органы фармаконадзора РФ
являются ответственной структурой за своевременное информирование врачей и
пациентов о возможных побочных реакциях и разработку специальных программ по
оптимизации безопасного использования ЛС. Это предусматривает, прежде всего,
максимальную активизацию выявления и анализа побочных эффектов лекарственных
средств. Большая территория страны и многомиллионное население являются теми
факторами, которые, как ни в одной другой стране мира, создают благоприятные
предпосылки для наиболее полной оценки безопасности применяемых лекарств.
При отсутствии реализации жестких механизмов контроля и надзора отечественный
фармацевтический рынок наполнен фальсификатами, даже солидные иностранные
фармацевтические компании в России продают ЛС иного качества, чем на
международном рынке. При появлении минимальной материальной и административной
возможности россияне, не желая рисковать своим здоровьем и самой жизнью,
стремятся лечиться в зарубежных клиниках. Значительный отток финансов из России
дополнительно усугубляет проблемы отечественной капиталоемкой сферы медицинских
услуг и производства ЛС. Медицинские учреждения становятся «центрами оценки
жизнеспособности» завуалировано ограничивают доступность, качество и
безопасность медицинских услуг для бедных соотечественников. К печальным
последствиям в таких случаях приводит комплекс нарушений в виде врачебных
ошибок, халатности, безграмотности и преступных преднамеренных действий при
производстве медицинских услуг.
Методологические аспекты качества, безопасности и эффективности
фармакотерапии весьма актуальны сегодня в связи с необходимостью обеспечения
государственных гарантий по оказанию бесплатной медицинской помощи, обеспечению
ее доступности, а также недостатками планирования и финансирования системы
здравоохранения, в то время как последние десятилетия характеризуются
возрастающим потреблением лекарственных препаратов населением всех стран мира. В
России также сохраняются мировые тенденции. Ряд авторов считает, что система
организации лекарственной помощи в отечественных ЛПУ запрограммирована на
формирование случайных ошибок. Контроль качества и безопасности лекарственной
помощи в этих условиях является важной частью системы непрерывного управления
качеством медицинской помощи на всех уровнях управления от уровня лечащего врача
(самоконтроль) до федерального уровня (стратегия функционирования фармаконадзора).
Уровень лечащего врача. При фармакотерапии врачи должны следить не только
за эффективностью применения ЛС, но и за безопасностью лекарственной терапии.
Для этого практические врачи должны использовать клинические, лабораторные,
инструментальные, морфологические методы контроля за НПР ЛС. Лечащий врач на
основании клинико-фармакологической характеристики используемого ЛС,
особенностей больного и реальных возможностей выбирает методы контроля за
безопасностью проводимой терапии и кратность их выполнения у конкретного
больного.
В том случае, если лечащий врач затрудняется с выбором методов, он может
обратиться к клиническому фармакологу, который должен дать рекомендации по
выбору методов контроля и кратности их выполнения у каждого конкретного
больного. При возникновении у больного патологических симптомов или синдромов,
подозрительных на НПР ЛС, каждый медицинский работник медицинского учреждения
(врач, фельдшер, медицинская сестра) должен в обязательном порядке уведомить
лечащего или дежурного врача.
Уровень медицинского учреждения. Лечащий врач или заведующий
отделением заполняют карту-извещение о возникших НПР ЛС. В медицинских
учреждениях форма карты-извещения должна быть доступной всем сотрудникам.
Заполненную форму лечащий врач направляет в формулярную комиссию медицинского
учреждения. Формулярная комиссия проводит сбор, регистрацию и анализ,
поступающих карт-сообщений и принимает соответствующие решения, которые могут
заключаться в организационных, методических, образовательных мерах. Формулярная
комиссия на основании поступающих данных информирует региональную формулярную
комиссию при Министерстве здравоохранения субъекта РФ ФРФР о зарегистрированных
НПР ЛС по определенной форме и в соответствии с определенными критериями. В
республиканскую формулярную комиссию при Министерстве здравоохранения региона
следует сообщать:
о развитии серьезных и/или неожиданных НПР – в течение 3-х дней с
момента выявления;
в случае выявления дополнительной информации (результаты аутопсии,
лабораторные данные) – не позднее последующих 5-ти дней.
Критериями понятия «серьезных НПР» действий являются смерть, угроза для
жизни, госпитализация или ее продление, стойкая или выраженная
нетрудоспособность/инвалидность, врожденные аномалии/пороки развития, развитие
опухоли.
Критерием понятия «неожиданные НПР» являются НПР, не отраженные в инструкции
по применению лекарственного препарата.
Уровень регионального МЗ. Региональная формулярная комиссия проводит сбор,
регистрацию и анализ, поступающей информации от формулярных комиссий медицинских
учреждений, информирует Научный центр экспертизы и государственного контроля
лекарственных средств Министерства здравоохранения Российской Федерации, а также
принимает соответствующие решения на уровне регионального министерства.
Практикующие врачи и администраторы системы здравоохранения должны помнить о
том, что не существует ни одного лекарственного средства, прием которого
исключал бы риск для пациента, а все без исключения ЛС имеют побочные эффекты,
некоторые из которых могут стать причиной летального исхода. Именно такой подход
сформирует необходимый уровень мер безопасности.
В соответствии с законодательством всех стран, фармацевтические компании, или
производители лекарств, должны тестировать свои лекарства на добровольных
участниках из числа здоровых людей и пациентов перед тем, как эти лекарства
станут доступными для широкого применения. Эти клинические испытания показывают,
насколько эффективно ЛС при определенном заболевании и какой потенциальный вред
оно может причинить. Однако они не дают информации для более крупных популяций,
остающихся за пределами тестирования и имеющих характеристики, отличные от
группы, участвующей в испытаниях, такие как возраст, пол, состояние здоровья и
этническое происхождение.
Для многих лекарств и, в частности, для комбинированных препаратов,
мониторинг безопасности не заканчивается на стадии производства. Необходимо
отслеживать безопасность лекарств путем тщательного наблюдения за пациентами и
последующего сбора научных данных. Этот аспект мониторинга лекарств называется
пост-маркетинговым наблюдением. Эффективность национального пост-маркетингового
наблюдения находится в прямой зависимости от активного участия медицинского
персонала.
Алгоритм поведения медицинского персонала. Основным элементом
системы производства медицинских услуг является лечащий врач, который непрерывно
взаимодействует с окружающей средой и обладает такими свойствами, как
«активность», целенаправленность, саморазвитие и саморегулирование. Элементы
системы находятся в определенном функциональном отношении к системе в целом и
оказывают противодействие внешним воздействиям, изменяющим ее равновесие.
Равновесие системы медицинского учреждения возможно тогда, когда каждый элемент
путем производства, обмена, распределения и потребления получают все необходимые
средства и ресурсы для выполнения своей функции. Для того, чтобы обеспечить
нормальное функционирование системы по производству медицинских услуг,
необходимо удовлетворить потребности элементов системы до какой-то определенного
нормативного показателя, который ограничивает уровень числа НПР. Вполне
естественно, что медицинский персонал производственной системы действует в
рамках соответствующего алгоритма. Основными
свойствами которого являются:
Понятность для исполнителя — исполнитель алгоритма должен понимать, как
его выполнять. Иными словами, имея алгоритм и произвольный вариант
исходных данных, исполнитель должен знать, как надо действовать для
выполнения этого алгоритма.
Дискpетность (прерывность, раздельность) — алгоpитм должен пpедставлять
пpоцесс pешения задачи как последовательное выполнение пpостых (или pанее
опpеделенных) шагов (этапов).
Опpеделенность — каждое пpавило алгоpитма должно быть четким,
однозначным и не оставлять места для сомнений. Благодаpя этому свойству
выполнение алгоpитма носит механический хаpактеp и не тpебует
дополнительных указаний или сведений о pешаемой задаче.
Pрезультативность (или конечность) состоит в
том, что за конечное число шагов алгоpитм либо
должен пpиводить к pешению
задачи, либо после конечного числа шагов останавливаться из-за
невозможности получить решение с выдачей соответствующего сообщения, либо
неограниченно продолжаться в течение времени, отведенного для исполнения
алгоритма, с выдачей промежуточных результатов.
Таким образом, алгоритм поведения медицинского персонала в условиях решения
задачи по снижению числа НПР применения ЛС заключается в реализации нескольких
последовательных операций: профилактика НПР, диагностика НПР и лечение НПР.
Профилактика НПР . Для снижения риска развития НПР необходимо учитывать:
групповую принадлежность ЛС по фармакологическому действию, возраст, пол и
антропологические характеристики больного. Необходимо оценить функциональное
состояние органов и систем пациента, определяющих фармакокинетику и
фармакодинамику ЛС, наличие сопутствующей патологии, характер образа жизни
пациента (элиминация ЛС повышается при интенсивной физической нагрузке), питание
(снижение биотрансформации ЛС у вегетарианцев), вредные привычки и др.
Диагностика НПР включает в себя сбор лекарственного
анамнеза с установлением факта приема ЛС и других медикаментозных средств, с
включением биологически активных добавок (БАДов) и установлением связи между НПР
и фактом приема ЛС, а так же установление связи между развившимся НПР и фактом
приема ЛС. Необходимо установить время приема ЛС и время появления НПР.
Определить соответствие вида НПР фармакологическому действию ЛС, а также частоту
развития предполагаемого НПР в популяции и частоту регистрации НПР
подозреваемого препарата.
Параллельно проводится лабораторное исследование с целью определения
концентрации ЛС в плазме крови пациента. Проведение провокационных тестов с
оценкой реакции на подозреваемый ЛС (подозреваемый препарат отменяют, с
повторным назначением через 2-3 дня). При использовании препаратов с высокой
молекулярной массой полезно использовать кожные тесты. Положительный результат
подтверждает наличие IgЕ антител. Осторожно надо относится к отрицательному
результату, так как он может свидетельствовать либо об отсутствии специфических
IgЕ антител, либо о неспецифичности реагента.
При поражении органов проводят необходимый спектр лабораторных исследований
(например, при поражении почек - анализ мочи, биохимический анализ крови и
т.д.). Проводят комплекс исследований на маркеры активизации иммунобиологических
механизмов - антинуклеарные антитела (лекарственная волчанка), метаболит
гистамина в моче (реакции гиперчувствительного типа), определение триптазы
(маркер активации тучных клеток), тест трансформации лимфоцитов.
При необходимости возможно проведение инструментального исследования. В
зависимости от клинического проявления НПР, проводят дополнительные
инструментальные исследования (электрокардиография, эхокардиография,
электроэнцефалография, гастродуоденоскопия, спирометрия, рентгенография и т.д.)
Обязательна оценка клинического состояния пациента в динамике,
ежедневная оценка самочувствия, с контролем объективного состояния организма
больного.
Лечение НПР . Лечебная тактика НПР всегда начинается с отмены препарата,
в случае, когда отменить препарат невозможно, снижают дозу препарата, а затем
проводят симптоматическую терапию и десенсибилизацию.
И, наконец, если пациента невозможно вести без ЛС, которое вызвало
неблагоприятную реакцию, необходимо обеспечить симптоматическую терапию, пока
продолжается основное лечение. Например, при тяжелой тошноте и рвоте у
пациентов, получающих противоопухолевые лекарства, следует назначить
симптоматическое лечение. Однако при лечении неблагоприятных лекарственных
реакций важно не вводить лекарств больше, чем необходимо. Всегда надо следовать
четким фармакотерапевтическим задачам, не лечить дольше, чем это необходимо,
избегать полипрагмазии, чаще осматривать пациента и искать всегда пути
уменьшения лекарственной нагрузки. |