
5.3. Сравнительные биохимические аспекты процесса
старения и стресса у мужчин и женщин
Гендерным аспектам процесса старения посвящено незначительное число
исследований, и эти исследования касаются в основном либо климактерических
проявлений у женщин, либо так называемой андропаузы у мужчин (Grady
D.,
Yaffe K.,
Kristof
M., et
al., 2002;
Henderson V.W.,
2006). Также нередко затрагиваются некоторые возрастзависимые психологические
моменты, так или иначе связанные с полом (Мякотных В.С., Березина Д.А.,
Сиденкова А.П. и др., 2014; Мякотных В.С., Сиденкова А.П., Боровкова Т.А.,
Березина Д.А., 2014). Еще меньшее число исследований посвящены вопросу гендерных
особенностей стресса. Такого рода исследования с подразделением по половому
признаку проводятся обычно при тех или иных достаточно тяжелых, хронически
протекающих заболеваниях и имеют своей целью разработку прогностических
критериев ряда заболеваний, в том числе возрастзависимых. Кроме того, данные
исследования касаются в основном изменений гормонального спектра как в связи с
увеличением возраста, так и на фоне патологических процессов, в том числе в
половой сфере (Кветная Т. В., Князькин И.В., Кветной И.М., 2005; Анисимов В.Н.,
2008; Смирнова О.В., Киликовский В.В., Кузина И.Н., 2010;
Otte C.,
Hart
S, Neylan
T.C.
et al.,
2005; Studd
J.W.,
2011). В связи с этим хотелось бы расширить наши представления о более
глобальных возрастных изменениях в организме мужчин и женщин в сравнительном
аспекте при отсутствии у тех и других клинических признаков какой-либо
хронической, тем более прогрессирующей и тяжелой патологии. Показателями,
указывающими на происходящую динамику в состоянии гомеостаза в связи с возрастом
и полом, могли бы быть результаты исследования липидного спектра, перекисного
окисления липидов (ПОЛ) и антиокислительной активности (АОА) системы крови,
уровня среднемолекулярных пептидов (СМП), биологического возраста (БВ). Именно
такое исследование было недавно проведено в нашей клинике (Мякотных В.С.,
Березина Д.А., Боровкова Т.А., Гаврилов И.В., 2014).
В исследовании приняли участие 1757 представителей разного
возраста: 858 (48,83%) мужчин и 899 (51,17%) женщин. На момент проведения
исследования они не предъявляли сколько-нибудь серьезных жалоб на состояние
своего здоровья, ни одна из женщин не находилась в состоянии беременности,
сопоставления с фазами менструального цикла также не проводилось. По отношению к
календарному возрасту (КВ) исследуемые были подразделены на 6 сравниваемых
групп: 1-я (n=285; 160 мужчин,
125 женщин) – лица в возрасте от 20 до 30 лет; 2-я (n=277;
134 мужчины, 143 женщины) – лица в возрасте от 30 до 40 лет; 3-я (n=266;
132 мужчины, 134 женщины) – лица в возрасте от 40 до 45 лет; 4-я (n=313;
130 мужчин, 183 женщины) – лица в возрасте от 45 до 50 лет; 5-я (n=309;
154 мужчины, 155 женщин) – лица в возрасте от 50 до 60 лет; 6-я (n=307;
148 мужчин, 159 женщин) – лица в возрасте от 60 до 70 лет. Только у некоторых
представителей 4-й, 5-й и 6-й групп в период обследования были зарегистрированы
умеренно повышенные показатели систолического артериального давления (АД),
расцененные в качестве признаков артериальной гипертонии не выше 1-й стадии. В
остальных группах наблюдений АД при обследовании оставалось нормальным.
Исследования состояния липидного спектра проводились с
использованием стандартных методов, аппаратуры «Cibacorning»
(США) и реактивов фирмы Rychem.
Определялись уровни общего холестерина сыворотки крови (ОХС), триглицеридов (ТГ),
липопротеидов низкой плотности (ЛПНП) и высокой плотности (ЛПВП). Состояние ПОЛ
в системе крови оценивали по нескольким методам, отражающим различные стадии
этого процесса. Исследовались показатели суммарной хемилюминесценции (ХЛ),
диеновой конъюгации (ДК) высших ненасыщенных жирных кислот с одновременным
определением общих липидов (ОЛ) сыворотки крови, содержания общего белка (ОБ) и
среднемолекулярных пептидов (СМП). Определялись также показатели перекисной
резистентности эритроцитов (ПРЭ).
ХЛ исследовалась на приборе хемилюминометре 1420.1 с ФЭУ-140 с
помощью индуцированной перекисью водорода ХЛ по стандартным методикам.
Результаты исследования получали в форме графика зависимости интенсивности
свечения от времени (3 минуты) в виде показателей суммарной ХЛ, складывающейся
из светосуммы ХЛ и амплитуды ХЛ. Определение ДК проводили модифицированным
стандартным методом (Ястребов А.П., Мещанинов В.Н., 2005) на основе
спектрофотометрической регистрации максимума поглощения ДК, отражающей
содержание ОЛ в гептановых экстрактах. Активность антиокислительного фермента
пероксидазы определяли по методу Т. Попова, Л. Нейковска (1971), активность
каталазы - по методу Баха-Зубковой в модификации А.П. Ястребова, В.Н. Мещанинова
А.П. (2005). Биологический возраст определялся с помощью разработанной нами
методики (Ястребов А.П., Мещанинов В.Н., 2005).
При исследовании липидного спектра обращал на себя внимание
закономерный и ожидаемый рост средних показателей ОХС по мере увеличения КВ
(рис. 25) при отсутствии статистически значимых различий по гендерному признаку.
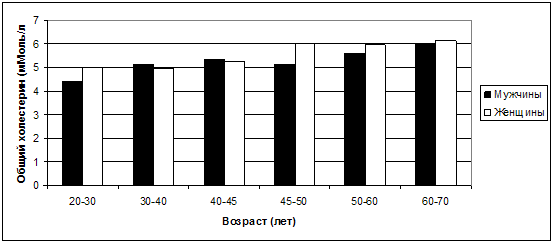
Рис. 25. Колебания средних значений ОХС в
зависимости от возраста и пола.
Только среди представителей 4-й группы (45-50 лет) данные различия
оказались наиболее заметными (соответственно 5,15±0,96 мМоль/л у мужчин и
6,0±1,04 мМоль/л у женщин). Это можно в определенной степени связать с началом
климактерического периода у женщин (в основном фаза пременопаузы), в котором при
прогрессирующем снижении уровня эстрогенов и повышении значений
фолликулостимулирующего гормона может несколько уменьшаться защитная роль
указанных гормонов в отношении поступления холестерина в сосудистое русло (Сметник
В.П., 2006; Studd
J.W.,
2011; Gray
P.B.,
Garcia
J.R.,
2013).
Наибольшие гендерные различия средних значений ЛПНП также отмечены
в возрасте 45-50 лет (рис. 26), и средние показатели ЛПНП также оказались более
высокими у женщин – 3,99±1,01 мМоль/л против 3,0±0,82 мМоль/л у мужчин (р<0,05).
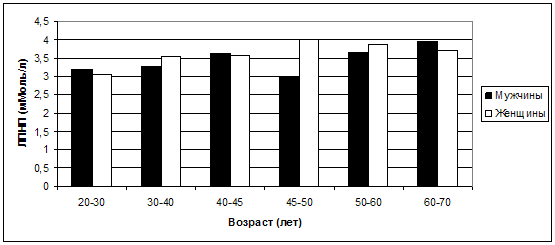
Рис. 26. Колебания средних значений ЛПНП в
зависимости от возраста и пола.
В дальнейшем же, по мере увеличения КВ средние значения ОХЛ и ЛПНП
у женщин практически стабилизируются, а у мужчин продолжают отчетливо нарастать,
достигая пограничных с принятой условной нормой значений. Можно предположить,
поэтому, что женщины в период перименопаузы оказываются менее защищенными, чем
мужчины, в плане возможного развития атеросклероза. Но затем «срабатывают»
известные механизмы адаптации (Анисимов В.Н., 2008), и дальнейшего ускоренного
развития дислипидемии не происходит, а наоборот, после определенного «скачка»
формируется некое «плато» в отношении таких показателей липидного спектра, как
ОХС и ЛПНП. У мужчин же подобного рода изменений не отмечено, а средние значения
ОХС и ЛПНП увеличиваются строго поступательно по отношению к КВ.
Более высокая подверженность развитию атеросклероза именно мужчин
подтверждается также отчетливо более высокими средними значениями ТГ (рис. 27) у
них в любом возрасте.
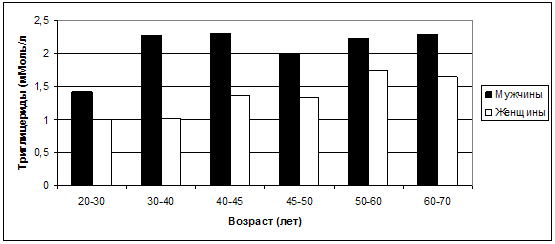
Рис. 27. Колебания средних значений ТГ в
зависимости от возраста и пола.
Особенно значительная разница между мужчинами и женщинами по
данному показателю выявлена в возрастные периоды 30-40 лет (соответственно
2,27±1,13 мМоль/л у мужчин и 1,01±0,5 мМоль/л у женщин; р<0,01) и 40-45 лет
(2,31±1,4 мМоль/л у мужчин и 1,37±0,53 мМоль/л у женщин; р<0,05). Именно в эти
возрастные периоды уровень ТГ у мужчин начинает превышать известные нормы, что
свидетельствует о наибольшей вероятности формирования и развития
атеросклеротических изменений у мужчин именно в возрасте от 30 до 45 лет. Это в
некоторой степени подтверждается сравнительной динамикой коэффициента
атерогенности (КА) (рис. 28), который среди мужчин оказывается значительно более
высоким (р<0,01), чем у женщин, уже в возрастные периоды 20-30 и 30-40 лет, хотя
в дальнейшем данный показатель в гендерном отношении различается уже не
существенно.
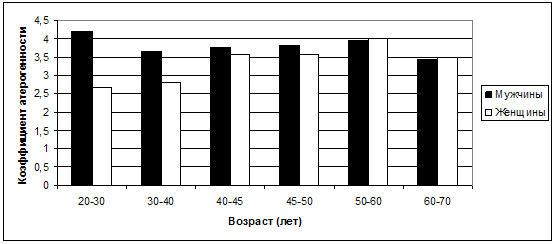
Рис. 28. Сравнительная динамика КА по отношению к
возрасту и полу
С другой стороны, средние значения ЛПВП, несколько «отставая» у
женщин по отношению к мужчинам в возрастные периоды 20-30, 30-40, 40-45 и 45-50
лет, затем вплотную приближаются к мужским значениям, а возрасте 60-70 лет
начинают даже несколько опережать таковые (рис. 29). Это может свидетельствовать
также о более благоприятном развитии атеросклероза именно у пожилых женщин, по
сравнению с пожилыми же мужчинами.
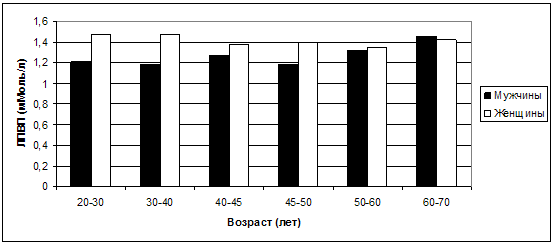
Рис. 29. Колебания средних значений ЛПВП в
зависимости от возраста и пола.
Несколько иначе обстоит дело с динамикой показателей ПОЛ/АОА.
Средние значения ДК, например, наиболее отчетливо возрастают у мужчин, по
сравнению с женщинами, в возрастном диапазоне 45-50 лет (рис. 30) -
соответственно 2,0±0,83 и 1,48±0,56 отн. ед. (р<0,05), и это вполне
соответствует выявленным различиям в показателях суммарной ХЛ в этот же
возрастной период: у мужчин – 6281,0±2027,06 отн. ед., у женщин –
5959,72±1904,59 отн. ед.
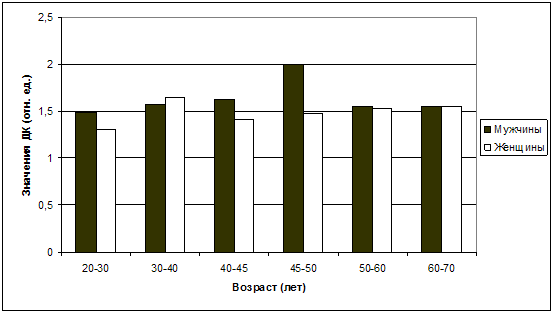
Рис. 30. Колебания средних значений ДК в
зависимости от возраста и пола.
При этом у женщин колебания показателей ДК в течение всего периода
от 20 до 70 лет представляются незначительными, и только в возрасте 30-40 лет
отмечено увеличение содержания ДК на 26,15% по отношению к возрастному периоду
20-30 лет, т.е. с 1,30±0,43 до 1,64±0,41 отн. ед. В дальнейшем, по мере
увеличения КВ, у женщин происходит стабилизация данного показателя в диапазоне
от 1,41±0,47 отн. ед. в возрасте 40-45 лет до 1,55±0,54 отн. ед. в возрасте
60-70 лет (р>0,05). Показатели суммарной ХЛ также колеблются по возрастным
периодам незначительно – как у женщин, так и у мужчин. Тем не менее, наиболее
высокие показатели светосуммы ХЛ обнаруживаются у женщин в возрасте 50-60 лет
(6416,37±2255,69 отн. ед.), а у мужчин – в 40-45 лет (6281,0±2027,06 отн. ед.).
Эти различия в некоторой степени можно связать с уровнем эстрогенов у женщин,
который в 50-60 лет достигает минимальных значений, при том условии, что
эстрадиол оказывает выраженное антиокислительное воздействие, а климактерические
расстройства сами по себе вызывают мощный стресс для женского организма, что еще
больше усиливает активность ПОЛ (Сметник В.П., 2006;
Gray P.B.,
Garcia
J.R.,
2013).
Известно, что ДК - это первичный продукт ПОЛ, соответственно
уровень ДК указывает на степень активности ПОЛ. Тогда анализируя ситуацию и
принимая во внимание факт отсутствия значимой патологии у обследованных лиц,
можно сделать предположение о том, что «среднестатистическая» женщина испытывает
сильнейший стресс в возрасте от 30 до 40 лет, а мужчина - в возрасте 45-50 лет.
С чем это может быть связано? Уровень эстрогенов здоровой женщины в 30-40 лет
укладывается в норму, значит причина в чем-то ином. Возможно, повышение
активности ПОЛ связано с уровнем кортизола и адреналина, которые вырабатываются
в ответ на внешнее стрессорное воздействие. Действительно, экспериментально
доказано, что введение кортизола ведет к долгосрочным изменениям одной из
важнейших регуляторных систем организма - ПОЛ, оказывая сенсибилизирующее
действие на изменения уровня ее продуктов, вызываемых стрессом (Ракицкая В.В.,
Флеров М.А., Герасимова И.А., 2002). Это также объясняет и повышение ДК у мужчин
в возрасте 45-50 лет, что оказывается довольно зависимым от возрастных колебаний
значений СМП (рис. 31), которые являясь продуктами распада белков, действуют как
вторичные эндотоксины, вызывая расстройство различных физиологических процессов.
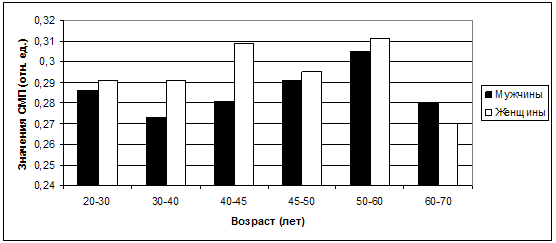
Рис. 31. Колебания средних значений СМП в
зависимости от возраста и пола.
Значения СМП выше у женщин, чем у мужчин, во всех возрастных
группах, за исключением группы 60-70 лет. Возможно, это также связано с уровнем
стресса, более высоким в целом как раз в женской популяции. Тем не менее, в
возрасте 20-30 лет уровень СМП у мужчин и женщин примерно одинаковый, и можно
предположить, что в целом их жизнь в этот период достаточно комфортна и
благополучна. В это время люди, как правило, получают образование, находят себе
пары, устраиваются на работу. Они молоды, красивы, амбициозны, их мало что
обременяет. Чуть более высокий уровень стресса у женщин, отражающийся в более
высоких показателях СМП, можно связать с тем, что, как правило, в возрасте 25-30
лет у них возникает потребность выйти замуж, и если нет соответствующей пары, то
эта мысль нередко становится раздражителем и запускает стрессовую реакцию. У
мужчин этой возрастной группы данной потребности нет. В 30-40 лет уровень СМП у
женщин становится отчетливо более высоким, чем у мужчин, что также можно связать
с гендерными различиями в стрессовом воздействии. У женщин это рождение детей,
сопровождающееся ответственностью за их воспитание и содержание. В этом же
возрасте, согласно статистике, происходит большинство разводов, что значительно
увеличивает уровень стресса женщины, так как она остается одна с детьми, и на
нее ложатся все заботы о семье. В 40-45 лет уровень СМП у женщин еще более
возрастает, и это, возможно, связано как с уже начавшимися процессами старения,
сопровождающимися разного рода возрастзависимой соматической патологией, которая
еще не начала ярко проявлять себя клинически, но уже отразилась на уровне
эндогенной интоксикации. В этот период нередко начинает снижаться уровень
эстрогенов, что делает жизнь женщины гораздо менее комфортабельной и интересной,
кожа теряет эластичность, появляются морщины, лишний вес, волосы начинают седеть
и истончаться и т.д. Безусловно, эти видимые признаки старения усугубляют
состояние женщины, а противоположный пол в этот же период более интересуется
женщинами младших возрастных групп. Для мужчины возраст 40-45 лет – это тот
период, когда он уже многого достиг, еще не потерял своей привлекательности и
здоровья. С этим можно связать низкий уровень стресса, отраженного в значениях
СМП, даже более низких, чем в 20-30 лет. В 45-50 гендерные различия в
показателях СМП практически отсутствуют и в дальнейших возрастных периодах не
столь значительны. Женщина постепенно адаптируется к своему новому состоянию,
появляются новые интересы и заботы (внуки, занятия садоводством и иными видами
хобби). Мужчина в этот период, как правило, подводит итоги определенного этапа
жизни, и не всегда они столь успешны, как хотелось бы. Пусть медленно и не столь
заметно, но усугубляется соматическая патология, порой возникают эректильные
дисфункции, что нередко запускает новую стрессовую реакцию. В 50-60 лет
увеличиваются показатели СМП как у женщин, так и у мужчин. Несколько более
высокие показатели уровня СМП у женщин могут быть связаны с критическим
снижением уровня эстрогенов и климактерическими расстройствами. И наконец, в
60-70 лет показатели СМП становятся более высокими у мужчин в сравнении с
женщинами. Вероятно, это связано с тем, что женщины в этот период уже
адаптировались к постменопаузе и новым условиям жизни. Мужчины же, часто
уходящие на пенсию именно в этот период, тяжелее приспосабливаются к новым
условиям жизни и переживают очередной стресс.
Гендерные различия в содержании ферментов АОА каталазы и
пероксидазы в разные возрастные периоды представляются еще более значимыми (рис.
32 и 33).
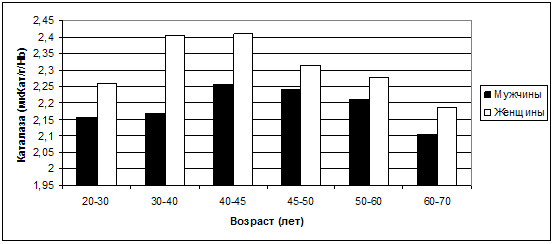
Рис. 32. Колебания средних значений каталазы в
зависимости от возраста и пола.
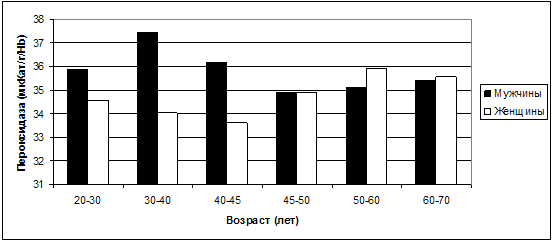
Рис. 33. Колебания средних значений пероксидазы в
зависимости от возраста и пола.
Уровень каталазы, исходя из представленных графиков, подвержен
значительным изменениям на протяжении жизни женщины, и максимальных значений
достигает в возрасте 30-40, 40-45 лет. Вероятно, это связано с компенсаторными
механизмами: высокие показатели ПОЛ - высокие показатели АОА. У мужчин
максимальные показатели каталазы в возрасте 40-45 лет также можно связать с
компенсацией. Механизмы компенсации, скорее всего, у относительно здоровых лиц
нарушаются в более позднем возрасте, когда активность каталазы уже не столь
велика, а светосумма ХЛ достаточно высока, особенно у мужчин в возрасте 60-70
лет (6525,88±20,95,2 отн. ед.) по сравнению с женщинами того же возраста
(5712,68±1944,11 отн. ед.).
Пероксидаза «работает», в отличие от каталазы, при малых
концентрациях перекисей (Ястребов А.П., Мещанинов В.Н., 2005) и максимальных
значений достигает у мужчин в возрасте 30-40 лет (37,44±11,47 мкКат/г/Hb),
у женщин - в 50-60 лет (35,93±8,05 мкКат/г/Hb),
т.е. в климактерическом периоде.
Активация процессов ПОЛ и недостаточность АОА приводит к снижению
ПРЭ(рис. 34).
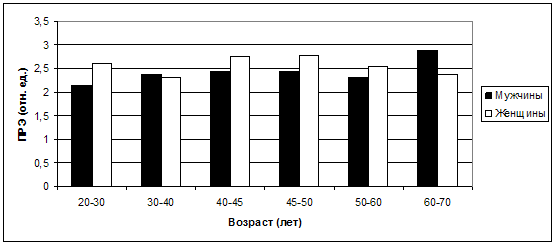
Рис. 34. Колебания средних значений ПРЭ в
зависимости от возраста и пола.
У женщин наибольшее снижение показателей ПРЭ наблюдается в группе
30-40 лет, как раз тогда, когда организм испытывает максимальный стресс. У
мужчин логично было бы ожидать такое же понижение резистентности в возрасте
45-50 лет, но согласно полученным результатам, максимальное снижение ПРЭ
зарегистрировано к них в наиболее молодом возрасте - 20-30 лет. Возможно, это
связано с достаточно высоким, по сравнению с женщинами, КА в этот период –
соответственно 4,2±2,31 и 2,67±1,33 (р<0,05)., что указывает на более раннее
формирование и развитие атеросклеротических изменений сосудов у мужчин при их
максимально высокой физической, интеллектуальной и сексуальной активности именно
в этом возрасте.
Конечно, оценивая показатели ПОЛ, необходимо не забывать еще и о
том, что у женщин показатели ПОЛ/АОА изменяются в динамике репродуктивного
цикла. В первые дни менструального цикла происходит увеличение соотношения
адреналин/серотонин, что свидетельствует о преобладании в функциональной
активности гипоталамуса адренергических компонентов. Это приводит к депрессии
противосвертывающей и антиокислительной систем крови, а также активации
клеточного и гуморального иммунитета и повышению неспецифической иммунной
резистентности, что может проявляться увеличением концентрации ДК и малонового
диальдегида, активацией свертывающего потенциала крови. К 21-му дню цикла
активность АОА прогрессивно увеличивается, на фоне этого снижается количество
продуктов ПОЛ. Это необходимо для обеспечения процессов имплантации в слизистую
матки, развития плаценты и создания оптимальных условий, которые позволят, с
одной стороны, обеспечить надежную защиту организма женщины, а с другой,
вынашивание беременности (Гусак Ю.К., Лазарева Ю.В., Морозов В.Н., 2000). И хотя
в нашем исследовании мы не подразделяли женщин репродуктивного возраста на
группы в зависимости от периода менструального цикла, но все же различия в
периодах данного цикла в момент проведения исследований могли в определенной
степени сказаться на результатах.
Наконец, при сравнительном анализе динамики отклонений БВ от КВ
(рис. 35) получены отчетливые различия в гендерном аспекте.
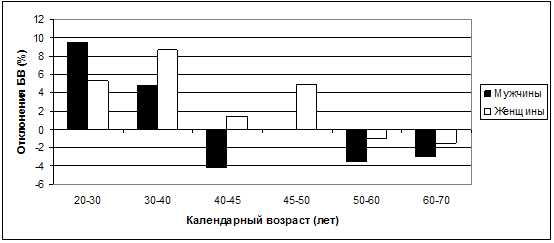
Рис. 35. Колебания отклонений БВ от КВ в
зависимости от возраста и пола.
С 20 до 30 лет мужчины в значительной степени превосходят женщин в
сторону увеличения БВ по отношению к КВ. Если в этот период БВ мужчин превышает
КВ на 9,52±24,71%, то у женщин данный показатель составляет 5,3±22,47% (р<0,01).
В дальнейшем во всех возрастных категориях женщины по своему БВ оказываются
«старше» мужчин аналогичного КВ. Подобную динамику, согласно полученным нами
данным, трудно связать с динамикой же липидного спектра, за исключением
показателей ТГ, и возможным нарастанием атеросклеротических изменений. Но вполне
возможно сопоставить это с происходящими изменениями в содержании СМП (рис. 31)
и в системе ПОЛ/АОА, в особенности средних значений пероксидазы (рис. 33).
Именно эти два показателя оказались значимо более позитивными при исследовании
мужчин в возрастных категориях от 30 до 45 лет. Можно даже предположить, что
именно значения СМП и пероксидазы более всего определяют отклонения БВ от КВ в
ту или иную сторону и служат основными биохимическими маркерами либо позитивных,
либо же негативных значений БВ в гендерном аспекте.
Таким образом, имеются определенные гендерные различия в динамике
целого ряда биохимических показателей по мере увеличения возраста. Эти различия
касаются липидного спектра, состояния ПОЛ/АОА системы крови, СМП, что
соответственно отражается на динамике БВ и темпе старения мужчин и женщин. У
мужчин в более молодом возрасте, чем у женщин, начинается постепенное нарастание
значений ТГ и ЛПНП, что определяет у них наличие более высокого КА,
свидетельствующего о первых признаках развивающегося атеросклероза. Но уже в
период пременопаузы, в 45-50 лет женщины становятся менее защищенными в плане
развития атеросклеротического процесса, и это выражается повышением у них
содержания ЛПНП именно в этот период, хотя в дальнейшем ситуация меняется –
значения ЛПНП у женщин стабилизируются, у мужчин продолжают неуклонно нарастать.
А вот наиболее высокие значения показателей ПОЛ регистрируются у представителей
обоих полов в достаточно молодом возрасте, от 30 до 50 лет, хотя у женщин – на
10-15 лет раньше, чем у мужчин. Это в определенной степени согласуется с
динамикой содержания СМП в сыворотке крови и может найти свое объяснение в
разных стрессовых ситуациях, которые испытывают как мужчины, так и женщины, но в
разные периоды их жизни. Ферменты АОА отчетливо реагируют на возрастную динамику
ПОЛ, но при этом повышение средних значений каталазы у женщин может
сопровождаться понижением данных значений у мужчин одной и той же возрастной
категории, и наоборот. В то же время содержание обоих ферментов АОА находится в
пределах референтных значений при отсутствии тяжелых, прогрессирующих
заболеваний в момент исследования, а показатели ПРЭ вообще меняются по мере
старения незначительно, но у женщин достигают своего «пика» в 40-50 лет, у
мужчин – в 60-70. Наконец, по показателям отклонений БВ от КВ мужчины, уже
начиная с возрастного периода 30-40 лет, оказываются в более позитивной ситуации
по сравнению с женщинами, несмотря на, казалось бы, более раннее развитие у
мужчин дислипидемий, указывающих на возможность более раннего формирования и
развития атеросклероза. Создается впечатление о том, что динамика показателей БВ
не столько связана с изменениями липидного спектра как у мужчин, так и у женщин,
сколько с динамикой содержания в сыворотке крови ферментов АОА, в первую очередь
пероксидазы, а также с уровнем СМП как показателей выраженности эндогенной
интоксикации, которая, в свою очередь, может зависеть от уровня и содержания
стрессовой нагрузки в разные возрастные периоды. Проведенное исследование в
очередной раз показало, что изучение процесса старения человека необходимо во
всех случаях проводить с учетом гендерных различий.
В продолжение представленного исследования показалось интересным
сравнить возрастную динамику и половые различия в состоянии липидного спектра и
стресс-реализующих систем человеческого организма. Идея данного исследования
была связана с тем, что процессы старения, формирования атеросклероза и стресса
в значительной степени связаны между собой. Атеросклероз, являясь по существу
отчетливо возрастзависимой патологией, в свою очередь потенцирует процесс
старения, переводя его из категории физиологического в категорию
патологического. В связи с этим возникает необходимость изучения общих для
старения и развития атеросклероза механизмов. Это представляется важным также с
точки зрения накапливающихся данных об интеграции сердечно-сосудистой, нервной,
эндокринной и иммунной систем в патогенезе основных возрастзависимых
заболеваний, в том числе обусловленных атеросклерозом (Фокин А.С., 2001; Тот
П.П., Мэки К.К., 2010; Коновалов С.С., Ильницкий А.Н., Прощаев К.И., Кветной
И.М., 2008; Лазебник Л.Б., Верткин А.Л., Конев Ю.В. и др., 2014).
В патогенезе атеросклероза обсуждается роль целого ряда
патогенетических факторов - биомаркеров атеросклероза, среди которых называются
С-реактивный белок, гомоцистеин, липопротеин (а), липопротеин-ассоциированная
фосфолипаза А2, миелопероксидаза, апопротеин В100, интерлейкины 6 и
18, натрийуретические пептиды, матриксные металлопротеиназы-9 и их тканевые
ингибиторы, фибриноген, тканевые активатор и ингибитор активатора плазминогена (Семенков
В.Ф., Карандашов В.И., Ковальчук Л.В., 2005; Сахарнова Т.А., Ведунова М.В.,
Мухина И.В., 2012). В свою очередь, многие белки острой фазы воспаления и
прооксидантные ферменты, участвующие в механизмах старения, в частности апоптоза,
в том числе в нервной ткани, запускают каскад событий, ведущий к
цереброваскулярной патологии, обусловленной атеросклерозом (Коновалов С.С.,
Ильницкий А.Н., Прощаев К.И., Кветной И.М., 2008; Гомазков О.А., 2011; Сахарнова
Т.А., Ведунова М.В., Мухина И.В., 2012). Развивающееся на этом фоне снижение
экспрессии ключевых нейротрофинов (ВDNF
и BNF) затрудняет реализацию их
плейотропных эффектов (Сахарнова Т.А., Ведунова М.В., Мухина И.В., 2012;
Chaldakov G.N.,
2011), снижает способность регулировать свободнорадикальные процессы и скорость
апоптоза (Гомазков О.А., 2011; Jeanneteau
F.
Chao M.V.,
2013), модулировать активность норадренергических систем головного мозга за счет
редукции норадренергических аксонов. Показана связь между содержанием ВDNF
в сыворотке крови, функцией коры надпочечников и психоэмоциональным и
соматическим статусом человека при стрессе (Гомазков О.А., 2011;
Jeanneteau F.
Chao
M.V.,
2013). Установлено, что BDNF, реализуя медленный путь воздействия, связывается с
двумя типами мембранных рецепторов - низкоаффинным рецептором к NGF, или p75, и
высокоаффинным рецептором В-TrkB с тирозинкиназной активностью (Гомазков О.А.,
2011; Сахарнова Т.А., Ведунова М.В., Мухина И.В., 2012;
Jeanneteau F.
Chao
M.V.,
2013). Комплекс нейротрофин - рецептор к NGF запускает внутриклеточные
механизмы, активирующие транскрипционный ядерный фактор NF-κB,
стресс-активируемые протеинкиназы и реакцию гидролиза сфингомиелина (Сахарнова
Т.А., Ведунова М.В., Мухина И.В., 2012). Также NF-kB участвует в регуляции
иммунного ответа, экспрессии генов клеточного цикла, апоптоза. Быстрый путь
регуляции BDNF реализуется за
счет прямого открытия ионных каналов, что изменяет потенциал клеточных мембран.
Гипотетически глюкокортикоиды при реализации стресс-реакции используют те же
рецепторы с тирозинкиназной активностью, что указывает на возможные конкурентные
взаимоотношения нейротрофинов и глюкокортикоидов не только на уровне мембранных
рецепторов, но и на пострецепторных этапах передачи сигнала. Это позволяет
говорить о нейротрофинах, как о звеньях стресс-реализующей системы (Мякотных
В.С., Торгашов М.Н., 2015; Jeanneteau
F.
Chao M.V.,
2013). Кроме того, универсальным модулятором физиологических и патологических
процессов, а также активным участником стресс-реакции, способным демпфировать
невротизацию, является мелатонин (Комаров Ф.И., Рапопорт С.И., Малиновский Н.К.,
Анисимов В.Н., 2004; Коркушко О.В., Хавинсон В.Х., Шатило В.Б., 2006), который
участвует также в регуляции функций сердечно-сосудистой системы, оказывая
влияние на частоту сердечных сокращений и сосудистый тонус, ингибируя агрегацию
тромбоцитов и изменяя концентрацию липопротеидов низкой плотности (ЛПНП).
Наконец, отмечено как антиоксидантное, так и прооксидантное действие мелатонина
и его геропротекторная активность в эксперименте на животных (Комаров Ф.И.,
Рапопорт С.И., Малиновский Н.К., Анисимов В.Н., 2004; Коновалов С.С., Ильницкий
А.Н., Прощаев К.И., Кветной И.М., 2008).
С учетом гетерокатефтенности и гетерокинетичности возрастных
изменений и сопутствующего вклада стресс-реализующих систем в процесс
формирования и развития атеросклероза (Фокин А.С., 2001; Чиркин А.А., Данченко
Е.О., Богуть С.Б., 2012) представилось интересным изучить динамику и
взаимоотношения показателей липидного спектра крови и некоторых составляющих
стресс-реализуюшей системы в возрастном и гендерном аспектах. Подобное
исследование было нами проведено (Мякотных В.С., Емельянов В.В., Гаврилов И.В. и
др., 2015).
Исследуемые лица (n=1136)
в возрасте от 20 до 98 лет в зависимости от возраста были изначально
подразделены на 8 групп: 20-29 лет (n=96),
30-39 лет (n=123), 40-49 лет (n=148),
50-59 лет (n=263), 60-69 лет (n=183),
70-79 лет (n=185), 80-89 лет (n=106),
90 и более лет (n=32). В
дальнейшем с целью усиления статистической значимости полученных сравнительных
результатов общее количество наблюдений было подразделено на три группы: 20-39
лет (n=219), 40-59 лет (n=411)
и 60 лет и старше (n=506). В
период проведения исследований все пациенты имели обычный режим труда и отдыха в
соответствии с возрастом и состоянием здоровья, не соблюдали какой-либо жесткой
диеты, не подвергались стрессам и хирургическим вмешательствам. Наряду с
практически здоровыми, среди обследуемых были лица, страдавшие клинически легко
и умеренно выраженными формами артериальной гипертонии, ишемической болезни
сердца, хронической цереброваскулярной болезни, хронических болезней органов
дыхания, пищеварения и почек вне обострения. Критериями исключения из
исследуемых групп наблюдений послужили практически все варианты клинически
выраженной, остро и хронически протекающей патологии, в том числе наследственные
дислипопротеинемии (ДЛП), недостаточность кровообращения и дыхательная
недостаточность выше 1-й стадии, хронические болезни почек выше 2-й стадии,
тяжелые неврологические и психические расстройства.
Показатели липидного спектра определялись унифицированными
энзиматическими методами. Для оценки состояния стресс-реализующих систем
исследовали суточную экскрецию с мочой ряда гормонов и их метаболитов.
Концентрацию свободного кортизола, мелатонина сульфата
(6-сульфатоксимелатонина), метанефрина и норметанефрина в моче, а также
мозгового нейротрофического фактора (BDNF)
в плазме крови определяли методом иммуноферментного анализа наборами фирмы «DRG»
на автоматическом иммуноферментном анализаторе «Chemwell»
(модель 2910, производитель Awareness Techonology, Inc,
США).
В процессе исследования у пациентов разного возраста и пола
обнаружен ряд различий в показателях липидного спектра крови (табл. 49).
Таблица 49. Сравнительная характеристика
показателей липидограммы у пациентов разного возраста
|
Возраст (лет) |
Пол |
Средние показатели липидограммы |
|
ХС (мМоль/л) |
ЛПНП (мМоль/л) |
ЛПВП (мМоль/л) |
ТГ (мМоль/л) |
КА |
|
20-29 (n=96) |
М. (n=59) |
3,85±0,038 |
2,31±0,052 |
1,18±0,025 |
0,71±0,039 |
2,26±0,071 |
|
Ж. (n=37) |
3,89±0,042 |
2,28±0,043 |
1,26±0,015 |
0,61±0,029 |
2,09±0,062 |
|
30-39 (n=123) |
М. (n=88) |
4,56±0,029 |
3,04±0,060 |
1,17±0,018 |
1,35±0,034 |
2,90±0,083 |
|
Ж. (n=35) |
4,23±0,034 |
2,45±0,031 |
1,42±0,014 |
1,02±0,037 |
1,98±0,064 |
|
40-49 (n=148) |
М. (n=101) |
5,64±0,056 |
3,38±0,042 |
1,11±0,018 |
2,24±0,031 |
4,08±0,052 |
|
Ж. (n=47) |
4,85±0,036 |
3,0±0,053 |
1,40±0,024 |
0,76±0,026 |
2,46±0,049 |
|
50-59 (n=263) |
М. (n=168) |
5,28±0,031 |
3,16±0,037 |
1,10±0,020 |
2,21±0,035 |
3,80±0,063 |
|
Ж. (n=95) |
4,83±0,029 |
3,0±0,046 |
1,23±0,019 |
1,40±0,032 |
2,93±0,054 |
|
60-69 (n=183) |
М. (n=130) |
5,17±0,035 |
3,16±0,033 |
1,13±0,028 |
1,75±0,026 |
3,58±0,071 |
|
Ж. (n=53) |
5,28±0,056 |
3,51±0,042 |
1,20±0,019 |
1,31±0,031 |
3,40±0,053 |
|
70-79 (n=185) |
М. (n=116) |
5,12±0,053 |
3,21±0,051 |
1,17±0,018 |
1,33±0,046 |
3,38±0,082 |
|
Ж. (n=69) |
5,22±0,061 |
3,23±0,054 |
1,22±0,017 |
1,37±0,027 |
3,28±0,078 |
|
80-89 (n=106) |
М. (n=58) |
5,19±0,066 |
3,53±0,071 |
1,15±0,023 |
1,37±0,036 |
3,51±0,067 |
|
Ж. (n=48) |
5,15±0,057 |
3,21±0,084 |
1,21±0,022 |
1,32±0,034 |
3,26±0,084 |
|
> 90 (n=32)
|
М. (n=18) |
4,11±0,124 |
2,51±0,140 |
0,95±0,015 |
1,41±0,055 |
3,33±0,101 |
|
Ж. (n=14) |
4,72± 0,068 |
2,78± 0,071 |
1,01±0,033 |
1,52±0,074 |
3,67±0,183 |
Это в определенной степени совпадает с ранее полученными нами
данными (Мякотных В.С., Березина Д.А., Боровкова Т.А., Гаврилов И.В., 2014).
Группы лиц среднего и пожилого и старческого возрастов отличались от группы
молодых пациентов большими средними значениями показателей ХС, ЛПНП, ТГ и КА. Но
наибольшей выраженности атерогенные сдвиги липидного спектра крови достигли у
лиц среднего возраста в диапазоне 50-59 лет (n=263),
в особенности мужчин (n=168),
что согласуется с концепцией онтогенетических изменений липидного обмена (Чиркин
А.А., Данченко Е.О., Богуть С.Б., 2012).
При подразделении выделенных групп по типу дислипидемии (ДЛП)
оказалось, что в целом среди наших наблюдений преобладали лица с условно
нормальными показателями (n=817;
71,9%), и в разных половозрастных группах относительная доля лиц с данными
нормальными показателями колебалась в диапазоне от 60,1 до 81,3%. Тем не менее,
в двух выделенных группах женщин, в возрасте от 40 до 49 лет и от 50 до 59 лет (n=142),
статистически значимо (рχ2<0,001) определялась наименьшая доля лиц с
нормальным липидным спектром (n=86;
60,6%). Среди мужчин подобный «всплеск» отсутствовал, и тенденция к постепенному
уменьшению числа лиц с нормальными показателями липидного спектра сохранялась и
при дальнейшем увеличении возраста, вплоть до 89 лет.
Оставшиеся 319 (28,1%) наблюдений, в которых обнаружены отчетливые
патологические сдвиги показателей липидного спектра, были ранжированы на три
группы в зависимости от возраста: а) 20-39 лет (n=57);
б) 40-59 лет (n=106); в) 60 и
более лет (n=156). Подобное
подразделение, на наш взгляд, наиболее полно отвечало требованиям
статистического анализа, т.к. с одной стороны, увеличивало количество наблюдений
в каждой из сравниваемых групп, с другой, исключало «близкие» значения
усредненных показателей, нередко имевшие место при подразделении на исходные 8
групп.
Показатели нарушенного липидного спектра крови были фенотипированы
как 2a, 2b,
4 типы по классификации Фредериксона-ВОЗ, либо как изолированное снижение уровня
ЛПВП (гипо-α-холестеринемия). Фенотипы ДЛП 1, 3, 5 у обследованных пациентов не
регистрировались. В итоге была выявлена различная частота присутствия ряда типов
ДЛП у лиц разного возраста и пола (рис. 36)
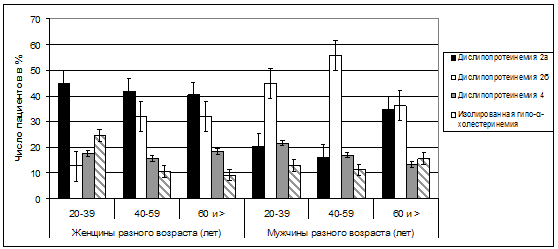
Рис. 36. Варианты типов ДЛП в зависимости от
возраста и пола.
При сравнении показателей, представленных в табл. 49 и на рис.36,
были выявлены следующие тенденции.
Среди женщин в возрасте от 20 до 39 лет (n=19)
наблюдалось статистически значимое преобладание доли лиц с 2a
типом ДЛП и изолированным снижением ЛПВП (p
χ2=0,025), по сравнению с женщинами старше 40 лет. Среди женщин в возрасте
старше 40 лет (n=88) отчетливо
увеличивалась доля лиц с гипертриглицеридемией, что позволяло чаще
диагностировать у них 2b и 4
типы ДЛП. И в этом отношении убедительных различий между женщинами в возрасте
40-59 лет (n=36) и в возрасте
старше 60 лет (n=52), имеющими
признаки ДЛП, не выявлялось. Но все же наиболее высокие средние показатели ЛПНП
определялись среди всех женщин в возрасте от 60 до 69 лет (n=53)
независимо от присутствия или отсутствия у них признаков ДЛП - 3,51±0,042 мМоль/л
(табл. 49).
Распределение мужчин по типам ДЛП оказалось иным. Во всех
выделенных возрастных группах у них преобладал 2b
тип ДЛП, в особенности среди лиц в возрасте от 40 до 59 лет (n=70).
В то же время после 60 лет (n=104)
среди мужчин отчетливо увеличивалась доля лиц с 2a
типом ДЛП, а доля лиц с гипертриглицеридемией сокращалась (pχ2=0,001).
В конечном счете, оказалось, что в отношении присутствия различных
типов ДЛП у представителей разного возраста и пола отчетливые половые различия
имеют место у лиц в возрасте до 60 лет, т.е. в молодом и среднем возрасте, в
котором как раз и происходят основные процессы формирования и развития
атеросклероза. Именно в эти периоды выявляется отчетливое преобладание 2a
типа ДЛП у женщин (рχ2<0,001) и 2b
и 4 типа ДЛП у мужчин (рχ2<0,001). В пожилом и старческом возрасте
подобные половые различия уже не обнаруживаются, и в отношении частоты
присутствия отдельных вариантов ДЛП оба пола «сближаются» между собой. Возможно,
обнаруженные половозрастные различия в определенной степени связаны с теми
«мишенями» атеросклероза, которые представляются различными у мужчин и женщин, и
с возрастом манифестации клинических проявлений поражения указанных «мишеней»,
также различном у представителей разного пола. (Липовецкий Б.М., 2010; Мякотных
В.С., Березина Д.А., Боровкова Т.А., Гаврилов И.В., 2014). Не исключено также
значение и фундаментальных механизмов старения, проявляющихся, в том числе, в
разнонаправленных нарушениях липидного обмена по отношению к полу и возрасту.
В процессе определения состояния стресс-реализующих систем у
разного количества пациентов вне зависимости от присутствия или отсутствия у них
признаков ДЛП получены следующие показатели (табл. 50).
Таблица 50. Усредненные показатели состояния
стресс-реализующих систем в зависимости от возраста обследуемых лиц
|
Показатель |
Возрастные категории пациентов (лет) |
|
20-39 |
40-59 |
60 и > |
|
BDNF (пг/мл сыворотки крови) |
95,20±17,01
(n=21) |
101,84±14,02
(n=56) |
84,18±16,02
(n=32) |
|
Свободный кортизол (мкг / 24 часа) |
91,09±8,68
(n=50) |
96,52±7,92
(n=68) |
85,47±22,0
(n=14) |
|
Мелатонин сульфат (мкг / 24 часа) |
10,37±3,06 (n=28) |
7,27±2,38
(n=29) |
8,62±3,92
(n=7) |
|
Метанефрин (мкг / 24 часа) |
5,1±0,45
(n=29) |
4,37±0,37
(n=43) |
4,8±1,16
(n=7) |
|
Норметанефрин (мкг / 24 часа) |
7,1±0,48 2
(n=92) |
7,4± 0,65 3
(n=166) |
5,1±0,5 2,3=
(n=111) |
Выявлено, что в период от 40 до 59 лет наблюдается некоторое
повышение содержания в крови BDNF,
в среднем на 6,97%, а затем, после 60-летнего возраста – снижение данного
показателя на 17,34%. Подобного же рода динамика наблюдается и в отношении
экскреции свободного кортизола с суточной мочой. Экскреция же мелатонина
сульфата и метанефрина, наоборот, снижется у лиц в возрасте 40-59 лет по
отношению к лицам 20-39 лет соответственно на 29,89% и 14,31%, а затем, после 60
лет вновь несколько повышается – соответственно на 18,57% и 9,84%, хотя и не
достигает уровня молодого возраста. Уровень экскреции с мочой норметанефрина в
значительной степени снижается после 60 лет, в среднем на 31,08% от
соответствующего уровня в возрастном диапазоне 40-59 лет.
При анализе полученных данных по отношению к полу обследуемых не
было выявлено существенных гендерных различий в отношении суточной экскреции
метанефрина и норметанефрина у представителей разного возраста. Что же касается
концентрации BDNF в сыворотке
крови, а также суточной экскреции свободного кортизола и мелатонина сульфата с
мочой у пациентов разного возраста и пола, то здесь были очевидными не только
возрастные, но и половые различия (рис. 36 - 38).
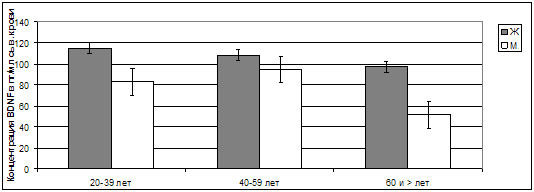
Рис. 36. Концентрация
BDNF в сыворотке крови у
пациентов разного возраста и пола.
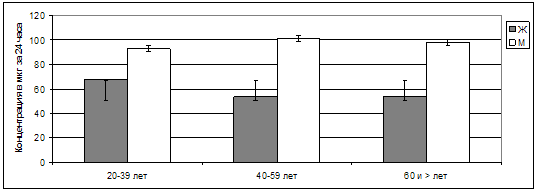
Рис. 37. Суточная экскреция свободного кортизола
с мочой у пациентов разного возраста и пола.
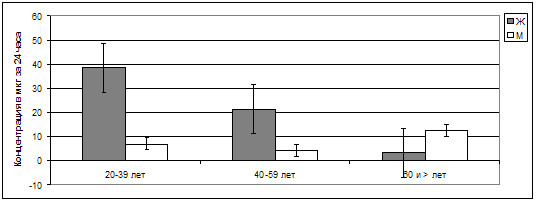
Рис. 38. Суточная экскреция мелатонина сульфата с
мочой у пациентов разного возраста и пола.
Возрастные изменения концентрации BDNF
в сыворотке крови мужчин в определенной степени повторяли общую динамику вне
зависимости от пола обследуемых, но снижение данной концентрации после 60 лет
представлялось очень значительным – с 94,55±16,70 пг/мл у лиц в возрасте 40-59
лет до 51,29±5,40 пг/мл у представителей пожилого и старческого возраста, т.е.
на 45,75% (р<0,01). У женщин снижение концентрации
BDNF происходило очень постепенно, плавно и незначительно
– с 115,28±37,50 пг/мл в возрасте от 20 до 39 лет до 97,05±21,72 пг/мл в
возрасте старше 60 лет (р>0,05).
У мужчин во всех выделенных возрастных категориях оказалась в
значительной степени более высокой суточная экскреция свободного кортизола с
мочой – в диапазоне 92,57±9,18 – 100,70±8,43 мкг за 24 часа при незначительном
увеличении показателей, на 8,78%, в возрасте после 40 лет (р>0,05). У женщин же
показатели суточной экскреции свободного кортизола колебались в разные
возрастные периоды от 67,91±9,05 до 53,36±12,10 мкг за 24 часа при их снижении в
возрасте после 40 лет на 21,43% от исходных в возрасте 20-39 лет (р<0,05).
Наибольшие гендерные различия выявлены в отношении суточной
экскреции мелатонина сульфата с мочой. У мужчин данный показатель уже в возрасте
от 20 до 39 лет оказался значительно ниже, чем у женщин той же возрастной
категории соответственно 6,99±2,10 и 38,49±17,20 мкг за 24 часа (р<0,001). Но в
дальнейшем после некоторого снижения в возрасте от 40 до 59 лет у мужчин,
преодолевших 60-летний рубеж, суточная экскреция мелатонина сульфата возросла до
12,51±6,44 мкг за 24 часа, т.е. на 78,97% по отношению к исходной в возрасте
20-39 лет (р<0,01). У женщин снижение уровня экскреции мелатонина сульфата по
отношению к выделенным возрастным категориям происходило плавно, без «скачков»,
и в возрасте старше 60 лет уровень данной экскреции оказался 3,42±0,92 мкг за 24
часа, что в 3,66 раза ниже (р<0,01) аналогичного показателя у мужчин.
При подразделении наших наблюдений на подгруппы в зависимости от
присутствия или же, наоборот, отсутствия у исследуемых лиц признаков ДЛП
некоторые различия выявлены только в отношении концентрации
BDNF в сыворотке крови. При отсутствии
признаков ДЛП (n=73) данный
усредненный показатель, вне зависимости от возрастной категории, оказался равным
90,83±19,87 пг/мл, при наличии признаков ДЛП (n=36),
вне зависимости от типа ДЛП, 76,33±10,46 пг/мл (р>0,05). Убедительных гендерных
различий также не получено. Тем не менее, при проведении корреляционного анализа
суточная экскреция метанефрина в целом обнаружила прямую корреляцию с уровнем
BDNF (r=0,75
p<0,05) при обратной корреляции
с возрастом (r= -0,93; р<0,01)
вне зависимости от пола. Также обнаружены достаточно сильные корреляционные
связи между суточной экскрецией свободного кортизола с мочой и концентрацией
ЛПНП (r=0,95,
p<0,05) и показателями КА (r=0,99,
p<0,05); между суточной
экскрецией метанефрина и показателями КА (r=0,75,
p<0,05). Полученные результаты
могут свидетельствовать о возможном влиянии возрастных различий
нейрогуморального «фона» на скорость процессов атерогенеза. Это не противоречит
тому, что глюкокортикоиды и катехоламины обладают сходным проатерогенным
действием, реализующимся на уровне регуляции липидного обмена и сосудистой
стенки (Фокин А.С., 2001; Мякотных В.С., Торгашов М.Н., 2015). Возможно,
возрастное снижение реактивности гипоталамо-гипофизарно-надпочечниковой и
симпато-адреналовой систем в сочетании с некоторым повышением продукции
мелатонина, в том числе экстрапинеального, в особенности у мужчин, может играть
адаптивную роль, снижая темпы прогрессирования атеросклероза после 60 лет даже
при существующей ДЛП. Кроме того, полученные данные могут указывать на
взаимосвязь BDNF и
стресс-реализующих систем, и именно поэтому BDNF,
как уже указывалось, можно рассматривать в качестве одного из звеньев указанных
стресс-реализующих систем. С учетом возможной физиологической протекторной роли
BDNF в отношении миокарда и
сосудистой стенки (Jiang
H., Liu
Y.,
Zhang Y.,
Chen
Z., 2011; Marion
A.,
Bowman H.,
McWally
M., 2012) становится вполне вероятным,
что высокий уровень защитного BDNF
в молодости компенсирует проатерогенное влияние глюкокортикоидов и
катехоламинов. В то же время в пожилом и старческом возрасте «равновесие»
достигается при более низких уровнях как тех, так и других показателей.
Таким образом, проведенное нами исследование определило отчетливые
возрастные и половые различия как в динамике показателей липидного спектра, так
и в плане частоты встречаемости различных типов ДЛП. Это может определять разные
пути формирования и развития атеросклероза у мужчин и женщин в разные возрастные
периоды, в том числе и по отношению к атеросклеротическому поражению разных
органов – «мишеней». Разная динамика ряда показателей состояния
стресс-реализующих систем по отношению к возрасту и полу может свидетельствовать
о принципиальных различиях в степени защищенности, адаптации организма мужчин и
женщин разного возраста, в том числе в плане темпов прогрессирования
атеросклероза и процесса старения. Имеющиеся корреляции между некоторыми
показателями состояния стресс-реализующих систем и концентрации атерогенных
фракций липидов заставляют предположить возможность практического использования
полученных данных для наиболее ранней, доклинической диагностики и
прогнозирования атеросклероза и патологического старения. Более того, вполне
оправданным для лечения женщин и профилактики у них ускоренного старения может
оказаться использование адаптогенов, содержащих аналоги мелатонина, например
известный препарат «Мелаксен». А вот у мужчин для достижения таких же целей
могут быть рекомендованы лекарственные препараты, обладающие эффектом
воздействия факторов роста, например, кортексин, церебролизин, актовегин. |