Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Глава I. Этиология, патогенез, классификация,современное
течение
1.1. Этиология современного инфекционного эндокардита
Инфекционный эндокардит является полиэтиологичным заболеванием. В настоящее
время в качестве возбудителей болезни известны более 128 микроорганизмов. К
частым возбудителям ИЭ относят стафилококки, стрептококки, грамотрицательные и
анаэробные бактерии, грибы. В странах Европы стафилококки выделяют у 31,4-36,9 %
больных, грамотрицательные бактерии – у 30,4-35,5 %, энтерококки – у 18,4-21,7
%, зеленящий стрептококк – у 17,1-19,7 %. На преобладание стафилококков,
стрептококков и грамотрицательных бактерий в микробном пейзаже заболевания
указывают многие американские и канадские авторы.
Исследования, проведенные в 90-е годы в тридцати госпиталях США, показали
следующее соотношение возбудителей ИЭ: staрh. aureus – 56,6 %, str. viridans –
31,2 %, staрh. epidermidis – 13,2 %, энтерококки и другие бактерии – 5,6 %
случаев. По данным отечественных авторов, удельный вес стафилококков составляет
– 45-56 %, стрептококков – 12,6-25,8 %, энтерококков – 0,5-20 %, анаэробный
бактерий – 12 %, грамотрицательных бактерий – 3-8 %, грибов – 2-3 % от
положительных гемокультур.
Вид возбудителя во многом определяет летальность от ИЭ. Если в 50-60-е годы
преобладал зеленящий стрептококк, то в последние десятилетия 20-го века
основными возбудителями инфекционного эндокардита стали эпидермальный и
золотистый стафилококк, которые выделяют у 75-80 % больных с положительной
гемокультурой. Смертность при ИЭ, вызванном золотистым стафилококком, составляет
60-80 %.
В последние десятилетия среди возбудителей ИЭ вырос удельный вес
грамотрицательных бактерий группы НАСЕК (4-21 %) и грибов (до 4-7 %). В качестве
возбудителей чаще выступают дрожжеподобные и истинные грибы (рода Candida,
Aspergillus), которые обладают выраженной тропностью к эндокарду. Смертность при
грибковом ИЭ достигает 90-100 %, а при ИЭ, вызванном грамотрицательной
микрофлорой – до 47-82 %.
В 80-90-е годы увеличилось количество случаев ИЭ, вызванного анаэробной (8-12
%) микрофлорой. Анаэробный эндокардит характеризуется высокой активностью
инфекционного процесса, резистентностью к антибактериальной терапии, повышенной
госпитальной летальностью (до 46-65 %). К особенностям течения анаэробного
эндокардита относят частое (41-64,5 %) образование тромбофлебитов, тромбоэмболий
в сосуды лёгких, сердца и головного мозга.
Основное значение среди возбудителей ИЭ имеют представители родов
Staphylococcus, Streptococcus, Enterococcus, Escherichia, Salmonella, Shigella,
Proteus, Klebsiella, Yersinia, Candida, Aspergillus.
Грамположителыные кокки. Группу аэробных, факультативных
грамположительных кокков образуют разнообразные по свойствам бактерии, которые
объединяет два общих свойства - сферическая форма и положительная окраска по
Граму. Они не образуют спор, подавляющее большинство не обладает подвижностью.
Медицинское значение имеют кокки семейств Micrococcaceae, Streptococcaceae.
Основными принципами дифференцировки являются наличие или отсутствие цитохромов
(отсутствуют у streptococcaceae), каталазной активности (отсутствует у
большинства streptococcaceae). Каталазаположительные стрептококки дифференцируют
от бактерий семейства Micrococcaceae с помощью бензидиновой пробы, положительной
у цитохромсодержащих бактерий. Представители семейства Micrococcaceae, способные
вызвать ИЭ, входят в роды Staphylococcus, Micrococcus, Stomatococcus.
Poд Staphylococcus представлен неподвижными кокками диаметром 0,5-1,5
мкм, располагающимися одиночно, парами или гроздьями, что обусловлено
способностью делиться во взаимно перпендикулярных плоскостях. Стафилококки
неподвижны, являются факультативными анаэробами, хемоорганотрофами с
окислительным и ферментативным метаболизмом, каталазаположительны. Содержат
цитохромы, но большинство видов обычно оксидазаотрицательны.
Бактерии растут на средах с 5-10 % раствором NaCl, температурный оптимум -
30-37°С. Предпочтительна слабощелочная реакция среды. На плотных средах образуют
мутные, круглые, ровные колонии кремового, жёлтого, оранжевого цвета. Цвет
колоний обусловлен наличием липохромного пигмента. Его образование происходит в
присутствии кислорода, наиболее выражено на средах, содержащих кровь, углеводы,
молоко. На 4-5-е сутки вызывают характерное разжижение желатина с образованием
воронки, заполненной жидкостью.
На жидких средах дают равномерное помутнение, а затем рыхлый осадок,
превращающийся в тягучую массу. Восстанавливают нитраты, разлагают глюкозу,
ксилозу, сахарозу, мальтозу, глицерин, маннит с выделением кислоты. Крахмал не
гидролизуют, индол не образуют, уреазаположительны. Видоспецифичными антигенами
являются тейхоевые кислоты: для staph. aureus - рибиттейхоевые, для staph.
epidermidis – глицеринтейхоевые, для staph. saprophyticus - обе кислоты.
Стафилококки хорошо переносят высушивание, сохраняя вирулентность. Довольно
устойчивы к нагреванию. Менее устойчивы к действию дезинфектантов, но
резистентны к воздействию 96 %-го этилового спирта. На коже, слизистых
обнаружены 14 из 27 известных видов: s. aureus, s. epidermidis, s. saprophyticus,
s. hominis, s. haemolyticus, s. wameri, s. capitis, s. saccharolyticus, s.
auricularis, s. simulans, s. cohni, s. xylosus, s. lugdunensis, s. schleiferi.
Большинство из них лучше растёт в аэробных условиях. По наличию коагулазы
стафилококки разделяют на две группы. Среди патогенных видов
коагулаза-положителен лишь s. aureus. Остальные виды являются
коагулаза-отрицательными. Основными возбудителями ИЭ являются s. aureus, s.
epidermidis, s. saprophyticus.
Staphylococcus aureus. Золотистый стафилококк входит в состав нормальной
микрофлоры человека, обычно колонизирует носовые ходы, брюшную полость,
подмышечные области. Хроническое носительство типично для персонала медицинских
учреждений, пациентов, страдающих атопическими дерматитами, наркоманов, больных
сахарным диабетом, лиц с хроническим гемодиализом. Стафилококковая бактериемия
развивается из катетеров, ран, очагов поражений кожи (стрептодермия). В 20 %
случаев причину бактериемии установить не удаётся. Циркуляция возбудителя в
крови вызывает повреждение различных органов. Приблизительно у 40 % пациентов с
бактериемией развивается ИЭ.
Факторами патогенности золотистого стафилококка являются микрокапсула,
компоненты клеточной стенки, ферменты, токсичные вещества. Микрокапсула защищает
бактерии от комплемент-опосредованного поглощения полиморфноядерными фагоцитами,
способствует адгезии микроорганизмов, распространению в ткани. Компоненты
клеточной стенки стимулируют развитие воспалительной реакции, усиливают синтез
ИЛ-1 макрофагами, активируют систему комплемента, являются мощными
хемоаттрактантами для нейтрофилов. Тейхоевые кислоты запускают комплементарный
каскад по альтернативному пути, активируют свёртывающую и калликреинкининовую
системы, способствуют адгезии к эпителию. Белок А (агглютиноген А) связывает
Fе-фрагменты IgG, усиливает активность Т-киллеров. Ферменты проявляют
разнонаправленное действие: каталаза защищает бактерии от действия микробицидных
механизмов фагоцитов, b-лактамаза разрушает молекулы b-лактамных антибиотиков.
Липазы облегчают адгезию и проникновение в ткани. Коагулаза вызывает свёртывание
сыворотки крови в результате образования тромбиноподобного вещества,
взаимодействующего с протромбином.
Золотистый стафилококк синтезируют 4 типа гемолизинов. А-гемолизин (а-токсин)
выявляют наиболее часто, неактивен в отношении эритроцитов человека, но быстро
лизирует эритроциты барана. При введении подопытным животным вызывает кожные
некротические реакции, гибель. Р-гемолизин (сфингомиелиназа) оказывает умеренное
действие на эритроциты человека. Обладает выраженными свойствами холодового
гемолизина. Максимально активен при низких температурах. Его выявляют у 20 %
изолятов. Y-гемолизин - двухкомпонентный гемолизин с умеренной активностью в
отношении эритроцитов человека. B-гемолизин обладает цитотоксичностью широкого
спектра. Из токсинов наибольшее значение имеют эксфолиатины А и В,
обусловливающие развитие токсического шока за счёт стимуляции выделения ФНО-L,
выраженного цитотоксического действия на полиморфно-ядерные лейкоциты.
Бактериологическое выделение стафилококка проводят по стандартной схеме.
Через 24 часа s. aureus образует гладкие выпуклые мутные колонии обычно
желтоватого цвета около 4 мм в диаметре. Наиболее интенсивно пигмент образуется
на агаре с добавлением 10 %-го молока. На кровяном агаре колонии окружены зоной
полного гемолиза. Иногда формируются карликовые G-колонии (менее 1 % изолятов).
Они лишённые зон гемолиза, растут в виде сателлитных колоний в смешанных
культурах. Стафилококки способны образовывать полиморфные L-формы. Хорошо растут
на бульоне, образуя сначала равномерное помутнение, а затем рыхлый хлопьевидный
осадок. Дают характерный рост на желатине. Через 24-28 ч происходит разжижение
среды, а на 4-5-е сутки образуется направленная вниз воронка, наполненная
жидкостью.
Для дифференцировки используют коагулазный тест на свёртывающий фактор
(положительный для 95 % изолятов), определяют способность ферментировать маннит,
исследуют способность синтезировать термостабильную ДНК-азу, агглютинировать
частицы латекса. Последний тест позволяет выявлять белок А и свёртывающий
фактор, либо оба продукта. В отличие от грамотрицательных бактерий, образование
золотистым стафилококком b-лактамаз и хлорамфеникол-трансфераз происходит только
в присутствии антибиотиков. Метод типирования стафилококков бактериофагами
широко применяют в клинической практике. Для фаготипирования используют
стандартный набор из 20 бактериофагов, с помощью которых определяют 60-80 %
изолятов бактерий.
Staphylococcus epidermidis. Наиболее часто колонизирует кожу, слизистые.
Микроорганизм характеризуется слабой вирулентностью. Подавляющее большинство
инфекций носит нозокомиальный характер у пациентов с пониженной резистентностью.
Типичными для эпидермального стафилококка считают инфекции, обусловленные
инфицированием протезов, катетеров, дренажей или гематогенным распространением
возбудителя после хирургических операций.
Важнейшими факторами вирулентности считают гидрофобные свойства капсулы,
облегчающие адгезию, а также поверхностный полисахаридный слой, защищающий от
микробицидных, цитотоксических механизмов защиты. Важное патогенетическое
значение имеют компоненты клеточной стенки, стимулирующие развитие
воспалительной реакции.
Диагностика включает выделение возбудителя по стандартной схеме.
Микроорганизм не проявляет гемолитическую активность, на кровяном агаре образует
белые, гладкие, выпуклые колонии. Основным методом дифференцировки от s. aureus
считают определение коагулазной активности. Выделенный коагулаза-отрицательный
стафилококк следует дифференцировать от микрококков, чаще образующих жёлтые
негемолизирующие колонии.
Staphylococcus saprophyticus колонизирует кожу гениталий, слизистую
уретры. Прикреплению, росту на эпителий мочевыводящих путей способствуют
олигосахаридные поверхностные рецепторы, ферментативные комплексы, подавляющего
рост других бактерий. Выделение проводят по стандартной схеме, идентификацию -
по чувствительности к новобиоцину и бацитрацину (чувствителен), особенностям
физиологии, метаболизма.
Poд Streptococcus образуют сферические или овоидные клетки размером 0,5-2
мкм. В мазках располагаются парами, короткими цепочками. Под различными
воздействиями могут приобретать вытянутую или ланцетовидную форму, напоминая
коккобациллы. Эти бактерии спор не образуют, неподвижны. Некоторые виды имеют
капсулу, хемоорганотрофы, метаболизм бродильный. Ферментируют глюкозу с
образованием молочной кислоты, каталаза-отрицательны. Большинство видов
проявляет гемолитическую активность, являются факультативными анаэробами,
образуют L-формы. Растут на средах при температуре 25-45оС,
температурный оптимум - 37°С.
Стрептококки классифицируют по наличию специфических углеводов в клеточной
стенке. Выделяют 17 серогрупп, обозначаемых заглавными латинскими буквами по
специфичности белковых антигенов М, Р, Т. Используют классификацию К. Брауна
(1919), основанную на особенностях роста в агаре с кровью барана. Выделяют а -
(частичный гемолиз, позеленение среды), р - (полностью гемолизирующие), у -
(визуально невидимый гемолиз) стрептококки.
Streptococcus group А. Стрептококки этой группы колонизируют кожу,
слизистые. Выраженная адгезия снижает вероятность элиминации с секретом, что
обеспечивает быструю колонизацию. Основным адгезином является липотейхоевая
кислота, покрывающая поверхностные фимбрии бактерий. Фимбриальный белок (белок
М) - основной фактор вирулентности, типоспецифический антиген, препятствующий
реализации фагоцитарных реакций. Он связывает фибриноген, фибрин, продукты его
деградации. Белок М обладает свойствами суперантигена, вызывая поликлональную
активацию лимфоцитов, образование антител с низким аффинитетом. Подобные
свойства имеют важное значение в нарушении толерантности к антигенам, развитии
аутоиммунопатологии.
Фактором вирулентности является капсула, защищающая стрептококки от
антимикробного потенциала фагоцитов, облегчающая адгезию к эпителию. Бактерии
способны самостоятельно разрушать капсулу за счёт синтеза гиалуроновой кислоты.
Гиалуронидаза участвует в разрушении соединительно-тканной стромы и, возможно,
участвует в запуске аутоиммунных реакций. Третьим фактором, подавляющим
активность фагоцитов, является пептидаза. Фермент расщепляет и инактивирует
С5а-компонент комплемента, являющийся мощным хемоаттрактантом.
Несмотря на подавление активности фагоцитов, стрептококки инициируют
выраженную воспалительную реакцию, во многом обусловленную секрецией более 20
растворимых продуктов. Часть из них составляют ферменты стрептолизины S, О,
гиалуронидаза, ДНК-азы, НАД-азы, стрептокиназа, другую часть - эритрогенные
токсины. Стрептолизин О чувствителен к кислороду, проявляет иммуногенные
свойства, вызывает гемолиз эритроцитов в глубине кровяного агара. Стрептолизин S
резистентен к О2, не несёт антигенной нагрузки, вызывает
поверхностный гемолиз на кровяных средах. Оба фермента разрушают не только
эритроциты, но и фагоциты, поглотившие их. Их роль в патогенезе поражений
остаётся недостаточно изученной, но их активируют многие сывороточные агенты (фосфолипиды).
Пирогенные токсины схожи с токсинами стафилококков, подразделяются на 3 типа
(А, В, С). Проявляют пирогенную активность за счёт непосредственного действия на
гипоталамус, вызывают развитие высыпаний на коже. Кардиогепатический токсин
продуцируют некоторые штаммы стрептококков группы А. Токсин вызывает поражение
миокарда, образование гигантоклеточных гранулём в печени. Стрептокиназа
активирует плазминоген, что приводит к образованию плазмина, растворению
фибриновых волокон. Гиалуронидаза облегчает перемещение бактерий по
соединительной ткани. Лабораторная диагностика основана на выделении
возбудителя, так как прочие методы имеют различные ограничения.
Через 24 часа на кровяном агаре образуются колонии 3-х типов: крупные,
блестящие, вязкие, напоминающие каплю воды (s. pyogenes); серые, матовые,
зернистые, с неровным краем (характерны для свежевыделенных вирулентных изолятов,
имеющих М-антиген); выпуклые прозрачные колонии диаметром около 0,1-0,3 мм
характерны для авирулентных лабораторных штаммов. Колонии окружены зоной полного
гемолиза, превышающей в 2-4 раза диаметр колонии. На жидких средах дают
придонный, иногда поднимающийся вверх рост.
В мазках выявляют типичные грамположительные кокки, образующие короткие
цепочки. Обнаруживают полиморфные формы, напоминающие коринебактерии или
лактобациллы, грамотрицательные формы у лиц, получавших антибиотики. Для
дифференцировки бактерии засевают на тиогликолевую среду, полужидкий агар.
Выросшие стрептококки отличаются типичной морфологией. Можно произвести посев на
кровяной агар и нанести на его поверхность диск, пропитанный пенициллином (10 ЕД).
Через 24 часа исследуют мазки из колоний. Стрептококки приобретают сферическую
форму, а лактобациллы сохраняют вытянутую форму. Более 99 % бактерий
чувствительно к бацитрацину, гидролизуют пирролидонил-нафтиламид.
Streptococcus group В. Колонизируют носоглотку, кишечник, влагалище.
Значительная часть изолятов идентифицирована как s. agalactiae. Его основным
резервуаром считают желудочно-кишечный тракт. Стрептококки этой группы разделяют
на серовары Ia, Ib, Ic, II, III. Инфекционный эндокардит развивается при
гематогенной диссеминации возбудителя. Это обусловлено дефицитом специфических
антител.
Определённую роль играет полисахаридная капсула, снижающая эффективность
фагоцитарных реакций. Как патогенетический фактор следует рассматривать
нейраминидазу, модифицирующую мембрану клеток и облегчающую адгезию
микроорганизмов. Бактериемия часто возникает у людей пожилого возраста, а также
лиц, страдающих сахарным диабетом, заболеваниями периферических сосудов, печени,
злокачественными новообразованиями.
Принципы лабораторной диагностики аналогичны схеме выделения стрептококков
группы А. Колонии, выросшие на кровяном агаре через 24 часа, прозрачные или
мутноватые, выпуклые, диаметром 0,5-1 мм, окружены зоной гемолиза. До 15 %
изолятов не проявляют гемолитических свойств. При выделении атипичных форм
используют посев на тиогликолевую среду, полужидкий агар, агар с глюкозой. Далее
делают пересев на кровяной агар, используют диски с пенициллином. Стрептококки
группы В нечувствительны к бацитрацину, разлагают гиппурат. Дальнейшую
идентификацию проводят серотипированием в реакции латекс-агглютинации,
коагглютинации. Используют инкубацию с моноклональными антителами, меченными
флюоресцеинами.
Streptococcus group С, G колонизируют кожу, зев, мочеполовую систему,
кишечник. У человека наиболее часто выделяют s. equisimilis, s. dysgalactiae, s.
zooepidermicus, s. equi и недифференцированные виды, образующие крупные колонии.
К этой группе относятся некоторые изоляты s. anginosus, не проявляющие
микроаэрофильных или анаэробных свойств. Основные факторы патогенности:
гиалуронидаза, фибринолизины, стрептокиназа, стрептолизин О, эритрогенные
токсины. s. defectives и s. adjacens, требующие для роста внесения в среду
витамина В6, редко вызывают ИЭ. Дифференцировку проводят на основании
результатов реакций латекс-агглютинации, изучения биохимических особенностей.
Streptococcus group D с 1984 года выделены в род Enterococcus.
Энтерококки обитают в кишечнике, органах мочевыводящей системе. Образуют
овальные бактерии размером 0,6-2х0,6-2,5 мкм. В мазках из культур, выращенных на
жидких средах, располагаются парами или короткими цепочками. Спор и капсул не
имеют, некоторые виды ограниченно подвижны (имеют небольшие жгутики). Являются
факультативными анаэробами с ферментативным метаболизмом. Расщепляют углеводы с
образованием молочной кислоты без газа. Растут при температуре 10-45°С,
температурный оптимум - 37°С. Лабораторная диагностика имеет некоторые
особенности. Наиболее часто ИЭ вызывают E. faecalis, E. faecium, Е. durans.
Streptococcus viridans, s. anginosus, s. bovis, s. mitis, s. sanguis, s.
mutans, s. salivarius, s. vestibularis являются наиболее частыми
возбудителями ИЭ. Поскольку они вызывают позеленение кровяных сред, их также
обозначают как зеленящие (негемолитические) стрептококки. Эти стрептококки
составляют 30-60 % всей микрофлоры ротовой полости, кишечника. Не
взаимодействуют с групповыми антисыворотками по Лэнсфилд.
Эти микроорганизмы отличает низкая вирулентность. Вызываемые ими инфекционные
поражения являются оппортунистическими. Основную их часть составляют ИЭ,
развивающиеся после проникновения бактерий в кровоток при травматизации
слизистой во время чистки зубов, пережёвывания грубой пищи. Способность вызывать
ИЭ обусловлена особенностями структуры гликанов (декстранов) клеточной стенки,
облегчающих адгезию стрептококков к агрегатам тромбоцитов, фибрина повреждённых
клапанов сердца. Течение заболевания характеризуются лихорадкой, снижением массы
тела, потливостью, артралгиями, эмболией сосудов (в центральную нервную систему
- в 30 % случаев, селезёнку - в 40 %, кожу и глаза - в 20-40 %). Поражения кожи
чаще представлены узелками Ослера, симптомом Джейнуэя на ладонях. Первые
обусловлены пролиферацией эндотелия капилляров при отложении иммунных комплексов
с последующим тромбозом, некрозом. На сетчатке образуются пятна Рота - белые
очаги в центре кровоизлияний, состоящих из скоплений лимфоцитов.
Лабораторная диагностика, помимо общих лабораторных исследований, включает
выделение возбудителя по стандартной схеме. На наличие бактерий указывает
появление а-гемолизирующих или негемолизирующих колоний. s. anginosus образует
мелкие колонии (> 0,5 мм), окружённые зоной а- или р-гемолиза. Дифференцировку
проводят по отсутствию роста на жидких средах с 6,5 % NaCl (в отличие от
энтерококков), неспособности гидролизовать эскулин в присутствии солей жёлчных
кислот, отсутствию чувствительности к оптохину.
Streptococcus рneumoniae не содержит группового антигена, серологически
неоднороден. Овальные или ланцетовидные кокки диаметром около 1 мкм. В мазках
располагаются парами, каждая из которых окружена толстой капсулой. По антигенам
капсульных полисахаридов выделяют 84 серовара.
На питательных средах могут располагаться цепочками. На простых средах
образуют тонкую капсулу. Её развитие стимулирует внесение крови, сыворотки,
асцитической жидкости. Спор не образуют, аэробы или факультативные анаэробы. При
культивировании необходимо наличие 5-10 % С02. Хорошо растут на
кровяных и сывороточных средах, дополненных 0,1 % глюкозой при температуре 37°С,
рН 7,8. На жидких средах дают равномерное помутнение, небольшой хлопьевидный
осадок. На агаре образуют нежные, полупрозрачные, очерченные колонии диаметром 1
мм. Подобно прочим стрептококкам, колонии никогда не сливаются между собой. На
кровяном агаре колонии окружает зона гемолиза в виде зеленоватого обесцвеченного
ободка.
Основным фактором вирулентности является капсула, защищающая бактерии от
фагоцитов, действия опсонинов. Некапсулированные штаммы практически авирулентны.
Большую часть противопневмококковых антител составляют антитела к антигенам
капсулы. Важное значение имеет холинсодержащая тейхоевая кислота клеточной
стенки, специфически взаимодействующая с С-реактивным белком.
Следствием подобного реагирования являются активация комплементов,
высвобождение медиаторов острой фазы воспаления. Их аккумуляция в ткани
стимулирует миграцию полиморфноядерных фагоцитов. Формирование воспалительных
инфильтратов сопровождается нарушением целостности ткани. Развитие ИЭ
происходит, как правило, гематогенным путём из очага воспаления лёгочной ткани
при снижении иммунитета.
На пневмококковую инфекцию указывает наличие нейтрофилов, грамположительных
ланцетовидных диплококков в мазках клинического материала не менее 10 в поле
зрения. В противном случае прибегают к выделению возбудителя по стандартной
схеме. Материал необходимо исследовать быстро, так как бактерии склонны к
аутолизу, обусловленному активностью внутриклеточных ферментов. Для
дифференцировки от других стрептококков используют пробу с оптохином, угнетающим
их рост. От зеленящих стрептококков отличается способностью ферментировать
инулин, хорошей чувствительностью к жёлчи (дезоксихолатная проба). Изоляты
серотипируют с использованием реагентов для реакций латекс-агглютинации или
коагглютинации, выявляющих капсульные антигены.
Грамотрицательные палочки, являющиеся возбудителями ИЭ, включают
семейства Enterobacteriaceae, Vibrioceae, Pasteurellaceae, несколько родов
факультативно-анаэробных палочек.
Семейство Enterobacteriaceae (кишечных бактерий) представлено
микроорганизмами, для которых средой обитания является кишечник. Семейство
включает 30 родов. В организме человека энтеробактерии входят в состав микробных
биоценозов тонкой, толстой кишки. Среди энтеробактерий имеются патогенные,
условно-патогенные, сапрофитные виды. Инфекционный эндокардит вызывают
условно-патогенные бактерии родов Escherichia (Е. coli), Salmonella, Shigella,
Klebsiella (Enterobacter, К. pneumoniae), Proteus (P. vulgaris), Yersinia (Y.
enterocolitica, Y. pseudotuberculosis) при выраженном иммунодефиците. Как
правило, их обнаруживают в ассоциациях с другими бактериями (Staphylococcus,
Streptococcus, Pseudomonas aeruginosa, грибы).
Микроорганизмы представляют собой небольшие палочки, которые хорошо
окрашиваются анилиновыми красителями, грамотрицательны. Многие из них подвижны
благодаря наличию жгутиков, имеют капсулу или микрокапсулу, спор не образуют. У
эшерихий, сальмонелл, шигелл, клебсиелл есть ворсинки, определяющие адгезию
бактерий. Все энтеробактерии являются факультативными анаэробами, хорошо растут
на средах с мясным экстрактом. Обладают выраженной ферментативной активностью,
связанной с образованием сахаролитических, протеолитических ферментов.
Основными признаками, указывающими на принадлежность энтеробактерий к одному
из пяти перечисленных родов, являются: характер продукта, образующегося при
сбраживании глюкозы (кислота, бутандиол, их смеси); реакция с метиловым красным;
образование ацетилметилкарбинола, положительная реакция Фогеса-Проскауэра;
восстановление нитратов; образование уреазы. Главными биохимическими признаками,
служащими для определения вида энтеробактерий, являются их способность
ферментировать различные углеводы до образования кислоты или газа, образование
индола, сероводорода, декарбоксилаз аминокислот (лизина, орнитина), утилизация
цитрата.
Антигенное строение является существенным критерием, на котором основывается
классификация и идентификация энтеробактерий. Различают три основных типа
антигенов: О-соматический антиген, Н-жгутиковый антиген, К-антигены. О-антиген
является составной частью липополисахарида наружного слоя клеточной стенки.
Специфичность О-антигена определяется гексозами и аминосахарами, связанными с
липополисахаридами клеточной стенки. Н-антиген локализован в жгутиках клетки. Он
состоит из белка флагеллина.
Капсульные К-антигены содержатся в клеточной стенке, но в более поверхностном
слое. Они маскируют О-антигены. В связи с этим для определения О-антигена
необходимо кипячение или автоклавирование культуры. К-антигены по химическим
свойствам относятся к кислым полисахаридам. Все эти антигены характеризуются
иммунохимической специфичностью, что позволяет дифференцировать роды, виды,
выделять серогруппы, серовары.
Патогенное действие энтеробактерий обусловлено белками клеточной мембраны,
капсульным полисахаридом, ворсинками, токсинами. Вирулентность энтеробактерий
определяется повышенной адгезией, положительным хемотаксисом между
поверхностными структурами микроба и рецепторами эпителия. Кроме того,
адгезивная способность определяется наличием ворсинок, структурой
липополисахаридов. Токсичность энтеробактерий обусловлена эндотоксином,
экзотоксинами (энтеротоксинами, цитотоксинами). Первый представляет собой
липополисахарид клеточной стенки, выделяемый после разрушения бактериальных
клеток.
Возбудители ИЭ чаще представлены серогруппами вида Е. coli, включающими
различные условно-патогенные штаммы. Е. coli - факультативный анаэроб, хорошо
растёт на обычных слабощелочных питательных средах при температуре 37°С. Однако
размножение бактерий возможно при значительных колебаниях рН среды,
температурного режима. Кишечная палочка обладает высокой ферментативной
активностью. Утилизирует ацетат в качестве единственного источника углерода,
восстанавливает нитраты в нитриты. Ферментирует глюкозу, другие углеводы.
Большинство штаммов ферментирует лактозу с образованием кислоты, газа.
Кишечная палочка имеет сложную антигенную структуру. Она содержит
соматический (О-антиген), капсульный К-антиген, жгутиковый Н-антиген. О-антигены
у бактерий рода Escherichia имеют сходную химическую структуру и связаны с
липополисахаридами клеточной стенки. Н-антигены есть только у жгутиковых форм
бактерий. О-антигены являются основными антигенами, определяющими серологическую
группу эшерихий. К-антигены представлены тремя антигенами, обозначаемыми буквами
А, В, L. К-антигены обладают способностью маскировать О-антигены, которые можно
выявить только после кипячения культуры. Н-антигены являются типоспецифическими.
Грибы. Инфекционный эндокардит вызывается условно-патогенными грибами из
родов Candida, Aspergillus. Грибы Candida, входят в состав нормальной микрофлоры
организма человека. Проявляют свое патогенное действие в ассоциациях с
условно-патогенными бактериями у лиц, длительно получающих антибиотики широкого
спектра действия, кортикостероиды, цитостатики. Наряду с условно-патогенными
бактериями в таких микробиоценозах могут присутствовать сапрофиты,
безусловно-патогенные виды. Для реализации патогенных свойств грибов необходим
иммунодефицит.
Переходу носительства условно-патогенных грибов в микотические поражения
препятствуют механизмы антифунгальной защиты. Выделяют надэпителиальный,
эпителиальный, соединительнотканный уровни морфологических структур, выполняющих
защитную роль. Рецепторы эпителиоцитов в норме заняты представителями нормальной
микрофлоры. Поэтому грибы, проникшие в определенные биотопы организма, должны
обладать антагонистическими свойствами по отношению к данной микрофлоре, чтобы
освободить соответствующие локусы для адгезии, последующей инвазии возбудителя в
ткани.
Проявление условно-патогенными грибами вирулентных свойств обусловлено
способностью к адгезии, колонизации, инвазии на фоне иммунодефицита. Исключение
составляют дрожжеподобные грибы рода Candida, которые изначально присутствуют в
организме человека. Вследствие чего для манифестации инфекции необходимо только
снижение резистентности организма.
Аспорогенные дрожжи рода Candida - диморфные грибы. Они близки к дрожжам -
сахаромицетам. В патологическом материале образуют овальные, почкующиеся
дрожжевые клетки, псевдомицелий. Хорошо растёт на обычных питательных средах при
температуре 20-37°С. На основании культуральных, микроскопических, биохимических
характеристик дифференцируют более 100 видов рода Candida.
Гликопротеины клеточных стенок дрожжеподобных грибов определяют их видовую
антигенную специфичность. Штаммы подразделяют на 3 серовара - А, В, С.
Спорообразующие сахаромицеты, аспорогенные дрожжи рода Candida имеют общие
антигены. Факторами патогенности являются гемолизины, эндоплазмокоагулаза,
липиды, полисахариды, некоторые гидролазы, эндотоксин. Для лабораторной
диагностики проводят микроскопические, культуральные, биохимические,
серологические исследования. Микроскопируют патологический материал в целях
обнаружения почкующихся дрожжевых клеток, элементов псевдомицелия. Культуры
получают на агаре Сабуро, сусло-агаре при температуре 20°С, 37°С.
Грибы рода Candida на 2-3-й день после посева образуют мелкие выпуклые
колонии. Они сливаются в мощные образования, врастающие в питательную среду.
Идентификацию проводят на основании данных микроскопии патологического
материала, культуральных признаков, биохимической активности, типов роста нитей
(филаментации). Образование нитей происходит за счёт псевдомицелия, который
отличается от истинного тем, что не имеет общей оболочки и перегородок. Он
состоит из длинных, тонких клеток. Псевдомицелий возникает путем
последовательного бокового или концевого почкования. Серодиагностику проводят с
помощью реакций агглютинации, связывания комплемента, преципитации,
иммунофлюорисценции, иммуноэлектрофореза.
Возбудителем ИЭ являются грибы рода Aspergillus. Известно 150 видов и
подвидов аспергиллов, наиболее патогенен Aspergillus fumigatus. Аспергиллы
относятся к головчатым плесеням, строгие аэробы, хорошо растут на различных
питательных средах при рН 6-6,5. Оптимальными источниками углерода являются
олигосахариды, источниками азота - аммонийные соли, некоторые аминокислоты.
Антигенные свойства аспергиллов мало выражены. Факторами патогенности являются
гидролазы, небелковые экзотоксины.
При росте на среде Сабуро, сусло-агаре при 20°С они образуют септированный
мицелий с конидиофорами, несущими стеригмы, конидиоспоры серого, зелёного,
сине-зелёного, чёрного цвета. В тканях, экссудате, мокроте аспергиллы выявляются
в виде септированных ветвящихся гиф. В лабораторной диагностике используют
микроскопию для определения септированных ветвящихся гиф или “пробок” из
мицелия. Получают также чистые культуры при посеве крови на агар Сабуро или
сусло-агар.
1.2. патогенез
Патогенез ИЭ довольно сложен и окончательно не изучен. Принципиальную схему
патогенеза ИЭ можно представить следующим образом: врождённые, приобрётенные
дефекты клапанов сердца увеличение скорости и появление турбулентности
трансклапанного потока крови механическое повреждение эндотелия клапанов
отложение тромбоцитов и фибрина на повреждённых участках эндокарда формирование
хронического неинфекционного эндокардита с тромботическими вегетациями
преходящая бактериемия на фоне снижения реактивности организма адгезия и
колонизация патогенных бактерий в фибрино-тромбоцитарных вегетациях воспаление
эндокарда, формирование микробных вегетаций, разрушение клапанов развитие СН,
системного инфекционного процесса с эмболическим, тромбогеморрагическим,
иммунокомплексным поражением внутренних органов и тканей (рисунок 1).
В качестве инициальных механизмов патогенеза выделяют повреждение эндокарда,
бактериемию, адгезию, размножение, колонизацию патогенных бактерий на клапанах.
Основная роль в развитии ИЭ принадлежит деструкции эндокарда, бактериемии.
Экспериментальные исследования свидетельствуют о том, что катетеризация сердца в
течение нескольких минут вызывает чувствительность эндокарда к микробной
агрессии на протяжении многих дней.
Данные электронной микроскопии позволили проследить последовательность
формирования патологического процесса. Выяснено, что под воздействием
регургитирующего потока крови изменяется форма и структура эндотелиоцитов,
увеличивается межклеточная проницаемость, происходит десквамация эндотелия.
Между эндотелиоцитами образуются поры, через которые проникают лимфоциты,
макрофаги. Увеличение размеров пор, снижение атромбогенных свойств эндокарда
усиливает адгезию бактерий. На месте отслоения дистрофически изменённых клеток
идёт интенсивное тромбообразование. Эндокард покрывается активированными
тромбоцитами, “прошивается” волокнами фибрина.
Повреждение, деэндотелизация эндокарда усиливают адгезию бактерий,
образование покрывающего слоя из тромбоцитов, фибрина. Создается недоступная для
фагоцитов “зона локального агранулоцитоза”, обеспечивающая выживание,
размножение патогенных микроорганизмов. В процессе продолжающейся бактериальной
колонизации, нарастания тромбоцитарно-фибринового матрикса формируются микробные
тромбы, вегетации, происходит повреждение, разрушение клапана.
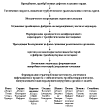
Рисунок 1. Патогенез инфекционного эндокардита.
Факторы, усиливающие адгезию бактерий к эндокарду, можно условно разделить на
местные и общие. В состав местных входят врождённые и приобретённые изменения
клапанов, нарушение внутрисердечной гемодинамики. Врождённые пороки увеличивают
риск трансформации бактериемии в ИЭ до 92 %. Предрасполагающие условия для
возникновения заболевания создают механические, биологические искусственные
клапаны. К общим факторам относят нарушения резистентности организма, выраженные
изменения иммунитета, развивающиеся при проведении иммунносупрессивной терапии,
у наркоманов, больных алкоголизмом, людей пожилого возраста и пациентов, имеющих
изменения в HLA-системе гистосовместимости.
Формирование ИЭ происходит на фоне бактериемии, травмы эндокарда, снижения
резистентности организма. Бактериемии принадлежит ведущая роль. Источниками
бактериемии могут быть очаги хронической инфекции, инвазивные медицинские
исследования и манипуляции (бронхоскопия, гастроскопия, колоноскопия,
хирургические вмешательства), тонзилэктомия, аденоидэктомия, вскрытие и
дренирование инфицированных тканей, стоматологические процедуры.
Развитие ИЭ зависит от массивности, частоты, видовой специфичности
бактериемии. Риск развития заболевания особенно велик при повторяющихся
“минимальных” или “массивной” бактериемии вследствие хирургических операций.
Бактериемия staph. aureus является стопроцентным фактором риска ИЭ в связи
повышенной адгезией и связыванием пептидогликаном эндокарда этих бактерий.
Значительно меньшая вирулентность у эпидермального стафилококка и стрептококков.
Вероятность развития ИЭ при пневмококковой бактериемии составляет приблизительно
30 %.
Существуют определённые закономерности в локализации инфекции, обусловленные
нарушением внутрисердечной гемодинамики при формировании порока. Такими
анатомическими образованиями при недостаточности клапанов являются поверхность
МК со стороны левого предсердия, поверхность АК со стороны аорты, хорды. При
незаращении межжелудочковой перегородки чаще поражается эндокард правого
желудочка в области дефекта.
Персистирующая бактериемия стимулирует иммунитет, запуская
иммунопатологические механизмы воспаления. Изменения иммунитета при ИЭ
проявляются гипофункцией Т-лимфоцитов, гиперфункцией В-лимфоцитов, поликлоновой
продукцией аутоантител. Нарушаются механизмы активации комплемента, образуются
циркулирующие иммунные комплексы. В современных исследованиях подтверждается
значительная патогенетическая роль увеличения концентрации ЦИК с отложением в
органах-мишенях. Несомненного внимания заслуживает увеличение концентрации
интерлейкинов 1, 6, 8 и фактора некроза опухоли, провоспалительная активность
которых наряду с индукцией острофазового ответа, участвует в развитии системных
проявлений ИЭ.
Тромбоэмболии способствуют генерализации инфекционного процесса, формированию
инфарктов, некроза органов. У 52-67 % больных ИЭ с преимущественным поражением
правых камер сердца развивается тромбоэмболия лёгочной артерии. Обструкция
сосуда сопровождается гуморальными нарушениями, возникающими в результате
выброса биологически активных веществ из агрегатов тромбоцитов в тромбе (тромбоксан,
гистамин, серотонин).
При ТЭЛА образуются “мёртвые” пространства в лёгких (несколько сегментов или
доля), не перфузируемые смешанной венозной кровью. Значительно возрастает
шунтирование смешанной венозной крови в лёгких. Снижение градиента напряжения
углекислого газа между смешанной венозной и артериальной кровью, повышение
концентрации углекислого газа в артериальной крови вызывает артериальную
гипоксемию. Увеличение общего сосудистого лёгочного сопротивления кровотоку –
один из основных механизмов формирования артериальной лёгочной гипертензии у
больных ИЭ. Изменения гемодинамики и реологии крови вызывают неадекватную
перфузию сосудистых зон, расстройство газообмена. Снижение доставки кислорода к
лёгочной ткани, накопление тканевых метаболитов и токсичных продуктов анаэробных
процессов являются причиной развития инфаркта лёгкого.
В развитии хронической СН у больных ИЭ выделяют несколько патогенетических
механизмов: формирование недостаточности клапана (ов), септическое поражение
миокарда, перикарда, изменения гемодинамики, нарушение ритма, проводимости,
задержка жидкости, связанная с нарушением функции почек. Важным звеном
патогенеза СН является увеличение постнагрузки при длительном повышении
периферического сосудистого сопротивления. Вазоконстрикция обусловливает
поддержание системного артериального давления, оптимизирует сниженный сердечный
выброс.
Недостаточность МК вызывает дилатацию, гипертрофию левых отделов сердца ->
повышение давления в сосудах малого круга кровообращения ->
декомпенсацию по левожелудочковому типу ->
гипертрофию правого желудочка ->
сердечную недостаточность по большому кругу. Повреждение аортального клапана
способствует развитию диастолической перегрузки левого желудочка ->
гипертрофии, дилатации левого желудочка ->
относительной недостаточности МК (“митрализация порока”) ->
гипертрофии, дилатации левого предсердия ->
застою крови в малом круге кровообращения, декомпенсации по левожелудочковому
типу -> гипертрофии, дилатации правых отделов сердца ->
правожелудочковой СН. Выраженная недостаточность трёхстворчатого клапана
вызывает дилатацию, гипертрофию правого предсердия дилатацию, гипертрофию
правого желудочка вследствие поступления в его полость увеличенного объёма крови
из правого предсердия венозный застой в большом круге кровообращения.
При ИЭ изменяются микроциркуляция, реологические свойства крови. Происходит
внутрисосудистое свёртывание крови, которое в своём развитии проходит четыре
стадии. Первая стадия гиперкоагуляции и компенсаторного гиперфибринолиза
начинается в поражённом органе, из клеток высвобождаются коагуляционно-активные
вещества, активация коагуляции распространяется на кровь. Вторая стадия
нарастающей коагулопатии потребления и непостоянной фибринолитической активности
характеризуется уменьшением числа тромбоцитов, концентрации фибриногена в крови.
Третья стадия дефибриногенации и тотального, но не постоянного фибринолиза (дефибриногенационно-фибринолитическая),
соответствует полному ДВС-синдрому. Четвёртая – стадия остаточных тромбозов и
окклюзий.
Причинами нарушения микроциркуляции являются микротромбозы, ремоделирование
микрососудов. Изменение геометрии сосудов начинается как адаптивный процесс при
нарушении гемодинамики, повышении активности тканевых, гуморальных факторов. В
последующем ремоделирование сосудов способствует прогрессированию расстройств
кровообращения. Изменения микроциркуляции обусловлены повышенной агрегацией
тромбоцитов, эритроцитов. При левожелудочковой СН на фоне периваскулярного отёка
происходит агрегация эритроцитов, локальный эритростаз, фрагментация кровотока.
Особая роль отводится повышенной активности плазменного гемостаза. Значение
гиперфибриногенемии, как самостоятельного фактора снижения реологических свойств
крови и прогрессирования ИЭ, обосновано в клинико-экспериментальных
исследованиях. Важное значение в нарушении микрогемодинамики имеет образование
микротромбов. Гемореологические изменения вызывают снижение перфузионных свойств
крови, усиливают расстройства гемодинамики на периферии. Нарастает тканевая
гипоксия, активизируется аэробный метаболизм. Гипоксия тканей при хронической СН
снижает сократительную способность миокарда, увеличивает пред- и постнагрузку.
В течении ИЭ различают несколько патогенетических фаз:
инфекционно-токсическую (септическую), иммуновоспалительную, дистрофическую.
Первая фаза характеризуется транзиторной бактериемией с адгезией патогенных
бактерий на эндотелий, формированием микробнотромботических вегетаций. Вторая
фаза проявляется полиорганной патологией (эндоваскулит, миокардит, перикардит,
гепатит, нефрит, диффузный гломерулонефрит). Под воздействием эндогенных
токсинов происходит декомпенсация органов и систем, нарушается метаболизм,
происходит дезинтеграция организма как биологического целого. Во время
дистрофической фазы формируются тяжёлые, необратимые изменения внутренних
органов.
Указанные патогенетические фазы типичны для всех клинико-морфологических форм
и вариантов течения болезни. Тем не менее, патогенез вторичного ИЭ имеет
некоторые особенности. Врождённый порок сердца увеличивает функциональную
нагрузку на сердечно-сосудистую систему и клапаны, повреждается эндотелий.
Функция органов, богатых ретикулоэндотелиальной тканью, подвержена угнетению.
Снижается неспецифическая резистентность организма. Преходящая бактериемия
вызывает образование первичного инфекционного очага. На фоне снижения общей
резистентности формируется хронический воспалительный процесс. Развивается
сенсибилизация организма бактериальными антигенами. Миокард повреждается
кардиальными антителами. Во время бактериемии из очагов хронической инфекции
происходит адгезия бактерий на изменённых клапанах. Формируется вторичный
септический очаг в сердце, являющийся основой для развития вторичного ИЭ.
Инфекционный эндокардит с поражением правых камер сердца развивается после
повреждения ТК подключичным катетером, при зондировании сердца, продолжительном
стоянии катетера Swan-Ganz, выполнении частых внутривенных инъекций. Широкое
применение катетеризации сосудов с целью интенсивной инфузионной терапии
увеличивает количество случаев тромбофлебита, тромбоза, инфицирования с
последующим развитием сепсиса.
Следует отметить, что 30 % катетеров подключичной вены достигают полости
правого предсердия сердца и травмирует створки ТК. Установка эндокардиальных
электродов для электрокардиостимуляции в ряде случаев является причиной
инфекционного поражения ТК. Причиной развития ИЭ в правых камерах сердца могут
быть пули, осколки других огнестрельных снарядов, длительно находящиеся в
сердце.
Вторичный ИЭ с поражением правых камер сердца чаще развивается при дефекте
межжелудочковой перегородки, открытом артериальном протоке (22 %). Развитие ИЭ
обусловлено повреждением эндокарда регургитирующим потоком крови. При высоких
небольших дефектах межжелудочковой перегородки тонкая струя крови травмирует
септальную створку ТК. В случае открытого артериального протока травмируется
эндокардиальная поверхность лёгочного ствола в области дефекта. Таким образом, в
последние десятилетия наиболее частой причиной развития первичного ИЭ является
сеспсис, внутривенная наркомания, а вторичного – врождённые пороки сердца.
Для развития ИЭ у наркоманов типично повреждение эндокарда при частых
внутривенных инъекциях. Во время инъекций самостоятельно изготовленных
наркотических веществ пузырьки воздуха повреждают эндокард трёхстворчатого
клапана в 100 % случаев. Травмируется эндокард, возникает его шероховатость.
Повреждённые участки служат местом адгезии, агрегации тромбоцитов с последующим
формированием тромбов. Нарушение асептики способствует развитию бактериемии,
инфицированию повреждённых участков эндокарда золотистым стафилококком (70-80
%). Причина его тропности к эндокарду ТК у наркоманов не совсем ясна.
Изменения иммунитета, неспецифической резистентности являются ключевыми
механизмами патогенеза этой формы болезани. По данным исследования иммунного
статуса у больных ИЭ с поражением правых камер сердца выявлено уменьшение
Т-хелперов, увеличение Т-супрессоров, снижение активности натуральных киллеров.
Эти изменения вызваны угнетением реактивности иммунной системы вследствие
истощения функциональных резервов. Зарегистрировано увеличение концентрации ФНО
– цитокина, играющего ключевую роль в развитии иммунно-воспалительных реакций
организма. Среди многочисленных эффектов ФНО обращает на себя внимание его
действие на коллаген клапанов 1, 3, 4-го типов, составляющий 50-70 % его массы.
Фактор некроза опухоли ингибирует транскрипцию гена коллагена, тем самым, снижая
синтез последнего фибробластами. Кроме того, ФНО стимулирует продукцию
коллагеназы, которая участвует в деградации коллагена клапанов. Денатурированные
фрагменты коллагена индуцируют продукцию воспалительных медиаторов макрофагами,
индуцируют и поддерживают воспалительный процесс.
Число наркоманов и пациентов, у которых длительно используются катетеры
сосудов велико. Однако, не у всех развивается ИЭ. В этой связи изучены
генетические аспекты предрасположенности. По данным исследования HLA-фенотипа
(по антигенам локусов А, В) наиболее вероятными маркерами генетической
предрасположенности к ИЭ с поражением правых камер сердца являются антиген
системы HLA В35, гаплотип А2-В35.
Структурной основой изменения реактивности иммунной системы у больных
являются нарушения пространственной организации комплекса: Т-клеточный рецептор
– иммуногенный пептид – белок главного комплекса гистосовместимости. В развитии
заболевания имеет значение сочетание генетической детерминированности дефекта
иммунной системы с модификацией антигенов гистосовместимости инфекционными
агентами, химическими веществами (наркотики, антибиотики) и другими факторами.
Развитие ИЭ протеза клапана обусловлено многими причинами: травматизацией
эндокарда во время операции, бактериемией, снижением резистентности организма,
изменением иммунитета. При протезировании искусственных клапанов происходит
инфицирование, которое определяется физическими свойствами, химическим составом
имплантируемого клапана, адгезией бактерий на шовном материале. Повышенная
адгезия стафилококков на внутрисердечных швах определяет состав возбудителей
раннего ИЭПК (staphylococcus epidermidis, staphylococcus aureus).
В 50 % случаев раннего ИЭПК источником бактериемии является послеоперационная
рана. В патогенезе позднего ИЭПК ключевое значение имеет транзиторная
бактериемия, возникающая при интеркуррентных инфекциях (36 %), стоматологических
манипуляциях (24 %), операциях (12 %), урологических исследованиях (8 %).
Дополнительными источниками инфекции являются артериальные системы,
внутривенные, уретральные катетеры, сердечные заплаты, эндотрахеальные трубки.
Инфекция начинается с абактериальных тромботических наложений, которые затем
инфицируются при транзиторной бактериемии. Большие гемодинамические нагрузки
являются причиной развития ИЭ искусственного клапана, находящегося в митральной
позиции. Воспаление начинается с манжеты протеза, фиброзного кольца. Далее
образуются аннулярные, кольцевые абсцессы, формируются парапротезные фистулы,
происходит отрыв протеза.
Таким образом, развитие инфекционного эндокардита обусловлено
иммунодефицитом, первичным или вторичным повреждением эндокарда, приходящей
бактериемией. Дальнейшее течение болезни опосредовано комплексом
патогенетических механизмов, которые формируются в результате системного
поражения сосудов, множественных тромбоэмболий, иммунокомплексных реакций,
изменения центральной и внутрисердечной гемодинамики, нарушения свёртывающей
системы крови.
1.3. Классификация
Инфекционный эндокардит – воспалительное поражение клапанов сердца и
пристеночного эндокарда, обусловленное прямым внедрением возбудителя и
протекающее чаще всего по типу сепсиса, остро или подостро, с циркуляцией
возбудителя в крови, эмболиями, иммунопатологическими изменениями и
осложнениями.
В международной классификации болезней 10-го пересмотра (1995) выделяют:
133.0. Острый и подострый инфекционный эндокардит:
- бактериальный,
- инфекционный без детального уточнения,
- медленно текущий,
- злокачественный,
- септический,
- язвенный.
Для обозначения инфекционного агента используют дополнительный код (В 95-96)
перечня бактериальных и других инфекционных агентов. Эти рубрики не используются
при первичном кодировании заболевания. Они предназначены для использования в
качестве дополнительных кодов, когда целесообразно идентифицировать возбудителя
болезней, классифицированных в иных рубриках.
В 95. Стрептококки и стафилококки как причина болезней, классифицированных в
других рубриках:
В 95.0. Стрептококки группы А как причина болезней, классифицированных в
других рубриках.
В 95.1. Стрептококки группы В как причина болезней, классифицированных в
других рубриках.
В 95.2. Стрептококки группы D как причина болезней, классифицированных в
других рубриках.
В 95.3. Streptococcus pneumoniae как причина болезней, классифицированных в
других рубриках.
В 95.4. Другие стрептококки как причина болезней, классифицированных в других
рубриках.
В 95.5. Неуточненные стрептококки как причина болезней, классифицированных в
других рубриках.
В 95.6. Staphylococcus aureus как причина болезней, классифицированных в
других рубриках.
В 95.7. Другие стафилококки как причина болезней, классифицированных в других
рубриках.
В 95.8. Неуточненные стафилококки как причина болезней, классифицированных в
других рубриках.
В 96. Другие бактериальные агенты как причина болезней, классифицированных в
других рубриках:
В 96.0. Mycoplasma pneumoniae как причина болезней, классифицированных в
других рубриках Pleura-pneumonia-like-organism.
В 96.1. Klebsiella pneumoniae как причина болезней, классифицированных в
других рубриках.
В 96.2. Escherichi coli как причина болезней, классифицированных в других
рубриках.
В 96.3. Haemophilus influenzae как причина болезней, классифицированных в
других рубриках.
В 96.4. Proteus (mirabilis, morganii) как причина болезней,
классифицированных в других рубриках.
В 96.5. Pseudomonas (aeruginosa, mallei, pseudomallei) как причина болезней,
классифицированных в других рубриках.
В 96.6. Bacillus fragilis как причина болезней, классифицированных в других
рубриках.
Б 96.7. Clostridium perfringens как причина болезней, классифицированных в
других рубриках.
В 96.8. Другие уточненные бактериальные агенты как причина болезней,
классифицированных в других рубриках.
В таблице 1 представлена клиническая классификация инфекционного эндокардита
А.А. Демина и В.П. Дробышевой (2003). Авторы выделяют этиологический раздел,
варианты течения, исходы, клинико-морфологические формы, патогенетические стадии
развития заболевания. Приводятся варианты поражения сердца, сосудов почек,
печени, селезенки, легких, нервной системы. Большого внимания заслуживает
стратификация риска, предикторов эмболических осложнений.
Таблица 1. Классификация инфекционного эндокардита
| Этиологическая характеристика |
Течение, стадия, исходы |
Клинико-морфологическая форма |
Органы-мишени: поражения |
Стратификация риска |
| Грамположительные бактерии:
стафилококки стрептококки
энтерококки
Грамотрицательные бактерии
E. coli
Pseudomonas aeruginosa
Klebsiella
Proteus
Грибы
Aspergillus
Candida
Микробные коалиции
Риккетсии
Вирусы |
Течение:
острое
подострое
Стадия:
инфекционно-токсическая
иммуновоспалительная
дистрофическая
Степень активности:
высокая(III) умеренная(II) минимальная(I)
Исходы:
выздоровление
ремиссия
неэффективность лечения рецидив |
Первичная (на интактных клапанах)
Вторичная при клапанных и сосудистых повреждениях):
ревматические, атеросклеротические, волчаночные, сифилитические,
травматические пороки и артериовенозные аневризмы, комиссуротомные,
искусственные сосудистые анастомозы, шунты при хроническом гемодиализе,
клапаны трансплантированного сердца |
Сердце: инфаркт, порок, абсцесс,
аневризма, миокардит, артимия, перикардит, сердечная недостаточность
Сосуды: васкулит, тромбоэмболия, тромбоз, геморрагии, аневризма
Почки: очаговый нефрит, диффузный гломерулонефрит, нефротический
синдром, инфаркт, почечная недостаточность
Печень: гепатит
Селезенка: пленомегалия, инфаркт, абсцесс, разрыв
Легкие: пневмония, абсцесс, инфаркт, легочная гмпертензия
Нервная система: ОНМК, преходящие нарушения мозгового кровообращения,
менингоэнцефалит, абсцесс, киста |
Факторы высоокого риска (III степень):
поражение более 5 органов-мишений, околоклапанные абсцессы и/или деструкция
клапанов, золотистый стафилококк в гемокультуре при поражении АК,
многоклапанное поражение, большое количество МВ, поражение всех створок
клапана, СН III-IV ФК по NYHA Факторы умеренного
риска (II степень) : поражение 3-5 органов
Факторы низкого риска ( I степень):
поражение 1-2 органов
Предикторы эмболизации: крупные МВ (более 15 мм), пожилой возраст,
запаздывание операции |
В классификации В.П. Тюрина (2001) приведены определения острого, подострого,
хронического рецидивирующего вариантов ИЭ по этиологическим и временным
критериям. В основу характеристики острого и подострого течения положена высокая
активность инфекционно-воспалительного процесса, выраженность клинической
картины, степень вирулентности микроорганизмов. Разработаны критерии
выздоровления, рецедива, повтороного ИЭ.
Острый (септический) ИЭ - воспалительное поражение эндокарда
длительностью до 2-х месяцев, вызванное высоковирулентными микроорганизмами,
протекающее с выраженными инфекционно-токсическими (септическими) проявлениями,
частым формированием гнойных метастазов в различные органы и ткани,
преимущественно без иммунных проявлений, которые не успевают развиться из-за
скоротечности болезни. Острый ИЭ – осложнение сепсиса.
Подострый ИЭ – особая форма сепсиса продолжительностью более
2-х месяцев, обусловленная наличием внутрисердечного инфекционного очага,
который вызывает рецидивирующую септицемию, эмболии, нарастающие изменения в
иммунной системе, приводящие к развитию нефрита, васкулита, синовита,
полисерозита. Этот вариант заболевания возникает при маловирулентном возбудителе
(энтерококке, эпидермальном стафилококке, гемофилюсе), определённых соотношениях
патогенности возбудителя и реактивности организма, а также при недостаточно
эффективной антибактериальной терапии.
Затяжной (хронический рецидивирующий) ИЭ является этиологическим вариантом
подострого эндокардита. Его вызывают зеленящий стрептококк или близкие к нему
штаммы стрептококка. Характеризуется пролонгированным течением (более 6
месяцев), отсутствием гнойных метастазов, преобладанием иммунопатологических
проявлений, обусловленных поражением ЦИК.
Выздоровевшим следует считать пациента через один год после завершения
лечения по поводу ИЭ, если в течение этого срока сохранялись нормальная
температура тела, СОЭ, не выделялся возбудитель из крови. Рецидивы болезни
классифицируют на ранние (в течение 2-3-х месяцев после лечения) и поздние (от
3-х до 12-х месяцев). Повторным ИЭ считается развитие заболевания через один год
и более после завершения лечения или выделение из крови другого возбудителя в
срок до одного года.
Особыми формами ИЭ являются: ИЭ протеза клапана, ИЭ у наркоманов, ИЭ у
пациентов с имплантированным электрокардиостимулятором, ИЭ у пациентов с
трансплантированным целым органом, ИЭ у пациентов, находящихся на программном
гемодиализе, нозокомиальный ИЭ, ИЭ у людей пожилого и старческого возраста.
1.4. Современное течение
Полиморфизм клинической картины ИЭ определяется полиорганным поражением. Для
современного течения заболевания свойственно развитие множества осложнений,
которые формируют ведущую органную патологию. Частыми осложнениями ИЭ являются:
со стороны сердца - миокардит, перикардит, абсцессы, нарушение ритма и
проводимости; почек – инфаркт, диффузный гломерулонефрит, очаговый нефрит,
нефротический синдром, острая почечная недостаточность; лёгких – ТЭЛА,
инфаркт-пневмония, плеврит, абсцесс, лёгочная гипертензия; печени - гепатит,
абсцесс, цирроз; селезёнки - спленомегалия, инфаркт, абсцесс; нервной системы -
острое нарушение мозгового кровообращения, менингит, менингоэнцефалит, абсцессы
головного мозга; сосудов - васкулит, эмболии, аневризмы, тромбозы. Фатальными
осложнениями инфекционного эндокардита являются: септический шок, респираторный
дистресс-синдром, полиорганная недостаточность, острая сердечная
недостаточность, эмболии в головной мозг, сердце.
В сравнении с серединой 20-го столетия, в последние десятилетия
увеличилось количество ТЭО. По-видимому, это обусловлено значительным
ростом первичных форм септического эндокардита (до 50-75 %). Если ранее ТЭО
наблюдали у 25-31 % больных, то в настоящее время – у 75-85%. Эмболии и инфаркты
внутренних органов определяются у 35 % больных, множественные эмболические
осложнения у - 38 %.
Структура ТЭО при современном течении ИЭ следующая: инфаркт селезёнки – 41 %
случаев, эмболии головного мозга – 35 %, эмболии в конечности – 25 %, эмболии в
коронарные артерии – 15,5 %, инфаркты лёгких – 8,5 %, эмболии в артерии сетчатки
– 2,8 %. В 2-8,5 % случаев ИЭ развиваются эмбологенные инфаркты миокарда,
которые в 50-60-е годы выявлялись в 0,8-1 %. Их происхождение обусловлено
попаданием в венечные артерии тромботических частиц из МВ и обызвествлённых
наложений клапанов.
В последние десятилетия ТЭО церебральных артерий стали наблюдаться
значительно чаще (22 %), чем в 50-60-е годы (8-11 %). В 80-90-е годы частота
выявления церебральных осложнений у больных ИЭ составила 6,7-41 %, среди них
чаще встречались инфаркты головного мозга (24-64,6 %), внутримозговые гематомы
(5,6-32 %), интракраниальные микотические аневризмы (17-24 %), менингиты (1-14
%), абсцессы (2,8 %), субарахноидальные кровоизлияния и артерииты (4-7,6 %).
Смертность больных ИЭ с церебральными осложнениями достигает 39-74 %.
На развитие ТЭО оказывают влияние вид бактерий, локализация инфекционного
очага на клапанах сердца, размер, форма, степень подвижности МВ. Эмболические
осложнения чаще диагностируют при стафилококковом (65 %), несколько реже при
стрептококковом (34,8 %), энтерококковом ИЭ (33 %). В сравнении с серединой
20-го столетия увеличилось количество инфарктов и абсцессов селезёнки. На
современном этапе их удельный вес в патологии селезёнки составляет 12-46 % и 6 %
соответственно. Чаще развиваются ишемические (55 %), реже – геморрагические (45
%) инфаркты селезёнки, эмболии артерий почек развиваются у 9-17 % больных.
Значительно увеличилось количество эмболий лёгочной артерии, которые выявляют в
44-56 % случаев ИЭ у наркоманов. Как правило, это множественные лёгочные эмболии
c клиникой ТЭЛА, осложняющиеся в 12-27 % инфаркт-пневмониями и абсцессами
лёгких. Лёгочно-плевральные осложнения развиваются у 75 % больных ИЭ.
В настоящее время гломерулонефрит, являющийся одним из иммунных осложнений ИЭ,
встречается реже (40-56 %). Это осложнение диагностируется клинически у 8-32 %
больных. Значительно чаще патология почек проявляется умеренным мочевым
синдромом (до 67-78 %). Нефротический синдром и острая почечная недостаточность
развиваются редко. Спленомегалия регистрируется в 21-67,5 % случаев.
Миокардит при современном течении ПИЭ диагностируется клиницистами у 23-54 %
больных, а патологоанатомами – у 86 %.
Распространение новых клинических форм болезни (ИЭ протеза клапана, ИЭ у
наркоманов) вызвано увеличением числа кардиохирургических операций, эпидемией
внутривенной наркомании, иммунодефицитом. Заболеваемость ИЭ у наркоманов
составляет 2-6 % в год, что значительно превышает частоту встречаемости ИЭ в
общей популяции. Эта группа больных ИЭ характеризуется преимущественным
поражением ТК, клапана лёгочной артерии, эндокарда правых предсердия и
желудочка. Выделение в особую форму ИЭ у наркоманов вызвано рядом особенностей:
атипичностью клинической картины, поражением лёгких в результате ТЭЛА,
выраженностью септических проявлений, ранним развитием сепсиса и полиорганной
недостаточности, резистентностью к АБТ.
Наиболее частым возбудителем ИЭ правых камер сердца является золотистый
стафилококк, при котором резистентность к АБ возникает у 90 % больных в течение
1-2-х недель. Многие авторы считают золотистый стафилококк специфическим
возбудителем ИЭ у наркоманов. Важность акцентирования внимания на этиологическом
факторе обусловлена высокой смертностью в этой группе больных – 70-80 %.
Причинами развития ИЭ с преимущественным поражением правых камер сердца могут
быть длительные катетеризации вен, внутрисердечные диагностические и лечебные
манипуляции (зондирование сердца, длительное использование катетера Svan-Ganz и
т.д.). Чаще инфицируются гемодиализные шунты (57-61 %), внутривенные катетеры
(21 %) и катетеры Svan-Ganz (18 %), реже – катетеры подключичной и ярёмной вен
(10 %), лёгочной артерии (8-8,5 %).
Клиническое течение ИЭ правых камер сердца весьма неспецифично, что
обусловливает частые ошибки и трудности в диагностике. Наиболее типично начало
заболевания с развития множественных лёгочных инфекционных очагов. Весьма
характерна манифестация с “лихорадки неясного генеза”, которая является
характерным симптомом и встречается у 90-95 % больных. Появление озноба
сопровождается обильным потоотделением без улучшения самочувствия больных.
Приблизительно у одной трети пациентов наблюдаются петехии и геморрагическая
сыпь. Изменения центральной гемодинамики при разрушении ТК менее выражены, чем
при поражении митрального и аортального клапанов, поэтому СН III-IV ФК
развивается на поздних стадиях заболевания. Тромбоэмболии лёгочной артерии часто
осложняются инфаркт-пневмониями, абсцессами лёгких и двусторонним
пневмотораксом.
После хирургического лечения врождённых и приобретенных пороков сердца
развивается ИЭПК (11-18 %). Термин ИЭПК характеризует генерализованную реакцию
организма и подразумевает воспалительные изменения в эндокарде. Эта форма ИЭ
является вариантом ангиогенного сепсиса с первичным очагом в протезе клапана.
Риск развития ИЭ в течение первого года после имплантации искусственного клапана
составляет 2-4 %, значительно увеличивается у пациентов пожилого возраста.
Летальность при этой форме ИЭ составляет 23-80 %.
Частота возникновения ИЭ значительно выше при протезировании АК, что
обусловлено продолжительностью операции, большими гемодинамическими нагрузками и
турбулентным кровотоком на искусственном клапане. По времени возникновения
различают ранний (в течение 60 дней после операции) и поздний
(позднее 60 дней) ИЭПК. Деление на ранний и поздний ИЭ вызвано особенностями
микробиологических, клинических и диагностических данных, течением и прогнозом
заболевания.
За последние 20-30 лет этиология ИЭПК существенно изменилась. Основными
возбудителями рассматриваемой формы ИЭ являются эпидермальный и золотистый
стафилококк. Всё большее значение приобретает условно-патогенная микрофлора,
грамотрицательные аэробы, стрептококки, грибы. Их видовой состав сходен с ИЭ
нативных клапанов. Однако количество положительных гемокультур выше:
грамотрицательная микрофлора – 20 %, грибы – 10-12 %, стрептококки – 5-10 %,
дифтероиды – 8-10 %, другие бактерии – 5-10 %. Смертность при ИЭПК, вызванном
staph. aureus составляет 86-90 %, а при ИЭ, вызванном staph. epidermidis – 52-60
%. Инфекционный эндокардит протеза клапана, вызванный грамотрицательными
бактериями, встречается в 2-4,6 % случаев. Грамотрицательные аэробы выделяются в
20 % случаев раннего и в 10 % случаев позднего ИЭПК. Спектр грамотрицательных
бактерий довольно широк: Hemophilus species, Ech. coli, Klehsiella species,
Proteus species, Pseudomoncis species, Serratia, Alcaligenes feacalis, Eikenella
corrodens.
Инфицирование во многом определяется физическими свойствами и химическим
составом имплантируемого клапана, способностью бактерий к адгезии на шовном
материале. Инфицирование может начинаться с абактериальных тромботических
наложений при транзиторной бактериемии. За счёт адгезии стафилококков на
внутрисердечных швах развивается ранний послеоперационный ИЭПК. Дополнительными
периоперационными источниками инфекции являются артериальные системы,
внутривенные и уретральные катетеры, сердечные заплаты, эндотрахеальные трубки.
При имплантации протеза миокард становится более восприимчивым к инфекции.
Воспаление начинается с манжеты искусственного клапана и локализуется в
фиброзном кольце.
Далее образуются аннулярные и (или) кольцевые абсцессы, которые вызывают
формирование парапротезных фистул, отрыв протеза. Такому осложнению чаще
подвержена аортальная позиция. Для этой локализации свойственно распространение
абсцесса фиброзного кольца на миокард, вовлечение в патологический процесс
проводящих путей сердца. Наибольшая частота ИЭ биопротезного клапана наблюдается
в митральной позиции, которая значительно труднее поддаётся консервативному и
оперативному лечению. В 13-40 % случаев ИЭПК образуются тромбы на протезе,
являющиеся источниками ТЭО.
Частым симптомом ИЭПК является лихорадка, которая встречается у
95-97 % больных. Сердечная недостаточность, обусловленная
инфекционно-токсическим миокардитом и параклапанными фистулами, формируется у
подавляющего большинства больных при раннем и только у трети пациентов - при
позднем ИЭПК. Септический шок встречается у 33 % больных с ранним и у 10 % - с
поздним ИЭПК. Нарушения атриовентрикулярной проводимости регистрируются на ЭКГ в
15-20 % случаев раннего и в 5-10 % позднего ИЭПК. Спленомегалию отмечают у 26 %
пациентов с ранним и у 44 % - с поздним ИЭПК. Частота развития ТЭО составляет
10-32 %. Наиболее характерны ТЭО для течения ИЭПК, вызванного грибами. При
раннем ИЭПК частота ТЭО составляет 10-11 %, при позднем - 23-28 %.
Клиническое течение ИЭПК зависит от многих факторов: вида возбудителя,
возраста больного, эффективности антибактериальной терапии. При
высоковирулентном возбудителе (золотистый стафилококк, грамотрицательная
микрофлора) преобладает острое течение с развитием острой сердечной и
полиорганной недостаточности, ТЭО. При маловирулентном возбудителе
разворачивается классическая картина ”sepsis lentа”, что более характерно для
позднего ИЭПК.
Увеличение заболеваемости инфекционным эндокардитом в последние десятилетия
обусловлено распространением нозокомиальных форм. За 30-40 лет изменилась
структура микрофлоры. По сравнению с серединой 20-го столетия основными
возбудителями стали золотистый и эпидермальный стафилококки. В структуре
возбудителей вырос удельный вес грамотрицательных, анаэробных бактерий и грибов,
которые в большинстве случаев резистентны к антибактериальной терапии. Это
способствовало увеличению количества первичного острого ИЭ с развитием
множественных тромбоэмболических осложнений. В последнее десятилетие
госпитальная летальность при проведении консервативной терапии достигает 65-80
%.

