Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Глава 12. Доказательная медицина - основа стандартов лечения
12.1 Основные принципы и понятия доказательной медицины
Понятие, основанное на доказательствах «Eviolence-based Medicine», т.е.
доказательная медицина была предложена канадскими учеными из университета
Мак-Мастера в Торонто в 1990 г. Вскоре в разных странах мира были организованы
центры доказательной медицины, которые начинают играть существенную роль в
работе национальных служб здравоохранения.
Доказательную медицину можно рассматривать, как новый подход, направление или
технологию сбора, анализа, обобщения и интеризации научной информации. А также
это добросовестное, точное и осмысленное использование лучших результатов
клинических исследований для выбора лечения конкретного больного. В области
клинической фармакологии наиболее активно используются принципы доказательной
медицины.
Одна из очевидных причин возникновения необходимости в доказательной медицине
это увеличение объема научной информации, в частности в области клинической
фармакологии. Ежегодно в практику внедряются все новые и новые препараты. Они
активно изучаются в многочисленных исследованиях, результаты которых нередко
оказываются неоднозначными, а иногда и прямо противоположными.
Другая причина – нехватка средств, связанная с ростом расходов на
здравоохранение. В этой ситуации среди большого числа лекарственных препаратов и
методов лечения, необходимо выбрать те средства, которые обладают наиболее
высокой эффективностью и лучшей переносимостью. Следует отметить, что новизна
или высокая стоимость препарата не являются гарантией его более высокой
эффективности. До настоящего времени продолжают использовать лекарственные
препараты, эффективность которых не доказана или вызывает сомнение. Очевидно,
что нет смысла пытаться удешевить лечение путем использования не дорогих, но
мало эффективных препаратов, но столь же бессмысленно назначать дорогостоящие
лекарственные средства в тех случаях, когда не меньший или даже больший эффект
могут дать более дешевые средства. И то и другое в конечном итоге приводит к
увеличению расходов.
Основой доказательной медицины является доказательство или опровержение
предположения об эффективности какого-либо лечебного или диагностического метода
у данной популяции больных. Вследствие того, что провести исследование с
вовлечением всех членов популяции по техническим и многим другим причинам не
представляются возможным, испытание обычно проводится с участием выборки -
исследуемой группы людей. Пациенты исследуемой группы получают препарат,
эффективность которого не доказана или вызывает сомнение в ходе испытания.
Контрольную группу составляют пациенты, не получающие никакого лечения, или
получающие плацебо- лекарственную форму, не отличающуюся от исследуемого
препарата по всем свойствам, но не обладающую терапевтической активностью в
отношении оценивающего признака. Контролируемые исследования гораздо более
достоверны, т.к. позволяют отличать истинную эффективность испытуемого
лекарственного средства от влияния самого факта медицинского вмешательства на
оцениваемые параметры - плацебо-эффект. Испытание лекарственных средств должно
быть слепым, т.е. пациент (просто слепое) или исследователь и пациент (двойное
слепое) – не информированы о том, какая из групп получает испытуемый препарат, а
какая - плацебо. Это также позволяет увеличить объективность результатов
исследования, т.к. уменьшается вероятность ошибки, связанной с формированием
групп больных.
Большую роль в исследовании играет идентичность обеих групп по различным
признакам (пол, возраст, длительность заболевания, лабораторные показатели и
т.д.), которые могут повлиять на исход. Это достигается путем включения
пациентов в разные группы случайным образом, т.е. путем рандомизации. При
включении большого количества больных в исследование рандомизация позволяет
уменьшить различия пациентов разных групп. Тем не менее, пациенты разных групп
могут различаться между собой вследствие случайной ошибки. Для оценки возможной
случайной ошибки при формировании исследуемой и контрольной групп авторы
рандомизированных исследований часто приводят данные о сравнении основных
характеристик больных перед исследованием.
Довольно часто результаты полученных исследований могут быть неверными из-за
влияния на них систематических и случайных ошибок. Систематические ошибки
изменяют результаты исследования однонаправлено и могут быть следствием
неправильного формирования исследуемых групп. Применение различных методов при
оценке результатов в разных группах или при учете различных других факторов,
потенциально влияющих на результат, позволяют максимально уменьшить влияние
систематических ошибок. В отличие от них, случайные ошибки являются следствием
простой случайности, и смещают результат исследования как в одну, так и в другую
стороны. В результате суммарный итог, полученный при сложении всех результатов,
стремится к истинному значению, особенно при большом числе наблюдений. Основными
характеристиками исследования при проведении его на выборке исследуемой группы
больных являются достоверность и обобщенность. Обобщенность результатов
исследования говорит о том, в какой мере результаты, полученные при анализе
выборки, могут быть перенесены на всю популяцию больных. В свою
очередь,достоверность результатов исследования определяется справедливыми
результатами исследования которые являются следствием влияния на результат
возможных систематических и случайных ошибок. Важными критериями клинических
испытаний являются клинические исходы, а не многочисленные лабораторные,
инструментальные и другие параметры. Это обусловлено тем, что в большинстве
случаев исход заболевания является результатом взаимодействия различных,
возможно еще неизвестных медицине, факторов не обусловленных просто изменением
какого-либо физиологического параметра в организме. Например, при оценке
эффективности средств для лечения остеохондроза – не только плотность костной
ткани, но и частоту развития переломов; при проведении исследований для оценки
эффективности сахароснижающего препарата чрезвычайно важно оценивать степень
снижения уровня гликемии или гликированного гемоглобина, но и частоту развития
поздних осложнений сахарного диабета и т.д. В редких случаях конечным параметром
клинических испытаний является продолжительность жизни пациентов вследствие чего
длительность испытаний (ММКИ) может быть довольно большой и достигать десятков
лет.
Необходимость подтверждения эффективности и безопасности лекарственных
средств, вряд ли, у кого вызывает сомнение. Вопрос заключается в том, что может
служить доказательством эффективности и безопасности лечения. Каждый врач вполне
обоснованно полагает, что он в своей практике ориентируется на реальные научные
факты. Одним из путей разработки новых препаратов является изучение механизмов
развития заболевания, которое позволяет определить «лишний» для действия
лекарственных веществ. Соответственно, врачи обычно полагают, что препарат,
благоприятно влияющий на то или иное звено патогенеза болезни, эффективен в ее
лечении. Хотя на практике мы сталкиваемся с обратной ситуацией. Например, одним
из основных медиаторов бронхоспазма является гистамин, однако антигистаминовые
средства мало эффективны в лечении бронхиальной астмы.
Применение сульфаниламидов при острых респираторных вирусных инфекциях;
широкое применение клофелина и комбинированных препаратов (типа адельфана) на
первом этапе лечения артериальной гипертонии; использование так называемых
гепатопротекторов для лечения циррозов печени; применение кокарбоксилазы,
рибоксина для лечения сердечной недостаточности; парентеральное введение
витаминов с целью вспомогательного лечения заболеваний внутренних органов;
назначение антибиотиков больным инфекционно-аллергическим миокардитом;
использование «иммунокорректоров» при герпетической инфекции; применение
антигистаминовых средств для лечения средне-тяжелой астмы; назначение
антипротекторов для лечения диабетической микроантипатии являются примерами
необоснованных подходов к лечению распространенных заболеваний. В медицине
большую роль играет субъективный фактор. В частности личный опыт врача, лечение
экспертов и т.п. В определенных ситуациях, например, при выборе антибиотика для
имперической терапии инфекций, индивидуальный опыт имеет очень важное значение,
однако в других случаях он не может принести какой-либо пользы, например –
применение аспирина с целью вторичной профилактики инфаркта миокарда
(«Библиотека доказательной медицины», М.2002, данные из Интернет).
Как показывают исследования, при решении вопроса о целесообразности
профилактического лечения врач может ориентироваться только на результаты
клинических исследований. Иногда личный опыт приводит к формированию ложных
представлений о лекарственном препарате. Очень часто врачи пытаются использовать
новые средства при наиболее тяжелых формах болезни. Отсутствие какого-либо
эффекта нередко приводит к их полному разочарованию, хотя тот же препарат мог бы
оказаться незаменимым средством лечения легких или среднетяжелых форм болезни
или пациентов группы пожилых людей, пациентов страдающих сопутствующими
заболеваниями и т.п.
В последние годы отмечается явная тенденция к боле широкому использованию
проверенных методов лечения, эффективность которых доказана в адекватных
клинических исследованиях.
Отражением этой тенденции являются попытки стандартизации подходов к лечению
распространенных заболеваний рекомендации по лечению артериальной гипертонии,
ВИЧ-инфекции, пневмонии, хронического гепатита и т.д. Такие попытки могут
вызвать критику у сторонников индивидуализированного лечения, однако подобные
возражения, вряд ли обоснованы. Рекомендации, как правило оставляют достаточно
широкое поле для маневра. Для рекомендации по лечению гипертонии предлагают
выбор средства первого ряда среди шести групп антигипертензивных препаратов, что
позволяет обеспечить индивидуальный подход к терапии. Но самое главное, подобные
рекомендации основываются на реальных фактах и исключают широкое использование
неадекватных методов лечения.
Таким образом, современная медицинская практика требует от врача, чтобы
диагностика заболеваний, назначение эффективного лечения, минимизация
неблагоприятных последствий вмешательств и составление индивидуального прогноза
для больного основывались только на самой надежной информации. Для того, чтобы
этот простой принцип мог быть претворен в жизнь, его недостаточно было
сформировать. Должна была произойти информационная революция, дающая возможность
быстрого поиска сведений, сама медицина должна была накопить достаточный объем
достоверных данных об эффективности вмешательств.
По разным данным только 30-50% работ, прошли проверку в ходе крупных
рандомизированных клинических испытаний, широко применяемые в современной
медицине. Однако с каждым годом объем надежно проверенной информации
стремительно увеличивается. Ежегодно публикуются результаты более 30 тысяч
клинических испытаний. Они доставляют новые значения в копилку врачей и позже
коренным образом меняют отношение к вновь появляющихся или уже хорошо известным
лечебным мероприятиям.
Доказательная медицина – это новый подход не только к научным исследованиям,
но и к применению результатов этих исследований в практике, которая выработала
систему информирования и помогает преодолевать временный барьер между последними
научными достижениями и их внедрением в повседневную работу врача. Такая
информационная система уже доступна с 2002 г. В России начат выпуск «Библиотеки
доказательной медицины». Основная задача этого проекта - обеспечить практических
врачей ключевой, тщательно проверенной, объективной и ежегодно обновляемой
информацией.
В Самаркандском филиале РНЦЭМП медицина основанная на доказательствах
рассматривается как новое направление в здравоохранении, как составная часть его
реформирования. Именно принципы доказательной медицины стали фундаментом для
создания диагностического и лечебного стандартов, значительно ускоряющих процесс
диагностики и лечения экстренных больных.
Получение данных о серьезных рандомизированных методах лечения, сведений по
клинической фармакологии из «Internet», позволило нам пересмотреть многие
стандарты и оставить в них только те методы и средства применение которых
основано на принципах доказательной медицины.
Введение в практику экстренной медицины стандартов действий основанных на
принципах доказательной медицины, является главной сущностью происходящей
реформы здравоохранения в Республике Узбекистан.
Диагностические и лечебные стандарты даже за небольшой срок их применения
доказали, что они необходимы во всех подразделениях экстренной медицины начиная
от скорой помощи и заканчивая реабилитационными отделениями. Особенно они важны
на этапе реанимации и интенсивной терапии. В современной литературе стандартам
уделяется большое внимание, написано очень много руководств, даны схемы лечения
многих экстренных ситуаций, однако механически переносить эти стандарты на
конкретную ситуацию нельзя. Все зависит от того, какими возможностями
располагает лечебное учреждение, его финансирование, оснащение, какова
квалификация врачей. Поэтому в 2002 г нами были разработаны собственные
стандарты действий, исходя из вышеуказанных принципов. В эти стандарты включены
только те средства и методы лечения, которые реально могут быть применены в
нашем Филиале. Действия по стандартам исключают полипрогмазию, назначение не
эффективных лекарственных препаратов дают возможность планировать расход
финансовых средств. Для врачей стандарты это еще и средство юридической защиты,
т.к. они разработаны и утверждены Ученым Советом филиала. Врач несет
ответственность только за осложнения от действий по стандартам. Конечно
идеальная медицина - это индивидуализированный подход к больному по принципу
лечения не болезни, а конкретного больного. Однако в условиях экстренной
медицины этот принцип не может быть применен из-за большого потока больных,
ограниченности возможности использования целого ряда дорогостоящих методик и
лекарств. В какой-то степени это компенсируется ускорением процесса диагностики
и лечения, проводимых по стандартам.
Разработанные схемы диагностики и лечения не являются постоянно действующими,
они пересматриваются по мере появления новых лекарственных препаратов, методов
лечения, переработанные стандарты вновь подтверждаются Ученым Советом. Эту
большую и ответственную работу выполняют самые опытные специалисты Филиала.
Стандарты действия необходимы в первые сутки лечения больного, они особенно
помогают дежурным врачам не имеющим большого опыта. В дальнейшем, во время
осмотра больного более опытными специалистами лечение может быть изменено в
зависимости от обстоятельств.
Пример одного из стандартов.
Стандарт действий при тяжелой черепно-мозговой травме (геморрагическом
инсульте).
А. Синдромы угрожающие жизни больного:
- острая дыхательная недостаточность;
- гипер- и гипотония;
- гипоксия мозга;
- отек-набухание мозга;
- дислокация мозга;
- коматозное состояние (по шкале Глазко);
- нарастающая гематома;
- асфиксия.
Б. Стандарт действия в стационаре
1. Приемно – диагностический отдел
1) Восстановление проходимости дыхательных путей, при отсутствии сознания -
интубация трахеи, вспомогательная вентиляция легких
2) Контроль АД при гипотонии в/в струйное введение плазмозамениетелей,
вазопрессоров
3) Перевод больного в отделение нейрореанимации
2. Отделение нейрореанимации.
1) Подключение больного к респиратору, монитору (для определения Ра О2 и АД).
2) Катетеризация магистральной вены, контроль ЦВД, продолжение инфузионной
терапии, стабилизация гемодинамики в максимально короткие сроки путем струйной
инфузии плазмозаменителей
3) Синхронизация больного с респиратором оксибутиратом натрия 20 % - 10.0 мл
в|в.
4) Свежезамороженная плазма в|в капельно 200.0, раствор хлорида натрия 0.97 %
- 400.0, раствор калия хлорида 4% - 30 мл в|в кап 4 раз в сутки.
5) Эхоэнцефалоскопия.
6) Компьютерная томография.
7) Наложение фрезевого отверстия и дренирование желудочков мозга с
мониторингом давления спинно-мозговой жидкости.
8) Расчет церебрального перфузионного давления по формуле Адср – ВЧД (норма
100мм.рт. ст. ЦПД менее 25 мм.рт.ст. дает необратимое изменение в мозге)
9) Установить зонд в желудок, эвакуировать содержимое, начать кормление в
первые сутки смесью в составе: одно яйцо, раствор меда или сахара (200 мл меда
на 500 мл воды), 1000 мл бульона, 500 мл соков).
10) Антибиотики
11) При повышении внутричерепного давления более 20 мм рт. ст. - 10% раствор
маннитол 500 мл внутривенно капельно или 1,2 % раствора хлорида натрия
12) Контроль свертывающей системы.
13) При необходимости длительной ИВЛ перевод на трахеостому.
14) Экскавационное назначение антибиотиков при появлении инфекции.
15) Анализ спиномозговой жидкости ежедневно.
16) Постуральный дренаж и отсасывание мокроты из дыхательных путей, введение
антибиотиков, диоксидина, муколитиков через небулайзер 4-5 раз в сутки.
17) Смена шлангов на респираторе каждые 12 часов.
18) Контроль часового диуреза через постоянный катетер.
Подобные стандарты разработаны для лечения всех наиболее часто
встречающихся травм и заболеваний.
12.2 Энтеральное питание
Опыт Самаркандского филиала РЦЭМП по применению энтерального питания в
практике реанимации и интенсивной терапии (отделения кардиореанимации,
хирургической реанимации, токсикологии, детской реанимации, ожоговой реанимации,
блоков интенсивной терапии и педиатрии, хирургические отделения) показал, что
данный метод питательной поддержки больных должен назначаться в зависимости от
фактической массы тела, роста, возраста, конкретной нозологической формы
заболевания и клинического состояния пациента, чтобы удовлетворить
действительные потребности организма во всех жизненно необходимых питательных
ингредиентах.
Энтеральное питание (ЭП) приобретает особую значимость у больных находящихся
по тем или иным причинам в критическом состоянии. ЭП является важнейшим
компонентом неотложной терапии пациента в критическом состоянии, так как при
отсутствие питательной поддержки больной организм быстро слабеет, что нередко
является причиной неблагоприятного исхода болезни. В соответствии с современными
представлениями кишечник должен восприниматься как потенциальный источник
сепсиса из-за нарушений проницаемости кишечного барьера. В настоящее время
данный метод в большинстве лечебных учреждений не имеет должного внедрения, что
снижает качество оказываемой медицинской помощи.
ЭП должно удовлетворять по край ней мере следующим трём критериям:
быть безопасным;
полностью удовлетворять потребности организма в макро- и микронутриентах;
допускать модификации в составе питательных смесей для удовлетворения
специфических потребностей, в зависимости от характера заболевания.
С помощью ЭП решаются следующие задачи:
обеспечение пластических потребностей организма ;
коррекция нарушения водно-электролитного баланса;
удовлетворения в других макро и микронутриентах.
Основные показания для ЭП.
1. Невозможность перорального приёма пищи в следствие:
нарушения сознания (черепно-мозговые травмы, инсульты, комы);
нарушения функции жевания и глотания;
нарушения функциональной проходимости верхних отделов пищеварительного
тракта (ожоги, стенозы, опухоли пищевода и желудка).
2. Катаболические состояния, сопровождающиеся повышением основного обмена и
высокими потерями белкового азота с мочой, при:
- политравмах, обширных и глубоких ожогах;
- сепсисе, абсцессах и других гнойных осложнениях;
- обширных оперативных вмешательствах (в торакальной хирургии, абдоминальной
хирургии, после радикальных операций по поводу рака).
Известно, что парентеральное питание по стоимости в 6 раз превосходит
энтеральное. При его проведении требуется строгое соблюдение стерильности,
скорости введения ингредиентов.
Энтеральное питание может быть полным и частичным
,
является единственным источником восполнения потерь белков, жиров и углеводов. В
первом варианте оно обеспечивает полную суточную потребность организма в
нутриентах, во втором - дополняет пероральное или парентеральное питание.
При осуществлении нутриционной поддержки больных мы соблюдали стандарты
искусственного питания: определяли показания, проводили расчет потребностей
организма в нутриентах, выбирали вид искусственного питания (энтеральное,
смешанное), состав смесей и растворов, составляли программу суточного рациона.
Для улучшения качества проведения ЭП мы рекомендуем использование пребиотиков,
например 2% го раствора пектина и глютамина. Они способствуют заживлению
толсто-кишечного анастомоза, уменьшают диарею, улучшают всасывательную функцию,
нормализуют моторику кишечника, оказывают бактерицидное действие на Гр+ и Гр-
микроорганизмы, улучшают иммунитет, азотный баланс, а также барьерную функцию
кишечника, уменьшают число инфекционных осложнений. Больным находящимся в
критическом состоянии рекомендуются сухие сбалансированные питательные смеси,
где имеется точный химический состав макро- и микронутриентов, например, смесь
Унипит, которая имеется в магазинах Узбекистана. В последнее время возрос
интерес медицинской общественности к смесям специального назначения.
ЭП допускает модификации в составе питательных смесей для удовлетворения
специфических потребностей в зависимости от характера заболеваний: например, при
сердечной патологии идёт ограничение жидкости, больным находящимся на ИВЛ,
необходима высоко калорийная концентрированная смесь, с ограничением углеводов,
у больных с почечной недостаточностью необходимо ограничение белка, калия,
натрия, хлора и повышение калорийной плотности при печёночной недостаточности
рекомендуется увеличение аминокислот, при дыхательной недостаточности идёт
ограничение углеводов. Этим требованиям отвечают смеси ГЕПАМИН, ГЕПАТИК,
НЕФРАМИН, ПУЛЬМОКЭРЕ АЛЬ-110.
Наилучшие результаты при воспалительных и инфекционных процессах оказывают
питательные смеси, в состав которых вводятся биологически активные вещества -
нутриенты: аргинин, глутамин, нуклеотиды, таурин, антиоксиданты и витамины. Их
использование улучшает азотный баланс, барьерную функцию кишечника, уменьшает
число инфекционных осложнений у послеоперационных больных, способствует быстрому
заживлению ран, повышению иммунитета.
Для приготовления питательной смеси выбрали смесь «Зонд» из натуральных
пищевых продуктов путем их фрагментации и обработки пищеварительными энзимами.
Питательных смесей для осуществления ЭП очень много. В Самаркандском филиале
РНЦЭМП с начала года была предложена и внедрена питательная смесь «Зонд» и его
модификации состоящие из натуральных продуктов. Основу составляет мясной бульон.
В зависимости от заболевания степени тяжести и реакции организма больных
использовали Зонд-1, Зонд-2, Зонд-3, отличающиеся друг от друга по калорийности
(таблица19) (Костюченко А.Л., 2003).
Основу питательной смеси «Зонд» составляет мясной бульон, куда добавляется
отварное мясо, яичный желток, сметана, сливочное масло, картофельное пюре, каша
из толокна и манной крупы, отвар кураги, яблочный и мандариновый соки. Смесь
обогащали витаминами (аскорбиновая кислота, группы В) и глютамином.
Глютамин-обогащенная диета (15-20 грамм глютамина в сутки) улучшает азотный
баланс, барьерную функцию кишечника, уменьшает число инфекционных осложнений у
послеоперационных больных, хорошо переносится и способствует лучшему усвоению
пищевых ингредиентов.
В состав питательных смесей, для улучшения усвоения продуктов практически у
всех больных в состав питательной смеси добавлялись ферментивные препараты (панзинорм,
фестал, мезим-форте, хилак-форте).
Состав питательных ингредиентов в смеси «Зонд-1, Зонд-2, Зонд 3»
| Зонд – 1 |
| № |
Продукты |
Количество |
| 1. |
Мясной бульон |
500 мл. |
| 2. |
Масло сливочное |
10 г. |
| 3. |
Яйцо (желток) |
36 г. |
| 4. |
Сметана |
100 г. |
| 5. |
Морковный сок |
200 мл |
| 6. |
Яблочный сок |
200 мл |
| 7. |
Толокно |
30 |
| 8. |
Курага |
150 г. |
| Итого |
1300-1500ккал |
| Зонд – 2 |
| № |
Продукты |
Количество |
| 1. |
Мясной бульон |
1000 мл. |
| 2. |
Мясо отварное, крученное |
200 г. |
| 3. |
Масло сливочное |
50 г. |
| 4. |
Яйцо (желток) |
100 г. |
| 5. |
Сметана |
100 г. |
| 6. |
Морковный сок |
200 мл |
| 7. |
Яблочный сок |
200 мл |
| 8. |
Толокно |
30 |
| 9. |
Курага |
150 г. |
|
Итого |
2000-2100 ккал |
| Зонд – 3 |
| № |
Продукты |
Количество |
| 1. |
Мясной бульон |
1000 мл. |
| 2. |
Мясо отварное, крученное |
400 г. |
| 3. |
Масло сливочное |
50 г. |
| 4. |
Яйцо (желток) |
100 г. |
| 5. |
Сметана |
100 г. |
| 6. |
Морковный сок |
200 мл |
| 7. |
Яблочный сок |
200 мл |
| 8. |
Толокно |
30 |
| 9. |
Курага |
100 г. |
| 10. |
Манная крупа |
40 г. |
| 11. |
Картофель |
200 г. |
| Итого |
3000-3200 ккал |
Показанием к назначению смеси «Зонд-1» в основном являлась хирургическая
патология в послеоперационном периоде, почечная недостаточность, отравления, а
смеси «Зонд-2» больным с сочетанными травмами, инсультами, комой, «Зонд-3»
больным терапевтического профиля, с ожоговой болезнью.
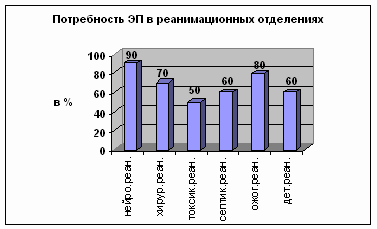
За 2003 год ЭП проведено 1690 больным: в отделении нейрореанимации - 667, в
отделении абдоминальной хирургии - 699, в отделении торакальной хирургии - 10,
отделении токсикореанимации - 88, в отделении септической хирургии - 84,
отделении ожоговой реанимации - 90, детской реанимации - 36, в других отделениях
- 16 больных. Продолжительность ЭП составила от одних суток до 20, в среднем 7.
Объем ЭП от 1 литра до 2.5 - 3 литров. Питание осуществлялась фракционно,
мелкопорционно или капельно. ЭП проводилось через назогастральный зонд,
назоинтестинальный зонд, гастростому или еюностому.
Энергетическую потребность у больных рассчитывали по калорийному методу, для
поддержания оптимальной массы тела - 30-35 ккал/кг, а для восстановления ее-
35-40 ккал/кг. У истощенных больных в связи со снижением основного обмена в
первые дни лечения, во избежании синдрома быстрого насыщения основной задачей
являлась поддержка фактической массы тела.
У больных с повышенным катаболизмом (черепно-мозговые травмы, ожоги,
генерализованная хирургическая инфекция) энергопотребность составляла 60-80
ккал/кг.
В первые 3-5 сутки, во избежании развития осложнений вследствие чрезмерно
быстрого начала искусственного питания, больные получали не более 50 - 70% от
рассчитанных фактических потребностей организма в питательных веществах.
Толерантность энтерального питания определяли путем введения глюкозо-солевых
растворов (5-10% раствор глюкозы и физиологический раствор натрия хлорида, в
соотношении 2: 1, в количестве от 500 до 1000мл на введение).
Для оценки эффективности и адекватности ЭП и для выявления осложнений
осуществлялся клинико-лабораторный мониторинг. Клиническую эффективность
определяли путем измерения окружностей плеча, мышц плеча, толщины кожно-жировой
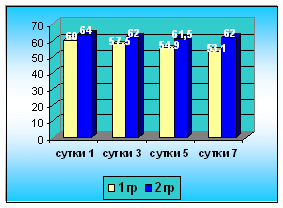
складки над трицепсом. Лабораторно определены белок крови, остаточный азот,
креатинин.
В отделении нейрореанимации ЭП получали больные: ЧМТ – 338, инсультами 230,
менингоэцефалитами, эпилепсией, ретробульбарным абсцессом 99.
При этом учитывали, что при ЧМТ потеря азота составляет 20-30 грамм в сутки,
а суточная потребность составляет 40-60 ккалкг. Особенностью ЭП при
повреждениях ЦНС, случайных (ЧМТ) или преднамеренных (нейрохирургические
операции) является то, что оно проводится на фоне гиперкатаболизма. Другой
особенностью таких пациентов является сохранение функциональной дееспособности
желудочно-кишечного тракта.
Диаграмма 51
Режим питания: фракционный и мелкопорционный. Объем от 1.5-2.5 литров.
Длительность от 1 суток до 20 суток. Всего ЭП получили 667 больных, что
составило 61.9 % (процентов) от общего количества больных. Осложнение в виде
диареи и рвоты было у 53 больных (8%) от общего количества больных получивших ЭП,
что явилось обоснованием для прекращения ЭП.
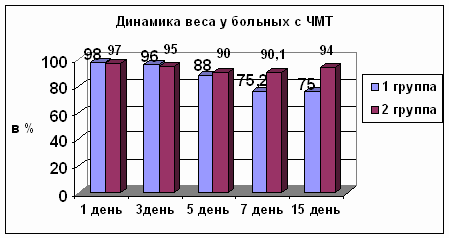
Наблюдения показали, что в первые 4-5 дней больные теряли массу тела, белок в
крови уменьшался. Далее шла относительная стабилизация массы тела, падение белка
в крови приостанавливалось, потери азота с мочой уменьшались. У больных
находившихся под наблюдением, прибавки массы тела не отмечалось, за исключением
12 больных, которые длительно получали ЭП, что составило 1.8 %. Благодаря
применению ЭП сократились сроки пребывания многих больных в стационаре.
Диаграмма 52
ЭП в абдоминальной хирургии должно применяться более широко. ЭП можно
проводить как до операции, так и после. Обычно ЭП начинали через 2-3 суток после
операции. По мере улучшения состояния больных переходили на обычный режим. Всего
ЭП в абдоминальной хирургии получили 699, что составляют 23 %, длительность его
была от 1 до 7-8 суток. У 5-6 % больных осложнения отмечались в виде вздутия,
рвоты, боли в животе.
Наблюдения показали, что у больных быстро стабилизировалась гемодинамика,
восстанавливалась перистальтика кишечника, нормализовался белковый,
электролитный баланс, восстанавливалась масса тела, лучше заживали раны,
отмечалось раннее восстановление двигательной активности кишечника, уменьшался
объем инфузий, сокращалась частота послеоперационных осложнений, что в итоге
уменьшало сроки пребывания их в стационаре.
Диаграмма 53. Динамика окружности
мышц плеча (см).
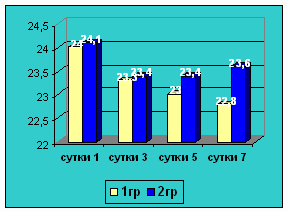
Диаграмма 54. Динамика содержания белка в
крови (гр/л).
Первый опыт внедрения принципов энтерального питания в системе ЭМП показал
важность этого направления.
В Самаркандском филиале РНЦЭМП разработана долгосрочная программа применения
ЭП, которая предусматривает следующие направления:
-разработка и внедрение более эффективных рационов энтерального питания;
-расширение выпускаемых смесей с охватом не менее 30% пациентов;
-наладить и внедрить методы оценки эффективности энтерального питания;
-сравнить используемые смеси с зарубежными готовыми препаратами для
энтерального питания.

