Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
5.3. ЛАБОРАТОРНО-ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
В большинстве случаев диагноз ИБС и стабильной стенокардии напряжения может
быть установлен уже при расспросе больного. Отсутствие типичных для стенокардии
характеристик болевого синдрома не является достаточным основанием для того,
чтобы отвергнуть диагноз ИБС. У любого пациента, предъявляющего жалобы на
периодически возникающую боль в области сердца, особенно у лиц пожилого
и старшего возраста, требуется проведение целого ряда современных лабораторных
и инструментальных тестов для того, чтобы объективно подтвердить или отвергнуть
диагноз ИБС.
Основные цели такого диагностического поиска следующие:
1. Доказать наличие или отсутствие у больного признаков коронарного
атеросклероза и, по возможности, оценить его распространенность и
преимущественную локализацию.
2. Оценить величину коронарного резерва, определить толерантность пациента
к физической нагрузке.
3. По возможности проанализировать преобладающие механизмы возникновения
коронарной недостаточности.
4. Выявить и количественно оценить имеющиеся ФР ИБС.
5. Оценить степень систолической и диастолической дисфункции ЛЖ.
6. Определить наличие признаков перенесенного в прошлом ИМ.
Электрокардиограмма
ЭКГ, зарегистрированная вне приступа стенокардии, примерно у 1/3 больных ИБС
мало отличается от нормы, особенно у лиц молодого возраста. У другой части
больных на ЭКГ можно выявить следующие неспецифические изменения: признаки
гипертрофии ЛЖ (даже у пациентов, не страдающих сопутствующей АГ):
горизонтальное положение электрической оси сердца, увеличение амплитуды зубцов R
в левых грудных отведениях и величины S в правых грудных отведениях, смещение
переходной зоны вправо (отведение V2–V3), увеличение
продолжительности интервала внутреннего отклонения в отведении V5, 6
больше 0,05 с; признаки рубцовых изменений миокарда, указывающие на перенесенный
в прошлом ИМ: патологический зубец Q в нескольких грудных и/или стандартных или
усиленных отведениях от конечностей; различные нарушения ритма и проводимости (внутрижелудочковые
блокады, АВ-блокады); умеренное увеличение продолжительности комплекса QRS (до
0,10 с) и интервала Q–Т; неспецифические изменения зубца Т (сглаженность,
двухфазность, инверсия Т или, наоборот, высокий гигантский зубец Т) и сегмента
RS–Т (чаще небольшое снижение RS–Т ниже изоэлектрической линии).
Указанные изменения зубца Т и сегмента RS-Т, зарегистрированные в покое (вне
приступа стенокардии), не специфичны для ИБС и встречаются также при многих
заболеваниях, сопровождающихся гипертрофией ЛЖ (АГ, ГКМП, приобретенные и
врожденные пороки сердца). Сходные изменения могут возникать на фоне приема ряда
лекарственных средств (дигиталис) и при некоторых нарушениях электролитного
обмена. Только обнаружение на ЭКГ покоя признаков перенесенного крупноочагового
(трансмурального) ИМ (патологический зубец Q) может служить достаточно надежным
подтверждением наличия у данного пациента ИБС.
Во время приступа стенокардии можно выявить ЭКГ-признаки преходящей ишемии
миокарда, к которым относятся изменения полярности, амплитуды и формы зубца Т,
а также положения сегмента RS–Т, которые во многом зависят от локализации
ишемизированного участка по отношению к полюсам регистрируемого отведения.
Обычно регистрируют снижение (депрессию) сегмента RS–Т ниже изоэлектрической
линии, что указывает на возникновение ишемии субэндокардиальных отделов
сердечной мышцы. Одновременно появляется сглаженность, двухфазность или инверсия
зубцов Т. Если эти изменения фиксируются в грудных отведениях, это
свидетельствует об ишемии передней стенки ЛЖ, а в отведениях II, III и аVF - об
ишемии заднедиафрагмальной области. В последнем случае в грудных отведениях
могут выявляться высокие остроконечные и равносторонние зубцы Т, которые также
указывают на ишемию задней стенки ЛЖ. Эти изменения, так же как и сам приступ
стенокардии, непродолжительны, и уже через 4–10 мин после купирования боли
обычно происходит полное восстановление ЭКГ. Именно поэтому на практике очень
редко удается зафиксировать эти изменения, хотя связь описанных
электрокардиографических изменений с типичным болевым приступом и является более
достоверным подтверждением диагноза ИБС,. Исключение составляют случаи, когда
проводится длительное мониторирование ЭКГ по Холтеру.
Функциональные нагрузочные тесты
Для электрокардиографической диагностики ИБС повсеместно используют
функциональные нагрузочные тесты. Чаще других применяют пробу с дозированной
физической нагрузкой на велоэргометре или тредмиле, дипиридамоловую пробу,
чреспищеводную электростимуляцию предсердий и суточное мониторирование ЭКГ по
Холтеру.
Пробы с дозированной физической нагрузкой
Пробы с дозированной физической нагрузкой применяются с целью выявления
скрытой коронарной недостаточности и для установления индивидуальной
толерантности больных к физической нагрузке. Физическая нагрузка оказывает
разнообразное действие на сердечно-сосудистую и дыхательную системы, вызывая
тахикардию, умеренное повышение АД, увеличение работы сердца, потребности
миокарда в кислороде. У здорового человека это приводит к адекватному расширению
коронарных сосудов и увеличению сократимости миокарда. В условиях
лимитированного коронарного кровообращения у больных ИБС увеличение потребности
миокарда в кислороде приводит к острой коронарной недостаточности,
сопровождающейся приступом стенокардии или/и изменениями на ЭКГ. Существует
несколько методов проведения пробы с физической нагрузкой, среди которых
наибольшее распространение в клинической практике получили пробы с дозированной
физической нагрузкой на велоэргометре или тредмиле (бегущая дорожка).
Велоэргометрия. Является наиболее доступной нагрузочной пробой. Используемый
для этой цели велоэргометр позволяет строго дозировать физическую нагрузку
и оценивать величину выполненной внешней работы в ваттах (Вт) или
килограммометрах (кГм). Для проведения пробы необходим также электрокардиограф
(желательно многоканальный), сфигмоманометр для измерения уровня АД
и фонендоскоп. Кабинет функциональной диагностики, где проводится исследование,
должен быть оснащен дефибриллятором и набором средств для оказания неотложной
помощи. Велоэргометрическую пробу проводят обычно в первой половине дня после
легкого завтрака или через 2–3 ч после еды.
За сутки до проведения исследования пациент не должен принимать лекарственных
препаратов, оказывающих влияние на результаты пробы с физической нагрузкой:
нитратов пролонгированного действия, блокаторов β-адренорецепторов, антагонистов
кальция, ингибиторов АПФ, сердечных гликозидов, мочегонных средств, некоторых
противоаритмических препаратов. ЭКГ регистрируют в 12 общепринятых отведениях.
Для удобства проведения исследования электроды от верхних конечностей помещают
на грудную клетку в подключичных областях или ниже углов лопаток, а электроды от
нижних конечностей - в области поясницы или у нижнего края реберных дуг.
Применяются различные схемы проведения велоэргометрической пробы. Чаще всего
нагрузку повышают ступенеобразно каждые 3 мин, начиная с мощности 25 или 50 Вт
(150–300 кГм/мин). Такое ступенеобразное повышение величины нагрузки на 25 Вт
можно осуществлять как непрерывно в течение 15–18 мин (у относительно хорошо
тренированных лиц с заведомо высокой толерантностью к физической нагрузке), так
и с 3-минутными перерывами для отдыха после каждой ступени нагрузки (у менее
тренированных лиц или больных с заболеваниями сердца и сниженной толерантностью
к физической нагрузке). Наиболее физиологичной считается непрерывная
ступенеобразно возрастающая нагрузка.
Велоэргометрическую пробу проводят под постоянным контролем ЭКГ на экране
монитора, уровня АД и состояния больного. Запись ЭКГ и измерение АД проводят до
начала исследования, в конце каждой минуты пробы, а также на 30-й секунде, 1-й,
2-й, 3-й, 5-й, 7-й и 10-й минутах отдыха.
Тредмил представляет собой движущуюся дорожку, которая может устанавливаться
под различным углом. Скорость движения дорожки и угол ее наклона регулируются в
зависимости от задаваемой мощности нагрузки и протокола исследования (таблица
14). Пациент, находящийся на движущейся дорожке, шагает или бежит по ней.
Развиваемая мощность и величина выполненной работы оцениваются по таблицам,
автоматически.
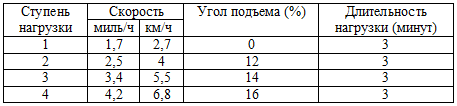
Таблица 14. Изменение скорости, угла подъема дорожки
Примечание: угол подъема дорожки принято оценивать в процентах, подъем конца
дорожки на 5 см соответствует углу подъема 5% (2,5 град).
Контроль за динамикой ЭКГ, АД и ЧСС осуществляется таким же способом, как
и проведение велоэргометрической пробы. Противопоказаниями к проведению
велоэргометрии и тредмил-теста являются: 1. Острый ИМ (или подозрение на ИМ). 2.
Нестабильная стенокардия (НС). 3. Сердечная недостаточность II–III стадии. 4.
Дыхательная недостаточность II–III степени. 5. Острое нарушение мозгового
кровообращения или хроническая дисциркуляторная недостаточность II–III степени.
6. Острые инфекционные заболевания, сопровождающиеся лихорадкой. 7. Острый
тромбофлебит.
Существуют также относительные противопоказания: 1. Выраженная АГ (АД выше
180/100 мм рт. ст.). 2. Тяжелые нарушения ритма и проводимости (АВ-блокада II–III
степени, мерцательная аритмия, пароксизмальные тахикардии, БНПГ). 3. Тахикардия
неясного генеза (ЧСС выше 100 уд. в мин). 4. Стеноз устья аорты (клапанный,
подклапанный). 5. Аневризмы сердца и сосудов. 6. Частые синкопальные состояния
в анамнезе. 7. Неврологические и психические заболевания. 8. Заболевания
опорно-двигательного аппарата.
Решение вопроса о возможности проведения велоэргометрической пробы должно
быть строго индивидуальным и учитывать общее состояние больного, его
гемодинамические показатели, целесообразность исследования, а также условия его
проведения. В специализированных кардиологических стационарах допускается
проведение нагрузочных проб у больных ИМ с целью ранней физической реабилитации
(с 2-й недели заболевания). Подобные исследования у больных ИМ и НС могут
осуществляться только в специально оснащенных блоках интенсивной терапии или
кардиореанимационных отделениях при участии врачей-реаниматологов.
Интерпретация результатов ЭКГ-исследования
При проведении пробы с дозированной физической нагрузкой у больных ИБС врач
преследует обычно две основные цели: определить толерантность пациента к
физической нагрузке и выявить клинические и электрокардиографические признаки
ишемии миокарда, обусловленной коронарной недостаточностью, с целью диагностики
ишемической болезни сердца. Толерантность к нагрузке оценивают преимущественно
по показателю максимальной (пороговой) мощности работы выполненной пациентом.
Используют и другие показатели: общий объем выполненной работы, длительность
нагрузки, время возникновения боли в области сердца и депрессии сегмента RS–T
и другие.
Различают высокую толерантность, когда максимальная мощность нагрузки в
момент ее прекращения равна 150 Вт (900 кГм/мин) и выше; среднюю толерантность,
когда максимальная мощность нагрузки равна 100–125 Вт (600–750 кГм/мин);низкую
толерантность, когда максимальная мощность нагрузки не превышает 25–75 Вт
(150–450 кГм/минуту). Индивидуальная толерантность к физической нагрузке зависит
от многих факторов: величины коронарного резерва, индивидуальной способности
к адекватному увеличению коронарного кровотока при физической нагрузке,
сократительной способности миокарда, физической тренированности обследуемого,
индивидуальной реакции сердечно-сосудистой системы на нагрузку в виде подъема
или снижения артериального давления.
Критериями прекращения велоэргометрической пробы являются: 1. Достижение
пациентом максимальной или субмаксимальной возрастной ЧСС. 2. Горизонтальное или
косонисходящее снижение (депрессия) сегмента RS–T на 1 мм и более от исходного
уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс
от точки соединения (j) 3. Медленное косовосходящее снижение (депрессия)
сегмента RS–T на 1,0 мм и более от исходного уровня при условии, если такое
снижение сохраняется на протяжении не менее 80 мс от точки соединения (j). 4.
Подъем сегмента RS–T на 1,0 мм и более от исходного уровня на протяжении 80 мс
от точки соединения. 5. Приступ стенокардии, типичный для данного больного. 6.
Снижение САД на 20 мм рт. ст. 7. Подъем САД до 220 мм рт. ст. и/или ДАД до
110 мм рт. ст. и выше. 8. Возникновение приступа удушья или выраженной одышки.
9. Появление угрожающих нарушений ритма (частая ЖЭ, политопная ЖЭ, залповая ЖЭ,
пароксизм суправентрикулярной или желудочковой тахикардии, пароксизм
мерцательной аритмии). 10. Возникновение АВ-блокады или блокады ножек пучка
Гиса. 11. Изменение комплекса QRS: углубление и увеличение продолжительности
ранее существовавших зубцов Q, переход патологического зубца Q в комплекс QS.
12. Появление резкой общей слабости. 13. Возникновение выраженного
головокружения, головной боли, тошноты, нарушений координации движений. 14.
Отказ больного от дальнейшего исследования. Изменения зубца Т, нередко
возникающие при выполнении физической нагрузки, не являются критериями
прекращения нагрузочной пробы.
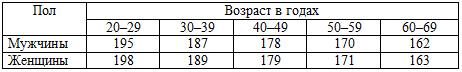
Таблица 15. Максимальная ЧСС в зависимости от пола и возраста
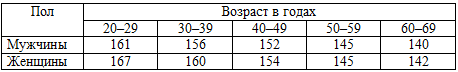
Таблица 16. Субмаксимальная ЧСС в зависимости от пола и возраста
В таблице 15 приведены величины максимальной частоты сердечных сокращений в
зависимости от пола и возраста, по достижении которой следует прекратить пробу с
нагрузкой у здоровых людей. У больных с установленным диагнозом ишемической
болезни сердца часто ограничиваются достижением так называемой субмаксимальной
частоты сердечных сокращений, составляющей 75% или 80% от максимальной, так как
дальнейшее увеличение нагрузки опасно из-за возможности возникновения
осложнений. В таблице 16 указаны величины субмаксимальной (75% от максимальной)
ЧСС в зависимости от пола и возраста.
Снижение толерантности к физической нагрузке возможно не только у больных
ишемической болезнью сердца, но и у пациентов с другими органическими
и функциональными заболеваниями сердечно-сосудистой системы и даже
у малотренированных здоровых людей. Снижение толерантности не является
специфичным признаком наличия ишемической болезни сердца.
При проведении функциональных нагрузочных тестов с целью объективного
подтверждения ишемии миокарда могут быть получены следующие результаты: 1.
Положительная проба. 2. Отрицательная проба. 3. Сомнительная проба. 4.
Неинформативная (незавершенная) проба.
Положительная проба. Наиболее достоверными объективными диагностическими
критериями ишемии миокарда являются следующие 3 электрокардиографических
признака. 1. Горизонтальное или косонисходящее снижение (депрессия) сегмента RS–T
на 1,0 мм и более от исходного уровня при условии, если такое снижение
сохраняется на протяжении не менее 80 мс от точки соединения (j). 2. Медленное
косовосходящее снижение (депрессия) сегмента RS–T на 1,0 мм и более от исходного
уровня при условии, если такое снижение сохраняется на протяжении не менее 80 мс
от точки соединения (j). 3. Подъем сегмента RS–T на 1,0 мм и более от исходного
уровня на протяжении 80 мс от точки соединения.
Ишемические смещения сегмента RS–T ниже изоэлектрической линии связывают
обычно с развитием субэндокардиальной ишемии миокарда. Ишемический подъем
сегмента RS–T может свидетельствовать о трансмуральной ишемии миокарда,
распространяющейся на все слои стенки ЛЖ, включая и субэпикардиальные ее отделы.
Подъем сегмента RS–T может развиться при спазме КА, индуцированном физической
нагрузкой, при выраженном стенозировании КА или хронической аневризме ЛЖ,
сопровождающихся критическим снижением коронарного кровотока. В этих последних
случаях подъем сегмента RS–T часто сочетается с признаками нарушения
сегментарной сократимости ЛЖ (дискинезия, акинезия или гипокинезия отдельных
сегментов).
Отрицательная проба диагностируется в тех случаях, когда пациент при
проведении исследования достиг заданной возрастной ЧСС, однако перечисленные
клинические и электрокардиографические признаки ишемии миокарда отсутствуют.
Сомнительная проба диагностируется в следующих случаях: 1. Если в процессе
исследования развился типичный для стенокардии или атипичный болевой синдром
в грудной клетке, не сопровождающийся объективными ишемическими признаками на
ЭКГ. 2. Если наблюдается горизонтальное, косонисходящее или медленно восходящее
смещение сегмента RS–T менее 1,0 мм от исходного уровня. 3. Если во время
исследования обнаружены нарушения ритма и проводимости (частая или политопная
экстрасистолия, преходящие нарушения атриовентрикулярной или внутрижелудочковой
проводимости, появление пароксизмов суправентрикулярной или желудочковой
тахикардии). 4. Если на высоте нагрузки произошло падение АД на 20 мм рт. ст.
и более от исходного уровня.
Неинформативной (незавершенной) называют такую пробу, которая не была
доведена до субмаксимальной возрастной ЧСС и не сопровождалась появлением
описанных выше клинических или электрокардиографических признаков ишемии или
дисфункции миокарда. Различные изменения морфологии зубца Т, в том числе
отрицательные зубцы Т, нередко наблюдаются во время нагрузки у больных без
поражения КА и даже у здоровых людей и не могут служить критерием ишемии.
Чувствительность проб с дозированной физической нагрузкой, проводимых с целью
диагностики ишемической болезни сердца, колеблется от 62% до 80%, специфичность
- от 83% до 96%.
Ложноположительные результаты пробы с физической нагрузкой могут выявляться
у 17% больных и здоровых лиц без поражения КА, причем у женщин частота
ложноположительных результатов пробы значительно выше, чем у мужчин. Причинами
ложноположительных результатов пробы являются: 1. Нейроциркуляторная дистония.
2. Заболевания, сопровождающиеся выраженной гипертрофией миокарда ЛЖ. 3. Пролапс
митрального клапана. 4. Заболевания и синдромы, сопровождающиеся значительными
нарушениями электролитного баланса. 5. Синдромы CLC и WPW. 6. Блокады ножек
пучка Гиса. 7. Анемии различного генеза (гипоксия миокарда). 8. Хронические
заболевания легких, сопровождающиеся выраженной дыхательной недостаточностью
(гипоксия миокарда). 9. Прием сердечных гликозидов, мочегонных, эстрогенов.
Частота ложноотрицательных результатов пробы у больных ИБС достигает 20–38%.
Дипиридамоловый тест
Проба с дипиридамолом (курантилом) применяется с целью выявления коронарной
недостаточности, особенно в тех случаях, когда по разным причинам невозможно
проведение пробы с дозированной физической нагрузкой. Внутривенное относительно
быстрое введение больших доз дипиридамола, являющегося мощным вазодилататором,
приводит к значительному расширению артериол в зонах непораженных коронарных
артерий, тогда как артериолы в бассейне стенозированных коронарных сосудов
расширяются в значительно меньшей степени. Это приводит к патологическому
перераспределению крови в различных участках сердечной мышцы: усиливается
кровоснабжение интактных участков миокарда и уменьшается коронарный кровоток по
стенозированным коронарным артериям (феномен межкоронарного “обкрадывания”).
В результате возникают участки ишемии сердечной мышцы, локализация которых
соответствует бассейнам кровоснабжения пораженных коронарных сосудов.
Перед проведением теста необходимо отменить прием лекарственных препаратов
и пищевых продуктов, содержащих ксантиновые производные (эуфиллин, теофиллин,
кофе, крепкий чай). Дипиридамол вводят внутривенно в дозе 0,75 мг на 1 кг массы
тела, что составляет обычно 10–12 мл 0,5% раствора. Чаще всего расчетную дозу
препарата делят на 3 равные части, которые вводят в 3 этапа. В течение первых
трех минут вводят первую треть дозы, затем в течение следующих 3–5 мин - вторую
треть. Если к этому времени не появятся клинические или/и
электрокардиографические признаки ишемии миокарда, на протяжении следующих 3–5
мин вводят последнюю треть дозы. Дипиридамоловую пробу осуществляют под
постоянным ЭКГ-контролем.
При отсутствии признаков ишемии миокарда ЭКГ регистрируют еще через 10, 15
и 20 мин после окончания введения препарата. Исследование завершают внутривенным
введением 10 мл 2,4% раствора эуфиллина, который является физиологическим
антагонистом дипиридамола. Критерии положительного дипиридамолового теста те же,
что и при проведении пробы с дозированной физической нагрузкой: ишемическая
депрессия или элевация сегмента RS–T на 1,0 мм и больше от исходного уровня.
Введение дипиридамола может сопровождаться небольшой тахикардией, снижением АД,
головной болью, тяжестью в нижних конечностях. Чувствительность дипиридамолового
теста составляет 60–75%, специфичность - 70–90%.
Проба с добутамином
Является одной из самых информативных функциональных нагрузочных проб,
используемых в клинической практике. Добутамин обладает выраженным
бета-адреностимулирующим действием. При введении препарата увеличивается ЧСС,
повышается АД, значительно увеличивается работа сердца и потребность миокарда в
кислороде. В условиях лимитированного коронарного кровоснабжения это приводит
к возникновению преходящей ишемии миокарда. Добутамин вводят внутривенно
в увеличивающихся дозах (5, 10, 15, 20, 30 мг на 1 кг/массы/мин) с интервалами
в 3 мин. Введение препарата осуществляют с помощью автоматического инфузомата.
Для диагностики преходящей ишемии миокарда используют те же критерии, что и при
проведении проб с дозированной физической нагрузкой и дипиридамолового теста.
Чувствительность пробы с добутамином изопротеренолом составляет 60–70%,
специфичность - 70–90%. Проба используется в диагностике ИБС у больных,
у которых выполнение интенсивной физической нагрузки невозможно.
Проба с эргометрином
Используется для подтверждения спастического механизма коронарной
недостаточности у больных ИБС, когда коронароангиография не обнаруживает
стенозирование КА, а клиническая картина заставляет заподозрить вазоспастическую
форму стенокардии (стенокардия Принцметала). Проба с эргометрином опасна
развитием тяжелых осложнений (ИМ, внезапная смерть, желудочковые аритмии).
Чреспищеводная электрическая стимуляция сердца
ЧПЭС - неинвазивный метод исследования, который используется для диагностики
коронарной недостаточности у больных ИБС, изучения характера
и электрофизиологических механизмов нарушений ритма сердца, а также для
купирования пароксизмальных наджелудочковых тахиаритмий. Сущность метода
заключается в регулируемом увеличении числа сердечных сокращений (ЧСС) путем
навязывания искусственного ритма электрической стимуляцией предсердий. Для
проведения ЧПЭС используется гибкий биполярный электрод-катетер, который
вводится через нос или рот в пищевод на глубину примерно 45 см и устанавливается
на уровне предсердий. Для возбуждения предсердий используют силу тока от
20 мА до 30 мА.
Напряжение достигает 30–60 В. Ниже приведена техника ЧПЭС, используемой для
выявления скрытой коронарной недостаточности. Регулируемое увеличение ЧСС значительно
повышает работу сердца и потребность миокарда в кислороде, что в условиях
лимитированного коронарного кровотока у больных ИБС может приводить к развитию
приступа стенокардии и/или появлению на поверхностной ЭКГ ишемических изменений.
После регистрации исходной ЭКГ в 12 отведениях начинают чреспищеводную
электрическую стимуляцию сердца. По достижении стабильной ЧСС в 100 уд/мин,
ступенеобразно (через каждые 1–2 минуты) увеличивают темп навязываемых сердечных
сокращений на 15–20 уд/мин. При хорошей переносимости пробы и отсутствии
ишемических изменений на ЭКГ достигают ЧСС 160 уд/мин, удерживая такой темп
сердечных сокращений в течение 10 мин, после чего отключают
электрокардиостимулятор, восстанавливая исходный синусовый ритм. Естественно,
чреспищеводная электростимуляция сердца может быть прекращена “досрочно” при
появлении клинических или/и электрокардиографических признаков возникновения
ишемии миокарда.
Пробу с ЧПЭС проводят под постоянным контролем ЭКГ на экране осциллоскопа,
уровня АД и состояния пациента. ЭКГ регистрируют в конце каждой минуты
исследования. Оценку результатов исследования проводят по тем же принципам, что
и при проведении теста с дозированной физической нагрузкой. Если при 10-минутном
навязывании ритма с частотой 160 сокращений в минуту отсутствуют клинические
и/или электрокардиографические признаки преходящей ишемии миокарда, проба
считается отрицательной.
Чувствительность чреспищеводной электростимуляции сердца в диагностике
ИБС несколько ниже, чем теста с дозированной физической нагрузкой, поскольку
степень увеличения потребности миокарда в кислороде при искусственном
навязывании ритма сердечных сокращений существенно меньше, чем при выполнении
физической нагрузки. Применение метода ЧПЭС в диагностике ИБС показано
в основном в тех случаях, когда проба с дозированной физической нагрузкой не
может быть проведена в связи с заболеваниями опорно-двигательного аппарата,
выраженной сердечной или дыхательной недостаточностью, наличием тромбофлебита
или облитерирующего атеросклероза артерий нижних конечностей, а также
у малотренированных больных, у которых невозможно достижение максимальной или
субмаксимальной ЧСС при выполнении физической нагрузки. ЧПЭС противопоказана при
заболеваниях пищевода, а также при наличии мерцательной аритмии,
атриовентрикулярной блокады II–III степени, блокады левой ножки пучка Гиса
и синдрома WPW.
Длительное мониторирование ЭКГ по Холтеру
В последнее десятилетие в клинической практике получило широкое
распространение длительное мониторирование ЭКГ по Холтеру. Метод применяется в
диагностике преходящих нарушений ритма сердца, выявления ишемических изменений
ЭКГ у больных ИБС, а также для оценки вариабельности сердечного ритма.
Существенным преимуществом метода является возможность длительной (в течение 1–2
суток) регистрации ЭКГ в привычных для пациента условиях.
У большинства больных ИБС метод холтеровского мониторирования ЭКГ позволяет
получить дополнительные подтверждения временной преходящей ишемии миокарда
в виде депрессии или/и элевации сегмента RS–T, часто сопровождающихся
изменениями ЧСС и АД. Важно, что непрерывная запись ЭКГ проводится в условиях
обычной для данного пациента активности. В большинстве случаев это дает
возможность изучить взаимосвязь эпизодов ишемических изменений ЭКГ
с разнообразными клиническими проявлениями болезни, в том числе и атипичными.
Чувствительность и специфичность диагностики ИБС с помощью метода суточного
мониторирования ЭКГ по Холтеру зависят прежде всего от выбранных критериев
ишемических изменений конечной части желудочкового комплекса.
Обычно используются те же объективные критерии преходящей ишемии миокарда,
что и при проведении нагрузочных тестов, а именно: смещение сегмента RS–T ниже
или выше изоэлектрической линии на 1,0 мм и более при условии сохранения этого
смещения на протяжении 80 мс от точки соединения (j). Продолжительность
диагностически значимого ишемического смещения сегмента RS–T должна превышать 1
мин.
Сцинтиграфия миокарда с 201Тl
Сцинтиграфия миокарда - это метод визуализации сердечной мышцы, основанный на
способности интактного или, наоборот, некротизированного миокарда накапливать
некоторые радионуклидные соединения. В клинической практике наиболее широко
применяют два метода сцинтиграфии миокарда: перфузионную сцинтиграфию с 201Тl
и сцинтиграфию с 99mТс. Исследование локальных нарушений перфузии
миокарда. Сцинтиграфия миокарда с 201Тl (таллием) используется для
выявления локальных нарушений коронарного кровотока у больных ИБС. Метод основан
на способности интактного миокарда активно накапливать 201Тl. При
нормальном коронарном кровоснабжении около 85–90% введенного внутривенно таллия
захватывается миокардом. При нарушении коронарного кровотока у больных
ИБС уровень экстракции этого вещества в бассейне стенозированной КА заметно
снижается.
Исследования выполняют в специальном помещении, предназначенном для
проведения радионуклидных исследований и оборудованном сцинтилляционной
гамма-камерой, позволяющей получать изображение сердца в трех стандартных
проекциях: передней прямой, левой передней косой (при повороте больного на 45°)
и левой боковой (поворот на 90°). В каждой из этих проекций в течение 3–5 мин
происходит накопление импульсов гамма-излучения, возникающего при распаде
201Тl, захваченного интактным миокардом. Чем лучше перфузия миокарда, тем
более высокая степень радиоактивности регистрируется на экране компьютера.
Наоборот, при локальном нарушении перфузии миокарда (ишемия, некроз,
постинфарктный рубец) на сцинтиграммах выявляются “холодные очаги” снижения или
отсутствия радиоактивности.
Проведение исследования в трех проекциях позволяет детально изучить перфузию
миокарда в нескольких сегментах ЛЖ: переднесептальном, переднебоковом,
заднедиафрагмальном, верхушечном и косвенно установить локализацию и степень
нарушения кровотока в бассейне той или иной КА. Возможности метода в топической
диагностике нарушений коронарного кровотока у больных ИБС существенно
расширяются при регистрации сцинтиграмм на высоте пробы с дозированной
физической нагрузкой или во время дипиридамолового теста.
Исследование жизнеспособности миокарда. Метод сцинтиграфии с 201Тl
позволяет дифференцировать ишемизированную, но сохранившую жизнеспособность
сердечную мышцу от рубцовой нежизнеспособной ткани. Вначале исследуют
распределение радиофармпрепарата (РФП) на высоте нагрузочного теста. Появление
“холодного очага” в одном из сегментов ЛЖ свидетельствует о сниженной перфузии,
которая может быть обусловлена наличием здесь как преходящей ишемии миокарда,
индуцированной нагрузочным тестом, так и рубцовой тканью. Поскольку
ишемизированная мышца, сохранившая свою жизнеспособность, с течением времени все
же медленно накапливает РФП, на отсроченных сцинтиграммах, зарегистрированных
через 3–4 ч после введения таллия, дефект распределения препарата исчезает.
Рубцовая ткань не может накапливать радиоактивный препарат, и на отсроченных
сцинтиграммах дефект перфузии сохраняется. В некоторых случаях, когда речь идет
о существовании в ЛЖ участков гибернирующего (“спящего”) и/или оглушенного
миокарда, при повторном исследовании через 3–4 ч после введения препарата дефект
распределения может остаться. В этих случаях рекомендуется повторить
исследование через 24 ч. Нормализация распределения таллия на таких поздних
сцинтиграммах указывает на сохранившуюся жизнеспособность сердечной мышцы (гибернирующий
или “оглушенный” миокард). При наличии в сердечной мышце рубцовой ткани
“холодный очаг” продолжает фиксироваться даже через 24 ч от начала исследования.
Позитронная эмиссионная томография
ПЭТ - относительно новый и высокоинформативный неинвазивный метод
исследования метаболизма сердечной мышцы, поглощения кислорода и коронарной
перфузии. Метод основан на регистрации лучевой активности сердца после введения
специальных радиоактивных меток, которые включаются в те или иные обменные
процессы (гликолиз, окислительное фосфорилирование глюкозы, β-окисление жирных
кислот), имитируя “поведение” основных метаболических субстратов (глюкозы,
жирных кислот).
У больных ИБС метод ПЭТ позволяет неинвазивным способом изучать региональный
миокардиальный кровоток, метаболизм глюкозы и жирных кислот, поглощение
кислорода. ПЭТ оказалась незамененимым методом в диагностике жизнеспособности
миокарда. Когда нарушение локальной сократимости ЛЖ (гипокинезия, акинезия)
обусловлено гибернирующим или оглушенным миокардом, сохранившим свою
жизнеспособность, при ПЭТ можно зарегистрировать метаболическую активность
данного участка сердечной мышцы, тогда как при наличии рубца такая активность не
выявляется.
Эхокардиография
С помощью ЭхоКГ диагностируют: нарушения локальной сократимости ЛЖ,
обусловленные снижением перфузии отдельных сегментов ЛЖ во время нагрузочных
тестов (стресс-эхокардиография); жизнеспособность ишемизированного миокарда
(диагностика “гибернирующего” и “оглушенного” миокарда); постинфарктный
(крупноочаговый) кардиосклероз и аневризму ЛЖ (острую и хроническую); наличие
внутрисердечного тромба; наличие систолической и диастолической дисфункции ЛЖ;
признаки застоя в венах большого круга кровообращения и (косвенно) - величину
ЦВД; признаки легочной артериальной гипертензии; компенсаторную гипертрофию
миокарда желудочков; дисфункцию клапанного аппарата (пролабирование митрального
клапана, отрыв хорд и папиллярных мышц); изменение некоторых морфометрических
параметров (толщины стенок желудочков и размеров камер сердца); нарушение
характера кровотока в крупных КА (некоторые современные методики ЭхоКГ).
Получение столь обширной информации возможно только при комплексном
использовании трех основных режимов эхокардиографии: одномерного (М-режима),
двухмерного (В-режима), допплеровского режимов.
Оценка систолической функции ЛЖ. Основными гемодинамическими показателями,
отражающими систолическую функцию ЛЖ, являются ФВ, УО, МО, СИ, а также
конечно-систолический (КСО) и конечно-диастолический (КДО) объемы ЛЖ. Эти
показатели получают при исследовании в двухмерном и допплеровском режимах. Как
было показано выше, наиболее ранним маркером систолической дисфункции ЛЖ
является уменьшение фракции выброса (ФВ) до 40–45% и ниже, которое обычно
сочетается с увеличением КСО и КДО, с дилатацией ЛЖ и его объемной перегрузкой.
ФВ может уменьшаться при гиповолемии (шок, острая кровопотеря), уменьшении
притока крови к правому сердцу, при быстром и резком подъеме уровня АД.
Умеренно выраженная систолическая дисфункция ЛЖ сопровождается снижением ФВ до
40–45% и ниже, увеличением КСО и КДО ( наличием умеренной дилатации ЛЖ)
и сохранением в течение некоторого времени нормальных значений СИ
(2,2–2,7 л/мин/м2). При выраженной систолической дисфункции ЛЖ
происходит дальнейшее падение величины ФВ, еще большее увеличение КДО и КСО
и уменьшение СИ до 2,2 л/мин/м2 и ниже.
Диастолическую функцию ЛЖ оценивают по результатам исследования
трансмитрального диастолического кровотока в импульсном допплеровском режиме.
Определяют: 1) максимальную скорость раннего пика диастолического наполнения (Vmax
Peak Е); 2) максимальную скорость трансмитрального кровотока во время систолы
левого предсердия (Vmax Peak А); 3) площадь под кривой (интеграл
скорости) раннего диастолического наполнения (MV VTI Peak Е) и 4) площадь под
кривой позднего диастолического наполнения (MV VTI Peak А); 5) отношение
максимальных скоростей (или интегралов скорости) раннего и позднего наполнения
(Е/А); 6) время изоволюмического расслабления ЛЖ - IVRT (измеряется при
одновременной регистрации аортального и трансмитрального кровотока в
постоянно-волновом режиме из апикального доступа); 7) время замедления раннего
диастолического наполнения (DT). Наиболее частыми причинами диастолической
дисфункции ЛЖ у больных ИБС со стабильной стенокардией являются:
атеросклеротический (диффузный) и постинфарктный кардиосклероз; хроническая
ишемия миокарда, в том числе “гибернирующий” или “оглушенный” миокард ЛЖ;
компенсаторная гипертрофия миокарда, особенно выраженная у больных с
сопутствующей АГ.
В большинстве случаев наблюдаются признаки диастолической дисфункции ЛЖ по
типу “замедленной релаксации”, для которой свойственно снижение скорости раннего
диастолического наполнения желудочка и перераспределение диастолического
наполнения в пользу предсердного компонента. Значительная часть диастолического
кровотока осуществляется во время активной систолы ЛП. На допплерограммах
трансмитрального кровотока выявляется снижение амплитуды пика Е и увеличение
высоты пика А. Отношение Е/А уменьшается до 1 и ниже. Определяется увеличение
времени изоволюмического расслабления ЛЖ (IVRT) до 90–100 мс и более и времени
замедления раннего диастолического наполнения (DТ) - до 220 мс и более. Более
выраженные изменения диастолической функции ЛЖ (“рестриктивный” тип)
характеризуются значительным ускорением раннего диастолического наполнения
желудочка (Peak Е) при одновременном уменьшении скорости кровотока во время
систолы предсердия (Peak А). В результате отношение Е/А увеличивается до 1,6–1,8
и более. Эти изменения сопровождаются укорочением фазы изоволюмического
расслабления (IVRT) до значений меньше 80 мс и времени замедления раннего
диастолического наполнения (DT) - меньше 150 мс. “Рестриктивный” тип
диастолической дисфункции чаще наблюдается при застойной СН или предшествует ей,
свидетельствуя о повышении давления наполнения и КДД ЛЖ.
Оценка нарушений сократимости ЛЖ
Исследование проводится из верхушечного доступа по длинной оси в проекции
двух- и четырехкамерного сердца, а также из левого парастернального доступа по
длинной и короткой оси. В соответствии с рекомендациями Американской ассоциации
эхокардиографии ЛЖ условно делится на 16 сегментов, располагающихся в плоскости
трех поперечных сечений сердца, зарегистрированных из левого парастернального
доступа по короткой оси. Изображение 6-ти базальных сегментов - переднего (А),
переднеперегородочного (AS), заднеперегородочного (IS), заднего (I),
заднебокового (IL) и переднебокового (AL) - получают при локации на уровне
створок митрального клапана (SAX MV), а средних частей тех же 6-ти сегментов -
на уровне папиллярных мышц (SAX PL). Изображения 4-х верхушечных сегментов -
переднего (А), перегородочного (S), заднего (I) и бокового (L), - получают при
локации из парастернального доступа на уровне верхушки сердца (SAX AP).
Общее представление о локальной сократимости этих сегментов хорошо дополняют
три продольных “среза” ЛЖ, зарегистрированных из парастернального доступа по
длинной оси сердца, а также в верхушечной позиции четырехкамерного
и двухкамерного сердца. В каждом из этих сегментов оценивается характер
и амплитуда движения миокарда, а также степень его систолического утолщения.
Различают 3 вида локальных нарушений сократительной функции ЛЖ, объединяемых
понятием “асинергия”: 1. Акинезия - отсутствие сокращения ограниченной области
сердечной мышцы. 2. Гипокинезия - выраженное локальное уменьшение степени
сокращения. 3. Дискинезия - парадоксальное расширение (выбухание) ограниченного
участка сердечной мышцы во время систолы. Причинами локальных нарушений
сократимости миокарда ЛЖ у больных ИБС являются: острый инфаркт миокарда (ИМ);
постинфарктный кардиосклероз; преходящая болевая и безболевая ишемия миокарда,
в том числе ишемия, индуцированная функциональными нагрузочными тестами;
постоянно действующая ишемия миокарда, еще сохранившего свою жизнеспособность (“гибернирующий
миокард”).
Наиболее выраженные нарушения локальной сократимости миокарда выявляют при
остром ИМ и аневризме ЛЖ. У больных со стабильной стенокардией напряжения,
перенесших в прошлом ИМ, можно выявить эхокардиографические признаки
крупноочагового или мелкоочагового постинфарктного кардиосклероза.
При крупноочаговом и трансмуральном постинфарктном кардиосклерозе двухмерная
и одномерная ЭхоКГ позволяет выявить локальные зоны гипокинезии или акинезии.
Мелкоочаговый кардиосклероз или преходящая ишемия миокарда характеризуются
появлением зон гипокинезии ЛЖ, которые чаще выявляются при переднеперегородочной
локализации ишемического повреждения и реже - при его задней локализации.
Нередко признаки мелкоочагового (интрамурального) постинфарктного кардиосклероза
при эхокардиографическом исследовании не обнаруживаются.
Нарушения локальной сократимости отдельных сегментов ЛЖ у больных ИБС принято
описывать по пятибалльной шкале: 1 балл - нормальная сократимость; 2 балла -
умеренная гипокинезия (незначительное снижение амплитуды систолического движения
и утолщения в исследуемой области); 3 балла - выраженная гипокинезия; 4 балла -
акинезия (отсутствие движения и утолщения миокарда); 5 баллов - дискинезия
(систолическое движение миокарда исследуемого сегмента происходит в направлении,
противоположном нормальному). Для такой оценки, помимо традиционного визуального
контроля, используется покадровый просмотр изображений, записанных на
видеомагнитофоне. Важное прогностическое значение имеет расчет так называемого
индекса локальной сократимости (ИЛС), который представляет собой сумму балльной
оценки сократимости каждого сегмента (SS), деленную на общее число исследованных
сегментов ЛЖ (n): ИЛС = ΣS / n�.
Высокие значения этого показателя у больных ИМ или постинфарктным
кардиосклерозом нередко ассоциируются с повышенным риском летального исхода. При
ЭхоКГ не всегда удается добиться достаточно хорошей визуализации всех 16
сегментов. В этих случаях учитывают только те участки миокарда ЛЖ, которые
хорошо выявляются при двухмерной эхокардиографии. Нередко в клинической практике
ограничиваются оценкой локальной сократимости 6 сегментов ЛЖ: 1) межжелудочковой
перегородки (верхней и нижней ее части); 2) верхушки; 3) переднебазального
сегмента; 4) бокового сегмента; 5) заднедиафрагмального (нижнего) сегмента; 6)
заднебазального сегмента. Стресс-эхокардиография. При хронических формах
ИБС исследование локальной сократимости миокарда ЛЖ в покое далеко не всегда
бывает информативным.
Возможности ультразвукового метода исследования существенно расширяются при
использовании метода стресс-эхокардиографии - регистрации нарушений локальной
сократимости миокарда с помощью двухмерной эхокардиографии во время нагрузки.
Чаще используют динамическую физическую нагрузку (тредмил или велоэргометрия
в сидячем или лежачем положении), пробы с дипиридамолом, добутамином или
чреспищеводную электростимуляцию сердца (ЧПЭС). Способы проведения нагрузочных
тестов и критерии прекращения пробы не отличаются от таковых, используемых при
классической электрокардиографии.
Двухмерные эхокардиограммы регистрируют в горизонтальном положении пациента
до начала исследования и сразу после окончания нагрузки (60–90 с). Для выявления
нарушений локальной сократимости миокарда используют специальные компьютерные
программы, позволяющие оценить степень изменения движения миокарда и его
утолщения во время нагрузки (“стресса”) в 16 предварительно визуализированных
сегментов ЛЖ. Результаты исследования практически не зависят от вида нагрузки,
хотя более удобной является ЧПЭС и дипиридамоловая или добутаминовая пробы,
поскольку все исследования проводятся в горизонтальном положении пациента.
Чувствительность и специфичность стресс-эхокардиографии в диагностике ИБС
достигает 80–90%. Главный недостаток этого метода состоит в том, что результаты
исследования существенно зависят от квалификации специалиста, вручную
устанавливающего границы эндокарда, которые в дальнейшем и используются для
автоматического вычисления локальной сократимости отдельных сегментов.
Определение жизнеспособности миокарда
Эхокардиография, наряду со сцинтиграфией миокарда с 201Т1 и
позитронной эмиссионной томографией, широко используется в последнее время для
диагностики жизнеспособности “гибернирующего” или “оглушенного” миокарда. С этой
целью используют обычно добутаминовый тест. Поскольку даже малые дозы добутамина
обладают выраженным положительным инотропным действием, сократимость
жизнеспособного миокарда возрастает, что сопровождается временным уменьшением
или исчезновением эхокардиографических признаков локальной гипокинезии. Эти
данные являются основанием для диагностики “гибернирующего” или “оглушенного”
миокарда, что имеет важное прогностическое значение в определении показаний
к хирургическому лечению. При более высоких дозах добутамина усугубляются
признаки ишемии миокарда и сократимость вновь падает. Во время добутаминового
теста можно встретиться с двухфазной реакцией сократительного миокарда на
введение положительного инотропного агента.
Коронароангиография
КАГ - это метод рентгенологического исследования коронарных артерий сердца
(КА) с помощью селективного заполнения венечных сосудов контрастным веществом.
Являясь “золотым стандартом” в диагностике ИБС, коронароангиография позволяет
определить характер, локализацию и степень атеросклеротического сужения КА,
протяженность патологического процесса, состояние коллатерального
кровообращения, а также выявить некоторые врожденные пороки развития венечных
сосудов (аномальное отхождение КА или коронарный артериовенозный свищ).
При выполнении КАГ производят левую вентрикулографию. Это исследование дает
возможность оценить важные гемодинамические параметры. Полученные при КАГ данные
необходимы при выборе метода хирургической коррекции обструктивных поражений КА.
В соответствии с рекомендациями Европейской ассоциации кардиологов (2004)
показаниями для проведения плановой КАГ являются уточнение характера, степени
и локализации поражения КА и оценка нарушений сократительной способности ЛЖ
у больных ИБС, подлежащих хирургическому лечению, а также больных с хроническими
формами ИБС (стабильная стенокардия напряжения III–IV ФК) при неэффективности
консервативной антиангинальной терапии; больные стабильной стенокардией
напряжения I–II ФК, перенесшие ИМ; больные с постинфарктной аневризмой
и прогрессирующей, преимущественно левожелудочковой, сердечной недостаточностью;
больные стабильной стенокардией напряжения с блокадой ножек пучка Гиса
в сочетании с признаками ишемии миокарда по данным сцинтиграфии миокарда;
больные ИБС в сочетании с аортальными пороками сердца, требующими хирургической
коррекции; больные с облитерирующим атеросклерозом артерий нижних конечностей,
направляемые на хирургическое лечение; больные ИБС с тяжелыми нарушениями ритма
сердца, требующими уточнения генеза и хирургической коррекции.
В ряде случаев плановая КАГ показана для верификации диагноза ИБС у больных
с болями в области сердца и некоторыми другими симптомами, генез которых не
удалось установить с помощью неинвазивных методов исследования, включая ЭКГ в 12
отведениях, функциональные нагрузочные пробы, суточное мониторирование ЭКГ по
Холтеру Однако в этих случаях врач, направляющий такого пациента
в специализированное учреждение для проведения КАГ, должен быть особенно
осторожен и учитывать многие факторы, определяющие целесообразность этого
исследования и риск его осложнений.
Проведение КАГ противопоказано при наличии лихорадки; тяжелых заболеваниях
паренхиматозных органов; выраженной тотальной (лево- и правожелудочковой)
сердечной недостаточности; острых нарушениях мозгового кровообращения; тяжелых
нарушениях желудочкового ритма. Методика исследования. Используют главным
образом две методики КАГ. Наиболее часто применяется методика Джадкинса, при
которой специальный катетер вводят путем чрескожной пункции в бедренную артерию,
а затем ретроградно в аорту. В устье правой и левой КА вводят по 5–10 мл
рентгеноконтрастного вещества и в нескольких проекциях осуществляют
рентгеновскую кино- или видеосъемку, позволяющую получить динамические
изображения коронарного русла. В тех случаях, когда у пациента имеется окклюзия
обеих бедренных артерий, используют методику Соунса, при которой катетер вводят
в обнаженную плечевую артерию. К числу тяжелых осложнений, которые могут
возникнуть при проведении КАГ, относятся: нарушения ритма, в том числе
желудочковая тахикардия и фибрилляция желудочков, развитие острого ИМ, внезапная
смерть.
Интерпретация результатов
При анализе коронарограмм оценивают несколько признаков, достаточно полно
характеризующих изменения коронарного русла при ИБС: 1. Анатомический тип
кровоснабжения сердца: правый, левый, сбалансированный (равномерный). 2.
Локализация поражений: а) ствол ЛКА; б) ПМЖВ ЛКА; в) ОВ ЛКА; г) передняя
диагональная ветвь ЛКА; д) ПКА; е) краевая ветвь ПКА и другие ветви КА. 3.
Распространенность поражения: а) локализованная форма (в проксимальной, средней
или дистальной трети КА); б) диффузное поражение. 4. Степень сужения просвета:
а. I степень - на 50%; б. II степень - от 50 до 75%; в. III степень - более 75%;
г. IV степень - окклюзия КА. Левый анатомический тип характеризуется
преобладанием кровоснабжения за счет ЛКА. Последняя участвует в васкуляризации
всего ЛП и ЛЖ, всей МЖП, задней стенки ПП, большей части задней стенки ПЖ
и части передней стенки ПЖ, прилежащей к МЖП. ПКА кровоснабжает при этом типе
только часть передней стенки ПЖ, переднюю и боковую стенки ПП.
При правом типе большая часть сердца (все ПП, большая часть передней и вся
задняя стенка ПЖ, задние 2/3 МЖП, задняя стенка ЛЖ и ЛП, верхушка сердца)
кровоснабжается за счет ПКА и ее ветвей. ЛКА при этом типе кровоснабжает
переднюю и боковую стенки ЛЖ, переднюю треть МЖП, переднюю и боковую стенки ЛП.
Чаще (примерно в 80–85% случаев) встречаются различные варианты
сбалансированного (равномерного) типа кровоснабжения сердца, при котором ЛКА кровоснабжает
все ЛП, переднюю, боковую и большую часть задней стенки ЛЖ, передние 2/3 МЖП
и небольшую часть передней стенки ПЖ, прилегающую к МЖП. ПКА участвует в васкуляризации
всего ПП, большей части передней и всей задней стенки ПЖ, задней трети МЖП
и небольшой части задней стенки ЛЖ. Во время проведения селективной КАГ
контрастное вещество последовательно вводится в ПКА и в ЛКА, что позволяет
получить картину коронарного кровоснабжения раздельно для бассейнов ПКА и ЛКА.
У больных ИБС по данным КАГ наиболее часто выявляется атеросклеротическое
сужение 2–3-х КА - ПМЖВ, ОВ и ПКА. Поражение этих сосудов имеет очень важное
диагностическое и прогностическое значение, поскольку сопровождается
возникновением ишемических повреждений значительных участков миокарда.
Степень сужения КА также имеет важное прогностическое значение.
Гемодинамически значимым считают сужение просвета венечных артерий на 70%
и больше. Стеноз КА до 50% расценивается как гемодинамически незначимый.
Клинические проявления ИБС зависят не только от степени сужения КА, но и от
других факторов: от степени развития коллатерального кровотока, состояния
системы гемостаза, вегетативной регуляции сосудистого тонуса, склонности
к спазму венечных артерий. Даже при относительно малом сужении КА или при его
отсутствии (по данным КАГ) при определенных обстоятельствах может развиться
обширный острый ИМ. С другой стороны, нередки случаи, когда при хорошо развитой
сети коллатеральных сосудов даже полная окклюзия одной КА длительное время может
не сопровождаться возникновением ИМ. Обычно при значительном и распространенном
поражении КА и длительном течении ИБС при КАГ выявляется хорошо развитая сеть
коллатералей, тогда как у больных с “коротким” ишемическим анамнезом и стенозом
одной КА коллатеральное кровообращение выражено хуже. Последнее обстоятельство
имеет особое значение в случаях внезапного тромбоза, сопровождающегося
возникновением распространенного и трансмурального некроза сердечной мышцы у
молодых больных ИБС.
Влияние обширности поражения коронарных артерий на внутрисосудистую активность тромбоцитов
В Самарском клиническом кардиологическом диспансере проведено обследование 89
больных ИБС (стенокардия напряжения 2, 3 функциональных классов), которым была
выполнена КАГ для оценки распространенности атеросклеротического поражения
коронарных артерий.
В соответствии с количеством пораженных сосудов каждому рассматриваемому
случаю был присвоен соответствующий код: 0 – неизмененные коронарные сосуды; 1 –
поражение одной коронарной артерии; 2 – поражение двух коронарных артерий; 3 –
поражение трех и более коронарных артерий. В качестве объекта исследования были
приняты результаты лабораторного обследования больных.
Результаты дисперсионного анализа по гемостазиологическим параметрам
представлены в таблице 17. Распространенность поражения коронарных сосудов
оказывает высоко достоверное влияние на все изученные гемостазиологические
показатели. Вклад дополнительного риска при множественном поражении сосудов
наиболее выражен по отношению к CRP (84,9%), ТВ (72,1%),
ФГ (68,6%), ПТИ (68,3%), АЧТВ (66,3%), общему количеству Тр (59,9%), Д (58,6%),
ТрА (57,6%), числу МА (55,5%) и АФ (53,2%) при р < 0,001.
Размахи дисперсий некоторых из параметров гемостазиограммы (АФ, ФГ)
представлены на рисунках 3 и 4. Эти переменные наглядно представляют результаты
проведенного дисперсионного анализа. Зависимость дисперсии активных форм
тромбоцитов (АФ) от количества пораженных коронарных сосудов характеризовалось
значительной вариабельностью при вовлечении в атеросклеротический процесс одного
или двух сосудов (рисунок ). Отсутствие поражения или его множественность
характеризовались малой степенью разброса.
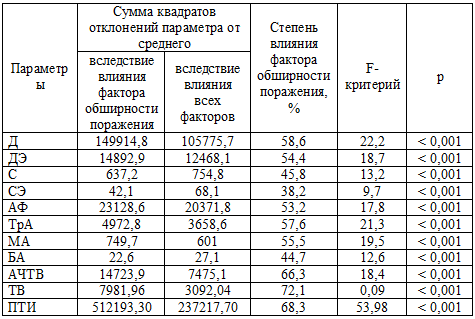
Таблица 17. Влияние фактора обширности поражения коронарных артерий на гемостазиологические параметры
Примечание: критическое значение t-критерия Стьюдента принято равным 1,96; Тр
– тромбоциты, Д - дискоциты, ДЭ - дискоэхиноциты, С - сероциты, СЭ -
сероэхиноциты, АФ – активные формы тромбоциты, ТрА – тромбоциты в агрегатах, МА
- малые агрегаты, БА – большие агрегаты.
Аналогичная картина отмечалась при анализе других параметров внутрисосудистой
активности тромбоцитов. В то же время вовлечение в процесс одной или двух
коронарных артерий сопровождается большой вариативностью изучаемых показателей
функциональной активности, что свидетельствовало о их значительных колебаниях
при таких объемах поражения.
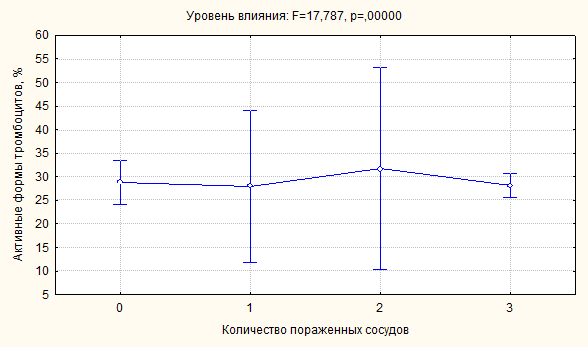
Рисунок 3. Влияние фактора распространенности поражения коронарных артерий на
дисперсию активных форм тромбоцитов.
Влияние фактора распространенности поражения коронарных артерий на дисперсию
ФГ характеризуется другой динамикой его дисперсии (рисунок 4).
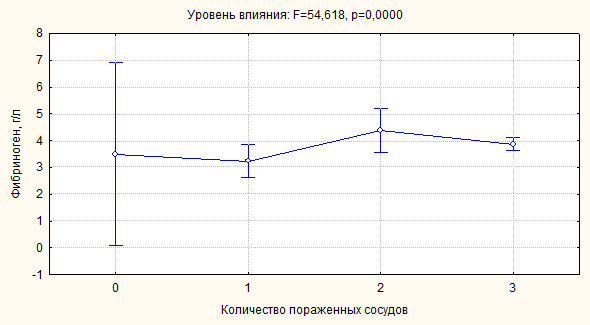
Рисунок 4. Влияние фактора распространенности поражения коронарных артерий на
дисперсию фибриногена
При отсутствии поражения коронарных сосудов дисперсия выражена значительно,
однако по мере распространения патологического процесса она уменьшалась. При
множественном сосудистом поражении достигала минимальных значений. Аналогичная
динамика дисперсий отмечена также для таких параметров, как ПТИ,
CRP. Указанные изменения свидетельствовали о наличии устойчивых
механизмов формирования нарушений со стороны свертывающей системы крови при
распространенном атеросклеротическом поражении коронарных сосудов.
Результаты влияния изучаемого фактора на гематологические показатели
представлены в таблице 18. Распространенность поражения коронарного сосудистого
русла оказывало наиболее выраженное влияние на распределение тромбоцитов по
объему PDW (66%), средний объем тромбоцита MPV (66%), тромбоцитокрит PCT (62%),
среднюю концентрацию гемоглобина в эритроците - MCHC (58%), среднее содержание
гемоглобина в отдельном эритроците - МСН (58%), показатель анизоцитоза
эритроцитов - RDW (57%).
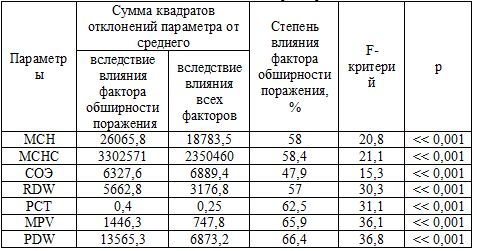
Таблица 18. Влияние фактора обширности поражения коронарных артерий на гематологические параметры
Примечание: PDW - распределение тромбоцитов по объему, MPV - средний объем
тромбоцита, PCT - тромбоцитокрит, MCHC - средняя концентрация гемоглобина в
эритроците, МСН - среднее содержание гемоглобина в отдельном эритроците, RDW -
показатель анизоцитоза эритроцитов.
Показатели, отражающие объемные характеристики тромбоцитов, показали
наибольшую зависимость от фактора обширности поражения коронарных артерий. Эти
изменения характеризовали патогенетическую связь тромбоцитарного звена системы
гемостаза и атеросклеротического процесса. Значительное влияние
распространенности атеросклеротического процесса оказывало влияние на
морфологическое и функциональное состояние эритроцитов. Анализ динамики
дисперсий гематологических показателей при различной распространенности
поражения коронарных сосудов выявил их полное сходство между собой. В качестве
примера мы приводим график влияния фактора распространенности поражения
коронарных артерий на дисперсию показателя MPV,
характеризующего средний объем тромбоцитов (рисунок 5).
Значительный разброс дисперсии отмечался при изолированном поражении одной
коронарной артерии, другие варианты характеризовались очень плотным
распределением значений вокруг среднего. Такая же зависимость отмечена у PDW и
PCT, то есть у тех показателей, которые характеризуют гетерогенность популяции
тромбоцитов по размеру.
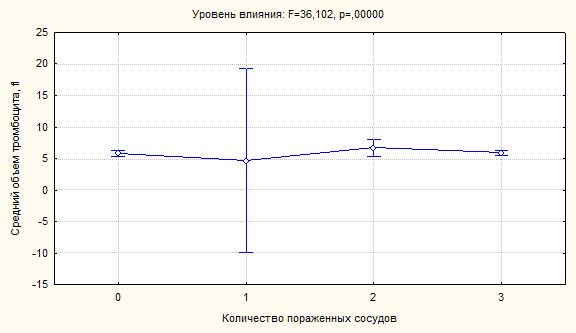
Рисунок 5. Влияние фактора распространенности поражения коронарных артерий на
дисперсию распределения тромбоцитов по объему.
По результатам анализа можно судить о существовании устойчивых
закономерностей, приводящих по мере прогрессирования атеросклеротического
процесса к изменениям морфологических, функциональных характеристик тромбоцитов.
Величина аддитивного риска при воздействии изучаемого фактора по отношению к
показателям липидного спектра представлена в таблице 19.
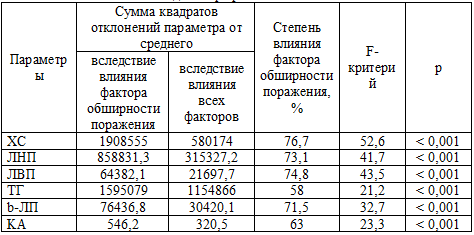
Таблица 19. Влияние факторов обширности поражения коронарных артерий на липидный профиль больных ИБС
Примечание: ХС – общий холестерин, ЛНП – липопротеиды низкой плотности, ЛВП –
липопротеиды высокой плотности, ТГ – триглицериды, b-ЛП –
бетталипопротеиды, КА - коронарные артерии.
Из представленных в таблице 18 результатов следует, что все показатели,
характеризующие липидный профиль у больных ИБС, подвержены воздействию фактора
обширности поражения коронарных сосудов, причем уровень этого влияния
значительно выражен – он превышает 50% для всех переменных при высоком уровне
достоверности (р < 0,001).
Для демонстрации выявленных закономерностей представлены графические
изображения для двух показателей липидного спектра – ЛВП и ТГ (рисунок 6, 7).
Определяется разнонаправленная динамика их средних значений по мере
прогрессирования атеросклеротического процесса, снижение дисперсий вышеназванных
параметров липидного профиля при увеличении числа пораженных сосудов.
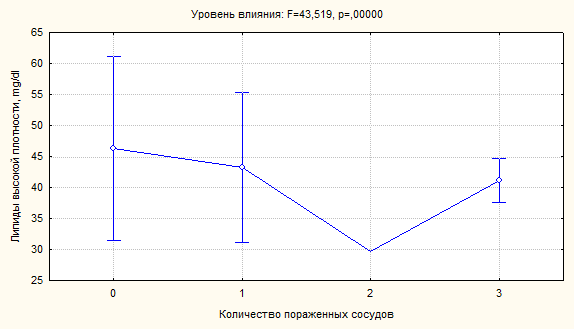
Рисунок 6. Влияние фактора распространенности поражения коронарных артерий на
дисперсию ЛВП.
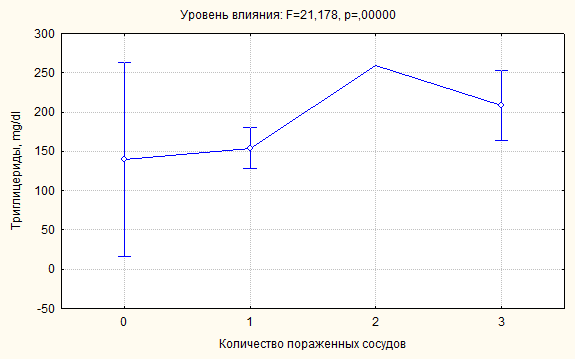
Рисунок 7. Влияние фактора распространенности поражения коронарных артерий на
дисперсию триглицеридов.
Таким образом, по данным исследования выявлена значительное влияние фактора
множественности поражения коронарных артерий на большинство гемостазиологических,
гематологических, липидных показателей у больных стабильной стенокардией 2, 3 ФК.
Селективная ангиокардиография ЛЖ
Является частью протокола инвазивного исследования больных ИБС, направляемых
на операцию реваскуляризации миокарда. Она дополняет результаты КАГ и позволяет
провести количественную оценку органических и функциональных нарушений ЛЖ. С
помощью левой вентрикулографии можно: обнаружить региональные нарушения функции
ЛЖ в виде локальных ограниченных участков акинезии, гипокинезии и дискинезии;
диагностировать аневризму ЛЖ и оценить ее локализацию и размеры; выявить
внутриполостные образования (пристеночные тромбы и опухоли); объективно оценить
систолическую функцию ЛЖ на основании инвазивного определения важнейших
гемодинамических показателей (ФВ, КСО, КДО, УО, МО, СИ, УИ, среднюю скорость
кругового укорочения волокон); оценить состояние клапанного аппарата сердца, в
том числе врожденные и приобретенные патологические изменения аортального и
митрального клапанов, которые могут повлиять на результаты хирургической
реваскуляризации миокарда.

