Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
6.3. Анализ некоторых результатов практического применения
антимикробных препаратов
Возможность того, что при проведении фармакотерапии лекарственные средства
могут проявлять отрицательные побочные эффекты, начала вызвать беспокойство у
врачей еще в конце XIX века. В 30 годах прошлого столетия США первыми из стран
мира вносят в Федеральное законодательство поправки, с целью обеспечения
гарантии безопасности ЛС. Однако, только 1961 г. стал переломным в этом
направлении — талидомидовая трагедия, выявление развития «грей-синдрома» у детей
при применении хлорамфеникола, запрет применения диэтилстильбестрола и др.
заставляют мировую медицинскую общественность и правительственные учреждения
сосредоточить внимание на мероприятиях, которые бы надежно обеспечивали
безопасность пациентов при применении препаратов. Но наряду с этими «громкими
скандалами» специалистами было выявлено немало других последствий
фармакотерапии, которые не вызывали широкого резонанса, но отрицательно влияли
на состояние здоровья пациентов.
С тех пор сделано многое для выявления риска, связанного с применением
лекарственных средств, и проведения мероприятий для его минимизации. Так, за
последние 40 лет с фармацевтического рынка по причинам, связанным с
недостаточной безопасностью, было изъято более 130 ЛС. Треть этих изъятий
происходила в пределах 2 лет, а половина – в пределах 5 лет маркетинга. Однако,
несмотря на глобальное внедрение систем наблюдения за фармакологической
безопасностью, неблагоприятные побочные реакции все еще остаются одной из
основных причин заболеваемости и смертности во всем мире. По данным, полученным
в 1994 г., неблагоприятные побочные реакции послужили причиной более 100 тыс.
летальных исходов, став четвертой по значимости причиной смертности в США.
Следовательно, необходимость глобального внедрения надежных и правильных систем
наблюдения за фармакологической безопасностью сегодня столь же важна, как и
раньше.
Большинство экспертных заключение по фармакотерапии, так или иначе, связано с
методологией постмаркетинговых наблюдений, которые были разработаны в
Великобритании, подверглись пересмотру в 1993 г. и были включены в IX том
правил, регулирующих обращение ЛС, предназначенных к применению у человека и
животных. Это руководство применяется к исследованиям, которые полностью или
частично спонсируются фармацевтической промышленностью и оценивают безопасность
препаратов, уже прошедших регистрацию. К постмаркетинговым исследованиям (или IV
фазе клинических испытаний) относят ряд мероприятий, включающий спонтанные
сообщения о подозреваемых неблагоприятных побочных реакциях (например, Схема
желтой карты (Yellow Card Scheme) в Великобритании), фармакоэпидемиологические
исследования (например, по типу случай–контроль и когортные) и мониторинг
нежелательных явлений.
Подобного рода исследования целесообразны в следующих ситуациях:
- препарат с новой химической структурой или новым механизмом действия;
- неопределенность относительно клинической значимости токсического эффекта,
выявленного у животных;
- наличие нерешенных аспектов профиля безопасности;
- необходимость лучшей категоризации НПР, обнаруженных в клинических
исследованиях, и уточнения факторов риска;
- высокоспецифичная область применения, что требует контроля со стороны
специалистов.
Такие исследования могут иметь разный дизайн, включая обсервационное
когортное исследование или исследование по типу случай–контроль. В
пострегистрационных исследованиях безопасности можно проверять конкретные
гипотезы, оценивать риск или проводить активное наблюдение в повседневных
условиях применения ЛС. Наблюдение следует проводить в соответствии с самыми
высокими этическими и профессиональными стандартами.
Наиболее удобным методом постмаркетинговой регистрации НПР является система
спонтанных сообщений. Метод спонтанных сообщений о непредвиденных побочных
реакциях является основным в работе служб фармаконадзора во всех странах мира.
Согласно требованиям служб фармаконадзора следует сообщать:
о всех нежелательных эффектах новых препаратов (в большинстве стран ЛС
считаются новыми в течение 5 лет после их регистрации);
о неизвестных и неожиданных эффектах «старых» препаратов;
о серьезных нежелательных побочных реакциях любых препаратов.
Основным недостатком спонтанной системы сообщений является, как это ни
парадоксально, то что работники сферы здравоохранения, сообщают далеко не обо
всех НПР. Даже в странах с хорошо отлаженной системой фармаконадзора (Австралия,
Новая Зеландия, Великобритания, Швеция, Канада) сообщается не более чем о 10 %
НПР от числа выявляемых. Причинами этого являются недостаток времени, плохое
знание системы и, особенно, трудности в установлении причинной связи между
реакцией и приемом ЛС. Что же относительно формирования аналога в системе
здравоохранения Дальнего Востока России, то этот «проект» находится в самом
начале своего пути.
Некоторые результаты экспертизы применения АМП. Вполне естественно,
что концентрация экспертов только на фиксации непредвиденных побочных реакций,
проблем безопасности качества медицинской помощи не решить. Ведь параллельно
существует целый пласт проблем связанный с недостатком знаний у медицинских
работников по клинической фармакологии и фармакотерапии, отсутствие у части из
них мотиваций к бездефектному труду, неэффективная система оплаты труда
медицинского персонала ЛПУ не ориентированная на конечный результат и многое
другое. Именно эти проблемы в конечном итоге могут привести к врачебной ошибке,
несчастному случаю и врачебному преступлению.
Поскольку в области медицинских и фармацевтических услуг ЛПУ (врачи,
провизоры и фармацевты) занимают доминирующее положение, вплоть до того, что они
диктуют «потребителю», какие ЛС и какие услуги покупать. Это объясняется с одной
стороны тем, что для правильных действий в области медицинского и
фармацевтического рынка нужны специальные знания, одних потребительских
ценностей недостаточно. С другой стороны – многие решения пациента принимаются в
состоянии крайней нужды, когда нет возможности подумать, собрать дополнительную
информацию, подождать. Действовать необходимо быстро и тогда, когда воля и
сознание «потребителя» сужены страданием. Потребителю в такой ситуации даже в
голову прийти не может, что врач тоже человек, которому свойственно ошибаться.
Таким образом, конечный результат медицинской помощи зачастую зависит от
пресловутого «человеческого фактора».
Выработка тактики лечебных мероприятий при инфекционной патологии — это
процесс, основанный на анализе выбранной методики применения АМП и оценке
вероятных последствий ее применения. Безусловно, практически невозможно
просчитать все варианты, но выбрать несколько соответствующих конкретному
заболеванию у конкретного пациента с учетом его индивидуальных особенностей,
задача реально выполнимая. Масса тактических ошибок применения АМП совершается в
ситуациях, которые при ретроспективном анализе не выглядят безвыходными. Как
правило, не учитывается исходное состояние здоровья пациента, возрастные
особенности, технические возможности врача или категория ЛПУ.
В реальной ситуации рекомендации врача должны быть основаны на оценочной
вероятности того или иного исхода и реальных последствиях предполагаемого
лечения. Врач должен показывать свое рациональное отношение к риску и не
подвергаться эмоциям, т. е. он должен в количественном отношении оценить разные
методы лечения АМП, вычислить вероятность их эффекта у конкретного пациента и
выбрать максимально эффективный. В некоторых случаях и врач, и пациент
нерационально относятся к риску. Так, врач-терапевт настороженно относится к
оперативным методам лечения, а пациент, ознакомленный с минимальной вероятностью
смерти на операционном столе в результате изучения анестезиологического пособия,
выберет консервативные методы лечения. Выбор обусловлен психологическими
причинами, врач-терапевт и пациент в такой ситуации предпочтут медикаментозную
терапию, поскольку она легче поддается контролю и не грозит, пусть редкими, но
очень серьезными последствиями. Такой подход может стать источником тактических
ошибок.
Существуют и другие ситуации, когда при быстром ухудшении состояния пациента
проводимое лечение не приносит ожидаемого результата, а врач приобретает
склонность к принятию рискованных решений, часто под давлением пациента и
родственников. Профессиональные нормы, мнения коллег, традиции ЛПУ способны, в
определенной мере, ослабить частоту принятия тактически необоснованных решений,
но иногда они становятся источником ошибок.
Если врачом тактика применения АМП выбрана, согласована с пациентом или его
доверенным лицом, результат просчитан, то каковы все же шансы на успех?
Вероятность успеха тем выше, чем выше профессиональный уровень выполнения
выбранной тактики лечебных мероприятий.
Следует рассмотреть следующий этап организации и осуществления лечения — этап
лечебных мероприятий, который зависит от нескольких составляющих:
- скрупулезного выполнения пациентом назначений врача;
- изменения образа жизни и привычек пациента;
- выполнения медицинским персоналом стандартов оказания медицинской помощи
при данной патологии;
- соблюдения медицинским персоналом мер безопасности при проведении лечебных
мероприятий.
В процессе проведения фармакоэпидемиологических исследований фармакотерапии
антибактериальными препаратами различных групп населения Дальнего Востока
вопросы экспертизы качества и безопасности применения АМП вышли на одно из
первых мест в ряду приоритетов. Органами управления здравоохранением региона все
чаще признается факт, что в определенных ситуациях при относительной
невозможности использования строгих математических методов при оценке качества
оказания медицинской помощи следует полагаться на суждения
специалистов-экспертов при условии, что суждения эти получены с помощью
специально разработанных процедур. Применение экспертных методов помогает
систематизировать процедуры сбора и анализа суждений специалистов, привести их к
виду, наиболее пригодному для принятия обоснованных управленческих решений.
В течение последнего десятилетия у некоторых клинических фармакологов региона
появился, пока еще в чем-то ограниченный, опыт экспертизы применения различных
групп лекарственных препаратов с позиции доступности, качества и безопасности.
Тем не менее, именно этот опыт позволяет надеяться на изменение ситуации,
поскольку управляющие структуры стали получать более достоверную информацию об
уровне доступности, качества и безопасности ЛС для населения региона. Эта
информация отражает реальную действительность и может стать основой для принятия
позитивных управленческих решений.
С целью расширения объема информации о доступности, качестве и безопасности
применении АМП в ЛПУ Дальневосточного региона, нами проведены значительные
объемы экспертиз применения АМП в стационарных и амбулаторно-поликлинических
медицинских учреждениях. Всего методом случайной выборки в течение 2005-2009 гг.
проведен анализ 4303 экземпляров медицинских документов, где фиксировались
данные о применении антибактериальных препаратов. Всего проанализировано 726
медицинских карт стационарного больного (форма № 003/у) и 3577 медицинских карт
амбулаторного больного (форма № 025/у). При необходимости экспертной оценке
подвергались иные медицинские документы, а именно: выписки из медицинских карт
амбулаторного и стационарного больного, операционные журналы, протоколы
патологоанатомического исследования, карты реанимационного больного, результаты
бактериологических исследований биологических сред больных, инструментов,
аппаратов и др.
В структуре видов экспертиз преобладали экспертные случаи соответствия
оказанной медицинской помощи медицинским рекомендациям и стандартам
фармакотерапии АМП. Значительно меньше случаев экспертиз (как правило,
комиссионных) проводилось для установления факта и степени причинения вреда
здоровью пациента. Этот вид экспертизы проводился по случаям летальных исходов,
жалобам и заявлениям пациентов или родственников. Меньший удельный вес в
структуре занимали комплексные экспертизы качества медицинской помощи, которые
проводились чаще всего в связи с летальными исходами или внутрибольничными
инфекциями.
Вышерассмотренные примеры неадекватной лекарственной терапии могут оказывать
негативное влияние на течение и исходы основного заболевания, степень тяжести
нежелательных побочных реакций и на финансовые затраты при оказании медицинской
помощи.
В то же время сухая констатация фактов нерациональной фармакотерапии в ЛПУ не
всегда будет воспринята адекватно врачами-клиницистами. Для них, как и для
администраторов ЛПУ, требуется формирование шкалы оценок достигнутых результатов
и методы их измерения, тогда проведенная фармакотерапия может быть сопоставлена
с исходами лечения пациента. Поэтому для унификации подходов к оценке оказания
медицинской помощи с учетом имеющихся тактических дефектов, необходимо провести
ранжирование результатов лекарственной терапии, в зависимости от степени их
значимости. Мы использовали деление на пять категорий (табл. 6.2).
Анализ экспертных заключений позволил разделить их на две большие группы.
Первая группа включала в себя случаи, где не было выявлено грубых отклонений
от стандартов применения АМП и в большинстве случаев планируемые результаты
оказания медицинской помощи в конечном итоге были достигнуты (n=2811)
– 0,1,2 и 3 категории.
Вторая группа включала в себя случаи, когда, как правило, было выявлено
отклонение от стандартов применения АМП и в большинстве случаев планируемые
результаты не были достигнуты, т.е. результаты лечения были отнесены в область
нежелательных исходов лечения.(n=1492) – 4 категория.
Таблица 6.2. Категории результатов лекарственной терапии
| Категория |
Критерии оценки результатов лекарственная терапия |
| 0 |
замечаний нет |
| 1 |
использованные медикаменты привели к положительной
динамике заболевания без осложнений от фармакотерапии, но проводимая
фармакотерапия гипотетически могла негативно повлиять на дальнейшее
течение заболеваний; |
| 2 |
применявшиеся лекарственные препараты привели к
удорожанию стоимости лечения, без отрицательного влияния на состояние
пациента; |
| 3 |
использованные медикаменты не вызвали осложнений, но не
привели к положительной динамике состояния пациента, что послужило
причиной их отмены и назначения иных препаратов для лечения основного
заболевания; |
| 4 |
использованные препараты по любым причинам не только не
улучшили, но и ухудшили состояние пациента, что привело к их отмене,
дополнительным расходам на коррекцию их отрицательного эффекта и
назначению новых медикаментов для лечения основного заболевания или
купирования нежелательных побочных реакций. |
Экспертные заключения, где были выявлены отклонения от стандартов
фармакотерапии АМП, которые сопровождались расстройствами здоровья (53,07% от
всех случаев фармакотерапии АМП, подвергнутых экспертизе) отнесены к четвертой
категории результатов лекарственной терапии. Эти экспертные заключения были
распределены на три основные группы: летальные исходы, временные расстройства
здоровья, стойкие расстройства здоровья. Анализ причин нежелательных результатов
показывает, что на уровень качества фармакотерапии АМП оказывали влияние многие
причины. По нашему мнению их следует разделить на две группы: комплекс причин
общего характера и комплекс причин ненадлежащего применения антибактериальных
препаратов.
Причины нежелательных результатов применения АМП общего характера. В
комплекс причин общего характера вошли дефекты структуры основных
производственных фондов и дефицит ресурсного обеспечения ЛПУ. Основными
структурными дефектами, оказавшими влияние на формирование нежелательных
результатов фармакотерапии АМП, были несоответствие основных фондов
значительного числа ЛПУ региона федеральным стандартам – СНиП и СанПин. Это, в
свою очередь, блокировало внедрение выполнения технологических стандартов
оказания медицинской помощи и службы инфекционного контроля (организация
эффективной дезинфекции предметов медицинского назначения, работа системы
вентиляции, организация работы оперблоков, боксирование палат стационарных
отделений для лечения респираторных инфекций, функционирование «фильтров» в
детских поликлиниках и т.п.). Структурными дефектами также являлись: отсутствие
специалистов необходимой квалификации или их недостаточная подготовка по
программам инфекционного контроля и применения АМП, недостаток средств на
обеспечение стандартного уровня оказания медицинской помощи, недостаток АМП и
прочих лекарственных средств, расходных материалов и медицинского оборудования и
т.п.
К дефектам общего характера мы отнесли не решаемые годами проблемы
организационных и медицинских технологий, оказавшими влияние на формирование
нежелательных результатов лечения больных. Это отклонения от стандартов
организации наблюдения за пациентами из групп повышенного риска в амбулаторных
условиях, от стандартов в организации медицинской помощи в стационарах, которые
не требовали дополнительных финансовых затрат. Отклонения от стандартов
медицинских технологий чаще всего приходились на различные виды диагностики
инфекционной патологии в амбулаторно-поликлинических учреждения и учреждениях
СМП, а также на организацию неотложной и реанимационной помощи в хирургических
стационарах. В частности, отклонением от стандартов и причиной нежелательных
результатов лечения были: поздняя диагностика тяжелых проявлений инфекционных
поражения верхних и нижних дыхательных путей у детей первых пяти лет жизни,
осложнения острых респираторных вирусных инфекций, внебольничных пневмоний, ХОБЛ,
внутрибольничного инфицирования выздоравливающих пациентов и т.п.
Имеется достаточное число экспертных заключений, где основной причиной
нежелательных результатов называются врачебные ошибки. Причем последние, как
правило, носят признаки дефектов общего характера и были связанные с поздним
направлением на банальное лабораторное и рентгеновское обследование,
консультацию «узких» специалистов, недооценку тяжести состояния и
транспортировку больных в учреждения более высокого уровня в тех случаях, когда
риск осложнений транспортировки был очень велик, и т.п.
Комплекс причин ненадлежащего применения антибактериальных препаратов.
Безусловно, в идеале для проведения рациональной антибактериальной терапии
необходимо выявление этиологического агента инфекции и определение его
чувствительности, на практике же даже самый современный микробиологический метод
не в состоянии дать врачу быстрый ответ. В этом случае на помощь приходят знания
о наиболее вероятных этиологических агентах конкретных нозологических форм
инфекционных болезней, спектре естественной активности АМП и уровне
приобретенной резистентности в данном регионе, как в амбулаторных условиях, так
и в стационарах. Однако, во многих случаях фармакотерапия АМП не носит признаков
рациональности и тогда её следует расценивать как причину ненадлежащего
применения антибактериальных препаратов в виде дефектов тактического и
стратегического характера.
К стратегическим дефектам мы отнесли планирование антибактериальной
терапии без учета региональных тенденций резистентности возбудителей. В связи с
тем, что проблемы стратегического характера будут рассмотрены в 6 главе
посвященной резистентности, то дальнейший анализ дефектов тактического характера
мы рассмотрим в рамках анализа причин нежелательных результатов фармакотерапии
АМП.
К тактическим дефектам отнесены следующие: использование АМП без
показаний; назначение неэффективных и небезопасных АМП, недостатки дозирования
эффективных АМП и их использование в течение неверного временного периода;
проявления полипрагмазии и назначение АМП без учета их взаимодействия с другими
ЛС или между собой; несоблюдение стандартов лечения инфекционной патологии и
необоснованный выбор пути введения АМП (табл. 6.3).
Тактические дефекты формируются в условиях, когда лечащий врач уклоняется от
исполнения принципов адекватного применения АМП или знает их нетвердо, а они
достаточно просты для понимания. Это, прежде всего излечение пациента (как
клиническое, так и микробиологическое), а так же недопущение формирования или
всемерное ограничение возникновения резистентности микроорганизмов в процессе
лечения и предупреждение распространения резистентных штаммов в лечебных
учреждениях и за их пределами.
Эти тактические принципы в более широкой интерпретации подразумевают:
назначение АМП при инфекциях бактериальной этиологии;
своевременное начало антибактериальной терапии;
выбор антибиотиков, активных в отношении предполагаемых или установленных
возбудителей заболевания;
назначение препаратов с доказанной клинической эффективностью при
инфекциях данной локализации;
учет локальных и региональных данных о резистентности возбудителей;
адекватное дозирование;
оптимальная длительность курса антибактериальной терапии;
оптимальное соотношение стоимость/эффективность;
использование ресурсосберегающих технологий;
предварительную оценку стартовой антибактериальной терапии через 48-72 ч
от начала лечения.
Таблица 6.3. Анализ причин нежелательных результатов
лечения АМП по данным экспертных заключений (на 100 случаев экспертизы
фармакотерапии АМП)
Воплощение тактических принципов фармакотерапии респираторных инфекций
требует обязательного учета особенностей пациента, заболевания, возбудителей и
АМП. Из особенностей пациента ключевое значение придается возрасту, массе и
площади поверхности тела, наличию беременности и/или лактации, иммунодефицитам,
нейтропении, сопутствующим заболеваниям, особенностям личности и поведенческим
стереотипам. Среди других факторов следует принимать в расчет условия
возникновения, локализацию, клинические проявления, тяжесть, течение
заболевания, уровень биотрансформации ксенобиотиков, путь введения и
лекарственную форму АМП, его безопасность, доступность, изменение активности в
зависимости от pH, возможность межлекарственных взаимодействий.
Прежде чем рассматривать анализ экспертных заключений следует указать на то,
что в большинстве случаев нами были выявлены сочетанные дефекты, когда,
например, недостаточная дозировка эффективных АМП сочеталась с их назначением
без учета взаимодействия с другими ЛС или между собой и несоблюдением стандартов
лечения, что в конечном итоге приводило к печальным исходам. Конечно, таких
случаев было относительно немного и, как правило, параллельно выявлялись дефекты
структуры ЛПУ и ошибки диагностики, однако неблагоприятный исход в целом
предопределяла фармакотерапия АМП. Безусловно, наблюдались и другие сочетания
дефектов в рамках оказания медицинской помощи одному и тому же пациенту. Для
уточнения частоты встречаемости причин неблагоприятных исходов фармакотерапии
АМП следует рассмотреть каждую группу отдельно.
1. Использование АМП в случаях, когда они не показаны. Особую
категорию тактических дефектов представляет неоправданное применение
антибактериальных препаратов в тех ситуациях, когда их назначение не показано. В
условиях реальной практики показанием для назначения АМП является четко
установленная или предполагаемая, с высоким уровнем вероятности, бактериальная
инфекция. В результате анализа экспертных заключений мы выявили, что в целом
этот дефект составляет 37,1±1,3 на 100 экспертиз применения АМП, но наибольшее
значение этого дефекта наблюдалось в группе пациентов, когда необоснованное
применение АМП становилось причиной временного расстройства здоровья
(длительностью до 21 дня) – 42,5±1,4%.
Анализ экспертных заключений показал, что наиболее распространенным дефектом
применения АМП в амбулаторной практике было их назначение при ОРВИ, имеющее
место, как в терапевтической, так и в педиатрической практике. При этом дефекты
были обусловлены, как неправильной трактовкой симптоматики заболевания, когда
врач, описывая четкие клинические проявления вирусной инфекции, диагностируя
бактериальную бронхолегочную инфекцию в виде пневмонии или бронхита, так и его
стремлением предотвратить бактериальные осложнения ОРВИ с помощью фармакотерапии
АМП.
Мы не склонны утверждать, что диагностика ОРВИ во всех без исключения случаях
– это стандартная и банальная процедура, однако при всех трудностях принятия
решения в подобных ситуациях врач должен отдавать себе отчет в том, что АМП не
оказывают положительного влияния на течение вирусной инфекции. Кроме того,
предполагаемая возможность предотвращения бактериальных осложнений вирусных
инфекций с помощью назначения антибактериальных препаратов ещё никогда не
находила себе достаточного числа союзников и подтверждения клинической
практикой. Очевидно, что широкое применение антибактериальных препаратов при
ОРВИ чревато формированием лекарственной устойчивости и повышением риска
возникновения нежелательных реакций у пациента.
Иллюстрацией данного тезиса является экспертное заключение по поводу
амбулаторного лечения ребенка в возрасте 2,5 лет. Алеша Н. заболел остро
12.10.07, когда на 4 день после первого посещения младшей группы детского сада,
где наблюдался сезонный подъем заболеваемости респираторными инфекциями, у
мальчика появилась лихорадка до 38°С, обильные, прозрачные выделения из носовых
ходов, редкий кашель. Медицинской сестрой ребенок отстранен от посещения
детского сада, а вызванный участковый врач установил диагноз ОРВИ, острый
вирусный назофарингит и назначил следующее лечение:
Амоксициллин 100 мг 3 раза в день, внутрь;
Нафтизин по 3-4 капли в носовые ходы 4 раза в день;
Сироп с парацетамолом (100 мг) внутрь;
Горчичники на грудную клетку.
В течение трех дней после обращения к участковому врачу состояние ребенка
было стабильно удовлетворительным, лихорадка уменьшилась до 37,3°С, уменьшились
выделения из носовых ходов, однако усилился кашель, который стал продуктивным,
особенно в утренние часы. На 5 сутки на фоне нормализовавшейся температуры тела,
на коже груди и живота появилась мелкопятнистая сыпь, приподнятая над уровнем
кожи, обильная склонная к слиянию, сопровождающаяся слабым зудом. Осмотревший
ребенка врач-педиатр расценил сыпь, как проявление аллергии на амоксициллин,
отменил его и сироп с парацетамолом, и назначил супрастин по ј таблетки 3 раза в
день внутрь. В течение последующих полутора суток кожа ребенка очистилась от
сыпи, температура тела оставалась нормальной, уменьшился кашель и выделения из
носа.
Однако на 8 сутки от начала заболевания на фоне терапии супрастином мать
ребенка стала отмечать у него повышенную сонливость, вялость, неустойчивую
походку и расстройство сна, навязчивый кашель. Ребенок был повторно осмотрен
участковым врачом, супрастин и нафтизин были отменены. На 12 сутки от начала
заболевания все без исключения проявления ОРВИ были купированы, однако
расстройство сна сохранялось еще в течение недели.
Анализ данного и аналогичных экспертных заключений показывает, что применение
АМП у пациентов, при четко очерченной клинике респираторной вирусной инфекции,
явление массовое и весьма характерное для врачей ЛПУ Дальневосточного региона.
Что же относительно конкретного примера, то нами проведена иллюстрация
применение амоксициллина, к назначению которого не было прямых показаний, а
проявление побочного эффекта по сути дела можно было прогнозировать заранее,
однако лечащий врач с завидным упорством продолжал «манипулировать»
лекарственными препаратами, назначив супрастин и снова получил побочный эффект.
Таким образом, вместо стандартных 7-10 дней, лечение ребенка с «банальной» ОРВИ
было завершено в течение 3 недель. Нам хотелось бы отметить, что в данном и
подобных сотнях случаев, побочное действие ЛС врачами нечетко фиксировалось в
медицинской документации и не формировалась соответствующая информация в адрес
руководителей ЛПУ.
Конечно, типичное течение ОРИ (острых респираторных инфекций) у детей явление
не такое частое, как иногда принято считать. В некоторых случаях первыми
признаками ОРИ у детей раннего возраста могут быть беспокойство, отказ от еды,
плохой сон. И лишь позже появляются насморк, чихание, повышение температуры,
кашель. И тут конечно без врача-педиатра не обойтись. Ведь многие простудные
заболевания при неадекватной помощи, в том числе при самолечении, нередко
приводят к формированию устойчивости микроорганизмов к АМП, что, в свою очередь,
становится причиной проявления хронических очагов инфекции и аллергических
заболеваний.
Безусловно, что применение АМП в случаях, когда их применение не показано,
имеет место не только у детей, но и у взрослых. При использовании АМП без прямых
показаний, для Дальневосточного региона характерным является применение новых
АМП, т.е. препаратов из группы резерва у больных всех возрастных групп. Проблема
заключается в том, что такие препараты, сразу после появления их на региональном
рынке, начинают немедленно использоваться чересчур широко, во всех без
исключения случаях. АМП резерва становится «модным» препаратом, и его применение
у многих больных начинает проводиться за пределами рекомендаций стандартных
схем, т. е. без достаточного обоснования, в виде коротких курсов, без
достаточного бактериального контроля и т.п. Следствием такой тактики является
формирование большого количества устойчивых штаммов. Такие дефекты лечебной
практики обрекают новый эффективный АМП на быструю несостоятельность. Мы
полагаем, что антибиотики «резерва» должны быть действительно препаратами,
применяемыми только при тяжелых формах болезней или у больных, у которых выделен
возбудитель, устойчивый ко всем другим антибиотикам, с условием достаточной
продолжительности лечения. Это единственный реальный путь для продления периода
безотказного действия, периода оптимальной эффективности новых препаратов.
2. Неадекватный выбор АМП. В некоторых случаях выбор самого АМП может
приводить к нежелательным последствиям в силу многих обстоятельств, но в первую
очередь из-за того, что лечащий врач не сопоставил уровень ожидаемых клинических
эффектов с вероятностью отрицательных, побочных эффектов избранного препарата.
В результате анализа экспертных заключений оказалось, что в целом этот дефект
составляет 68,1±1,0 на 100 экспертиз применения АМП, но наибольшее значение
наблюдалось в группе пациентов, когда неадекватный выбор АМП становился причиной
стойкого расстройства здоровья (длительностью более 21 дня) – 78,5±1,7%. Что же
относительно летальных исходов, то значение неадекватного выбора было
установлено в 25,9±8,4% экспертиз случаев с летальным исходом. Причем в
отдельных случаях летальных исходов, после ретроспективного анализа, проводимого
совместно с лечащими врачами, формировалось согласованное мнение о допущенном
тактическом дефекте – консенсус, однако сложившуюся ситуацию невозможно
повернуть вспять. Мотивации применения именно данного АМП у конкретного
пациента, которые приводят клиницисты, это отсутствие ЛС в больничной аптеке,
пациент (родственники) настаивали на применении именно этого препарата, личный
опыт применения данного АМП без побочных эффектов и др.
Иллюстрацией неадекватного выбора АМП является данные экспертизы их
применения у больного Г., 68 лет, которому при лечении в терапевтически
отделении ЦРБ по поводу внебольничной пневмонии, назначили фармакотерапию в виде
комбинации ЛС, включавших гентамицин в разовой дозе 80 мг 3 раза в сутки,
эуфиллин по 150 мг 3 раза в сутки, престариум по 4 мг и фуросемид по 40 мг в
день для коррекции хронической сердечной недостаточности и повышенного
артериального давления. Через две недели с начала терапии развилась острая
почечная недостаточность с последующим летальным исходом. В анамнезе – наличие
почечно-каменной и гипертонической болезни II Б.
При ретроспективном анализе данного случая фармакотерапии АМП бросается в
глаза позиция врача, игнорировавшего применение специфических приемов тактики
фармакотерапии в рамках прогнозирования повышения нефротоксичности гентамицина
при одновременном применении этого препарата с фуросемидом у пациента с
сочетанными факторами риска – возраст старше 65 лет, поражение почек и
гипертоническая болезнь. Информация о взаимодействии применявшихся препаратов
содержится в доступных инструктивно-методических указаниях по фармакотерапии. В
рамках анализа регионального аспекта причинно-следственных связей тактических
дефектов неадекватного выбора АМП следует отметить ограничение финансового
обеспечения, как для лекарственного обеспечения, так и для обучения врачей. Это
характерно для муниципальных ЛПУ в сельской местности и отдаленных северных
территориях ДФО, что приводит к снижению уровня профессиональной подготовки
врачей. Вдумчивое отношение к назначению АМП и других лекарственных средств
позволит избежать причин формирования этой группы тактических дефектов.
3. Назначение неэффективных АМП и препаратов сомнительной эффективности.
Во многих ЛПУ региона наблюдается применение АМП неэффективных, либо
сомнительным лечебным эффектом при имеющейся патологии. Как правило, большинство
тактических дефектов упомянутого плана встречается при назначении АМП врачами
скорой медицинской помощи, дежурными врачами ЛПУ или врачами приемных отделений
стационаров, которые находятся в стесненных временных рамках для принятия
решений, не имеют возможности для консультаций с коллегами и соответствующими
клиническими справочными руководствами. Такие дефекты в большинстве случаев
исправляются лечащими врачами на 2-4 сутки госпитализации пациентов, однако
уровень вреда, наносимый здоровью пациентов в таких случаях оценить непросто.
В результате анализа экспертных заключений оказалось, что в целом назначение
неэффективных АМП и препаратов сомнительной эффективности составляет 43,2±1,3 на
100 экспертиз применения АМП, но наибольшее значение наблюдалось в группе
пациентов, когда назначение неэффективных АМП становился причиной стойкого
расстройства здоровья (длительностью более 21 дня) – 57,6±1,9%. Примером
тактического дефекта назначения неэффективных АМП являются данные экспертных
заключений применения АМП врачами, работающих в условиях дефицита времени для
оценки реальной ситуации. Так в приемном отделении одной из многопрофильных
больниц г. Хабаровска больному мужчине в возрасте 47 лет с обычными физическими
данными (масса 78 кг., рост 176 см.) дежурным врачом приемного отделения при
поступлении в пульмонологическое отделение был диагностирован острый абсцесс
верхней доли справа на фоне пневмонии (клиническая диагностика подтверждена с
помощью рентгенограмм в двух проекциях).
При поступлении был назначен пенициллин в дозировке 300 тыс. в/м 4 раза
сутки, который пациент получал в течение 72 часов на фоне ухудшаюшегося
состояния. На четвертые сутки с момента госпитализации пенициллин был отменен
лечащим врачом и назначены другие АМП (Клафоран, Тиенам), после чего через 48
часов состояние больного стало прогрессивно улучшаться. В конечном итоге, через
1,5 мес. пациент был выписан со значительным улучшением на реабилитационный
этап. Следует отметить, что данный пациент параллельно получал ЛС с сомнительной
эффективностью, такие как инозин (рибоксин) и кокарбоксилазу.
Аналогичные тактические дефекты при организации фармакотерапии АМП
наблюдаются практически в большинстве ЛПУ региона, что требует выработки
реальных шагов к обеспечению рационального применения АМП. Первым шагом на этом
сложном пути должна стать стратегия подбора персонала именно в те подразделения
ЛПУ, где наблюдаются тактические дефекты выше указанного плана. А следующим
шагом — создание комиссии по рациональному использованию АМП с включением в нее
клиницистов, бактериологов, эпидемиологов, клинического фармаколога, провизора и
т. п. Руководитель данной комиссии должен быть освобожден от других
обязанностей, поскольку значительная часть его работы будет весьма трудоемкой.
4. Назначение небезопасных АМП без учета соотношения положительных и
отрицательных эффектов. Нельзя сказать о том, что именно эти тактические
дефекты являются лидерами причинно-следственных связей нежелательных результатов
фармакотерапии различных инфекционных заболеваний, поскольку в целом они
представлены в объеме 9,6±0,8 на 100 экспертиз. Тем не менее, в 21,7±2,8%
экспертных заключений указывается на связь ненадлежащих результатов
фармакотерапии АМП со стойкими нарушениями состояниями здоровья именно по
причине применения небезопасных для пациентов АМП.
Вместе с тем в условиях Дальневосточного региона при лечении пневмоний
легкого или среднетяжелого течения общепринятым подходом считается применение
амоксициллина, амоксициллин/клавуланата, доксициклина или макролидных
антибиотиков. Такие рекомендации приводятся в большинстве стандартов по лечению
пневмонии. Если учитывать возрастающую резистентность пневмококков к макролидам
и доксициклину в регионе, круг рекомендуемых АМП постоянно расширяется. А у
некоторых категории больных с внебольничной пневмонией (пожилые, с наличием
сопутствующей патологии, больные алкоголизмом) существенное значение в этиологии
воспалительных заболеваний бронхолегочной системы имеют грамотрицательные
микроорганизмы.
Следовательно, для достижения приемлемых результатов при проведении терапии
АМП, идет постоянный поиск новых групп ЛС. Это, в первую очередь фторхинолоны, к
которым относится левофлоксацин, который в своем спектре активности охватывают
практически всех потенциальных возбудителей пневмонии (пневмококки, гемофильная
палочка, микоплазма, хламидии, стафилококки, грамотрицательные бактерии).
Указанные выше препараты дополняются применением такими ЛС, как, гентамицин,
амикацин, рифампицин, дифлюкан и др. При этом не всегда учитывается соотношение
их положительных/отрицательных эффектов, что, в конечном итоге и определяет
конечный результат фармакотерапии. При этом следует отметить, что в 22,2±8,0%
экспертных заключений по случаям фармакотерапии воспалительных заболеваний
бронхолегочной системы закончившихся летальным исходом, именно на них указывал
эксперт, как на одну из причин неуспеха.
При назначении и проведении фармакотерапии пневмоний повышенное внимание
следует уделять безопасности терапии АМП, в связи с чем, следует учитывать
многочисленные факторы пациентов (возраст, сопутствующая патология, прием других
медикаментов и т. д.), определяющие тактику. Неадекватная оценка особенностей
конкретного пациента влечет за собой развитие побочных токсических эффектов.
Чаще всего тактические дефекты могут встречаться в следующих ситуациях:
- возраст больных (дети, старики);
- беременность;
- тяжелая сопутствующая патология с функциональными нарушениями различных
органов и систем;
- медикаментозная терапия сопутствующих заболеваний;
- аллергические реакции на различные АП.
Наличие сопутствующей патологии в ряде случаев создает сложности в проведении
лечения АМП. В основе тактических дефектов могут лежать либо игнорирование
сопутствующей патологии, либо недооценка в отношении токсического влияния АМП,
либо, что весьма существенно, недостаточное знание фармакокинетических
особенностей выбранного АМП. Примером такой недооценки может являться следующий
случай применения АМП.
Больная Х., 62 лет, госпитализирована в терапевтическое отделение ЦРБ по
поводу острой внебольничной пневмонии в удовлетворительном состоянии. Кроме
пневмонии пациентка имела сопутствующие заболевания: хронический пиелонефрит без
признаков обострения, гипертоническую болезнь IIА ст. В
приемном отделении было назначено лечение: ампициллин по 1,0 г 2 раза в сутки
в/м, гентамицин 80 мг 2 раза в сутки, рибоксин по 10 мг 1 раз в день
внутривенно, дихлортиазид 25 мг 2 раза в день внутрь, локрен 10 мг. внутрь.
Спустя пять суток состояние больной ухудшилось, появились отеки, снизился
суточный диурез. Уровень креатинина превышал нормативные показатели.
Антибактериальная терапия была пересмотрена (отменены гентамицин и ампициллин,
назначен цефтриаксон). Проведен программный почечный гемодиализ, после чего
состояние больной улучшилось, исчезли отеки и лабораторные признаки ОПН. В
течение 3 недель пневмония была купирована и больная выписана на амбулаторное
лечение.
Анализ приведенного случая указывает на то, что лечащий врач
игнорировал указания на то, что гентамицин совместно с диуретиками и
ампициллином реализует нефротоксические эффекты, гораздо чаще. В результате
ожидаемые положительные антибактериальные эффекты не были получены, а вот
побочные эффекты применяемого АМП были реализованы в полной мере. Кроме того,
определенное значение сыграл в этой ситуации и хронический пиелонефрит, хотя его
обострение не было доказано.
К сожалению, данный случай не стал основанием для широкого обсуждения в среде
врачей данного ЛПУ, а был выявлен с помощью случайного отбора медицинской
документации для клинико-экономической экспертизы. Региональная практика и
публикации об аналогичных исследованиях показали, что именно боязнь обвинения в
некомпетентности и возможного наказания больше всего препятствуют активному
участию в этой работе большинства врачей.
5. Недостатки дозирования эффективных АМП. Дефекты тактики применения
АМП довольно часто формируются в области выбора оптимальной дозы препарата.
Причем дефекты могут заключаться в назначении как недостаточной, так и
избыточной дозы ЛС. Если доза препарата недостаточна и не создает в крови и
тканях дыхательных путей концентрацию, превышающую минимальную дозу для
подавления основных возбудителей инфекции, что является условием эрадикации
соответствующего возбудителя, то это не только может служить одной из причин
неэффективности терапии, но и создает реальные предпосылки для формирования
резистентности микроорганизмов. По нашим данным чаще формируются негативные
последствия течения заболевания вследствие применения недостаточной дозировки
АМП.
В результате анализа экспертных заключений оказалось, что в целом назначение
эффективных АМП в условиях дефектного дозирования наблюдается в 32,6±1,3 на 100
экспертных заключений применения АМП, причем в группе экспертиз летальных
исходов уровень этих дефектов составлял 30,4±8,8%, что указывает на высокий
уровень значимости дозирования АМП и неблагоприятного исхода заболевания. В
группе экспертиз временных расстройств здоровья пациентов уровень дефектного
дозирования составил 38,7±1,3%, а в группе экспертиз стойких расстройств
здоровья нарушения дозирования АМП наблюдалось намного реже -
26,7±3,0%. Следует отметить, что тактические дефекты заключались, как в
выборе оптимальной дозы, так и выборе неправильного режима дозирования
(недостаточная кратность введения).
В качестве примера неадекватного режима дозирования АМП приводим историю
болезни больного П. 48 лет, обратившегося за медицинской помощью к участковому
врачу 15.02.07. После клинического обследования и анализа рентгенограмм в 2-х
проекциях у пациента было установлено наличие левосторонней нижнедолевой
внебольничной пневмонии, нетяжелого течения. В качестве базовой
антибактериальной терапии был назначен амоксициллин по 250 мг 2 раза в сутки,
внутрь.
В течение трех суток с момента начала антибактериальной терапии состояние
больного оставалось прежним. Однако на 5 сутки на фоне уменьшения лихорадки с
39,2°С до 37,5°С, усилился влажный кашель и появились боли в левой половине
грудной клетки в подлопаточной области. Клинически изменений по сравнению с
15.02.07. не выявлено. На рентгенограмме органов грудной клетки 19.02.07 объем
инфильтрации остался прежним, выпот в левой плевральной полости отсутствует.
В связи с сомнительной положительной динамикой от лечения АМП в выше
указанной дозировке, пациенту была проведена коррекция дозирования амоксициллина
- 750 мг 3 раза в сутки внутрь, что
сопровождалось наличием положительной динамики с 22.02.07, когда температура
тела снизилась до субфебрильных цифр, уменьшился кашель, улучшилось
самочувствие, исчезли боли в грудной клетке. Терапия амоксициллином продолжалась
до 25.02.07., после чего проведен второй курс терапии АМП (цефуроксимом 500 мг 2
раза в сутки внутрь в течение 7 дней) физиотерапевтическое лечение, ЛФК, массаж
и витаминотерапия, поскольку сохранялся влажный кашель, слабость, боли в левой
половине грудной клетки. 09.03.07 на контрольной рентгенограмме органов грудной
клетки патологии в легких не выявлено. На 32 сутки с момента обращения за
медицинской помощью пациент приступил к работе в связи с выздоровлением.
Анализ данного случая применения АМП показывает, что недостаточная
дозирование амоксициллина на начальном этапе лечения привело к необходимости в
последующем к увеличению дозировки, а затем и к назначению второго курса АМП (цефуроксима).
Следует отметить, что по имеющимся рекомендациям при внебольничной пневмонии
предполагается назначение амоксициллина в суточной дозе 1,5 и даже 3 г для
преодоления возможной резистентности S. рneumoniae, а некоторые
исследователи предлагают укороченные курсы антибактериальной терапии, но в
условиях адекватного дозирования.
6. Использование АМП в течение неверного временного периода.
Антибактериальная терапия должна быть достаточно продолжительной для того, чтобы
подавить жизнедеятельность возбудителя заболевания и позволить иммунной системе
закончить его элиминацию или инактивацию. В современных публикация иногда
предлагается отказаться от термина «длительность курса терапии
антибактериальными препаратами», поскольку она определяется продолжительностью
клинико-лабораторного эффекта применения АМП. И все-таки для определенного круга
заболеваний существуют рекомендации относительно длительности антибактериальной
терапии. В ЛПУ Дальневосточного региона имеется значительные отклонения от
общепринятых сроков применения АМП, тем более, ориентированных на оценку
клинической эффективности.
В результате анализа проведенных нами экспертиз оказалось, что в целом
назначение эффективных АМП в условиях неверного временного периода наблюдается в
26,6±1,1 на 100 экспертных заключений применения АМП, причем в группе экспертиз
летальных исходов уровень этих дефектов составлял 29,6±8,8%, что не намного
превышало число экспертных заключений с данным тактическим дефектом в группе
временных расстройств здоровья пациентов 26,4±1,2%, а в группе стойких
расстройств здоровья нарушения временного периода применения АМП составляло -
27,2±3,0%.
Анализ данных исследований проведенных в последнее десятилетие по вопросу
длительности применения АМП представляет значительный интерес для тактики
фармакотерапии в педиатрии с точки зрения принципов доказательной медицины. А
именно, известно, что фармакотерапия АМП острого тонзиллофарингита, вызванного
β-гемолитическим стрептококком группы А (БГСА), преследует выполнение несколько
задач: купирование клинических проявлений, стойкая элиминация инфекционного
агента, профилактика острой ревматической лихорадки, заболеваний почек и гнойных
осложнений, а также предотвращение распространения возбудителя.
В качестве примера неадекватных сроков применения АМП приводим историю
болезни больная Р. 14 лет, обратившейся за медицинской помощью к участковому
врачу-педиатру 07.10.06 с жалобами на лихорадку в течение 4-5 дней до 38-39°С,
боли в горле при глотании, заложенность носовых ходов, головную боль и слабость.
В рамках клинического осмотра врачом выявлено увеличение и гиперемия миндалин и
задней стенки глотки, наличие гнойного отделяемого из лакун.
Поставлен диагноз острый гнойный тонзиллофарингит, назначена фармакотерапия
АМП - цефалексином по 500 мг 4 раза в сутки внутрь,
местное лечение в виде полоскания горла раствором фурациллина 1:5000 и
ацетилсалициловая кислота по 500 мг 2 раза в сутки. На фоне назначенного лечения
состояние ребенка значительно улучшилось, на вторые сутки нормализовалась
температура тела и прекратились боли при глотании, на 3 сутки прекратилось
гнойное отделяемое из лакун и исчезла гиперемия слизистой, головная боль и
слабость. На 5 сутки от начала лечения, «в связи со значительным улучшением
состояния ребенка» лечение цефалексином прекращено, еще через 3 дня (15.10.06.)
ребенок приступил к занятиям в общеобразовательной школе.
01.11.06. появились лихорадка до 37,5-37,8°С, непостоянные, мигрирующие боли
в коленных и голеностопных суставах, боли в области сердца и одышка в покое.
Девочка госпитализирована в кардиологический стационар. При поступлении: на коже
туловища бледно-розовые кольцевидные высыпания, границы сердца расширены влево,
в проекции митрального клапана выслушивается систолический шум, тахикардия в
покое до 108 в 1 мин. При обследовании: в анализах крови лейкоцитоз до 14,3х1мм3,
повышенная СОЭ до 58 мм, повышение СРП и титра антистрептолизина О. По ЭКГ-
признаки перегрузки левого желудочка, ЭхоКГ- признаки поражения митрального
клапана. В мазке с миндалин выявлен β-гемолитический стрептококк группы А.
Поставлен диагноз: Острая ревматическая лихорадка, кардит, III
ст. активности. Назначено этиотропное лечение в виде бензилпенициллина 500 000 х
4 раза в сутки в течение 10 дней и симптоматическую терапию. В последующие
месяцы у ребенка сформировался порок сердца – недостаточность митрального
клапана.
Мы полагаем, что причиной развития острой ревматической лихорадки явились
нарушения сроков назначения цефалексина при лечении тонзиллофарингита и
отсутствие настороженности участкового врача-педиатра в отношении
прогрессирования стрептококковой инфекции с последующей трансформацией в тяжелую
патологию сердца. В данных случаях профилактикой ревматических поражений
является адекватная антибактериальная терапия острых стрептококковых инфекций
длительностью не менее 10 дней. Тем не менее, действующие в настоящее время
руководства по лечению острого тонзиллофарингита (подготовленные Infectious
Diseases Society of America, American College of Physicians, American Society of
Internal Medicine, American Academy of Family Physicians и US Centers for
Disease Control and Prevention) предлагают перед назначением эмпирической
терапии АМП проводить обязательное лабораторное подтверждение наличия БГСА.
Мы согласны с рекомендациями специалистов, где для лечения детей с указанной
патологией рекомендуется бактериологическое исследование или экспресс-тест с
культуральным подтверждением отрицательного результата (такое исследование имеет
100% чувствительность и 99-100% специфичность). Назначение антибактериальной
терапии оправдано только при бактериальной этиологии острого тонзиллофарингита.
При выборе АМП в случае тонзиллофарингита, вызываемого чаще всего БГСА,
необходимо учитывать, что на Дальнем Востоке России БГСА сохраняет
чувствительность к пенициллину и другим β-лактамным АБ, а также к макролидам.
Тетрациклины, сульфаниламиды и ко-тримоксазол не обеспечивают эрадикации БГСА,
поэтому их не следует назначать для лечения острых стрептококковых тонзиллитов,
вызванных даже чувствительными к ним in vitro штаммами.
7. Проявление полипрагмазии. Полифармация, полипрагмазия (polypharmacy)
– одновременное назначение больному нескольких лекарственных средств. Проводимая
нами экспертиза назначения АМП показала, что, несмотря на определенный уровень
недофинансирования производства медицинских и фармацевтических услуг по
программе государственных гарантий оказания бесплатной медицинской помощи
населению Дальневосточного региона, в фармакотерапии реализуется выраженная
идеология полипрагмазии. Пациенты различного возраста (от периода
новорожденности до пенсионного возраста) в среднем получали 12,34 препаратов (от
2,14 до 35), причем по основному заболеванию —7,28±0,14, т.е. больше половины от
всего объема назначаемых ЛС. Подобный уровень полипрагмазии приводит к
нерациональному сочетанию ЛС и реализации побочных эффектов.
Применение препаратов к которым пациенты имели противопоказания создает
высокую вероятность развития осложнений фармакотерапии АМП или усугубления
патологического процесса. Однако многие осложнения фармакотерапии не
фиксировались лечащими врачами в медицинской документации. Многие побочные
эффекты оценивались как усугубление основного заболевания, как резистентность к
АМП или как появление нового заболевания. Характерно, что в каждом случае
лечение осложнений фармакотерапии АМП требовало длительного использования
дорогостоящих лекарственных средств.
Развитие медицины и научно-технический прогресс ведут к росту числа и
разнообразия ЛС. На сегодняшний день не существует абсолютно безопасных для
пациента методов профилактики, диагностики и лечения заболеваний. Арсенал
методов лечения становится всё более «агрессивным» по отношению к больному.
Кроме того, научно-технический прогресс в медицине постоянно повышает роль
человеческого фактора в реализации возможных, негативных последствий (риска)
медицинских воздействий.
В результате врачи всё чаще встречаются с патологическими процессами,
вызванными применением лекарственных препаратов, в том числе и антибиотиков.
Лекарственные средства, используемые в химиотерапии, стероидные
противовоспалительные препараты, антибиотики и прочие средства долговременной
фармакотерапии формируют тенденцию к уничтожению или устранению натуральных
кишечных бактерий. В случаях развития дисбиоза место сапрофитных микроорганизмов
занимают грибы, паразиты и патогенные бактерии. Есть основание предполагать, что
бессистемное применение АМП может привести не только к развитию дисбиоза, но и
антибиотикорезистентности, аутоиммунных заболеваний, бронхиальной астмы и пр.
По данным анализа проведенных нами экспертиз фармакотерапии АМП оказалось,
что их назначение в сочетании с множеством других ЛС наблюдается в 68,0±1,2 на
100 экспертных заключений. В группе экспертиз летальных исходов в условиях
полипрагмазии уровень этих дефектов составлял 48,1±9,6%, что намного меньше, чем
число экспертных заключений с данным тактическим дефектом в группе временных
расстройств здоровья пациентов 57,0±1,4%, а в группе стойких расстройств
здоровья нарушения временного периода применения АМП составляло -
74,4±2,3%.
В качестве примера полипрагмазии приводим экспертизу амбулаторной карты
больного Ш. 48 лет, страдающего сахарным диабетом 2 типа, на фоне которого
развились ОРИ, острый бронхит. За период лечения респираторной инфекции с
01.02.04 по 28.02.04. согласно идеологии ДЛО пациенту были назначены ЛС и
выписаны соответствующие рецепты на медикаменты приведенные в табл. 6.4.
Лечащим врачом в качестве стартового препарата был использован бисептол,
положительного эффекта от применения которого не наблюдалось, что послужило его
заменой в дальнейшем на ципрофлоксацин. «С целью уменьшения риска возможных
аллергических реакций на АМП», врач назначил больному Ш. кетотифен без учета
того, что реальный фармакологический эффект от использования данного препарата
может быть реализован через 3-4 недели его регулярного применения, а последний
выписан всего на 10 дней. Следует отметить, что выбор стартового АМП (бисептол)
был проведен неверно, поскольку его применение помимо развития возможных
аллергических реакций может сочетаться с нефротоксичностью в условиях высокой
степени риска сосудистых поражений почек у больного сахарным диабетом.
Таблица 6.4. Перечень лекарственных препаратов, назначенных
пациенту Ш. в рамках ДЛО
| № пп |
Наименование препарата |
Количество |
Стоимость препарата (руб.) |
| 1 |
Сиофор таб. по 850 мг № 60 |
1 |
207,29 |
| 2 |
Арифон таб. по 2,5 мг № 30 |
1 |
271,47 |
| 3 |
Манинил таб. 3,5 мг № 120 |
0,5 |
52,43 |
| 4 |
Кордафлекс таб. по 20 мг № 60 |
1 |
97,88 |
| 5 |
Бисептол таб. 480 мг № 20 |
1 |
49,96 |
| 6 |
Ципрофлоксацин таб. 250 мг |
2 |
64,68 |
| 7 |
Кетотифен таб. 10 мг № 10 |
2 |
11,16 |
| 8 |
Престариум таб. 4 мг № 30 |
0,5 |
152,68 |
| 9 |
Фамотидин таб. по 20 мг № 20 |
1 |
57,02 |
В заключение по данному примеру следует указать на то, что кроме
специфической терапии сахарного диабета (3 наименования ЛС) пациент получал еще
9 наименований лекарственных средств. Записи лечащего врача и
врача-эндокринолога в амбулаторной карте не содержат клинических и лабораторных
признаков отражения полипрагмазии, но сроки лечения пациента с диагнозом
нетяжелых заболеваний: ОРИ, острый бронхит в течение 28 дней говорят сами за
себя. По нашему мнению именно применение значительного числа ЛС в виде
«коктейля» и непредсказуемые варианты их взаимодействия привели к удлинению
сроков достижения клинических эффектов и улучшения состояния пациента.
8. Назначение АМП без учета их взаимодействия с другими ЛС или между собой.
При фармакотерапии часто используется сочетание лекарственных средств
для усиления действия одного препарата другим, ограничения дозы каждого из них,
ослабления побочных эффектов и т.п. Сочетание нескольких ЛС используется в
случаях полисиндромных проявлений заболевания для воздействия на ряд механизмов
патогенеза, коррекции возникших сдвигов, облегчения имеющихся жалоб, а при
наличии нескольких заболеваний – для одновременного лечения каждого из них.
Поскольку известны побочные эффекты, свойственные тем или другим ЛС, существует
возможность профилактики этих нежелательных последствий лечения путем назначения
защитных препаратов. Например, лечение глюкокортикоидами принято проводить под
защитой антибиотиков, антацидов и анаболических средств. Фармакотерапию АМП
иногда рекомендуется сочетать с нистатином или другими противогрибковыми
препаратами. Успехи дифференцированной фармакотерапии все более увеличивают
перечень возможных и желательных направлений лечения, но именно способы
достижения этих успехов угрожают обернуться ятрогенией с ее многочисленными
опасностями, особенно с точки зрения несовместимости ЛС.
Одной из проблем тактики применения АМП при респираторных инфекциях является
назначение комбинации ЛС. Методические рекомендации половины ХХ века по
фармакотерапии антибиотиками пневмонии содержали советы по одновременному
назначению пенициллина и стрептомицина или антибиотиков и сульфаниламидов. Это
была своеобразная стандартная технология лечения пневмоний.
В последние десятилетия, при наличии значительного арсенала высокоэффективных
АМП широкого спектра, показания к комбинированной антибактериальной терапии
значительно сузились, а приоритет в фармакотерапии респираторных инфекций был
занят идеологией монотерапии. В многочисленных контролируемых исследованиях
показана высокая клиническая и бактериологическая эффективность адекватных
антибактериальных средств при лечении респираторных инфекций в режиме
монотерапии (амоксициллин, амоксициллин/клавуланат, цефалоспорины II-III
поколений, новые фторхинолоны). В этой связи следует отметить, что
комбинированная терапия сегодня не имеет доказанных преимуществ ни в
выраженности клинического эффекта, ни в уровне предотвращения резистентности
возбудителей к АМП. Следует отметить, что нерациональные комбинации
антибактериальных препаратов без доказанных преимуществ до сих пор выпускаются
отечественной фармацевтической промышленностью, например ампиокс, олететрин.
И все-таки комбинированная терапия АМП, хотя и ограниченно, но применяется в
клинической практике. Основными показаниями к её использованию являются тяжелое
течение пневмонии — в этом случае довольно часто применяется стандартное
сочетание парентерального применения цефалоспорина III поколения (цефотаксим или
цефтриаксон) и макролидного АМП (эритромицин, кларитромицин, спирамицин).
Макролиды включаются в комбинацию для воздействия на вероятных возбудителей
пневмонии – атипичные микроорганизмы (легионелла или микоплазма). Иной
клинической ситуацией, которая обосновывает комбинированное назначение АМП,
является пневмония у иммунокомпрометированных пациентов (лечение цитостатиками,
СПИД и др.), при которой имеется высокая вероятность ассоциации возбудителей.
Тем не менее, даже в отношении атипичных возбудителей возможно применение
идеологии монотерапии, поскольку в настоящее время в клинической практике
используются новые АМП (левофлоксацин, моксифлоксацин и др.) с высокой
активностью, что позволяет назначать их в режиме монотерапии даже при тяжелой
пневмонии.
К региональным особенностям применения АМП, к сожалению, следует отнести
идеологию применения двух антибактериальных препаратов одновременно больным с
нетяжелым течением пневмонии, при отсутствии осложнений в амбулаторных условиях.
Логичного обоснования этой идеологии фармакотерапии нет. Лечащие врачи при этом
не учитывают возможный антагонизм препаратов, высокий риск нежелательных реакций
и увеличение стоимости лечения.
По данным анализа проведенных нами экспертиз фармакотерапии АМП тактический
дефект назначения антибиотиков без учета их взаимодействия с другими ЛС или
между собой наблюдается в 33,2±1,2 на 100 экспертных заключений. В группе
экспертиз летальных исходов в условиях полипрагмазии уровень этих дефектов
составлял 74,1±8,4%, что намного выше, чем число экспертных заключений с данным
тактическим дефектом в группе временных расстройств здоровья пациентов
30,0±1,3%, а в группе стойких расстройств здоровья нарушения временного периода
применения АМП составляло - 47,5±3,4%.
В качестве примера назначения антибиотиков без учета их взаимодействия с
другими ЛС или между собой приводим экспертизу истории болезни № 4449 больного
Н. 54 лет. Пациент находился в пульмонологическим отделении с 07.08.06 по
22.08.06 с диагнозом: пневмония внебольничная, средней доли справа,
средне-тяжелого течения. ДН 1 ст., ХОБЛ обострение. Получал фармакотерапию АМП:
цефотаксим в/в 1,0 х 3 раза в сутки с 08.08 по 18.08.06 в сочетании с циплоксом
(ципрофлоксацин) 1 амп. х 2 раза в сутки в/в с 08.08.06 по 18.08.06. Применение
2-х АМП, по мнению лечащего врача, сформировало положительный клинический
эффект. Уже к 14.08.06 состояние больного удовлетворительное, температура
нормальная, хрипов в легких нет, но внутривенное введение цефотаксима и
ципрофлоксацина продолжается еще 4 дня. С точки зрения экспертов в данном случае
не было обосновано применение одновременно двух АМП, кроме того наиболее
рациональным выбором должна стать ступенчатая фармакотерапия АМП, что позволило
бы после получения клинического, инструментального и лабораторного подтверждения
положительного результата, перейти на прием АМП внутрь.
В последние годы к региональным особенностям следует отнести одновременное
назначения двух или даже трёх АМП. Таких примеров можно привести великое
множество, и, что удивительно, тактические дефекты именно этого плана характерны
для медицинских учреждений регионального уровня, т.е. областных и краевых ЛПУ.
Экспертиза история болезни № 5747, где одновременно парэнтерально назначаются:
кефзол и цефотаксим, экспертиза истории болезни № 5512 - в качестве стартовой
терапии используются одновременно цефотаксим, гентамицин и метрогил.
Материалы еще одного примера тактического дефекта назначения
АМП без учета их взаимодействия с другими ЛС или между собой. Больной Н. с
начальной формой катаракты, осложненной миопией высокой степени тяжести, время
нахождения в стационаре с 12.01.04 по 31.01.04. Госпитализирован в
офтальмологическое отделение для проведения оперативного вмешательства. В
послеоперационном периоде больной получал следующее лечение:
I. Лечение общее:
- Пенициллин 500 тыс. х 4 раза в день в/м с 21.01 по 28.01
- Метрогил 200,0 в/в кап. №3 с 23.01.04 по 26.01.04
- Аскорбиновая кислота 5%-5,0 в/в с 15.01 по 28.01.04
- Этамзилат 2,0 в/в № 4 с 15.01.04 (дата отмены не указана)
- Эднит 5 мг/2 раза с 16.01.04
- Феназепам по 1 табл. на ночь 19.01.-20.01.04
- Дексаметазон 1,0 в/в с 20.01.04
- Индометацин по 1 табл. х 3 раза в день с 20.01. по 28.01.04
- Ортофен 3,0 в/в с 21.01.04
- Гемодез 200,0 в/в с 23.01.04 ежедневно
- Аспаркам по 1 таб. х 2 раза с 27.01.04
- Верапамил 1 таб. х 1 раз внутрь
- Дигоксин Ѕ таб. - 2 раза в день внутрь
- Диклофенак 3,0 в/м №4 с 28.01.04
II. Лечение местное:
Раствор диоксидина х 3 раза в день и левомицетина 4 раза с 20.01.04
Трипсин и мезатон с 21.01. по 22.01.04
Арутимол с 28.01.04
Этамзилат и Деклон с 28.01.04
Одновременное использование двух АМП (пенициллин и метрогил) парэнтерально и
одного АМП (левомицетин) местно, двух НПВС (индометацин и ортофен) и прочих
препаратов формирует «лекарственный коктейль», сочетанные эффекты которого
предсказать не возьмется ни один здравомыслящий и весьма квалифицированный
специалист.
9. Несоблюдение стандартов лечения
инфекционной патологии ЛПУ.
Эффективное и безопасное применение АМП включает в себя
использование технологий, основанных на доказательных данных, рациональное
использование доступных ресурсов и максимальные усилия по предотвращению или
сдерживанию развития антибиотикорезистентности. Большинство критериев качества
применения АМП должны быть рассмотрены с позиций клинической и экономической
эффективности. С точки зрения эффективности терапии многие стандарты
региональных ЛПУ по применению антибактериальных препаратов требуют, по нашему
мнению, критической переоценки. Некоторые стандарты, в частности применения АМП
для профилактики гнойных осложнений при грыжесечении, оперативных вмешательствах
на органах грудной клетки и т.п., не учитывают уровень риска развития
резистентности и степень экономических затрат.
Длительный опыт применения стандартов селективной деконтаминации
желудочно-кишечного тракта у пациентов отделений интенсивной терапии не только
не улучшает результаты лечения, но и изменяет состав нормальной микрофлоры с
преобладанием грамположительных антибиотикорезистентных штаммов, ставит под
сомнение целесообразность их дальнейшего применения. Уже имеются исследования,
которые свидетельствуют именно об этом. Весьма спорным остается и вопрос о
необходимости эрадикационной терапии Helicobacter pylori у больных с неязвенной
диспепсией. Реализация стандартных схем для лечения некоторых заболеваний, при
которых применение АМП считалось первой линией терапии, как, например,
длительный прием макролидов или тетрациклинов у пациентов с угревой сыпью,
сегодня подвергается сомнению в целесообразности дальнейшего использования.
Тем не менее, материалы проводимых экспертиз применения АМП, основываются на
существующих стандартов, что во многих случаях дает основание приходить к
заключению о том, что стандартные технологии применения АМП являются наиболее
безопасными и обеспечивают наибольший уровень качества медицинской помощи. По
данным анализа проведенных нами экспертиз фармакотерапии АМП тактический дефект
назначения антибиотиков без соблюдения стандартов лечения респираторной
патологии наблюдается в 27,5±1,2 на 100 экспертных заключений. В группе
экспертиз летальных исходов, в условиях недостаточного уровня подготовки врачей
по стандартным технологиям применения АМП, число этих дефектов составляло
51,9±9,6% – это намного выше, чем число экспертных заключений с данным
тактическим дефектом в группе временных расстройств здоровья пациентов
31,8±3,2%. В группе стойких расстройств здоровья применения АМП за пределами
требований технологических стандартов составляло 26,3±1,2%. Во многих случаях
игнорирование стандартных подходов применения АМП при лечении неосложненных
пневмоний у различных групп пациентов приводило к их госпитализации в профильные
отделения, что для части из них заканчивалось вторичным инфицированием и
развитием различных форм внутрибольничных инфекций.
В этой связи мы хотели бы обратить внимание на то, что в условиях
пренебрежения принципами инфекционного контроля во многих стационарах региона
частой причиной летальности пациентов в условиях стационарного лечения является
внутрибольничная (госпитальная, нозокомиальная) пневмония. Она характеризуется
появлением на рентгенограмме «свежих» очагово-инфильтративных изменений в легких
спустя 48 ч и более после госпитализации в сочетании с клиническими данными,
подтверждающими их инфекционную природу (новая волна лихорадки, гнойная мокрота
или гнойное отделяемое трахеобронхиального дерева, лейкоцитоз и пр.) при
исключении инфекций, которые находились в инкубационном периоде на момент
поступления больного в стационар. Подавляющее большинство нозокомиальных
пневмоний вызваны аэробными грамотрицательными бактериями (P.
aeruginosa, E.
coli, K. pneumoniae,
Acinetobacter spp.), увеличивается
частота заболеваний, вызванных и грамположительными микроорганизмами. Патогенные
грибы, такие как Candida и Aspergillis Fumigatus у иммунокомпетентных пациентов
встречаются относительно редко. Что же относительно госпитальных пневмоний
вследствие распространения различных вирусов (вируса гриппа, парагриппа,
аденовирусов и респираторных синцитиальных вирусов), то эти пневмонии носят
сезонный характер и встречается главным образом в педиатрических стационарах.
Госпитальная пневмония занимает второе место среди всех нозокомиальных
инфекций (13-18%) и является самой частой инфекцией (≥ 45%) в отделениях
интенсивной терапии и реанимации, где уже само пребывание больного повышает риск
ее развития в 5-10 раз по сравнению с общесоматическим стационаром.
В качестве примера нарушения стандарта современной тактики антибактериальной
терапии пневмоний приводим экспертизу истории болезни № 514 больной Е. 24 лет,
которая обратилась за медицинской помощью в отделение скорой медицинской помощи
районной больницы 05.11.06 с жалобами на повышение температуры тела выше 39°С,
першение в горле, сухой кашель, насморк и общую слабость. После осмотра молодой
женщины дежурным фельдшером установлен диагноз ОРВИ (Грипп?), острый
назофарингит. Назначено лечение ампициллин 0,5 г х 3 раза в сутки внутрь,
аспирин по 0,5 г. х 3 раза в сутки внутрь, горчичники на грудную клетку,
нафтизин в носовые ходы, обильное питьё.
В течение последующих 4 суток на фоне уменьшения проявлений лихорадки,
сохранялись кашель, слабость, потливость. После осмотра участковым терапевтом
09.11.06, который в проекции правого легкого обнаружил сухие хрипы, направил на
рентгенографию легких, где, кроме усиления легочного рисунка в прикорневых
зонах, изменений выявлено не было. Тем не менее, больная была направлена на
стационарное лечение в терапевтическое отделение районной больницы с диагнозом
острый бронхит.
При госпитализации 10.11.06 состояние больной было средней тяжести,
сохранялись жалобы на сухой кашель, выделения из носовых ходов, лихорадку до
37,3-37,5°С, аускультативно в проекции правого легкого выслушивались сухие
рассеянные хрипы. Назначено лечение: ампициллин 0,5 г х 4 раза в сутки
внутримышечно, римантадин 0,1 х 2 раза в сутки внутрь, АЕВИТ по 2 др. х 3 раза в
сутки внутрь, отхаркивающая микстура и ингаляции. В течение трех последующих
суток состояние больной оставалось стабильным, нормализовалась температура тела,
улучшилось самочувствие, уменьшился кашель.
Однако 14.11.06 состояние больной резко ухудшилось, усилился кашель,
появились боли в правой половине грудной клетки при дыхании, лихорадка до 40°С,
одышка в покое до 32 в 1 мин., периодически наблюдалась спутанность сознания. На
повторной рентгенограмме сделанной 15.11.06 наблюдалась субтотальная
инфильтрация легочной ткани справа и в области нижней доли слева. В анализе
крови – выраженный лейкоцитоз, токсическая зернистость нейтрофилов, СОЭ 56
мм/час. Клинический диагноз: Двухсторонняя очагово-сливная пневмония, острого
течения, ДН-2. Поведена коррекция антибактериальной терапии: цефотаксим 1,0 г
в/вено 2 раза в сутки, гентамицин 40 мг х 2 раза в сутки в/м. Параллельно
проводилась инфузионная и детоксикационная терапия.
На фоне лечения состояние больной продолжало ухудшаться, 16.11.06 пациентка
была переведена в реанимационное отделение областной больницы, где
антибактериальная терапия претерпела изменения: цефтриаксон 2,0 г в/вено каждые
8 часов, амикацин 0,25 г в/вено каждые 8 часов. Кроме того, проводилась
детоксикация, интенсивная терапия, ИВЛ и др. Летальный исход наступил через 10
часов после перевода в РАО.
Этот случай весьма показателен с точки зрения ненадлежащей организации
фармакотерапии АМП в условиях нескольких уровней оказания медицинской помощи.
Всеми специалистами, которые оказывали медицинскую помощь больной были допущены
отклонения от существующих стандартов. В частности с самого начала заболевания
05.11.06, при диагностике респираторной вирусной инфекции пациентке назначается
АМП – ампициллин, который не включен в стандарты и ожидать, появления каких-либо
положительных эффектов, не следует.
Госпитализация больной 09.11.06 в терапевтический стационар с диагнозом
острый бронхит является отражением региональной тенденции заполнения коечного
фонда стационаров в сельской местности для выполнения «плана». Многолетний
анализ этой ситуации указывает на то, что около ⅓ всех пациентов терапевтических
отделений ЛПУ в субботу, воскресенье и праздничные дни покидают стационары под
различными предлогами (принять ванну, встретиться с родственниками, решить
неотложные дела и пр.), продолжая числиться на лечении. На них «списываются»
продукты питания, медикаменты, заработная плата персонала и т.п., что не
выдерживает критики с точки зрения эффективности управления ресурсами ЛПУ.
Однако в контексте выполнения стандартов, эта группа пациентов не нуждается в
госпитализации и круглосуточном наблюдении медицинского персонала, т.е. это
амбулаторные пациенты, которым должно быть организовано лечение, как максимум, в
условиях дневного стационара поликлиники.
Госпитализация больной Е. 10.11.06 и назначение ампициллина 0,5 г х 4 раза в
сутки внутримышечно, римантадина 0,1 г х 2 раза в сутки внутрь, не выдерживает
критики с точки зрения существующих клинических рекомендаций, поскольку
состояние пациентки явно улучшилось, но, вероятно, эта динамика могла бы быть
достигнута и в амбулаторных условиях. Катастрофа, развившаяся 14.11.06 и
дальнейшая тактика фармакотерапии АМП в виде цефотаксима 1,0 г в/вено 2 раза в
сутки и гентамицина 40 мг х 2 раза в сутки в/м, не отвечает требованиям
клинических рекомендаций и стандартов. Во-первых, суточная доза цефотакима явно
занижена, а рекомендуемая стандартами кратность введения цефотаксима составляет
3-4 раза в сутки. Во-вторых, назначение и дозировка гентамицина в данном
конкретном случае не имеет под собой оснований с точки зрения выполнения
существующих клинических рекомендаций. Перевод пациентки в РАО областной
больницы 16.11.06 с большой долей вероятности отрицательно повлиял на динамику
заболевания (транспортировка в течение 2 часов). Скорректированная
фармакотерапия АМП (цефтриаксон и амикацин) – с теми же нарушениями дозирования
не являлась адекватной. Проводимые и другие мероприятия не внесли изменений в
динамику течения пневмонии, и фатальный исход стал логическим завершением цепи
ошибок, неточностей и отклонений от существующих стандартов фармакотерапии АМП.
Исход терапии госпитальной пневмонии, как правило, определяется по
клиническим и микробиологическим критериям. Вопрос об идентификации возбудителя
пневмонии, о возможности ранней микробиологической оценки эффективности
применения АМП, как в данном, так и в других случаях остается открытым,
поскольку в ЛПУ региона уровень клинической бактериологической диагностики
низкий и большинство АМП назначается клиницистами эмпирически. В то же время,
быстрое ухудшение рентгенологической картины с мультилобарным распространением
процесса, увеличением размеров инфильтратов на 50% в течение 24-48 часов,
появление признаков деструкции свидетельствует о неэффективной антибактериальной
терапии.
В приведенном нами примере, наиболее вероятной причиной возникновения
пневмонии было суперинфицирование пациентки в терапевтическом отделении районной
больницы. Из обсуждаемых экспертами и специалистами причин неэффективной тактики
фармакотрапии АМП в конкретном случае (несанированный очаг инфекции; тяжесть
состояния больного; высокая антибиотикорезистентность возбудителей
внутрибольничной пневмонии; персистенция возбудителей –MRSA,
Acinetobacter spp ,P. aerugenosa); микроорганизмы «вне
спектра» действия эмпирической терапии (Candida
spp.); развитие суперинфекции (Enterobacter
spp., Pseudomonas
spp., грибы, C. difficile);
неадекватный выбор препарата; позднее начало адекватной антибактериальной
терапии; несоблюдение режима дозирования препаратов (способ введения, разовая
доза, интервал введения); низкие дозы и концентрация в плазме и тканях), мы
склоняемся к следующим: высокой антибиотикорезистентности возбудителя пневмонии,
неадекватному выбору и несоблюдению режима дозирования АМП.
По нашему мнению избежать или, во всяком случае, снизить уровень вероятности
фатального исхода внутрибольничной пневмонии можно с помощью определенной
системы алгоритмов тактики проведения фармакотерапии АМП, в частности используя
общий лечебно-диагностический алгоритм действий при подозрении на развитие
госпитальной пневмонии (рис. 6.1).
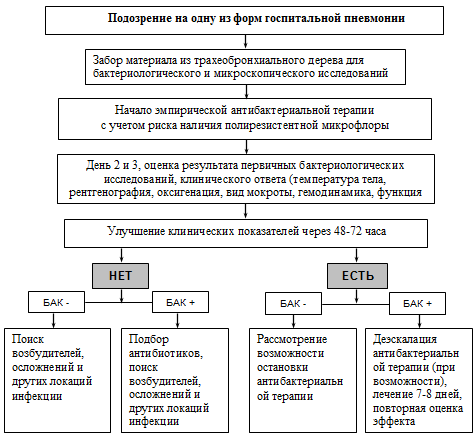
Рис. 6.1. Алгоритм ведения больного с подозрением на госпитальную пневмонию (Илюкевич
Г.В. Олецкий В.Э. БелМАПО, Минск. 2006.)
10. Необоснованный выбор пути введения АМП. Выбор пути введения АМП
иногда влияет на исход заболевания. В частности при проведении экспертиз нам
довольно часто приходилось сталкиваться с ситуациями в амбулаторной практике,
когда при нетяжелом течении пневмонии, при отсутствии осложнений и тяжелой
фоновой патологии АМП назначались парэнтерально. Логичного обоснования этой
тактики, с учетом наличия целых групп эффективных АМП, которые можно вводить
внутрь. При этом следует учитывать, что внутримышечное или внутривенное введение
антибиотиков сопровождается более высоким риском нежелательных реакций и
увеличением стоимости лечения.
Особое значение форма АМП и пути их введения имеет в амбулаторной
педиатрической практике. При этом предпочтение, естественно, отдается
пероральным антибиотикам, что уменьшает риск ятрогенных повреждений органов и
систем. Кроме того, важным аспектом современного подхода к антибактериальной
терапии является возврат в настоящее время к традиционным антибиотикам,
антибиотикам первого поколения. Пероральные антибиотики первого поколения
наименее токсичны, хорошо всасываются. При простоте применения они активны по
отношению ко многим микроорганизмам, а так же могут играть роль препарата
выбора.
Что же до парентерального пути введения АМП, то этот путь должен быть
использован при проведении эмпирической терапии у тяжелобольных, у лиц с
нарушением функции желудочно-кишечного тракта, а также при назначении ЛС с
плохой биодоступностью при приеме внутрь. Однако на практике оказывается, что и
традиции часто влияют на выбор пути введения АМП.
Несмотря на то, что данные о локализации и тяжести инфекционных болезней в
европейских клиниках неотложной медицинской помощи были приблизительно
одинаковыми, 60% стационарных больных в Великобритании назначались пероральные
формы антибиотиков, в то время как в Италии превалировали парентеральные
формы. С другой стороны в США внутривенный способ назначения АМП в свое время
был стандартом лечения.
В настоящее время главным образом по экономическим соображениям у клинически
стабильных пациентов все шире применяется ступенчатая терапия АМП. Основной
критерий назначения ступенчатой терапии – возможность достижения, при применении
пероральных форм антибиотика достаточно высоких концентраций в сыворотке крови и
тканях. Поэтому выбор врача должен ограничиваться лишь теми препаратами, которые
имеют высокую биодоступность, то есть обладают хорошей всасываемостью в
желудочно-кишечном тракте и минимальным взаимодействием при всасывании. При этом
пациент должен быть хорошо проинформирован о времени приема лекарства по
отношению к приему пищи.
По данным анализа проведенных нами экспертиз фармакотерапии АМП тактический
дефект в виде необоснованного выбора пути введения антибиотиков наблюдается
относительно нечасто, в 14,0±0,9 на 100 экспертных заключений. В группе
экспертиз летальных исходов число этих дефектов составляло 18,5±7,5% – это
несколько выше, чем число экспертных заключений с данным тактическим дефектом в
группе временных расстройств здоровья пациентов 13,2±1,0%. В группе стойких
расстройств здоровья применения АМП за пределами стандартных требований пути
введения составляло 18,0±2,6%.
Характерным примером необоснованного выбора пути введения АМП является их
применение в амбулаторной практике при ОРИ и поражениях слизистой ротоглотки.
Больной К., 23 лет, обратился в поликлинику 16.12.06 с жалобами на боли в горле
при глотании, лихорадку до 38,5°С, слабость, потливость и сердцебиение.
Участковым врачом был поставлен диагноз острый тонзиллофарингит. Было назначено
консервативное лечение: ампициллин 1,5 г х 2 раза в сутки в/м, биопарокс по 2
ингаляции через каждые 8 часов, ацетилсалициловая кислота 0,5 г х 3 раза в сутки
внутрь. До начала терапии АМП был взят мазок из глотки для бактериологического
исследования на флору, грибы и чувствительность, где был выявлен рост
Staphylococcus aureus, Streptococcus gr. Viridans с высоким уровнем
чувствительности к препаратам пенициллинового ряда.
19.12.06 на фоне нормализации температуры тела, уменьшения болей в горле,
исчезновения слабости и сердцебиения у пациента в месте инъекций ампициллина
(левая ягодичная обл.) появилось уплотнение. Лечащий врач рекомендовал все
инъекции производить в правую ягодичную области. На следующий день в левой
ягодичной области появилась гиперемия кожи, отек, болезненность, температура
тела поднялась до 39°С. Осмотрен хирургом, который поставил диагноз:
постинъекционный абсцесс левой ягодичной области, 21.12.06 абсцесс был вскрыт,
удалено около 25 мл гноя, полость абсцесса дренирована. Последующее течение
острого тонзиллофарингита имело положительную динамику, фармакотерапия АМП
продолжалась до 10 дня от начала заболевания. Постинъекционный абсцесс претерпел
обратное развитие.
В конкретном примере по нашему мнению не было никаких оснований назначать АМП
(ампициллин) парэнтерально, что в конечном итоге стало причиной реализации риска
ятрогении в виде постинъекционного абсцесса левой ягодичной области. Результаты
фармакоэпидемиологических исследований, проводимых в различных регионах России,
свидетельствуют, что большинству больных с болью в горле, обращающихся за
медицинской помощью, лечащие врачи назначают фармакотерапию АМП. Потенциальные
пациенты также предпочитает принимать для самолечения препараты именно этой
группы, тем более, что, несмотря на официальные приказы Минздравсоцразвития РФ,
АМП можно свободно приобрести практически в любой аптеке Дальневосточного
региона.
Широкое применение антибиотиков при болях в горле обусловлено, в первую
очередь, угрозой тонзиллита, вызванного БГСА, который способен приводить к
серьезным осложнениям, прежде всего к острой ревматической лихорадке. Кроме
того, очень редко боль в горле может быть проявлением состояний с недостаточно
хорошо изученной этиологией, например, болезни Кавасаки, синдрома Стивенса -
Джонсона, рецидивирующего афтозного стоматита и системной красной волчанки.
Другими причинами боли в горле могут быть ожоги, злокачественные
новообразования, лейкемия, радиация, отраженная боль от щитовидной железы,
химиотерапия и полипы. В то же время следует отдавать себе отчет в том, что
наиболее частыми возбудителями инфекционных поражений ротоглотки являются вирусы
(до 70 % случаев). Бактерии занимают второе место.
Исходя из структуры причин болей в горле, можно предположить, что АМП
показаны лишь небольшому количеству пациентов с болями в горле. Это
предположение подтверждается и результатами мета анализов клинических
исследований, выполненных экспертами Кокрановского содружества. Они не позволили
выявить преимуществ рутинного применения антибиотиков при боли в горле. Было
показано, что у 90 % пациентов симптомы исчезают в течение недели независимо от
приема антибиотиков. Более того, вероятность повторного обращения в медицинское
учреждение по поводу боли в горле значительно выше у пациентов, принимавших
антибиотики, чем у не принимавших их. Недостатком применения антибиотиков
является и развитие их побочных эффектов примерно у 5% пациентов, получающих эти
препараты по поводу болей в горле. Кроме того, неоправданное назначение
антибиотиков существенно повышает стоимость лечения. Выше изложенное позволяет
нам утверждать, что парэнтеральное применение АМП в амбулаторной практике в
весьма редких случаях имеет под собой достаточное обоснование.
Проблемы ненадлежащего применения антибактериальных препаратов многогранны,
однако с точки зрения обеспечения приемлемого уровня качества и безопасности
фармакотерапии АМП необходим системный анализ причинно-следственных связей, в
том числе и их побочного действия. Источниками получения информации об их
побочном действии могут выступать сами компании-производители ЛС, врачи,
провизоры и фармацевты, а в ряде случаев — и сами потребители фармацевтической
продукции. Однако на сегодняшний день основным способом сбора информации о
побочных реакциях ЛС в большинстве стран мира является метод спонтанных
сообщений — добровольного предоставления медицинскими работниками данных о
наблюдаемых ими побочных эффектах. К преимуществам использования метода
спонтанных сообщений можно отнести его простоту, экономическую доступность,
возможность контролировать безопасность препарата в течение всего времени
пребывания на рынке, охват большого количества пациентов; а к недостаткам —
невозможность выявить весь спектр побочных реакций ЛС и установить их истинную
частоту. Тем не менее, в настоящее время совершенствуются процедуры
предоставления спонтанных сообщений, направленная на увеличение объема
получаемых данных. Однако такие отдаленные от центра регионы, как Дальний
Восток, в этом смысле находятся ещё только в начале пути.
Приводимые результаты анализа побочных эффектов ЛС показывают, что тройку
лидеров по их формированию стабильно представляют антибактериальные средства,
нестероидные противовоспалительные препараты и средства, влияющие на
сердечно-сосудистую систему. При этом более чем в половине случаев причиной
возникновения их побочных реакций является полипрагмазия — назначение нескольких
ЛС одновременно зачастую без учета их взаимодействия.
По мнению академика РАМН В.И. Петрова, по мере реализации идеологии
стандартизации в отечественной медицине, надежда на формирование парадигмы
рационального использования ЛС, прежде всего за счет более грамотного и
эффективного их назначения, становится более обоснованной. В этой связи
фармакоэпидемиологические исследования позволяют оценить особенности
использования ЛС, в частности степень следования врачей имеющимся рекомендациям,
и на основании полученных данных разработать программы использования ЛС.
Среди большого числа отечественных исследований особого внимания заслуживают
работы, посвященные фармакоэпидемиологическому изучению использования
антибактериальных препаратов при различных заболеваниях. Такой повышенный
интерес к этой проблеме не случаен. Он обусловлен, прежде всего, отсутствием в
большинстве стран доступного национального регистра использования ЛС, в т.ч. и
антибактериальных препаратов.
Дальний Восток России, с точки зрения фармакоэпидемиологических характеристик
применения антибактериальных препаратов при различных заболеваниях, делает
только первые шаги в направлении изучения причинно-следственных связей
формирования ненадлежащего уровня качества и безопасности фармакотерапии. Однако
наиболее важной на сегодняшний день проблемой является проблема формирования
антибиотикорезистентности микроорганизмов. Нет страны, которая могла бы
позволить себе игнорировать её, и нет страны, которая могла бы не отвечать на её
угрозы. Только одновременно проводимые действия по сдерживанию роста
антибиотикорезистентности в каждой отдельной стране, в каждом её регионе смогут
дать положительные результаты для всех.

