Данная информация предназначена для специалистов в области здравоохранения и фармацевтики. Пациенты не должны использовать эту информацию в качестве медицинских советов или рекомендаций.
Глава 4. ИШЕМИЧЕСКИЙ ИНСУЛЬТ И ЕГО ПРОФИЛАКТИКА
Инсульт – быстро развивающееся фокальное или глобальное нарушение функций
мозга, длящееся более 24 часов или приводящее к смерти, при исключении иного
генеза заболевания. C.P.
Warlow (1998) определяет инсульт как клинический синдром,
характеризующийся быстро возникающими жалобами и симптомами утраты фокальных или
общемозговых функций, длящихся более 24 часов или приводящих к смерти без иной
причины, кроме сосудистой патологии.
По данным ВОЗ, инсульт является второй по частоте причиной смертности и в
структуре общей смертности составляет 21,4%.Частота инсультов в развитых странах
составляет от 150 до 740 случаев на 100 000 населения в год. В целом частота
инсульта составила 370 на 100000 населения в год. В странах западной Европы
ежегодно заболевает инсультом до 2000 человек на 1 млн населения, и 75% из них
переносят инсульт впервые. В России в среднем регистрируется ежегодно более 450
000 инсультов. Заболеваемость составляет от 250 до 320 на 100000 городского
населения и 170 на 100000 сельского населения. Риск развития инсульта повышается
экспоненциально с увеличением возраста представителей популяции. Частота
инсультов у лиц старше 50–55 лет возрастает в 1,8 – 2 раза в каждом последующем
десятилетии. Вероятность возникновения инсульта у мужчин в возрастной группе от
45 до 64 лет в целом на 30% выше, чем у женщин, но в более пожилом возрасте
корреляции отсутствуют. Ишемические инсульты составляют примерно 80% от общей
совокупности, в структуре геморрагических 5% составляют субарахноидальные
кровоизлияния, 15% – кровоизлияния в мозг.
Прогностические показатели представляются различными в зависимости от
вариантов инсульта. При наблюдении в течение 3 – 4 лет за больными с преходящим
нарушением мозгового кровообращения (ПНМК) и ТИА удалось выяснить, что в 16 –
28% случаев отмечается только одна атака заболевания. У 50% больных фиксируется
повторная атака в течение первого года; инсульт развивается у 15%; около 4 – 5%
больных погибают в течение первого года после перенесенного ТИА: причиной смерти
в 50% случаев является инфаркт миокарда, в 12% – инфаркт мозга.
В России инсульт занимает первое место среди причин инвалидности – 3,2 на
10 000 населения. 80% лиц, перенесших инсульт, имеют инвалидность разной степени
тяжести. В странах Европы этот показатель составляет не более 50%.
Повторные инсульты среди выживших в течение первых 30 дней после первого
развиваются в 2 – 3% случаев, в течение первых 6 месяцев – в 9%, в первый год –
в 10 – 16%, в последующие годы риск развития повторного инсульта составляет 5%.
Частота повторного инсульта неодинакова для различных клинических вариантов
инфаркта мозга: при тотальном инфаркте в каротидном бассейне она составляет 6%,
при лакунарном – 9%, при частичном инфаркте в каротидном бассейне – 17%, при
инфаркте в вертебрально–базилярном бассейне – 20% (Пинчук Е.А., 2004).
4.1. Факторы риска инсульта
Фактор риска определяется как особенность организма или внешнее воздействие,
приводящее к увеличению риска возникновения заболевания или иному
неблагоприятному исходу.
В настоящее время определено много десятков факторов риска инсульта,
изолированных и их совокупностей, наиболее опасных или значимых. Н.С. Мисюк
(1989) выделил одиннадцать из пятидесяти факторов риска, ранжированных по
степени значимости и не потерявшими свое значение (табл. 2).
Таблица 2. Факторы риска развития инсультов
| № |
Фактор |
Баллы |
| 1 |
Склероз сосудов мозга, выраженный умеренно Склероз сосудов мозга,
выраженный значительно |
2 3 |
| 2 |
Систолическое давление 151–160 мм рт. ст Систолическое давление выше
160 мм рт. ст. |
1 3 |
| 3 |
Диастолическое давление 100 мм рт. ст. |
3 |
| 4 |
Частая боль в области сердца |
1 |
| 5 |
Значительные изменения сосудов глазного дна |
3 |
| 6 |
Значительные изменения сердца по данным ЭКГ |
2 |
| 7 |
Сопутствующие заболевания |
1 |
| 8 |
Наследственная отягощенность |
1 |
| 9 |
Психотравмирующая ситуация |
1 |
| 10 |
Злоупотребление алкоголем |
1 |
| 11 |
Преходящее нарушение мозгового кровообращения |
3 |
Угрозой инсульта является сумма баллов: в возрасте до 50 лет – 7; в возрасте
51 – 60 лет – 10, старше 60 лет – 12.
Международная группа ВОЗ / МОАГ (1999) признали факторами риска:
повышение АД (как систолического, так и диастолического);
ТИА;
сахарный диабет – для ишемического инсульта;
болезни сердца, особенно с нарушением ритма – для ишемического инсульта;
курение;
гиперагрегация тромбоцитов и повышение фибриногена;
алкоголизм;
урикемию;
инфекционные заболевания (СПИД, лептоспироз);
наркоманию;
пероральные контрацептивы.
Данные стратификации риска развития инсульта представлены в табл. 3.
Таблица 3. Стратификация риска развития инсульта (ВОЗ/МОАГ,
1999)
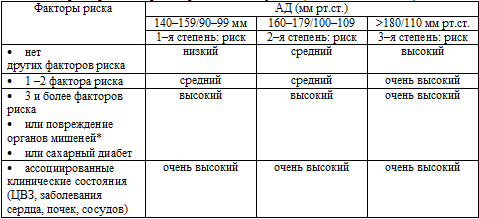
Примечание: * – повреждение органов–мишеней включает следующие изменения:
гипертрофия левого желудочка, протеинурия или повышение концентрации креатинина
плазмы, ультразвуковые или рентгенологические признаки атеросклеротической
бляшки, генерализованное или локальное сужение артерий сетчатки.
Учитывая многообразие факторов риска и разные точки зрения на их значимость,
НАБИ (2007) предложено разделение факторов риска на три категории:
наиболее значимые;
значимость которых сомнительна;
имеющих дополнительное значение.
Так как значимость фактора не всегда согласуется с возможностью его
коррекции, то с указанной точки зрения в настоящее время определено две
категории факторов риска:
некорригируемые профилактическими мероприятиями;
корригируемые профилактическими мероприятиями (табл. 4).
К наиболее частым этиологическим факторам относят атеросклероз, артериальную
гипертензию и их сочетание, причем как сахарный диабет, так и черепно–мозговые
травмы утяжеляют течение сосудистой недостаточности головного мозга.
Частота атеросклеротического поражения артерий головы и мозга стоит на
третьем месте после поражений аорты и коронарных артерий. Типичным является
распространение процесса от центра к периферии, т.е. раньше поражаются
экстракраниальные, а затем церебральные артерии.
Таблица 4. Факторы риска развития инсульта
| Факторы риска |
Некорригируемые |
Корригируемые |
| Наиболее
значимые |
Возраст (пожилой и старческий)
Пол |
Артериальная гипертония
Нарушение сердечного ритма
Гиперхолестеринемия и атеросклероз
ТИА и ПНМК в анамнезе
Сахарный диабет
Курение
Злоупотребление алкоголем
Длительное употребление эстрогенсодержащих контрацептивов |
| Значимость
сомнительна |
Инфекционные болезни в
анамнезе (туберкулез, малярия, эндокардит) |
Дислипидемии Избыточная
масса тела
Патология крови
Резкое переохлаждение |
| Имеющие
дополнительное значение |
Неблагоприятная
наследственность в отношении цереброваскулярной патологии Неблагоприятные климатические и метеофакторы
Неблагоприятные жилищно–бытовые и социально–экономические условия
Эмоциональный стресс
Низкое качество питьевой воды
Стенозирующее поражение магистральных артерий
Утолщение стенок дуги аорты вследствие наличия крупных атероматозных бляшек
Последствия травм мозга
Микроангио– и артериопатии
Пролапс митрального клапана с 3 – 4 ст. регургитации |
Избыточное потребление
натрия, недостаточное потребление калия Гипокинезия
Несбалансированная диета
Незаращение овального отверстия
Мигрень |
Атеросклероз. Отмечена связь между увеличением общего ХС, ЛПНП, снижением
содержания ЛПВП и заболеваемостью инсультом.
В 90 – 95% случаев ишемические нарушения мозгового кровообращения вызваны
атеросклерозом церебральных и прецеребральных сосудов. Атероматозные бляшки
поражают артерии крупного и среднего калибра, преимущественно в местах деления,
извитости и слияния. Основные патогенетические механизмы церебральной ишемии при
атеросклерозе прецеребральных и церебральных артерий:
закупорка прецеребральной или церебральной артерии;
гемодинамически значимый стеноз прецеребральной или церебральной артерии
(сужение 70 – 75% и более площади просвета артерии);
артерио–артериальная эмболия – осложняясь тромбозом и эмболией, она
является причиной примерно 50% ишемических инсультов и транзиторных
ишемических атак (ТИА) в результате попадания эмболов в сосуды мозга и
острой тромботической окклюзии артерии или замедленного тока крови
дистальнее от суженной или закупоренной артерии.
Артериальная гипертензия (АГ) – один из значимых и корригируемых факторов
инсульта. В более чем 50% случаев она является фактором риска для развития
ишемических инсультов и ТИА, в 60% – внутримозговых кровоизлияний, в 30% –
субарахноидальных кровоизлияний. У больных с подтвержденной АГ частота инсульта
в 3 раза больше, чем у больных с нормотензией. При первичной профилактике
инсульта проведение гипотензивной терапии в течение 4,9 лет приводит к снижению
частоты инсульта на 38%. Снижение уровня диастолического АД на 5, 7,5 и 10 мм рт.
ст. приводит к снижению частоты инсульта на 35%, 46%, и 56% соответственно.
Доказана эффективность гипотензивной терапии при вторичной профилактике инсульта
у больных с мягкой АГ и с нормальным уровнем АД (Чазов Е.И., 2003).
Одной из наиболее частых причин развития мозгового инсульта, особенно при
отсутствии гемодинамически значимых стенозов церебральных артерий, является
хроническое снижение мозгового кровотока вследствие реакции
микроциркуляторного русла головного мозга на повышение АД. Хроническое повышение
АД приводит к спазму мозговых сосудов и снижению перфузии головного мозга.
Длительное время возможно поддержание мозгового кровотока на должном уровне за
счет компенсаторной вазодилатации сосудов микроциркуляторного русла глубинных
отделов мозга. Когда по тем или иным причинам возможность ауторегуляции этих
сосудов утрачивается, возникает нарушение перфузии головного мозга, что приводит
к развитию ишемии.
Кардиогенная эмболия является причиной в среднем 20% ишемических
инсультов и ТИА. К доказанным кардиогенным факторам риска эмболии мозговых
сосудов относят фибрилляцию предсердий (ФП), риск инсульта у таких
больных составляет 4,5 – 5% в год, что в 6 раз выше, чем у лиц с синусовым
ритмом, искусственный клапан сердца (риск эмболии 2% в год), ревматоидное
поражение клапанов (чаще в хронической стадии заболевания при появлении ФП),
инфаркт миокарда давностью до 1 месяца (риск 1– 2 % в год), внутрисердечный
тромб и/или внутрисердечное новообразование. К возможным кардиогенным фактором
риска эмболии относят также синдром слабости синусового узла, открытое овальное
отверстие, атеросклеротическую бляшку в грудной аорте, инфаркт миокарда
давностью 2 – 6 месяцев, кальцификацию митрального или аортального клапанов.
Сахарный диабет удваивает риск развития инсульта. Сочетание АГ и
сахарного диабета приводит к возрастанию частоты инсульта в 4 – 7 раз в
сравнении с показателем для популяции в целом.
Возраст и пол – с возрастом риск развития инсульта достоверно
увеличивается, среди лиц с инсультом 75% пациентов в возрасте 65 лет и старше.
Вероятность развития инсульта у мужчин на 30% больше, чем у женщин, в возрасте
45 – 64 лет.
Курение повышает риск инсульта у мужчин на 40%, у женщин – на 60%.
Злоупотребление алкоголем (регулярное потребление более 70 грамм чистого
этанола в сутки, алкогольные запои) повышает риск развития инсульта, при этом
рассматриваются данные о профилактирующем атерогенез действии малых доз этанола
(20 – 30 грамм в сутки).
Ожирение – увеличение риска инсульта может объясняться связью ожирения с
гипертензией, сахарным диабетом, гиперхолестеринемией.
Социальная депривация – выявлены четкие социальные различия в
поведенческих факторах риска инсульта. Выявлено, что инсульт чаще встречается
среди безработных или низкооплачиваемых лиц из низших социальных групп, лиц,
страдающих депрессиями.
Изучение факторов риска находит практическое применение при разработке
стратегий профилактики инсульта.
4.2. Патогенетические типы ишемического инсульта
Атеротромботический ишемический инсульт (34%). Развивается вследствие
атеросклероза экстракраниальных и крупных интракраниальных артерий. Инфаркт
происходит за счет нарушения целостности атеросклеротической бляшки и
образования тромба, что и приводит к полному закрытию просвета сосуда или его
критическому сужению (Rothwell P.M.,
2003).
Кардиоэмболический ишемический инсульт (22%). Источником тромбоэмболии
являются различные изменения в полостях или клапанном аппарате сердца (кардиоцеребральная
эмболия). В качестве эмболов могут выступать фрагменты тромба.
Гемодинамический ишемический инсульт (15% больных). Основную роль играют
изменения магистральных артерий головы и факторы, вызывающие нестабильность
системной гемодинамики и последующую редукцию церебральной перфузии.
Гемореологический ишемический инсульт (9%). Причиной являются изменения
гемостаза и реологических свойств крови, приводящие к окклюзии, в основном,
микроциркуляторного русла.
Лакунарный ишемический инсульт, ли лакунарный инфаркт (20%). Причиной
являются изменения мелких внутримозговых артерий (интрацеребральных,
перфорирующих, пенетрирующих), характерные для АГ: плазморрагии, фибриноидный
некроз, облитерирующий гиалиноз и т.д.
Согласно нашим данным (Боровкова Т.А., Мякотных В.С., 2006), лакунарный
инсульт гораздо чаще регистрируется в следующих случаях:
у лиц пожилого и старческого возраста (65,4%);
у лиц, уже перенесших ишемические инсульты (71,11%);
у лиц, перенесших инфаркты миокарда (31,72%);
у лиц, страдающих облитерирующим атеросклерозом сосудов нижних
конечностей (40%).
Как показывают эпидемиологические исследования, знание типа первого
ишемического инсульта важно для вторичной профилактики (Gueyffier
F., 2003; Nissen S.E.
et al., 2005). В 88% случаев
рецидивы имеют те же типы, что и первый инсульт. Наиболее высокая частота
повторных инсультов отмечается у больных с атеротромботическим инсультом (26% в
год), второе место занимают кардиоэмболические инсульты (12% в год). Таким
образом, в развитии инсультов участвуют разные механизмы, которые требуют
дифференцированного подхода к его профилактике. Эти исследования свидетельствуют
о тесной взаимосвязи между развитием патологии со стороны различных органов и
систем при полиорганном атеросклеротическом процессе.
4.3. Принципы профилактики инсульта
Различают первичную и вторичную профилактику инсульта.
Первичная профилактика обеспечивает предупреждение заболевания у здоровых
лиц и пациентов с начальными формами цереброваскулярной патологии. Такая
профилактика наиболее перспективна, но требует высоких затрат. Первичная
профилактика пропагандирует здоровый образ жизни и предотвращение возникновения
вредных привычек. Более эффективна первичная профилактика, проводимая по
стратегии высокого риска, то есть у группы лиц, имеющих наибольшую вероятность
развития инсульта.
Вторичная профилактика направлена на предотвращение возникновения
повторных нарушений мозгового кровообращения.
Разумеется, решение вопросов профилактики было бы невозможным без изучения
ранговых взаимоотношений факторов риска как первичных, так и, конечно же,
повторных инсультов. При этом практический интерес представляли данные о
корригируемых факторах, так как наиболее вероятно, что именно их неблагоприятная
динамика ведет к росту инцидентов и рецидивов инсульта.
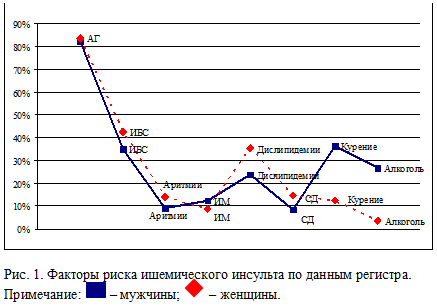
По данным нашего регистра (Пинчук Е.А., 2004), на каждого больного в среднем
приходится по 2,4 факторов риска. Наиболее значимыми факторами риска развития
ишемического инсульта оказались такие, как АГ (93,5%), ИБС (34,4%),
дислипопротеинемия (30,3%), мультифокальный атеросклероз (26,8%) и нарушения
сердечного ритма (16,8%). У 30,5% пациентов отмечена кумуляция таких факторов
как АГ, сахарный диабет, ИБС, дислипидемия. Показательно, что у мужчин второе и
третье места по частоте занимали курение (36,2%) и злоупотребление алкоголем
(26,7%), у женщин – ИБС (42,7%) и дислипидемии (35,5%). Несмотря на определенную
ключевую роль АГ в генезе мозгового инсульта, только 7,1% пациентов, перенесших
инсульт, не знали о наличии у них АГ, постоянную и адекватную гипотензивную
терапию получали только 43,2% пациентов, 37,4% принимали гипотензивные препараты
эпизодически и 14,4% пациентов, знавших о своем заболевании, не получали
гипотензивную терапию. Похожие ситуации отмечены и в отношении других факторов
риска инсульта, что свидетельствует о серьезных недостатках в первичной
профилактике инсульта (рис. 1).
Мы провели сравнительный анализ основных факторов риска развития первичных и
повторных инсультов и выявили наиболее значимые, рассчитав их достоверность, а
также показатель отношения рисков для каждого фактора. Оказалось, что среди
факторов риска повторных инсультов ведущее место занимают АГ, ИБС, нарушения
ритма сердца, сахарный диабет, дислипидемии. Очевидно, что своевременная
коррекция указанных и иных (курение, злоупотребление алкоголем, ухудшение
гемостатических показателей) факторов риска, то есть правильно организованная и
проводимая профилактика, могла бы привести к значительному снижению уровня
повторной заболеваемости инсультом.
Для коррекции имеющихся факторов риска нами предложен алгоритм проведения
профилактических мероприятий. Организационная основа данных мероприятий –
концентрация пациентов, перенесших инсульт, их наблюдение и лечение в
специализированном Центре профилактики инсульта, организованном на базе
Городской клинической больницы № 40 г. Екатеринбурга. Предложенный
диагностический и лечебно–профилактический алгоритм в своей диагностической
составляющей предполагал уточнение патогенетического варианта ишемического
инсульта – атеротромботического, кардиоэмболического, лакунарного,
гемодинамического; лечебная и профилактическая составляющие строились на основе
дифференцированных подходов к профилактике повторного инсульта, патогенетически
аналогичного первому, что может быть наиболее ожидаемым. При этом весь комплекс
лечебно–профилактических мероприятий включал в себя две линии мероприятий.
Первая линия мероприятий проводилась независимо от патогенетического варианта
первого ишемического инсульта, вторая предусматривала уже определенную
детализацию в зависимости от данного варианта (Белкин А.А., Пинчук Е.А., 2000).
Все мероприятия первой линии подразделялись на немедикаментозную коррекцию
факторов риска повторного инсульта (отказ от курения, диета, корригируемые
физические нагрузки и др.) и медикаментозную коррекцию факторов риска. При этом
основой медикаментозной коррекции были адекватная гипотензивная и
антиагрегантная терапия.
Мероприятия второй линии включали в себя мероприятия первой, но
дополнительно, в зависимости от патогенетического варианта ишемического инсульта
– гиполипидемическую терапию статинами – у больных с атеростромботическим
вариантом ишемического инсульта, антикоагулянтную терапию непрямыми
антикоагулянтами – у пациентов с кардиоэмболическим вариантом ишемического
инсульта. Кроме того, после проведения УЗИ исследований магистральных сосудов
головы и церебральных сосудов в необходимых случаях, а именно при выраженных
окклюзиях, решался вопрос о хирургическом вмешательств на сосудах – сонных
артериях.
Разработанный нами диагностический и лечебно–профилактический алгоритм
использован в лечении 100 больных, перенесших впервые в жизни ишемический
инсульт (Пинчук Е.А. и др., 2002; Пинчук Е.А., 2004).
Комплекс инструментальных и лабораторных исследований включал ряд моментов:
исследования системы гемостаза, липидного спектра, ЭКГ, транскраниальную
ультразвуковую допплерографию, КТ, МРТ головного мозга, по показаниям –
ультразвуковое дуплексное сканирование брахиоцефальных артерий – ветвей дуги
аорты, эхокардиографические исследования, холтеровское мониторирование. В
необходимых случаях проводилось суточное мониторирование АД. Целевыми значениями
лечебно–профилактических мероприятий были выбраны следующие: значения
показателей гемостаза – МНО – 2,0–2,5; липидов и липидного спектра: ХС – менее
5,0 ммоль/л; ЛПНП – менее 3,35 ммоль/л; триглицеридов – менее 1,8 ммоль/л; ЛПВП
– более 1 ммоль/л.
Проведенный в течение одного года комплекс лечебно–профилактических
мероприятий оказался высоко результативным практически по всем показателям.
Повторные ишемические инсульты произошли за период наблюдения всего у 2%
пациентов, тогда как в группе сравнения, среди лиц, не наблюдавшихся в
специализированном Центре – у 16%. При суммарной оценке эффективности
предлагаемых мероприятий можно утверждать, что применение комплексного подхода в
организации диагностических и лечебно–профилактических мероприятий позволило
снизить частоту повторных инсультов на 87,2% (р<0,01).
Таким образом, наблюдение и лечение пациентов в условиях Центра профилактики
инсульта позволяло на основании проведенных диагностических методик подобрать
оптимальную профилактическую терапию, что привело к выраженному снижению
показателя частоты повторных инсультов в течение первого года от развития
первичного инсульта (Пинчук Е.А., 2004).
В заключение считаем возможным привести наши данные о штатном расписании,
оснащении и финансово–экономической целесообразности организованного Центра
профилактики инсульта.
На постоянной основе в Центре работают 2 врача–невролога и 1 врач–кардиолог
или терапевт, занимающие 3 выделенных в штатном расписании врачебных ставки;
данные ставки выделяются за счет уже имеющихся в лечебном учреждении, в нашем
случае – в ГКБ № 40 г. Екатеринбурга.
Также выделена 1 ставка медицинской сестры–регистратора, но ее функции
выполняет медицинская сестра регистратуры поликлиники.
Предоставляемые площади – консультативный кабинет на базе существующего
поликлинического отделения нейрохирургического корпуса, что также не требует
дополнительных финансовых затрат.
Собственное оборудование консультативного кабинета включает персональный
компьютер (системный блок с периферией), 2 тонометра для измерения АД и 1 прибор
для экспресс–диагностики уровня холестерина в крови, дополненный, разумеется,
расходными материалами – реактивами, пробирками и т.д. Остальное используемое
оборудование является базовым для ГКБ №40. Это КТ и МРТ аппаратура, оборудование
для проведения ТК УЗДГ, дуплексного сканирования, УЗИ сердца, лаборатория
гемостаза, биохимическая лаборатория и др. Врачи–консультанты (нейрохирург,
сосудистый хирург, эндокринолог, окулист и др.) привлекаются при необходимости
из штата базовой клиники.
Финансирование деятельности Центра осуществляется за счет оплаты из фонда
обязательного медицинского страхования (Центр профилактики инсульта структурно
входит в состав амбулаторно–диагностического отделения Центра нейрохирургии и
неврологии, работающего на базе ГКБ №40). Стоимость обследования пациента
изменяется в зависимости от социально–экономической ситуации в стране, поэтому
приводить какие–либо цифры нам показалось не вполне корректным. Следует
отметить, однако, что, исходя из данных 2004 года, пребывание пациента в
стационаре обходилось в 3,38 раза дороже, чем обследование и лечение его в
условиях Центра.
Таким образом, не только положительные общемедицинские,
лечебно–диагностические, профилактические аспекты заставляют обратить внимание
на результативность работы созданного Центра профилактики инсульта, но и
финансово–экономическая сторона вопроса. Необходимость создания на базе крупных
многопрофильных клиник Российской Федерации Центров профилактики инсульта и
разработка программ вторичной профилактики инсульта, аналогичных разработанному
нами и доказавшему свою эффективность алгоритму, представляется вполне
очевидной.
Предлагаемый нами алгоритм (рис. 2) основан как на определении
патогенетического типа инсульта, так и на адекватном, индивидуальном подборе
методов медикаментозной и немедикаментозной профилактической терапии.
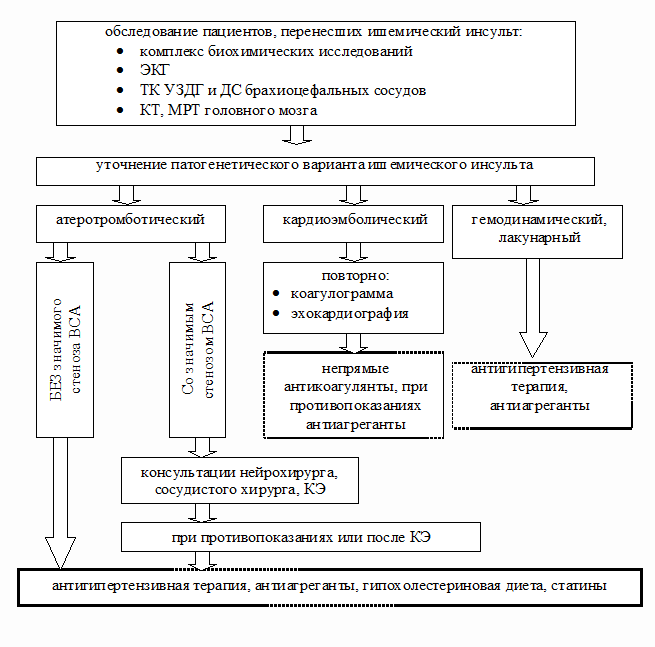
Рис. 2. Схема диагностических и лечебно–профилактических
мероприятий, проводимых в условиях Центра профилактики инсульта.
Терапия, проводимая пациентам основной группы, была подобрана исключительно в
соответствии с представленным алгоритмом. При этом мы преследовали две основные
цели: доказать эффективность комплексного подхода к лечению пациентов,
перенесших инсульт, в условиях Центра профилактики инсульта, и снизить риск
развития повторного инсульта. Эффективность терапии, подобранной в соответствии
с алгоритмом, оценивалась клинически и на основании динамики лабораторных и
инструментальных показателей (гемостаза, липидного спектра, результатов
транскраниальной ультразвуковой допплерографии и дуплексного сканирования сонных
артерий, КТ и МРТ исследований головного мозга, мониторинга АД).
Результативность вторичной профилактики ишемического инсульта, основанной на
использовании в организованном Центре профилактики инсульта диагностического и
лечебно–профилактического алгоритма, оказалась достаточно высокой, применение
комплексного подхода в организации диагностических и лечебно–профилактических
мероприятий в суммарной эффективности позволило снизить частоту повторных
инсультов у лиц, наблюдавшихся и лечившихся в Центре, на 87,2% по отношению к
общим показателям по г. Екатеринбургу (Пинчук Е.А., 2004).
4.4. Лакунарные инфаркты головного мозга
Лакунарные инфаркты (инсульты) (ЛИ) головного мозга являются в принципе одним
из самых частых вариантов ишемических инсультов, но до сего времени
рассматриваются в основном как следствие АГ. С другой стороны, исходя из
представлений о патогенетическом сродстве, если не единстве, АГ и атеросклероза
и отчетливой возрастзависимости ЛИ, можно говорить об определенной степени
сочетанности АГ и атерослероза как этиопатогенетической основы возникновения ЛИ.
4.4.1. История вопроса, эпидемиология. ЛИ – один из видов ишемических
нарушений мозгового кровообращения при АГ, характеризующийся развитием небольших
очагов некроза в глубоких отделах головного мозга вследствие поражения
внутримозговых артерий и имеющий определенную морфологическую и клиническую
картину (Калашникова Л.А., 1988; Верещагин Н.В. и др., 1997). При возникновении
ЛИ в веществе мозга образуются небольшие полости (лакуны), что и определило
название патологического процесса. Термин «лакуна» обязан своим происхождением
французскому врачу и исследователю Decambre, впервые в 1838 году применившему
его при описании небольших полостей в веществе головного мозга, образовавшихся
вследствие резорбции размягчений. Лишь спустя более 60 лет, в 1901 – 1902 гг.,
известные неврологи Маrie е. Ferrаnd описали морфологию лакун и отдельные
клинические проявления лакунарных поражений мозга. Еще через 60 лет, в 60–х –80–х
годах ХХ века появились работы C. Fisher (1982, 1986), в которых впервые была
сделана попытка связать воедино клинику, морфологию, диагностику и лечение ЛИ
мозга, а сами ЛИ стали рассматриваться как особый вид ишемических повреждений
мозга при АГ. Сейчас подобного рода трактовка является наиболее признанной, и
большинством исследователей образование ЛИ связывается с АГ, хотя, разумеется,
как уже сказано выше, нельзя полностью отвергать и иной механизм образования
лакун в веществе головного мозга, например, атеросклеротический или сочетанный,
при котором приблизительно равноценное патогенетическое значение имеют как АГ,
так и атеросклероз у данного конкретного больного. Особенно характерно развитие
ЛИ мозга для лиц пожилого и старческого возраста (Верещагин Н.В. и др., 1997;
Мякотных В.С. и др., 1996, 2004).
ЛИ является самой частой патологоанатомической находкой, выявляемой при
аутопсии у лиц пожилого и старческого возраста, страдающих АГ. Количество ЛИ по
отношению к общему числу вскрытий составляет от 11 до 26,6% (Калашникова Л.А.,
1988; Верещагин Н.В. и др., 1997). Доля ЛИ по отношению к общему числу
ишемических нарушений мозгового кровообращения достигает 35%, по результатам
клинических исследований среди цереброваскулярных заболеваний 13–20%. Среди всех
случаев инсульта при АГ свыше 15% приходится также на ЛИ (Чазов Е.И., 2003).
4.4.2. Локализация, морфология, патоморфогенез. Наиболее частая
локализация ЛИ – базальные ядра, таламус, внутренняя капсула, белое вещество
полушарий мозга, мост мозга (основание), ядра мозжечка. Величина ЛИ – от 0,1 см
и менее до 1,5 – 2,0 см (определяется по максимальной зоне инфаркта). Некоторые
ЛИ выявляются только при гистологическом исследовании. Лакуны диаметром более
2,0 см встречаются крайне редко и носят название гигантских.
Классические ЛИ, возникающие при АГ, никогда не поражают кору больших
полушарий мозга, что объясняется нарушением кровотока исключительно в
пенетрирующих, перфорантных, внутримозговых артериях диаметром от 40 до 900 мкм.
Для развития ЛИ имеют значение и анатомические особенности строения этих артерий
– они имеют мало коллатералей (Верещагин Н.В. и др., 1997). Характер
морфологических изменений артерий отчетлив для АГ: плазморрагии, фибриноидный
некроз, гиалиноз, отложение липидов, замещение стенок артерий соединительной
тканью. Данные изменения строго локальны, имеют сегментарный характер; длина
сегмента – до 10 мм. В целом описываемая патологоанатомическая картина получила
название сегментарной артериальной дезорганизации, сегментарной фибриноидной
дегенерации. Встречающиеся иногда микроаневризмы также развиваются на почве АГ.
Внутримозговые артерии относятся к сосудам мелкого калибра, поэтому не попадают
под определение классических мишеней атеросклероза – артерий крупного и среднего
калибра. Именно поэтому отдельные авторы разделяют ЛИ на «атеросклеротические» и
«гипертонические» как по морфологической картине, так и патогенетическому
механизму развития (Верещагин Н.В. и др., 1997), но, по нашему мнению, механизм
образования лакун в веществе головного мозга у пожилых и престарелых лиц носит
сочетанный характер, при котором приблизительно равноценное патогенетическое
значение имеют как АГ, так и атеросклероз (Боровкова Т.А., Мякотных В.С., 2006).
Возможно, речь идет не столько об атеросклеротическом, сколько об
артериосклеротическом процессе, который в принципе сопоставим с патологическими
изменениями стенки сосуда, характерными для АГ, тем более, что в последние годы
в литературе появляются сообщения о возможности развития атеросклеротического
процесса в артериях малого диаметра, с повышением частоты атеросклеротического
стеноза сосудов в возрасте старше 60 лет (Сергиенко В.Б. и др., 1999;
Armentano R. et
al., 1995).
Морфологические изменения при ЛИ представлены на рис. 3–4.
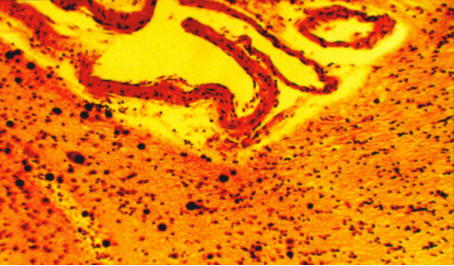
Рис. 3. Плазморрагии, фибриноидный некроз, гиалиноз, отложение липидов,
замещение стенок артерий соединительной тканью, криброзность и атрофия вещества
головного мозга, дистрофия нейронов (Боровкова Т.А., Мякотных В.С., 2006).
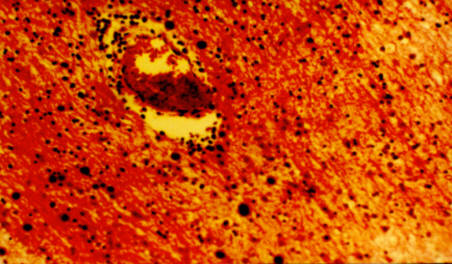
Рис.4. Криброзность и атрофические изменения вещества головного мозга,
дистрофия нейронов, расширение периваскулярных пространств, лакунарные инфаркты
(Боровкова Т.А., Мякотных В.С., 2006).
На основании выявляемых на секции и при гистологическом исследовании
морфологических особенностей ЛИ, в том числе топографических взаимоотношений
между пораженным сосудом (интрацеребральной артерией) и непосредственно очагом
ЛИ выделено 4 варианта морфологической картины ЛИ (Верещагин Н.В. и др., 1997):
облитерированные и склерозированные артерии с некротизированными стенками
вплотную примыкают к инфаркту, но в нем самом не обнаруживаются;
характерна своеобразная ампутация артерии в пределах инфаркта,
развившегося в ее бассейне;
организующиеся и организованные инфаркты располагаются на некотором
расстоянии от измененных артерий, то есть в бассейне их ветвей;
организованные и организующиеся инфаркты возникают в бассейне ветвей
артерий, утративших миоциты средней оболочки на предыдущих стадиях АГ.
4.4.3. Клиническая картина, диагностика. Считается, что ЛИ имеет
характерную клиническую картину, на основании которой можно ставить его
прижизненный диагноз (Верещагин Н.В. и др. 1997; Мякотных В.С., Боровкова Т.А.,
2006). Выделены общие клинические признаки ЛИ и синдромологические, клинические
варианты ЛИ.
Общие клинические признаки ЛИ:
обязательное присутствие АГ в анамнезе; частое развитие во сне (ночью) при
наличии предшествующей головной боли и повышенного АД вечером;
в период развития инфаркта АД умеренно повышено или в пределах нормы,
головная боль отсутствует или незначительна, а уровень бодрствования не
снижается; отсутствуют менингеальные симптомы и нарушения высших корковых
функций (даже при клинически отчетливом правостороннем гемипарезе);
очаговая неврологическая симптоматика нарастает в течение нескольких часов
или дней, возможно интермиттирующее или ступенеобразное развитие заболевания;
характерно хорошее восстановление двигательных функций, чаще в течение от
нескольких дней до 6 месяцев, но в этот период возможно развитие повторных ЛИ;
ангиография не выявляет патологии;
при проведении КТ, МРТ определяется средний объем очага пониженной
плотности – 1,7 мм, лучшая визуализация очага – к 7–му дню заболевания, но
очень часто КТ и МРТ вообще не выявляет отчетливых признаков патологии из–за
малых размеров очагов ЛИ.
Выделено множество клинических вариантов ЛИ. Основные из них:
«чисто двигательный инсульт», изолированный гемипарез (очаги: внутренняя
капсула, семиовальный центр, основание моста, чечевицеобразное ядро);
«чисто чувствительный инсульт», изолированная гемигипестезия (очаги:
зрительный бугор, таламо–кортикальные волокна);
«атактический гемипарез», гомолатеральная атаксия и круральный парез
(очаги: внутренняя капсула (верхняя часть задних отделов заднего бедра),
основание моста, семиовальный центр);
неловкость в руке и дизартрия (очаги: верхняя часть основания моста,
внутренняя капсула – семиовальный центр);
чувствительно–двигательный инсульт (очаги: задневентральные ядра таламуса,
внутренняя капсула);
гемихорея – гемибаллизм (очаги: чечевицеобразное ядро, хвостатое ядро);
изолированный центральный паралич мышц лица (очаги: лучистый венец,
внутренняя капсула).
Но, если, например, «чисто двигательный инсульт» встречается чаще всего – в
63–65% случаев ЛИ, то последующие варианты – значительно реже, иногда
описаны лишь единичные наблюдения.
Диагностика ЛИ мозга нередко основана на сопоставлении достаточно выраженной
неврологической симптоматики при сохранении высших корковых функций, на
отсутствии при этом отчетливых изменений при проведении КТ, МРТ мозга и на
выявлении существующей в течение нескольких лет АГ. Характерна неизменность
уровня ферментов ликвора (креатининкиназа, лактатдегидрогеназа,
ангиотензинпревращающий), тогда как примерно в 80% случаев корковых инфарктов
мозга наблюдается повышение уровня хотя бы одного фермента.
Данные исследования нейротрансмиттеров крови у больных с острым ЛИ показали
достоверное повышение содержания глутамата, определяющего нейротоксическое
влияние, и, напротив, снижение уровня ГАМК как регулятора нейропротекторных
механизмов. Возможно, дланный лабораторный феномен может служить определяющим
при прогрессировании ЛИ.
В подавляющем большинстве случаев с помощью МРТ не удается вообще выявить
наличие ЛИ, так как основная масса подобного рода поражений имеет размеры, не
превышающие 1,0 мм в диаметре, что редко поддается отчетливой нейровизуализации.
Поэтому как раз отсутствие изменений на томограммах при наличии клинической
картины ишемического инсульта у человека, страдающего АГ, должно наводить врача
на мысль о развитии ЛИ.
Действительно, далеко не всегда ЛИ удается диагностировать при жизни. Нами
проанализированы результаты аутопсии 504 умерших в Свердловском областном
клиническом психоневрологическом госпитале для ветеранов войн за 9 лет (с 1996
по 2004 гг.) больных в возрасте от 60 до 93 лет. У 129 (25,59%) из них при
морфологическом, гистологическом исследовании головного мозга были обнаружены
как единичные, так и множественные ЛИ. Все больные прижизненно страдали АГ, но
ни у одного из них в анамнезе не было указаний на перенесенные острые нарушения
мозгового кровообращения. Клинически дисциркуляторная энцефалопатия с
интеллектуально–мнестическими расстройствами была диагностирована у 93 (72,09%)
пациентов с обнаруженными ЛИ, деменция – у 36 (27, 91%). Кроме того, у 33
(25,58%) пациентов в историях болезни имели место указания на те или иные
экстрапирамидные нарушения, связанные с поражением подкорковых структур,
мозжечка, причем локализация патологоанатомически выявленных ЛИ указывала на
прямую связь данной экстрапирамидной симптоматики именно с ЛИ. Но постепенное
развитие двигательных расстройств, деменции ни лечащие врачи, ни сами пациенты
никак не связывали с возможным наличием не только единичного, но повторных ЛИ, и
больные по этому поводу целенаправленно не лечились. Отсюда вывод о малой
осведомленности клиницистов о такой патологии, каковой является ЛИ.
Интересна группа из 94 пациентов, умерших от различных причин, в возрасте от
80 до 93 лет (m=83,87±2,03 лет). При аутопсии у 39
(41,49%) из них выявлены ЛИ, локализованные преимущественно диффузно в веществе
головного мозга в значительном количестве, не поддающемся счислению. Кроме того,
клинические критерии деменции были определены у 25 человек, что составило 64,10%
в группе имевших ЛИ (Мякотных В.С., Боровкова Т.А., 2004, 2006).
Наши данные подтверждают очень высокую частоту развития ЛИ у представителей
пожилого и старческого возраста при почти полном отсутствии прижизненной
диагностики данных острых патологических состояний и, следовательно, адекватного
и своевременного лечения. Именно повторные, множественные ЛИ являются, на наш
взгляд, основой того патогенетического механизма, который постепенно, в течение
многих лет приводит к развитию и прогрессированию по клиническим стадиям так
называемой хронической ишемии головного мозга, дисциркуляторной энцефалопатии.
Другими словами, повторные, но мало заметные в клиническом плане церебральные
сосудистые катастрофы ошибочно рассматриваются в качестве прогрессирующей
хронической ишемии головного мозга у пожилых и престарелых лиц. Отсюда –
проблемы с профилактикой и лечением подобного рода патологических состояний.

